-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ODVOZENÍ A CHARAKTERIZACE BUNĚČNÉHO MODELU MULTILÉKOVÉ REZISTENCE UROTELIÁLNÍHO KARCINOMU
ESTABLISHMENT AND CHARACTERIZATION OF MULTIDRUG RESISTANT CELL LINE MODEL OF UROTHELIAL CARCINOMA
Major statement:
New chemoresistant urothelial bladder cancer cell line as an experimental model for studying the mechanisms of multidrug resistance in advanced bladder cancer.Aim:
The aim of the study was to establish and characterize a new multidrug resistant urothelial cancer cell line.Materials and methods:
The parental cancer cell line BC44 was previously established from the large exophytic and better differentiated papillary part of a progressive tumor (pT4 G3) of a female patient. The daughter cell line BC44DoxoR has been derived by prolonged culture in increasing doxorubicin concentrations. Morphological response of parental and daughter cells after application of the individual drugs (doxorubicin, methotrexate, vinblastine, cisplatin, and gemcitabine) has been followed by phase-contrast microscopy. Cell viability has been determined using mitochondrial dehydrogenases assay and quantified by absorption spectrophotometry. Man-Whitney U Test (significance level α = 0.05) has been applied for statistical evaluation.Results:
The derivative cell line BC44DoxoR exhibited chemoresistance to all cytostatics tested. To the best of our knowledge, this is the first report of such a multidrug resistant urothelial carcinoma cell line.Conclusion:
The new multidrug resistant urothelial bladder cancer cell line could provide important new insights into understanding the therapeutic resistance of advanced bladder cancer.KEY WORDS:
Chemotherapy, multidrug resistance, urothelial carcinoma.
Autoři: Michaela Kripnerová 1; Pavel Dvořák 1; Martin Pešta 1; Jitka Kuncová 2; Tomáš Vlas 3; Martin Leba 4; Luboš Holubec 5; Jiří Hatina 1
Působiště autorů: Ústav biologie, Lékařská fakulta UK v Plzni, Plzeň 1; Ústav fyziologie, Lékařská fakulta UK v Plzni, Plzeň 2; Ústav imunologie a alergologie, Fakultní nemocnice Plzeň, Plzeň 3; Katedra kybernetiky, Fakulta aplikovaných věd, Západočeská univerzita v Plzni, Plzeň 4; Onkologická a radioterapeutická klinika, Fakultní nemocnice Plzeň, Plzeň 5
Vyšlo v časopise: Ces Urol 2015; 19(4): 281-290
Kategorie: Originální práce
Souhrn
Hlavní stanovisko práce:
Nově odvozená chemorezistentní buněčná linie karcinomu močového měchýře jako experimentální model pro studium mechanizmů mnohočetné terapeutické rezistence pokročilých nádorů močového měchýře.Cíl:
Cílem práce bylo odvodit a charakterizovat novou progresivní chemorezistentní buněčnou linii uroteliálního karcinomu.Materiál a metody:
Mateřská buněčná linie uroteliálního karcinomu BC44 byla odvozena z papilárně diferencované části pokročilého karcinomu močového měchýře (pT4 G3) a z ní ustanovená dceřiná linie BC44DoxoR byla získána selekcí rezistentních klonů po aplikaci zvyšujících se koncentrací doxorubicinu. Mikroskopická analýza chemorezistentního fenotypu byla fotograficky dokumentována po aplikaci jednotlivých cytostatik (doxorubicin, metotrexát, vinblastin, cisplatina a gemcitabin). Pro stanovení viability buněk v prostředí různých koncentrací cytostatik byl použit test funkce mitochondriálních dehydrogenáz. Ke kvantitativnímu vyhodnocení mitochondriální funkce byla využita metoda absorpční spektrofotometrie a výsledné naměřené hodnoty absorbancí byly zhodnoceny pomocí neparametrického Mann-Whitney U testu pro hladinu významnosti α = 0,05.Výsledky:
Podařilo se nám odvodit z mateřské buněčné linie karcinomu močového měchýře BC44 dceřinou buněčnou linii BC44DoxoR, která vykazuje mnohočetnou lékovou rezistenci vůči všem cytostatikům používaným ve standardní systémové chemoterapii uroteliálního karcinomu (doxorubicin, metotrexát, vinblastin, cisplatina a gemcitabin).Závěr:
Nově ustanovená chemorezistentní nádorová buněčná linie BC44DoxoR představuje cenný modelový systém, jehož další molekulární analýza může přinést důležité nové poznatky pro pochopení terapeutické rezistence pokročilých nádorů močového měchýře.KLÍČOVÁ SLOVA:
Chemoterapie, mnohočetná léková rezistence, uroteliální karcinom.ÚVOD
Karcinom močového měchýře představuje v celosvětovém měřítku čtvrtý nejčastější nádor u mužů a sedmý u žen, s celosvětovou incidencí blížící se 430 000, mortalitou přesahující 165 000 a prevalencí přes jeden milion nemocných (1, 2). Jedná se o velmi heterogenní skupinu onemocnění; z histopatologického hlediska se rozlišují dvě velké skupiny nádorů, a to tzv. superficiální nádory, zpravidla papilárního typu (NMIBC – non-muscle - invasive bladder cancer; stadia pTa a pT1) a svalově invadující nádory (MIBC – muscle-invasive bladder cancer; stadia pT2–pT4); samostatnou skupinu mezi neinvadujícími nádory zaujímá karcinom in situ (CIS – carcinoma in situ, pTis), jež s sebou nese vysoké riziko další progrese. Jednotlivé typy uroteliálních karcinomů se liší nejen klinickým chováním, ale rovněž se vykazují velmi odlišnou biologií nádorové transformace (tzv. dual-track carcinogenesis) (3). Zatímco podstatou nádorové transformace je u povrchových nádorů komplexní deregulace buněčné proliferace, základní molekulární změnou u svalově invadujících nádorů je celková destabilizace genomu (4). Povrchové karcinomy jsou prognosticky poměrně příznivé, ovšem se značnou četností lokálních recidiv, nicméně pravděpodobnost další progrese se pohybuje jen v rozmezí 10–15 %. Svalově invadující nádory jsou prognosticky méně příznivé, přičemž průměrné pětileté přežití klesá úměrně pokročilosti onemocnění (pro pacienty s onemocněním pT2 se udává v rozmezí 40–65 %, v případě metastatického rozsevu nepřesahuje pětileté přežití zpravidla 5%) (5, 6).
Chemoterapie se v léčbě karcinomu močového měchýře uplatňuje dvojím způsobem. Intravezikální chemoterapie po transuretrální resekci povrchových karcinomů může signifikantně snížit riziko recidivy; nejčastěji se používá mitomycin C nebo epirubicin (7). Systémová chemoterapie se může uplatňovat jak adjuvantně, tak neoadjuvantně, popř. paliativně, opět v naprosté většině v podobě polychemoterapie. V adjuvanci a neoadjuvanci jsou dvě nejrozšířenější schémata M-VAC – metotrexát, vinblastin, doxorubicin – adriamycin a cisplatina a GC – gemcitabin a cisplatina (8), v paliativní léčbě se v první linii opět používá M-VAC nebo gemcitabin + cisplatina, při renální insuficienci gemcitabin + carboplatina, v druhé linii jsou možné monoterapie gemcitabinem nebo vinfluninem, popř. kombinace GC či gemcitabin – karboplatina, nebo cisplatina – cyklofosfamid – doxorubicin. Objektivní klinická účinnost (response rate) zpravidla ovšem nepřesahuje 50 %, což implikuje častou existenci mechanizmů primární chemorezistence. V rámci klinických studií jsou proto testována alternativní chemoterapeutická schémata, např. paktitaxel – doxorubicin (9) či paktitaxel – gemcitabin (10), jejich objektivní klinická účinnost je ovšem ještě daleko nižší.
Biologické mechanizmy chemorezistence mohou zahrnovat širokou škálu procesů, od zvýšeného efluxu cytostatika po snížení proliferační aktivity nádoru (tzv. quiescence) až po narušení apoptotické kompetence (11). K objasnění možných biologických příčin chemorezistence lze s výhodou využít experimentální modely nádorových buněčných kultur (12). Naše recentní studie např. odhalila možný úplně nový mechanizmus chemorezistence vůči doxorubicinu, a to na základě permanentní aktivace mevalonátové syntetické dráhy (13). V současné práci přinášíme odvození nového modelu doxorubicinové chemorezistence uroteliálního karcinomu a jeho základní biologickou charakterizaci.
METODIKA
Základní buněčná kultivace
Buněčná linie uroteliálního karcinomu BC44 byla odvozena z papilárně diferencované části pokročilého karcinomu močového měchýře (pT4 G3) pacientky Urologické kliniky Univerzitní nemocnice v Düsseldorfu v Německu (14). Základní buněčná kultivace probíhala podle optimalizovaného protokolu (15) ve směsném médiu sestávajícím ze suplementovaných médií Epilife (Cascade Biologics) a DMEM (high glucose + glutaMAXTM – Gibco) v poměru 1 : 1. Médium Epilife bylo suplementováno rekombinantním lidským epidermálním růstovým faktorem (0,5 ng/ml, Gibco), bovinním hypofyzárním extraktem (25 μg/ml, Gibco), nonesenciálními amikokyselinami (1%, Gibco), ITS suplementem (insulin – transferrin – sodium selenit; 1%, Gibco), glycinem (3 mM, Sigma) a směsí antibiotik penicilin (100 U/ml) a streptomycin (100 μg/ml) (Sigma). Médium DMEM bylo suplementováno teplem inaktivovaným fetálním bovinním sérem (10%, Sigma) a antibiotiky, stejně jako u média Epilife. Dceřiná buněčná linie BC44DoxoR byla odvozena kultivací BC44 buněk ve zvyšující se koncentraci doxorubicinu (počáteční koncentrace 100 nM, konečná koncentrace 400 nM) v časovém intervalu tří měsíců (Doxorubicin Teva 2mg/ml, Doxorubicinum hydrochloridum, Teva Pharmaceuticals ČR). Doxorubicin jakožto selekční cytostatikum byl zvolen zejména z důvodů disponibility a možného dalšího využití doxorubicin-responzivních reportérských genových kostruktů v procesu podrobnější analýzy mechanismů chemorezistence (13, 16).
Mikroskopická analýza chemorezistentního fenotypu
Mateřská buněčná linie BC44 a odvozená dceřiná buněčná linie BC44DoxoR byly kultivovány do stadia 80% konfluence a cytostatika byla aplikována ve výsledných koncentracích odpovídajících 1 000x ředění u cisplatiny (Cisplatin Hospira 0,5 ml/ml, Cisplatinum, Hospira UK Limited) a metotrexátu (Metotrexate Hospira 25ml/ml, Metotrexatum, Hospira UK Limited) a 10 000x ředění u doxorubicinu (Doxorubicin Teva 2 mg/ml, Doxorubicinum hydrochloridum, Teva Pharmaceuticals ČR), gemcitabinu (Gemcirena 38 mg/ml, Gemcitabini hydrochloriudum, Fresenius Kabi) a vinblastinu (Vinblastin Teva 1mg/ml, Vinblastini sulfas, Teva Pharmaceuticals ČR) (tabulka 1). Po kultivaci 96 h byly buněčné kultury fotograficky dokumentovány prostřednictvím zobrazovacího systému Olympus IX81 – CellR, jak bylo předešle popsáno (13).
Stanovení cytotoxicity in vitro pomocí hodnocení funkce mitochondrií (MTT)
Pro stanovení viability buněk v prostředí různých koncentrací cytostatik byl použit test funkce mitochondriálních dehydrogenáz. Na 96jamkovou destičku s rovným dnem (TPP, Switzerland) bylo nasazeno 7 000 buněk/jamku v celkovém objemu 200 μl média/jamku. Buňky byly kultivovány 24 h ve standardním CO2 inkubátoru při 37°C s 95% vlhkostí a 5% saturací oxidem uhličitým (Sanyo, Japonsko). Po 24 hodinách bylo k buňkám přidáno 20 μl roztoku cytostatika (Doxorubicin, Metotrexát, Vinblastin, Cis Pt, a Gemcitabin) v sestupných koncentračních řadách (Stock a následné ředění vždy 10x, tabulka 1) a jamky byly opatrně propipetovány (tabulka 1). Ovlivněné buňky byly kultivovány 48 hodin s následným provedením MTT testu. Po 48 hodinách bylo k buňkám přidáno 20 μl žlutého MTT roztoku (3-(4,5-Dimethylthiazol-2yl)-2,5-diphenyltetrazolium bromide, Sigma) v koncentraci 5 mg soli/ml PBS a kultivační destička byla ponechána 2,5 h v inkubátoru při 37 °C přikrytá alobalem. Poté bylo médium s cytostatiky opatrně odsáto a vzniklé fialové krystaly byly rozpuštěny přidáním 200 μl rozpouštědla (DMSO:absolutní etanol – 1 : 1) a ponechány za mírného protřepávání v alobalu při laboratorní teplotě 30 minut. Ke kvantitativnímu vyhodnocení MTT testu jsme využili metodu absorpční spektrofotometrie (Tecan GENios, software X Fluor 4.51) při vlnové délce λ=490 nm. Jako pozadí sloužilo samotné rozpouštědlo a jako pozitivní kontrola a tedy 100% životaschopnost buněk byly brány jamky bez ovlivnění cytostatikem. Měření byla provedena minimálně v triplikátech. Pro vybrané koncentrace testovaných látek lze sestavit koncentrační závislost viability, kterou v logaritmickém měřítku reprezentuje sigmoidní křivka. Výsledné naměřené hodnoty absorbancí dvou souborů byly zhodnoceny pomocí neparametrického Mann-Whitney U testu pro hladinu významnosti α=0,05. Tento pořadový test vyhodnotil statistickou významnost rozdílu mediánů dvou souborových hodnot, tedy hodnot absorbancí pro linii BC44 a linii BC44DoxoR.
Tab. 1. Výsledné koncentrace použitých cytostatik v jednotlivých ředěních použitých při analýze Table 1. Final concentrations of cytostatics at variable dilutions used 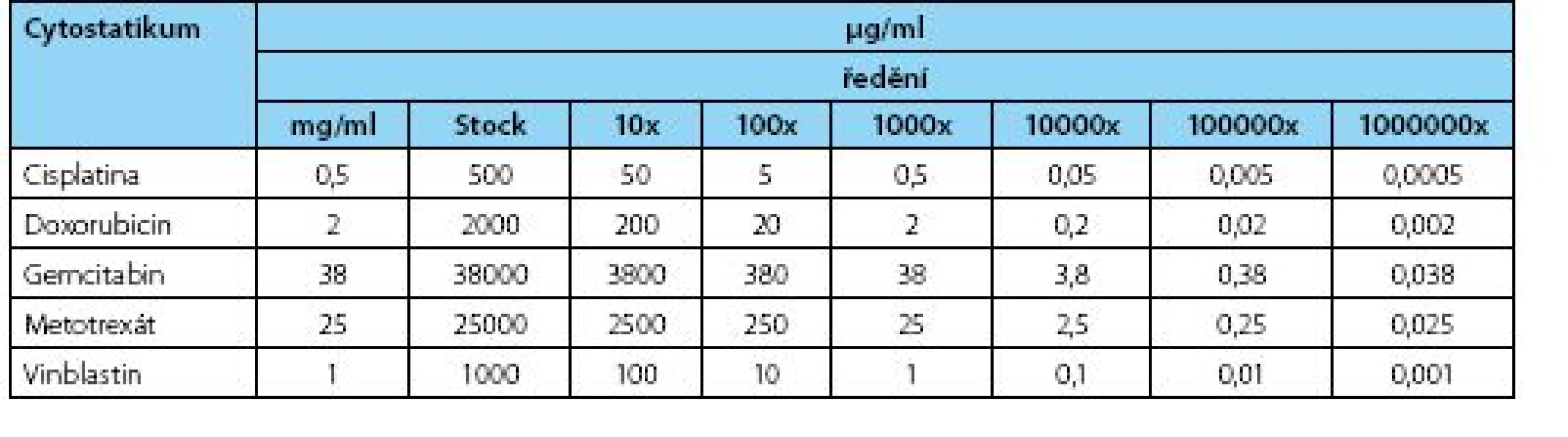
VÝSLEDKY
Podařilo se nám ustanovit dceřinou buněčnou linii BC44DoxoR za pomocí kultivace ve vzrůstající koncentraci doxorubicinu během několika měsíců. Tuto linii jsme podrobili sérii testů, kde jsme ověřovali její potenciální rezistenci i na jiná cytostatika než je doxorubicin, která se běžně užívají při léčbě karcinomu močového měchýře. Veškeré tyto analýzy byly prováděny komparativně s mateřskou linií BC44. Prvotní mikroskopická analýza prokázala multirezistentí fenotyp BC44DoxoR buněk (obrázek 1) a tento nález se nám podařilo kvantitativně potvrdit testem mitochondriální funkce (obrázek 2).
Obr. 1. Mikroskopická analýza multirezistentního fenotypu BC44DoxoR buněk Fig. 1. Microscopic analysis of multiresistant phenotype of BC44DoxoR cells 
Obr. 2. Výsledky MTT testu mateřské linie BC44 a dceřiné rezistentní linie BC44DoxoR při aplikaci sestupné koncentrační řady jednotlivých cytostatik Fig. 2. The results of the MTT assay for the parent line BC44 and the daughter resistant line BC44DoxoR after cytostatic applications in descending concentrations 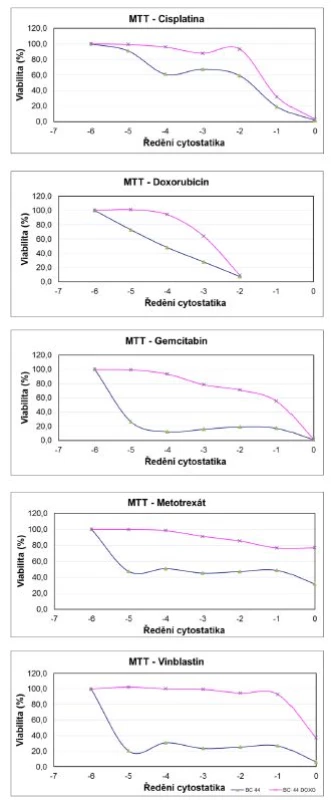
Výsledky kvantitativního MTT testu přesvědčivě prokazují, že hodnota IC 50 pro obě linie se signifikantně liší a dokazuje, že inhibiční koncentrace rezistentní linie je posunuta oproti původní linii BC 44 do mnohem nižšího ředění (obrázek 2, tabulka 2). Z výsledků vyplývá, že nejvyšší rezistenci vykazuje dceřiná buněčná linie BC44DoxoR ve vztahu k gemcitabinu, metotrexátu a vinblastinu, naopak u cisplatiny je relativní rezistence nejnižší. Výsledky rezistence vůči doxorubicinu je nutno rozebrat blíže, protože tato látka, chemicky dostupná jako injekční roztok hydrochloridu doxorubicinu, je již komerčně dodávaná jako barevný roztok s absorbancí ve viditelné oblasti přibližně při vlnové délce λ=550 nm. Test funkce mitochondrií (MTT) byl měřen při vlnové délce λ=490 nm a díky interkalační schopnosti doxorubicinu do DNA docházelo při nižších ředěních cytostatika k obarvení buněk a tudíž ke zkreslení výsledků, které pak nemohly být zahrnuty do statistiky, neboť při zpracování ukazovaly nesprávné výsledky. Při vyšších ředěních již barevnost původního zásobního roztoku nehrála roli a data se spolehlivě statisticky potvrdila.
Tab. 2. Poměrové zvýšení životaschopnosti nově odvozené rezistentní linie BC44DoxoR proti mateřské linii BC 44 – stínovaná data jsou statisticky významná na hladině významnosti α=0,05 (Mann-Whitney test) Table 2. Fold increased viability of the new derived line 44BCDoxoR – shaded values are statistically significant (α=0,05; Mann-Whitney test) 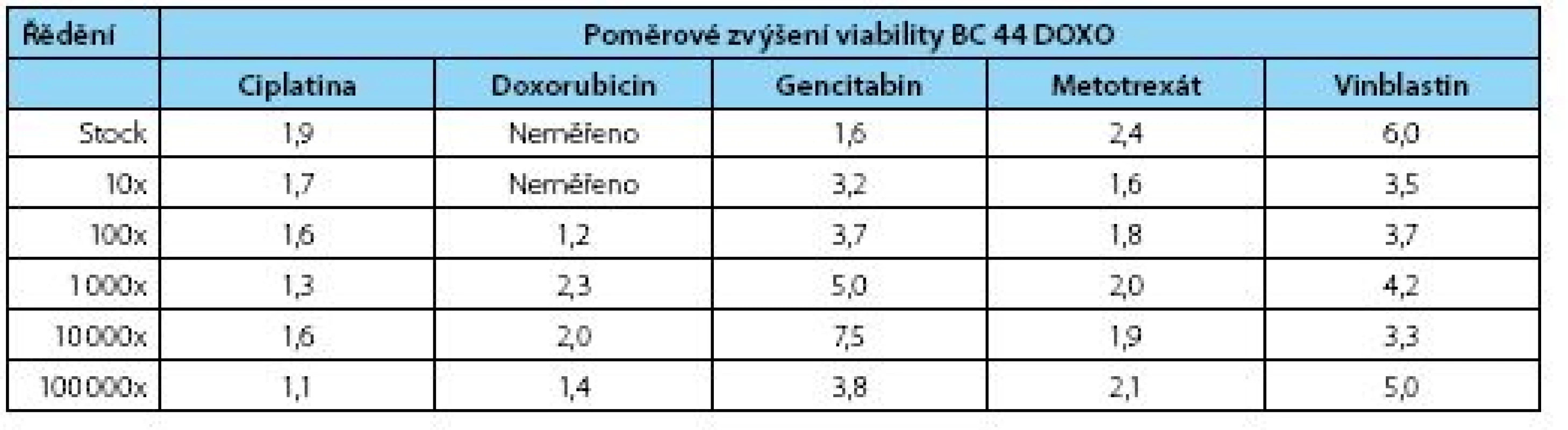
DISKUZE
Hlavním problémem klinického použití protinádorové chemoterapie je vznik chemorezistence, zejména tzv. mnohočetné lékové rezistence. Samotná koncepce kombinační chemoterapie byla právě formulována s cílem co možná nejvíce minimalizovat vývoj terapeutické rezistence nádorů. Uvažovalo se tak, že přestože každé jednotlivé cytostatikum i u nejsenzitivnějších typů nádorů po často velmi dramatické klinické odpovědi nakonec vždy vede k selekci nádorových buněk, jejichž genetické a epigenetické změny vylučují klinickou účinnost daného cytostatika, použití chemoterapeutické kombinace různých cytostatik s různým mechanismem účinku by mělo tuto možnost dramaticky snižovat – klon buněk, jehož genom a regulace jednotlivých genů a proteinů zakládá rezistenci vůči jednomu cytostatiku, bude citlivý vůči jinému (17, 18). Bohužel klinická zkušenost ukazuje, že nádory jsou v konečném stádiu vývoje a progrese rezistentní současně vůči všem pro daný typ určených cytostatikům, a tudíž chemoterapeuticky neléčitelné.
Mnohočetná léková rezistence nádorů je definována jako fenotyp, kdy expozice určitému cytostatiku indukuje vznik rezistence nejen proti tomuto cytostatiku, ale rovněž proti strukturně a mechanismem účinku nepříbuzným cytostatikům, kterým daná populace nádorových buněk nebyla nikdy vystavena (19, 20). Tato kritéria naše dceřiná buněčná linie BC44DoxoR dokonale splňuje. Navíc se podle veškerých dostupných literárních údajů jedná o první buněčnou linii karcinomu močového měchýře s fenotypem mnohočetné lékové rezistence, a navíc s chemorezistencí vůči všem standardně používaným chemoterapeutikům pro systémovou chemoterapii uroteliálního karcinomu.
Existuje několik biologických vysvětlení mechanizmu mnohočetné lékové rezistence. Historicky první popsaný a molekulárně biologicky vysvětlený mechanizmus je založen na aktivitě efluxních pump tzv. ATP-binding casette (ABC) – rodiny (21, 22). Jedná se o aktivní transportéry lokalizované v cytoplazmatické membráně (u epiteliálních buněk v její apikální části), které jsou schopny za spotřeby ATP pumpovat z buňky řadu toxinů a xenobiotik, včetně protinádorových chemoterapeutik. Jedná se ovšem o velmi komplexní proteinovou rodinu, zahrnující nejméně 49 různých strukturně a funkčně homologních transportérů, členěnou na základě sekvenční homologie do 7 tříd – A až G (23). Klinický význam pro vývoj mnohočetné lékové rezistence nádorů byl ovšem prokázán jen pro několik z nich, především MDR-1 (P-glykoprotein, ABCB1), dále některé transportéry třídy C (tzv. multidrug resistance proteins – MRP1 – 9, což odpovídá ABCC1 – ABCC6 a ABCC10 – ABCC12), a tzv. breast cancer resistance protein (BCRP) neboli mitoxantrone resistance protein (MXR) neboli ABCG2. Tyto pumpy mají částečně překryvné, částečně specifické substrátové specifity. Navíc zatímco některá cytostatika mohou být transportována přímo (zejména ta, jejichž molekuly mají velké hydrofobní jádro, jako jsou antracykliny, vinca alkaloidy, taxany, aj.), pro jiné je nutná předchozí konjugace detoxifikačními enzymy 2. fáze – MRP2 (cMOAT – canalicular multispecific organic anion transporter = ABCC2) je takto schopen efluxu cisplatiny až po její konjugaci s glutathionem (24). Situace je o to složitější, že exprese některých ABC-pump může zprostředkovat rezistenci vůči jedné skupině cytostatik, a zároveň senzitivitu vůči jiné; P-glykoprotein (ABCB1) a multidrug resistance protein 1 (ABCC1) pravděpodobně zvyšují citlivost buněk vůči gemcitabinu (23). Vzhledem k tomu je velice obtížné najít jakékoli jednoduché vysvětlení fenotypu mnohočetné lékové rezistence u BC44DoxoR buněk v rámci zvýšené exprese ABC – efluxních pump. Současná rezistence vůči “klasickým“ substrátům (doxorubicin, vinblastin, metotrexát) a současně cisplatině a gemcitabinu by vyžadovala, jestliže by jejím základem měl být zvýšený eflux cytostatik, komplexní změny v expresi řady transportérů ABC – rodiny.
Dalším z možných mechanizmů mnohočetné lékové rezistence je celkové snížení apoptotické kompetence, ať už v důsledku nadměrné exprese některého z mnoha inhibitorů apoptózy (Bcl-2, Bcl-XL, XIAP, aj.), tak naopak mutačním vyřazením apoptotických aktivátorů, zejména na signální dráze tumorového supresorového genu p53 (19). Další z možných strategií obejití či oddálení buněčné smrti je tzv. autofágie, zejména její specifická varianta, tzv. mitofágie, při níž se buňky selektivně zbavují mitochondrií a celá iniciace vnitřní apoptotické dráhy je tak vyřazena (25). Je docela pravděpodobné, že některý z těchto mechanizmů bude ve hře rovněž u BC44DoxoR buněk. V předešlé práci jsme prokázali, že mateřská nádorová buněčná linie BC44 neexprimuje funkční p53 protein (14). Tato okolnost mohla přispět ke vzniku chemorezistentního klonu, sama o sobě ovšem neposkytuje žádné vysvětlení mechanizmu chemorezistence, neboť tato mutační změna je již přítomna v mateřské buněčné linii, která je chemosenzitivní.
Hlavním praktickým přínosem molekulární analýzy progresivních sérií nádorových buněčných linií založených na selekci dceřiných chemorezistentních buněčných linií je v přinášení vhodných kandidátů pro biomarkery chemorezistence či přímo cílové molekuly, jejichž terapeutická inhibice či jiná modifikace by mohla chemorezistenci zvrátit (12, 13). Naším cílem je dosáhnout podobné úrovně molekulární analýzy i pro nově odvozenou buněčnou linii s mnohočetnou lékovou rezistencí BC44DoxoR. Je však na tomto místě třeba zdůraznit, že veškeré klinické i experimentální případy chemorezistence, zejména mnohočetné lékové rezistence, které byly analyzovány dostatečně podrobně, odhalily multifaktoriální charakter tohoto fenotypu, jehož podstatou byla současná aktivita několika různých mechanizmů chemorezistence (12). Je velmi pravděpodobné, že mnohočetná léková rezistence u buněčné linie BC44DoxoR bude mít rovněž tento komplexní základ. Je ovšem na místě rovněž upozornit, že se jedná pouze o experimentální model multilékové rezistence uroteliálního karcinomu, a teprve jeho další, zejména molekulární, analýza ukáže, nakolik jsou mechanizmy chemorezistence u BC44DoxoR buněk typické i pro klinické nádory, a tudíž i klinicky relevantní. V každém případě vzhledem k tomu, že se jedná podle veškerých dostupných literárních údajů o první popsaný model mnohočetné lékové rezistence karcinomu močového měchýře, zaslouží si tento experimentální systém nepochybně další podrobnou analýzu zaměřenou na molekulární mechanizmy chemorezistence; v úvahu v tomto směru přichází zejména analýza diferenciálně exprimovaných genů, popř. proteinů, tedy techniky expresních čipů či proteomiky. I kdyby se zjištěné molekulární mechanizmy daly aplikovat pouze na část chemorezistentních klinických nádorů, pro tuto část pacientů by mohly být získané poznatky velmi podstatné pro vypracování léčebných postupů pro zmírnění či překonání chemorezistentního fenotypu, a tím i odpovídající zlepšení léčebné odpovědi.
Došlo: 28. 8. 2015
Přijato: 4. 11. 2015
Kontaktní adresa:
doc. Ing. Jiří Hatina, CSc.
Ústav biologie,
Lékařská fakulta UK v Plzni
Alej Svobody 76,
323 00 Plzeň
e-mail: jiri.hatina@lfp.cuni.cz
Střet zájmů: žádný
Prohlášení o podpoře:
Tato práce byla podpořena grantem Univerzity Karlovy SVV-2015-260 173.
Zdroje
1. Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin 2015 Mar; 65(2): 87–108.
2. Montie JE, Clark PE, Eisenberger MA. Bladder cancer. J Natl Compr Canc Netw 2009 Jan; 7(1): 8–39.
3. Dinney CP, McConkey DJ, Millikan RE, et al. Focus on bladder cancer. Cancer Cell 2004 Aug; 6(2): 111–116.
4. Knowles MA, Hurst CD. Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity. Nature Reviews Cancer 2015; 15 : 25–41.
5. Raghavan MD, Stein JP, Cote D, Jones JS. Bladder Cancer. In: Holland JF, Frei E eds. Cancer Medicine. 8. ed. Shelton: PMPH-USA; 2009 : 1219–1227.
6. Soukup V, Pešl M. Karcinom močového měchýře. Postgraduální medicína 2001; 13(1): 42–47.
7. Dvořáček J, Babjuk M, et al. Onkourologie. 1. vyd., Praha: Galén; 2005.
8. Von der Maase H, Sengelov L, Roberts JT, et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005 Jul; 23(21): 4602–4608.
9. Kaya AO, Coskun U, Ozkan M. Paclitaxel plus doxorubicin chemotherapy as second-line therapy in patients with advanced urothelial carcinoma pretreated with platinum plus gemcitabine chemotherapy. Onkologie 2012; 35(10): 576–580
10. Albers P, Park SI, Niegisch G. Randomized phase III trial of 2nd line gemcitabine and paclitaxel chemotherapy in patients with advanced bladder cancer: short-term versus prolonged treatment [German Association of Urological Oncology (AUO) trial AB 20/99]. Ann Oncol 2011 Feb; 22(2): 288–294.
11. Longley DB, Johnston PG. Molecular mechanisms of drug resistance. J Pathol 2005 Jan; 205(2): 275–292.
12. Kripnerová M, Hatina J. Buněčné modely chemorezistence urotheliálního karcinomu. Ces Urol 2015; 19(4).
13. Greife A, Tukova J, Steinhoff C, et al. Establishment and characterization of a bladder cancer cell line with enhanced doxorubicin resistance by mevalonate pathway activation. Tumour Biol 2015 May; 36(5): 3293–3300.
14. Koch A, Hatina J, Rieder H, et al. Discovery of TP53 splice variants in two novel papillary urothelial cancer cell lines. Cell Oncol (Dordr) 2012 Aug; 35(4): 243–257.
15. Seifert HH, Meyer A, Cronauer MV, et al. A new and reliable culture system for superficial low-grade urothelial carcinoma of the bladder. World J Urol 2007 Jun; 25(3): 297–302.
16. Greco O, Powell TM, Marples B, Joiner MC, Scott SD. Gene therapy vectors containing CArG elements from the Egr1 gene are activated by neutron irradiation, cisplatin and doxorubicin. Cancer Gene Ther 2005 Jul; 12(7): 655–62.
17. Bruce ACH, Longo DL. Longo eds. Clinical strategies for cancer treatment: The role of drugs. In: Bruce A. Cancer Chemotherapy and Biotherapy. Principles and Practice. 5th ed. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins; 2011, 3–14.
18. Pritchard JR, Lauffenburger DA, Hemann MT. Understanding resistance to combination chemotherapy. Drug Resist Updat 2012 Oct; 15(5–6): 249–257.
19. Moscow JA, Schneider E, Sikic BI, Morrow CS, Cowan KH. Drug resistance and its clinical circumvention. In: Holland JF, Frei E, eds. Cancer Medicine. 8. ed. Shelton: PMPH-USA; 2010 : 597–610.
20. Baguley BC. Multidrug resistance in cancer. In: Baguley BC. Multi-Drug Resistance in Cancer. Methods in Molecular, Biology vol. 596, New York: Humana Press/Springer; 2010, 1–14.
21. Persidis A. Cancer multidrug resistance. Nature Biotechnol 1999 Jan; 17(1): 94–95.
22. O‘Connor R. The pharmacology of cancer resistance. Anticancer Res 2007 May-Jun; 27(3A): 1267–1272.
23. Mohelníková-Duchoňová B, Souček P. Role membránových transportérů v chemorezistenci karcinomu pankreatu při terapii gemcitabinem. Klin Onkol 2010; 23(5): 306–310.
24. Drayton RM, Catto JW. Molecular mechanisms of cisplatin resistance in bladder cancer. Expert Rev Anticancer Ther 2012 Feb; 12(2): 271–281.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2015 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- ROK 2015 PRINIESOL ĎALŠÍ ROZVOJ EDUKAČNÝCH AKTIVÍT ČUS A SUS
- LAPAROSKOPICKÁ RESEKCE LEIOMYOMU TRIGONA MOČOVÉHO MĚCHÝŘE
- LÉČBA LOKALIZOVANÉHO A LOKÁLNĚ POKROČILÉHO KARCINOMU PROSTATY Z POHLEDU UROLOGA A RADIAČNÍHO ONKOLOGA
- BUNĚČNÉ MODELY CHEMOREZISTENCE UROTELIÁLNÍHO KARCINOMU
- ODVOZENÍ A CHARAKTERIZACE BUNĚČNÉHO MODELU MULTILÉKOVÉ REZISTENCE UROTELIÁLNÍHO KARCINOMU
- RADIAČNÍ ZÁTĚŽ PACIENTŮ PODSTUPUJÍCÍCH PERKUTÁNNÍ NEFROLITOTRYPSI NA UROLOGICKÉM ODDĚLENÍ NEMOCNICE ČESKÉ BUDĚJOVICE
- SEDMILETÉ ZKUŠENOSTI S APLIKACÍ RÁZOVÝCH VLN U MUŽŮ S INDURATIO PENIS PLASTICA (IPP)
- SYNCHRONNÍ BILATERÁLNÍ SEMINOM VARLETE
- INFIKOVANÁ CYSTA ZPŮSOBUJÍCÍ MECHANICKÝ SYNDROM JAKO KOMPLIKACE RENÁLNÍHO KARCINOMU
- SOUTĚŽ ČUS O NEJLEPŠÍ VĚDECKOU PUBLIKACI ZA ROK 2014
- WORKSHOP „MÍSTO BOTULINUMTOXINU V TERAPII DYSFUNKCÍ DOLNÍCH CEST MOČOVÝCH“
- TISKOVÁ KONFERENCE ČESKÉ UROLOGICKÉ SPOLEČNOSTI NA TÉMA RAKOVINA PROSTATY
- ANDROLOGIE V UROLOGICKÉ PRAXI – ZPRÁVA O PRŮBĚHU SYMPOZIA
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- SEDMILETÉ ZKUŠENOSTI S APLIKACÍ RÁZOVÝCH VLN U MUŽŮ S INDURATIO PENIS PLASTICA (IPP)
- INFIKOVANÁ CYSTA ZPŮSOBUJÍCÍ MECHANICKÝ SYNDROM JAKO KOMPLIKACE RENÁLNÍHO KARCINOMU
- SYNCHRONNÍ BILATERÁLNÍ SEMINOM VARLETE
- LÉČBA LOKALIZOVANÉHO A LOKÁLNĚ POKROČILÉHO KARCINOMU PROSTATY Z POHLEDU UROLOGA A RADIAČNÍHO ONKOLOGA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



