-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neurální kontrola dolních močových cest
Neural control of the lower urinary tract
Neural control of the lower urinary tract function is a complex and complicated process performed on several levels. The principles of peripheral inervation of the lower urinary tract are relatively well-known to urologists. However, central control mechanisms are known to a rather small number of urologists, even though the consequences of their disorder are encountered in the urological practice on a daily basis. In the last two decades the studies of the brain using the positron emission tomography and the functional magnetic resonance contributed to understanding of the control structures and mechanisms of the micturition cycle on the brain level. Owning to these methods, a basic structure model of functional control of a micturition cycle could have been formed. The objective of this article is to introduce a contemporary view on the neural control of the lower urinary tract to urologists with an emphasis on the function of central structures.
Key words:
brain, spinal cord, sympathetic nerves, parasympathetic nerves, myovesical plexus, prefrontal cortex
Autoři: Jan Krhut 1; Roman Zachoval 2
Působiště autorů: Urologické oddělení FN, Ostrava-Poruba 1; Urologické oddělení FTN, Praha 2
Vyšlo v časopise: Ces Urol 2011; 15(2): 69-77
Kategorie: Přehledový článek
Souhrn
Neurální kontrola činnosti dolních močových cest je komplexní a složitý děj zajišťovaný na několika úrovních. Principy periferní inervace močových cest jsou urologům poměrně známé. Centrální mechanismy kontroly však zná jen poměrně malá část urologů, přestože s důsledky jejich postižení se setkáváme v denní urologické praxi. K poznání struktur a mechanismů kontroly mikčního cyklu na úrovni mozku přispěly v posledních dvou desetiletích zejména studie využívající pozitronovou emisní tomografii mozku a funkční magnetickou rezonanci mozku. Díky těmto metodám bylo možné sestavit alespoň v základních rysech model funkční kontroly mikčního cyklu. Cílem práce je představit urologům současný pohled neurální kontroly dolních močových cest s důrazem na roli centrálních struktur.
Klíčová slova:
mozek, mícha, sympatické nervy, parasympatické nervy, myovezikální plexus, prefrontální kortex.Úvod
Nervová kontrola činnosti dolních močových cest je komplexní a složitý děj zajišťovaný na několika úrovních. Principy periferní inervace močových cest jsou urologům poměrně známé, již dlouho rutinně používají ve své praxi léčiva ovlivňující jak sympatický, tak parasympatický nervový systém (α-sympatolytika, parasympatolytika, parasympatomimetika apod.). Centrální mechanismy kontroly dolních cest močových (DCM) však zná jen poměrně malá část urologů, přestože s důsledky jejich postižení se setkáváme v denní urologické praxi. Všichni urologové se setkávají s pacienty po cévních mozkových příhodách, pacienty s Parkinsonovou chorobou, pacienty s depresemi. Souvislosti mezi onemocněními centrálního nervového systému (CNS) a dysfunkcemi DCM spíše tuší, než že by je byli schopni racionálně vysvětlit.
V posledních dvou dekádách byla objevena řada nových informací, které významně doplnily naše vědomosti o vztazích mezi řídícími nervovými strukturami a DCM. Převratné byly zejména práce Bloka a Holstega využívající pozitronovou emisní tomografii mozku (PET) (1). V posledních letech je ve výzkumu využívána spíše funkční magnetická rezonance mozku (MR).
Díky těmto metodám bylo možné sestavit alespoň v základních rysech model funkční kontroly mikčního cyklu.
Neurální kontrola dolních močových cest na úrovni periferní
Dolní močové cesty jsou inervovány somatickým i vegetativním nervovým systémem (2).
Somatická inervace odstupuje ze sakrální míchy ve výši S2–4 (Onufovo – Onufrowitzovo jádro) a inervuje svaly pánevního dna cestou nervus pudendus.
Sympatická inervace se skládá z eferentních a aferentních vláken. Šedá hmota míchy mezi segmenty Th1 a L2 formuje tzv. laterální neboli postranní rohy míšní, které obsahují tzv. konektorové sympatické neurony. Axony těchto neuronů opouštějí míchu cestou předních rohů míšních a vstupují jako rami communicantes albi do paravertebrálních ganglií tvořících sympatický provazec. Zde synaptují s postsynaptickými neurony, které poté z ganglií L1–L2 sestupují cestou plexus hypogastricus jako sympatická eferentní vlákna k močovému měchýři. V poslední době byla však prokázána sympatická vlákna rovněž v plexus pelvicus. Sympatická inervace zajišťuje zejména kontrakci hrdla močového měchýře a proximální uretry. Zde je ve svalovině lokalizováno největší množství α-adrenergních receptorů. Při podráždění přirozeným neurotransmiterem noradrenalinem a serotoninem spouštějí svalovou kontrakci s následným zvýšením uzávěrového tlaku. V oblasti stěny fundu močového měchýře jsou α-adrenergní receptory zastoupeny jen velmi málo. Přesto se spekuluje o jejich přímém i nepřímém účinku na detruzor. Dokázáno je, že vzhledem k vysoké denzitě adrenoreceptorů v cévní stěně se podílejí na regulaci krevního průtoku stěnou měchýře, což může ovlivňovat jeho funkci (3).
V buňkách detruzoru v oblasti fundu močového měchýře jsou exprimovány podstatně více adrenergní receptory třídy β. Nejpočetnějším subtypem jsou β-3-adrenoreceptory. Ty po interakci se svým mediátorem noradrenalinem aktivují enzym adenylátcyklázu, která indukuje syntézu cAMP, který pak přímým působením na svalovou buňku působí relaxaci detruzoru. Ve studiích in vitro se aplikací agonistů β-3-adrenoreceptorů podařilo dosáhnout větší relaxace detruzoru a většího nárůstu kapacity močového měchýře než při podání antimuskarinik (4).
Sympatická aferentní vlákna jsou ve srovnání s parasympatickými jen málo početná. Z močového měchýře jdou aference cestou hypogastrického plexu. Těla aferentních sympatických neuronů leží v gangliích zadních kořenů, sympatickým provazcem procházejí tedy bez přepojení. Jejich centrální axony cestou zadních rohů vstupují do míchy. Axony pak zčásti komunikují na horizontální úrovni s eferetními vlákny sympatiku i parasympatiku a zajišťují funkci lokálního reflexního oblouku, zčásti jsou vedeny zejména spinotalamickými drahami centrálně a zajišťují vertikální komunikaci.
Parasympatická inervace se rovněž skládá z eferencí a aferencí. Konektorové parasympatické neurony jsou uloženy v šedé hmotě míchy 2.–4. míšního sakrálního segmentu. Početně je však těchto buněk podstatně méně než konektorových buněk sympatických, proto netvoří laterální rohy.
Eferentní parasympatická vlákna tvořená myelinizovanými axony těchto buněk vystupují z míchy cestou předních míšních kořenů a směřují pelvickým nervem směrem k močovému měchýři. K synapsi s postgangliovými nervy dochází v parasympatických gangliích, která se nachází buď těsně u stěny močového měchýře (vezikální ganglia), nebo přímo ve stěně močového měchýře (intramurální ganglia).
Nervový přenos mezi preganliovým a postgangliovým parasympatickým neuronem je v gangliu modulován řadou dalších receptorů (nikotinové, muskarinové, adrenergní, purinergní, peptidergní), které mohou mít na přenos jak stimulační, tak inhibiční efekt.
Spolu s intersticiálními buňkami tvoří intramurální ganglia ve stěně měchýře tzv. myovezikální plexus (viz níže).
Postganglionické parasympatické nervy jsou krátké a nemyelinizované. Jejich zakončení vytváří neuromuskulární ploténky se svalovými buňkami detruzoru. Při uvolnění acetylcholinu na neuromuskulární ploténce dochází k jeho vazbě na muskarinové receptory buněčné membrány detruzoru, což aktivuje fosfolipázu C. Tento enzym pak facilituje intracelulárně syntézu inositol trifosfatázy, jenž způsobuje uvolnění kalcia ze sarkoplazmatického retikula s následnou kontrakcí svalové buňky detruzoru. Acetylcholin se váže rovněž na nikotinové cholinergní receptory. Interpretace jejich role vycházela tradičně ze Weinova schématu distribuce autonomních receptorů v močovém měchýři. Podle něj je maximální exprese parasympatických nikotinových receptorů v oblasti hrdla močového měchýře a uretry. Při excitaci parasympatiku dochází k uvolnění oxidu dusnatého (NO), který se váže na nikotinové receptory, čímž je vyvolána relaxace svalových buněk ve výtokové části dolních močových cest.
V současné době je však jisté, že jejich role je podstatně složitější. Dosud bylo izolováno 17 různých subtypů těchto receptorů a byla dokázána jejich exprese v různých vrstvách stěny měchýře. Víme, že podráždění některých má na stěnu měchýře excitační, podráždění jiných naopak inhibiční účinek. Nikotinové receptory se také podílejí na modulaci zánětlivé odpovědi urotelu ve smyslu její inhibice a zásadní roli hrají nikotinové receptory i v neurotransmisi mezi pregangliovými a postgangliovými parasympatickými neurony. Na definitivní objasnění jejich úlohy v regulaci mikčního cyklu zatím čekáme.
Parasympatická aferentní vlákna jsou dominantní složkou aferencí z močového měchýře, neboť jsou podstatně početnější než sympatická aferentní vlákna. Stejně jako v případě sympatiku se jedná o dlouhá vlákna s tělem v oblasti ganglií zadních kořenů míšních, jejichž centrální axony pak vstupují do míchy a zajišťují horizontální i vertikální komunikaci. Prokázána je komunikace mezi sympatickým a parasympatickým systémem na spinální úrovni, která je základem reflexních mechanismů kontrolujících kontinenci. Důležité ale je, že mezi parasympatickými aferentními vlákny můžeme diferencovat A-δ a C aferentní vlákna. A-δ aferentní vlákna jsou myelinizovaná a podílejí na vedení aferencí za fyziologických okolností. Na jejich aktivaci se podílejí mechanoreceptory a vedou proprioceptivní informace o náplni močového měchýře. C vlákna jsou nemyelinizovaná a za normálních okolností na vedení aferencí nepodílejí, proto jsou též někdy nazývána „spící vlákna“. Mají totiž vyšší práh dráždivosti a na jejich aktivaci se podílejí chemoreceptory a chladové receptory. Vedou zejména nociceptivní podněty. Prokázána je jejich role při vedení aferencí z měchýře za patologických podmínek, např. po míšním traumatu a některých dalších neurologických onemocněních („probuzení spících vláken“) (5). Spekuluje se o roli C vláken v období ranného dětství.
V souvislosti s kontrolou mikčního cyklu je poukazováno na úlohy řady dalších nonadrenergních, non-cholinergních receptorů močového měchýře.
Velká pozornost je v současné době věnována tzv. purinergním receptorům. Jejich přirozeným mediátorem je adenosintrifosfát (ATP). Obecně jsou označovány P2 a se dělí se velmi obecně na metabotropní receptory (P2Y) s pomalou transmisí, které hrají roli v regulaci pomalých a dlouhodobých dějů v organismu a ionotropní receptory (P2X), které se vyznačují rychlou transmisí a jejichž exprese byla prokázána jak na eferentních, tak zejména na aferentních nervech stěny močového měchýře.
Na důležitou roli P2X receptorů poukázal zejména Apostolitis, který prokázal zvýšenou expresi těchto receptorů ve stěně měchýře pacientů s idiopatickou i neurogenní hyperaktivitou detruzoru (6).
Mezi další relativně dobře prozkoumané receptory patří tzv. vaniloidní receptory (TRPV). Jsou exprimovány v urotelu a na aferentních nervových zakončeních a jsou aktivovány například chladem, změnami osmolarity, změnymi pH apod. Právě jejich působením se vysvětluje iniciace mikčního reflexu (vznik urgencí, frekvencí) při pobytu v chladu, při nedostatečném příjmu tekutin s příliš koncentrovanou moči apod. známá z klinické empirie. Vaniloidní receptory se podílejí nejspíše rovněž na vedení nociceptivních podnětů. Na znalosti vlastností vaniloidních receptorů byla založena léčba hyperaktivity detruzoru capsaicinem a resiniferatoxinem, která však v praxi nenalezla širšího uplatnění (7).
Dalšími významnými skupinami receptorů, které se podílejí na kontrole mikčního cyklu, jsou bradykininové receptory B1 a B2 a receptory skupiny p 75, které jsou stimulovány nervovým růstovým faktorem (NGF). Významnou úlohu v regulaci kontraktility detruzoru hrají nejspíše iontové kanály, především kalciové a kaliové.
Neurální kontrola dolních močových cest na úrovni spinální
Základní etáží, na níž se realizuje kontrola mikčního cyklu na spinální úrovni, je oblast sakrálních spinálních segmentů, zejména segmentu S3. Ve mediolaterální oblasti předních rohů míšních je zde lokalizováno tzv. Onufrowiczovo (někdy též nesprávně Onufovo) jádro. To je tvořeno těly neuronů, jejichž axony konstituují somatický pudendální nerv, který inervuje většinu příčně pruhovaného svalstva pánevního dna včetně uretrálního a análního svěrače.
Onufrowiczovo jádro se podílí zejména na realizaci tzv. somatického strážního reflexu. S rostoucí náplní močového měchýře roste intenzita aferencí, které jsou do míchy přiváděny cestou parasympatických aferentních A-δ vláken. Podněty jsou dále vedeny do supraspinálních center zejména zadními míšními provazci. Jako zpětná vazba je následně v oblasti Onufrowiczova jádra uvolňován glutamát, který aktivuje somatický pudendální nerv. Ten způsobuje tonické zvyšování kontrakce uretrálního sfinkteru, což směřuje k zachování kontinence.
Podkladem sympatického (vegetativního) strážního reflexu je naopak zpětnovazebná komunikace parasympatického a sympatického systému. Na zvýšený aferentní input přiváděný do míchy A-δ parasympatickými vlákny reaguje podrážděním lumbální sympatikus. Dochází k podráždění sympatických eferencí s útlumem parasympatické eferentní aktivity dvěma mechanismy. Jednak na eferentních sympatických vláknech inervujících fundus močového měchýře dochází k uvolňování noradrenalinu, který interferuje s β-3-adrenoreceptory v membránách buněk detruzoru. Výsledkem je přímá relaxace detruzoru. Jednak dochází k reakci noradrenalinu uvolňovaného ve stěně měchýře s adrenergními receptory, které jsou exprimovány v parasympatických intramurálních gangliích. Ty inhibují přenos nervového vzruchu z pregangliového na postgangliové parasympatické vlákno a tímto mechanismem je nepřímo tlumena eferentní (prokontrakční) parasympatická aktivita.
Neurální kontrola dolních močových cest na úrovni cerebrální
Obecně je realizována kontrola mikčního cyklu na čtyřech úrovních – korové (převaha inhibiční aktivity), zadního hypothalamu (převaha excitační aktivity), limbického systému (převaha inhibiční aktivity) a mozkového kmene (převaha excitační aktivity). Funkce jednotlivých struktur mozku v řízení mikčního cyklu shrnuje tabulka 1.
Tab. 1. Přehled struktur podílejících se na regulaci mikce na cerebrální úrovni Table 1. Structures involved in the neural regulation of micturition on cerebral level 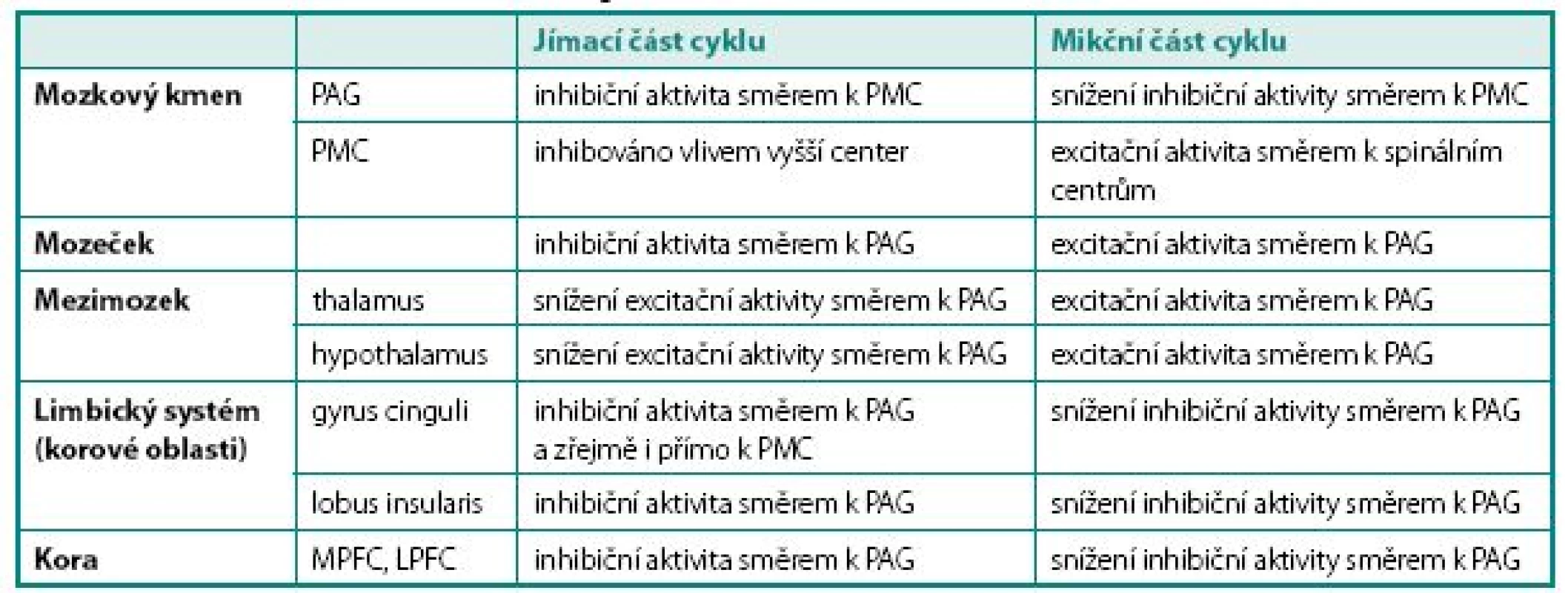
PAG – periaqueduktální šedá hmota, PMC – pontinní mikční centrum, MPFC – mediální prefrontální kortex, LPFC – laterální prefrontální kortex PAG – periaquaeductal grey, PMC – pontine micturition center, MPFC – medial prefrontal cortex, LPFC – lateral prefrontal cortex Aference z periférie jsou přiváděny do mozku do oblasti mesencefala do tzv. periaqueduktální šedé kůry (PAG). Odtud existují mnohočetná spojení jednak do substancia nigra a dále do oblasti pons Varoli, kde se nachází pontinní mikční centrum (PMC), jednak do oblasti mozečku a konečně i směrem rostrálním do oblasti hypothalamu a thalamu. Zejména spoje do hypothalamu mají zásadní význam, protože jeho struktury řídí homeostázu pomocí regulace vegetativního nervstva. Proto bývá též někdy nazýván hlavním jádrem sympatiku. Hypothalamus je jednou z mála mozkových struktur, jež mají přímé spoje k PMC a v kontrole mikce má převážně excitační úlohu.
Role mozečku zatím není dostatečně prozkoumána, má se však za to, že moduluje výšku prahu pro spuštění řady pontinních reflexů. Byla prokázána jeho aktivita (nejspíše inhibiční) v plnící fázi mikčního cyklu a naopak aktivita facilitační v mikční fázi cyklu (8).
Z thalamu jsou aference vedeny do gyrus cinguli a do lobus insularis (insuly). Gyrus cinguli je formace šedé hmoty na mediální ploše hemisféry funkčně patřící k limbickému systému, který se podílí na řízení somatovegeta tivních funkcí, reakcích organismu směřujících k zachování jedince a rodu (příjem potravy, močení, defekace, sexuální chování) a tvorbě základních paměťových stop. Podílí se rovněž na regulaci vegetativních funkcí v důsledku emočních změn (změna srdečního rytmu při strachu apod.). Gyrus cinguli modifikuje reakce organismu na autonomní, emoční a motorické podněty. Vzruchy odsud jsou vedeny směrem k prefrontálnímu kortexu, ale předpokládá se rovněž přímé spojení z gyrus cinguli k PMC s vysokou inhibiční aktivitou během jímací fáze cyklu. Lobus insularis (insula) je okrsek původně povrchové kory, který byl během ontogeneze překryt částmi laloků frontálního, parietálního a temporálního. Je zřejmě další úrovní kontroly homeostázy nadřazenou thalamu. Je proto někdy nazýván homeostatickým aferentním kortexem. Jsou sem vedeny aference z většiny vnitřních orgánů. Zdá se, že pro kontrolu mikčního reflexu je dominantní pravostranný insulární lalok, který pomáhá identifikovat povahu viscerálních signálů přicházejících z nižších etáží a posouvá je dále k prefrontálnímu kortexu. Stejně jako ostatní korové struktury má primárně inhibiční aktivitu v jímací fázi cyklu, na mikční fázi se zřejmě příliš nepodílí (9).
Prefrontálním kortexem nazýváme oblast šedé hmoty čelního laloku mozku ventrálně od gyrus praecentralis. Je zodpovědná zejména za integraci vjemů ze smyslových orgánů, pochody učení, abstraktního myšlení a paměti a regulaci sociálního chování. Zastává rovněž regulační funkce vůči limbickému systému. Ventrální korové oblasti hrají roli zejména v kognitivních, laterální a inferiorní zejména v emočních funkcích.
Laterální prefrontální kortex (LPFC) je považován za centrum hedonické diskriminace – rozhoduje se zde o tom, zde je přicházející podnět vnímán jako příjemný, či nepříjemný. Mediální prefrontální kortex (MPFC) je nejspíše strukturou, kde probíhá volní rozhodování o spuštění mikčního reflexu. Ve své činnosti je ovlivněn i signály z LPFC.
Pokud je žádoucí udržení systému v jímací fázi, zajišťuje MPFC inhibici pontinního mikčního centra, v případě volní iniciace mikční fáze cyklu dochází k oslabení inhibičního vlivu MPFC na PMC. Do PMC navíc současně přicházejí „potvrzující“ signály z hypothalamu o změně nastavení vegetativní inervace. PMC pak následně aktivuje sestupné dráhy směrem k spinálním centrům (10).
Lokalizaci struktur podílejících se na kontrole DCM ilustruje obrázek 1.
Obr.1 Lokalizace struktur podílejících se na regulaci funkce dolních močových cest Fig. 1. Location of structures involved in the regulation of lower urinary tract function 
MPFC – motorický prefrontální kortex, LPFC – laterální prefrontální kortex, LI – lobus insularis, GC – cingulate gyrus, TH – thalamus, HT – hypothalamus, PAG – periaqueduktální šedá hmota, PMC – pontinní mikční centrum MPFC – medial prefrontal cortex, LPFC – lateral prefrontal cortex, LI – lobus insularis, GC – cingulate gyrus, TH – thalamus, HT – hypothalamus, PAG – periaquaeductal grey, PMC – pontine micturition center Dalším systémem, který se zapojuje do kontroly mikčního cyklu, je systém serotoninové regulace. Neurony, v nichž jsou exprimovány serotoninové receptory jsou v mozku uloženy v oblasti jader mozkového kmene. Axony těchto neuronů směřují jednak rostrálně k prefrontálnímu kortexu, jednak směrem do sakrálních oblastí míchy.
Tato jádra se účastní regulace široké škály fyziologických funkcí, jako je např. regulace teploty, percepce bolesti, gastrointestinální mobility, sexuálních funkcí, spánku a nálady. Sestupné serotoninové dráhy mají obecně na aktivitu močového měchýře inhibiční účinek.
Pokusy na zvířeti prokázaly, že aktivace serotoninového systému prostřednictvím serotoninových agonistů nebo inhibitorů zpětného vychytávání serotoninu (SSRI) vedou k útlumu kontraktility detruzoru a nárůstu kapacity močového měchýře (11). Serotoninový systém nejspíše inhibuje množství eferentního inputu, který je vysílán z PMC směrem do spinální míchy. Na úrovni míchy se podílí na regulaci somatického strážního reflexu. Znalost principů serotoninového systému umožňuje vysvětlit souvislost poruch funkce dolních močových cest s poruchami homeostázy serotoninu v CNS u depresí apod.
Na kontrolu mikčního cyklu má vliv samozřejmě řada dalších struktur a neurotransmiterů, jejichž podrobný popis přesahuje rámec tohoto sdělení.
Je třeba se však alespoň zmínit o vlivu dopaminu a kyseliny γ-aminomáselné na dolní močové cesty. Dopamin je secernován zejména v oblasti bazálních ganglií, izolovány byly dva typy dopaminerních receptorů. Zatímco podráždění receptorů D1 vede k inhibici kontraktility detruzoru, excitace D2 receptorů kontraktilitu detruzoru zvyšuje. Deplece sekrece dopaminu vede proto u pacientů s Parkinsonovou chorobou s rozvoji symptomů dolních močových cest, většinou ve smyslu poruchy inhibice mikčního reflexu.
Fyziologie mikce
Během plnící fáze mikčního cyklu je měchýř distendován močí přitékající z horních cest močových. Vzhledem k akomodační schopnosti močového měchýře dochází během plnící fázi jen k minimálnímu a velmi pomalému zvyšování intravezikálního tlaku. Proto hovoříme o normálním močovém měchýři jako o nízkotlakém rezervoáru.
Podle teorie autonomního měchýře je okrsek stěny močového měchýře, který je inervován z jednoho parasympatického ganglia relativně autonomní jednotkou a nazývá se též modulem (12).
Močový měchýř je přirovnáván k fotbalovému míči, který je sešit z jednotlivých kusů (13). Celá stěna močového měchýře je tedy sestavena z modulů, které jsou do značné míry samostatné, ale za určitých okolností jsou schopny svoji aktivitu koordinovat. Během plnící fáze mikčního cyklu jednotlivé moduly produkují nekoordinované kontrakce detruzoru, které jsou výsledkem permanentní bazální neurální stimulace postgangliovými vlákny parasympatiku. Nicméně celkové napětí stěny močového měchýře se nemění, protože kontrakce jednoho modulu je kompenzována relaxací modulů sousedních. Teprve v mikční fázi dochází ke koordinovanému stahu všech modulů, jehož výsledkem je nárůst intravezikálního tlaku.
Klíčovým poznatkem poslední doby je fakt, že spouštěcím místem normální mikce je nejspíše urotel.
S rostoucí náplní v močovém měchýři, dochází k prostorové deformaci uroteliálních buněk. To vede k pohybu intraplazmatických vezikul obsahujících ATP a další neurotransmitery. Tyto vezikuly v další fázi splývají s buněčnou membránou a tímto mechanismem uvolňují neurotransmitery, zejména ATP, do extracelulárního prostoru. Tak dochází k podráždění terminálních aferentních nervových zakončení, což vede ke zvýšení aferentního „inputu“ směrem do CNS. Aferentní impulzy jsou vedeny cestou A-δ vláken do sakrální míchy, kde jsou aktivovány reflexní obranné mechanismy (somatický strážní reflex, vegetativní strážní reflex), které zajišťují udržení nastavení systému do jímací fáze. Aference jsou vedeny dále ascendentně spinobulbárními drahami do oblasti mesencefalu (PAG). Odtud jsou aference vedeny jednak do thalamu a hypothalamu, jednak do korových oblastí frontálního laloku. Tak, jak roste náplň močového měchýře, zvyšuje se množství aferentního inputu v CNS a současně se zvyšuje inhibiční aktivita korového centra. Korová centra jsou schopna za fyziologických okolností velmi účinně tlumit aktivitu pontinního mikčního centra, aby nedošlo k nežádoucímu spuštění eferentní větve mikčního reflexu. Tento útlum může trvat v závislosti na náplni močového měchýře i desítky minut a ukončen je až při volním započetí mikce. Schéma činnosti nervových struktur v plnící fázi mikčního cyklu ukazuje obrázek 2.
Obr. 2. Schéma centrální regulace během jímací fáze mikčního cyklu Fig. 2. Scheme of central regulation during storage phase of the micturition cyclus 
MPFC – motorický prefrontální kortex, LPFC – laterální prefrontální kortex, LI – lobus insularis, GC – gyrus cinguli, TH – thalamus, HT – hypothalamus, PAG – periaqueduktální šedá hmota, PMC – pontinní mikční centrum, M – mícha MPFC – medial prefrontal cortex, LPFC – lateral prefrontal cortex, LI – lobus insularis, GC – cingulate gyrus, TH – thalamus, HT – hypothalamus, PAG – periaquaeductal grey, PMC – pontine micturition center, M – spinal cord Při volním spuštění mikce dochází k poklesu inhibiční aktivity mozkové kůry a současně začínají do oblasti PAG přicházet signály z thalamu a hypothalamu o přenastavení celého systému vegetativní inervace. Pokud jsou signály z mozkové kůry a thalamických center koherentní, dochází k deblokaci aktivity PMC. To pak vysílá eferentní impulzy spinobulbospinálními drahami k parasympatickým neuronům v sakrální míše. Synchronně dochází k inhibici tzv. strážních reflexů na spinální úrovni. Aktivované parasympatické eference vedou vzruchy do superficiálních a intramurálních parasympatických ganglií ve stěně močového měchýře.
Postgangliová vlákna ve stěně měchýře uvolňují acetylcholin, který spouští kontrakci detruzoru. Dosud nejasným způsobem dochází k horizontální komunikaci mezi jednotlivými moduly močového měchýře a dosud nekoordinované a urodynamicky nevýznamné kontrakce detruzoru se mění na koordinovanou kontrakci močového měchýře jako celku.
Pelvický plexus vede i parasympatická vlákna inervující oblast hrdla močového měchýře a uretry. Při excitaci dochází na jejich zakončení k uvolnění oxidu dusnatého, který se váže na nikotinové receptory s následnou relaxací svalových buněk ve výtokové části dolních močových cest. Tímto mechanismem dochází při podráždění parasympatiku k současné kontrakci detruzoru a relaxaci uzávěrového mechanismu.
Po vyprázdnění močového měchýře dochází k přenastavení systému a přechodu opět do jímací fáze. Činnost nervových struktur během mikční fáze cyklu ilustruje obrázek 3. Kromě klasických neurotransmitérů sympatiku a parasympatiku (acetylcholin, adrenalin, noradrenalin, dopamin, serotin) moduluje funkci dolních močových cest (mnohdy ne zcela jasným mechanismem) ještě celá řada dalších substancí, z nichž nejznámější je vazoaktivní intestinální polypeptid (VIP), neuropeptid Y (NPY), substance P (SP), neurální růstový faktor (NGF) a další.
Obr. 3. Schéma centrální regulace během mikční fáze mikčního cyklu Fig. 3. Scheme of central regulation during voiding phase of the micturition cyclus 
MPFC – motorický prefrontální kortex, LPFC – laterální prefrontální kortex, LI – lobus insularis, GC – gyrus cinguli, TH – thalamus, HT – hypothalamus, PAG – periaqueduktální šedá hmota, PMC – pontinní mikční centrum, M – mícha MPFC – medial prefrontal cortex, LPFC – lateral prefrontal cortex, LI – lobus insularis, GC – cingulate gyrus, TH – thalamus, HT – hypothalamus, PAG – periaquaeductal grey, PMC – pontine micturition center, M – spinal cord Závěr
Neurální kontrola DCM je složitý mnohaúrovňový děj, který v mnoha aspektech ještě není objasněn.
Základním poznatkem poslední doby je: Neexistují speciální „mozková centra pro močový měchýř“ nebo specifické „nervové dráhy pro močový měchýř“. Inervaci DCM je třeba chápat v kontextu řízení celého vegetativního systému. Existence struktur, které specificky ovlivňují pouze činnost močového měchýře je diskutabilní. Například anatomická existence pontinního mikčního centra je velmi sporná. Nejspíše se jedná o strukturu, která se podílí na regulaci systémusympatikus/ parasympatikus jako celku.
Další změnu pohledu na inervaci močových cest si vynutil průkaz exprese muskarinových a adrenergních receptorů v nervových strukturách (aferentní nervová zakončení, perivezikální ganglia, míšní struktury). Lze tak implikovat, že mnoho dějů, u nichž jsme předpokládali periferní mechanismy řízení na úrovni močového měchýře (působení sympatiku na hrdlo močového měchýře), jsou ve skutečnosti řízeny spíše z etáží vyšších. Stejně tak se v současné době potvrzuje, že účinek mnoha léků ovlivňujících DCM (α-sympatolytika, parasympatolytika) není realizován na úrovni močového měchýře, ale na úrovni nervových řídících struktur. I z těchto důvodů by urolog měl mít alespoň základní znalost o neurální kontrole dolních močových cest.
Došlo: 9. 8. 2010.
Přijato: 29. 9. 2010.
Kontaktní adresa
doc. MUDr. Jan Krhut, Ph.D.
Urologické oddělení FN
tř. 17. listopadu 1790,
708 52 Ostrava-Poruba
e-mail: jan.krhut@fnspo.cz
Zdroje
1. Blok B, Willemsen T, Holstege G. A PET study of brain control of micturion in humans. Brain
1997; 120 : 111–121.
2. Hanuš T. Farmakologické ovlivnění dynamiky dolních močových cest. Rozhl Chir 1982; 61(1):
42–46.
3. Das AK, Leggett RE, Whitbeck C, et al. Effect of doxazosin on rat urinary bladder function
after partial bladder obstruction. Neurourol Urodyn. 2002; 21(2): 160–166.
4. Andersson KE, Wein AJ. Pharmacology of the lower urinary tract. Basis for current and future
treatments of urinary incontinence. Pharmacol Rev 2004; 56(4): 581–631.
5. Habler HJ, Janig W, Koltzenburg M. Activation of unmyelinated afferent fibres by mechanical
stimuli and inflammation of the urinary bladder in the cat. J Physiol 1990; 425 : 545–562.
6. Apostolidis A, Popat R, Yiangou Y, et al. Decreased sensory receptors P2X3 and TRPV1 in
suburothelial nerve fibers following intradetrusor injections of botulinum toxin for human
detrusor overactivity. J Urol 2005; 174(3): 977–982.
7. de Seze M , Wiart L, de Seze MP, et al. Intravesical capsaicin versus resiniferatoxin for the treatment
of detrusor hyperreflexia in spinal cord injured patients: a double-blind, randomized,
controlled study. J Urol 2004; 171(1): 251–255.
8. Griffiths D, Tadic SD. Bladder control, urgency and urge incontinence: evidence from functional
brain imaging. Neurourol Urodyn 2008; 27; 466–474.
9. Drake MJ, Fowler CJ, Griffiths D, et al. Neural control of the lower urinary and gastrointestinal
tracts: supraspinal CNS mechanism. Neurourol Urodyn 2010; 29 : 119–127.
10. Fowler CJ, Griffiths DJ. A decade of functional brain imaging applied to bladder control Neurourol
Urodyn 2010; 29 : 49–55.
11. Ramage AG. The role of central 5-hydroxytryptamine (5-HT, serotonin) receptors in the control
of micturition. Br J Pharmacol 2006; 147(Suppl 2): 20–31.
12. Gillespie JI. The autonomous bladder: a view of the origin of bladder overactivity and sensory
urge. BJU Int 2004; 93(4): 478–483.
13. Drake MJ. The integrative physiology of the bladder. Ann R Coll Surg Engl 2007; 89 : 580–585.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2011 Číslo 2- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
-
Všechny články tohoto čísla
- Nehmatné varle u dítěte: začít diagnostickou laparoskopií nebo otevřenou revizí třísla?
- Léčba neurogenní hyperaktivity detruzoru botulinumtoxinem A – první zkušenosti se subslizniční aplikací
- Výsledky léčby retroperitoneálních sarkomů a jejich hlavní rizika
- Sarkomatoidný karcinóm močového mechúra s heterológnou osteosarkomatóznou diferenciáciou
- Extrakce kalcifikované spirály z močového měchýře s použitím Holmiového laseru
- Práce českých urologů publikované v zahraničí v roce 2010
-
VZPOMÍNKA NA PANA DOCENTA MUDr. SVATOPLUKA KOČVARU, DrSc.
15. července 1921 – 23. ledna 2011 - Docent Radim Kočvara šedesátníkem
- Současné možnosti miniinvazivní léčby nádorů ledvin
- Editorial
- Neurální kontrola dolních močových cest
- Lichen sclerosus – stále přehlížená urologická diagnóza se závažnými komplikacemi
- Komentář k článku Lichen sclerosus – stále přehlížená urologická diagnóza se závažnými komplikacemi
- Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře
- Role laparoskopie v urologii
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lichen sclerosus – stále přehlížená urologická diagnóza se závažnými komplikacemi
- Neurální kontrola dolních močových cest
- Nehmatné varle u dítěte: začít diagnostickou laparoskopií nebo otevřenou revizí třísla?
- Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



