-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaÚČINEK RANIBIZUMABU A AFLIBERCEPTU NA SERÓZNÍ ABLACI RETINÁLNÍHO PIGMENTOVÉHO EPITELU, SUBRETINÁLNÍ A INTRARETINÁLNÍ TEKUTINU PŘI VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACI
EFFECT OF RANIBIZUMAB AND AFLIBERCEPT ON RETINAL PIGMENT EPITHELIAL DETACHEMENT, SUBRETINAL AND INTRARETINAL FLUID IN AGE-RELATED MACULAR DEGENERATION
Purpose: The aim of the study was to compare the effect of three initial doses of the anti-VEGF ranibizumab and aflibercept medication on serous pigment epithelial detachment (PED), subretinal fluid (SRF) and intraretinal fluid (IRF) in the macula of treatment naive neovascular AMD (nvAMD) patients.
Material and Methods: The cohort consists of 148 patients, of which 74 patients were treated with ranibizumab (51 females and 23 males) and 74 with aflibercept (46 females and 28 males). The data was recorded prospectively from the moment of diagnosis and start of treatment for a period of 3 months. At the moment of diagnosis and 3 months later, an OCT examination (Spectralis OCT, Heidelberg Engineering, Heidelberg, Germany) was performed. The OCT examination included a macular scan with 25 scans. Using the OCT instrument software, we measured the maximum anterior-posterior elevation of serous PED, the highest thickness of SRF and the largest diameter of the intraretinal cystic space. The statistical significance of differences between groups was evaluated using the t-test for continuous data and the Fisher exact test for categorical data. Changes in values of continuous variables over time were evaluated using the Wilcoxon paired test. Paired comparisons of binary parameters were determined by the McNemar test.
Results: Full regression of PED, SRF and IRF occurred in 3 (4.1%), 25 (39%) and 20 (51%) patients treated with ranibizumab, and in 5 (7.9%, p = 0.470), 28 (47%, p = 0.470) and 25 (57%, p = 0.827) patients treated with aflibercept, respectively. The average regression of PED, SRF and IRF was -60.4 μm (median -37.5 μm), -84.3 μm (median -85 μm) and -109.3 μm (median -81 μm) in patients treated with ranibizumab, and -46.3 μm (median -30 μm, p = 0.389), -127.7 μm (median -104 μm, p = 0.096) and -204.4 μm (median -163 μm, p = 0.005) in patients treated with aflibercept, respectively. We did not show a statistically significant difference in the regression rates of PED, SRF and IRF between the ranibizumab and aflibercept groups. (in patients with IRF after adjustment of the higher baseline IRF volumes in patients treated with aflibercept, p = 0.891).
Conclusion: We are convinced that ranibizumab and aflibercept have the same effect on serous PED, SRF and IRF in the macula in patients with treatment naive nvAMD during the initial loading phase.
Keywords:
ranibizumab – aflibercept – age-related macular degeneration – pigment epithelium detachment – subretinal fluid – intraretinal fluid
Autoři: P. Sumarová 1,2; P. Ovesná 3; V. Matušková 1,2; J. Beránek 1,2; M. Michalec 1,2; L. Michalcová 1; D. Autrata 1,2; D. Vysloužilová 1,2; O. Chrapek 1,2
Působiště autorů: Oční klinika FN Brno 1; Oční klinika, Lékařská fakulta, Masarykova univerzita Brno 2; Institut biostatistiky a analýz s. r. o., Brno 3
Vyšlo v časopise: Čes. a slov. Oftal., 78, 2022, No. 4, p. 176-185
Kategorie: Původní práce
doi: https://doi.org/10.31348/2022/20Souhrn
Cíl: Cílem studie bylo porovnat účinek třech počátečních dávek anti-VEGF ranibizumabu a afliberceptu na serózní ablaci retinálního pigmentového epitelu (PED), subretinální tekutinu (SRF) a intraretinální tekutinu (IRF) v makule u pacientů s neléčenou neovaskulární věkem podmíněnou makulární degenerací (nvAMD).
Materiál a metody: Soubor tvoří 148 pacientů, z toho 74 pacientů bylo léčených ranibizumabem (51 žen a 23 mužů) a 74 afliberceptem (46 žen a 28 mužů). Údaje se zaznamenávaly prospektivně od okamžiku diagnózy a počátku léčby po dobu 3 měsíců. V okamžiku diagnózy a o 3 měsíce později bylo provedeno OCT vyšetření. OCT vyšetření zahrnovalo makulární sken s 25 skeny. Pomocí softwaru OCT přístroje jsme změřili maximální elevaci serózní PED, maximální výšku SRF a největší průměr intraretinální cystické tekutiny.
Výsledky: Úplná regrese PED, SRF a IRF se vyskytla u 3 (4,1 %), 25 (39 %) a 20 (51 %) pacientů léčených ranibizumabem a u 5 (7,9 %, p = 0,470), 28 (47 %, p = 0,470) a 25 (57 %, p = 0,827) pacientů léčených afliberceptem. Průměrná regrese PED, SRF a IRF byla -60,4 μm (medián -37,5 μm), -84,3 μm (medián -85 μm) a -109,3 μm (medián -81 μm) u pacientů léčených ranibizumabem a -46,3 μm (medián -30 μm, p = 0,389), -127,7 μm (medián -104 μm, p = 0,096) a -204,4 μm (medián -163 μm, p = 0,005) u pacientů léčených afliberceptem. Mezi skupinami s ranibizumabem a afliberceptem jsme neprokázali statisticky významný rozdíl v míře regrese PED, SRF a IRF (u pacientů s IRF po úpravě vyšších vstupních hodnot IRF u pacientů léčených afliberceptem, p = 0,891).
Závěr: Naše výsledky ukazují, že ranibizumab a aflibercept mají stejný účinek na serózní PED, SRF a IRF v makule u pacientů s dosud neléčenou nvAMD během úvodní fáze terapie.
Klíčová slova:
ranibizumab – aflibercept – věkem podmíněná makulární degenerace – ablace pigmentového retinálního epitelu – subretinální tekutina – intraretinální tekutina
ÚVOD
Věkem podmíněná makulární degenerace (AMD) se dělí na suchou a vlhkou formu. Vlhká forma představuje jen 10 % případů tohoto onemocnění, podle Bresslera je 90 % legální slepoty z AMD způsobené vlhkou formou [1].
Vlhká forma AMD, též nazývaná neovaskulární AMD (nvAMD), je založená na růstu subretinální membrány (CNV), která vede ke snížení zrakové ostrosti (VA) v důsledku anatomických změn v makule. Anatomické změny v makule u pacientů s nvAMD typicky pozůstávají z odloučení pigmentového epitelu sítnice (PED), subretinální tekutiny (SRF) a intraretinální tekutiny (IRF) [2,3].
Opakované intravitreální injekce blokátoru vaskulárního endotelového růstového faktoru (anti-VEGF) jsou současným zlatým standardem léčby nvAMD [4–7]. Ranibizumab (Lucentis; Novartis Pharma AG, Bazilej, Švýcarsko) a Aflibercept (Eylea; Bayer HealthCare, Berlín, Německo) jsou dnes hlavní léčbou tohoto stavu. Aflibercept a ranibizumab prokázaly srovnatelnou účinnost, pokud jde o nejlepší korigovanou zrakovou ostrost (BCVA) a zlepšení tloušťky centrální sítnice [7–8]. Tyto dvě anti-VEGF medikace ovšem vykazují odlišné farmakologické profily [9]. Probíhá diskuze o potenciálních rozdílech v účinku těchto preparátů u různých podskupin pacientů. Proto jsou potřebné srovnávací studie.
Dosud jsme nenašli studii, která by prospektivně a přímo porovnávala účinek ranibizumabu a afliberceptu na serózní PED, SRF a IRF u pacientů s nvAMD. Jelikož víme, že nejvyšší zlepšení BCVA se dosahuje v počáteční fázi léčby, tedy po prvních třech injekcích ranibizumabu nebo afliberceptu [7,8,10,11], rozhodli jsme se porovnat účinek ranibizumabu a afliberceptu na morfologické změny u pacientů s nvAMD právě během počáteční fáze léčby. Navíc, výběrem tohoto období jsme byli schopni podat stejný počet injekcí obou přípravků ve stejném časovém období.
Cílem studie bylo vyhodnocení případného statisticky významného rozdílu v účinku ranibizumabu proti afliberceptu na serózní PED, SRF a IRF u naivních pacientů s nvAMD během úvodní loadovací fáze léčby.
MATERIÁL A METODY
Soubor tvoří 148 pacientů (51 mužů a 97 žen, průměrný věk 74, resp. 72 roků). Pravé oko bylo ošetřeno v 79 a levé oko v 69 případech. 74 pacientů bylo léčených ranibizumabem (51 žen a 23 mužů) a 74 afliberceptem (46 žen a 28 mužů). Pacienti byli prospektivně sledováni od ledna 2018. Do sledování jsme průběžně zařazovali pacienty, kteří byli dle uvážení léčbu indikujícího lékaře nahodile zařazováni k léčbě ranibizumabem nebo afliberceptem. Sběr dat byl nezávislý na všech rozhodnutích o léčbě; neovlivnil přístup pacienta k léčbě a plně splňoval všechny etické, jakožto i zákonné požadavky na sběr údajů v České republice. Všichni pacienti dali svůj písemný informovaný souhlas s léčbou i sběrem údajů. Vyšetření i sběr dat byly v souladu se zásadami Helsinské deklarace.
Každá návštěva zahrnovala biomikroskopické vyšetření očního pozadí, stanovení BCVA pomocí ETDRS optotypů (Early Treatment Diabetic Retinopathy Study). První návštěva zahrnovala fluorescenční angiografii (FA). V den stanovení diagnózy a o tři měsíce později bylo provedeno OCT vyšetření (Spectralis OCT, Heidelberg Engineering, Heidelberg, Německo). OCT vyšetření zahrnovalo makulární sken s 25 skeny. Manuálně jsme vyšetřili každý z 25 vstupních OCT skenů u každého pacienta. Pomocí softwaru přístroje OCT jsme změřili nejvyšší serózní PED (největší vzdálenost mezi RPE a Bruchovou membránou) v μm, nejvyšší akumulaci SRF (největší vzdálenost RPE a vnější strany neuroepitelu) a průměr největšího intraretinálního cystického prostoru. Obrázek 1. Jelikož OCT Spectralis je vybavený systémem sledování očí, bylo možné zopakovat 25 skenů na stejném místě o 3 měsíce později v rámci sledování po 3 počátečních dávkách anti-VEGF léčby. Zopakovali jsme měření nejvyšší serózní PED, nejvyšší akumulace SRF a průměru nejvyššího intraretinálního cystického prostoru. Pacienti s diagnostikovanou vlhkou formou AMD, kteří splnili kritéria Státního ústavu pro kontrolu léčiv pro zahájení léčby anti-VEGF, byli léčeni třemi injekcemi ranibizumabu (0,5 mg) nebo afliberceptu (2 mg). Anti-VEGF terapie v České republice je indikována u pacientů s AMD, kteří jsou starší 50 let, s převážně klasickou, minimálně klasickou nebo skrytou CNV dosahující do subfoveolární oblasti, skóre BCVA mezi 70–35 písmeny (20/40–20/200 Snellenova ekvivalentu), celková plocha makulární léze ≤ 8 ploch disku, submakulární krvácení ≤ 25 % celkové plochy makulární léze. Údaje byly popsané pomocí standardní statistiky – kontinuální proměnné popsané průměrem, mediánem, minimem a maximem; na popis kategoriálních proměnných byly použité absolutní a relativní početnosti. Statistická významnost rozdílů mezi skupinami byla hodnocena pomocí testu pro kontinuální data a Fisherovým exaktním testem pro kategorická data. Úprava vstupních hodnot IRF se dále aplikovala pomocí vícerozměrného lineárního regresního modelu, protože různé základní objemy IRF by mohly zmást účinek léčby – vyšší základní objemy IRF poskytují vyšší potenciál na snížení IRF. Změny hodnot kontinuálních proměnných v čase byly hodnoceny pomocí Wilcoxonova párového testu. Párové porovnání binárních parametrů bylo provedeno McNemarovým testem. Analýza byla provedena pomocí softweru R Ústavu biostatistiky a analýz s.r.o., Brno. Hladina statistické významnosti byla ve všech analýzách stanovena na α = 0,05.
Obr. 1. Měření nejvyšší akumulace SRF, IRF a PED 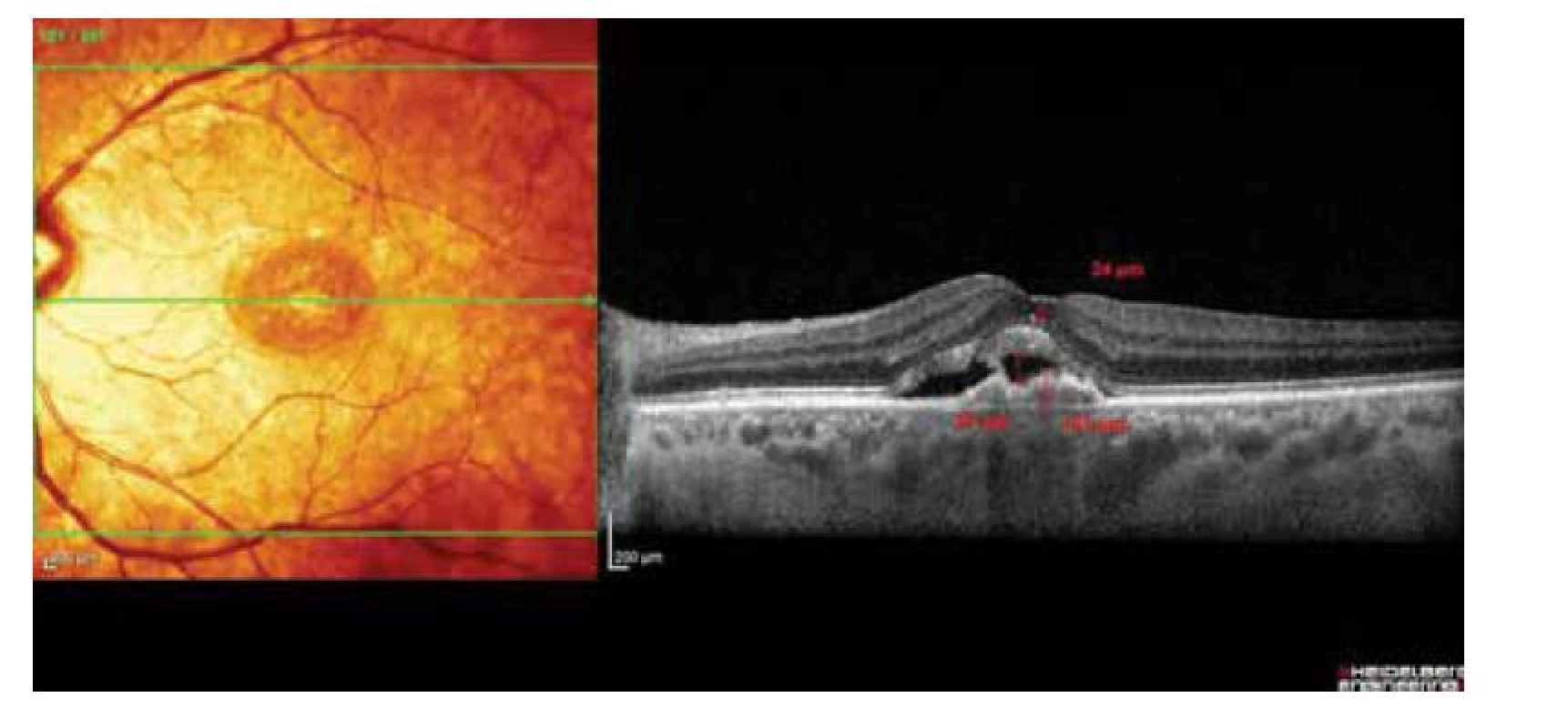
SRF– subretinální tekutina, IRF – intraretinální tekutina, PED – ablace retinálního pigmentového epitelu VÝSLEDKY
Serózní PED byla diagnostikována na začátku léčby u 137 pacientů. Plná regrese a úplné vymizení PED nastalo u 8 (6 %) pacientů a léčba anti-VEGF byla statisticky významně úspěšná (p = 0,046). Průměrná regrese PED po léčbě byla -53,9 μm (medián -36) a míra úspěšnosti byla statisticky významná (p < 0,001) (Tabulka 1). Tabulka ukazuje míru regrese serózní PED dosaženou u všech pacientů, ale i u pacientů samostatně léčených ranibizumabem a afliberceptem Z této kohorty bylo 74 pacientů ve skupině s ranibizumabem a 63 ve skupině s afliberceptem. K úplné regresi PED došlo u 3 (4,1 %) pacientů léčených ranibizumabem a 5 (7,9 %) pacientů léčených afliberceptem (p = 0,470). Průměrná regrese PED po léčbě byla -60,4 μm (medián -37,5 μm) a -46,3 μm (medián -30) ve skupině s ranibizumabem a afliberceptem (p = 0,389). U pacientů léčených ranibizumabem a afliberceptem se nezjistil statisticky významný rozdíl v míře regrese serózní PED (Graf 1). Rozdíl mezi preparáty nebyl prokázán jako statisticky významný (p = 0,389), a to ani po adjustaci na vstupní hodnoty ablace. SRF byla vstupně zjištěna u 123 pacientů souboru. Plná regrese SRF nastala u 53 pacientů (43 %), což je výsledek, který byl statisticky významný (p < 0,001). Průměrná regrese SRF po ošetření byla -105,3 μm (medián -95 μm) a míra resorpce byla statisticky významná (p < 0,001) (Tabulka 2). Tabulka ukazuje míru regrese subretinální tekutiny dosažené u všech pacientů, ale i u pacientů samostatně léčených ranibizumabem a afliberceptem.
Tab. 1. Ablace retinálního pigmentového epitelu 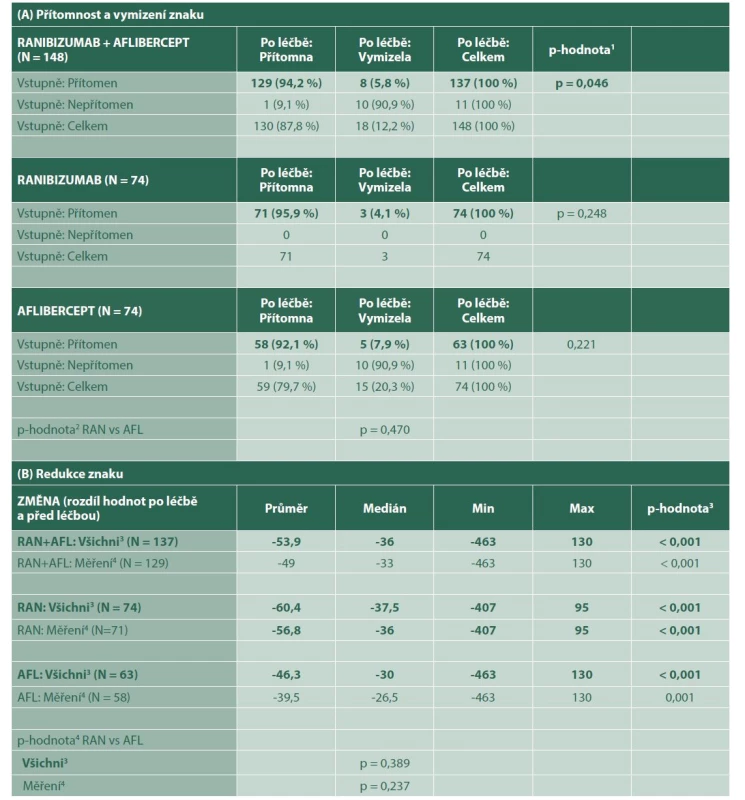
p-hodnota1 McNemarova testu
p-hodnota2 Fisherova exaktního testu
p-hodnota3 Wilcoxonova párového testu
p-hodnota4 Mann-Whitneyho U-testu
3 pacientům s vymizeným znakem po léčbě dosazena hodnota 0 (tzn. maximální pokles)
4 pacienti s přítomným znakem a naměřenou hodnotou před i po léčbě (tzn. pacienti bez úplného vymizení znaku)
RAN – Ranibizumab, AFL – AfliberceptGraf 1. Změna ablace retinálního pigmentového epitelu 
Tab. 2. Subretinální tekutina 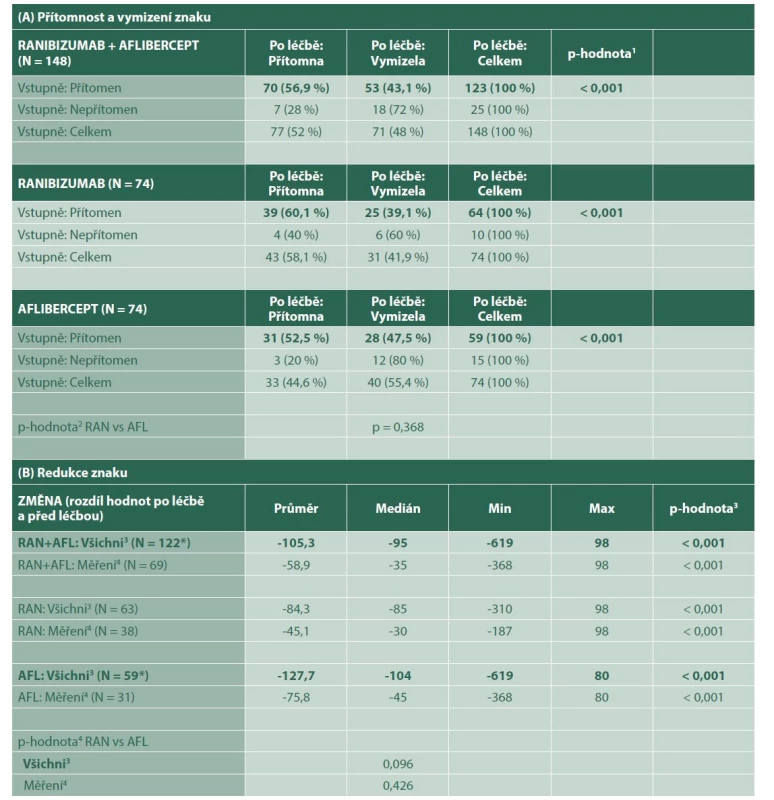
p-hodnota1 McNemarova testu
p-hodnota2 Fisherova exaktního testu
p-hodnota3 Wilcoxonova párového testu
p-hodnota4 Mann-Whitneyho U-testu
3 pacientům s vymizeným znakem po léčbě dosazena hodnota 0 (tzn. maximální pokles)
4 pacienti s přítomným znakem a naměřenou hodnotou před i po léčbě (tzn. pacienti bez úplného vymizení znaku)
RAN – Ranibizumab, AFL – Aflibercept
* u 1 pacientky chybí měření po ukončení léčbySRF byla zjištěná u 123 pacientů v souboru. 64 z těchto pacientů bylo ve skupině s ranibizumabem a 59 ve skupině s afliberceptem. Úplná regrese SRF byla pozorována u 25 (39 %) pacientů léčených ranibizumabem a 28 (47 %) pacientů léčených afliberceptem (p = 0,470). Průměrná regrese SRF po léčbě byla -84,3 μm (medián -85 μm) a -127,7 μm (medián -104 μm) ve skupinách s ranibizumabem a afliberceptem (p = 0,096). Mezi pacienty léčenými ranibizumabem a afliberceptem nebyl statisticky významný rozdíl v míře regrese SRF (Graf 2).
Graf 2. Změna subretinální tekutiny 
Rozdíl mezi preparáty nebyl prokázán jako statisticky významný (p = 0,096), a to ani po adjustaci na vstupní hodnoty subretinální tekutiny (p = 0,249, v Tabulce 2 neuvedeno).
IRF byla zjištěná u 84 pacientů v souboru. Úplná regrese a úplné vymizení IRF nastalo u 45 (53 %) pacientů a léčba anti-VEGF byla statisticky významně úspěšná (p < 0,001). Průměrná regrese IRF po léčbě byla -160,9 μm (medián -139 μm) a míra regrese byla statisticky významná (p < 0,001) (Tabulka 3). Tabulka ukazuje míru regrese intraretinální tekutiny dosažené u všech pacientů, ale i u pacientů samostatně léčených ranibizumabem a afliberceptem.
Tab. 3. Intraretinální tekutina 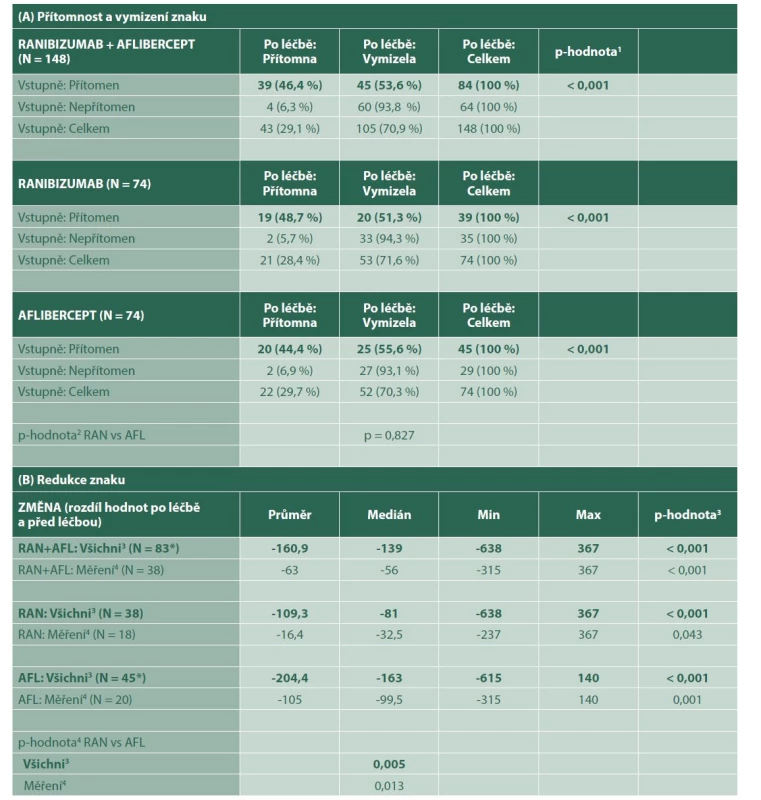
p-hodnota1 McNemarova testu
p-hodnota2 Fisherova exaktního testu
p-hodnota3 Wilcoxonova párového testu
p-hodnota4 Mann-Whitneyho U-testu
3 pacientům s vymizeným znakem po léčbě dosazena hodnota 0 (tzn. maximální pokles)
4 pacienti s přítomným znakem a naměřenou hodnotou před i po léčbě (tzn. pacienti bez úplného vymizení znaku)
RAN – Ranibizumab, AFL – Aflibercept
* u 1 pacientky chybí měření po ukončení léčbyIRF byla diagnostikovaná u 84 pacientů v souboru - 39 pacientů ve skupině s ranibizumabem a 45 ve skupině s afliberceptem. Úplnou regresi IRF jsme pozorovali u 20 (51 %) pacientů léčených ranibizumabem a 25 (57 %) pacientů léčených afliberceptem (p = 0,827). Průměrná regrese IRF po léčbě byla -109,3 μm (medián -81 μm) a -204,4 μm (medián -163 μm) ve skupinách s ranibizumabem a afliberceptem (p = 0,005). V obou skupinách došlo ke statisticky významnému snížení IRF. Léčba afliberceptem vedla ke statisticky významně větší redukci IRF (medián -163 vs. medián -81, p = 0,005). Svou roli zde ovšem sehrála vyšší hodnota vstupních objemů IRF u pacientů léčených afliberceptem poskytující vyšší potenciál na snížení. Po úpravě nebyl statisticky významný rozdíl v redukci IRF mezi ranibizumabem a afliberceptem (p = 0,891) (Tabulka 4). Jenom intraretinální tekutina vykazovala statisticky významný rozdíl ve velikosti základních znaků mezi skupinami s ranibizumabem a afliberceptem. Ve skupině s afliberceptem byla ovšem vstupní hodnota intraretinální tekutiny statisticky významně vyšší než ve skupině s ranibizumabem (p < 0,001). Mezi pacienty léčenými ranibizumabem a afliberceptem tedy nebyl statisticky významný rozdíl v míře regrese IRF (Tabulka 3, Tabulka 4, Graf 3).
Tab. 4. Hodnoty sledovaných parametrů před léčbou a po léčbě 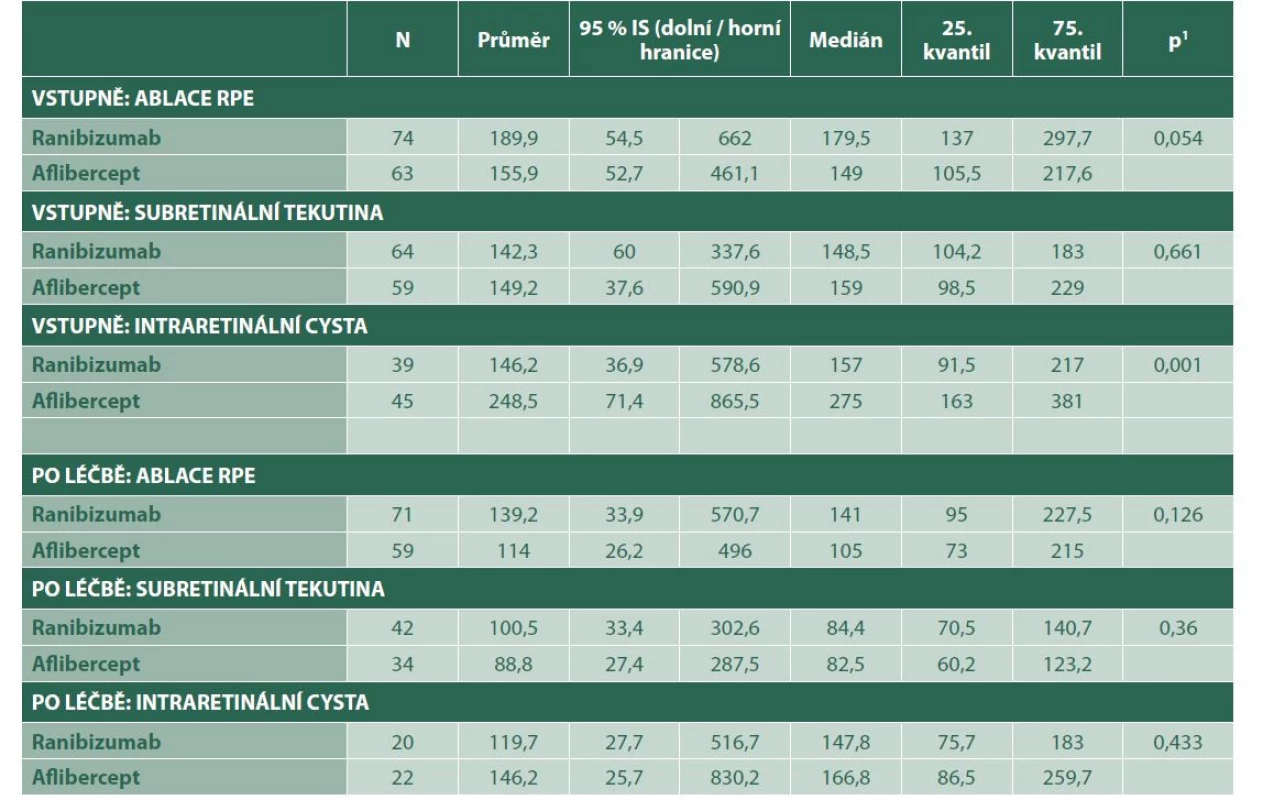
p1 – hodnota t-testu
RPE – Retinální pigmentový epitelGraf 3. Změna intraretinální tekutiny 
Ve skupině s afliberceptem došlo k statisticky signifikantně vyšší redukci intraretinální tekutiny (p = 0,005). Ovšem po adjustaci na vstupní hodnoty nebyl prokázán statisticky významný rozdíl v redukci intraretinální tekutiny mezi preparáty ranibizumab a aflibercept (p = 0,891, v Tabulce 3 neuvedeno).
DISKUZE
Studie MARINA [4], ANCHOR [6], VIEW 1 a VIEW 2 [7] doložily účinnost ranibizumabu a afliberceptu podávaných ve fixním režimu během 24 měsíců u pacientů s nvAMD. V těchto počátečních studiích byl ukazatelem účinku ranibizumabu a afliberceptu vývoj BCVA. Popis morfologických změn v makule byl omezen na rychlost změny tloušťky makuly v souvislosti s ústupem makulárního edému. Tento trend se časem mírně změnil. Při léčbě nvAMD byly publikovány změny v morfologii makuly. Studie HARBOR 1roční výsledky ve skupině s ranibizumabem (0,5 mg měsíčně) ukázala rychlý pokles tloušťky centrální fovey 7. den, který pokračoval až do 3. měsíce a přetrval do 12. měsíce. Po 12. měsíci byl prokázán pokles celkové plochy CNV [12]. Clemens popsal úplné zploštění léze v serózní vaskularizované skupině PED u 30 % pacientů a úplnou absorpci SRF po třech injekcích pozorovanou u přibližně 70 % pacientů při dávce 0,5 mg ranibizumabu měsíčně [13]. To je v souladu s předtím publikovanými údaji Schmidt – Erfurth [3]. Němčanský uvádí, že po roční léčbě afliberceptem byla reziduální makulární tekutina přítomná u 27,8 % všech pacientů, bez specifikace, zda šlo o subretinální nebo intraretinální tekutinu [14]. V některých studiích koreluje základní morfologický nález v makule na počátku léčby nvAMD a funkční výsledek terapie. Ashraf uvádí, že pacienti s PED, IRF a vitreomakulární adhezí dosáhli menší zrakové zisky [15]. Post hoc analýza výsledků VIEW 1/ VIEW 2 se zaměřila na souvislost mezi různými morfologickými znaky a funkčními výsledky. Studie zjistila, že bez ohledu na použitou medikaci byla přítomnost IRF a PED na začátku léčby spojená s menší změnou BCVA v 52. týdnu (2,11 méně písmen pro IRF a 1,88 méně písmen pro ablaci RPE) ve srovnání se SRF, která byla spojena s o 2,11 písmeny ziskem BCVA v 52. týdnu proti vstupní hodnotě [16–17]. Existují i studie porovnávající vývoj morfologických nálezů v makule při léčbě ranibizumabem a afliberceptem. V Heierově studii, měl aflibercept tendenci vykazovat zvýšenou účinnost při absorpci tekutin; 27,6 % pacientů léčených afliberceptem mělo perzistentní tekutinu během 1 roku v porovnání s 38 % pacientů léčených ranibizumabem [7]. Studie VIEW 1 a VIEW 2 porovnávaly účinnost a bezpečnost intravitreálních injekcí afliberceptu (IAI) a injekcí ranibizumabu u naivních očí s nvAMD. 0,5 mg intravitreálního ranibizumabu každé 4 týdny (Rq4), 2 mg IAI každé 4 týdny (2q4) a 2 mg IAI každých 8 týdnů (2q8) po 3 úvodních měsíčních injekcích. V obou skupinách 2q4 a 2q8 mělo více než 50 % zkoumaných očí první epizodu absence tekutiny v sítnici do 4. týdne. Ve 12. týdnu bylo více než 75 % očí léčených 2q4 nebo 2q8 suchých alespoň na první vizitě. Ve 20. týdnu byl dosažen 75 % kumulativní výskyt suché makuly při první návštěvě očí léčených Rq4. Na základě poměru relativního rizika pro přetrvávající suchost byla u očí léčených 2q4 přibližně 1,5krát vyšší pravděpodobnost než u léčených Rq4 a 2q8 na dosažení trvalého vysušení. Když byla po prvních třech injekcích přítomna perzistentní intraretinální nebo subretinální tekutina (nález přítomný u přibližně 20 % očí původně léčených IAI a u 30 % očí Rq4), může být přínosem měsíční aplikace IAI v porovnání s jiným režimem, co dokazuje vyšší podíl suché makuly, větší zlepšení zrakové ostrosti a menší podíl se ztrátou zrakové ostrosti v očích léčených 2q4 v porovnání s očima léčenýma Rq4 nebo 2q8 v 52. týdnu. Důvod lepších výsledků zrakové ostrosti v IAI 2q4 léčebné skupině mezi očima s přetrvávající tekutinou není známa. Autoři předpokládají, že neléčené oči, ve kterých tekutina přetrvává i po počáteční léčbě, mohou být méně citlivé na antipermeabilní účinky anti-VEGF a vyžadují nepřetržitou léčbu anti - -VEGF, aby se předešlo nepříznivým účinkům tekutiny na fotoreceptory a jiné neurosenzorické struktury sítnice. Nebyli schopni posoudit vliv včasné perzistující tekutiny na mikro anatomii sítnice, protože v této studii bylo použito time-domain OCT s nižším rozlišením [16–17]. Dirani publikoval studii, která zkoumala faktory ovlivňující zrakovou ostrost a odpověď PED při nvAMD po třech měsících léčby anti-VEGF, včetně porovnaní mezi ranibizumabem a afliberceptem. Dirani pozoroval snížení maximální výšky PED o 66 μm větší u pacientů léčených afliberceptem než u očí léčených ranibizumabem (p = 0,22) [18]. Massougnes provedl retrospektivní porovnání účinku 12měsíční léčby ranibizumabu a afliberceptu na PED u pacientů s vlhkou formou AMD. Pacienti léčení afliberceptem vykazovali o 90,66 μm větší snížení maximální výšky PED než tomu bylo u očí léčených ranibizumabem (p = 0,008) [19]. Cho kromě toho pozoroval, že aflibercept vykazoval větší pravděpodobnost zploštění RPE než ranibizumab (p = 0,039) po 12 měsících léčby, i když úplné vymizení PED bylo omezené jen na 19,5 % jedinců [20]. Velké multicentrické studie u neovaskulární AMD ukázaly, že největší změna tloušťky sítnice vzniká po prvním ošetření, což naznačuje, že první injekce anti - -VEGF má největší morfologický dopad na sítnici a největší stres na RPE [21–22]. Funkční efekt anti-VEGF medikace je nejvýraznější během nasycovací fáze terapie [10–11]. Proto jsme se zaměřili na morfologické změny makuly během nasycovací fáze terapie (loading fáze). Na rozdíl od Diraniho a Massougnese nebyl statisticky významný rozdíl v účinnosti afliberceptu proti ranibizumabu na PED. Naše studie nejenom přímo porovnává účinky afliberceptu a ranibizumabu na PED, ale i na SRF a IRF, opět během zahajovací fáze terapie. Ani SRF, ani IRF nevykazovaly statisticky významné rozdíly v účinnosti mezi těmito dvěma preparáty. V dostupné literatuře jsme nenašli žádné další studie, které by prospektivně hodnotili účinek ranibizumabu a afliberceptu na všechny tři typické morfologické změny v doteď neléčených očích s nvAMD s porovnatelným počtem injekcí během stejného časového intervalu. Výsledky této studie možno použít jako základ pro budoucí prospektivní studie účinků ranibizumabu, afliberceptu a nově se objevujícího brolucizumabu na morfologické změny v makule pacientů s naivní nvAMD.
ZÁVĚR
Léčba anti-VEGF významně snižuje serózní PED, SRF a IRF u pacientů s nvAMD. Nejslabší efekt léčby byl pozorován při serózní PED, kde byla úspěšnost léčby na hranici statistické významnosti. Nezjistili jsme statisticky významné rozdíly v účinku ranibizumabu a afliberceptu na morfologické změny u pacientů s nvAMD. Naše výsledky ukazují, že účinek ranibizumabu a afliberceptu na serózní PED, SRF a IRF v makule pacientů s nvAMD je během počáteční fáze terapie srovnatelný.
Autoři prohlašují, že vznik a téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou. Práce nebyla zadána jinému časopisu ani jinde otištěna.
Do redakce doručeno dne: 18. 3. 2022
Přijato k publikaci dne: 23. 5. 2022
MUDr. Patrícia Sumarová
Oční klinika FN Brno
Jihlavská 340/20
625 00 Brno
E-mail: sumarova.patricia@fnbrno.cz
Zdroje
1. Bressler NM, Bressler SB, Fine SL. Age related macular degeneration. Surv Ophthalmol. 1988;32(6):375-413.
2. Simader Ch, Ritter M, Bolz M, et al. Morphologic Parameters Relevant for Visual Outcome during Anti-Angiogenic Therapy of Neovascular Age-Related Macular Degeneration. Ophthalmology 2014;121(6):1237-1245.
3. Schmidt-Erfurth U, Waldstein SM, Deak GG, Kundi M., Simader Ch. Pigment Epithelial Detachment Followed by Retinal Cystoid Degeneration Leads to Vision Loss in Treatment of Neovascular Age-Related Macular Degeneration. Ophthalmology 2015;122(4):822 - 832.
4. Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1419-1431.
5. Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006;355 : 1432-1444.
6. Brown DM, Michels M, Kaiser PK, Heier JS, Sy JP, Ianchulev T. Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: two-year results of the ANCHOR study. Ophthalmology 2009;116(1):57-65.
7. Heier JS, Brown DM, Chong V, et al. Intravitreal aflibercept (VEGF trap-eye) in wet age-related macular degeneration. Ophthalmology 2012;119(12): 2537-2548.
8. Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal Aflibercept Injection for Neovascular Age-related Macular Degeneration: ninety-six-week results of the VIEW studies. Ophthalmology 2014;121(1):193-201.
9. Papadopoulos N, Martin J, Ruan Q, et al. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis 2012;15(2):171-185.
10. Gillies MC, Hunyor AP, Arnold JJ, et al. Effect of Ranibizumab and Aflibercept on Best-Corrected Visual Acuity in Treat-and-Extend for Neovascular Age-Related Macular Degeneration: A Randomized Clinical Trial. JAMA Opthalmol 2019;137(4):372-379.
11. Silva R, Berta A, Larsen M, et al. Treat-and-Extend versus Monthly Regimen in Neovascular Age-Related Macular Degeneration: Results with Ranibizumab from the TREND Study. Ophthalmology 2018;125(1):57-65.
12. Busbee BG, Ho AC, Brown DM, Heier JS, Suner IJ, Li Z. Twelve - -month efficacy and safety of 0.5 mg or 2.0 mg ranibizumab in patients with subfoveal neovascular age-related macular degeneration. Ophthalmology 2013;120(5):1046-1056.
13. Clemens CR, Wolf A, Alten F, Milojcic C, Heiduschka P, Eter N. Response of vascular pigment epithelium detachment due to age-related macular degeneration to monthly treatment with ranibizumab: the prospective, multicentre RECOVER study. Acta Ophthalmol. 2017;95(7):683-689.
14. Němčanský J, Stepanov A, Koubek M, Veith M, Klimesova JM, Studnicka J. Response to Aflibercept Therapy in Three Types of Choroidal Neovascular Membrane in Neovascular Age-Related Macular Degeneration: Real-Life Evidence in the Czech Republic. Journal of Ophthalmol, 2019;Article ID 2635689.
15. Ashraf M, Souka A, Adelman R. Age-related macular degeneration: using morphological predictors to modify current treatment protocols. Acta Ophthalmol. 2018;96(2):120-133.
16. Waldstein SM, Simader C, Staurenghi G, et al. Morphology and visual acuity in aflibercept and ranibizumab therapy for neovascular age-related macular degeneration in the VIEW trials. Ophthalmology 2016;123(7):1521-1529.
17. Waldstein SM, Wright J, Warburton J, Margaron P, Simader Ch, Schmidt-Erfurth U. Predictive value of retinal morphology for visual acuity outcomes of different ranibizumab treatment regimens for neovascular AMD. Ophthalmology 2016;123(1):60-69.
18. Dirani A, Ambresin A, Marchionno L, Decugis D, Mantel I. Factors influencing the treatment response of pigment epithelium detachment in age-related macular degeneration. Am J Ophthalmol. 2015;160(4):732-738.
19. de Massougnes S, Dirani A, Mantel I. Good visual outcome at 1 year in neovascular age-related macular degeneration with pigment epithelium detachment. Factors influencing the treatment response. Retina 2017;0 : 1-8.
20. Cho HJ, Kim KM, Kim HS, Lee DW, Kim CG, Kim JW. Response of pigment epithelial detachment to anti-vascular endothelial growth factor treatment in age-related macular degeneration. Am J Ophthalmol. 2016;166 : 112-9.
21. Chakravarthy U, Harding SP, Rogers CA, Downes SM, Lotery AJ, Wordsworth S, et al. Ranibizumab versus bevacizumab to treat neovascular age-related macular degeneration: one-year findings from the IVAN randomized trial. Ophthalmology 2012;119(7):1399-1411.
21. Chakravarthy U, Harding SP, Rogers CA, et al. Ranibizumab versus bevacizumab to treat neovascular age-related macular degeneration: one-year findings from the IVAN randomized trial. Ophthalmology 2012;119(7):1399-1411.
22. Martin DF, Maguire MG, Fine SL, et al. Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration: two-year results. Ophthalmology 2012;119(7):1388-1398.
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2022 Číslo 4- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
-
Všechny články tohoto čísla
- VITAMÍN D A OFTALMOPATIE. PREHĽAD
- ENDOPHTHALMITIS IN OPHTHALMOLOGICAL REFERRAL CENTRE IN COLOMBIA: AETIOLOGY AND MICROBIAL RESISTANCE
- ÚČINEK RANIBIZUMABU A AFLIBERCEPTU NA SERÓZNÍ ABLACI RETINÁLNÍHO PIGMENTOVÉHO EPITELU, SUBRETINÁLNÍ A INTRARETINÁLNÍ TEKUTINU PŘI VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACI
- DETERMINATION OF FACTORS ASSOCIATED WITH LONG-TERM ENDOTHELIAL LOSS AND REFRACTIVE RESULT IN PATIENTS WITH ARTISAN PHAKIC LENS
- KOINCIDENCE IDIOPATICKÉ INTRAKRANIÁLNÍ HYPERTENZE A LEBEROVY HEREDITÁRNÍ OPTICKÉ NEUROPATIE. KAZUISTIKA
- EN BLOC RESEKCIA VAZOPROLIFERATÍVNEHO TUMORU SIETNICE POMOCOU 23G VITREKTÓMIE. KAZUISTIKA
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- EN BLOC RESEKCIA VAZOPROLIFERATÍVNEHO TUMORU SIETNICE POMOCOU 23G VITREKTÓMIE. KAZUISTIKA
- VITAMÍN D A OFTALMOPATIE. PREHĽAD
- KOINCIDENCE IDIOPATICKÉ INTRAKRANIÁLNÍ HYPERTENZE A LEBEROVY HEREDITÁRNÍ OPTICKÉ NEUROPATIE. KAZUISTIKA
- ÚČINEK RANIBIZUMABU A AFLIBERCEPTU NA SERÓZNÍ ABLACI RETINÁLNÍHO PIGMENTOVÉHO EPITELU, SUBRETINÁLNÍ A INTRARETINÁLNÍ TEKUTINU PŘI VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACI
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




