-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
VLIV LÉČBY NA POVRCH OKA U PACIENTŮ S JEDNOSTRANNÝM DĚTSKÝM GLAUKOMEM
Autoři: M. Janderová 1; A. Filouš 1; M. Hložánek 1; D. Dotřelová 1; G. Mahelková 1,2
Působiště autorů: Oční klinika dětí a dospělých 2. LF UK a FN v Motole 1; Ústav fyziologie 2. LF UK 2
Vyšlo v časopise: Čes. a slov. Oftal., 77, 2021, No. 1, p. 28-34
Kategorie: Původní práce
doi: https://doi.org/10.31348/2021/3Souhrn
Cíl: Cílem práce bylo zhodnotit změny povrchu oka a slzného filmu u pacientů s dětským (primárním nebo sekundárním) jednostranným glaukomem a porovnat nálezy na oku léčeném a na zdravém oku bez léčby.
Metodika: Do studie byli zařazeni pacienti s jednostranným glaukomem sledovaní v dětské ambulanci Oční kliniky dětí a dospělých 2. LF UK a FN v Motole. Bylo provedeno vyšetření osmolarity slz, tloušťky epitelu rohovky, slzného menisku, Schirmerova testu, barvení povrchu oka pomocí fluoresceinu a hodnocení stability slzného filmu (TBUT). Ke zjištění subjektivních potíží byl použit standardizovaný dotazník (Ocular Surface Disease Index, OSDI). Byly porovnávány hodnoty na oku léčeném a na oku zdravém bez léčby. Výsledky byly uváděny jako průměrné hodnoty ± SD a byly statisticky analyzovány.
Výsledky: Celkem bylo vyšetřeno 13 pacientů. Průměrný věk pacientů byl 17,2 ± 8,1 let. Na léčeném oku jsme prokázali statisticky významně nižší tloušťku epitelu rohovky (45,9 ± 5,3 µm) a kratší TBUT (6,0 ± 1,7 s) oproti hodnotám na zdravém oku (50,2 ± 2,6, resp. 8,8 ± 3,2 s; p = 0,0106, resp. p = 0,0015). Povrch léčeného oka se statisticky významně více barvil fluoresceinem (1,7 ± 2,1) než povrch zdravého oka (0,5 ± 0,8; p = 0,0243). V ostatních sledovaných parametrech jsme neprokázali rozdíl mezi léčeným okem a okem bez léčby.
Závěr: Výsledky potvrzují změny povrchu oka a slzného filmu na léčeném oku, které mohou být vyvolané nežádoucími účinky chronicky podávané antiglaukomové terapie nebo i jako následek prodělaného chirurgického zákroku. Z hlediska minimalizace těchto nežádoucích účinků je vhodné věnovat v klinické praxi zvýšenou pozornost výběru léčivého přípravku, zejména s ohledem na obsah konzervačních látek.
Klíčová slova:
povrch oka – antiglaukomová léčba – konzervační látky
ÚVOD
Glaukom je heterogenní skupina onemocnění, jejichž nejvýznamnějším rizikovým faktorem je zvýšený nitrooční tlak (NOT). U dětí rozeznáváme primární glaukom (vrozený, infantilní, juvenilní) a sekundární glaukom, způsobený ztížením odtoku komorové tekutiny v důsledku dalšího očního nebo systémového onemocnění [1]. V obou případech může jít pouze o jednostranné postižení.
Cílem léčby glaukomu je pomocí snížení nitroočního tlaku, zlepšení oční perfuze a neuroprotekce zabránit apoptóze gangliových buněk sítnice, tedy progresi onemocnění. Při léčbě dětských glaukomů je často nutné už v časné fázi indikovat operační výkon, v případě řešení kongenitálních glaukomů je chirurgická léčba primární. Přesto je v mnoha případech následně nutné pokračovat i terapií medikamentózní pomocí lokálně podávaných preparátů.
V současné době je již dobře zdokumentován negativní vliv konzervačních látek v očních kapkách na rozvoj poškození tkání povrchu oka a vznik syndromu suchého oka [2–6]. Syndrom suchého oka (SSO) je multifaktoriálně podmíněné onemocnění slz a očního povrchu, které je spojeno s nestabilitou slzného filmu a subjektivními obtížemi pacienta, včetně zhoršení zrakové ostrosti. Narušení homeostázy povrchu oka a slzného filmu vede k zvýšení osmolarity slzného filmu a aktivaci kaskády prozánětlivých faktorů. Rozvoj chronického zánětu vede k dalšímu narušení stability slzného filmu – vzniká circulus vitiosus [7,8].
Příznaky syndromu suchého oka byly popsány až u 60 % dospělých pacientů léčených pro glaukom [4,9,10,11]. Pacienti s glaukomem jsou vzhledem k dlouhodobé aplikaci antiglaukomových kapek chronicky vystaveni účinku konzervačních látek [12]. Toxický efekt těchto látek, zejména benzalkoniumchloridu (BAK), může vysvětlovat vysokou prevalenci syndromu suchého oka pozorovaného u této skupiny pacientů a korelaci mezi příznaky, počtem aplikovaných antiglaukomatik a trváním léčby [2,6,13,14]. Změny slzného filmu a povrchu oka však byly popsány i po antiglaukomových a jiných očních operacích [15–17].
Cílem práce bylo zhodnotit změny povrchu oka a slzného filmu u pacientů s jednostranným dětským primárním či sekundárním glaukomem a porovnat nálezy na oku léčeném a na druhostranném zdravém oku bez léčby.
METODIKA
Do studie byli zařazeni pacienti s jednostranným glaukomem, kteří jsou dlouhodobě sledováni v dětské ambulanci Oční kliniky dětí a dospělých 2. LF UK a FN v Motole. Pacienti byli v letech 2016–2018 aktivně vyhledáváni z dostupné databáze pacientů a osloveni k účasti ve studii. Do studie byli zařazení pouze pacienti, kteří měli zájem o účast ve studii a byli schopni absolvovat příslušná vyšetření. Všichni účastníci studie podepsali informovaný souhlas schválený Etickou komisí Fakultní nemocnice v Motole.
U pacientů byla odebrána podrobná anamnéza (délka sledování glaukomu, operační zákroky, doba a typ používané medikamentózní léčby) a zaznamenána přesná diagnóza. Dále bylo provedeno podrobné oční vyšetření, včetně nejlépe korigované centrální zrakové ostrosti (BCVA), zaznamenány aktuální hodnoty nitroočního tlaku (NOT), provedeno vyšetření osmolarity slz, vyšetření tloušťky epitelu rohovky (CET), vyšetření slzného menisku (LTMA), Schirmerova testu I (ST1, bez aplikace anestetika), barvení povrchu oka pomocí fluoresceinu a hodnocení stability slzného filmu break-up time testem (TBUT). Pro měření osmolarity slz byl použit přístroj TearLab Osmolarity System (TearLab Corp, San Diego, CA, USA). Pomocí mikročipu byl odebrán vzorek slz (50 nl) z dolního temporálního slzného menisku a následně automaticky přístrojem analyzován. Osmolarita byla měřena dvakrát vždy současně na obou očích a zaznamenána průměrná hodnota i vyšší z obou hodnot pro každé oko. K měření CET rohovky a LTMA byl použit Fourier-Domain AS-OCT system (Optovue Inc., Fremont, CA, USA) s rohovkovým adaptačním nástavcem CAM-L. LTMA jsme měřili na 4milimetrovém vertikálním skenu (sken určený k zobrazení komorového úhlu), který byl otočen vertikálně a centrován na dolní slzný meniskus u čísla 6 při pohledu pacienta nahoru. Plocha byla měřena pomocí nástroje pro měření plochy, který je dostupný v rámci softwaru přístroje (Obrázek 1). CET rohovky byla odečtena na horizontálním OCT řezu rohovky ve třech místech a zaznamenána průměrná hodnota pro každé oko. Pro hodnocení vitálního barvení povrchu oka jsme použili hodnocení dle Oxfordského schématu [18]. Schéma obsahuje 5 panelů A-E, přičemž na každém z panelů jsou zobrazeny 3 zóny: temporální bulbární spojivka – rohovka – nasální bulbární spojivka. Rozsah tečkovité epiteliopatie každé zóny je hodnocen od 0 do 5, maximální možná hodnota je 15 (odpovídá nálezu těžké epiteliopatie ve všech třech zónách). Nález jsme hodnotili po mrknutí pacienta pomocí štěrbinové lampy a předsazeného modrého filtru. Při hodnocení stability slzného filmu (TBUT; hodnocení času po mrknutí do roztržení slzného filmu) bylo měření provedeno třikrát a zaznamenána průměrná hodnota. Ke zjištění subjektivních potíží byl využit standardizovaný dotazník (Ocular Surface Disease Index, OSDI; modifikace hodnotící potíže pro každé oko zvlášť). V něm pacient na stupnici 0–4 (0 - nikdy, 1 - občas, 2 - polovinu času, 3 - většinu času, 4 - neustále) hodnotí pomocí 12 otázek subjektivní výskyt potíží v průběhu předešlého týdne. Dosazením do vzorce následně získáme výsledné skóre. Výsledky se pohybují v rozsahu 0–100, vyšší skóre představuje větší postižení (0–12 = normální; 13–22 = mírný SSO; 23–32 = středně pokročilý SSO; 33–100 = pokročilý SSO).
Obr. 1. Měření plochy slzného menisku (LTMA) 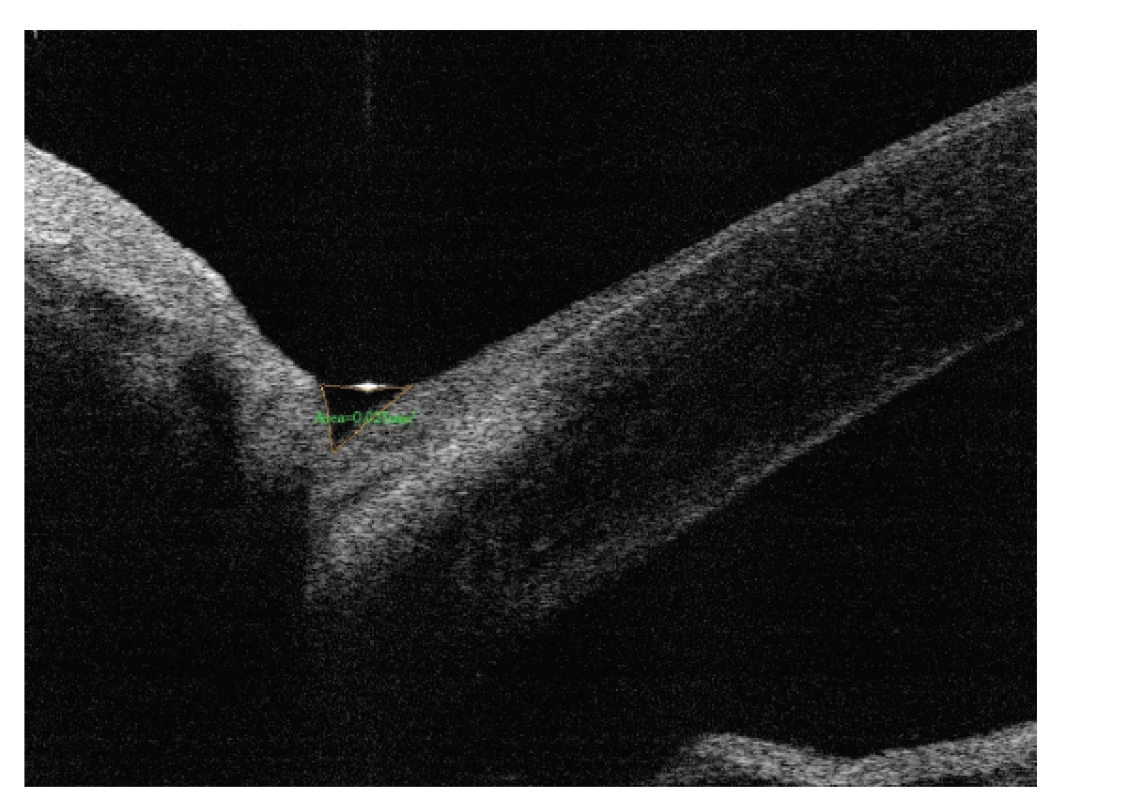
Byly porovnávány hodnoty na oku léčeném a na oku zdravém bez léčby. Výsledky jsou uváděny jako průměrné hodnoty ± SD. Výsledky byly statisticky analyzovány pomocí párového t-testu (software pro statistické zpracování dat StatView 5.0 (SAS Institute Inc, Cary, NC, USA) v případě parametrického rozložení dat a pomocí Wilcoxonova párového testu pro neparametrická data. Za hranici statistické významnosti byla považována hodnota p ≤ 0,05.
VÝSLEDKY
V rámci studie bylo vyšetřeno 13 pacientů. Průměrný věk pacientů byl 17,2 ± 8,1 let (rozmezí 6–32 let). Všichni pacienti aplikovali antiglaukomovou léčbu pouze do jednoho oka, druhé oko bylo zdravé, bez léčby.
Šest pacientů bylo dispenzarizováno s primárním jednostranným glaukomem, zbylí pacienti se sekundárním jednostranným glaukomem - tři pacienti po operaci vrozené jednostranné katarakty, jeden pacient po operaci katarakty s perzistující fetální vaskulaturou, u dvou pacientů byla základní diagnóza Sturgeův-Weberův syndrom, u jednoho pacienta ektropium uvey. Průměrná doba léčby oka s glaukomem byla 13,6 ± 7,9 let (rozmezí 3–29 let). Ve všech případech byli pacienti léčeni lokálními preparáty s obsahem konzervačních látek (BAK). Všichni pacienti podstoupili minimálně jednu operaci léčeného oka, dvanáct pacientů absolvovalo antiglaukomový zákrok, u čtyř pacientů jsme provedli operaci vrozené katarakty. Průměrná hodnota nitroočního tlaku byla na léčeném oku 15,9 ± 4,3 mm Hg (rozmezí 8–23 mm Hg), na zdravém oku 15,8 ± 3,1 mm Hg (13–21 mm Hg). Hodnoty nitroočního tlaku na léčeném a zdravém oku se statisticky významně nelišily (p = 0,9231). Žádný z pacientů nepoužíval přípravky typu umělých slz. Souhrnně je charakteristika souboru pacientů uvedena v tabulce 1.
Tab. 1. Charakteristika souboru pacientů 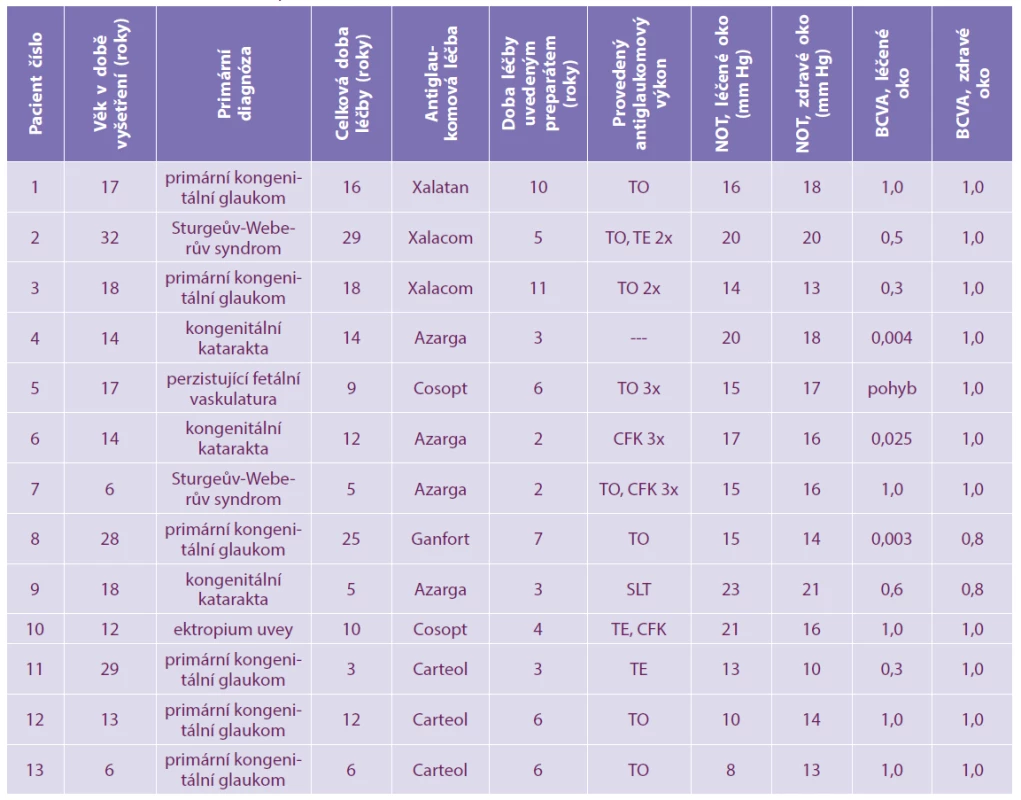
NOT - nitrooční tlak v době vyšetření
BCVA - nejlépe korigovaná zraková ostrost
TO - trabekulotomie
TE - trabekulektomie
CFK - cyklofotokoagulace
SLT - selektivní laserová trabekuloplastikaVýsledky vyšetření u jednotlivých pacientů jsou přehledně uvedeny v tabulce 2. Žádný z pacientů neudával subjektivní potíže zjišťované pomocí OSDI dotazníku na zdravém oku. Subjektivní potíže na léčeném oku byly u dvanácti pacientů minimální, skóre se pohybovalo v rozmezí 0–10,4 bodu (odpovídá rozmezí normálních hodnot). Pouze u jednoho pacienta byly hodnoty OSDI skóre téměř 40, což svědčí pro pokročilý SSO.
Tab. 2. Výsledky jednotlivých měření 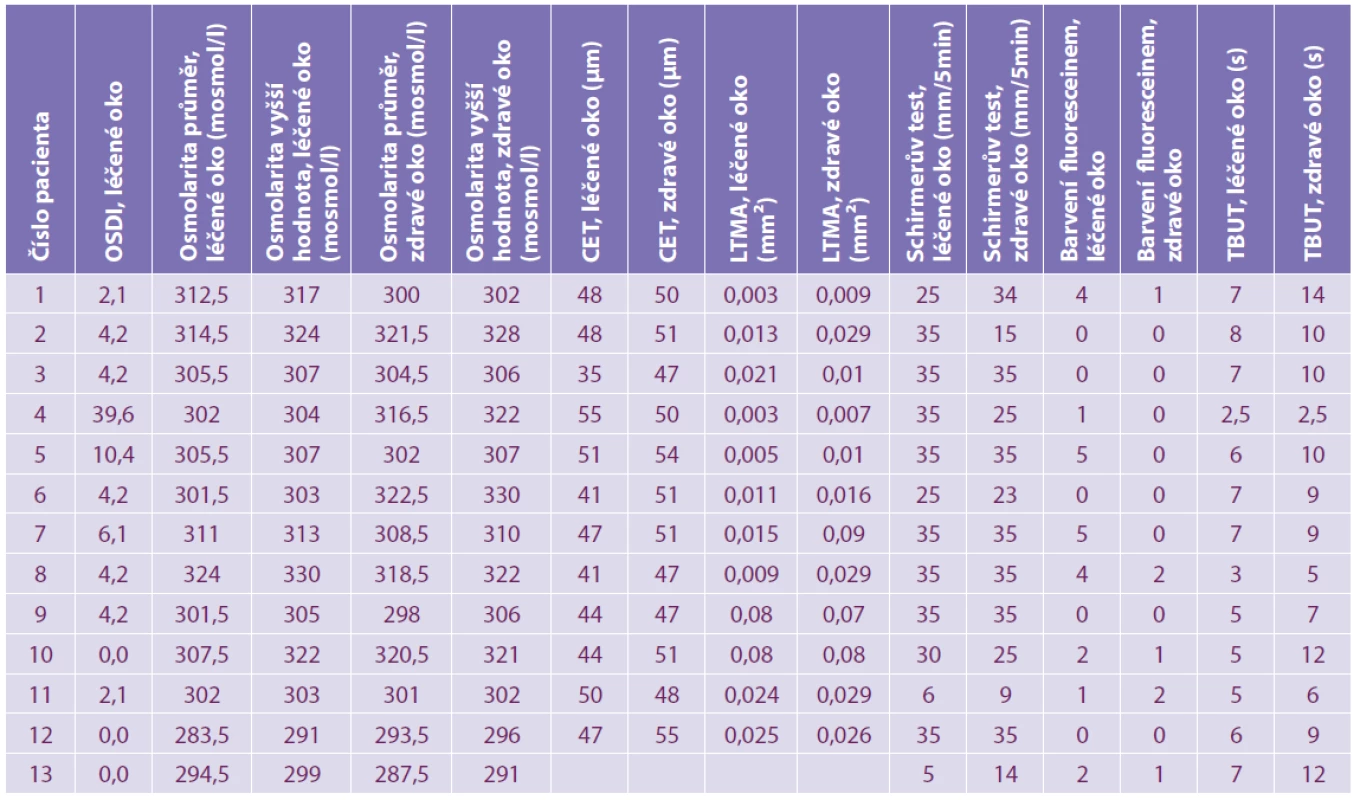
OSDI - standardizovaný dotazník k hodnocení subjektivních potíží
CET - tloušťka epitelu rohovky
LTMA - plocha dolního slzného menisku
TBUT - „tear break-up time“, doba po mrknutí do roztržení slzného filmuPrůměrná osmolarita slz na léčeném oku byla 305,0 ± 9,9 mosmol/l a na zdravém oku 307,3 ± 11,6 mosmol/l. Hodnoty se na léčeném a zdravém oku statisticky významně nelišily (p = 0,4317). Hodnota osmolarity slz na léčeném oku se u všech pacientů pohybovala v mezích normy. Na zdravém oku byla osmolarita ve čtyřech případech vyšší než 316 mosmol/l.
Průměrná CET rohovky na léčeném oku byla 45,9 ± 5,3 µm, na zdravém oku 50,2 ± 2,6 µm. CET rohovky na léčeném oku byla statisticky významně nižší než na zdravém oku (p = 0,0106). Průměrná LTMA na léčeném oku byla 0,024 ± 0,027 mm², na zdravém oku 0,034 ± 0,029 mm². Rozdíl nebyl statisticky významný (p = 0,1596).
Průměrná hodnota Schirmerova testu na oku léčeném byla 28,5 ± 10,9 mm/5 min a na oku zdravém 27,3 ± 9,5 mm/5 min. Hodnoty se statisticky významně nelišily (p = 0,5665). Hodnoty Schirmerova testu byly na léčeném oku u dvou pacientů snížené (pod 10 mm/5 min; č. 11 a 13), u jednoho z těchto pacientů byla hodnota snížená i na zdravém oku (č. 11), u druhého pacienta byla na zdravém oku hodnota hraniční (č. 13). U ostatních pacientů byly hodnoty na léčeném i neléčeném oku v mezích normy.
Ani v jednom případě jsme pomocí barvení fluoresceinem neprokázali klinicky závažné postižení povrchu oka. Povrch oka se však barvil fluoresceinem statisticky významně více u očí léčených (1,7 ± 2,1) než zdravých (0,5 ± 0,8; p = 0,02433). Hodnoty TBUT na očích léčených (6,0 ± 1,7 s) byly statisticky významně nižší než na očích zdravých (8,8 ± 3,2 s; p = 0,0015).
DISKUSE
V současnosti je již řadou studií dobře zdokumentováno, že chronická lokální antiglaukomová léčba zvyšuje u pacientů riziko rozvoje příznaků SSO, ať už v důsledku obsahu konzervačních látek nebo jako nežádoucí efekt vlastní účinné látky [6,10,12,13,19,20,21].
Diagnostika onemocnění SSO, zejména počínajících stádií onemocnění, je obtížná. Po zavedení testování osmolarity slz část autorů prokázala dobrou specificitu a senzitivitu tohoto vyšetření při diagnostice SSO a navrhovala měření osmolarity jako „zlatý standard“ pro diagnostiku onemocnění [22–25]. U pacientů léčených antiglaukomatiky byla prokázána korelace osmolarity slz a výsledků hodnocení subjektivních potíží pomocí OSDI, hodnot TBUT, počtu aplikovaných přípravků a četností aplikace léků za den [2,14,26,27].
V naší studii byly hodnoty osmolarity slz velice variabilní a hodnoty na léčených očích nevykazovaly významný rozdíl oproti hodnotám zdravých očí. Dokonce byly hodnoty považované za patologické (nad 316 mosmol/l) zaznamenány i na zdravém oku. Naše výsledky tak korespondují s dalšími studiemi, které poukazují na nesourodé výsledky měření osmolarity a nejednotný názor na prahovou hodnotu osmolarity slz [23, 28–31]. Halkiadis et al. neprokázali rozdíl v osmolaritě slz u pacientů léčených antiglaukomatiky bez subjektivních potíží v porovnání s hodnotami u zdravých kontrol [32]. V naší studii rovněž většina pacientů udávala jen minimální nebo žádné subjektivní potíže. Pouze u jednoho pacienta jsme zaznamenali závažnější subjektivní potíže. Tento pacient měl také výrazně snížený TBUT na obou očí. V naší studii jsme nesledovali frekvenci mrkání. Zvýšená frekvence mrkání mohla u tohoto pacienta kompenzovat zvýšenou nestabilitu slzného filmu, a proto jsem neprokázali patologické výsledky dalších vyšetření. Jen malé poškození povrchu oka potvrdily i výsledky barvení fluoresceinem.
Za jednu z příčin vedoucích ke vzniku onemocnění povrchu oka (SSO) je považován toxický efekt konzervačních látek obsažených v očních kapkách [6,10,13,33,34]. Obecně tyto látky narušují buněčnou stěnu bakterií a zároveň mohou zvyšovat průnik látek rohovkou. Nejčastěji používanou konzervační látkou je BAK. Jeho dobré baktericidní účinky dlouho zastiňovaly jeho toxické účinky na povrchové tkáně oka, spojivku i rohovku. Bylo popsáno, že BAK má proapoptotický a prozánětlivý efekt na spojivkové buňky, destabilizuje pohárkové buňky, způsobuje metaplázii epitelových buněk spojivky, poškozením buněk epitelu rohovky narušuje jeho bariérovou funkci a zvyšuje aktivaci keratocytů ve stromatu rohovky [35–38]. Rovněž v klinických studiích byly u pacientů léčených pro glaukom potvrzeny změny v morfologii epitelových buněk spojivky i rohovky a snížení tloušťky epitelu rohovky [14,39–41]. V souladu s těmito výsledky jsme u našich pacientů prokázali nižší tloušťku epitelu rohovky na léčeném oku. Předpokládá se, že u pacientů se syndromem suchého oka dochází v důsledku poruchy homeostázy a poruchy slzného filmu k nadměrné indukci apoptózy epitelových buněk a zároveň vlivem reflexně zvýšené frekvence mrkání i ke zvýšení mechanického tření, což vede k dalšímu ztenčení epitelu postižené rohovky. Abnormálně rychlý obrat tkáně a hyperplazie epitelu je běžnou reakcí na „stresové reakce“ [8,13,42]. Ve snaze o kompenzaci zvýšené apoptózy pak může docházet k zvýšené proliferaci epitelových buněk. Tuto teorii podporují i výsledky naší dřívější studie u pacientů s jednostranným hydroftalmem a studie Martone et al., které u léčených očí prokázaly pomocí rohovkového konfokálního mikroskopu vyšší denzitu bazálních epitelových buněk [43,45].
Vliv lokální antiglaukomové léčby na produkci slz měřenou pomocí Schirmerova testu nebo na základě měření plochy slzného menisku není jasný [19,45,46]. Velký rozptyl hodnot plochy slzného menisku u léčených očí zaznamenaný v naší studii může podporovat závěry studie autorů Shimazaki et al., kteří prokázali nezměněnou nebo dokonce lehce zvýšenou hodnotu Schirmerova testu u pacientů se SSO. Autoři předpokládají, že v počátečních stádiích SSO může docházet k reflexní hypersekreci slz [46].
Výsledky vyšetření TBUT na zdravém a léčeném oku v naší práci potvrzují nižší stabilitu slzného filmu na léčeném oku než na oku zdravém. Možný podíl konzervantů v antiglakomových přípravcích při rozvoji nestability slzného filmu byl opakovaně demonstrován [14,15,19,26,34].
V současné době se věnuje značná pozornost rovněž vlivu očních operací na homeostázu povrchu oka a rozvoj příznaků SSO. Přestože výsledky nejsou jednoznačné, byla popsána zvýšená incidence subjektivních i objektivních příznaků SSO po antiglaukomových operacích, po operaci katarakty i po pars plana vitrektomii [15–17,47–53]. Naše výsledky tak nemusí dokumentovat jen nežádoucí účinek lokálně podávaných léků, ale může jít i o důsledek předchozích operačních zákroků na postiženém oku. Limitem naší studie je i malý počet pacientů a rozdílné primární onemocnění, což je dáno faktem, že dětský jednostranný glaukom se vyskytuje velmi vzácně.
Přesto naše výsledky podporují aktuální doporučení, která zdůrazňují, že cílem moderní léčby glaukomu je, kromě dostatečného snížení NOT a zabránění progrese poškození zraku, také snaha o redukování nežádoucích účinků dlouhodobé léčby. Jde zejména o omezení obsahu konzervačních látek v kapkách [2,3,6,14,54,55]. Do roku 2009 bylo v České republice dostupné jediné antiglaukomatikum bez konzervačních látek [56,57]. Od té doby však došlo k výraznému rozšíření dostupnosti přípravků bez konzervačních látek. Při výběru léčby obzvlášť u dětských pacientů je třeba mít na paměti, že pacienti s diagnostikovaným glaukomem v raném věku budou lokální terapii užívat dlouhodobě a její nežádoucí účinky mohou být navíc potencovány změnami vyvolanými operačními zákroky. I relativně malé změny povrchu léčeného oka v našem souboru mladých pacientů tak upozorňují na riziko rozvoje postižení povrchu oka v průběhu dalšího života a akcentují potřebu výběru co nejšetrnějšího preparátu. Zároveň je nutné počítat s vyšším rizikem rozvoje příznaků SSO v případě indikace dalších chirurgických zákroků.
ZÁVĚR
V předložené práci jsme sledovali vliv antiglaukomové léčby na rozvoj příznaků SSO u pacientů s dětským jednostranným primárním či sekundárním glaukomem a výsledky vyšetření byly porovnávány s hodnotami na druhostranném, zdravém oku. Na oku léčeném jsme prokázali statisticky významně nižší CET, nižší hodnoty TBUT a povrch oka léčených očí se výrazněji barvil fluoresceinem. Statisticky nevýznamné a dosti variabilní byly změny osmolarity slzného filmu u léčených očí, hodnoty Schirmerova testu a velikost plochy slzného menisku. Výsledky potvrzují změny povrchu oka a slzného filmu u těchto pacientů, které mohou být vyvolané nežádoucími účinky chronicky podávané antiglaukomové terapie nebo mohou být následkem prodělaného chirurgického zákroku. Z hlediska minimalizace těchto nežádoucích účinků je vhodné věnovat v klinické praxi zvýšenou pozornost výběru léčivého přípravku, zejména s ohledem na obsah konzervačních látek.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN MOTOL.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou, že práce nebyla zadána jinému časopisu ani jinde otištěna, s výjimkou kongresových abstrakt.
Do redakce doručeno dne: 29. 7. 2020
Přijato k publikaci dne: 22. 12. 2020
MUDr. Martina Janderová
Korespondující autor:
MUDr. Gabriela Mahelková, Ph.D.
Oční klinika dětí a dospělých 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Zdroje
1. Papadopoulos M, Khaw PT. Childhood glaucoma. In: Taylor D, Hoyt CS. Pediatric Ophthalmolgy and Stabismus. 5th ed. New York: Elsevier Saunders; 2014 : 458–71.
2. Fechtner RD, Godfrey DG, Budenz D, Stewart JA, Stewart WC, Jasek MC. Prevalence of ocular surface complaints in patients with glaucoma using topical intraocular pressure-lowering medications. Cornea. 2010;29 : 618–621.
3. Jaenen N, Baudouin C, Pouliquen P, Manni G, Figueiredo A, Zeyen T. Ocular symptoms and signs with preserved and preservative-free glaucoma medications. Eur J Ophthalmol. 2007;17 : 341–349.
4. Leung EW, Medeiros FA, Weinreb RN. Prevalence of ocular surface disease in glaucoma patients. J Glaucoma. 2008;17 : 350–355.
5. Mastropasqua R, Agnifili L, Mastropasqua L. Structural and Molecular Tear Film Changes in Glaucoma. Curr Med Chem. 2019;26 : 4225–4240.
6. Zhang X, Vadoothker S, Munir WM, Saeedi O. Ocular Surface Disease and Glaucoma Medications: A Clinical Approach. Eye Contact Lens. 2019;45 : 11–18.
7. Craig JP, Nichols KK, Akpek EK et al. TFOS DEWS II Definition and Classification Report. Ocul Surf. 2017;15 : 276–283.
8. Bron AJ, de Paiva CS, Chauhan SK et al. TFOS DEWS II pathophysiology report. Ocul Surf. 2017;15 : 438–510.
9. Valente C, Iester M, Corsi E, Rolando M. Symptoms and signs of tear film dysfunction in glaucomatous patients. J Ocul Pharmacol Ther. 2011;27 : 281–285.
10. Anwar Z, Wellik SR, Galor A. Glaucoma therapy and ocular surface disease: current literature and recommendations. Curr Opin Ophthalmol. 2013;24 : 136–143.
11. Stewart WC, Stewart JA, Nelson LA. Ocular surface disease in patients with ocular hypertension and glaucoma. Curr Eye Res. 2011;36 : 391–398.
12. Výborný P, Sičáková S, Veselá Flórová Z. Konzervační činidla – denní dávka benzalkonium chloridu v léčbě glaukomu z pohledu pacienta [Preservative substances - the daily dose of benzalkonium chloride in glaucoma treatment from the patients point of view]. Cesk Slov Oftalmol. 2014;70 : 95–97.
13. Baudouin C, Labbe A, Liang H, Pauly A, Brignole-Baudouin F. Preservatives in eyedrops: the good, the bad and the ugly. Prog Retin Eye Res. 2010;29 : 312–334.
14. Pflugfelder SC, Baudouin C. Challenges in the clinical measurement of ocular surface disease in glaucoma patients. Clin Ophthalmol. 2011;5 : 1575–1583.
15. Lee SY, Wong TT, Chua J, Boo C, Soh YF, Tong L. Effect of chronic anti-glaucoma medications and trabeculectomy on tear osmolarity. Eye (Lond). 2013;27 : 1142–1150.
16. Kato K, Miyake K, Hirano K, Kondo M. Management of Postoperative Inflammation and Dry Eye After Cataract Surgery. Cornea. 2019;38 Suppl 1:S25–S33.
17. Elksnis E, Lace I, Laganovska G, Erts R. Tear osmolarity after cataract surgery. J Curr Ophthalmol. 2018;31 : 31–35.
18. Methodologies to diagnose and monitor dry eye disease: report of the Diagnostic Methodology Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf. 2007;5 : 108–152.
19. Wong ABC, Wang MTM, Liu K, Prime ZJ, Danesh-Meyer HV, Craig JP. Exploring topical anti-glaucoma medication effects on the ocular surface in the context of the current understanding of dry eye. Ocul Surf. 2018;16 : 289–293.
20. Fogagnolo P, Torregrossa G, Tranchina L et al. Tear Film Osmolarity, Ocular Surface Disease and Glaucoma: A Review. Curr Med Chem. 2019;26 : 4241–4252.
21. Mlčáková E, Mlčák P, Karhanová M, Langová K. Marešová K. Hodnocení očního povrchu u pacientů léčených analogy prostaglandinů s ohledem na obsaženou konzervační látku [Ocular Surface Evaluation in Patients Treated with Prostaglandin Analogues Considering Preservative Agent]. Cesk Slov Oftalmol. 2016;72 : 120–127.
22. Sullivan BD, Whitmer D, Nichols KK et al. An objective approach to dry eye disease severity. Invest Ophthalmol Vis Sci. 2010;51 : 6125-6130.23. Tomlinson A, Khanal S, Ramaesh K, Diaper C, McFadyen A. Tear film osmolarity: determination of a referent for dry eye diagnosis. Invest Ophthalmol Vis Sci. 2006;47 : 4309–4315.
24. Versura P, Profazio V, Campos EC. Performance of tear osmolarity compared to previous diagnostic tests for dry eye diseases. Curr Eye Res. 2010;35 : 553–564.
25. Potvin R, Makari S, Rapuano CJ. Tear film osmolarity and dry eye disease: a review of the literature. Clin Ophthalmol. 2015;9 : 2039–2047.
26. Labbe A, Terry O, Brasnu E, Van Went C, Baudouin C. Tear film osmolarity in patients treated for glaucoma or ocular hypertension. Cornea. 2012;31 : 994–999.
27. Erb C, Gast U, Schremmer D. German register for glaucoma patients with dry eye. I. Basic outcome with respect to dry eye. Graefes Arch Clin Exp Ophthalmol. 2008;246 : 1593–1601.
28. Amparo F, Jin Y, Hamrah P, Schaumberg DA, Dana R. What is the value of incorporating tear osmolarity measurement in assessing patient response to therapy in dry eye disease? Am J Ophthalmol. 2014;157 : 69–77 e62.
29. Khanal S, Millar TJ. Barriers to clinical uptake of tear osmolarity measurements. Br J Ophthalmol. 2012;96 : 341–344.
30. Mahelková G, Veselá V, Seidler Štangová P, et al. Osmolarita slz u pacientů s těžkým syndromem suchého oka před a po aplikaci autologního séra. Porovnání s hodnotami zdravých dobrovolníků [Tear Osmolarity in Patients with Severe Dry Eye Syndrome Before and After Autologous Serum Treatment: a Comparison with Tear Osmolarity in Healthy Volunteers]. Cesk Slov Oftalmol. 2015;71 : 184–188.
31. Szalai E, Berta A, Szekanecz Z, Szucs G, Modis L, Jr. Evaluation of tear osmolarity in non-Sjogren and Sjogren syndrome dry eye patients with the TearLab system. Cornea. 2012;31 : 867–871.
32. Halkiadakis I, Kontadakis GA, Tsiakou D, Patsea E, Mitropoulos P, Kandarakis AS. Effect of Glaucoma Medication in Tear Film Osmolarity of Patients Without Symptoms of Ocular Discomfort. J Ocul Pharmacol Ther. 2015;31 : 330–334.
33. Gomes JAP, Azar DT, Baudouin C et al. TFOS DEWS II iatrogenic report. Ocul Surf. 2017;15 : 511–538.
34. Cvenkel B, Stunf S, Srebotnik Kirbis I, Strojan Flezar M. Symptoms and signs of ocular surface disease related to topical medication in patients with glaucoma. Clin Ophthalmol. 2015;9 : 625–631.
35. Chen W, Li Z, Hu J et al. Corneal alternations induced by topical application of benzalkonium chloride in rabbit. PLoS One. 2011;6:e26103.
36. Clouzeau C, Godefroy D, Riancho L, Rostene W, Baudouin C, Brignole-Baudouin F. Hyperosmolarity potentiates toxic effects of benzalkonium chloride on conjunctival epithelial cells in vitro. Mol Vis. 2012;18 : 851–863.
37. Pisella PJ, Debbasch C, Hamard P et al. Conjunctival proinflammatory and proapoptotic effects of latanoprost and preserved and unpreserved timolol: an ex vivo and in vitro study. Invest Ophthalmol Vis Sci. 2004;45 : 1360–1368.
38. Xiong C, Chen D, Liu J et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Invest Ophthalmol Vis Sci. 2008;49 : 1850–1856.
39. Cennamo G, Montorio D, Del Prete S, Del Prete A, Cennamo G. Anterior-Segment Optical Coherence Tomography and Scanning Electron Microscopy to Evaluate Corneal Epithelial Changes in Patients Undergoing Glaucoma Therapy. Cornea. 2018;37 : 1522–1526.
40. Montorio D, Cennamo G, Breve MA et al. Evaluation of corneal epithelial thickness in glaucomatous patients using anterior-segment optical coherence tomography. J Biophotonics. 2020;13:e201900095.
41. Cui X, Hong J, Wang F et al. Assessment of corneal epithelial thickness in dry eye patients. Optom Vis Sci. 2014;91 : 1446-1454.
42. Fabiani C, Barabino S, Rashid S, Dana MR. Corneal epithelial proliferation and thickness in a mouse model of dry eye. Exp Eye Res. 2009;89 : 166–171.
43. Mahelkova G, Filous A, Odehnal M, Cendelin J. Corneal changes assessed using confocal microscopy in patients with unilateral buphthalmos. Invest Ophthalmol Vis Sci. 2013;54 : 4048–4053.
44. Martone G, Frezzotti P, Tosi GM et al. An in vivo confocal microscopy analysis of effects of topical antiglaucoma therapy with preservative on corneal innervation and morphology. Am J Ophthalmol. 2009;147 : 725–735 e721.
45. Agnifili L, Brescia L, Scatena B et al. Tear Meniscus Imaging by Anterior Segment-Optical Coherence Tomography in Medically Controlled Glaucoma. J Glaucoma. 2020;29 : 374–380.
46. Shimazaki J, Hanada K, Yagi Y et al. Changes in ocular surface caused by antiglaucomatous eyedrops: prospective, randomised study for the comparison of 0.5% timolol v 0. 12% unoprostone. Br J Ophthalmol. 2000;84 : 1250–1254.
47. Tong L, Hou AH, Wong TT. Altered expression level of inflammation-related genes and long-term changes in ocular surface after trabeculectomy, a prospective cohort study. Ocul Surf. 2018;16 : 441–447.
48. Gonzalez-Mesa A, Moreno-Arrones JP, Ferrari D, Teus MA. Role of Tear Osmolarity in Dry Eye Symptoms After Cataract Surgery. Am J Ophthalmol. 2016;170 : 128–132.
49. Ishrat S, Nema N, Chandravanshi SCL. Incidence and pattern of dry eye after cataract surgery. Saudi J Ophthalmol. 2019;33 : 34–40.
50. Hanyuda A, Ayaki M, Tsubota K, Negishi K. Discrepancies in Persistent Dry Eye Signs and Symptoms in Bilateral Pseudophakic Patients. J Clin Med. 2019;8.
51. Lam J, Wong TT, Tong L. Ocular surface disease in posttrabeculectomy/mitomycin C patients. Clin Ophthalmol. 2015;9 : 187–191.
52. Sato T, Koh S, Yasukura YI et al. Surgical Factors Affecting Changes in Ocular Surface Dynamics in the Early Postoperative Period After 25-Gauge Vitrectomy. Eye Contact Lens. 2019;45 : 254–259.
53. Lee JH, Na KS, Kim TK, Oh HY, Lee MY. Effects on ocular discomfort and tear film dynamics of suturing 23-gauge pars plana vitrectomies. Arq Bras Oftalmol. 2019;82 : 214–219.
54. Broadway DC, Grierson I, O‘Brien C, Hitchings RA. Adverse effects of topical antiglaucoma medication. I. The conjunctival cell profile. Arch Ophthalmol. 1994;112 : 1437–1445.
55. Karhanová M, Mlčák P, Fryšák Z, Marešová K. Účinnost a snášenlivost tafluprostu 0,0015% bez konzervačních látek v léčbě glaukomu a oční hypertenze [Ocular Surface Evaluation in Patients Treated with Prostaglandin Analogues Considering Preservative Agent]. Cesk Slov Oftalmol. 2012;68 : 150–155.
56. Mlčák P, Karhanová M, Marešová K. Konzervativní léčba glaukomu. Prakt lékáren. 2009;5 : 22–25.
57. Liehneová I. Farmakoterapie glaukomu [Glaucoma medical therapy]. Cesk Slov Oftalmol. 2010;66 : 155–158.
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2021 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
-
Všechny články tohoto čísla
-
NAŠE ZKUŠENOSTI S POUŽITÍM FAKOEMULZIFIKAČNÍ KONCOVKY
ACTIVE SENTRY A CENTURION OZIL - VYŠETŘENÍ ZORNÉHO POLE U HYPERTENZNÍCH GLAUKOMŮ
- VLIV LÉČBY NA POVRCH OKA U PACIENTŮ S JEDNOSTRANNÝM DĚTSKÝM GLAUKOMEM
-
TERAPIE UVEÁLNÍHO MELANOMU
PŘEHLED - STAVY NAPODOBUJÍCÍ PACHYCHOROIDNÍ CHOROBY SÍTNICE – SOUBOR KAZUISTIK
- BLOW-IN FRAKTURA STROPU OČNICE KAZUISTIKA
-
NAŠE ZKUŠENOSTI S POUŽITÍM FAKOEMULZIFIKAČNÍ KONCOVKY
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
TERAPIE UVEÁLNÍHO MELANOMU
PŘEHLED - BLOW-IN FRAKTURA STROPU OČNICE KAZUISTIKA
- STAVY NAPODOBUJÍCÍ PACHYCHOROIDNÍ CHOROBY SÍTNICE – SOUBOR KAZUISTIK
- VYŠETŘENÍ ZORNÉHO POLE U HYPERTENZNÍCH GLAUKOMŮ
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




