-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pilotní studie efektu ambulantní funkční peroneální stimulace
The pilot study of effect of outpatient functional electrical stimulation of peroneal nerve
Aim:
The aim of this pilot study was to verify therapeutical effect of periodical functional electrical stimulation of peroneal nerve during 4 weeks of intensive outpatient therapy on speed and performance of gait in post-stroke patients, suffering from spastic leg paresis.Methods:
14 subjects were enrolled into this pilot study (10 male, 4 female), aged 54,4 ± 9,4. The subjects were selected from patients suffering from chronic phase of stroke, spactic leg paresis and drop foot syndrome. Functional electrical stimulation was performed in total for 4 weeks (5 days weekly) as intensive ambulatory gait training with WalkAide neurostimulator. Emory Functional Ambulation Profile and Two Minute Walk Test were performed for evaluation of changes in speed of gait on different terrains and changes in the walking performance, respectively.Results:
In this pilot study, average improvement of Emory Functional Ambulation Profile score of 11% was observed as well as average improvement of Two Minute Walk Test of 9%.Conclusion:
Positive therapeutic effect of periodical ambulatory functional electrical stimulation of peroneal nerve on gait speed and gait performance in post-stroke patients was observed in this limited pilot study. Further research, including randomized controlled study featuring larger data sample, is needed to show significant evidence of the observed effect.Key words:
functional electrical stimulation – stroke – spastic paresis – neurorehabilitation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
门诊功能性电刺激腓总神经效果的初步研究
目标:
这项研究的初步目的是评估在强化门诊治疗4周期间,对患有痉挛性腿部轻瘫的中风后患者速度和步态的表现进行周期性功能性电刺激的效果。
方法:
14名受试者参加了这项试点研究(10名男性,4名女性),年龄为54.4±9.4岁。 这些受试者选自慢性中风期,痉挛性腿部轻瘫和跌脚综合症的患者。 使用WalkAide神经刺激器进行功能性电刺激总共4周(每周5天)作为强化步态训练。 Emory功能性步行剖面和两分钟步行测试分别用于评估不同地形上的步态速度变化和步行性能变化。
结果:
在这项初步研究中,观察到Emory功能性行走模式评分平均改善11%,以及两分钟步行测试平均改善9%。
结论:
在这项有限的试点研究中观察到周期性步态功能性电刺激腓神经对步行速度和卒中后患者步态表现的积极治疗作用。 需要进一步包括以更大数据样本为特征的随机对照的研究,以展示观察到的效应的重要证据。
关键词:
功能性电刺激 - 中风 - 痉挛性麻痹 - 神经修复
Autoři: J. Jeníček 1,2; Z. Drábová 1; M. Janatová 1,3; M. Vítězník 3; O. Švestková 1
Působiště autorů: Klinika rehabilitačního lékařství 1. LF UK a VFN v Praze 1; Fakulta tělesné výchovy a sportu, UK v Praze 2; Společné pracoviště biomedicínského inženýrství FBMI ČVUT a 1. LF UK, Praha 3
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(1): 81-85
Kategorie: Krátké sdělení
doi: https://doi.org/10.14735/amcsnn201881Souhrn
Cíl:
Cílem pilotní studie bylo ověřit terapeutický efekt pravidelné funkční elektrostimulace peroneálního nervu realizované jako každodenní intenzivní ambulantní terapeutická jednotka po dobu 4 týdnů, a to na rychlost a výkonnost chůze pacientů po cévní mozkové příhodě se spastickou parézou dolní končetiny.Soubor a metodika:
Pilotní studie se zúčastnilo 14 probandů (10 mužů a 4 ženy) ve věku 54,4 ± 9,4 let z cílové populace pacientů v chronické fázi cévní mozkové příhody se spastickou parézou dolní končetiny a drop foot syndromem. Funkční elektrostimulace probíhala ambulantně po dobu 4 týdnů (5× týdně) v rámci intenzivního tréninku chůze s využitím funkčního neurostimulátoru WalkAide. Porovnávány byly změny v rychlosti chůze na různých terénech pomocí testu Emory Functional Ambulation Profile a změny ve výkonnosti chůze pomocí testu Two minute walk test.Výsledky:
Z výsledků vyplynulo, že v pilotním pokusu došlo u probandů k průměrnému zlepšení skóre testu Emory Functional Ambulation Profile o 11 % a skóre testu Two Minute Walk Test o 9 %.Závěr:
U skupiny probandů byl pozorován pozitivní terapeutický efekt pravidelné funkční elektrostimulace peroneálního nervu v ambulantním prostředí na rychlost a výkonnost chůze. Pro prokázání efektu tohoto typu intervence je nutné zpracovat randomizovanou kontrolovanou studii na větším počtu probandů.Klíčová slova:
funkční elektrostimulace – cévní mozková příhoda – spastická paréza – neurorehabilitaceÚvod
Cévní mozková příhoda (CMP) představuje nejčastější příčinu těžkého a dlouhotrvajícího zdravotního postižení dospělých osob. Dle údajů Ústavu zdravotnických informací a statistiky je v ČR ročně s touto diagnózou hospitalizováno více než 25 000 pacientů, přičemž přibližně čtvrtina je v produktivním věku [1]. Jedním z nejnápadnějších klinických následků CMP bývá porucha hybnosti ve smyslu kontralaterální spastické hemiparézy, která je v různé závažnosti přítomna u přibližně 80 % pacientů [2]. Typickou změnou, kterou se porucha projevuje na dolní končetině při chůzi, je tzv. drop foot syndrom – tedy neschopnost dosáhnout adekvátní dorzální flexe nohy ve švihové fázi kroku. V rámci terapie chůze a kompenzace drop foot syndromu jsou pacienti v chronické fázi CMP standardně vybavováni různými typy peroneálních ortéz, které během švihové fáze kroku pasivně udržují hlezenní kloub v neutrální pozici a ve stojné fázi ho pomáhají stabilizovat, nijak však nepodporují zbytkovou nebo navracející se dynamickou funkci [3,4]. Alternativou k peroneálnímu ortézování je metoda funkční elektrostimulace (FES) peroneálního nervu (obr. 1). FES využívá aplikaci elektrických impulzů do oblasti peroneálního nervu za účelem jeho podráždění a vyvolání kontrakce m. tibialis anterior a dalších svalů anterolaterální skupiny bérce. Při chůzi pak dochází správně načasovaným signálem z patního tlakového spínače nebo ze senzorů náklonu a zrychlení bérce umístěných přímo ve stimulátoru k provedení adekvátní dorzální flexe a everze nohy ve švihové fázi krokového cyklu [3,5].
Obr. 1. Funkční peroneální neurostimulátoru přístrojového systému WalkAide. Fig. 1. Functional electrical stimulation of peroneal nerve with WalkAide neurostimulator. 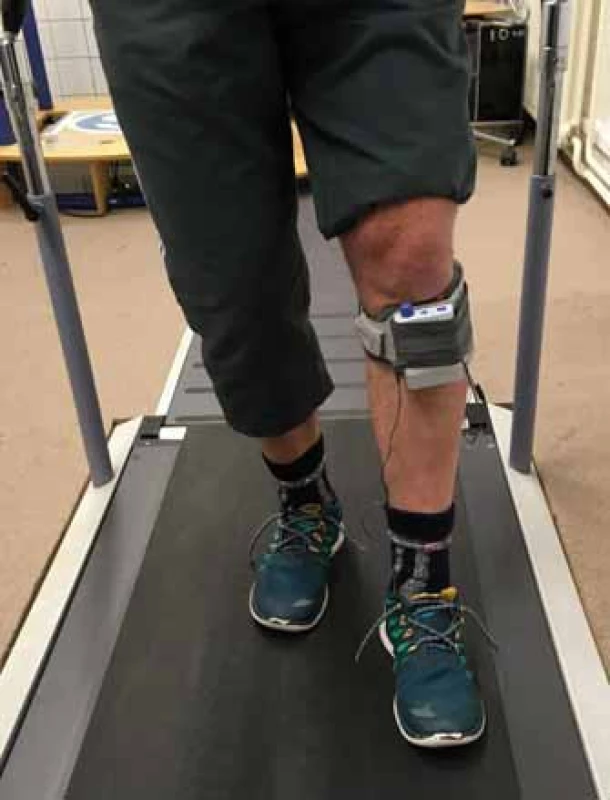
V řadě studií byl při chůzi se stimulátorem prokázán bezprostřední „ortotický“ efekt v úpravě drop foot syndromu a na zlepšení rychlosti, symetrie a stability chůze [6,7]. Při pravidelné aplikaci se navíc díky plasticitě centrálního nervového systému uvažuje i o efektu „terapeutickém“, tedy o alespoň částečném obnovení aktivní hybnosti hlezenního kloubu a zlepšení chůze v dlouhodobém horizontu i po přerušení používání stimulátoru [2,3,6 – 8]. Design většiny těchto studií nicméně vychází z toho, že je pacient vybaven vlastním stimulátorem a FES je aplikována při běžné chůzi v průběhu celého dne. V podmínkách našeho zdravotnictví je z důvodu vysoké pořizovací ceny přístrojových systémů pro FES a absence úhrady zdravotními pojišťovnami terapie vázána převážně na kratší terapeutické jednotky na specializovaných pracovištích, kdy jeden přístroj využívá více pacientů. Cílem pilotní studie v tomto sdělení bylo ověřit terapeutický efekt 4týdenní FES peroneálního nervu na rychlost a výkonnost chůze pacientů po CMP se spastickou parézou dolní končetiny a drop foot syndromem, pokud je FES realizována jako intenzivní ambulantní terapeutická jednotka. Časový objem stimulace v každé terapeutické jednotce je nižší než u celodenního používání v rámci běžné chůze, nicméně terapeutický efekt může spočívat v intenzitě intervence, kterou recentní literatura označuje jako klíčovou podmínku pro stimulaci plasticity nervového systému a obnovu řízené hybnosti [8,9].
Soubor a metodika
Do pilotní studie efektu ambulantní FES peroneálního nervu bylo v období 04/ 2015 – 12/ 2016 zařazeno 14 probandů z cílové populace pacientů v chronické fázi CMP hemoragické či ischemické etiologie se spastickou parézou dolní končetiny a drop foot syndromem, přičemž dostupnou populaci tvořili pacienti Kliniky rehabilitačního lékařství 1. LF UK a VFN v Praze indikovaní lékařem kliniky k FES. Soubor tvořilo 10 mužů a 4 ženy ve věku 54,4 ± 9,4 let. Kritériem pro zařazení pacientů byla doba od vzniku onemocnění 0,5 – 4 roky, schopnost samostatné chůze (příp. s kompenzační pomůckou) alespoň na 10 metrů, dobrá odpověď na testovací elektrostimulaci peroneálního nervu a pasivní rozsah dorzální flexe v hlezenním kloubu alespoň do neutrálního postavení.
Pacienti po dobu 4 týdnů (5× týdně) absolvovali série každodenních intenzivních 30min terapeutických jednotek tréninku chůze s funkčním elektrostimulátorem a byli instruováni, aby rychlost chůze byla maximální možná při zachování podmínky bezpečnosti a stability. Během 4týdenní intervence pacienti nepodstupovali žádné jiné formy terapie, ani nebyli jinak peroneálně ortézováni.
Ve studii byl využit systém pro FES WalkAide firmy Innovative Neurotronics (Reno), který umožňuje pomocí povrchových gelových elektrod umístěných ve společné manžetě se stimulátorem v proximální části bérce jednokanálovou stimulaci peroneálního nervu impulzy nízkofrekvenčního proudu typu TENS (transcutaneous electrical nerve stimulation). Optimální načasování stimulace do švihové fáze kroku je programováno individuálně pro každého pacienta s využitím signálů ze senzorů, které jsou zabudovány přímo do stimulátoru a jež detekují měnící se zrychlení a náklon bérce v průběhu jednotlivých fází krokového cyklu.
Před začátkem a po ukončení 4týdenní intervence byl proveden test Emory Functional Ambulation Profile (EFAP). Tento test byl navržen přímo pro pacienty po CMP a hodnotí rychlost chůze pomocí času nutného k ujití přesně definovaných úseků na pěti různých terénech a v situacích, se kterými se pacient běžně setkává v denním životě – tvrdé rovné podlaze, koberci, při zvednutí ze židle, ujití určitého úseku a opětovném posazení (timed up-and-go test), při chůzi s překračováním a obcházením překážek a při chůzi do schodů a ze schodů. Společně s popisovanou vysokou senzitivitou a absencí stropového efektu může být komplexnost tohoto testu výhodou oproti dalším klinicky běžně používaným testům chůze (např. 10 Meter Walk Test), které hodnotí chůzi jen na rovném úseku tvrdé podlahy [10]. Při případném použití kompenzační pomůcky se čas k zvládnutí subtestu násobí „asistenčním faktorem“ dle typu pomůcky. Časy provedení všech pěti subtestů se následně sčítají do celkového skóre testu [10]. Dále byl pro ověření efektu intervence použit test Two Minute Walk Test (2MWT), který hodnotí vytrvalost chůze na základě celkově ujité vzdálenosti na rovném úseku za 2 min. Pacient je instruován, aby ušel maximální možnou vzdálenost tak, aby měl po skončení testu pocit, že při zachování podmínky bezpečnosti a stability nemohl za 2 min ujít více. Případné použití kompenzačních pomůcek se ve výsledném skóre nezohledňuje, ale musí být stejné i ve výstupním vyšetření. Vstupní a výstupní vyšetření v obou testech bylo u každého pacienta prováděno ve stejnou denní dobu, stejným vyšetřujícím a s využitím stejných pomůcek. Všichni pacienti podepsali informovaný souhlas a byli plně instruováni, aby nedošlo k nežádoucím událostem. Studie byla provedena v souladu se standardy Etické komise FTVS UK a Helsinskou deklarací z roku 1975, revidovanou v roce 2000.
Výsledky
Efekt 4týdenní intervence intenzivní ambulantní FES na rychlost chůze byl vyhodnocen jako procentuální změna skóre testu EFAP (výsledný čas po sečtení všech časů nutných k provedení pěti subtestů, násobených „asistenčním faktorem“ v případě použití kompenzační pomůcky). V pilotním pokusu došlo u 14 probandů ve výsledku k průměrnému zlepšení skóre EFAP o 11 % (SD = 7 %) s mediánem zlepšení 10,95 % (IQR = 8,45 %) – výsledky a grafická vizualizace dat jsou uvedeny v krabicovém grafu (obr. 1). Mediány procentuální změny skóre v jednotlivých subtestech EFAP jsou uvedeny v krabicových grafech (obr. 2), přičemž největší zlepšení bylo pozorováno v subtestu chůze s překračováním a obcházením překážek (průměrné zlepšení 12,4 %; medián zlepšení 14,98 %), a naopak nejmenší zlepšení u subtestu zvednutí ze židle, ujití 3metrového úseku a opětovném posazení (průměrné zlepšení 6,4 %; medián zlepšení 5,2 %). V subtestu chůze po tvrdé podlaze bylo průměrné zlepšení 9,7 % a medián zlepšení 7,14 %; v subtestu chůze po koberci průměrné zlepšení 8,9 % a medián zlepšení 8,81 % a v subtestu chůze do schodů průměrné zlepšení 8 % a medián zlepšení 10,7 %.
Obr. 1 Procentuální změna celkového skóre v testu Emory Functional Ambulation Profile (EFAP). Fig. 1. Percentual change in Emory Functional Ambulation Profile test. 
Efekt intervence na výkonnost chůze pomocí testu 2MWT byl hodnocen jako procentuální změna skóre tohoto testu (celková ujitá vzdálenost za 2 min). Průměrné zlepšení u popisované skupiny pacientů dosáhlo 9 % (SD = 7 %) s mediánem zlepšení 9,55 % (IQR = 8,65 %) – výsledky a grafická vizualizace dat jsou uvedeny v krabicovém grafu (obr. 3). U žádného z probandů nebyl zaznamenán úraz nebo komplikace jiného charakteru (např. popálení elektrickým proudem).
Obr. 2. Procentuální změny skóre v jednotlivých subtestech Emory Functional Ambulation Profi le (EFAP): (1) chůze po podlaze, (2) chůze po koberci, (3) zvednutí ze židle, ujití třímetrového úseku a opětovné posazení, (4) chůze s překračováním a obcházením překážek, (5) chůze do a ze schodů. Fig. 2. Percentual changee in Emory Functional Ambulation Profi le subtasks: (1) hard fl oor, (2) carpeted surface, (3) timed up-and-go test, (4) traversing obstacle course, (5) ascending and descending stairs. 
Obr. 3. Procentuální změna skóre v testu Two Minute Walk Test (2MWT). Fig. 3. Percentual change in Two Minute Walk Test (2MWT). 
Diskuze
Přibližně 70 – 80 % přeživších pacientů po CMP je sice schopno navrátit se k samostatné chůzi, ta je ale většinou různě závažně limitována přetrvávající spastickou parézou dolní končetiny a nutností používání kompenzačních pomůcek [3,7,11]. Typickou poruchou, kterou v hemiparetické chůzi nacházíme až u 20 % pacientů, je chybějící nebo nedostatečná dorzální flexe a everze nohy během švihové fáze kroku – tzv. drop foot syndrom způsobený zčásti parézou anterolaterální svalové skupiny bérce a zčásti patologickou hyperaktivitou svalů lýtka [2,11]. Syndrom drop foot je v řadě případů kombinován s neschopností dosáhnout při došlapu z důvodu patologicky ekvinovarózního postavení nohy iniciálního kontaktu paty s podložkou, nestabilitou hlezenního i kolenního kloubu ve fázi opory a odrazem bez adekvátní propulze. Chůze pacientů po CMP je tak ve výsledku nápadná svým zpomalením, nevýkonností a asymetrií, má prodlouženou dobu dvojí opory, nižší kadenci a délku kroků a je nestabilní. Pacienti vykazují zhoršenou adaptaci na nerovnosti terénu nebo překážky, na které reagují zkrácením kroku, často zakopnutím nebo neadekvátním nekoordinovaným pohybem vedoucím k pádu [2,3,12].
K úpravě patologického stereotypu chůze a snížení rizika zakopávání a pádů jsou pacienti standardně vybavováni různými typy prefabrikovaných peroneálních ortéz, které pasivně udržují hlezenní kloub během švihové fáze kroku v neutrální pozici a ve stojné fázi ho pomáhají stabilizovat. Literatura uvádí, že chůze s ortézou snižuje riziko pádu, je rychlejší, stabilnější a méně energeticky náročná než chůze bez ortézy [3,4]. Jsou nicméně popisovány i nevýhody tohoto řešení – pasivní ortéza většinou limituje rozsah hybnosti hlezenního kloubu, což může přispívat k rozvoji svalové hypotrofie a zkrácení a především nepodporuje zbytkovou nebo navracející se dynamickou funkci. Ortéza je pacienty navíc často vnímána jako dyskomfortní, může způsobovat otlaky nebo zvyšovat patologickou svalovou hyperaktivitu [2,3,7,12].
Alternativním terapeutickým přístupem k peroneálnímu ortézování je znovu se rozšiřující metoda FES peroneálního nervu, při které je kontrakce svalů anterolaterální skupiny bérce k navození adekvátní dorzální flexe a everze nohy během švihové fáze kroku stimulována elektrickými impulzy. Metoda byla pro hemiparetické pacienty poprvé navržena Libersonem už v roce 1961, k většímu rozšíření dochází díky technologickým možnostem až v posledních 10 letech [11]. Klíčovým prvkem je správné načasování signálu – současné přístrojové systémy jsou k tomuto účelu vybaveny tlakovým patním spínačem nebo senzory detekujícími náklon a zrychlení bérce (případně kombinují oba způsoby). Ty spouští stimulaci v optimální fázi krokového cyklu, tedy v zahájení a průběhu švihu (initial swing a mid-swing), s postupným ukončováním stimulace v období dokončení švihu (terminal swing), kdy se noha již připravuje na kontakt paty s podložkou.
V literatuře je jako výhoda tohoto řešení oproti peroneálnímu ortézování uváděna podpora zbytkové nebo navracející se dynamické funkce hlezna, podpora trofiky a zvýšení proprioceptivní informace do centrálního nervového systému [7,11,12]. Účelné používání paretické dolní končetiny během chůze s pomocí FES a fakt, že chůze začne u řady pacientů alespoň částečně vykazovat poprvé od CMP své původní rysy, mohou mít i nezanedbatelný psychologický efekt v motivaci pacientů k další terapii [13].
U pacientů v chronické fázi CMP je ve studiích prokázán okamžitý pozitivní efekt FES na rychlost, energetickou náročnost, symetrii a stabilitu chůze. Pacient má také vyšší schopnost vyhnout se terénním překážkám [6,7,12]. V literatuře je kromě tohoto bezprostředního „ortotického“ efektu v okamžiku, kdy je stimulátor používán, popisován i efekt „terapeutický“ – tedy alespoň částečné obnovení aktivní hybnosti hlezenního kloubu a zlepšení parametrů chůze i v období po přerušení používání stimulátoru [2,3,6 – 8]. Převážně nekontrolované studie uvádí, že FES má vliv na dlouhodobé zvýšení rychlosti a výkonnosti chůze, snížení její energetické náročnosti a prodloužení doby opory na paretické dolní končetině [6,7]. Byl popsán i pozitivní dlouhodobý vliv cvičení opakované dorzální flexe pomocí FES na aktivní rozsah pohybu v hlezenním kloubu a míru spasticity plantárních flexorů [2]. Rozsáhlá kontrolovaná studie uvádí pozitivní efekt 30týdenní FES na rychlost chůze, který ale nebyl významně odlišný od kontrolní skupiny, která byla peroneálně ortézována [14]. Podobně jiná rozsáhlá multicentrická kontrolovaná studie popisuje výrazně pozitivní efekt 6měsíční FES na rychlost chůze, nicméně vzhledem ke zvolenému designu studie pouze prokazuje, že efekt FES není inferiorní k efektu peroneálního ortézování [7]. Literatura tedy doposud naznačuje, že FES má pozitivní efekt v dlouhodobém ovlivnění chůze u pacientů po CMP, není ale zcela jasné, zda je přínosnější než standardní peroneální ortézování.
Design většiny studií zaměřených na dlouhodobý „terapeutický“ efekt FES využívá stimulaci v průběhu celého dne – předpokládá, že je každý pacient vybaven vlastním stimulátorem a používá ho v rámci běžné chůze v domácím prostředí a jeho okolí. To je v současných podmínkách našeho zdravotnictví z důvodu vysoké pořizovací ceny přístrojových systémů pro FES (přibližně 100 000 Kč) a absence úhrady zdravotními pojišťovnami pro řadu pacientů obtížně realizovatelné. Terapie se tak odehrává převážně formou kratších (obvykle hodinových) ambulantních terapeutických jednotek na specializovaných pracovištích, kdy jeden přístroj postupně využívá více pacientů. Tato intervence je sice v celkovém časovém objemu výrazně kratší než celodenní FES při běžné chůzi a pohybu v domácím prostředí, její efekt může nicméně spočívat ve vyšší intenzitě – trénink probíhá tak, že pacienti jsou instruováni, aby rychlost chůze s FES byla maximální možná při zachování podmínky bezpečnosti a stability. Tento předpoklad vychází z recentní literatury zabývající se plasticitou nervového systému, která uvádí, že intenzita tréninku (jeho náročnost) představuje společně s počtem opakování klíčovou podmínku pro účinnou stimulaci plasticity, efektivní motorické učení, posílení kortikospinálních drah a postupnou reedukaci pohybu [8,9].
V souladu s tím jsou i výsledky této pilotní studie, kdy u probandů došlo po 4týdenní každodenní ambulantní a maximálně intenzivní intervenci k průměrnému zlepšení celkového skóre všech pěti subtestů EFAP, a tedy rychlosti chůze, o 11 % (medián zlepšení 10,95 %) a průměrnému zlepšení skóre v testu 2MWT, a tedy výkonnosti chůze, o 9 % (medián zlepšení 9,55 %). V subtestech EFAP se pacienti nejvíce zlepšili při chůzi s překračováním a obcházením překážek a naopak nejméně při zvednutí ze židle, ujití 3m úseku a opětovném posazení. Důvodem může být vyšší vliv FES na stabilitu chůze a schopnost lépe reagovat na požadavky prostředí, který je popisován i v literatuře [3,12] než na schopnost základní mobility při vstávání ze židle.
Ve výsledcích obou testů byl zaznamenán poměrně velký rozptyl hodnot (směrodatná odchylka průměrného zlepšení v testech EFAP i 2MWT byla 7 %), což může být dáno širokými indikačními kritérii pilotní studie (např. věkový rozptyl pacientů byl 45 – 63 let, nebyla zohledněna celková tíže postižení apod.). U jednoho pacienta bylo po 4 týdnech intervence pozorováno dokonce zhoršení jak v testu EFAP, tak i v testu 2MWT. I přesto, že měření probíhalo vždy za shodných podmínek a stejným vyšetřujícím, mohou být výsledky ovlivněny dalšími zdravotními komplikacemi, bolestmi pohybového aparátu nebo únavou pacientů s těžkým zdravotním postižením. U pacientů byly ve vstupním i výstupním vyšetření vždy zaznamenávány i subjektivní obtíže, přičemž pacient, u kterého bylo pozorováno zhoršení v obou testech, uvedl při výstupním vyšetření bolest hlavy. Ostatní probandi žádné limitující zdravotní obtíže neuváděli, nicméně řada z nich subjektivně hodnotila, že je pro ně náročné absolvovat každodenní ambulantní terapii po dobu 4 týdnů. Pro prokázání, zda je tento typ intervence srovnatelný s celodenním používáním FES v rámci běžné chůze, bude nutné provést navazující studii s kontrolní skupinou, která podstoupí terapii s FES v domácím prostředí, a dále zvážit zúžení indikačních kritérií.
Závěr
V rámci pilotní studie byl splněn cíl ověřit efekt terapie chůze s FES v ambulantním prostředí – u skupiny probandů byl pozorován pozitivní terapeutický efekt pravidelné a intenzivní FES peroneálního nervu na rychlost a výkonnost chůze s využitím dvou standardizovaných testů. V průběhu terapeutické intervence nebyly zaznamenány žádné nežádoucí účinky nebo komplikace. Byl ověřen základní princip, že je tento typ terapie využitelný u pacientů s centrální spastickou parézou dolní končetiny a drop foot syndromem. Pro validnější prokázání efektu tohoto typu intervence a jeho porovnání s efektem FES v domácím prostředí je nutné provést randomizovanou kontrolovanou studii s větším počtem probandů.
Tato práce byla podpořena grantem č. 940214 Grantové agentury Univerzity Karlovy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 3. 8. 2017
Přijato do tisku: 15. 1. 2018
Mgr. Jakub Jeníček
Klinika rehabilitačního lékařství 1. LF UK a VFN v Praze
Albertov 7
128 00 Praha 2
e-mail: jakub.jenicek@lf1.cuni.cz
Zdroje
1. Sedova P, Brown RD, Zvolsky M et al. Incidence of hospitalized stroke in the Czech Republic: The national registry of hospitalized patients. J Stroke Cerebrovasc Dis 2017; 26(5): 979 – 986. doi: 10.1016/ j.jstrokecerebrovasdis.2016.11.006.
2. Sabut SK, Sikdar C, Kumar R et al. Functional electrical stimulation of dorsiflexor muscle: effects on dorsiflexor strength, plantarflexor spasticity, and motor recovery in stroke patients. Neuro Rehabilitation 2011; 29(4): 393 – 400. doi: 10.3233/ NRE-2011-0717.
3. Nolan KJ, Yarossi M, Mclaughlin P. Changes in center of pressure displacement with the use of a foot drop stimulator in individuals with stroke. Clin Biomech 2015; 30(7): 755 – 761. doi: 10.1016/ j.clinbiomech.2015.03.016.
4. Cakar E, Durmus O, Tekin L et al. The ankle-foot orthosis improves balance and reduces fall risk of chronic spastic hemipatretic patients. Eur J Phys Rehabil Med 2010; 46(3): 363 – 368.
5. Cameron M. The walkaide functional electrical stimulation system – a novel therapeutic approach for foot drop in central nervous system disorders. European Neurological Review 2010; 5(2): 18 – 20. doi: 10.17925/ ENR.2010.05.02.18.
6. Lairamore CH, Garrison MK, Bourgeon L. Effects of functional electrical stimulation on gait recovery post-neurological injury during inpatient rehabilitation. Percept Mot Skills 2014; 119(2): 591 – 608. doi: 10.2466/ 15.25.PMS.119c19z5.
7. Bethoux F, Rogers HL, Nolan KJ et al. The effects of peroneal nerve functional electrical stimulation versus ankle-foot orthosis in patients with chronic stroke: a randomized controlled trial. Neurorehabilitation Neural Repair 2014; 28(7): 688 – 697. doi: 10.1177/ 1545968314521007.
8. Everaert DG, Thompson AK, Chong SL et al. Does functional electrical stimulation for foot drop strengthen corticospinal connections? Neurorehabilitation Neural Repair 2010; 24(2): 168 – 177. doi: 10.1177/ 1545968309349939.
9. Meimoun M, Bayle N, Baude M et al. Intensity in the neurorehabilitation of spastic paresis. Rev Neurol 2015; 171(2): 130 – 140. doi: 10.1016/ j.neurol.2014.09.011.
10. Wolf SL, Catlin PA, Gage K et al. Establishing the reliability and validity of measurements of walking time using the Emory Functional Ambulation Profile. Phys Ther 1999; 79(12): 1122 – 1133.
11. Kafri M, Laufer Y. Therapeutic effects of functional electrical stimulation on gait in individuals post-stroke. Ann Biomed Eng 2015; 43(2): 451 – 466. doi: 10.1007/ s10439-014-1148-8.
12. Swigchem R, Duijnhoven HJ, Boer J et al. Effect of peroneal electrical stimulation versus an ankle-foot orthosis on obstacle avoidance ability in people with stroke-related foot drop. Phys Ther 2012; 92(3): 398 – 406. doi: 10.2522/ ptj.20100405.
13. Wilkie KM, Shiels JE, Bulley C et al. Functional elec-trical stimulation impacted on important aspects of my life – a qualitative exploration of chronic stroke patients perceptions of FES. Physiother Theory Pract 2012; 28(1): 1 – 9. doi: 10.3109/ 09593985.2011.563775.
14. Kluding PM, Dunning K, O’Dell MW et al. Foot drop stimulation versus ankle foot orthosis after stroke, 30-week outcomes. Stroke 2013; 44(6): 1660 – 1669. doi: 10.1161/ STROKEAHA.111.000334.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Neuropatologické okénkoČlánek Poděkování recenzentůmČlánek Dopis redakciČlánek Leiomyom dlaně
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2018 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Komentár ku kontroverziám Traumy ako príčina extrapyramídových syndrómov
- Trombóza kavernózního splavu – stále aktuální komplikace rinosinusitidy
- Radikulopatie Th1 na podkladě masivního výhřezu disku Th1/ 2
- Dlouhodobé sledování pacienta s primárním meningeálním melanocytomem krční míchy
- Neuropatologické okénko
- Neuropatologické post mortem vyšetření mozku a míchy v deseti bodech – co může neurolog od neuropatologa očekávat při verifikaci klinické diagnózy neurodegenerativního onemocnění?
- Olfaktoriální meningiomy – chirurgická léčba, její rizika a možnosti zachování čichu
- Poděkování recenzentům
- Analýza dat v neurologii LXVII. - Statistická analýza studií s jedním zařazeným pacientem („N of 1 trials“)
- Dopis redakci
- Zemřel prim. MU Dr. Jan Országh, CSc.
- Neuropaliativní a rehabilitační péče u pacientů v pokročilé fázi progresivních neurologických onemocnění
- Ochranné faktory kognitivního deficitu u roztroušené sklerózy
- Měření kognitivních funkcí pomocí krátkých opakovatelných neuropsychologických baterií
- Editorial
- Test gest (TEGEST) k rychlému vyšetření epizodické paměti u mírné kognitivní poruchy
- Význam morfologických a klinických klasifikací stenózy bederní páteře v předoperační rozvaze
- Parosmie a fantosmie u pacientů s poruchou čichu
- Syndróm Dravetovej s mutáciou v SCN1A géne, genetické aspekty a klinické skúsenosti
- Porozumenie viet u slovensky hovoriacich pacientov s Parkinsonovou chorobou
- Neurochirurgické předatestační vzdělávání v ČR
- Alternativní formy pro české verze Paměťového testu učení, Reyovy-Osterriethovy komplexní figury a testu Verbální fluence
- Traumata jako příčina extrapyramidových syndromů
- Pilotní studie efektu ambulantní funkční peroneální stimulace
- Spondylodiscitida z pohledu neurologa
- Traumy ako príčina extrapyramídových syndrómov
- Leiomyom dlaně
- Gigantický kavernózní hemangiom zadní jámy nasedající na duru napodobující hemangiopericytom
- Statiny a jejich vliv na periferní nervový systém
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Spondylodiscitida z pohledu neurologa
- Parosmie a fantosmie u pacientů s poruchou čichu
- Měření kognitivních funkcí pomocí krátkých opakovatelných neuropsychologických baterií
- Trombóza kavernózního splavu – stále aktuální komplikace rinosinusitidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



