-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Germinom thalamu u dítěte s projevy předčasné pseudopuberty – kazuistika
Thalamic Germinoma in a Child with Symptoms of Precocious Pseudopuberty – a Case Report
We describe a case of a 6 years old boy with germinoma of an unusual thalamic localization that presented with precocious pseudopuberty based on ectopic human chorionic gonadotropin (hCG) secretion. The tumour was confirmed with stereotactic biopsy; subsequent chemotherapy and radiotherapy led to complete remission. The mechanism of precocious pseudopuberty and clinical and treatment aspects of brain germinomas in children arediscussed.
Key words:
germinoma – central nervous system – human chorionic gonadotropin – pseudopuberty – chemotherapy – radiotherapy
Autoři: Z. Pavelka 1; O. Magnová 2; L. Křen 3; T. Svoboda 4; E. Brichtová 5; J. Štěrba 1
Působiště autorů: LF MU Brno a FN Brno Klinika dětské onkologie 1; LF MU Brno a FN Brno Pediatrická klinika 2; LF MU Brno a FN Brno Ústav patologie 3; LF MU Brno a FN Brno Neurochirurgická klinika 4; LF MU Brno a FN Brno Neurochirurgické oddělení Kliniky dětské chirurgie, ortopedie a traumatologie 5
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(4): 497-500
Kategorie: Kazuistika
Souhrn
Prezentujeme kazuistiku šestiletého chlapce s germinomem v neobvyklé lokalizaci thalamu, který se klinicky manifestoval předčasnou pseudopubertou na podkladě ektopické sekrece humánního choriogonadotropinu (hCG). Nádor byl potvrzen ze stereotaktické biopsie, následná chemoterapie a radioterapie vedla ke kompletní remisi. Je diskutováno o mechanizmu vzniku předčasné pseudopuberty, klinických i léčebných aspektech germinomů mozku u dětí.
Klíčová slova:
germinom – centrální nervový systém – choriogonadotropin – pseudopuberta – chemoterapie – radioterapieÚvod
Intrakraniální nádory ze zárodečných buněk (ICGT) jsou vzácné a tvoří pouze 3 – 5 % primárních nádorů centrálního nervového systému (CNS) dětí [1 – 3]. Prezentujeme kazuistiku dítěte s germinomem mozku v neobvyklé lokalizaci bazálních ganglií, který se klinicky manifestoval předčasnou pseudopubertou na podkladě ektopické sekrece humánního choriogonadotropinu (hCG).
Kazuistika
Chlapec (ročník narození 2005) s negativní rodinnou onkologickou anamnézou byl léčen v roce 2006 pro uzlinovou formu histiocytózy z Langerhansových buněk kombinací prednizonu a vinblastinu, od října 2006 byl bez známek aktivity choroby v dispenzární péči. V listopadu 2011 ve věku šesti let se dostavil se známkami rozvíjejících se sekundárních pohlavních znaků: sekundární pohlavní ochlupení, zvětšení genitálu (objem varlat dle UZV 5 – 6 ml, Tannerovo stadium: pubické ochlupení 3/ 5, genitál 3/ 5), zhrubnutí hlasu, bilaterální zvětšení prsní žlázy do velikosti areoly, akné. Neurologický nález dítěte byl po celou dobu normální. Pomýšleli jsme na předčasnou pubertu podmíněnou hormonálně aktivním tumorem nebo na jinou endokrinologickou příčinu předčasného rozvoje sekundárních pohlavních znaků. Komplexní vyšetření zobrazovacími metodami (včetně celotělové pozitronové emisní tomografie s fluorodeoxy - glukózou) vyloučilo extrakraniální tumor. Byla zjištěna patologicky zvýšená hodnota hCG v séru i mozkomíšním moku odebraném lumbální punkcí: hCG 160 IU/ l (sérum), resp. 157 IU/ l (mok) a zvýšená hodnota testosteronu v séru 43,76 nmol/ l. Alfa‑fetoprotein byl negativní. Následně provedený LH/ RH test potvrdil supresi sekrece LH/ FSH. Závěr endokrinologa: pseudopubertas praecox isosexualis. CT oblasti nadledvinek bylo negativní. Vyšetření mozku MR prokázalo kulovité patologické ložisko o velikosti 16 × 16 × 17 mm v oblasti bazálních ganglií vlevo v blízkém vztahu k průběhu levostranné kortikospinální dráhy. V T1 zobrazení bylo ložisko obtížně rozlišitelné s absencí sycení po kontrastu, mnohem lépe bylo zobrazeno v T2 sekvenci (obr. 1). Stereotakticky navigovanou biopsií byl odebrán vzorek tkáně, ve kterém patolog potvrdil maligní germinální nádor typu germinomu se složkou syncytiotrofoblastu obsahující velké polygonální buňky v solidních ložiscích a hnízdech s velkými centrálně uloženými jádry (imunohistochemie: PLAP pozitivní; ostatní, tj. S100, AE1/ AE3, LCA, NSE, synaptofyzin, AFP negativní; vysoké Ki67 90 %) (obr. 2, 3). Po stereotaktické biopsii bylo dítě prosto neurologických symptomů. Diseminace v rámci CNS byla vyloučena. K blokádě efektu testosteronu na cílových receptorech byl nasazen anti‑androgen cyproteron acetát. U pacienta bylo zahájeno genetické šetření vzhledem k sekvenci dvou rozdílných malignit včetně vyšetření na průkaz mutace (dysfunkce) v obvyklých nádorově supresorových genech či genech DNA reparačních systémů. Minimální množství bioptického materiálu z biopsie limitovalo možnosti cytogenetické analýzy nádorové tkáně.
Obr. 1. MR mozku, T2 zobrazení, transverzální řez: patologické ložisko zvýšeného T2 signálu velikosti 16 × 16 × 17 mm v levém globus pallidus. 
Obr. 2. Nádor tvoří velké polygonální buňky v solidních ložiscích a hnízdech s velkými centrálně uloženými jádry (hematoxylin-eozin, zvětšení 200×). 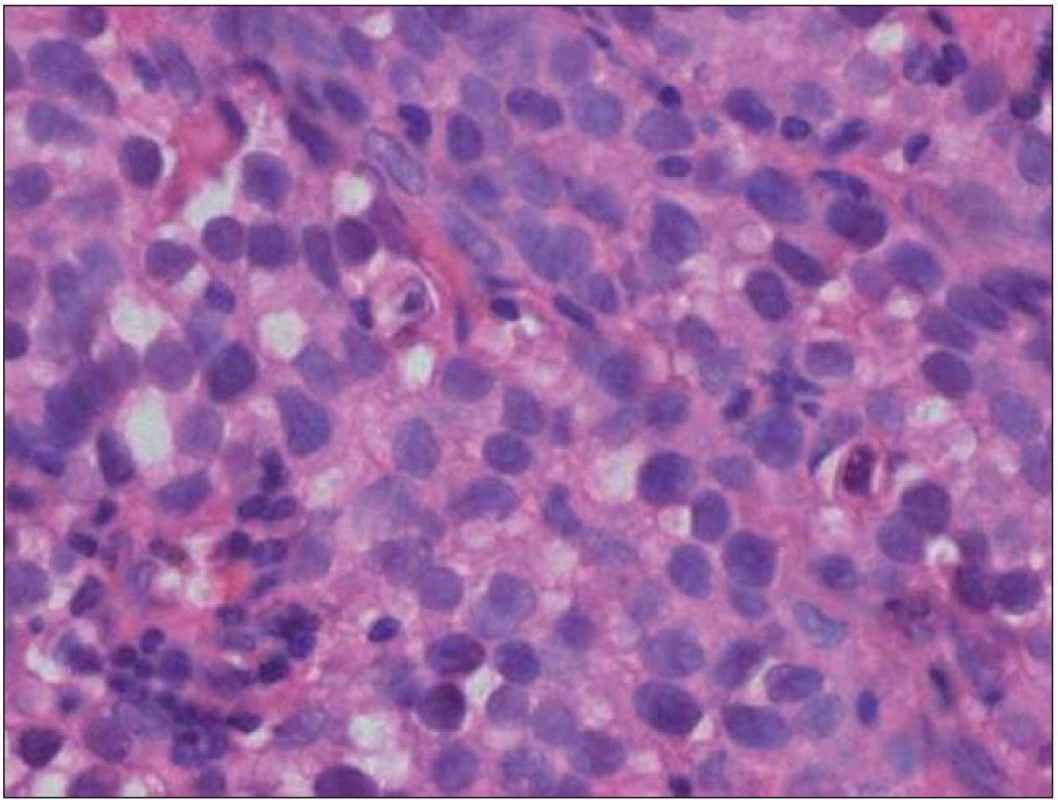
Obr. 3. Imunohistochemické vyšetření nádoru: pozitivní průkaz syncytiotrofoblastu produkujícího hCG (zvětšení 400×). 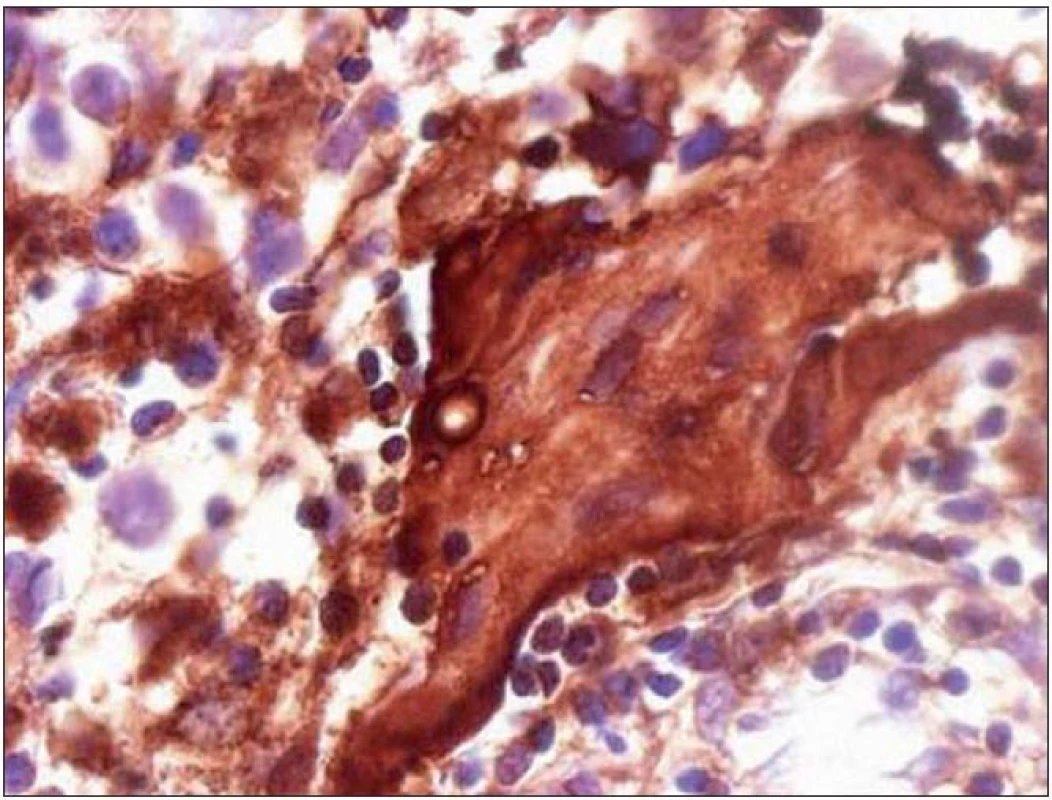
Dítě zahájilo léčbu dle léčebného protokolu ACNS 0232: alternující cykly chemoterapie karboplatina/ etoposid a cisplatina/ cyklofosfamid [4]. Po dvou cyklech chemoterapie byla dosažena částečná regrese onemocnění (hCG v moku 6 U/ l, v séru negativní, regrese nádorového ložiska na MR s ústupem solidní složky ve prospěch cystoidní, úplná negativizace testosteronu v séru). Po dalších dvou cyklech došlo k úplné negativizaci hCG i nálezu na MR, kde je v T2 zobrazení patrna likvorovým obsahem vyplněná pseudocysta v levém globus pallidus (dosažena první kompletní remise onemocnění) (obr. 4). Následovala lokální konformní radioterapie na lůžko tumoru s bezpečnostním lemem za užití lineárního urychlovače o energii 6 MV, v dávce 30 Gy (15 × 2,0 Gy), technikou „RapidArc“ [4].
Obr. 4. MR mozku, T2 zobrazení, transverzální řez: po léčbě je v levém globus pallidus pseudocysta vyplněná mokem bez patologického sycení (remise). 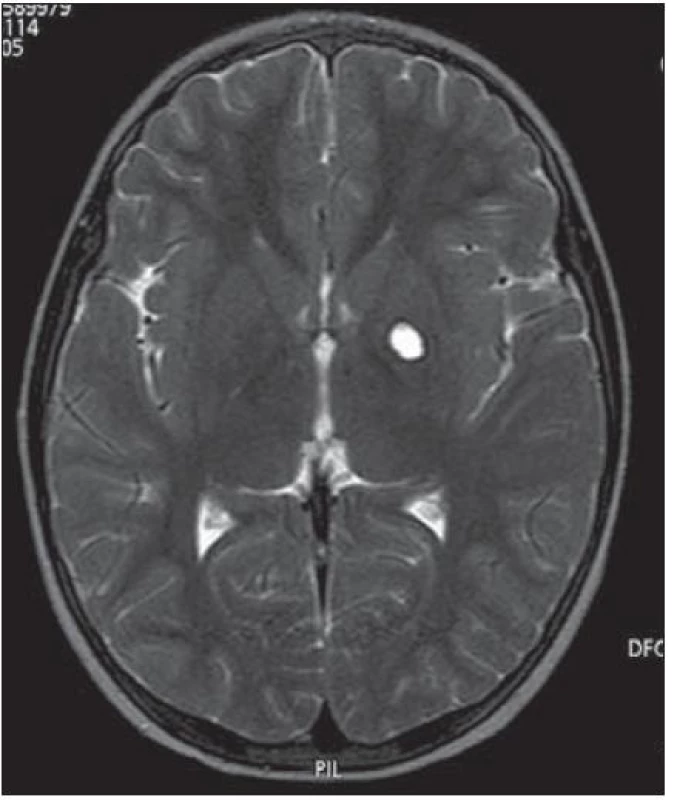
Dítě je půl roku po skončení onkologické terapie nadále v remisi základního onemocnění (EFS 1 rok), bez neurologických příznaků. Jsou prováděny pravidelné periodické kontroly MR a laboratorních ukazatelů (AFP, hCG). Dítě je v péči endokrinologa. Známky předčasné pseudopuberty regredují, blokáda periferního efektu testosteronu cyproteron acetátem již byla ukončena.
Diskuze
ICGT jsou vzácné a představují jen 3 – 5 % všech primárních nádorů CNS dětí [1 – 3]. IGCT dělíme na germinomy a non‑germinomy [1 – 3]. Histologicky „čisté“ germinomy tvoří 50 – 60 % ICGT. Složka syncytiotrofoblastu produkující hCG může být v tumoru zastižena, podmínkou je ale hladina hCG v séru i likvoru pod 500 IU/ l a negativita AFP [5]. V opačném případě je třeba nádor brát jako sekretorický non‑germinom s nutností intenzivnější léčby a horší prognózou [3,5, 6].
ICGT vyrůstají typicky ve střední čáře v supraselární a pineální oblasti [7]. Lokalizace v bazálních gangliích je spíše neobvyklá a literárně je popisována u 14 % případů. ICGT bazálních ganglií a thalamu jsou nalézány převážně ve věkové kategorii 7 – 20 let a vykazují silnou (20 : 1) predominanci mužského pohlaví [6 – 8]. Nádory ze zárodečných buněk v této lokalizaci jsou obvykle unilaterální a mohou se manifestovat hemiparézou, okulomotorickým deficitem, hemianopsií, poruchou řeči, mentální deteriorací, či příznaky diabetes insipidus a vzácněji předčasnou pubertou/ pseudopubertou. Klinický průběh bývá pomalý s trváním symptomů před stanovením diagnózy od jednoho měsíce do 4,5 roků [8]. Většina ICGT bazálních ganglií se na MR zobrazuje jako solidní ložisko nepravidelného vzhledu s možným cystickým podílem. V T1 váženém obraze bývá ložisko germinomu obtížně odlišitelné pro minimální sycení po kontrastu, naopak v T2 zobrazení se zobrazuje jako ložisko vysoké signálové intenzity a bývá lépe patrno. Kolaterální edém bývá většinou minimální [6]. Vzhledem k neobvyklé lokalizaci v kombinaci s hladinou hCG pod hranicí určující diagnózu sekretorického non‑germinomu [5] jsme volili verifikaci tumoru stereotaktickou biopsií přes určité riziko neurologického poškození.
Asociace histiocytózy z Langerhansových buněk a nádoru ze zárodečných buněk je velmi vzácná, v literatuře jsou uvedeny jen ojedinělé kazuistiky, navíc převážně u dospělých. Asociace s ICGT lokalizovaným intrakraniálně je pak vysloveně raritní [9]. O možných společných genetických jmenovatelích vzniku obou malignit či vlivu předchozí chemoterapie vedoucí k sekundární malignitě můžeme pouze spekulovat.
Jedním z popisovaných klinických projevů germinomu CNS, jak již bylo uvedeno, je předčasná pseudopuberta. Je třeba terminologicky i medicínsky odlišovat předčasnou pubertu a pseudopubertu. V středoevropském regionu se používá více termín pseudopubertas praecox isosexualis, kdežto anglosaská literatura pracuje s termínem gonadotropin‑independentní předčasná puberta (tab. 1). Mechanizmem vzniku pseudopuberty je v případě našeho pacienta produkce hCG tumorem (složkou syncytiotrofoblastu), který zkříženou reakcí s LH receptorem vede k typickým klinickým projevům, ale se suprimovanou bazální a/ nebo stimulovanou hladinou LH (potvrzeno LH/ RH testem). K aktivaci osy GnRH – LH – gonády zde nedochází [7,10]. Obvykle je udáváno, že hladina hCG vedoucí k předčasné pseudopubertě by měla být excesivní. V případě chlapce byly hodnoty v séru i moku před zahájením terapie opakovaně sice patologické, ale pod obvyklou mezí (500 IU/ l) určující sekretorické non‑germinomy [3 – 5]. Nádor byl z histopatologického i onkologického hlediska skutečně „čistým“ germinomem.
Tab. 1. Možné příčiny předčasné izosexuální pseudopuberty u chlapců. 
Germinomy mají obecně dobrou prognózu, za standard léčby je považováno pooperační ozáření [3, 4,11]. Rozsah radioterapie v protokolech bývá různý, při profylaktickém ozáření celé kraniospinální osy s dosycením na primární ložisko maximální tolerovatelnou dávkou je dosahováno desetileté přežívání 80 %. U dětí však při takové terapii existuje vysoké riziko závažných pozdních následků, především centrálních endokrinologických deficitů (částečný nebo úplný hypopituitarizmus) a poškození neurokognitivních funkcí, zejména pokles IQ [3]. Proto současné generace dětských protokolů (např. námi užitý ACNS 0232) zařazují nejprve chemoterapii a při dobré léčebné odpovědi je radioterapie u lokalizovaných tumorů redukována na lokální ozáření [4].
Závěr
Při zjištění předčasné pseudopuberty u dítěte je třeba diferenciálně diagnosticky zvažovat také hCG produkující tumor CNS jako možnou neobvyklou příčinu. Případ dokumentuje potřebu interdisciplinárního přístupu při diagnostice a léčbě takových dětí. Prognóza pacienta je vzhledem k asociaci s předchozím jiným onkologickým onemocněním, a tedy teoreticky možnému genetickému pozadí nejistá.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zdeněk Pavelka
Klinika dětské onkologie
LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: zpavelka@fnbrno.cz
Přijato k recenzi: 25. 10. 2012
Přijato do tisku: 11. 12. 2012
Zdroje
1. Kleihues P, Cavanee WK. Pathology and genetics of tumors of the nervous system. Lyon: International Agency for Research on Cancer (IARC) Press 2007.
2. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007; 114(2): 97 – 109.
3. Pizzo PA, Poplack DG. Principles and Practice of Pediatric Oncology. 5th ed. Philadelphia: Lippincott Williams & Wilkins 2005.
4. Childrens Oncology Group [online]. Available from: www.childrensoncologygroup.org/ members/ protocols/ CNS.
5. González - Sánchez V, Moreno‑Pérez O, Pellicer PS, Sánchez - Ortiga R, Guerra RA, Dot MM et al. Validation of the human chorionic gonadotropin immunoassay in cerebrospinal fluid for the diagnostic work - up of neurohypophyseal germinomas. Ann Clin Biochem 2011; 48(5): 433 – 437.
6. Phi JH, Cho BK, Kim SK, Paeng JC, Kim IO, Kim IH et al. Germinomas in the basal ganglia: magnetic resonance imaging classification and the prognosis. J Neurooncol 2010; 99(2): 227 – 236.
7. Jorsal T, Rørth M. Intracranial germ cell tumours. A review with special reference to endocrine manifestations. Acta Oncol 2012; 51(1): 3 – 9.
8. Tamaki N, Lin T, Shirataki K, Hosoda K, Kurata H, Matsumoto S et al. Germ cell tumors of the thalamus and the basal ganglia. Childs Nerv Syst 1990; 6(1): 3 – 7.
9. Ng WK, Lam KY, Ng IO. Langerhans‘ cell histiocytosis: possible association with malignant germ cell tumour. J Clin Pathol 1995; 48(10): 963 – 965.
10. Stephen MD, Zage PE, Waguespack SG. Gonadotropin‑dependent precocious puberty: neoplastic causes and endocrine considerations. Int J Pediatr Endocrinol 2011; 2011 : 184502.
11. Fadrus P, Lakomý R, Hübnerová P, Slabý O, Keřkovský M, Svoboda T et al. Intrakraniální nádory – diagnostika a terapie. Intern Med Prax 2010; 12(7,8): 376 – 381.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2013 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Chirurgie baze lební (uvnitř minimonografie video)
- Trigemino‑ kardiálny reflex a jeho variácie
- Genetické a environmentálne faktory zapojené do patogenézy sklerózy multiplex
- Neuropsychiatrický pohľad na Huntingtonovu chorobu
- Endoskopické endonazální operace meningeomů baze lební
- Soubor jednoznačně pojmenovatelných obrázků k hodnocení a léčbě jazykových a kognitivních deficitů
- Validizácia slovenskej verzie Movement Disorder Society – Unified Parkinson’s Disease Rating Scale (MDS‑ UPDRS)
- Význam vestibulárního a posturografického vyšetření u pacientů s vestibulárním schwannomem
- Komentář k práci P. Kalitové et al. Význam vestibulárního a posturografického vyšetření u pacientů s vestibulárním schwannomem
- Význam MR zobrazení difuze míchy v diferenciální diagnostice míšních lézí
- Endovaskulární léčba nepřímé karotido‑ kavernózní píštěle s použitímchirurgického přístupu přes vena ophthalmica superior
- Augmentované krční stabilizace po selhání předchozí fixace u pacientů s těžkou osteoporózou – dvě kazuistiky
- Dysembryoplastický neuroepiteliální tumor a jeho atypická varianta u dětí – kazuistiky
- Germinom thalamu u dítěte s projevy předčasné pseudopuberty – kazuistika
- Úskalí diagnostiky progresivní multifokální leukoencefalopatie u pacientů infikovaných lidským virem imunodeficience – kazuistiky
- Arteriovenózní malformace conus medullaris – kazuistika
- Guillainův‑Barrého syndrom asociovaný s karcinomem prsu léčeným trastuzumabem – kazuistika
- Akutní encefalitida vyvolaná virem chřipky B – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XL. Studium vlivu zavádějících faktorů na odhad poměru šancí a relativního rizika - 16. Jedličkovy neuroimunologické a likvorologické dny
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Úskalí diagnostiky progresivní multifokální leukoencefalopatie u pacientů infikovaných lidským virem imunodeficience – kazuistiky
- Chirurgie baze lební (uvnitř minimonografie video)
- Neuropsychiatrický pohľad na Huntingtonovu chorobu
- Akutní encefalitida vyvolaná virem chřipky B – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



