-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sclerosis multiplex a komorbidita s iným a uto imunitným ochorením
Sclerosis Multiplex and Comorbidity with Another Autoimmune Disease
Introduction:
The objective of the study was to assess concomitant incidence of multiple sclerosis (MS) with additional autoimmune diseases in our set of patients and to analyse, in more detail, the impact of such comorbidities on the course of the disease. Patient group and Methods: 256 patients with clinically definitive multiple sclerosis according to McDonald’s criteria. The patients were classified into two groups. Group 1: MS with an additional autoimmune disease. Group 2: SM without an additional autoimmune disease. Results: The average EDSS (Expanded Disability Status Scale) score in the patient set was 3.4 ± 1.4. 23 (8.9%) patients had a concomitant autoimmune disease, the incidence rate being as follows: autoimmune thyroid disease (AIT) – 16; celiac disease – 2, type I diabetes mellitus – 1, rheumatoid arthritis – 1, ulcerous colitis – 1, psoriasis vulgaris – 1, ankylosing spondylitis – 1, and autoimmune hemolytic anaemia – 1. Conclusion: The highest incidence of MS was in patients with concomitant autoimmune thyroid disease. The presence of an additional autoimmune disease did not have a major impact on the degree of functional impairment of patients as compared with the group of patients without any comorbidity. In all cases, autoimmune disease preceded the occurrence of multiple sclerosis.Key words:
sclerosis multiplex – comorbidity – autoimmune diseases
Autoři: J. Szilasiová 1; I. Lazúrová 2
Působiště autorů: Neurologická klinika LF UPJŠ a FN L. Pasteura Košice 1; I. Interná klinika LF UPJŠ a FN L. Pasteura Košice 2
Vyšlo v časopise: Cesk Slov Neurol N 2009; 72/105(1): 51-56
Kategorie: Krátké sdělení
Souhrn
Úvod:
Cieľom práce bolo zistiť súčasný výskyt sclerosis multiplex (SM) s inými autoimunitnými ochoreniami v našom súbore pacientov a bližšie analyzovať ich vplyv na priebeh ochorenia. Súbor a Metodika: V retrospektívnej štúdii boli analyzované údaje 256 chorých s klinicky definitívnou diagnózou sclerosis multiplex podľa McDonaldových kritérií. Pacienti boli rozdelení do dvoch skupín – skupina 1: SM s iným autoimunitným ochorením – a skupina 2: SM bez iného autoimunitného ochorenia. Výsledky: Priemerné skóre EDSS (Expanded Disability Status Scale) v súbore chorých bolo 3,4 ± 1,4. 23 (8,9%) pacientov malo súčasný výskyt iného autoimunitného ochorenia, v nasledovnom poradí častosti výskytu: autoimunitná tyreoiditída (AIT) 16, celiakia 2, diabetes mellitus I. typu 1, reumatoidná artritída 1, ulcerózna kolitída 1, psoriasis vulgaris 1, ankylozujúca spondylartritída 1 a autoimunitná hemolytická anémia 1 prípad. Záver: Najvyšší výskyt SM bol v komorbidite s autoimunitnou tyreoiditídou. Prítomnosť iného autoimunitného ochorenia neovplyvnila významne stupeň funkčného zneschopnenia pacientov v porovnaní so skupinou bez inej autoimunity. Vo všetkých prípadoch predchádzalo autoimunitné ochorenie vzniku sclerosis multiplex.Kľúčové slová:
sclerosis multiplex – komorbidita – autoimunitné ochoreniaÚvod
Sclerosis multiplex je chronické zápalové ochorenie centrálneho nervového systému (CNS), ktoré vedie k demyelinizácii nervových vláken ako aj ich priamej strate [1]. K transekcii axónov dochádza u jednotlivých pacientov v rôznej miere už vo včasnej fáze ochorenia. Axonálne poškodenie a lézie sivej hmoty CNS, ktoré vedú k ireverzibilným stratám funkčných schopností pacienta, sú pravdepodobne následkom primárneho autoimunitného ataku proti antigénom axonálnym, neuronálnym, oligodendrocytárnym, alebo poškodzujú funkciu iónových kanálov [2–5].
V posledných dvoch desaťročiach sa SM zaraďuje do skupiny autoimunitných ochorení [6–8]. Sclerosis multiplex sa môže vyskytovať súčasne s iným zápalovým ochorením autoimunitného charakteru [9–11]. Niektorí autori poukazujú na zvýšený výskyt autoimunít v spojení so sclerosis multiplex v porovnaní s kontrolnými súbormi [12–14]. Cieľom práce bolo zistiť, aká je koincidencia iného autoimunitného ochorenia u pacientov so SM v našom súbore a bližšie analyzovať parametre (pohlavie, dĺžka trvania ochorenia, klinická forma, stupeň funkčného zneschopnenia) tejto skupiny v porovnaní s tými, u ktorých sa iné autoimunitné ochorenie nevyskytlo.
Súbor a metodika
V retrospektívnej štúdii sme analyzovali údaje pacientov s diagnózou sclerosis multiplex podľa McDonaldových kritérií, ktorí boli vyšetrení na ambulancii Neurologickej kliniky LF UPJŠ a FNLP v Košiciach v rokoch 2005–2007 [15,16]. Do súboru boli zahrnutí pacienti s trvaním sclerosis multiplex najmenej jeden rok, starší ako 18 rokov. Všetci chorí pochádzali z regiónu východného Slovenska. Súbor tvorilo 256 pacientov (181 žien a 75 mužov, priemerný vek 36,1 ± 9,9 rokov, od 18–63 rokov, priemerná dĺžka trvania ochorenia 8,5 ± 6,2 rokov).
Diagnóza iného autoimunitného ochorenia bola získaná zo zdravotnej dokumentácie, s využitím zoznamu autoimunitných ochorení podľa Medzinárodnej klasifikácie chorôb (International Classification of Diseases).
Pacienti boli rozdelení na skupinu 1 s výskytom iného autoimunitného ochorenia a skupinu 2 bez iného autoimunitného ochorenia. Obe skupiny boli navzájom porovnané na základe pohlavia, dĺžky trvania ochorenia, klinickej formy, stupňa funkčného zneschopnenia vyjadreného pomocou skóre v stupnici EDSS [17]. Údaje boli štatisticky vyhodnotené metódou regresnej korelačnej analýzy; hypotéza rovnosti stredných hodnôt bola overovaná nepárovým t-testom a Mann Whitneyovým neparametrickým testom. Parametre chorých sú uvedené v tab. 1.
Tab. 1. Demografické údaje a klinické parametre pacientov. 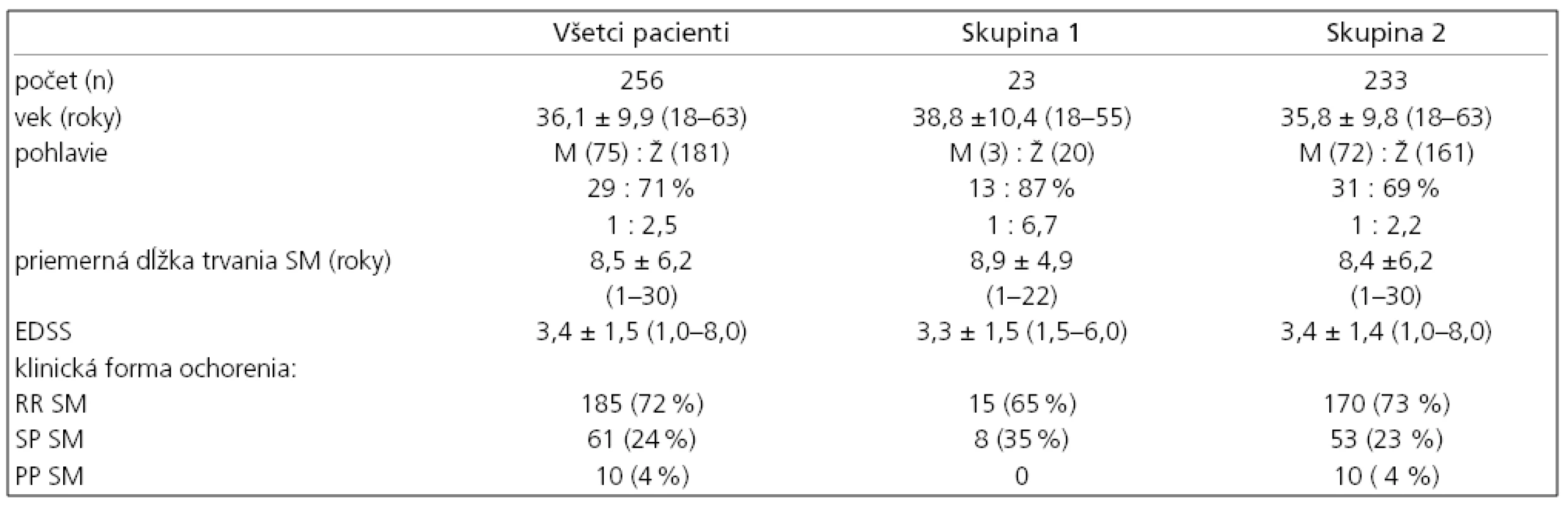
Vysvetlivky: n – počet pacientov, M – muži, Ž – ženy, SM – sclerosis multiplex, RR – relapsoremitujúca forma, SP – sekundárne progresívna forma, PP – primárne progresívna forma, ED SS – stupnica Expanded Disability Status Scale Výsledky
Z celkového počtu 256 malo 185 (72%) pacientov relapso-remitujúcu formu ochorenia (RRSM), 61 (24%) sekundárne progresívnu (SPSM) a 10 (4%) primárne progresívnu SM (PPSM) formu ochorenia podľa definície Lublina a Reingolda [18]. V skupine 1 bolo 23 (8,9%) pacientov, ktorí mali súčasne iné autoimunitné ochorenie. Z nich jedna pacientka mala dve ďalšie autoimunitné choroby. Medzi skupinou 1 a 2 nebol zistený štatisticky významný rozdiel vo veku pacientov, dĺžke trvania sclerosis multiplex, ani v stupni funkčného zneschopnenia vyjadreného stupnicou EDSS. V celom súbore chorých (n = 256) prevládal počet žien nad mužmi v pomere 1 : 2,5. V skupine 1 bol pomer mužov a žien 1 : 6,7 (tab. 1). V skupine 1 bolo nasledovné zastúpenie pacientov podľa klinickej formy ochorenia: 15 (65%) malo RRSM a 8 (35%) malo SPSM, PP forma sa nevyskytovala. Z celkového počtu chorých bolo 176 pacientov liečených niektorým z interferónov beta (interferón beta 1a: Avonex®, Rebif®, interferón beta 1b: Betaferon®), 33 pacientov glatirameracetátom (Copaxon®) a 3 pacienti boli liečení natalizumabom (Tysabri®). 24 chorých nebolo liečených imunomodulačnými ani imunosupresívnymi preparátmi. V skupine 1 je liečených niektorým z interferónov beta šesť pacientov, glatirameracetátom sedem pacientov a desiati chorí nie sú liečení žiadnym z týchto preparátov. Prehľad autoimunitných ochorení u našich pacientov so sclerosis multiplex je uvedený v tab. 2.
Tab. 2. Prehľad autoimunitných ochorení v súbore našich pacientov so sclerosis multiplex. 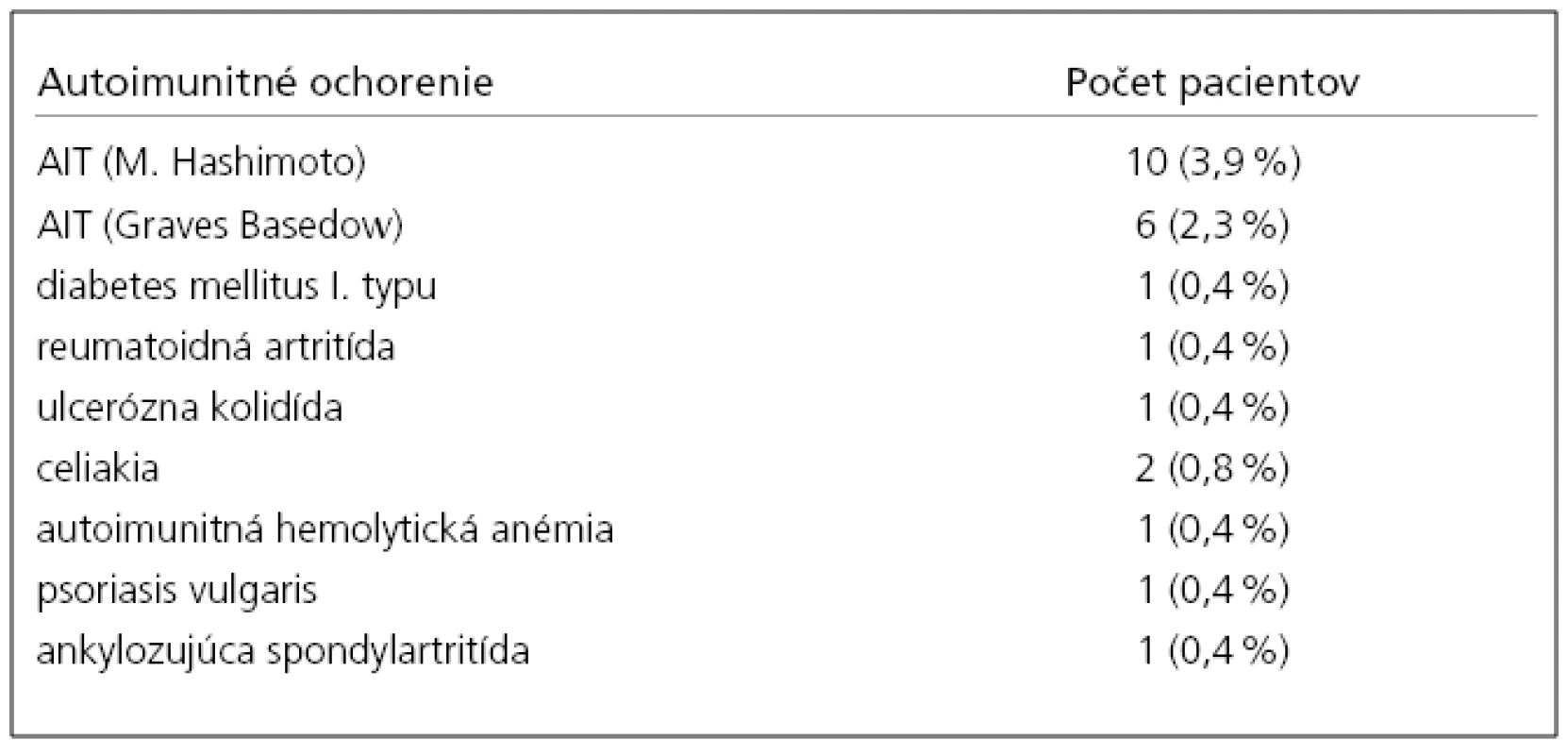
*v jednom prípade sa vyskytovala súčasne sclerosis multiplex, re umato idná artritída a autoimunitná Hashimotova tyre o iditída Vysvetlivky: AIT – autoimunitná tyreoditída Najčastejšie sa súčasne so SM vyskytovala: autoimunitná tyreoiditída (AIT) 16 (prípadov), celiakia 2, diabetes mellitus I. typu 1, reumatoidná artritída 1, ulcerózna kolitída 1, psoriasis vulgaris 1, ankylozujúca spondylartritída 1 a autoimunitná hemolytická anémia v jednom prípade. U jednej pacientky bol súčasný výskyt SM, AIT a reumatoidnej artritídy. Vo všetkých prípadoch sa autoimunitné ochorenie zistilo pred vznikom neurologických symptómov, diagnostikovaním a liečbou sclerosis multiplex. V tab. 3 je prehľad klinických parametrov pacientov skupiny 1.
Tab. 3. Prehľad klinických parametrov pacientov skupiny 1. 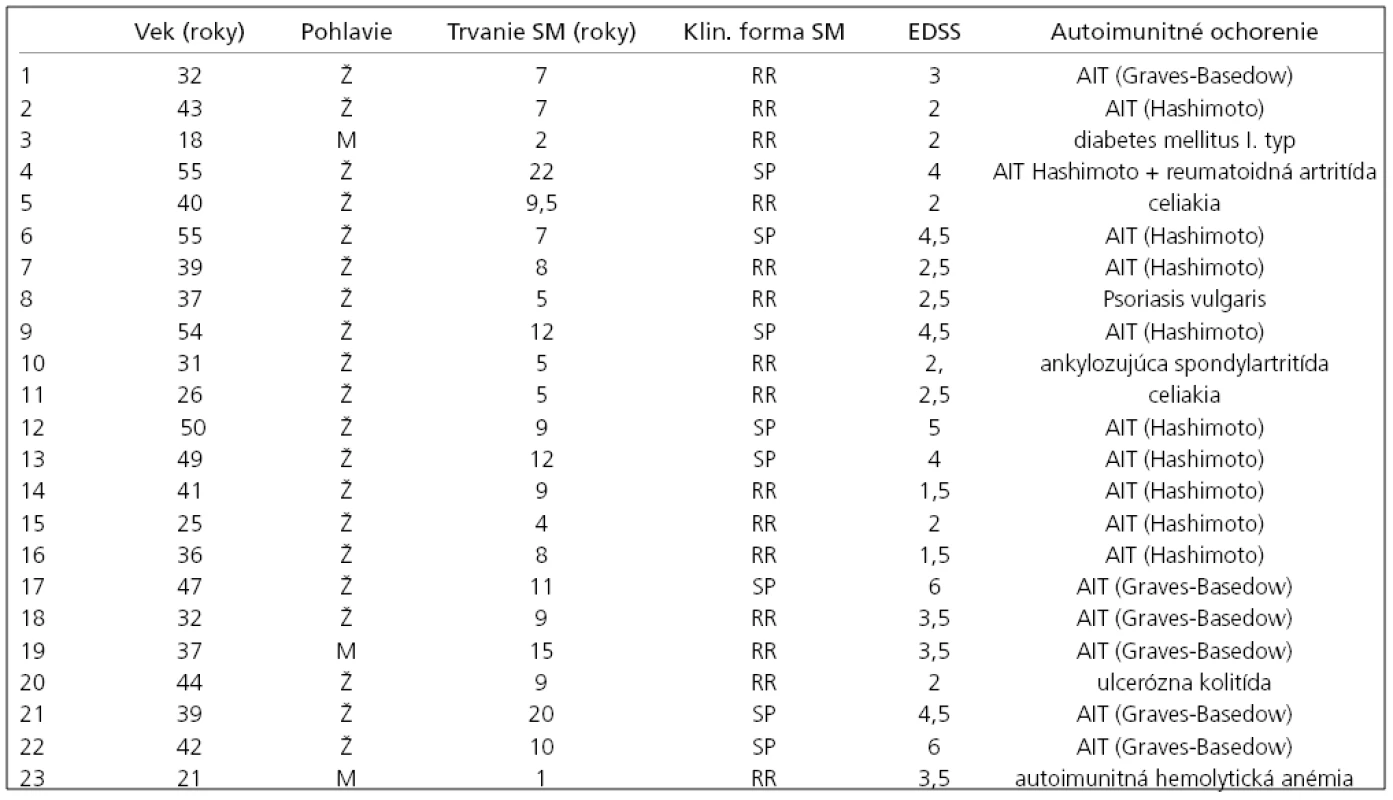
Vysvetlivky: M – muži, Ž – ženy, SM – sclerosis multiplex, RR – relapso-remitujúca forma, SP – sekundárne progresívna forma, PP – primárne progresívna forma, ED SS – stupnica Expanded Disability Status Scale Diskusia
Autoimunitné ochorenia charakterizuje abnormálna imunitná odpoveď sprostredkovaná humorálnymi a celulárnymi reakciami, namierená voči určitým antigénom, tkanivám a orgánom. Delia sa na orgánovo špecifické alebo systémové, i rôzne navzájom sa prekrývajúce syndrómy, ktorých fenotypy reprezentujú široké spektrum imunitnej dysregulácie. V súčasnosti je známych viac ako 80 autoimunitných ochorení, ktoré postihujú 5–7% ľudskej populácie. Presná príčina väčšiny týchto ochorení nie je dodnes známa. Väčšina z nich má chronický priebeh, začína v mladom veku. 75% všetkých autoimunít postihuje prevažne ženy. Medzi autoimunitné ochorenia patrí aj sclerosis multiplex, pre ktorú je charakteristická perivenulárna akumulácia autoreaktívnych T lymfocytov v centrálnom nervovom systéme. Zmena genetických alebo enviromentálnych faktorov ovplyvňujúcich reguláciu cytokínov, alebo polarizáciu T lymfocytov, môže viesť k vzniku ochorení spôsobených abnormálnou funkciou T lymfocytov, buniek TH1 (T lymfocyty, H helpery). Tieto úvahy by mohli vysvetliť koexistenciu dysimunitných ochorení u toho istého jedinca [19–22]. Niektorí autori upozorňujú na tendenciu autoimunitných ochorení k ich koexistencii u jednej osoby, alebo jednej rodiny, opierajúc sa o koncepciu určitej „autoimunitnej diatézy“ [11].
Napriek všeobecne akceptovanej vzájomnej asociácii imunitných ochorení, viaceré výskumy ukázali, že prevalencia iných autoimunít u pacientov so sclerosis multiplex nie je vyššia ako v bežnej populácii [23–25]. U pacientov so SM nie je v porovnaní s bežnou populáciou vyšší výskyt reumatoidnej artritídy, ankylozujúcej spondylatritídy, diabetes mellitus I. typu, primárnej hypotyreózy, ani vitiliga [23]. Na rozdiel od prác v 90. rokoch, Henderson et al našli vyšší výskyt autoimunitných chorôb u pacientov so SM a ich rodinných príslušníkov. Predpokladajú, že ide o genetickú predispozíciu na autoimunitné reakcie [20,26].
Výsledky spracovania dát v našom súbore dokazujú možnosť súčasného výskytu sclerosis multiplex s iným autoimunitným ochorením, hlavne s tými, ktoré sú sprostredkované abnormálnou funkciou buniek TH, kde sa zaraďujú okrem sclerosis multiplex diabetes mellitus I. typu, autoimunitná tyreoiditída a reumatoidná artritída [27,28]. Zachytili sme aj koincidenciu so zápalovým ochorením čreva a psoriázou, podobne ako uvádzajú práce Ranga a Cendrowského [29,30]. Komorbiditu s inou autoimunitou sme našli v 8,9% prípadov. Najvyšší podiel tvorili pacienti s autoimunitnou Hashimotovou a Gravesovou tyreoiditídou (spolu 6,3%), menej s celiakiou (0,8%) a ostatné autoimunity sa vyskytli v 0,4% prípadov pacientov (tab. 2). Prevaha autoimunitnej tyreoiditídy môže odrážať vysoký výskyt zápalov štítnej žľazy v bežnej populácii obyvateľov Slovenska. AIT sa v bežnej populácii vyskytuje u 5–7% ľudí; v selektovanej populácii pacientov so strumou je v Slovenskej republike výskyt AIT až v 20% [31]. S výnimkou AIT sa ostatné autoimunity vyskytovali vzácne (0,4–0,8%).
Porovnaním oboch skupín pacientov (1 SM s inou autoimunitou, 2 SM bez inej autoimunity) sme nezistili signifikantné rozdiely vo veku, stupni funkčného zneschopnenia (EDSS) a klinickej forme sclerosis multiplex. Súčasný výskyt inej autoimunity teda nemá negatívny vplyv na priebeh sclerosis multiplex. V skupine 1 aj 2 prevládala RR forma ochorenia nad SP. U pacientov s PP formou SM sme v porovnaní s RR a SP nezistili žiaden prípad s ďalšou autoimunitou. Tento nález možno vysvetliť prevahou degeneratívnych procesov a nízkou zápalovou aktivitou u PP formy sclerosis multiplex. Prevalencia autoimunitných ochorení je vo všeobecnosti vyššia u žien ako mužov [32]. Preto neprekvapuje, že aj v našom súbore bola vyššia proporcia žien oproti mužom v skupine všetkých pacientov so SM (1 : 2,5), s ešte vyšším podielom v skupine s inou autoimunitou (1 : 6,7).
Väčšina (n = 212, tj. 91%) našich pacientov bola zaradená do dlhodobej liečby sclerosis multiplex niektorým z imunomodulačných a imunosupresívnych liekov. Vo všetkých prípadoch sa iné autoimunitné ochorenie zistilo pred diagnostikou a liečbou sclerosis multiplex. Nemôžeme preto potvrdiť názory niektorých autorov, že imunomodulačná liečba sclerosis multiplex interferónmi beta indukuje klinický rozvoj iného autoimunitného ochorenia, predovšetkým zápalov štítnej žľazy. Žiaden z našich pacientov nemal inú autoimunitnú chorobu zistenú počas imunomodulačnej liečby pre sclerosis multiplex [33,34].
Názory na vznik autoimunitného ochorenia štítnej žľazy u sclerosis multiplex nie sú jednotné. Karni et al vo svojej štúdii u žien so SM zistili v porovnaní s kontrolnou skupinou zvýšený výskyt autoimunitných ochorení štítnej žľazy, nezávisle od liečby SM [34]. U pacientov so SM bola nájdená vysoká incidencia anti mikrozomálnych tyroidálnych protilátok bez evidentných prejavov alterácie funkcie štítnej žľazy [35,36]. Podľa Rotondiho indukuje liečba interferónom beta 1b tvorbu tyroidálnych autoprotilátok v 42,8% prípadov, a v 12,5% sa objavujú aj klinické prejavy tyroidálnej dysfunkcie [14]. Opačné nálezy publikovali Durelli et al, ktorý nepotvrdili vyšší výskyt AIT u pacientov liečených interferónmi beta [37]. Pri dlhodobom sledovaní pacientov sa zistilo, že po prvom roku liečby interferónom beta 1b neboli popísané žiadne nové prípady dysfunkcie štítnej žľazy; riziko rozvoja ochorenia vo vzťahu k interferónovej liečbe je iba v priebehu prvého roku terapie, obzvlášť u pacientov s preexistujúcou tyreoiditídou. Ak sa u týchto pacientov vyvinula porucha funkcie štítnej žľazy, bola všeobecne prechodného charakteru a mierneho stupňa [13,38]. Tunbridge et al v súbore 353 pacientov so SM v porovnaní s 308 kontrolami zistili vyššiu prevalenciu autoimunitnej tyroiditídy iba u pacientov mužského pohlavia. U žien nebol signifikantný rozdiel oproti kontrolnej skupine [39]. Klinické a experimentálne pozorovania ukázali, že hormóny štítnej žľazy môžu zohrávať tak u zdravých jedincov, ako aj u sclerosis multiplex dôležitú úlohu v procese myelinizácie a remyelinizácie centrálneho nervového systému. Pozitívne ovplyvňujú remyelinizačnú schopnosť oligodendrocytových prekurzorov v ložiskách demyelinizácie. Neobjasnená zostáva úloha endokrinného systému v podmienkach rozvinutej sclerosis multiplex. V našej skupine pacientov s inou autoimunitou dominovala autoimunitná tyreoiditída (16 z 23 prípadov, 69%). Tieto dve ochorenia sa pravdepodobne v našich geografických podmienkach vyskytujú pomerne často u jednej osoby, alebo rodine, pre podobné kodeterminanty etiopatogenézy, ktorými sú genetická vnímavosť, vírusy, baktérie, geografická poloha, pohlavie a endokrínny systém.
S patologickou funkciou buniek TH sa spolu so sclerosis multiplex spájajú diabetes mellitus I. typu, autoimunitná tyreoiditída a reumatoidná artritída, z čoho by mohla zdanlivo vyplývať aj ich vyššia komorbidita [11]. Na druhej strane niektorí autori dospeli k záverom, že vyššia genetická predispozícia voči sclerosis multiplex tvorí relatívny ochranný faktor voči rozvoju autoimunitného diabetu [9]. Vychádzajú z predpokladu, že trieda 2 hlavného histokompatibilného systému, a alela HLA DR2, ktorá sa spája so sclerosis multiplex, je v populácii severnej Európy ochranným faktorom v rozvoji diabetes mellitus I. typu [40]. Aj v našom súbore sa koincidencia SM a diabetu I. typu vyskytla iba v jednom prípade (0,4%), podobne ako aj reumatoidná artridída.
Autoimunitná hemolytická anémia (AIHA) sa popisuje u pacientov so SM iba ojedinele. V literatúre sú prípady pacientov s AIHA a akútnou diseminovanou encefalomyelitídou (ADEM) v náväznosti na infekciu Cryptococcus neoformans a ojedinele i asociácia AIHA so sclerosis multiplex [41]. Koincidencia SM so zápalovým ochorením čreva je tiež zriedkavá [42,43]. V našom súbore mala jedna pacientka sclerosis multiplex a ulceróznu kolitídu (0,4%).
V klinickej praxi je potrebné si uvedomiť rozdiel medzi „autoimunitou“ a „autoimunitným ochorením“. Autoimunita, ako prítomnosť autoreaktívnych T a B lymfocytov a autoprotilátok, nemusí viesť ku klinickému rozvoju patologického procesu. Prechodná pozitivita alebo elevácia hladiny autoprotilátok sa môže vyskytnúť ako vedľajší efekt non autoimunitného fenoménu, napr. infekcie. To, či laboratórne prítomná autoimunita progreduje do obrazu klinického ochorenia, determinuje biochemická rovnováha vnútorného prostredia, aktivácia alebo pasivita cytokínovej siete a enviromentálne faktory [10,12]. U pacientov so SM sa v porovnaní s bežnou populáciou popisuje vyššia frekvencia výskytu orgánovo a non orgánovo špecifických autoprotilátok, ktoré nemusia viesť k rozvoju klinicky zjavného autoimunitného ochorenia [23,24,44]. Ide o jav generalizovanej imunitnej dysregulácie v tejto skupine chorých, ktorý nekorešponduje so zvýšeným výskytom rozvinutých autoimunitných ochorení.
MS like syndrómy predstavujú skupinu ochorení s postihnutím nervového systému, ktoré klinickým priebehom alebo nálezom demyelinizačných lézií v obraze magnetickej rezonancie mozgu alebo miechy môžu napodobňovať sclerosis multiplex. Ide prevažne o autoimunitné (antifosfolipidový syndróm, systémový lupus erythematodes, Behcetov syndróm, Sjogrenov syndróm) alebo chronické infekčné ochorenia (neuroborelióza, infekcia HIV), vaskulitídu CNS, alebo neurosarkoidózu. [45–49]. U niektorých MS like ochorení môžu byť detekované oligoklonálne pásy IgG v likvore [50]. Mikroangiopatie môžu viesť k vzniku demyelinizačných ischemických ložiskových lézií najčastejšie na pozadí hyperkoagulačného stavu, v rámci antifosfolipidového syndrómu [51,52]. U niektorých autoimunitných ochorení napodobňujúcich SM bol zistený tranzitórny výskyt sérovej pozitivity protilátok anti MOG IgG (MOG: Myelin Oligodendrocyte Glycoprotein) a anti MBP IgG (MBP: Myelin Basic Protein), ktoré sú nachádzané aj u pacientov so SM. V prípadoch sclerosis multiplex titre protilátok perzistujú a sú prítomné už vo včasnej fáze ochorenia [9,53]. MS like syndrómy môžu viesť k mylnej diagnóze sclerosis multiplex i následnej nesprávnej liečbe.
Cieľom našej práce nebola epidemiologická analýza výskytu SM s inými autoimunitami v porovnaní s bežnou populáciou nášho regiónu. Výsledky potvrdzujú možnosť súčasného výskytu SM s iným autoimunitným ochorením, pričom porovnaním s literárnymi údajmi predpokladáme, že tento výskyt nie je vyšší ako v bežnej populácii [9,32,46,54,55].
Záver
U pacientov so sclerosis multiplex sa môže súčasne vyskytovať iné autoimunitné ochorenie. V našom súbore chorých mala najvyššiu prevalenciu autoimunitná tyreoiditída. Prítomnosť iného autoimunitného ochorenia u pacientov so sclerosis multiplex neovplyvnila významne stupeň funkčného zneschopnenia v porovnaní so skupinou bez inej autoimunity. Výrazná prevaha komorbidity s inou autoimunitou bola u pacientov s relapso-remitujúcou formou ochorenia a ženského pohlavia. Vo všetkých prípadoch predchádzalo autoimunitné ochorenie vzniku a liečbe sclerosis multiplex. Naše nálezy sú porovnateľné s výsledkami iných prác [9,10,24].
MUDr. Jarmila Szilasiová, PhD.
Neurologická klinika
LF UPJŠ a FN L. Pasteura Košice
Trieda SNP 1
041 66 Košice
e-mail: jarmila.szilasiova@upjs.sk
Zdroje
1. Havrdová E. Roztroušená skleróza mozkomíšní. In: Havrdová et al. Neuroimunologie. Praha: Maxdorf 2001 : 231–269.
2. Herrero Herranz E, Pardo LA, Gold R, Linker RA. Pattern of axonal injury in murine myelin oligodendrocyte glycoprotein induced experimental autoimmune encephalomyelitis: implications for multiple sclerosis. Neurobiol Dis 2008; 30(2): 162–173.
3. Bjartmar C, Wujek JR, Trapp BD. Axonal loss in the pathology of MS: consequences for understanding the progressive phase of the disease. J Neurol Sci 2003; 206(2): 165–171.
4. Kleinschnitz C, Meuth SG, Kieseier BC, Wiendl H. Immunotherapeutic approaches in MS: update on pathophysiology and emerging agents or strategies 2006. Endocr Metab Immune Disord Drug Targets 2007; 7(1): 35–63.
5. Rovaris M, Gambini A, Gallo A, Falini A, Ghezzi A, Benedetti B et al. Axonal injury in early multiple sclerosis is irreversible and independent of the short term disease evolution. Neurology 2005; 65(10): 1626–1630.
6. Compston A. Revisiting the pathogenesis of multiple sclerosis revisited. The Int MS J 2003; 10(1): 29–31.
7. Hemmer B, Cepok S, Nessler S, Sommer N. Pathogenesis of multiple sclerosis: an update on immunology. Curr Opin Neurol 2002; 15(3): 227–231.
8. Martin R, McFarland HF. Immunological aspects of experimental allergic encephalomyelitis and multiple sclerosis. Crit Rev clin Lab Sci 1995; 32(2): 121–182.
9. Broadley SA, Deans J, Sawcer SJ, Clayton D, Compston DA. Autoimmune disease in first-degree relatives of patients with multiple sclerosis. A UK survey. Brain 2000; 123(6): 1102–1111.
10. Niwa Y, Sakane T, Kanoh T, Shichijo S, Wiederhold MD, Yokoyama MM. Transient autoantibodies with elevated complement levels in common viral diseases. J Clin Lab Immunol 1984; 13(4): 183–188.
11. Somers EC, Thomas SL, Smeeth L, Hall AJ. Autoimmune diseases co-occuring within individuals and within families. a systematic review. Epidemiology 2006; 17(2): 202–217.
12. Hansen KE, Arnason J, Bridges AJ. Autoantibodies and common viral illness. Semin Arthritis Rheum 1998; 27(5): 263–271.
13. Niederwieser G, Buchinger W, Bonelli R, Berghold A, Reisecker F, Költringer P et al. Prevalence of autoimmune thyroiditis and non immune thyroid disease in multiple sclerosis. J Neurol 2003; 250(6): 672–675.
14. Rotondi M, Oliviero A, Profice P, Mone CM, Biondi B, Del Buono A et al. Occurrence of thyroid autoimmunity and dysfunction thougout a nine-month follow up in patients undergoing interferon beta therapy for multiple sclerosis. J Endocrinol Invest 1998; 21(11): 748–752.
15. McDonald WI, Compston A, Edan G, Goodkin D, Hantung HP, Lublin FD et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001; 50(1): 121–127.
16. Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the „McDonald Criteria“. Ann Neurol 2005; 58(6): 840–846.
17. Kurtzke RF. Rating neurologic impairmnent in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983; 33(11): 1444–1452.
18. Lublin F, Reingold SC. Defining the clinical course of multiple sclerosis. Neurology 1996; 46(6): 907–911.
19. Babbe H, Roers A, Waisman A, Lassmann H, Goebels N, Hohlfeld R et al. Clonal expansion of CD8(+) T cells dominate the T cell infiltrate in active multiple sclerosis lesions as shown by micromanipulation and single cell polymerase chain reaction. J Exp Med 2000; 192(3): 393–404.
20. Henderson RD, Bain CJ, Pender MP. The occurrence of autoimmune diseases in patients with multiple sclerosis and their families. J Clin Neurosci 2000; 7(5): 434–437.
21. Rudick RA. Evolving concepts in the pathogenesis of multiple sclerosis and their therapeutic implications. J Neuroophthalmol 2001; 21(4): 279–283.
22. Utz U, McFarland HF. The role of T cells in multiple sclerosis: implications for therapies targeting the T cell receptor. J Neuropathol Exp Neurol 1994, 53(4): 351–358.
23. De Keyser. Autoimmunity in multiple sclerosis. Neurology 1988; 38(3): 371–374.
24. Seyfert S, Klapps P, Meisel C, Fischer T, Junghan U. Multiple sclerosis and other immunologic diseases. Acta Neurol Scand 1990; 81(1): 38–42.
25. Wynn DR, Rodriguez M, O’Fallon M, Kurland LT. A reappraisal of the epidemiology of multiple sclerosis in Olmsted County, Minnesota. Neurology 1990; 40(5): 780–786.
26. Heward J, Gough SC. Genetic susceptibility to the development of autoimmune disease. Clin Sci (Lond) 1997; 93(6): 479–491.
27. Kastrukoff L, Morgan N, Zecchini D, White R, Petkau AJ, Satoh J et al. A role for natural killer cells in the immunopathogenesis of multiple sclerosis. J Neuroimmunol 1998; 86(2): 123–133.
28. Wertman E, Zilber N, Abramsky O. An association between MS and type 1 diabetes mellitus. J Neurol 1992; 239(1): 43–45.
29. Rang EH, Brooke BN, Hermon-Taylor J. Association of ulcerative colitis with multiple sclerosis. Lancet 1982; 2(8297): 555.
30. Cendrowski W. Multiple sclerosis and psoriasis. Wiad Lek 1989; 42(9): 575–578.
31. Hnilica P, Ďurechová E, Podoba J, Rešetková E. Occurrence of diffuse lymphoid thyroiditis in goitres during long term iodine prophylaxis in our area. In: Ulrich FE, Schneyer U (eds). Endokrinologie interdisziplinär. Halle-Wittenberg: Martin Luther-Univ 1988 : 39–41.
32. Jacobson DL, Gange SJ, Rose NR, Graham NM. Epidemiology and estimated population burden of selected autoimmune disease in the United States. Clin Immunol Immunopathol 1997; 84(3): 223–243.
33. Sládková V, Mareš J, Luběnová B, Kollárová K, Opavský R, Kaňovský P. Léky navozený systémový lupus erythematodes při terapii inteferonem beta 1b – kazuistika. Cesk Slov Neurol N 2008; 71/104(4): 487–489.
34. Karni A, Abramsky O. Association of MS with thyroid disorders. Neurology 1999; 53(4): 883–885.
35. Annunziata P, Lore‘ F, Venturini E, Morana P, Guarino E, Borghi S et al. Early synthesis and correlation of serum anti thyroid antibodies with clinical parameters in multiple sclerosis. J Neurol Sci 1999; 168(1): 32–36.
36. Kiessling WR, Pflughaupt KW. Antithyroid antibodies in multiple sclerosis. Lancet 1980; 1(8158): 41.
37. Durelli L, Ferrero B, Oggero A, Verdun E, Ghezzi A, Montanari E, Zaffaroni M. Liver and thyroid function and autoimmunity during interferon beta 1b treatment for MS. Neurology 2000; 57 : 1363–1370.
38. Monzani F, Caraccio N, Casolaro A, Lombardo F, Moscato G, Murri L et al. Long term interferon beta 1b therapy for MS: is routine thyroid assessment always useful? Neurology 2000; 55(4): 549–552.
39. Tunbridge WM, Vanderpump MP. Population screening for autoimmune thyroid disease. Endocrinol Metab Clin North Am 2000; 29(2): 239–253.
40. Noble JA, Valdes AM, Cook M, Klitz W, Thomson G, Erlich HA. The role of HLA class II genes in insulin dependent diabetes mellitus: molecular analysis of 180 Caucasian, multiplex families. Am J Hum Genet 1996; 59(5): 1134–1148.
41. Brinar VV, Petelin Z, Brinar M, Djaković V, Zadro I, Vranjes D. CNS demyelination in autoimmune diseases. Clin Neurol Neurosurg 2006; 108(3): 318–326.
42. Kimura K, Hunter SF, Thollander MS, Loftus EV jr, Melton LJ jr, O‘Brien PC et al. Concurrence of inflammatory bowel disease and multiple sclerosis. Mayo Clin Proc 2000; 75(8): 802–806.
43. Sadovnick A, Paty D, Yannakoulias G. Concurrence of multiple sclerosis and inflammatory bowel disease. N Engl J Med 1989; 321(11): 762–763.
44. Collard RC, Koehler RP, Mattson DH. Frequency and significance of antinuclear antibodies in multiple sclerosis. Neurology 1997; 49(3): 857–861.
45. Ijdo JW, Conti Kelly AM, Greco P, Abedi M, Amos M, Provenzale JM et al. Anti phospholipid antibodies in patients with multiple sclerosis and MS like illnesses: MS or APS? Lupus 1999; 8(2): 109–115.
46. Scott TF. Diseases that mimic multiple sclerosis. Postgrad Med 1991; 89(8): 187–191.
47. Sommer H, Müller K, Kinnunen E. Myasthenia gravis associated with multiple sclerosis. Epidemiological survey and immunological findings. J Neurol Sci 1989; 89(1): 37–48.
48. Alexander EL, Malinow K, Lejewski JE, Jerdan MS, Provost TT, Alexander GE. Primary Sjörgen’s syndrome with central nervous system disease mimicking multiple sclerosis. Ann Intern Med 1986; 104(3): 323–330.
49. Coates T, Slavotinek JP, Rischmueller M, Schultz D, Anderson C, Dellamelva M et al. Cerebral white matter lesions in primary Sjogren’s syndrome: a controlled study. J Rheumatol 1999; 26(6):1301–1305.
50. McLean BN, Miller DH, Thompson EJ. Oligoclonal banding of IgG in CSF, blood-brain barrier function, and MRI findings in patients with sarcoidosis, systemic lupus erythematosus, and Behçet’s disease involving the nervous system. J Neurol Neurosurg Psychiatry 1995; 58(5): 548–554.
51. Scott F, Hess D, Brillman J. Antiphospholipid antibody syndrome mimicking multiple sclerosis clinically and by magnetic resonance imaging. Arch Intern Med 1994; 154(8): 917–920.
52. Szilasiová J, Klímová E, Szilasiová A, Čiderová A, Rosocha J. Neurologické prejavy u chorých s antifosfolipidovými protilátkami. Cesk Slov Neurol N 2001; 64/97(1): 31–35.
53. Reindl M, Linington C, Brehm U, Egg R, Dilitz E, Deisenhammer F et al. Antibodies against the myelin oligodendrocyte glycoprotein and the myelin basic protein in multiple sclerosis and other neurological diseases: a comparative study. Brain 1999; 122(11): 2047–2056.
54. Midgard R, Grønning M, Riise T, Kvåle G, Nyland H. Multiple sclerosis and chronic inflammatory diseases. A case-control study. Acta Neurol Scand 1996; 93(5): 322–328.
55. Klímová E. Sclerosis multiplex a autoimunitné ochorenia. Neurol pre prax 2005; 6(5): 255–257.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2009 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
-
Intraspinální lumbální synovi ální cysty I.
Přehled problematiky - Diferenciální diagnostika neuroakantocytóz
- Detekce mikroembolizací pomocí transkraniální dopplerovské sonografie
- Použití titanových a PEEKových implantátů při ALIF stand alone u degenerativního onemocnění lumbosakrální páteře – prospektivní studie
- První zkušenosti s použitím intraoperační MR při resekcích adenomů hypofýzy
- Hereditární neuropatie
- Sclerosis multiplex a komorbidita s iným a uto imunitným ochorením
- Ependymální „čerchování“, typický znak u pacientů s roztroušenou sklerózou mozkomíšní
- Intraspinální lumbální synoviální cysty II – chirurgická léčba 13 nemocných
- Dermatomyozitida asociovaná s mnohočetným myelomem a amyloidózou – kazuistika
- Trombotická trombocytopenická purpura (TTP) u pacientky s roztroušenou sklerózou – kazuistika
- Virtuální pitva pomocí magnetické rezonance – kazuistika
- Možnost predikce průběhu herpetické encefalitidy pomocí magnetické rezonance – kazuistika
- Webové okénko
- Analýza dat v neurologii
- Zpráva z 36. kongresu ISPN
-
Intraspinální lumbální synovi ální cysty I.
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hereditární neuropatie
- Trombotická trombocytopenická purpura (TTP) u pacientky s roztroušenou sklerózou – kazuistika
- Možnost predikce průběhu herpetické encefalitidy pomocí magnetické rezonance – kazuistika
-
Intraspinální lumbální synovi ální cysty I.
Přehled problematiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



