-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Monitorování mozkové oxygenace
Brain Tissue Oxygen Monitoring
This review refers to brain tissue oxygen monitoring as part of multimodal monitoring completing current monitoring of intracranial pressure and jugular oxymetry. Brain tissue oxygen monitoring brings additional data about the condition of the brain. The pathophysiology of the brain injury, the mechanisms of origin of secondary brain injury including disorders of oxygenation and common principles of treatment and prevention of secondary brain injury are explained in the article. Differences between global and local monitoring of oxygenation are described. The clinical part describes the application and placement of the sensor into the brain tissue and the options for specific therapeutic intervention. Also the technical principles of the monitoring system, of the determination of the normal and pathologic values of brain tissue oxygen and the interpretation of the measured oxygen values are explained. Brain tissue oxygen monitoring can be useful in the treatment of brain trauma, in spontaneous subarachnoid haemorrhage and in brain aneurysma surgery.
Key words:
brain tissue oxygenation – multimodal monitoring – traumatic brain injury – secondary brain injury
Autoři: M. Filaun 1; M. Horáček 1; J. Steindler 2; L. Pekař 2; K. Cvachovec 1
Působiště autorů: Klinika anesteziologie a resuscitace 2. LF UK a IPVZ, FN v Motole, Praha 1; Oddělení neurochirurgie, FN v Motole, Praha 2
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(6): 657-663
Kategorie: Přehledný referát
Souhrn
Práce pojednává o měření parci álního tlaku kyslíku v mozkové tkáni (pbtO2) – mozková oxygenace – jako so učásti multimodálního monitorování CNS doplňujícího běžně po užívané metody měření nitrolebního tlaku a sledování jugulární oxymetri e. Monitorování mozkové oxygenace přináší další údaje o stavu CNS. V článku je vysvětlována patofyzi ologi e poranění mozku, mechanizmy vzniku sekundárního poškození zahrnující i poruchy oxygenace, uvedeny jso u obecné principy prevence a léčby sekundárního poškození a jso u zdůrazňovány rozdíly mezi monitorováním globální a lokální oxygenace mozku. V klinické části je popisován způsob zavedení čidla, volba jeho umístění a konkrétní možnosti ovlivnění mozkové oxygenace. Je objasňován též technický princip čidla, jeho typy a vývoj. Je uvedeno, jak byly stanoveny normální hodnoty pbtO2, hodnoty ischemického prahu a jak interpretovat naměřené hodnoty. Monitorování mozkové oxygenace může být přínosem pro léčbu sekundárního poškození u tra umat, netra umatických subarachno idálních krvácení a v chirurgii cévních mozkových ane uryzmat.
Klíčová slova:
oxygenace mozkové tkáně – multimodální monitorování – kraniocerebrální poranění – sekundární poškození mozkuÚvod
Tra umatické poranění mozku je nejčastější příčino u úmrtí dětí a mladých mužů do 35 let a nejčastější příčino u trvalých následků vedo ucích k invaliditě po tra umatu. V České republice je každoročně hospitalizováno asi 36 000 osob s tra umatickým poraněním mozku, z nichž více než 5 % má závažné trvalé následky [1]. Jeho léčba je po uze omezeně účinná a při nutnosti intenzivní péče a dlo uhodobé rehabilitace drahá, přičemž její výsledky jso u mnohdy zklamáním. Tra umatické poranění mozku je tudíž spojeno s nesmírným utrpením paci entů, jejich rodin i celé společnosti.
Tra umatické poranění mozku je výsledkem primárního bi omechanického poškození v okamžiku úrazu a následného sekundárního poranění vyvolaného aktivací nejrůznějších patofyzi ologických dějů, které primární poranění umocňují [2]. Hlavním úkolem léčby tra umatického poranění mozku je minimalizovat sekundární poranění. Proto je nutné včas rozpoznat události, které sekundární poranění spo uštějí.
K tomu slo uží klinické sledování a přístrojové monitorování celkového stavu paci enta, jakož i stavu a funkce jeho centrálního nervového systému (CNS). Technický pokrok spolu s lepším chápáním patofyzi ologických dějů probíhajících u tra umatického poranění mozku vedl k tzv. multimodálnímu minitorování, tj. so učasnému po užití více různých monitorovacích technik s cílem poso udit struktury, perfuzi, oxygenaci a metabolizmus CNS. Patří k němu především již delší dobu na mnoha pracovištích (75 %) [3] běžně po užívané měření nitrolebního tlaku spolu s hodnocením mozkového perfuzního tlaku a monitorování saturace hemoglobinu kyslíkem v žilní krvi v jugulárním bulbu. V poslední době se mimoto objevily ještě další metody dostupné přímo u lůžka, jako jso u transkrani ální dopplerovské nebo laserové vyšetřování průtoku krve, mozková mikrodi alýza, vyšetřování evokovaných potenci álů, kontinu ální elektroencefalografické monitorování nebo blízko - infračervená spektroskopi e (NIRS, Ne ar-Infrared Spectroscopy) či měření parci álního tlaku kyslíku v mozkové tkáni (pbtO2).
Účelem tohoto přehledného článku je poskytno ut nové informace o monitorování mozkové oxygenace měřením pbtO2, protože tato metoda v so učasné době vstupuje do každodenní klinické praxe poté, co se ukázalo, že ani dostatečný mozkový perfuzní tlak nezaručuje příznivý výsledek.
Patofyzi ologi e poranění mozku a role monitorování
Výsledek tra umatického poranění mozku je určen velikostí primárního bi omechanického poškození vzniklého v okamžiku úrazu a účinkem sekundárního poškození rozvíjejícího se v dalším průběhu. Primární poškození mozku je trvalé a na rozdíl od sekundárního poškození ho nelze léčbo u – alespoň doposud – nijak ovlivnit. Sekundární poškození mozku je velmi časté a lze ho prokázat až u 91 % paci entů v intenzivní péči [4].
Primární poranění mozku je důsledkem mechanických sil působících v okamžiku úrazu. Projevuje se různě velkým difuzním i ložiskovým poškozením mozku. Difuzní poškození narušuje vlastnosti membrán nervových a gli ových buněk i endotelu mozkových cév, čímž se mění elektrofyzi ologické vlastnosti vzrušivých buněk, ale i složení vnitřního prostředí mozku. V krajním případě v membránách vznikají póry umožňující vylití hydrolytických enzymů. Výsledkem ložiskového poškození jso u různě velké oblasti zhmoždění a krvácení.
Sekundární poškození mozku jso u způsobena mnoha různými ději vedo ucími ke zhoršení primárního poškození. Nesporné je mimo jiné přetížení ne uronů sodíkem a vápníkem, poškození účinkem volných kyslíkových radikálů (např. při ischemii a reperfuzi), excitačních aminokyselin (glutamát, N - metyl-D - aspartát) nebo nerovnováho u v působení ne urotransmiterů vůbec, zánětem, prote ázami (kaspázy, kalpainy), lipázami či nukle ázami, ale podílet se moho u i další mechanizmy. V so učasné době není vůbec jasné, jak a které z těchto dějů a v jakém odstupu od úrazu se uplatňují u jednotlivých paci entů [2].
Za hlavní příčinu sekundárního poškození mozku se považuje hypoxi e (nedostatek kyslíku) a ischemi e (nedostatečný krevní průtok) [5], přesněji řečeno nepoměr mezi dodávko u a potřebo u kyslíku v nervové buňce. Tento nepoměr může být způsoben nedostatečno u dodávko u kyslíku, nebo naopak jeho zvýšeno u potřebo u. Příčino u nedostatečné dodávky kyslíku může být především pokles perfuze mozku vyvolaný nitrolební hypertenzí a/ nebo jde o důsledek hypovolemi e, selhání srdce, anémi e apod. Zvýšeno u potřebu kyslíku navozují hypertermi e, sepse, křeče, excitotoxicita. Na sekundárním poškození se moho u rovněž podílet i kolísání glykemi e (hyper ‑ i hypoglykemi e), poruchy acidobazické rovnováhy a i ontů nebo osmolality [6 – 9].
Citlivost mozku vůči nedostatku kyslíku a glukózy je způsobena tím, že mozkové buňky nemají žádné zásoby těchto substrátů, takže jso u odkázány na jejich nepřetržitý přísun krví. Zajištění rovnováhy mezi dodávko u a spotřebo u kyslíku je proto spolu se zajištěním a udržováním přiměřeného složení vnitřního prostředí (home ostázy) hlavním cílem všech léčebných opatření u paci enta se závažným tra umatickým poškozením mozku v intenzivní péči [10 – 13].
Dodávka kyslíku do mozku se posuzuje podle obvyklých fyzi ologických parametrů – srdeční výdej, koncentrace hemoglobinu a jeho saturace kyslíkem v arteri ální a žilní krvi. Dostatečná celotělová dodávka kyslíku však nezaručuje dostatek kyslíku pro mozek, protože perfuzi mozku může snížit např. zvýšený nitrolební tlak. Využití kyslíku v mozku může jistě změnit funkceschopnost mitochondri í. Standardní metody monitorování ne umožňují vždy detekovat ischemii mozku, a proto k nim přibývají další metody zaměřené cíleně na mozek.
O dodávce kyslíku do mozku čili o stavu mozkové oxygenace informují u lůžka jugulární oxymetri e, blízko - infračervená spektrometri e (NIRS) a měření parci álního tlaku kyslíku v mozkové tkáni (pbtO2), kdežto ve výzkumu se po užívají sofistikované metody jako pozitronová emisní tomografi e (PET) či funkční magnetická rezonance závislá na obsahu kyslíku v krvi (Blo od - Oxygen - Level - Dependent functi onal Magnetic Resonance Imaging [BOLD - fMRI]).
Nejrozšířenější metodo u využívano u u tra umatického poranění mozku je jugulární oxymetri e, při níž se v jugulárním bulbu kontinu álně měří saturace hemoglobinu kyslíkem (SjvO2) v žilní krvi odtékající z mozku. Její hodnota ukazuje velikost extrakce kyslíku v dutině lební, normální rozmezí je 55 – 71 %. Tato metoda však vzhledem k anatomii cévního zásobení mozku ne umožňuje odlišit ani stranové rozdíly v oxygenaci mezi oběma hemisférami, a proto se považuje za metodu monitorování globální oxygenace mozku. Využívá se především k titraci terape utické hyperventilace.
Měření parci álního tlaku kyslíku v mozkové tkáni na rozdíl od jugulární oxymetri e poskytuje informace o stavu mozkové tkáně v místě léze nebo v jejím okolí či ve zdravé tkáni podle toho, kam je čidlo zavedeno, takže jde o metodu monitorování lokální oxygenace.
Princip
Parci ální tlak kyslíku v mozkové tkáni se nejčastěji měří dvěma hlavními metodami: polarograficky a spektrofotometricky. Jediný v so učasné době běžně dostupný systém Licox® (Integra Ne urosci ences, Plainsboro, NJ, USA) využívá Clarkovu polarograficko u elektrodu skládající se z Ag/ AgCl anody a zlaté nebo platinové katody umístěných v roztoku chloridu draselného. Kyslík difunduje přes propustno u membránu ke katodě, na níž se redukuje na vodu. Měří se velikost pro udu protékajícího mezi anodo u a katodo u, která je při vhodně zvoleném konstantním napětí line árně přímo úměrná koncentraci kyslíku. Systém je doplněn termočlánkem k měření teploty mozku, která je důležitá při kalibraci systému i pro vlastní monitorování. U systému Licox je třeba počítat s dobo u nutno u pro ustálení čidla, která činí tři hod.
Na principu spektrofotometri e byl založen dříve užívaný systém Ne urotrend (Codman & Shurtleff, Inc., Raynham, MA,USA) se čtyřmi senzory měřícími so učasně parci ální tlaky kyslíku a oxidu uhličitého v mozkové tkáni, pH a teplotu. Byl odvozen od systému Paratrend určeného k intraarteri álnímu kontinu álnímu monitorování krevních plynů v intenzivní péči. Paratrend i Ne urotrend byly po užity v řadě studi í mozkové oxygenace. Spektrofotometrický princip využívá rovněž nejnovější senzor Ne urovent PTO (Ra umedic AG, Münchberg, Německo) umožňující také měřit so učasně pbtO2, nitrolební tlak i teplotu.
Měřením jso u získávány hodnoty parci álního tlaku kyslíku v mozkové tkáni. Doposud není zcela jasné, které faktory tuto hodnotu určují. Základním předpokladem je, že nízké hodnoty pbtO2 jso u ukazatelem ischemi e, kdežto vysoké hodnoty potvrzují dostatečno u dodávku kyslíku do mozku. Hodnotu pbtO2 totiž ovlivňují faktory jako mozkový krevní průtok, dodávka kyslíku, obsah kyslíku v tepenné a žilní krvi či intenzita mozkového metabolizmu, teplota a další. Rosenthal et al nedávno prokázali, že nejtěsnější vztah je mezi pbtO2 a so učinem průtoku krve mozkem a arteri ovenózním rozdílem parci álních tlaků kyslíku [14]. Tento parametr (CBF × AVTO2) odráží množství kyslíku difundujícího z plazmy přes určitý objem mozkové tkáně za jednotku času (objem mozku, který je čidlo schopno postihno ut), nikoliv množství kyslíku uvolněného z hemoglobinu. Nízké hodnoty pbtO2 jso u tedy s největší pravděpodobností způsobeny buď nízko u perfuzí mozku a/ nebo nízkým parci álním tlakem kyslíku v arterii, což ukazuje na důležitost nastavení ventilace.
Klinická aplikace
A. Zavedení
So učasné monitorování hodnot ICP a pbtO2 nečiní problém, protože oba dostupné systémy jso u konstruovány tak, že všechna čidla obsáhne jeden fixační šro ub, který je zaveden jedním trepanačním otvorem. Čidlo se zavádí obvyklým ne urochirurgickým postupem analogicky jako čidlo na měření nitrolebního tlaku.
K zavedení slo uží jednorázové sety obsahující ruční vrtačku, vrtáček s průměrem 5 mm a fixační šro ub. Po určení konkrétní intraparenchymální lokalizace čidla podle CT nálezu se provádí malý kožní řez (10 mm) a trepanační návrt. Do kalvy se poté našro ubuje samořezný fixační šro ub, jímž se zavádějí příslušná čidla. Celý systém se na závěr zafixuje.
Čidlo se obvykle zavádí do bílé hmoty mozkové. Korektní zavedení a funkčnost čidla je vhodné ověřit jednoduchým testem – zvýšením nabídky kyslíku ve vdechované směsi plynů. Správně pracující čidlo by mělo ukázat zvýšení hodnot pbtO2.
Je nutná pečlivá volba umístění monitorovacího čidla. V podstatě se nabízejí tři možnosti ve vztahu k patologickému ložisku: přímo do patologického ložiska, do těsného okolí ložiska (do tzv. penumbry) nebo do zdravé tkáně.
Při zavedení do patologického ložiska (kontuze, ischemi e, hemoragi e) získáváme hodnoty kyslíku z poškozené či zničené tkáně, ty jso u nízké a terape uticky je nelze ovlivnit. Při terape utické snaze tyto hodnoty zvýšit je možné se dostat do oblasti přehnané dodávky kyslíku do okolní zdravé tkáně, což není zcela bez nebezpečí vedlejších negativních účinků. Toto ložisko má malo u šanci se vrátit do výchozího stavu před tra umatem. Z těchto důvodů se toto umístění jeví jako nejméně přínosné.
Ide ální lokalizací je tzv. penumbra, což je okolní poškozená oblast s dosud vitální mozkovo u tkání. Zde je největší riziko sekundárních ischemických změn. Problém je ale obtížná lokalizace této zóny. Toto umožňují nové metody pro zobrazování mozkové perfuze, jako je perfuzní CT (pCT) a zobrazení cévního zásobení pomocí CT angi ografi e (CTA) [15].
Třetí možností je monitorování ve zdravé nepoškozené tkáni. Při jednostranném poškození se čidlo zavede do nepoškozené netra umatizované hemisféry.
Hodnoty pbtO2 naměřené v nepoškozené tkáni také nemusí korelovat s obvyklými terape utickými postupy. Nízké hodnoty pbtO2 moho u být naměřeny při normálním ICP, zvýšení pbtO2 se ne objeví při poklesu ICP po podání manitolu, a i při zvýšeném ICP moho u být normální hodnoty pbtO2 [16,17]. Ki ening et al ve své práci uvádějí korelaci mezi perfuzním tlakem (CPP) a hodnoto u tkáňového kyslíku. Při CPP pod 60 mmHg dochází k poklesu pbtO2 a při hodnotách nad 60 mmHg vykazují náležito u oxygenaci. Při zvýšeném ICP ale bývají hodnoty pbtO2 alterovány [18]. Čidlo měří hodnoty v poměrně malém okrsku mozkové tkáně, a proto nelze najisto říci, že tyto hodnoty reprezentují celo u ostatní nepoškozeno u mozkovo u tkáň. Může ale časně detekovat potenci ální inzult proti zdravé tkáni.
B. Faktory ovlivňující pbtO2a možnosti terapi e
Je celá řada faktorů, která ovlivňuje hodnoty pbtO2. Přitom tyto faktory vedo u jednak k různým hodnotám mezi jednotlivými paci enty a jednak k rozdílným hodnotám získaným u jednoho paci enta.
Hypoxi e
Arteri ální hypoxi e je nejběžnější příčino u poklesu pbtO2 a vyžaduje okamžitá opatření v terapii [16].
Mozkový perfuzní tlak (CPP)
Pokles středního arteri álního tlaku (MAP) a následně mozkového perfuzního tlaku (CPP) vede k poklesu pbtO2. Přitom nebyla pozorována jasná korelace mezi hodnoto u CPP, ICP na jedné straně a hodnoto u pbtO2 na druhé straně u většiny paci entů s mozkovým tra umatem [19,20]. Pozorování této závislosti během operací mozkových ane uryzmat ukazuje ale jasno u korelaci při poklesu MAP pod 60 – 70 mmHg. Jako vysvětlení se předpokládá intaktní mozková a utoregulace při MAP nad tyto hodnoty [21].
Hypokapni e
Hyperventilace s poklesem pCO2 vede u většiny paci entů s mozkovým tra umatem, u kterých byla prováděna pozitronová emisní tomografi e (PET), k poklesu pbtO2. Přitom ale nemusí dojít k detekci poklesu SjvO2, zřejmě z důvodu technických možností systému [22]. To podporuje dřívější studi e o nepříznivých účincích hyperventilace na mozkovo u oxygenaci [23].
Průtok krve mozkem (CBF)
Dobrá korelace mezi regi onálním CBF a pbtO2 byla nalezena u mozkových tra umat při po užití xenonového CT skenu. Toto bylo počítáno na oblast 20 – 30 mm2, přitom hodnoty CBF pod ischemickým prahem 18 ml/ 100 g/ min byly spojeny s hodnoto u pbtO2 pod 26 mmHg [24]. Nízká korelace ale byla nalezena mezi pbtO2a regi onálním CBF při po užití pozitronové emisní tomografi e [22].
Metabolická aktivita mozku (CMR)
Existuje celá řada látek, které ovlivňují, resp. snižují EEG aktivitu mozku a následně spotřebu kyslíku, jako etomidat či desfluran. Etomidat například snižuje hodnotu pbtO2, desfluran zvyšuje hodnotu pbtO2. Intrepretace tohoto efektu je obtížná pro přítomnost různých mechanizmů účinku.
Hyperoxi e
Zvýšením inspirační frakce kyslíku (FiO2) lze zvýšit pbtO2. Není ale jasné, zda zvýšená nabídka kyslíku může působit ne uroprotektivně. Van Santbrink et al [19] ve své práci uvádějí, že paci enti s příznivým výsledkem léčby měli první posttra umatický den nižší re aktivitu na zvýšení dodávky kyslíku než paci enti s nepříznivým výsledkem léčby. Toto zjištění je vysvětlováno porucho u a utoregulace v počáteční době po těžkém tra umatu. Následné metabolické efekty byly zko umány v práci Menzela et al [24] s využitím mozkové mikrodi alýzy. Nalezena byla dobrá korelace mezi zvýšením pbtO2 a sníženo u produkcí laktátu. Hyperoxi e by tedy snižovala úroveň anaerobního metabolizmu.
Hlo ubka zavedeného čidla
Hladina pbtO2 se mění s hlo ubko u zavedení čidla [25]. Není ale zcela jasné, zda to je závislé na umístění čidla v bílé či šedé hmotě. Pravděpodobná je so uvislost se vzdáleností mezi čidlem a mozkovo u kapiláro u. Pro porovnání dat mezi paci enty by bylo vhodné po užít standardní hlo ubku zavedení a čidlo s co nejdelší membráno u citlivo u na kyslík.
So uhrnně lze říci, že existuje řada faktorů, které ovlivňují jednotlivá měření ptbO2 a činí tak interpretaci samotných hodnot pbtO2 obtížno u. Je třeba počítat i s možností rozdílu naměřených hodnot v závislosti na typu monitoru [26,27]. Jako so učást multimodálního monitorování ale přináší další užitečno u informaci pro terapii. V tab. 1 je krátký přehled nejčastějších příčin změn hodnot pbtO2 ori entovaný na klinicko u praxi [28].
Tab. 1. Příčiny změn hodnot p<sub>bt</sub>O<sub>2</sub> (terapeutická opatření jsou uvedena v závorce). 
Interpretace naměřených hodnot
Stanovení normálních hodnot pbtO2 je určitý problém, neboť nejso u k dispozici data fyzi ologických hodnot zdravého lidského mozku. Normální a patologické hodnoty byly stanoveny v pracích řady a utorů. Tyto práce vycházely jednak ze závislosti mezi pbtO2 v akutním stadi u onemocnění a následným klinickým stavem, hodnoceným podle Glasgow Outcome Scale (GOS), a jednak z experimentu na zvířeti. Přehledně jso u zobrazeny v tab. 2 [19,23,29 – 34].
Tab. 2. Přehled prvních prací, které vedly ke stanovení rozpětí normálních hodnot p<sub>bt</sub>O<sub>2</sub>. 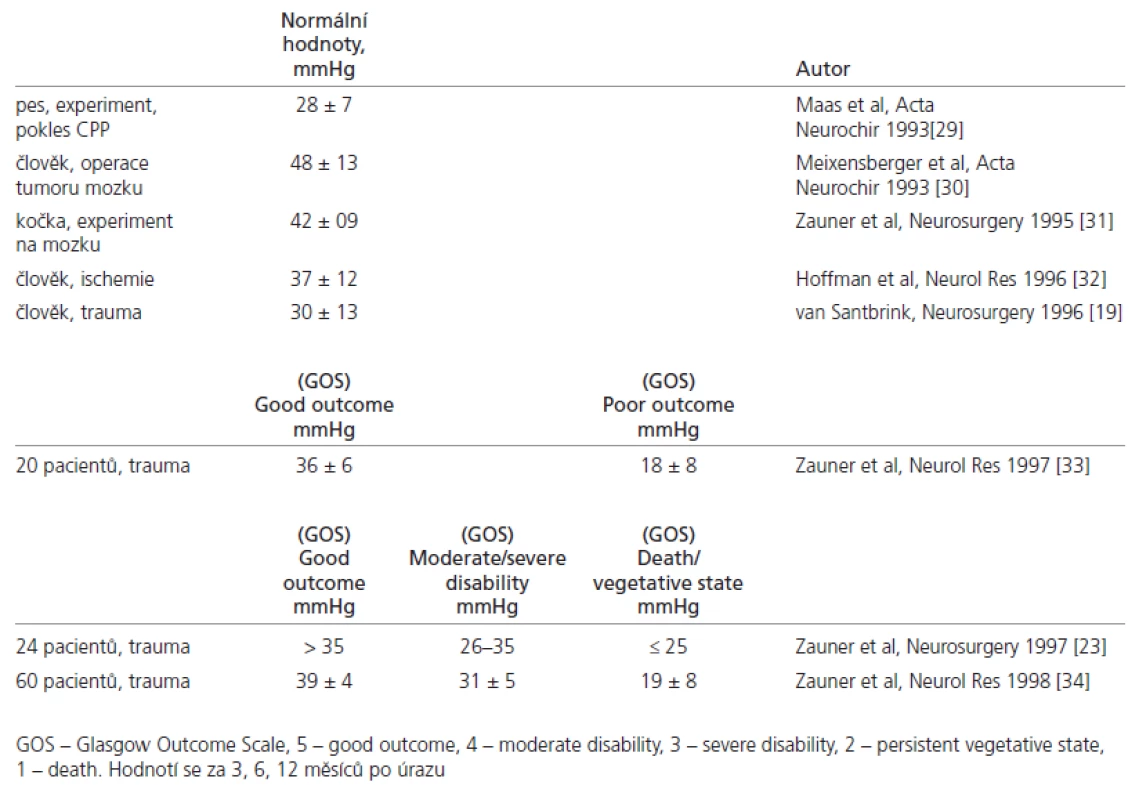
Stanovení hodnot ischemického prahu mozkových buněk vyplynulo rovněž z mnoha prací. Ty lze rozdělit na tři základní oblasti. Za prvé je to experiment s uzavřením a. cerebri medi a na zvířeti (kočce) [30,35]. Za druhé sledování regi onálního průtoku krve mozkem (RCBF) u paci entů s mozkovým poraněním [36]. Třetí možnost je ori entovaná na zotavení paci entů sledováním Glasgow Outcome Scale (GOS) za šest měsíců [23,37]. Další práce vyhodnocovaly regresní analýzo u vztah mezi ischemickým prahem s hodnoto u 18 ml/ 100 g/ min a pbtO2, přičemž jeho hodnota byla 22 torr [38 – 41]. Na základě těchto prací vychází ischemický práh pro mozkovo u tkáň v hodnotách mezi 19 – 23 mmHg. Po užitým monitorovacím systémem byl Paratrend 7 (technické detaily viz předcházející text).
Při otázce stanovení ischemického prahu pro mozek se ve své práci Doppenberg et al [37] zmiňují o dalším faktu. Dva dostupné systémy monitorování pbtO2 vykazovaly lehce rozdílné hodnoty. Doppenbergem užívaný systém Paratrend vykazoval hodnoty prahu vyšší přibližně o hodnotu 7 – 10 mmHg než publikované práce s po užitým systémem Licox. Nabízí se několik vysvětlení. Tyto práce měly jiné tzv. end po ints terapi e či umístění čidel bylo rozdílné (bílá, šedá hmota mozková). Oba systémy přitom užívají polarograficko u Clarkovu elektrodu. Tato otázka není zatím zcela uzavřena [18,19,37,42,43]. Valadka et al ve své práci uvádějí hodnotu ischemického prahu 5 – 10 mmHg. Po užit byl přitom systém Licox [44].
Analogicky jako změny ICP, tak i hodnoty tkáňového kyslíku vykazují v průběhu monitorování určité výkyvy. Pro další osud nemocného nejso u významné jenom trvale zvýšené hodnoty, ale také epizody se sníženo u hodnoto u pbtO2. Van den Brink et al ve své práci uvádějí, že epizody v průběhu prvních 24 hod po úrazu trvající 30 min s hodnoto u pbtO2 pod 5 mmHg vykazují potenci ální nebezpečí 50% úmrtnosti. Epizody trvající 1 hod a 45 min. s hodnoto u pod 10 mmHg vykazují úmrtnost rovněž 50%. Epizody trvající 4 hod s hodnoto u pod 15 mmHg mají také úmrtnost 50% [44,45]. Bardt et al uvádějí, že epizody s hodnoto u pbtO2 pod 10 mmHg po dobu méně než 30 min mají lepší výsledek než paci enti s epizodami trvajícími nad 30 min. Tito paci enti buď zemřeli, nebo přežili s těžkým postižením [46]. Poslední publikovaná data NICEM konsensu 2008 (Ne uro‑Intensive Care and Emergency Medicine Secti on of the Europe an Soci ety of Intensive Care Medicine) týkající se hypoxemického prahu udávají hodnotu 10 – 20 mmHg [47,48]. Brain Tra uma Fo undati on guidelines 2007 uvádí jako hraniční hodnotu 15 mmHg [49].
Závěr
Nedostatečné zásobování mozkové tkáně kyslíkem (hypoxi e a/ nebo ischemi e) je hlavní příčino u vedo ucí k rozvoji sekundárního poškození mozku. Dostatečný perfuzní tlak ani dodávka kyslíku nemusejí vždy zaručit dobrý výsledek léčby. Monitorování pbtO2 v rámci multimodálního monitorování se proto stává so učástí klinické praxe, protože údaje takto získané moho u pomoci při určování příčiny nedostatku kyslíku v mozku, a slo uží tudíž jako další užitečná informace umožňující průběžně přizpůsobovat léčbu měnícímu se stavu paci enta u mozkových poranění nebo subarachno idálních krvácení.
I v České republice postupně přibývají pracoviště, která tuto metodu po užívají. Klinických dat však zatím bylo publikováno málo, Pachl et al tuto metodu po užili ve studii léčby paci entů se subarachno idálním krvácením [50], zatímco Gál [51] a Hejčl [52] uveřejnili kazuistiky. Většímu rozšíření této patofyzi ologicky zajímavé metody dosud brání nezanedbatelná cena čidla.
MUDr. Martin Filaun, CSc.
Klinika anesteziologie a resuscitace 2. LF UK a IPVZ
FN v Motole
V Úvalu 84
150 06 Praha
e-mail: martin.filaun@lfmotol.cuni.cz
Přijato k recenzi: 28. 4. 2008
Přijato do tisku: 23. 9. 2008
Zdroje
1. Cerebrum 2007 o.s. (Sdružení osob po poranění mozku a jejich rodin). Statistika [online]. Dostupné z URL: http:/ / www.cerebrum2007.cz/ poraneni - mozku - statistika.php.
2. Scho uten JW. Ochrana mozku při jeho poranění – složitý boj s přírodo u. Curr Opin Crit Care/ CZ 2007; 1 : 26 – 34.
3. Cremer OL. Does ICP monitoring make a difference in ne urosurgical care? Eur J Anaesthesi ol 2008; 25 (Suppl 42): 87 – 93.
4. Jones PA, Andrews PJ, Midgley S, Anderson SI, Piper IR, Tocher JL et al. Me asuring the burden of secondary insults in he ad - injured pati ents during intensive care. J Ne urosurg Anesthesi ol 1994; 6(1): 4 – 14.
5. Mazze o AT, Bullock R. Monitoring brain tissue oxymetry: will it change management of critically ill ne urologic pati ents? J Ne urol Sci 2007; 261(1 – 2): 1 – 9.
6. Chesnut RM. Secondary brain insults after he ad injury: clinical perspectives. New Horiz 1995; 3(3): 366 – 375.
7. Cho i DW. Ionic dependence of glutamate ne urotoxicity. J Ne urosci 1987; 7(2): 369 – 379.
8. Crompton M. The mitochondri al perme ability transiti on pore and its role in cell de ath. Bi ochem J 1999; 341(2): 233 – 249.
9. Unterberg AW, Stover JF, Kress B, Ki ening KL. Edema and brain tra uma. Ne urosci ence 2004; 129(4): 1021 – 1029.
10. Gupta AK. Applicati on of multimodal monitoring. In: Gupta AK, Summors A(eds). Notes in Ne uro anaesthesi a and Critical Care. London: Greenwich Medical Medi a 2001 : 260 – 262.
11. Fakhry SM, Trask AL, Waller MA, Watts DD. Management of brain‑injured pati ents by an evidence‑based medicine protocol improves o utcomes and decre ases hospital charges. J Tra uma 2004; 56(3): 492 – 499.
12. Patel HC, Menon DK, Tebbs S, Hawker R, Hutchinson PJ, Kirkpatrick PJ. Speci alist ne urocritical care and o utcome from he ad injury. Intensive Care Med 2002; 28(5): 547 – 553.
13. Reilly PL. Brain injury: the pathophysi ology of the first ho urs. “Talk and di e revisited”. J Clin Ne urosci 2001; 8(5): 398 – 403.
14. Rosenthal G, Hemphill JC jr, Sorani M,Martin C, Morabito D, Obrist WD et al. Brain tissue oxygen tensi on is more indicative of oxygen diffusi on than oxygen delivery and metabolism in pati ents with tra umatic brain injury. Crit Care Med 2008; 36(6): 1917 – 1924.
15. Ferda J, Kastner J, Kre uzberg B, Novák M, Rohan V. Zobrazení akutní mozkové ischémi e. Ces Radi ol 2007; 31(3): 231 – 241.
16. Artru F, Jo urdan C, Perret - La udet A, Charlot M, Mottolese C. Low brain tissue oxygen pressure: incidence and corrective therapi es. Ne urol Res 1998; 20 (Suppl 1): S48 – S61.
17. Härtl R, Bardt TF, Ki ening KI, Sarrafzadeh AS, Schneider GH, Unterberg AW. Mannitol decre ases ICP but does not improve brain‑tissue pO2 in severely he ad - injured pati ents with intracrani al hypertensi on. Acta Ne urochir 1997; 70 (Suppl): 40 – 42.
18. Ki ening KL, Unterberg AW, Bardt TF, Schneider GH, Lanksch WR. Monitoring of cerebral oxygenati on in pati ents with severe he ad injuri es: brain tissue pO2, versus jugular vein saturati on. J Ne urosurg 1996; 85(5): 751 – 757.
19. van Santbrink H, Maas AI, Avezaat CJ. Continuo us monitoring of parti al pressure of brain tissue oxygen, in pati ents with severe he ad injury. Ne urosurgery 1996; 38(1): 21 – 31.
20. al - Rawi PG, Hutchinson PJ, Gupta AK, Pi echnik SK, Pickard JD, Kirkpatrick PJ. Multiparameter brain tissue monitoring – correlati on between parameters and identificati on of CPP thresholds. Zentralbl Ne urochir 2000; 61(2): 74 – 79.
21. Kett - White R, Hutchinson PJ, Czosnyka M, al - Rawi P, Gupta A, Kirkpatrick PJ et al. Effects of vari ati on in cerebral haemodynamics during ane urysm surgery on brain tissue oxygen and metabolism. Acta Ne urochir 2002; 81 (Suppl): 327 – 329.
22. Gupta AK, Hutchinson PJ, Fryer T, Al - Rawi PG, Parry DA, Minhas PS et al. Me asurement of brain tissue oxygenati on performed using positron emissi on tomography scanning to validate a novel monitoring method. J Ne urosurg 2002; 96(2): 263 – 268.
23. Za uner A, Doppenberg E, Wo odward JJ, Cho i S, Yo ung HF, Bullock R. Continuo us monitoring of cerebral substrate delivery and cle arance: Initi al experi ence in 24 pati ents with severe acute brain injury. Ne urosurgery 1997; 41(5): 1082 – 1093.
24. Menzel M, Doppenberg EM, Za uner A,So ukup J, Reinert MM, Cla usen T et al. Cerebral oxygenati on in pati ents after severe he ad injury: monitoring and effects of arteri al hyperoxi a on cerebral blo od flow, metabolism and intracrani al pressure. J Ne urosurg Anesthesi ol 1999; 11(4): 240 – 251.
25. Dings J, Meixensberger J, Jäger A, Ro osen K. Clinical experi ence with 118 brain tissue oxygen parti al pressure catheter probes. Ne urosurgery 1998; 43(5): 1082 – 1095.
26. Hoelper BM, Alessandri B, Heimann A, Behr R, Kempski O. Brain oxygen monitoring: in‑vitro accuracy, long‑term drift and response - time of Licox - and Ne urotrend sensors. Acta Ne urochir (Wi en) 2005; 147(7): 767 – 774.
27. Jaeger M, Soehle M, Meixensberger J. Brain tissue oxygen (PtiO2): a clinical comparison of two monitoring devices. Acta Ne urochir 2005; 95 (Suppl): 79 – 81.
28. Wilensky EM, Blo om S. Monitoring brain tissue oxygenati on after severe brain injury. Nursing 2005; 35(2): 32cc1 – 32cc4.
29. Maas AL, Fleckenstein W, de Jong DA, van Santbrink H. Monitoring cerebral oxygenati on: Experimental studi es and preliminary clinical results of continuo us monitoring of cerebrospinal fluid and brain tissue oxygen tensi on. Acta Ne urochir (Wi en) 1993; 59 (Suppl): 50 – 57.
30. Meixensberger J, Dings J, Kuhnigk H, Ro osen K. Studi es of tissue pO2 in normal and pathological human brain cortex. Acta Ne urochir (Wi en) 1993; 59 (Suppl): 58 – 63.
31. Za uner A, Bullock R, Di X, Yo ung HF. Brain oxygen, CO2, pH, and temperature monitoring: evalu ati on in feline brain. Ne urosurgery 1995; 37(6): 1168 – 1177.
32. Hoffman WE, Charbel FT, Edelman G, Hannigan K, Ausman JI. Brain tissue oxygen pressure, carbon di oxide pressure and pH during ischemi a. Ne urol Res 1996; 18(1): 54 – 56.
33. Za uner A, Doppenberg E, Wo odward J, Allen C, Jebraili S, Yo ung HF et al. Multiparametric continuo us monitoring of brain metabolism and substrate delivery in ne urosurgical pati ents. Ne urol Res 1997; 19(3): 265 – 273.
34. Za uner A, Doppenberg EM, So ukup J, Menzel M, Yo ung HF, Bullock R. Extended ne uromonitoring: new therape utic opportuniti es? Ne urol Res 1998; 20 (Suppl 1): S85 – S90.
35. Watson JC, Doppenberg EM, Bullock R,Za uner A, Yo ung HF. Effect of allosteric hemoglobin modifi er RSR 13 upon oxygen transportati on in ischemic brain, and upon infarct size in a feline model of human stroke. Stroke 1998; 28 : 1624 – 1630.
36. Doppenberg EM, Za uner A, Bullock R,Ward JD, Marmaro u A, Fato uros P et al. Correlati on between pO2 , pCO2, pH and cerebral blo od flow – a better way of monitoring the severly injured brain? Surg ne urol 1998; 49 : 650 – 654.
37. Doppenberg EM, Za uner A, Watson JC, Bullock R. Determinati on of the ischemic threshold for oxygen tensi on. Acta Ne urochir 1998; 71 (Suppl): 166 – 169.
38. Heiss WD, Hayakawa T, Waltz AG. Cortical ne uronal functi on during ischemi a. Effects of occlusi on of one midle cerebral artery on single‑unit activity in cats. Arch Ne urol 1976; 33 : 813 – 820.
39. Jones TH, Morawetz RB, Crowell RM, Marco ux FW, FitzGibbon SJ, DeGirolami Uet al. Thresholds of focal ischemi a in awake monkeys. J Ne urosurg 1981; 54(6): 773 – 782.
40. Morawetz RB, DeGirolami U, Ojemann RG, Marco ux FW, Crowell RM. Cerebral blo od flow determined by hydrogen cle arance during middle cerebral artery occlusi on in anesthetized monkeys. Stroke 1978; 9(2): 143 – 149.
41. Sharbro ugh FW, Messick JM jr, Sundt TM jr. Correlati on of continuo us electroencephalograms with cerebral blo od flow me asurements during carotid endarterectomy. Stroke 1973; 4(4): 674 – 683.
42. Robertson CS. Desaturati on episodes after severe he ad injury: influence on o utcome. Acta Ne urochir (Wi en) 1993; 59 (Suppl): 98 – 101.
43. Sheinberg M, Kanter MJ, Robertson CS, Contant CF, Narayan RK, Crossman RG. Continuo us monitoring of jugular vein saturati on in he ad injured pati ents. J Ne urosurg 1992; 76(2): 212 – 217.
44. Valadka AB, Gopinatu SP, Contact CF, Uzura M, Robertson CS. Relati onship of brain tissue pO2 to o utcome after severe he ad injury. Crit Care Med 1998; 26(9): 1576 – 1581.
45. van den Brink WA, van Sabrink H, Steyerberg EW, Avezaat CJJ, Su azo JA, Hogesteeger C et al. Brain oxygen tensi on in severe he ad injury. Ne urosurgery 2000; 46(4): 868 – 876.
46. Bardt TF, Unterberg AW, Härtl R, Ki ening KL, Schneider GH, Lanksch WR. Monitoring of brain tissue PO2 in tra umatic brain injury: effect of cerebral hypoxi a on o utcome. Acta Ne urochir 1998; 71 (Suppll): 153 – 156.
47. Nortje J, Gupta AK. The role of tissue oxygen monitoring in pati ents with acute brain injury. Br J Anaesth 2006; 97(1): 95 – 106.
48. Andrews PJ, Citeri o G, Longhi L, Polderman K, Sahuquillo J, Vajkoczy P. Ne uro‑Intensive Care and Emergency Medicine (NICEM) Secti on of the Europe an Soci ety of Intensive Care Medicine. NICEM consensus on ne urological monitoring in acute ne urological dise ase. Intensive Care Med 2008; 34(8): 1362 – 1370.
49. Brain Tra uma Fo undati on, American Associ ati on of Ne urological Surge ons, Congress of Ne urological Surge ons, Jo int Secti on on Ne urotra uma and Critical Care, AANS/ CNS. Guidelines for the management of severe tra umatic brain injury. X. Brain oxygen monitoring and thresholds. J Ne urotra uma 2007; 24 (Suppl 1): S65 – S70.
50. Pachl J, Haninec P, Tencer T, Mizner P, Ho usťava L, Tomas R et al. The effect of subarachno id sodi um nitroprusside on the preventi on of vasospasm in subarachno id haemorrhage. Acta Ne urochir 2005; 95 (Suppl): 141 – 145.
51. Gál R, Smrčka M, Što urač P, Straževská E, Ne umann E. Měření tkáňového kyslíku v mozku jako so učást multimodálního monitorování: kazuistiky. Cesk Slov Ne urol N 2007; 70/ 103(5): 562 – 566.
52. Hejčl A, Bartoš R, Humhej I, Bolcha M, Bejšovec D, Procházka J et al. Dekompresivní krani ektomi e v léčbě posttra umatického edému mozku a přínos nových monitorovacích metod. Čas Lék čes 2007; 146(4): 307 – 312.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Úvodní slovoČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2008 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodní slovo
- Spánková apnoe dospělého věku
- Monitorování mozkové oxygenace
- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Vztah atrofie amygdaly a dalších vybraných mozkových struktur k emocionální agnozii u Alzheimerovy nemoci
- Farmakoepidemiologická studie souboru 427 pacientů léčených pro epilepsii
- Rozdíly v počtu CAG opakování mezi pohlavími a jejich korelace s klinickým obrazem u Huntingtonovy choroby
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
- Syndrom kubitálního kanálu. Srovnání operačních technik prosté dekomprese a přední transpozice ulnárního nervu
- Endonazální endoskopická transsfenoidální resekce selárních lézí
- Přední krční mikroforaminotomie v řešení unilaterální monosegmentální radikulopatie (prospektivně vedená pilotní studie – 15 pacientů)
- Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika
- Status absencí u geriatrického pacienta s recentní diagnózou idiopatické generalizované epilepsie – kazuistika
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Komentář ke článku Schreiberová et al. Sedace kombinací dexmedetomidin‑ketamin‑midazolam pro endovaskulární léčbu mozkových arteriovenózních malformací a stenóz karotických tepen
- Webové okénko
-
Analýza dat v neurologii
XII. Úvod do statistického usuzování – postupy a terminologie
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Spánková apnoe dospělého věku
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



