-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Barevnost a obsah některých biologicky aktivních látek v přírodninách a v produktech přírodního původu
Colour and content of some biologically active substances in natural products and products of natural origin
The paper draws attention to the correlations between the results of instrumental colour measurements and the content of some biologically active organic substances (carotenoids, chlorophyll, anthocyanins, curcuminoids, etc.) in natural products and products of natural origin. After supplementation by regression analysis and calibration, sufficiently close correlations can lead to the development of procedures for rapid determination of the content of these substances and their groups by colour measurement without more demanding sample treatment.
Keywords:
biologically active substances – colour measurement – correlation – content determination
Autoři: Jan Šubert 1; Jozef Kolář 2; Jozef Čižmárik 3
Působiště autorů: Dušínova 1512/42, 664 34 Kuřim 1; Katedra sociální a klinické farmacie, Farmaceutická fakulta, Univerzita Karlova 2; Katedra farmaceutickej chémie, Farmaceutická fakulta, Univerzita Komenského v Bratislave, SR 3
Vyšlo v časopise: Čes. slov. Farm., 2021; 70, 83-90
Kategorie: Přehledy a odborná sdělení
doi: https://doi.org/https://doi.org/10.5817/CSF2021-3-83Souhrn
Příspěvek upozorňuje na korelace mezi výsledky instrumentálního měření barevnosti a obsahem některých biologicky aktivních organických látek (karotenoidy, chlorofyl, anthokyaniny, kurkuminoidy aj.) v přírodninách a v produktech přírodního původu. Dostatečně těsné korelace mohou vést po doplnění regresní analýzou a kalibrací k vývoji postupů pro rychlé stanovení obsahu těchto látek a jejich skupin měřením barevnosti bez náročnější úpravy vzorků.
Klíčová slova:
biologicky aktivní látky – měření barevnosti – korelace – stanovení obsahu
Úvod
Na souvislost barevnosti organických látek s jejich strukturou bylo poukázáno již nejednou dříve1). Údaje o jejich barevnosti lze získat mimo subjektivní hodnocení měřením založeným na číselném vyjadřování barev v trichromatickém systému2–4). Východiskem k instrumentálnímu měření barevnosti je spektrální propustnost nebo spektrální odraz látek ve viditelné spektrální oblasti. Realizovat ho lze klasickou spektrofotometrií ve viditelné spektrální oblasti a následným výpočtem, častěji ale měřením měřidlem barevnosti a zejména v posledním desetiletí také s využitím obrazové analýzy, přičemž tyto aplikace mají vzestupný trend5–7). Výsledky měření barevnosti lze použít ke zjištění existence a těsnosti závislosti barevnosti látek a jejich koncentrace korelační analýzou. Byly popsány četné korelace některých parametrů z instrumentálního měření barevnosti ve vhodně voleném barevném prostoru a obsahu biologicky aktivních látek v přírodninách a v produktech přírodního původu, stanoveného jinou analytickou metodou. Korelační analýza nevyjadřuje funkční vztah8), analytické využití jejich výsledků proto předpokládá doplnění regresní analýzou ke stanovení vhodného matematického modelu příslušné závislosti. Ta byla v části dále citovaných prací již provedena. Dále výběr vhodného kolorimetrického parametru2–4) a kalibraci8) jako výchozí předpoklady k rychlému a nezřídka nedestruktivnímu stanovení obsahu příslušných látek (resp. analýz bez nutnosti větší úpravy vzorku). Většinou se jedná o látky barevné, v některých případech však byly zjištěny korelace barevných charakteristik vzorků s obsahem látek nebarevných, jako je např. glukosa9), kyselina askorbová10) či kyselina chlorogenová11). Záměrem našeho příspěvku je poukázat na tyto korelace u biologicky aktivních látek organického původu a jejich skupin se zaměřením na látky lidskému zdraví prospěšné, obsažené v přírodninách a v produktech přírodního původu. V příspěvku jsou příklady těsnějších korelací s korelačním koeficientem nejméně 0,9 a některých korelací s nižším korelačním koeficientem, pokud byl statisticky významný.
U některých dalších biologicky aktivních látek lze korelovat jejich koncentraci, resp. obsah s parametry z instrumentálního měření barevnosti po chromogenní reakci těchto látek s vhodně voleným činidlem. Tyto aplikace nejsou předmětem příspěvku.
Korelace výsledků měření barevnosti a obsahu některých biologicky aktivních látek a jejich možné analytické využití
Korelace výsledků instrumentálního měření barevnosti a obsahu biologicky aktivních látek v přírodninách a v produktech přírodního původu byly pravděpodobně nejčastěji popsány u karotenoidů, u kterých byl navíc v barevném prostoru CIELAB2–4) podrobněji studován vztah mezi jejich chemickou strukturou a zbarvením12). Některé z těsnějších korelací popsaných ve skupině karotenoidů jsou uvedeny v tabulce 1. Pro případné analytické využití jsou z nich výhodné zejména korelace lineární8, 23, 24).
Tab. 1. Některé těsnější korelace mezi parametry získanými měřením barevnosti a obsahem karotenoidů v přírodninách a v produktech přírodního původu 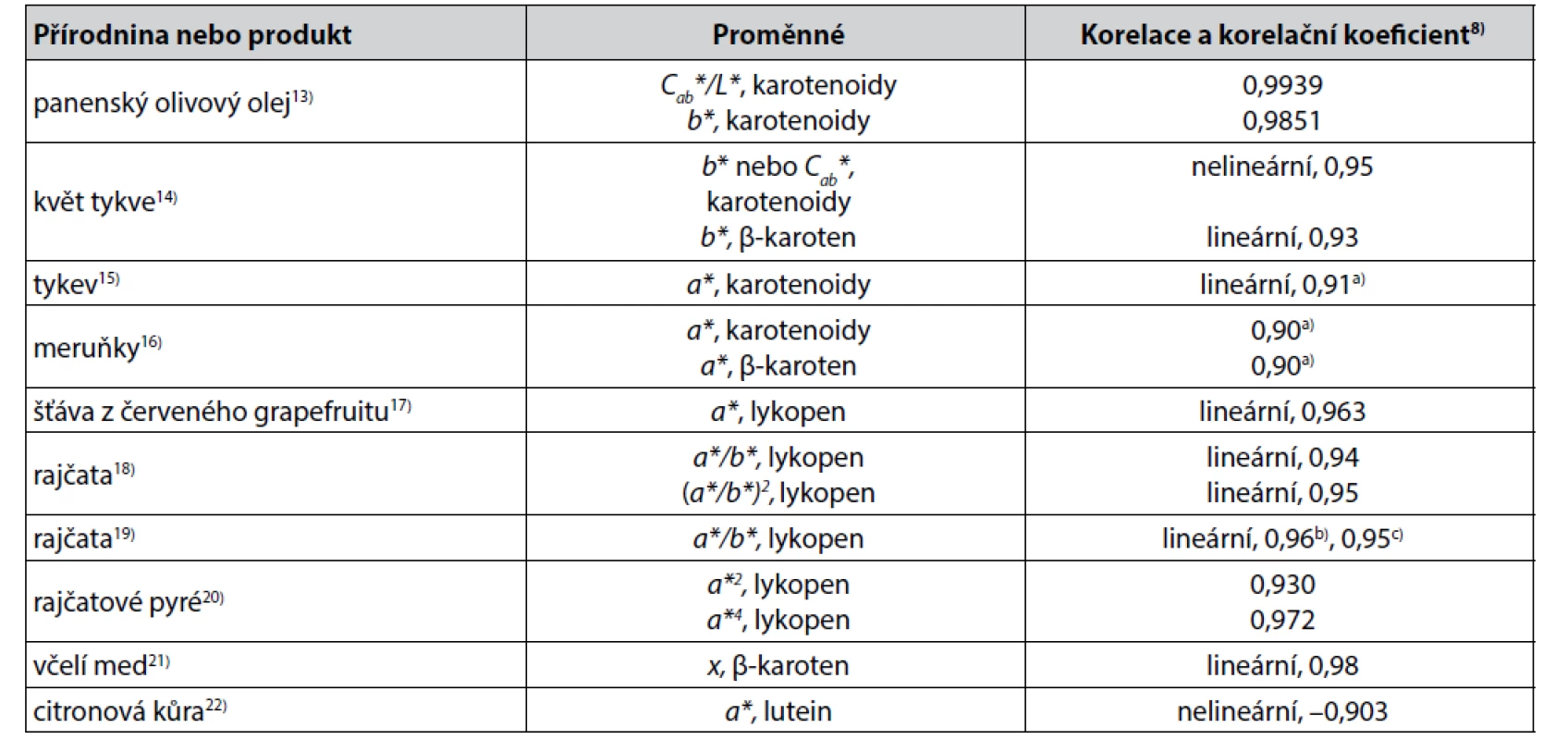
a) Pearsonův korelační koeficient
b, c) hodnoty získané měřením kolorimetrem a obrazovou analýzouMimo tyto korelace byla popsána ve skupině karotenoidů řada méně těsných lineárních a nelineárních korelací. Z nich lze zmínit např. lineární korelaci hodnot souřadnice a* a celkového obsahu karotenoidů v pomerančové šťávě (korelační koeficient 0,88)25), lineární korelaci poměru souřadnic a*/b* a obsahu lykopenu v rajčatech (korelační koeficient 0,89)26),lineární korelaci souřadnice b* a obsahu luteinu v rajčatech (Pearsonův korelační koeficient 0,87)15), korelaci souřadnice b* a β-karotenu anebo barevného tónu hab a lykopenu (Pearsonův korelační koeficient 0,867 a –0,895) v cherry rajčatech27). Dále korelace souřadnice b* a obsahu β-karotenu, β-kryptoxantinu nebo luteinu + zeaxantinu v pomerančové šťávě (korelační koeficienty 0,643, 0,691, –0,655)28) anebo nelineární korelaci souřadnice a* a obsahu β-kryptoxantinu v citronové kůře (korelační koeficient 0,799)22).
Častěji byly popsány také korelace parametrů barevnosti přírodnin anebo produktů přírodního původu a obsahu chlorofylu. Některé z těchto korelací jsou uvedeny v tabulce 2.
Tab. 2. Některé těsnější korelace mezi parametry získanými měřením barevnosti a obsahem chlorofylu v přírodninách a v produktech přírodního původu 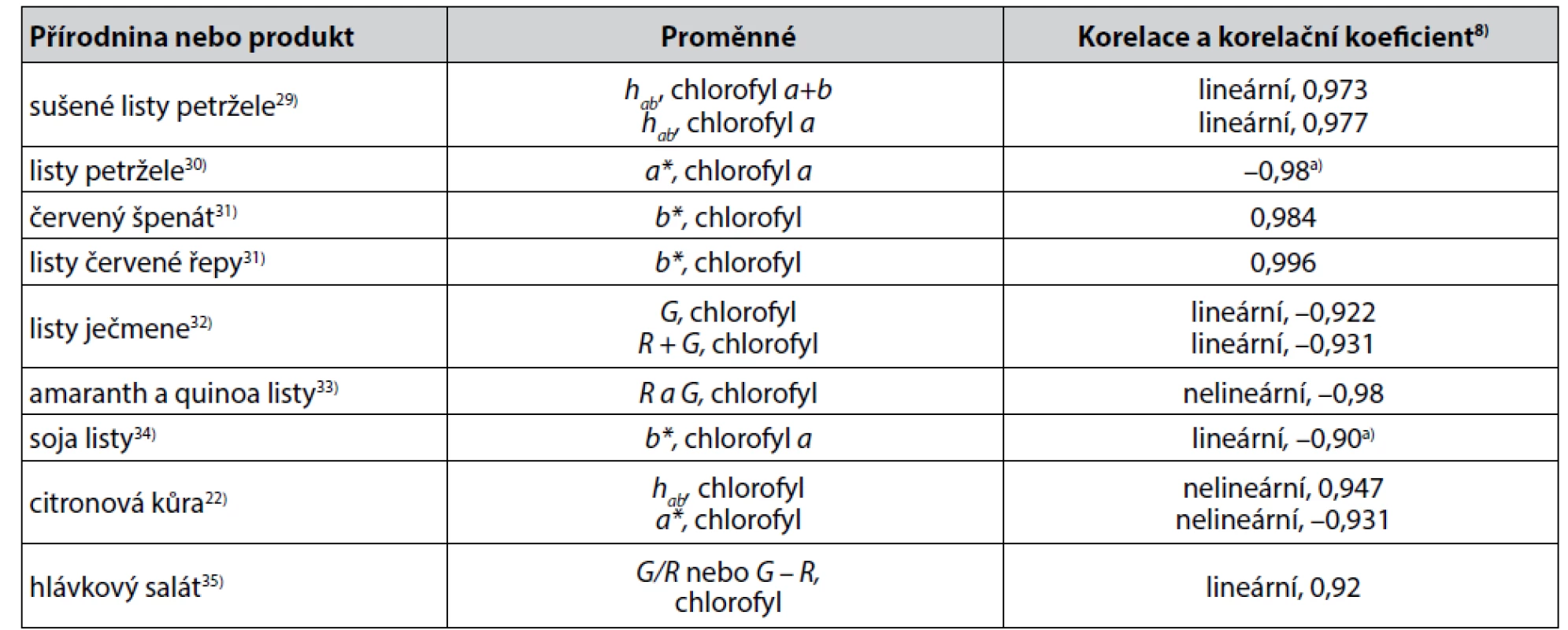
a) Pearsonův korelační koeficient Mimoto byly popsány méně těsné korelace obsahu chlorofylu s parametry barevnosti přírodnin a produktů přírodního původu, jako korelace poměru Cab*/L* a chlorofylu v panenském olivovém oleji (korelační koeficient 0,8421)13), lineární korelace hodnot chroma Cab* a chlorofylu b v sušených listech petržele (korelační koeficient 0,811)29) a další.
U dalších biologicky aktivních organických látek a jejich skupin byly popsány korelace s parametry barevnosti mimo jiné ve skupinách flavonoidů, kurkuminoidů, betalainů a u řady látek mimo tyto skupiny. Některé těsnější z nich jsou uvedeny v tabulce 3.
Tab. 3. Některé těsnější korelace mezi parametry získanými měřením barevnosti a obsahem dalších biologicky aktivních látek v přírodninách a v produktech přírodního původu 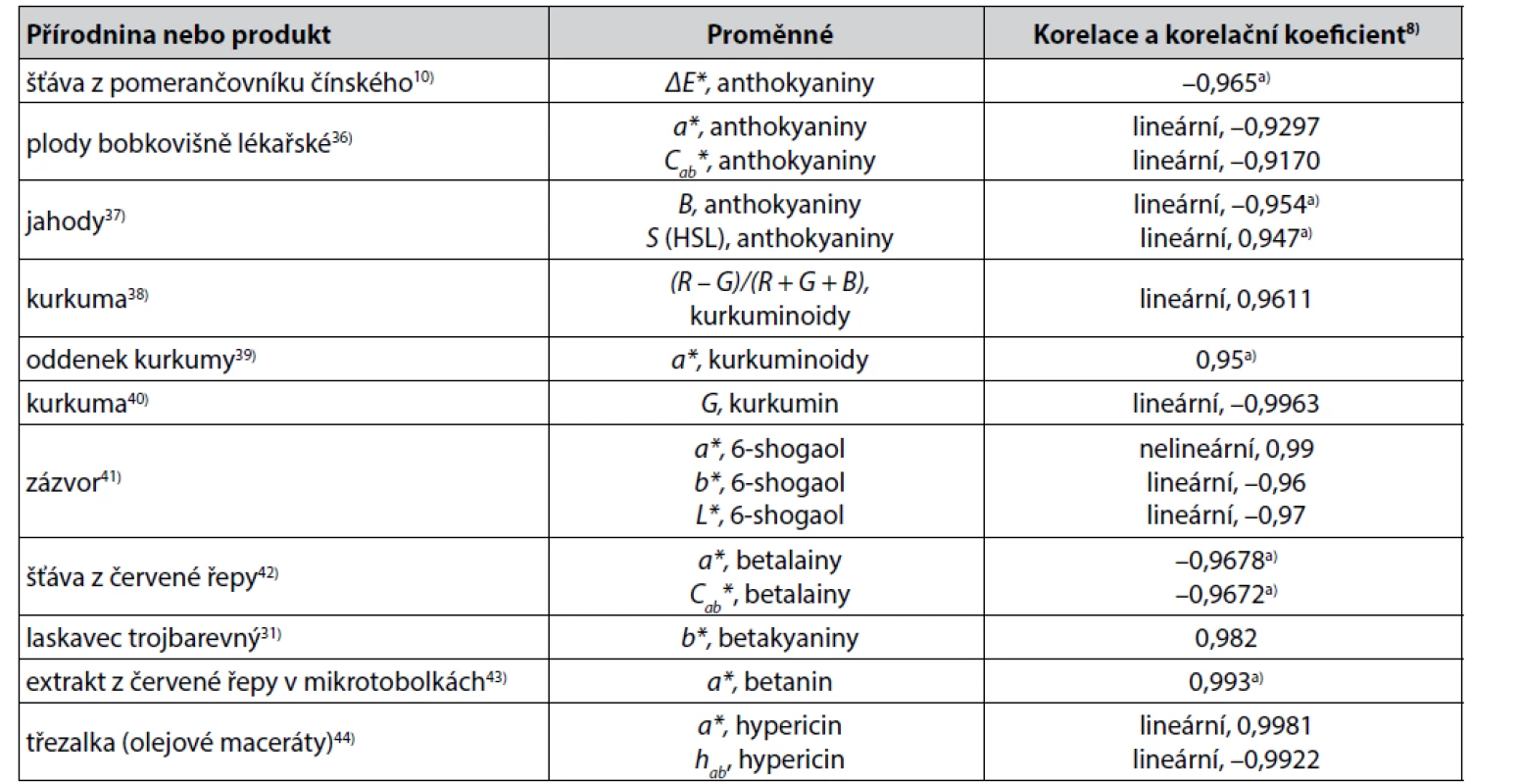
a) Pearsonův korelační koeficient Z korelací méně těsných byly popsány častěji korelace flavonoidů, a to buď celkových flavonoidů (ve včelím medu s využitím souřadnice a* byl korelační koeficient roven 0,8645), v propolisu s hodnotami chroma Cab* byl Spearmanův korelační koeficient 0,63046)), nebo i jednotlivých flavonoidů (např. luteolin v šafránu, souřadnice b*, korelační koeficient 0,83547)). Statisticky významné korelace obsahu jednotlivých flavonoidů (luteolin, kvercetin, kaempferol) s hodnotami souřadnic barevného prostoru CIELAB L*, a*, b* byly popsány v práci48) v rámci studia rostliny nevadlec hřebenitý. Další statisticky významné korelace obsahu flavonoidů, jako jsou baikalin a wogonosid s hodnotami souřadnic L*, a*, b*, byly popsány u kořene šišáku bajkalského49). Při sledování stability kyanidin-3-glukosidu z malin byla zjištěna korelace mezi jeho obsahem a hodnotami b* nebo hab s korelačním koeficientem > 0,9150). Ve studii51) bylo korelováno jednotlivě několik různých kolorimetrických parametrů s obsahem celkových anthokyaninů a mimoto jedenácti jednotlivých anthokyaninů a jejich skupin v červeném víně. Vysokých hodnot Pearsonova korelačního koeficientu (u celkových anthokyaninů vždy a u jednotlivých anthokyaninů a jejich skupin většinou > 0,9) při přímé závislosti proměnných bylo dosaženo v korelacích s parametry a*, Cab* a suv* z barevného prostoru CIELUV. Autoři52) sledovali korelace barevných biologicky aktivních látek v květech chryzantém pěstovaných v květináči. Mezi zajímavější z nich patří mimo korelace celkových karotenoidů nebo luteinu či violaxanthinu se souřadnicí b* (Pearsonův korelační koeficient 0,881, 0,804 a 0,674) a těsnější korelace celkových anthokyaninů, nebo kyanidin-3-O-(6´´-O-malonyl-glukosidu) či kyanidin - 3-O-(3´´,6´´-O-dimalonyl-β-glukopyranosidu) s hodnotou souřadnice a* (Pearsonův korelační koeficient 0,896, 0,884 a 0,864). V barevném prostoru HSV korelovala sytost barvy S světlice barvířské s obsahem polyfenolu hydroxysaffrol yellow A, Pearsonův korelační koeficient byl 0,779, při korelaci s hodnotou R v barevném prostoru RGB byl Pearsonův korelační koeficient 0,75853). Pozoruhodně těsné lineární korelace byly zjištěny při studiu sušení listů meduňky lékařské mezi hodnotami některých parametrů barevnosti v barevném prostoru CIELAB a obsahem hydroxyskořicových kyselin jako ekvivalentů kyseliny rozmarýnové (nejlépe souřadnice b*, kdy byl korelační koeficient 0,9945)54). Obsah kyseliny askorbové ve šťávě z čínského pomerančovníku koreloval podle10) s hodnotami chroma Cab*, Pearsonův korelační koeficient byl 0,813. Statisticky významné korelace s parametry z instrumentálního měření barevnosti (nejlépe ze zkoušených korelovaly hodnoty ΔE*) byly dále popsány u alkaloidů obsažených v kořenu oměje Carmichaelova. Spearmanův korelační koeficient pro benzoylhypakonitin, benzoylakonitin, benzoylmesakonin a pro celkový obsah těchto alkaloidů byl 0,634, 0,577, 0,564 a 0,69855). Odkazy na některé další korelace obsahu biologicky aktivních látek v přírodninách a v produktech přírodního původu s výsledky instrumentálního měření barevnosti lze nalézt v přehledu56).
Řadu korelací uvedených v tabulkách 1, 2 a 3 nebo v textu lze využít (a některé z nich již byly využity) k vývoji postupů ke stanovení obsahu příslušných látek. Jako nejvýhodnější z nich se pro tento účel jeví korelace lineární s přímou závislostí proměnných. Při použití kalibrační křivky sice není nutné, aby byla závislost naměřené veličiny na koncentraci stanovované složky lineární, při srovnávání s jedním standardem se ale linearita předpokládá57). V obecné rovině jsou proto preferovány lineární závislosti vedoucí ke kalibrační přímce8, 23, 24) a ověřování linearity je v kvantitativní instrumentální analytice součástí validačních schémat23, 24). Přesto lze nalézt v odborné literatuře i práce doporučující pro stanovení analytu využití kolorimetrického parametru, jehož závislost na koncentraci lineární obvykle není58). Tento kolorimetrický parametr (L*) ale někteří jiní autoři v dané souvislosti odmítají, protože charakterizuje pouze světlost vzorku. Např. v práci59) pro stanovení lykopenu preferují před souřadnicí L* hodnotu (a*/b*)2 vycházející ze souřadnic barevnosti v barevném prostoru CIELAB. Použití této transformace současně převádí při málo rozdílném korelačním koeficientu nepřímou závislost proměnných, jejíž využití v instrumentální analytice není běžné, na závislost přímou a lineární. Obdobně tomu je v práci27) při korelaci obsahu lykopenu s hab (Pearsonův korelační koeficient –0,895) a se souřadnicí a* (Pearsonův korelační koeficient 0,877). V rámci citovaných prací mohou být dalšími příklady převodu nepřímé závislosti proměnných na závislost přímou volbou kolorimetrického parametru korelace obsahu betaninu v mikrotobolkách, kdy s hodnotou hab byl Pearsonův korelační koeficient –0,918, s hodnotou a* ale 0,99343), tedy kladný a vyšší. Při korelaci obsahu anthokyaninů v jahodách37) s hodnotou souřadnice B byl Pearsonův korelační koeficient –0,954, s hodnotou parametru S barevného prostoru HSL 0,947 a při využití hodnot souřadnice a* barevného prostoru CIELAB 0,942. U obsahu hypericinu v olejových macerátech z třezalky byl korelační koeficient při jeho korelaci s hab –0,9928 a 0,9981 při korelaci s hodnotou souřadnice a*44). Při korelaci obsahu kyselin hydroxyskořicových v listech meduňky lékařské byl korelační koeficient s hodnotou souřadnice a* –0,9928, se souřadnicí b* 0,994554). V některých případech může linearitu závislosti proměnných zajistit místo změny kolorimetrického parametru korelace poměru souřadnic barevného prostoru CIELAB a*/b* po jeho transformaci na (a*/b*)2, která vedla při korelaci s obsahem lykopenu v rajčatech k lepším výsledkům59). Autoři19) v obdobné situaci popsali lineární korelaci obsahu lykopenu s poměrem souřadnic a*/b* bez jeho transformace (korelační koeficient byl 0,95–0,96), přičemž při korelaci s parametry hab nebo ΔE* byly závislosti proměnných nelineární a nepřímé. V barevném prostoru RGB se k linearizaci při korelaci obsahu karotenoidů a chlorofylu ve špenátu osvědčilo korelovat místo složek G a R jejich převrácené hodnoty 1/G a 1/R60). Při korelaci obsahu kurkuminoidů v kurkumě bylo dosaženo v barevném prostoru RGB přímé lineární korelace s korelačním koeficientem 0,9611 použitím poměru (R – G)/(R + G + B)38). Při korelaci obsahu chlorofylu v hlávkovém salátu v barevném prostoru RGB s barevnými složkami R a G byly sice korelace lineární, v prvním případě však byla závislost proměnných nepřímá s korelačním koeficientem –0,79, ve druhém přímá s korelačním koeficientem rovným 0,35. S použitím poměru G/R však byla korelace lineární, závislost proměnných přímá a hodnota korelačního koeficientu vzrostla na 0,9235). K obdobnému výsledku vedla korelace rozdílu G – R35). Korelace součtu hodnot G + R sice vedla k vysokému korelačnímu koeficientu (–0,931), závislost proměnných ale byla nepřímá32). Pokud jde o míru využití jednotlivých barevných prostorů, nejčastěji jde o prostory CIELAB a CIELCH a dále o barevný prostor RGB, jehož využívání se zvyšuje v souvislosti s nárůstem využívání obrazové analýzy. Jiné barevné prostory, jako jsou CIELUV, HSV či HSL, byly využívány jen málo.
Z uváděných příkladů a dalších prací je zřejmé, že průběh korelační funkce a hodnotu korelačního koeficientu může často ve značné míře ovlivnit volba a mimoto i případná transformace kolorimetrického parametru. I po těchto krocích ale v řadě případů zůstávají hodnoty korelačního koeficientu dosti vzdáleny těm, které jsou dosahovány při aplikaci běžných metod instrumentální analýzy založených na kalibraci. Přesto je řada publikovaných prací zaměřena analyticky přímo názvem nebo v závěrech či souhrnu zmiňuje možné využití korelací mezi obsahem biologicky aktivních látek v přírodninách a v produktech přírodního původu a parametry z instrumentálního měření barevnosti k hodnocení či přímo stanovení obsahu příslušných látek. Týká se to častěji obsahu karotenoidů a v jejich rámci zejména lykopenu15, 18–20, 27, 59, 60), dále chlorofylu32 – 35, 60), kurkuminoidů a kurkuminu38, 40), ale i jiných látek, jako např. betalainů42).
Údaje o přesnosti a správnosti výsledků kolorimetrických měření vzorků přírodnin a produktů přírodního původu a na nich založených stanovení lze nalézt v publikovaných pracích jen ojediněle. Podle17) byla reprodukovatelnost měření kolorimetrických parametrů charakterizována relativní směrodatnou odchylkou < 1 %, jde však pouze o jednu ze složek variability výsledků stanovení příslušných látek touto cestou. V práci38) byly porovnány výsledky kolorimetrického stanovení kurkuminoidů s využitím parametrů barevného prostoru RGB s výsledky stanovení spektrofotometrií v ultrafialové oblasti, přičemž nebyly zjištěny statisticky významné rozdíly. Z výsledků testování postupu stanovení kurkuminu lze jako charakteristiku přesnosti s využitím barevného prostoru RGB a obrazové analýzy vyčíslit relativní směrodatnou odchylku v průměru 0,71 %, což je hodnota příznivá; z výsledků testování stanovení kurkuminu HPLC byla průměrná relativní směrodatná odchylka 1,2 %40). Při analýze tří různých vzorků kurkumy (n = 5) byl nevážený průměr výsledků stanovení obsahu kurkuminu měřením barevnosti 4,97 %, HPLC 5,33 %40) při prakticky shodném odhadu přesnosti výsledků obou metod. V jiných případech může být přesnost a správnost výsledků stanovení obsahu s využitím výsledků měření barevnosti nižší. Většinou ale jde o stanovení rychlá, s nenáročnou přípravou vzorku či dokonce nedestruktivní, takže by neměl být problém zvýšit přesnost a správnost jejich výsledků větším počtem opakování vzhledem ke skutečnosti, že směrodatná odchylka aritmetického průměru několika paralelních stanovení klesá se zvyšováním jejich počtu57).
Jinou možnou cestou ke zlepšení přesnosti a správnosti výsledků stanovení obsahu založených na výsledcích měření barevnosti může být zvýšení těsnosti korelace proměnných. jako základního předpokladu použitím více než jednoho kolorimetrického parametru ve vícenásobné korelaci a vícenásobné regresi, včetně PLS. Příkladem může být studie28), ve které korelace souřadnice b* (anebo a*, L*, C*ab či hab, b* byla nejlepší volbou) a obsahu β-karotenu, β-kryptoxantinu nebo luteinu + zeaxantinu v pomerančové šťávě vedly ke korelačním koeficientům < 0,70, zatímco vícenásobná korelace obsahu těchto látek s L*, a* a b* nebo s L*, C*ab a hab vedla ke korelačním koeficientům > 0,98 (β-kryptoxanthin) až > 0,99 (β-karoten a lutein + zeaxanthin). Další zvyšování počtu kolorimetrických parametrů ve vícenásobné regresi ale nemusí přinést výrazné zvýšení korelačního koeficientu. Ukazují to výsledky autorů53), kteří korelovali s obsahem účinné látky hodnoty sedmi kolorimetrických parametrů z různých barevných prostorů. Výsledkem bylo zvýšení korelačního koeficientu z 0,794 (nejvyšší hodnota v rámci kolorimetrických parametrů korelovaných jednotlivě) na 0,897.
Seznam použitých zkratek a symbolů (viz také2–4))
Cab* chroma (měrná čistota) barvy v barevném prostoru CIELCH (CIE L* C* h)
CIE Mezinárodní komise pro osvětlování (Commission Internationale de l’Éclairage)
CIELAB,
CIELCH,
CIELUV barevné prostory CIE bližší lidskému vidění (CIE L* a* b*, CIE L* u* v*)
hab měrný úhel barevného tónu v barevném prostoru CIELCH
L*, a*, b* souřadnice barevného prostoru CIELAB
PLS metoda částečných nejmenších čtverců
R, G, B složky barevného prostoru RGB
S sytost barvy v barevném prostoru HSL nebo HSV
suv* sytost barvy v barevném prostoru CIELUV
X, Y, Z trichromatické složky barevného prostoru CIE XYZ
ΔE* barevný rozdíl v barevném prostoru CIELAB
Střet zájmů: žádný.
Došlo 12. dubna 2021
Přijato 8. června 2021
J. Šubert
Dušínova 1512/42, 664 34 Kuřim
doc. RNDr. Jozef Kolář, CSc.
Univerzita Karlova, Farmaceutická fakulta
Katedra sociální a klinické farmacie Heyrovského 1203, 500 05 Hradec Králové
e-mail: kolarjozef02@gmail.com
J. Čižmárik
Univerzita Komenského v Bratislave
Farmaceutická fakulta, Katedra farmaceutickej chémie, SR
Zdroje
1. Griffiths J. Colour and constitution of organic molecules. London: Academic Press 1976.
2. Wyszecki G., Stiles W. S. Color science: Concepts and methods, quantitative data and formulae. 2nd ed. New York: Wiley 1982.
3. Berger-Schunn A. Practical color measurement: A primer for the beginner, a reminder for the expert. New York: Wiley 1994.
4. Ohta N., Robertson A. R. Colorimetry: Fundamentals and applications. Chichester: Wiley 2005.
5. Capitán-Vallvey L. F., Lopez-Ruiz N., Martinez-Olmos A., Erenas M. M., Palma A. J. Recent developments in computer vision-based analytical chemistry: A tutorial review. Anal. Chim. Acta 2015; 899, 23–56. https://doi. org/10.1016/j.aca.2015.10.009 (2.2.2021).
6. Schults E. V., Monogarova O. V., Oskolok K. V. Digital colorimetry: Analytical possibilities and prospects of use. Moscow Univ. Chem. Bull. 2019; 74(2), 55–62. https://doi. org/10.3103/S002713141902007X (2.2.2021).
7. Fan Y., Li J., Guo Y., Xie L., Zhang G. Digital image colorimetry on smartphone for chemical analysis: A review. Measurement 2021; 171, 108829. https://doi.org/ 10.1016/j.measurement.2020.108829 (2.2.2021).
8. Kružlicová D. Chemometria. Trnava: Univerzita sv. Cyrila a Metoda 2015.
9. Yap M., Fernando W. M., Brennan C. S., Jayasena V., Coorey R. The effects of banana ripeness on quality indices for puree production. LWT 2017; 80, 10–18. https://doi.org/10.1016/j.lwt.2017.01.073 (25.2.2021).
10. Choi M. H., Kim G. H., Lee H. S. Effects of ascorbic acid retention on juice color and pigment stability in blood orange (Citrus sinensis) juice during refrigerated storage. Food Res. Int. 2002; 35, 753–759. https://doi. org/10.1016/S0963-9969(02)00071-6 (2.2.2021).
11. Xiong Y., Xiao X., Yan Y., Zou H., Li J. Study of the correlation between effective components content and color values of Lonicera japonica based on chromatometry. Chin. Arch. Tradit. Chin. Med. 2013; 31, 667–670.
12. Meléndez-Martínez A. J., Britton G., Vicario I. M., Heredia F. J. Relationship between the colour and the chemical structure of carotenoid pigments. Food Chem. 2007; 101, 1145–1150. https://doi.org/10.1016/j. foodchem.2006.03.015 (2.2.2021).
13. Isabel Minguez‐Mosquera M., Rejano‐Navarro L., Gandul‐Rojas B., Sánchez-Gómez A. H., Garrido‐Fernandez J. Color‐pigment correlation in virgin olive oil. J. Am. Oil Chem. Soc. 1991; 68, 332–336. https://doi. org/10.1007/BF02657688 (9.2.2021).
14. Seroczyńska A., Korzeniewska A., Sztangret-Wiśniewska J., Niemirowicz-Szczytt K., Gajewski M. Relationship between carotenoids content and flower or fruit flesh colour of winter squash (Cucurbita maxima Duch.). Folia Hortic. 2006; 18, 51–61.
15. Itle R. A., Kabelka E. A. Correlation between L* a* b* color space values and carotenoid content in pumpkins and squash (Cucurbita spp.). HortScience 2009; 44, 633–637. https://doi.org/10.21273/HORTSCI.44.3.633 (9.2.2021).
16. Ruiz D., Reich M., Bureau S., Renard C. M., Audergon J. M. Application of reflectance colorimeter measurements and infrared spectroscopy methods to rapid and nondestructive evaluation of carotenoids content in apricot (Prunus armeniaca L.). J. Agric. Food Chem. 2008; 56, 4916–4922. https://doi.org/10.1021/ jf7036032 (9.2.2021).
17. Lee H. S. Objective measurement of red grapefruit juice color. J. Agric. Food Chem. 2000; 48, 1507–1511. https://doi.org/10.1021/jf9907236 (9.2.2021).
18. Arias R., Lee T. C., Logendra L., Janes H. Correlation of lycopene measured by HPLC with the L*, a*, b* color readings of a hydroponic tomato and the relationship of maturity with color and lycopene content. J. Agric. Food Chem. 2000; 48, 1697–1702. https://doi. org/10.1021/jf990974e (9.2.2021).
19. Saad A. M., Ibrahim A., El-Bialee N. Internal quality assessment of tomato fruits using image color analysis. AgricEngInt: CIGR Journal 2016; 18, 339–352. http:// www.cigrjournal.org (11.2.2021).
20. Hyman J. R., Gaus J., Foolad M. R. A rapid and accurate method for estimating tomato lycopene content by measuring chromaticity values of fruit puree. J. Amer. Soc. Hort. Sci. 2004; 129, 717–723. https://doi. org/10.21273/JASHS.129.5.0717 (10.2.2021).
21. Nikolova K., Gentscheva G., Ivanova E. Survey of the mineral content and some physico-chemical parameters of Bulgarian bee honeys. Bulg. Chem. Commun. 2013; 45, 244–249.
22. Conesa A., Manera F. C., Brotons J. M., Fernandez - Zapata J. C., Simón I., Simón-Grao S., Alfosea - Simónd M., Martínez Nicolás J. J., Valverdee J. M., García-Sanchez F. Changes in the content of chlorophylls and carotenoids in the rind of Fino 49 lemons during maturation and their relationship with parame ters from the CIELAB color space. Sci. Hortic. 2019; 243, 252–260. https://doi.org/10.1016/j.scienta.2018.08.030 (11.2.2021).
23. Raposo F. Evaluation of analytical calibration based on least-squares linear regression for instrumental techniques: A tutorial review. TrAC – Trends Anal. Chem. 2016; 77, 167–185. https://doi.org/10.1016/j. trac.2015.12.006 (14.2.2021).
24. Jurado J. M., Alcázar A., Muñiz-Valencia R., Ceballos - Magaña S. G., Raposo F. Some practical considerations for linearity assessment of calibration curves as function of concentration levels according to the fitness-for-purpose approach. Talanta 2017; 172, 221–229. https://doi.org/10.1016/j.talanta.2017.05.049 (14.2.2021).
25. Meléndez-Martínez A. J., Gómez-Robledo L., Melgosa M., Vicario I. M., Heredia F. J. Color of orange juices in relation to their carotenoid contents as assessed from different spectroscopic data. J. Food Compos. Anal. 2011; 24, 837–844. https://doi.org/10.1016/j. jfca.2011.05.001 (14.2.2021).
26. Helyes L., Pék Z., Lugasi A. Tomato fruit quality and content depend on stage of maturity. HortScience 2006; 41, 1400–1401. https://doi.org/10.21273/HORTSCI. 41.6.1400 (14.2.20121).
27. Pandurangaiah S., Sadashiva A. T., Shivashankar K. S., Sudhakar Rao D. V., Ravishankar K. V. Carotenoid content in cherry tomatoes correlated to the color space values L*, a*, b*: A non-destructive method of estimation. J. Hort. Sci. 2020; 15, 27–34. https://doi. org/10.24154/JHS.2020.v15i01.004 (15.2.2021).
28. Meléndez-Martínez A. J., Vicario I. M., Heredia F. J. Application of tristimulus colorimetry to estimate the carotenoids content in ultrafrozen orange juices. J. Agric. Food Chem. 2003; 51, 7266–7270. https://doi. org/10.1021/jf034873z (14.2.20121).
29. Berset C., Caniaux P. Relationship between color evaluation and chlorophyllian pigment content in dried parsley leaves. J. Food Sci. 1983; 48, 1854–1857. https://doi.org/10.1111/j.1365-2621.1983.tb05100.x (17.2.2021).
30. Sledz M., Witrowa-Rajchert D. Influence of microwave - convective drying of chlorophyll content and colour of herbs. Acta Agrophysica 2012; 19, 865–876.
31. Ali M. B., Khandaker L., Oba S. Comparative study on functional components, antioxidant activity and color parameters of selected colored leafy vegetables as affected by photoperiods. J. Food Agric. Environ. 2009; 7, 392–398.
32. Hu H., Liu H. Q., Zhang H., Zhu J. H., Yao X. G., Zhang X. B., Zheng K. F. Assessment of chlorophyll content based on image color analysis, comparison with SPAD - 502. In: 2nd International conference on information engineering and computer science. Wuhan: 2010, 1–3. doi: 10.1109/ICIECS.2010.5678413 (20.2.2020).
33. Riccardi M., Mele G., Pulvento C., Lavini A., d’Andria R., Jacobsen S. E. Non-destructive evaluation of chlorophyll content in quinoa and amaranth leaves by simple and multiple regression analysis of RGB image com - ponents. Photosynth. Res. 2014; 120, 263–272. https:// doi.org/10.1007/s11120-014-9970-2 (21.2.2021).
34. Rigon J. P. G., Capuani S., Fernandes D. M., Guimarães T. M. A novel method for the estimation of soybean chlorophyll content using a smartphone and image analysis. Photosynthetica 2016; 54, 559–566. https:// doi.org/10.1007/s11099-016-0214-x (21.2.2021).
35. Ibrahim N. U. A., Abd Aziz S., Jamaludin D., Harith H. H. Development of smartphone-based imaging techniques for the estimation of chlorophyll content in lettuce leaves. Food Res. 2021; 5(Suppl 1), 33–38. https:// doi.org/10.26656/fr.2017.5(S1).036 (21.2.2021).
36. Kasım R., Suuml M., Kasım M. U. Relationship between total anthocyanin level and colour of natural cherry laurel (Prunus laurocerasus L.) fruits. Afr. J. Plant Sci. 2011; 5, 323–328. http://www.academicjournals. org/ajps (26.2.2021).
37. Yoshioka Y., Nakayama M., Noguchi Y., Horie H. Use of image analysis to estimate anthocyanin and UV-excited fluorescent phenolic compound levels in strawberry fruit. Breeding Sci. 2013; 63, 211–217. https://doi. org/10.1270/jsbbs.63.211 (27.2.2021).
38. Supannarach S. The study of using picture to measure the curcuminiods amount in turmeric (Curcuma longa Linn.) by comparing with ratio of RGB colors. In: Proceedings of the 51st Kasetsart University Annual Conference. Bangkok: Kasetsart University 2013 (27.2.2021).
39. Pal K., Chowdhury S., Dutta S. K., Chakraborty S., Chakraborty M., Pandit G. K., Dutta S., Paul P. K., Choudhury A., Majumder B., Sahana N., Mandal S. Analysis of rhizome colour content, bioactive compound profiling and ex-situ conservation of turmeric genotypes (Curcuma longa L.) from sub-Himalayan terai region of India. Ind. Crops Prod. 2020; 150, 112401. https://doi.org/10.1016/j.indcrop.2020.112401 (27.2.2021).
40. Wongthanyakram J., Harfield A., Masawat P. A smart device-based digital image colorimetry for immediate and simultaneous determination of curcumin in turmeric. Comput. Electron. Agric. 2019; 166, 104981. https:// doi.org/10.1016/j.compag.2019.104981 (27.2.2021).
41. Doui M., Mikage M. The relationship between the color value and pungent compound contents of ginger subjected to heating, soaking in hot water, or steaming. J. Trad. Med. 2012; 29, 115–123. https://doi.org/10.11339/ jtm.29.115 (28.2.2021).
42. Prieto-Santiago V., Cavia M. M., Alonso-Torre S. R., Carrillo C. Relationship between color and betalain content in different thermally treated beetroot products. J. Food Sci. Technol. 2020; 57, 3305–3313. https:// doi.org/10.1007/s13197-020-04363-z (28.2.2021).
43. Antigo J. L. D., Bergamasco R. D. C., Madrona G. S. Effect of pH on the stability of red beet extract (Beta vulgaris L.) microcapsules produced by spray drying or freeze drying. Food Sci. Technol. 2018; 38, 72–77. https://doi.org/10.1590/1678-457x.34316 (28.2.2021).
44. Heinrich M., Daniels R., Stintzing F. C., Kammerer D. R. Comprehensive phytochemical characterization of St. John’s wort (Hypericum perforatum L.) oil macerates obtained by different extraction protocols via analytical tools applicable in routine control. Pharmazie 2017; 72, 131–138. https://doi.org/10.1691/ph.2017.6749 (28.2.2021).
45. Al-Dabbas M. M., Otoom H. A., Al-Antary T. M. Impact of honey color from Jordanian flora on total phenolic and flavonoids content and antioxidant activity. Fresenius Environ. Bull. 2019; 28, 6898–6907.
46. Falcão S. I., Freire C., Vilas-Boas M. A proposal for physicochemical standards and antioxidant activity of Portuguese propolis. J. Am. Oil Chem. Soc. 2013; 90, 1729–1741. https://doi.org/10.1007/s11746-013 - 2324-y (1.3.2021).
47. Anuar N., Taha R. M., Mahmad N., Mohajer S., Musa S. A. N. I. C., Abidin Z. H. Z. Correlation of colour, antioxidant capacity and phytochemical diversity of imported saffron by principal components analysis. Pigment Resin Technol. 2017; 46, 107–114. https://doi. org/10.1108/PRT-09-2015-0091 (1.3.2021).
48. Guo S., Li Q., He W. W., Kang T. G. Correlation between effective components and powder color of Celosiae cristatae flos. Chin. J. Exp. Tradit. Med. Form. 2016; 24, 014. Abstract: https://en.cnki.com.cn/Article_en/CJFDTotal -ZSFX201624014.htm (25.2.2021).
49. Chai C. C., Mao M., Yuan J. F., Peng S. T., Wang J. Y., Liu N., Wei J., Li X. X., Zhang K., Li F. Correlation between color of Scutellariae radix pieces and content of five flavonoids after softening and cutting by different methods. China J. Chin. Mater. Med. 2019; 44, 4467–4475. Abstract: doi: 10.19540/j.cnki.cjcmm.20190630.306. (2.3.2021).
50. Zhang Y., Hu X. S. Chen F., Wu J. H., Liao X. J., Wang Z. F. Stability and colour characteristics of PEF-treated cyanidin-3-glucoside during storage. Food Chem. 2008; 106, 669–676. https://doi.org/10.1016/j.foodchem. 2007.06.030 (8.3.2021).
51. García-Marino M., Hernández-Hierro J. M., Rivas -Gonzalo J. C., Escribano-Bailón M. T. Colour and pigment composition of red wines obtained from co-maceration of Tempranillo and Graciano varieties. Anal. Chim. Acta 2010; 660, 134–142. https://doi. org/10.1016/j.aca.2009.10.055(31.3.2021).
52. Lu C., Li Y., Wang J., Qu J., Chen Y., Chen X., Huang H., Dai S. Flower color classification and correlation between color space values with pigments in potted multiflora chrysanthemum. Sci. Hortic. 2021; 283, 110082. https://doi.org/10.1016/j.scienta.2021.110082 (12.3.2021).
53. Xu M., Du C., Zhang N., Shi X., Wu Z., Qiao Y. Color spaces of safflower (Carthamus tinctorius L.) for quality assessment. J. Tradit. Chin. Med. Sci. 2016; 3, 168–175. https://doi.org/10.1016/j.jtcms.2016.11.004 (2.3.2021).
54. Argyropoulos D., Müller J. Kinetics of change in colour and rosmarinic acid equivalents during convective drying of lemon balm (Melissa officinalis L.). J. Appl. Res. Med. Aromat. Plants 2014; 1(1), e15–e22. https://doi. org/10.1016/j.jarmap.2013.12.001 (7.3.2021).
55. Li R. Q., Wu C., Xu L., Ma Y. C., Chen Y., Chao Z. M. Correlation between color and contents of chemical constituents in Aconiti lateralis radix praeparata. Chin. J. Pharm. Anal. 2019; 39, 1315–1322. doi: 10.16155/ j.0254-1793.2019.07.20 (2.3.2021).
56. He X. F., Wang L. L., Zhang J. Application of color analysis method in the field of medical research based on chromaticity. Chin. J. Pharm. Anal. 2018; 38, 1471–1475. http://dx.doi.org/10.16155/j.0254-1793.2018.09.01 (4.3.2021).
57. Eckschlager K., Horsák I., Kodejš Z. Vyhodnocování analytických výsledků a metod. Praha: SNTL – Nakladatelství technické literatury 1980.
58. Kumpanenko I. V., Roshchin A. V., Ivanova N. A., Bloshenko A. V., Shalynina N. A., Korneeva T. N. Colorimetry: Choice of colorimetric parameters for chro mophore concentration measurements. Russ. J. Gen. Chem. 2014; 84, 2295–2304. https://doi.org/10.1134/ S1070363214110498 (2.2.2021).
59. Ye X., Izawa T., Zhang S. Rapid determination of lycopene content and fruit grading in tomatoes using a smart device camera. Cogent Eng. 2018; 5, 1504499. https://doi.org/10.1080/23311916.2018.1504499 (21.3.2021).
60. Agarwal A., Dongre P. K., Gupta S. D. Smartphone-assisted real-time estimation of chlorophyll and carotenoid contents in spinach following the inversion of red and green color features. bioRxiv. 2021; https:// www.biorxiv.org/content/10.1101/2021.03.06.43423 7v1.full.pdf (21.3.2021).
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2021 Číslo 3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Antioxidační a anticytolytické účinky jako základ hepatoprotectivního účinku přípravku Pancreo-Plant® při akutní jaterní ischemii
- Metodika prístupu frikčných nákladov vo farmakoekonomických analýzach
- Fenolové kyseliny a antioxidační potenciál výhonků Caragana frutex
- Barevnost a obsah některých biologicky aktivních látek v přírodninách a v produktech přírodního původu
- Výzkum účinku modifikovaného fragmentu neuropeptidu Y na paměťové fáze a extrapolační únikový test zvířat
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výzkum účinku modifikovaného fragmentu neuropeptidu Y na paměťové fáze a extrapolační únikový test zvířat
- Metodika prístupu frikčných nákladov vo farmakoekonomických analýzach
- Barevnost a obsah některých biologicky aktivních látek v přírodninách a v produktech přírodního původu
- Fenolové kyseliny a antioxidační potenciál výhonků Caragana frutex
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



