-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Identifikácia lipoxygenázy s ω-6 dioxygenázovou aktivitou kvapalinovou chromatografiou
Identification of lipoxygenase expressing ω-6 dioxygenase activity by means of liquid chromatography
Lipoxygenases (LOX) represent a family of lipid peroxidising enzymes which catalyse the reaction of achiral polyunsaturated fatty acids by oxygen forming chiral peroxide products possessing high positional stereospecific purity. The four double bonds of arachidonic acid, the main substrate of animal LOX, present the position for a wide range of enzymatic modifications enabling eicosanoid creation, unique molecules with biological significance. In this study, lipoxygenase from rat lung cytoplasma was isolated and purified to 40-fold by combining hydrophobic and gel chromatography. The forming positional specific fatty acid hydroxyl-isomers were separated on a non-polar system (RP-HPLC) and identified on a polar adsorbent (SP-HPLC). In the purified enzyme, dual positional specificity was demonstrated by the production of 12 - and 15-HETE in the ratio of 1,0 : 1,38, which responds to the product spectrum of mammalian 15-LOX-1.
Keywords:
lipoxygenase • purification, HPLC analysis • 15-LOX-1
Autoři: Peter Hoffman; Mária Cupáková 1; Drahomíra Rauová 1; Renáta Kollárová; Mária Pekárová; Marek Obložinský; Lýdia Bezáková
Působiště autorů: Katedra bunkovej a molekulárnej biológie liečiv, Farmaceutická fakulta Univerzita Komenského ; Toxikologické a antidopingové centrum, Farmaceutická fakulta, Univerzita Komenského v Bratislave, Slovenská republika 1
Vyšlo v časopise: Čes. slov. Farm., 2012; 61, 53-59
Kategorie: Původní práce
Souhrn
Lipoxygenázy (LOX) tvoria rodinu lipidy peroxidujúcich enzýmov, ktoré katalýzou reakcie achirálnych polynenasýtených mastných kyselín s kyslíkom tvoria chirálne peroxidové produkty vysokej polohovej a priestorovej izomérnej čistoty. Štyri násobné väzby kyseliny arachidónovej, hlavného substrátu živočíšnych LOX, predstavujú miesta pre širokú škálu enzymatických modifikácií umožňujúcich vznik eikozanoidov ako unikátnych molekúl s biologickým významom. V rámci práce bola cytoplazmová LOX z pľúcneho tkaniva potkana izolovaná a purifikovaná do 40-násobného prečistenia kombináciou hydrofóbnej a gélovej chromatografie. Vznikajúce polohové hydroxy–izoméry mastných kyselín boli podrobené separácii na nepolárnom systéme (RP-HPLC) a identifikácii na polárnom adsorbente (SP-HPLC). U purifikovaného enzýmu bola dokázaná duálna polohová špecificita produkciou 12 - a 15-HETE v pomere 1,0 : 1,38, ktorá zodpovedá spektru produktov cicavčej 15-LOX-1.
Kľúčové slová:
lipoxygenáza • purifikácia • HPLC analýza • 15-LOX-1Úvod
Lipoxygenázy (LOX) v súčasnosti patria k intenzívne študovaným enzýmom v súvislosti s viacerými chronickými zápalovými a alergickými ochoreniami ako aj nádorovými procesmi a kardiovaskulárnymi ochoreniami. Spoločne s ďalšími unikátnymi enzýmami a inými neenzymatickými procesmi sa spolupodieľajú na tvorbe dnes už vyše 100 známych eikozanoidov. Tieto 20 uhlíkov obsahujúce metabolity sú zapojené vo vnútro - a medzibunkových signalizačných a komunikačných procesoch tak u rastlín, ako aj u živočíchov.
Živočíšne LOX sú vo vzťahu k ich polohovej špecificite pri oxygenácii kyseliny arachidónovej (AA) kategorizované na 4 izoformy: 5-LOX [EC 1.13.11.34], 8-LOX [EC 1.13.11.40], 12-LOX [EC 1.13.11.31] a 15-LOX [EC 1.13.11.33]. Medzi najviac preštudované patrí 5 LOX, ktorá je najvýraznejšia v procese rozvoja zápalových a alergických ochorení1, 2). Jej aktivita je dôkladne kontrolovaná viacerými regulačnými mechanizmami, predovšetkým enzýmom FLAP (5-lipoxygenase activating protein) a fosforyláciou. 12 - a 15-LOXs sa zúčastňujú najmä prostredníctvom metabolitov hydroxyeikozatetraénových kyselín (HETE) v rozvoji kardiovaskulárnych ochorení ale aj metastázovým potenciálom nádorových buniek 3, 4). Tieto enzýmy sa vyznačujú existenciou viacerých izoforiem, každá s jedinečným spektrom primárnych produktov 5) a vysokou polohovou a priestorovou špecificitou. Výnimkou sú tzv. LOX s duálnou aktivitou: 12/15-LOX, kam zaraďujeme 15 LOX-1 a leukocytový typ 12-LOX.
Kyselina arachidónová, substrát s najvyššou afinitou k živočíšnym LOX, môže byť po uvoľnení z membránových fosfolipidov metabolizovaná cyklooxygenázami (COX), cytochrómom P-450 (CYP) alebo lipoxygenázami (obr. 1). Oxygenáciu polynenasýtených mastných kyselín LOX nazývame lipoxygenázovou signalizačnou cestou. Najvýznamnejšie zastúpenie v nej majú cysteinyl-leukotriény (cys-LTs), spájané s rozvojom astmy bronchiale, a leukotrién B4 (LTB4) s 5-oxoeikozatetraénovou kyselinou (5-oxoETE) pôsobiace ako chemoatraktanty rôznych typov leukocytov6). Lipoxíny, metabolity 15-LOX dráhy, sa považujú za stop-signálne mediátory, s inhibičnými účinkami na leukotriénmi vyvolané reakcie pri zápale. Najmenej prebádanými eikozanoidmi sú eoxíny (EX) a hepoxilíny (HX), popisované ako prozápalové cytokíny7).
Obr. 1. Metabolicke dráhy kyseliny arachidónovej a syntéza najvýznamnejších eikozanoidov 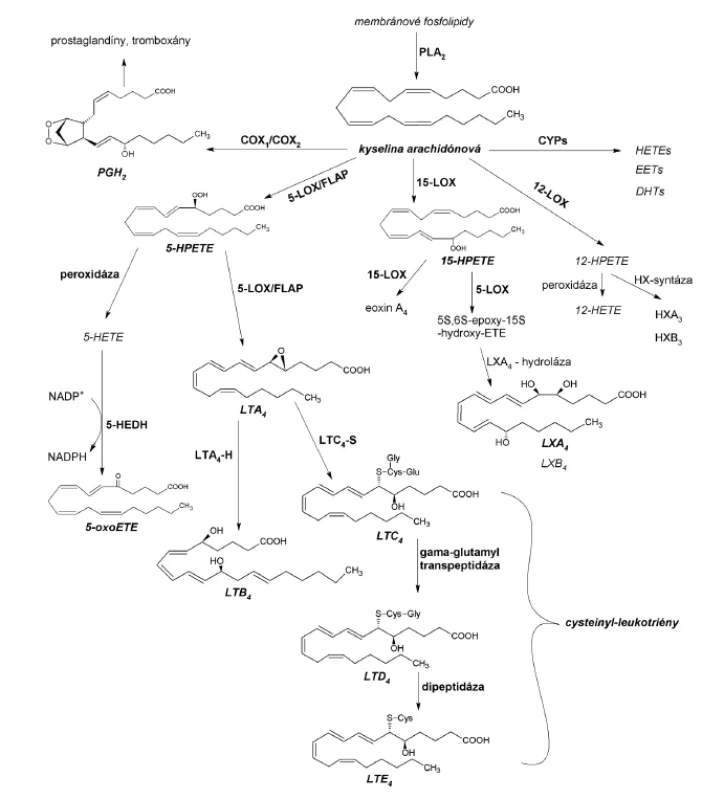
COX – cyklooxygenáza, CYP – pečeňový cytochróm P-450, DHT – dihydroxyeikozatriénová kyselina, EET – epoxyeikozatriénová kyselina, FLAP – 5-LOX aktivujúci proteín, LT – leukotrién, PG – prostaglandin Cieľom predloženej práce bolo izolovať a purifikovať lipoxygenázy vyskytujúce sa v cytoplazme pľúcneho tkaniva potkana a následne ich identifikovať prostredníctvom HPLC analýz. Identifikácia LOX je možná iba prostredníctvom separácie a identifikácie polohových izomérov vznikajúcich hydroxy-derivátov kyseliny arachidónovej (HETE), prípadne inej vhodnej polynenasýtenej mastnej kyseliny. V prípade LOX s duálnou polohovou špecificitou je potrebné porovnanie so súčasne inkubovaným príbuzným enzýmom s rovnakou polohovou špecificitou.
Experimentálna časť
Príprava vzoriek z cytozolovej frakcie pľúcneho tkaniva
Cytozolovú frakciu LOX sme získali homogenizáciou tkaniva s 0,05 mol.l-1 Tris-HCl tlmivým roztokom (pH 7,4) s prídavkom PMSF (inhibítor serínových proteáz; 0,001 mol.l–1) v pomere 1 ml homogenizačného roztoku na 0,2 g tkaniva a následným odstránením frakcie organel a nezhomogenizovaných buniek centrifugáciou pri 1000x g (10 min; SIGMA 3–30K). Supernatant sme podrobili precipitácii hemoglobínu ZnSO4.2H2O (1 mmol.l–1) pri 25 000x g (15 min, SIGMA 3–30K) a následným vysolením proteínov síranom amónnym na 30 % (odstránenie nukleových kyselín) a 60 % (vysolenie bielkovín). Sediment získaný centrifugáciou (25 000x g, 15 min, 4 °C, SIGMA 3–30K) po druhom vysolení sme po resuspendovaní vo fosforečnanovom elučnom roztoku A (50 mmol.l–1; pH 5,5; s 1 mol.l–1 koncentráciou síranu amónneho) podrobili frakcionácii hydrofóbnou chromatografiou.
Purifikácia lipoxygenáz
Za účelom purifikácie LOX sme použili hydrofóbnu chromatografiu na stĺpci Phenyl-Sepharose CL-4B (13 cm x ∅ 14 mm; rýchlosť prietoku 2 ml.min–1). Na stĺpec ekvilibrovaný fosforečnanovým elučným roztokom A sme aplikovali resuspendovanú vzorku a po jeho naadsorbovaní sme stĺpec premývali fosforečnanovými tlmivými roztokmi (pH 5,5; 50 mmol.l–1; gradient koncentrácie (NH4)2SO4 v roztoku A-C: 1,0–0,1 mol.l–1). Lipoxygenázu sme eluovali 50 mmol.l–1 fosforečnanovým tlmivým roztokom (pH 9,0) s obsahom Tween 20 (0,03% v/v; roztok D) (obr. 2).
Obr. 2. Separácia bielkovin na hydrofóbnom nosiči 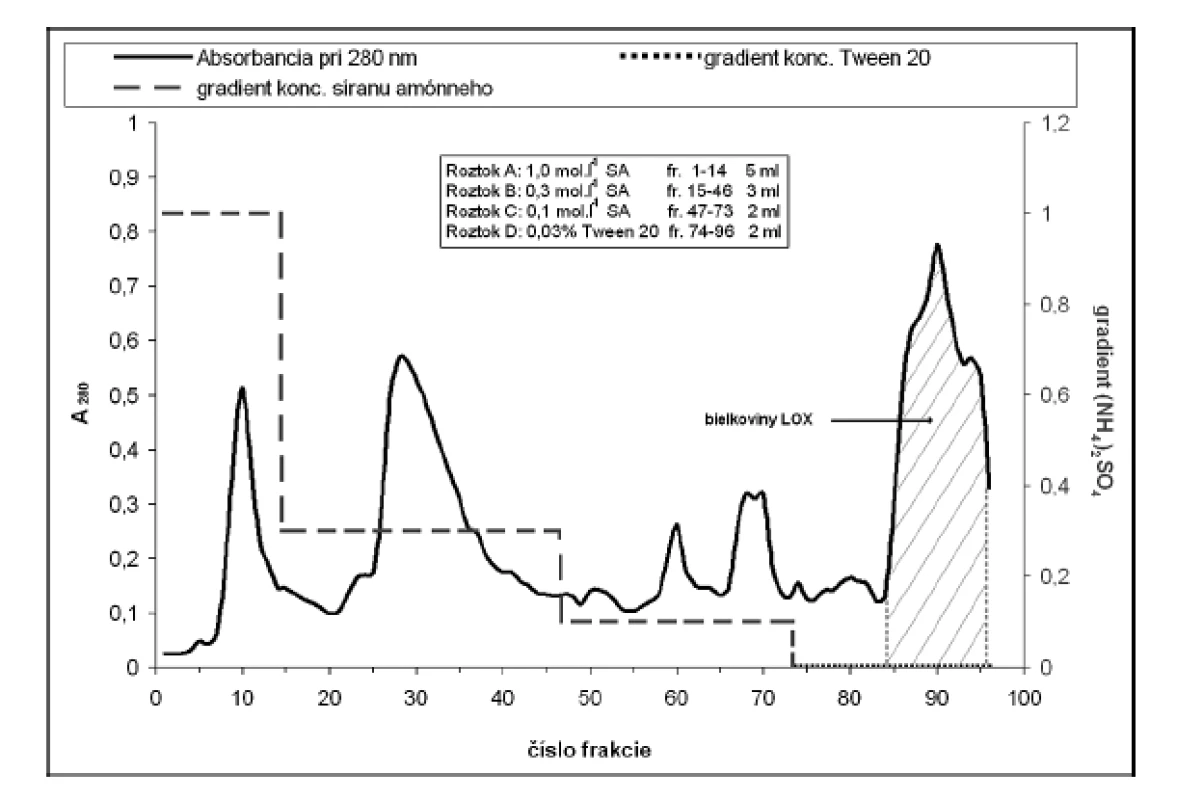
Na grafe je zobrazena elúcia bielkovin (A pri 280 nm); prerušovanou čiarou zmena gradientu síranu amónneho v elučnom roztoku (fosforečnanové tlmivé roztoky). Zvýraznená je oblasť spojených a zakoncentrovaných bielkovín LOX. Frakcie s najvyššou aktivitou LOX sme zakoncentrovali membránovým filtrom Amicon Ultra 50 kDa a po resuspendovaní v elučnom tlmivom roztoku Tris-HCl (50 mmol.l–1; pH 7,5) naniesli na stĺpec Sephadex G-100 (20 cm x ∅ 14 mm; rýchlosť prietoku 5 ml.min–1). Frakcie s najvyššou aktivitou LOX sme zakoncentrovali membránovým filtrom Amicon Ultra 50 kDa.
Stanovenie aktivity LOX
Aktivitu LOX vo vzorkách sme stanovili v UV oblasti pri 234 nm na spektrofotometri Lambda 35 UV/VIS Spectrometer (Perkin Elmer). Ako substrát sme použili solubilizovanú kyselinu linolovú v koncentrácii 1 mmol.l–1. Enzýmovú aktivitu (nkat.ml–1) sme vypočítali podľa Lambert–Beerovho zákona ako zmenu absorbancie v kyvete o hrúbke 1 cm v čase 1 minúty.
Stanovenie bielkovín
Bielkoviny vo vzorkách sme stanovili podľa Bradfordovej8).
Stanovenie hemoglobínu
Hemoglobín (Hb) vo vzorkách bol stanovený spektrofotometricky kyanomethemoglobínovou metódou (KIT – BioSystems, Španielsko).
HPLC analýza
Purifikovanú LOX (100 μl enzýmového preparátu, t.j. 0,046 mg bielkovín) a komerčnú sójovú LOX (Lipoxidase from Glycine max, Type V; 0,05mg na vzorku) sme 20 min inkubovali s kyselinou arachidónovou (10 μl 5% v/v etanolového roztoku, t.j. 1,514 mmol.l–1) v celkovom objeme 1 ml použitím Tris-HCl tlmivého roztoku (pH 7,5; 50 mmol.l–1). Vzniknuté hydroxy-produkty (HETE) sme extrahovali 2× 1 ml dietyléteru a po odparení rozpúšťadla uchovali v metanole pod inertnou atmosférou. Rovnakým spôsobom sme postupovali pri inkubácii s kyselinou linolovou (10 μl 10% v/v etanolového roztoku; t.j. 3,214 mmol.l–1) a identifikácii ich hydroxy-produktov (HODE). Dvojnásobná koncentrácia kyseliny linolovej oproti arachidonátu bola zvolená z dôvodu predpokladanej vyššej afinity živočíšnych LOX ku kyseline arachidónovej.
Pred samotnou analýzou bola vzorka odparená do sucha prúdom dusíka a rozpustená v 200 μl mobilnej fázy pre RP-HPLC metódu (chromatografia na reverzných fázach). Nástrek predstavoval 70 μl vzorky. Separácia HETE prebiehala na nepolárnej stacionárnej fáze (Nucleosil 120-5 C18) gradientovou elúciou mobilnej fázy (okyslený metanol: voda; gradient zložky A 85–100%; gradient rýchlosti prietoku 0,2 až 0,4 ml.min–1), tzv. RP-HPLC metódou. Eluát sme zachytávali v čase 23-24 min, odparili v prúde dusíka a rekonštituovali v 100 μl n-hexánu.
Identifikácia polohových izomérov HETE prebiehala na polárnom adsorbene (Zorbax Rx–SIL) elúciou zmesou okyslený n–hexán : 2–propanol (99 : 1 v/v; rýchlosť prietoku 0,2 ml.l–1), tzv. SP-HPLC metódou (chromatografia na priamej fáze). Nástrek predstavoval 50 μl vzorky. HPLC analýza prebiehala na kvapalinovom chromatografe Agilent Technologies 1050 Series (Holbron, SRN) v Toxikologickom a antidopingovom centre (TAC).
Výsledky a diskusia
Lipoxygenázy sú v rámci metabolickej premeny kyseliny arachidónovej na biologicky významné eikozanoidy predmetom intenzívnych štúdií. Cicavčie LOX sa líšia polohovou špecificitou a uhlíkovým atómom, na ktorý sa aduje molekula kyslíka do štruktúry kyseliny arachidónovej. Nomenklatúra vychádza z polohy, v ktorej dochádza k dioxygenácii dvojnej väzby. Podľa toho sú známe polohovo a priestorovo špecifické 5-, 8-, 12 - a 15 LOX. Zapojenie LOX v patologických procesoch je teda viazané na jednotlivé polohovo špecifické izoformy.
Purifikácii enzýmu predchádzalo úvodné prečistenie tkanivového homogenátu precipitáciou hemoglobínu Zn2+ iónmi a vysolením bielkovín síranom amónnym. Týmto postupom sme získali zo 48 ml homogenátu tkaniva 7,3 ml enzýmového preparátu, pričom špecifická aktivita LOX sa zvýšila 3,5 násobne (tab. 1).
Tab. 1. Sumarizácia LOX charakteristik v jednotlivých purifikačných stupňoch 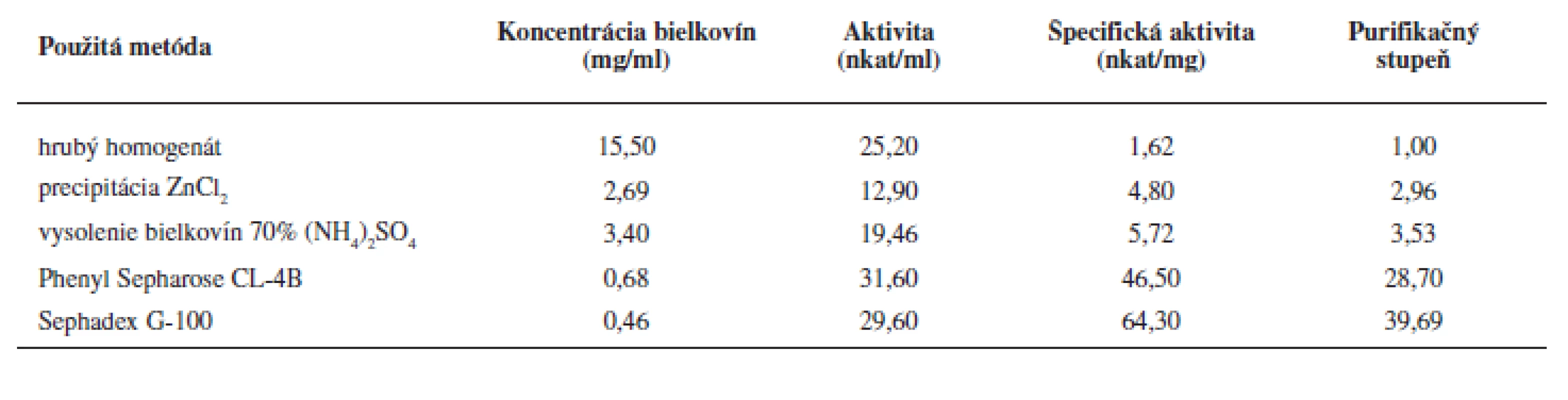
Na purifikáciu LOX sme použili chromatografiu na hydrofóbnom a gélovom adsorbente. LOX je pri hodnote pH blízkej jej izoelektrickému bodu hydrofóbnym proteínom a je zadržiavaná hydrofóbnymi silami v matrici chromatografickej náplne. K elúcii enzýmu dochádza až zmenou pH a prerušením väzieb neiónovým tenzidom Tween 20. Podobne purifikovali LOX zo sóje Flurkey a kol.9). Frakcie s najvyššou peroxidázovou aktivitou sme spojili (84–96) (viz obr. 2), zakoncentrovali pomocou membránového filtra Amicon Ultra 50 kDa a aplikovali na stĺpec Sephadex G-100. Elúciou tlmivým roztokom a stanovením aktivity sme frakcie s najvyššou lipoxygenázovou aktivitou (frakcie č. 10–18) opätovne spojili a zakoncentrovali membránovým filtrom. Vzorku o objeme 2 ml s 39,69-násobným (tab. 1) prečistením sme používali ako enzýmový roztok pre HPLC stanovenia.
Hemoglobín (Hb) v homogenáte bol stanovený ako 100%, precipitáciou Zn2+ iónmi (1 mmol.l–1) sme odstránili 83,1% Hb s tým, že lipoxygenázová aktivita vo vzorke klesla o 48,8%. Tento pokles však mohol súvisieť s poklesom kvázi–lipoxygenázovej aktivity Hb10). K úplnému odstráneniu Hb sme dospeli vo vzorke purifikovanej na stĺpci Phenyl-Sepharose CL-4B (údaje nie sú uvedené).
Purifikovaný enzým sme inkubovali s kyselinou arachidónovou (20 : 4, n-6) a linolovou (18 : 2, n-6). Súčasne sme analyzovali tvorbu hydroxyproduktov komerčnou sójovou LOX (Lipoxidase from Glycine max, Type V), ktorá sa vyznačuje 13(S)-peroxidázovou aktivitou. V dôsledku vstupu substrátu do substrát–viažucej dutiny CH3 - koncom, peroxidácia prebieha vždy v totožnej vzdialenosti od metylového konca (obr. 3). To umožňuje identifikáciu primárnej peroxidázovej aktivity aj u duálne špecifických LOX.
Obr. 3. Peroxidácia substrátu enzýmom s ω-6 katalytickou aktivitou. 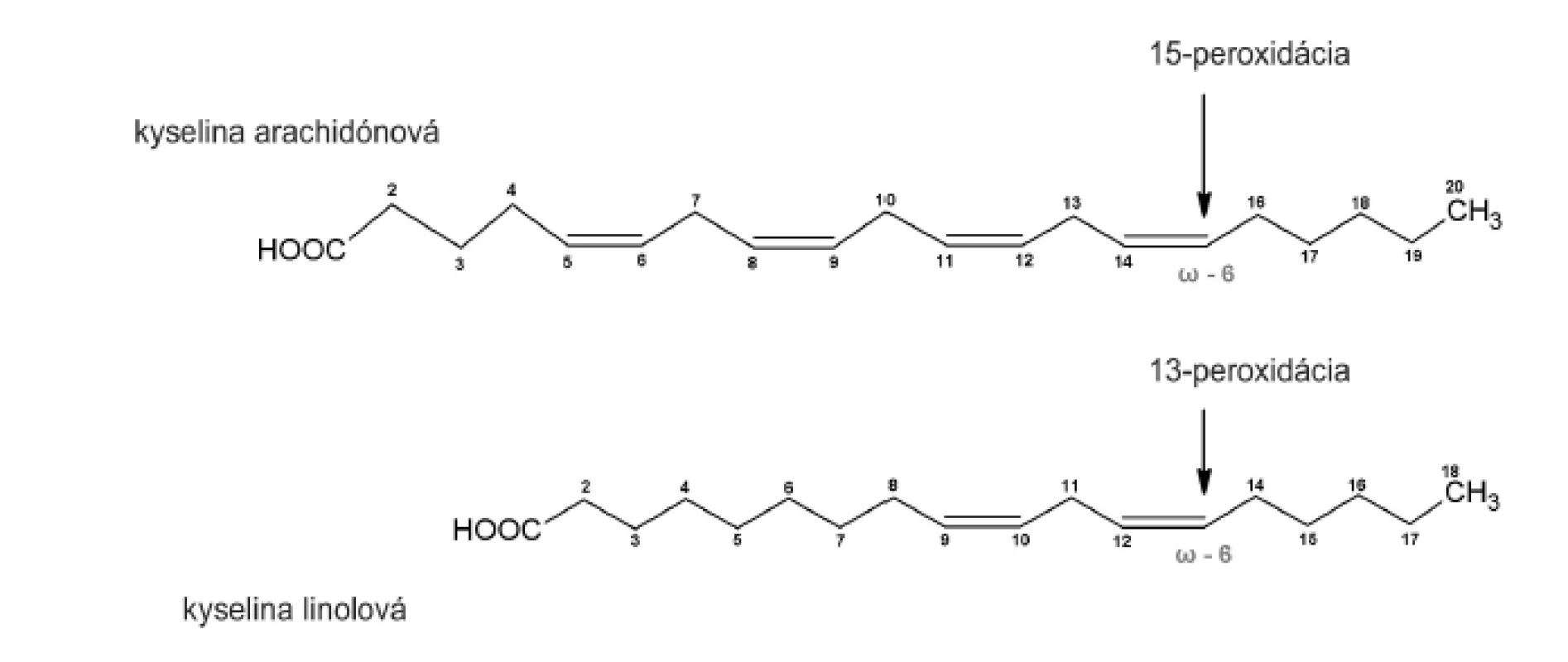
Lipoxygenázy katalyzujú peroxidáciu substrátu od -CH3 konca, v prípade 15-LOX tak bude vznikať z kyseliny arachidónovej 15-HETE a z kyseliny linolovej 13-HODE. HPLC analýzou hydroxyproduktov AA v zmesi s purifikovanou LOX sme identifikovali tvorbu 12 - a 15-HETE v pomere 1,0 : 1,38 (obr. 4). Analýzou produktov LA sme identifikovali prítomnosť 9 - a 13-HODE v pomere 1,0 : 1,54 (obr. 5 a 6). Súčasne sme analyzovali tvorbu hydroxyproduktov komerčnou LOX zo sóje (Lipoxidase from Glycine max, Type V) inkubáciou s AA a LA, ktorá sa vyznačuje 13(S)-peroxidázovou aktivitou. V analyte sme taktiež identifikovali tvorbu 9-HODE, avšak vo výrazne nižšej miere (1,0 : 2,84 v prospech 13-HODE). Inkubáciou s AA bol pomer 15-HETE k 12-HETE ešte výraznejší (100 : 1) (obr. 6). Výrazný rozdiel v aktivitách purifikovanej a sójovej LOX (asi 30-násobný) pri použití zhodného množstva bielkoviny enzýmu je pravdepodobne spôsobený stále nedostatočným stupňom prečistenia LOX z tkanivového preparátu.
Obr. 4. SP-HPLC záznam produktov inkubácie vzorky s kyselinou arachidónovou 
Rt = 5,426: 12-HETE; Rt = 5,820: 15-HETE Obr. 5. SP-HPLC záznam produktov inkubácie vzorky s kyselinou linolovou 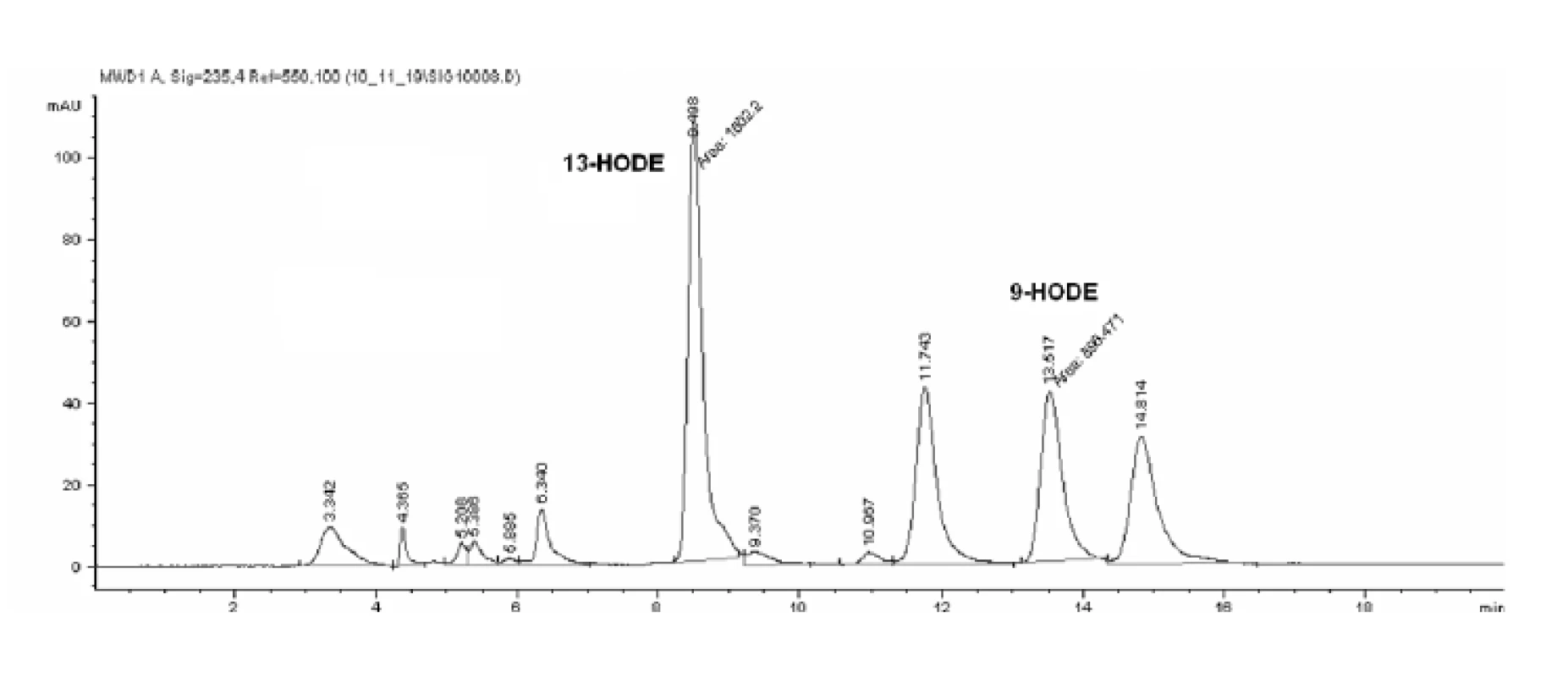
Rt = 8,498: 13-HODE; Rt =13,517: 9-HODE Obr. 6. Porovnanie spektra produktov purifikovanej a sójovej LOX inkubovaných s AA a LA 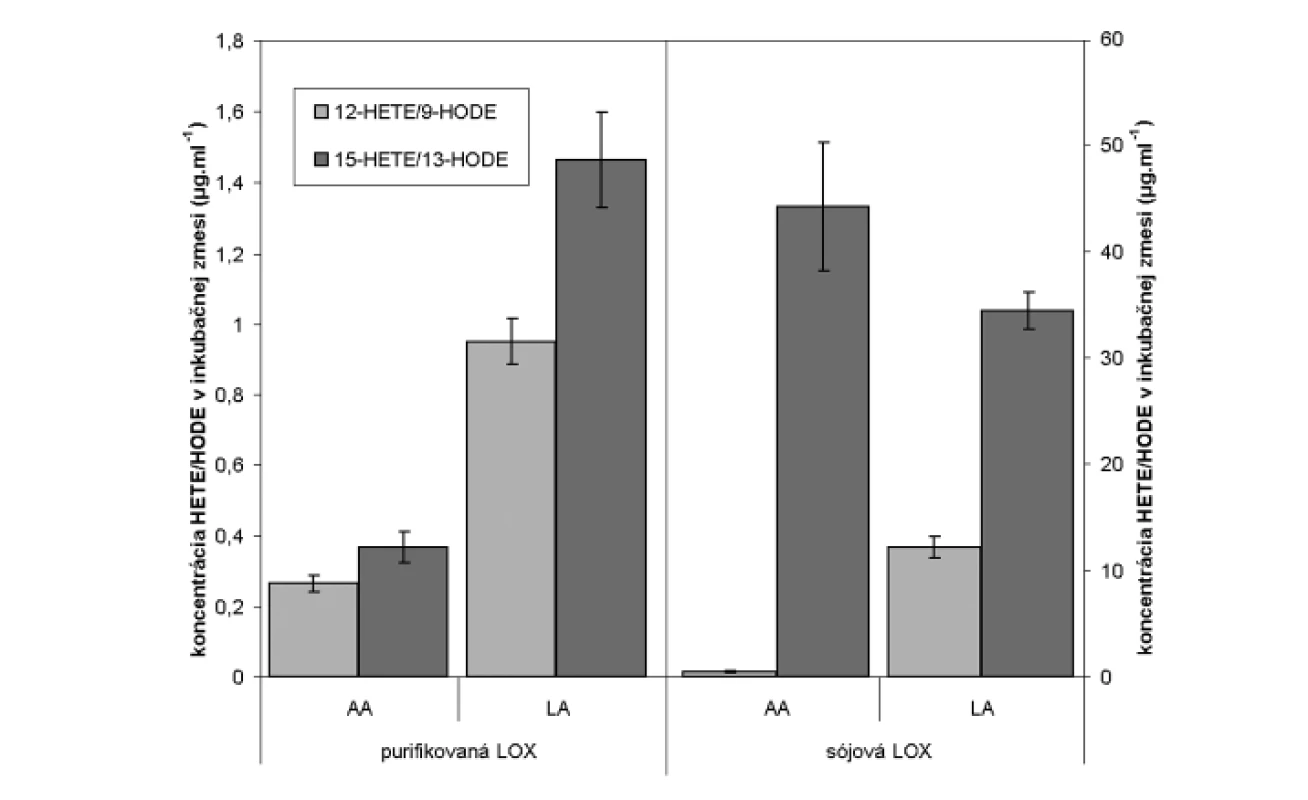
Uvedené výsledky vysvetľuje obrázok 3. Sójová LOX sa vyznačuje tvorbou polohovo špecifickej 13(S)-HODE v prípade LA a 15(S)-HETE v prípade AA, čiže sa vyznačuje ω-6 aktivitou, čo je vlastnosť 15-LOX enzýmov. Kým 15-LOX-2 je vysoko špecifická a tvorí iba 15(S)-HETE, 15-LOX-1 premieňa AA na 15-HETE a menšie množstvo 12-HETE11). Purifikovaná lipoxygenáza cytozolovej frakcie pľúc potkana má rovnakú ω-6 aktivitu, taktiež tvorí významné množstvo sekundárneho produktu: 12-HETE (ω-9) z arachidonátu a 9-HODE (ω 10) z LA. Rozdielnosť peroxidácie je spôsobená tým, že vznikajúci radikál kyseliny arachidónovej (počas katalytického cyklu) konjuguje so susediacimi násobnými väzbami a utvára produkt s najnižšou energiou. Na základe spektra produktov nami purifikovanej LOX môžeme predpokladať, že sme purifikovali a identifikovali 15 LOX-1, enzým s duálnou polohovou špecificitou.
Úloha 15-LOX-1, nazývanej taktiež retikulocytová 15-LOX alebo ALOX15, bola preukázaná v progresii rakoviny prostaty12), ale tiež v indukcii apoptózy kolorektálneho karcinómu13). Zvýšená aktivita 15 LOX-1 v epitelových bunkách pľúc je prozápalovým signálom v patogenéze astmy a ďalších zápalových ochoreniach pľúc14). Izolovanú izoformu LOX tak môžeme považovať za perspektívny cieľ v terapii uvedených ochorení.
Konflikt záujmov: žiadny.
Došlo 24. októbra 2011 /Přijato 28. novembra 2011
Mgr. Peter Hoffman
Katedra bunkovej a molekulárnej biológie liečiv
Farmaceutická fakulta Univerzita Komenského
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: hoffman@fpharm.uniba.sk
Zdroje
1. Werz O., Steinhilber, D. Therapeutic options for 5-lipoxygenase inhibitors. Pharmacol Therapeut. 2006; 112, 701–718.
2. Radmark O., Werz O., Steinhilber D., Samuelsson B. 5‑lipoxygenase: regulation of expression and enzyme activity. Trends Biochem Sci 2007; 32, 332–341.
3. González-Périz A., Claria, J. New approaches to the modulation of the cyclooxygenase-2 and 5-lipoxygenase pathways. Curr Top In Med Chem 2007; 7, 297–309.
4. Cyrus T., Pratico D., Zhao L., Witzlum J. L., Rader D. J., Rokach J., FitzGerald G. A., Funk C.D. Absence of 12/15-lipoxygenase expression decreases lipid peroxidation and atherogenesis in apolipoprotein E-deficient mice. Circulation 2001; 103, 2277–2282.
5. Iversen L., Kragballe K. Arachidonic acid metabolism in skin health and disease. Prostag Oth Lipid M 2000; 63, 25–42.
6. Powell W.S., Rokach J. Biochemistry, biology and chemistry of the 5-lipoxygenase product 5-oxo-ETE. Prog Lipid Res 2005; 44, 154–183.
7. Buczynski M. W., Dumlao D. S., Dennis E. A. Thematic review series: Proteomics. An integrated omics analysis of eicosanoid biology. J Lipid Res 2009; 50, 1015–1038.
8. Bradford, M. M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal Biochem 1979; 72, 248–254.
9. Flurkey W. H., Young L. W., Jen J. J. Separation of soybean lipoxygenase and peroxidase by hydrophobic chromatography. J Agric Food Chem 1978; 26, 1474–1476.
10. Hover C. G., Kulkarni A. P. A simple and efficient method for hemoglobin removal from mammalian tissue cytosol by zinc sulfate and its application to the study of lipoxygenase. Prostag Leukotr Ess 2000; 62, 97–105.
11. Calandria J. M., Marcheselli V. L., Mukherjee P. K., Uddin J., Winkler J. W., Petasis N. A., Bazan N. G. Selective survival rescue in 15-lipoxygenase-1-deficient retinal pigment epithelial cells by the novel docosahexaenoic acid-derived mediator, neuroprotectin D1. J Biol Chem 2009; 284, 17877–17882.
12. Jiang W. G., Watkins G., Douglas–Jones A., Mansel R. E. Reduction of isoforms of 15-lipoxygenase (15-LOX)-1 and 15-LOX-2 in human breast cancer. Prostag Leukotr Ess 2006; 74, 235–245.
13. Shureiqi I., Jiang W., Zuo X., Wu Y., Stimmel J. B., Leesnitzer L. M., Morris J. S., Fan H. Z., Fischer S. M., Lippman S. M. The 15-lipoxygenase-1 product 13-S-hydroxyoctadecadienoic acid down-regulates PPAR-∂ to induce apoptosis in colorectal cancer cells. P Natl Acad Sci USA 2003; 100, 9968–9973.
14. Liu C., Xu D., Liu L., Schain F., Brunnström A., Björkholm M., Claesson H. E., Sjöberg J. 15-lipoxygenase-1 induces expression and release of chemokines in cultured human lung epithelial cells. Am J Physiol 2009; 297, L196–L203.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2012 Číslo 1-2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Možnosti inovace individuální přípravy léčivých přípravků v lékárnách v České republice
- Deriváty kyseliny fenylkarbamové jako potenciální antituberkulotika
- Metabolomika vo výskume fytoterapeutík
- Hodnocení stability filmů z natrium-alginátu a chitosanu
- Časopis Česká a slovenská farmacie při vstupu do roku 2012
- Kompatibilita fosforečnanů se solemi vápníku v parenterální výživě
- Nové knihy
- Zvažované farmakoterapeutické přístupy léčby Alzheimerovy choroby
- Sledovanie účinnosti niektorých preventívnych opatrení proti chrípke
- Analytické hodnotenie mono[{3-[4-(2-etoxyetoxy)--benzoyloxy]-2-hydroxypropyl}-terc-butylamónium]fumarátu
- Nové knihy
- Identifikácia lipoxygenázy s ω-6 dioxygenázovou aktivitou kvapalinovou chromatografiou
- Štúdium lokálnych anestetík – časť 196* Formulácia lokálneho anestetika heptakaín do hydrogélov na báze chitosanu
- Pracovní den Sekce technologie lékůČeské farmaceutické společnosti ČLS JEPPokroky v lékových formách
- Doc. RNDr. Želmíra Bezáková, CSc. jubiluje
- 40. mezinárodní kongres pro dějiny farmacie
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti inovace individuální přípravy léčivých přípravků v lékárnách v České republice
- Kompatibilita fosforečnanů se solemi vápníku v parenterální výživě
- Metabolomika vo výskume fytoterapeutík
- Doc. RNDr. Želmíra Bezáková, CSc. jubiluje
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



