-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Testování efektu 2’, 3, 4’-trihydroxychalkonu u experimentálního diabetes mellitus – pilotní studie
Testing the effect of 2’, 3, 4’-trihydroxychalcone in experimental diabetes mellitus: a pilot study
The effect of 2’, 3, 4’ - trihydroxychalcone was monitored in the experimental conditions of alloxan-induced diabetes mellitus. The animals were divided by random selection into 2 groups (n = 7). The treated group was given chalcone in doses of 10 mg/kg in Avicel, the placebo group was given only a solution of Avicel. The last group was intact. Selected laboratory parameters (glucose, urea, cholesterol, antioxidative enzymes, total antioxidative capacity, malondialdehyde in serum; diuresis, total glucose and protein losses through urine) were determined. Kidney tissue and pancreas samples were taken for histopathological analysis. The results revealed a statistically significant decrease (p ≤ 0.01) in blood glucose level, a significant increase (p ≤ 0.01) in glutathione peroxidase, total antioxidative capacity (p ≤ 0.01) and a significant decrease (p ≤ 0.01) in the malondialdehyde level in the treated group compared to the placebo group. A highly significant decrease (p ≤ 0.01) in diuresis, glucose and protein losses through ureine was identified in the treated group compared to the placebo group. The superoxide dismutase catalytic activity, urea and cholesterol levels involved non-significant changes. The results of biochemical examination show a protective antioxidative and antihyperglycemic effect of tested chalcone. The results of histopathological examination correlate with them only partially.
Key words:
chalcones – diabetes mellitus – antioxidants
Autoři: L. Bartošíková 1; J. Nečas 1; T. Bartošík 2; M. Pavlík 2
Působiště autorů: Univerzita Palackého Olomouc, Lékařská fakulta, Ústav fyziologie 1; Fakultní nemocnice U svaté Anny v Brně, Anesteziologicko-resuscitační klinika 2
Vyšlo v časopise: Čes. slov. Farm., 2008; 57, 249-253
Kategorie: Původní práce
Souhrn
Pilotní studie sledovala efekt 2’, 3, 4’-trihydroxychalkonu u alloxanového diabetu v experimentu. Zvířata byla metodou náhodného výběru rozdělena do dvou skupin (n = 7). Léčené skupině byl podáván chalkon 10 mg/kg v 0,5% roztoku Avicelu perorálně 1× denně, skupině s placebem byl podáván pouze roztok Avicelu. Intaktní skupina byla bez zákroku a bez medikace. Byly stanoveny vybrané laboratorní parametry (glukosa, urea a cholesterol v séru, ztráty glukózy a bílkovin močí), diuréza, antioxidační enzymy (superoxiddismutasa, glutathionperoxidasa), celková antioxidační kapacita a hladina malondialdehydu, a to na konci experimentu. Byly odebrány vzorky ledvinné tkáně a pankreatu pro histopatologické vyšetření. Zjistili jsme statisticky významný pokles hladiny glukózy v séru (p ≤ 0,01), statisticky významný vzestup (p ≤ 0,01) katalytické aktivity glutathionperoxidasy a celkové antioxidační kapacity (p ≤ 0,01) u léčené skupiny ve srovnání se skupinou s placebem. Dále byl zjištěn statisticky významný pokles hladiny malondialdehydu (p ≤ 0,01), statisticky vysoce významný pokles (p ≤ 0,01) diurézy, glykosurie a ztrát bílkovin močí u léčené skupiny ve srovnání se skupinou s placebem. Superoxiddismutasa, cholesterol a urea nevykázaly signifikantní změny. Výsledky biochemického vyšetření ukazují na antioxidační a antidiabetický efekt 2’, 3, 4’-trihydroxychalkonu. Histopatologické nálezy s těmito výsledky korelují pouze částečně.
Klíčová slova:
chalkony – diabetes mellitus – antioxidantyÚvod
Diabetes mellitus je chronické onemocnění charakterizované hyperglykémií, jež je zapříčiněna nedostatečným působením insulinu1). V poslední době vzrůstá počet nemocných pacientů s cukrovkou 2. typu, a to především díky západnímu stylu života 2). Onemocnění je často spojováno s obezitou, dyslipidémií a hypertenzí (metabolický syndrom), které představují rizikové faktory kardiovaskulárních onemocnění 3).
Diabetes mellitus je spojen s oxidativními reakcemi, které jsou částečně katalyzovány přechodnými kovy, ale jejich příčinný vliv na poškození diabetických tkání je stále diskutován 4). Důkazy objasňující úlohu oxidativních pochodů v indukci diabetes mellitus pochází například ze studií, kde byl u experimentálních zvířat navozen modelový patologický stav pomocí alloxanu 5, 6). Alloxan selektivně toxicky poškozuje ß-buňky Langerhansových ostrůvků pankreatu a vede v závislosti na dávce k rozvoji různě závažné insulinopenie, a tedy i diabetes mellitus typu I. Alloxan vyvolá nejprve přechodnou stimulaci ß buněk, při které dojde k uvolnění intracelulárních zásob insulinu a vznikne krátkodobá hypoglykémie. Po několika dnech se pak u zvířat objeví insulinopenie s klasickými příznaky diabetu: hyperglykémie, glykosurie, polydipsie a polyurie. Toxicita alloxanu in vitro a in vivo může být inhibována cheláty, zhášeči hydroxylových radikálů a antioxidanty rozpustnými v tucích 4, 7).
2’, 3, 4’-trihydroxychalkon byl uměle nasyntetizován, a to tak, že 32 mmol 2, 4-dihydroxyacetofenonu (A) a 32 mmol 3-hydroxybenzaldehydu (B) se rozpustily v 80 ml methanolu a 40 ml vody. Po přidání 32 g hydroxidu draselného byla směs zahřívána k varu půl hodiny pod zpětným chladičem a poté ochlazena v ledové lázni. Za stálého míchání a chlazení byla směs neutralizována 32 ml koncentrované kyseliny chlorovodíkové. Reakční směs byla nalita do 300 ml ledové vody a vzniklá žlutá sraženina byla po 12 hodinách stání v chladu odfiltrována. Výsledný 2’, 3, 4’-trihydroxychalkon (C) byl přečištěn sloupcovou chromatografií na silikagelu s eluční směsí methanol : chloroform (1 : 5) (obr. 1).
Obr. 1. Syntéza 2’, 3, 4’- trihydroxychalkonu 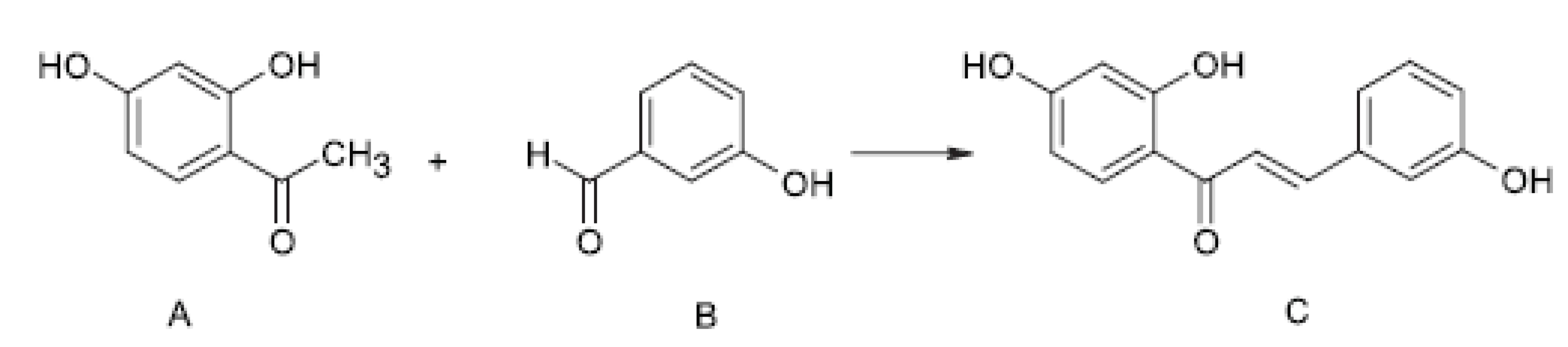
Testováním in vitro byla potvrzena jeho antibakteriální aktivita proti Staphylococcus aureus. Látka dále působila jako inhibitor aldosareduktasy z čočky skotu a ledvinné aldehydreduktasy u skotu, inhibitor glutathionreduktasy typu IV z kvasnic a jako inhibitor sorbitoldehydrogenasy z ovčích jater. Výsledky testování in vitro rovněž prokázaly antioxidační aktivitu ve srovnání s butylhydroxytoluenem (BHT). Proto byla látka následně testována v rámci in vivo experimentů, a to za uměle navozených podmínek oxidativního stresu.
Cílem práce bylo sledovat efekt 2’, 3, 4’-trihydroxychalkonu u alloxanem navozeného diabetes mellitus laboratorního potkana.
Vlastní studie a její průběh byl schválen a monitorován Etickou komisí Veterinární a farmaceutické univerzity Brno. Zdravotní stav všech zvířat byl pravidelně kontrolován několikrát denně jak po dobu aklimatizace zvířat, tak i v průběhu celého prováděného experimentu pracovní skupinou, jejíž členové jsou držitelé osvědčení Ústřední komise pro ochranu zvířat o způsobilosti dle § 17, zákona České národní rady č. 246/1992 Sb., na ochranu zvířat proti týrání.
Pokusná část
Materiál a metodika
Vlastní in vivo studie byla prováděna na laboratorních potkanech kmene Wistar SPF (původ AnLab s.r.o., SRN), samčího pohlaví, stejného stáří a srovnatelné tělesné hmotnosti (320 Ī 14 g). Zvířata byla umístěna jednotlivě ve skleněných metabolických klecích, byla krmena standardní dietou (Dieta pro malá laboratorní zvířata SPF M 1) a napájena vodou ad libitum.
Po době nezbytné pro aklimatizaci byl 20 zvířatům jednorázově podán alloxan tetrahydrát v dávce 50 mg/kg hmotnosti intravenózně. Po pěti dnech bylo provedeno stanovení hodnot glykémie pomocí přístroje Glucochir a diagnostických testovacích proužků Glucocard. Do pokusu byla zařazena zvířata, u nichž byla hladina krevního cukru zvýšena z primárních 4–6 mmol/l na 18 Ī 2 mmol/l. Metodou náhodného výběru byla zvířata rozdělena do dvou skupin (n = 7). Skupině léčené byl podáván 2’, 3, 4’-trihydroxychalkon v dávce 10 mg/kg perorálně v 0,5% roztoku Avicelu 1× denně. Placebo skupině byl podáván pouze 0,5% roztok Avicelu v množství 2 ml, rovněž perorálně × denně. Do experimentu byla zařazena ještě skupina zvířat intaktních (n = 7), bez navození patologického stavu a bez medikace.
Na začátku experimentu byla u zvířat všech skupin stanovena hodnota glukosy v séru, na konci experimentu byly u všech zvířat stanoveny vybrané laboratorní parametry (hladina glukosy, urey a cholesterolu v séru) spektrofotometricky za pomoci laboratorních testovacích souprav Diagnostika Lachema, antioxidační enzymy (superoxiddismutasa, glutathionperoxidasa) a celková antioxidační kapacita na automatickém analyzátoru Cobas Mira S, pomocí testovacích setů firmy Randox, Dublin.Rovněž byla jednorázově na konci experimentu stanovena hladina malondialdehydu v séru spekrofotometricky metodou TBARs 8). Dále byla stanovena diuréza a celkové ztráty glukosy (glykosurie) a bílkovin močí spektrofotometricky za pomoci laboratorních testovacích souprav Diagnostika Lachema.
Po ukončení medikace – 20. den – byla zvířata utracena exsanquinací a byly odebrány vzorky ledvinné tkáně a pankreatu pro histopatologické vyšetření. Materiál byl fixován v neutrálním 10% formolu a rutinně barven hematoxylinem-eosinem. Preparáty byly vyšetřeny v optickém mikroskopu erudovaným histopatologem bez znalosti experimentálního protokolu. Na histologických preparátech byl hodnocen stupeň poškození korové a dřeňové části parenchymu ledvin, zejména stav všech částí proximálních tubulů, obsah v jejich luminech, stav epitelií, jejich edém, ztráta brush border, pyknosa jader a ztráta jejich barvitelnosti.
Změny byly hodnoceny semikvantitativně co do rozsahu a intenzity poškození množství tubulů jako lehké, středně těžké a těžké.
Získané hodnoty sledovaných laboratorních parametrů byly zpracovány pomocí tabulkového procesoru Microsoft Excel a statisticky vyhodnoceny za pomoci programu UNISTAT, testu ANOVA a Studentova t-testu, hodnota p ≤ 0,05 byla považována za signifikantní.
Výsledky
Výsledky laboratorních vyšetření
Na začátku experimentu nebyl při srovnání skupiny zvířat léčených a placebové skupiny zjištěn signifikantní rozdíl. Na konci experimentu došlo k vysoce signifikantnímu snížení hodnoty glukosy v séru u skupiny léčené (p ≤ 0,01) (tab. 1).
Tab. 1. Hladina glukosy v séru 
** p ≤ 0,01 léčená vs. placebová Skupina intaktní nevykázala v průběhu experimentu žádné změny.
Hodnoty superoxiddismutasy nevykázaly na konci terapie signifikantní změny při porovnání hodnot skupiny léčené a placebové (v průběhu terapie se hodnoty naměřených hladin nezměnily).
Na konci terapie byl zjištěn statisticky významný rozdíl (p ≤ 0,01) hladiny glutathionperoxidasy u skupiny léčené ve srovnání se skupinou placebovou.
Statisticky významný rozdíl (p ≤ 0,01) hodnot celkové antioxidační kapacity u skupiny léčené ve srovnání se skupinou kontrolní jsme zjistili na konci terapie.
Statisticky vysoce významný pokles (p ≤ 0,01) hladiny MDA u skupiny léčené ve srovnání se skupinou placebovou byl zjištěn na konci terapie (tab. 2).
Tab. 2. Hodnoty denní diurézy, glykosurie a ztrát bílkovin močí na konci experimentu 
** p ≤ 0,01 léčená vs. placebová Hodnoty denní diurézy i glykosurie vykázaly vysoce signifikantní rozdíly (p ≤ 0,01) při porovnání hodnot léčené a placebové skupiny na konci experimentu. Rovněž byl zjištěn vysoce signifikantní rozdíl (p ≤ 0,01) u ztrát bílkovin močí při porovnání obou skupin (tab. 3).
Tab. 2. Hodnoty denní diurézy, glykosurie a ztrát bílkovin močí na konci experimentu 
** p ≤ 0,01 léčená vs. placebová Porovnáním hodnot cholesterolu a urey v séru u skupin léčené a placebové nebyl zjištěn signifikantní rozdíl na konci experimentu (tab. 4).
Tab. 4. Hodnoty cholesterolu a urey v séru na konci experimentu 
Výsledky histopatologického vyšetření
Ledvinná tkáň
Skupina léčená:
Hodnotitelné změny byly zastiženy jen v menších okrscích ledvinné kůry v rozsahu asi 10 %, mírnějšího stupně než u skupiny kontrolních zvířat s diabetes mellitus. Histologické změny byly hodnoceny jako lehké.
Skupina placebová:
Proximální tubuly vykázaly známky kalného zduření tubulárních epiteliálních buněk, vakuolární degeneraci, fokálně ztrátu barvitelnosti jader, ztrátu ostrosti buněčné membrány.
Tyto změny byly multifokální, lehkého stupně v rozsahu asi 40 %.
Skupina intaktní:
Normální stavba bez histopatologických změn.
Pankreas
Obě skupiny zvířat, jak léčená, tak i placebová měly exokrinní i endokrinní složku pankreatu obvyklé stavby bez výrazných histologických změn. U skupiny zvířat kontrolních byla nalezena mírná variace velikosti ostrůvků. Změny v pankreatu nebyly příznačné, i mírnou variabilitu ve velikosti a počtu ostrůvků je třeba hodnotit s rezervou, vzhledem k tomu že se tyto veličiny mění v závislosti na lokalitě odběru (hlava pankreatu × tělo pankreatu).
Skupina intaktní:
Normální stavba bez histopatologických změn.
Diskuze
Diabetes mellitus je syndrom, který je v začátku charakterizován ztrátou glukosové homeostasy. Onemocnění je progresivní a je spojeno s vysokým rizikem makroangiopatických (aterosklerotických) a mikroangiopatických komplikací, tj. především diabetické nefropatie, neuropatie a retinopatie, která může vyústit i v úplnou slepotu. Odchylky v regulaci peroxidů a v metabolismu přechodných kovů jsou schopné vést k onemocnění a postupně rozvinout i jeho dlouhodobé komplikace 9).
Účinky látek s potenciálním antioxidačním a antidiabetickým efektem in vivo jsou studovány experimentálně na patologických biomodelech, za stavů, u nichž významná účast volných radikálů v patogenezi byla prokázána 5, 6, 10). Diabetes mellitus je jedním z patologických stavů, které jsou vždy provázeny oxidačním stresem, tj. převahou oxidačních reakcí nad antioxidační ochranou tkání 11). V krvi a tkáních nemocných je prokazatelně vyšší tvorba reaktivních forem kyslíku a lipoperoxidů a současně snížené hladiny antioxidačně působících látek (vitamin C, vitamin E, kyselina lipoová, glutathion) a antioxidačně působících enzymů, např. superoxiddismutasa, katalasa 12–14). Podle současných názorů hraje oxidační stress významnou roli v etiopatogenezi diabetu 1. i 2. typu a má klíčový význam pro vznik a rozvoj diabetických komplikací.
Diabetes mellitus je charakterizován zvýšenou glykémií a často současnou glykosurií. Základním patogenetickým činitelem, který k hyperglykémii vede, je chybějící či nedostatečná sekrece insulinu nebo jeho nedostatečný účinek na úrovni buněk periferních tkání. Metabolické důsledky tohoto se promítají nejen do metabolismu sacharidů, často se projeví i jako porucha v metabolismu proteinů, jindy jako porucha metabolismu lipidů, jejíž patogeneze je však složitější 15).
Zvýšení hladiny glukosy v séru, stanovené na začátku a v průběhu experimentu byly důkazem navozeného patologického stavu pomocí alloxanu. Rovněž tak glykosurie jako důsledek překročení ledvinného prahu pro glukózu. Změny obou sledovaných parametrů vykázaly při statistickém vyhodnocování signifikantní změny při vzájemném porovnání hodnot léčené a placebové skupiny.
V rámci experimentu bylo zjištěno zlepšení hodnot ukazatelů antioxidačního systému, zejména významné zvýšení aktivity GSHPx a celkové antioxidační kapacity při srovnání hodnot léčené a placebové skupiny. Hodnoty SOD nevykázaly v průběhu experimentu signifikantní změny. Vyšetřované enzymy působí intracelulárně a jejich aktivita na sebe většinou navazuje 16). Statisticky významně vyšší hodnota celkové antioxidační kapacity u léčené skupiny je zřejmě důsledkem suplementace látkou s prokázaným antioxidačním účinkem in vitro. Rovněž změny MDA potvrzují předchozí nálezy. U skupiny léčené jsme nalezli na konci terapie statisticky významně nižší průměrné hodnoty tohoto vedlejšího toxického produktu lipoperoxidace, ve srovnání se skupinou placebovou na konci terapie.
Hladina cholesterolu byla v rámci experimentu monitorována jako doprovodný biochemický parametr a zároveň jako jeden z ukazatelů stavu tukového metabolismu za daného uměle navozeného patologického stavu u laboratorního potkana. Nebyly zjištěny signifikantní změny.
U pacientů s déletrvajícím diabetem a zvláště u dlouhodobě nedostatečně kompenzovaných diabetiků se setkáváme s výskytem chronických komplikací specifických a nespecifických 17). Jednou z chronických specifických komplikací je nález diabetické nefropatie, která je charakterizovaná proteinurií, často hypertenzí a pomalou postupnou alterací renálních funkcí. Diabetická nefropatie byla poprvé popsána v roce 1936 Kimmelstielem a Wilsonem jako interkapilární nodulární glomerulosklerosa. V užším smyslu slova diabetickou nefropatií rozumíme mikroangiopatické postižení ledvin.
V rámci experimentu byla u pokusných zvířat monitorována hladina urey v séru, ztráty celkových bílkovin močí a diuréza jako ukazatelé možného navození diabetické nefropatie. Hodnoty urey vykázaly nesignifikantní změny, diuréza byla ve srovnání se skupinou léčených zvířat signifikantně vyšší u placebové skupiny. Ztráty bílkovin močí rovněž vykázaly signifikantní změny při porovnání hodnot skupiny léčené a placebové.
Histopatologicky hodnotitelné změny v ledvinách závisí na délce trvání diabetu a na tom, zda a jak byl diabetes mellitus léčen. U krátkodobě trvajícího neléčeného onemocnění je za určitých okolností možno prokázat postižení charakteru diabetické nefrózy, která se mikroskopicky projevuje kalným zduřením, vakuolární degenerací, steatózou buněk proximálních tubulů, ztlustěním bazálních membrán a přítomností glykogenu v buňkách Armaniho zóny.
Histopatologické změny v pankreatu nebývají mikroskopicky příznačné a nález nebývá jednotný. U juvenilního diabetu může být počet ostrůvků snížen, někdy nacházíme degranulaci beta buněk, fibrózu ostrůvků a někdy lymfocytární infiltrace. U dospělých diabetiků bývá počet ostrůvků většinou normální nebo lehce snížený, ale není možno diabetes jednoznačně histologicky diagnostikovat.
2’, 3, 4’-trihydroxychalkon je syntetickou látkou, která byla zatím ojediněle použita pro testování in vivo na patologických biomodelech. Proto není možné námi zjištěné výsledky porovnat s výsledky jiných autorů. V literárních odkazech se setkáváme, zvláště poslední dobou, s experimenty, které jsou prováděny s chalkony přírodního typu.
Chalkony ať přírodní, či syntetické mají antioxidační aktivitu 18), efekt antimalarický 19), antileishmaniální 20), protizánětlivý 21) a antikancerogenní 22). O některých chalkonech je již dnes známo, že vykazují tzv. „inzulin-like“ aktivitu 9). Syntetické deriváty na bázi aryloxypropanolaminů působí v závislosti na strukturních odchylkách v různém procentu antihyperglykemicky 23, 24) při testování na modelu streptozocinového diabetu. Významným efektem chalkonů je inhibice aldosareduktasy, která hraje roli především v rozvoji pozdních diabetických komplikací 25). Chalkon izolovaný z chmele (Humulus lupulus L.) je ligandem pro farnesoid X-receptor a ovlivňuje lipidový a glukosový metabolismus 25).
Závěr
Výsledky předložené studie ukazují pozitivní antioxidační a antidiabetický efekt testovaného chalkonu in vivo v podmínkách alloxanem navozeného diabetes mellitus. Experimentálně získané výsledky by se tak mohly stát impulzem pro další preklinické analýzy.
Došlo 28. srpna 2008
Přijato 16. října 2008
Adresa pro korespondenci:
MUDr. PharmDr. Lenka Bartošíková, Ph.D.
Ústav fyziologie LF UP
Hněvotínská 3, 775 15 Olomouc
e-mail: bartosil@tunw.upol.cz
Zdroje
1. Saltiel, A. R., Kahn, R.: Nature, 2001; 414, 799–806.
2. Zimmet, P., Alberti, K. G. M., Shaw, J.: Nature, 2001; 414, 782–787.
3. Ginsberg, H., Plutzky, J., Sobel E.: J. Cardiovasc. Risk, 1999; 6, 337.
4. Wolff, S. P.: British Med. Bull., 1993; 49(3), 642–652.
5. Tang, L., Wei, W., Chen, L., Liu, S.: J. Ethnopharmacol., 2006; 108, 109–115.
6. Zanatta, L., de Sousa, E., Cazarolli, L. H. et al.: J. Ethnopharmacol., 2007; 109, 151–155.
7. Malaisse, W. J.: Biochem. Pharmacol., 1982; 22, 3527–3534.
8. Kosugy, H., Kikugava, K.: Free Rad. Biol. Med., 1989; 7, 205–207.
9. Enoki, T., Ohniti, H., Nagamine, K. et al.: J. Agricult. Food Chem., 2007; 55, 6013–6017.
10. Sharma, S. B., Nasir, A., Prabhu, K. M., Murthy, P. S.: J. Ethnopharmacol., 2006; 104, 367–373.
11. Sinclair, A. J.: Diabet. Rev., 1993; 2, 7–11.
12. Giugliano, D., Ceriello, A., Paoliso, G.: Diabet, Care, 1996; 19, 257–267.
13. Packer, L., Witt, E. H., Tritschler, H. J.: Biol. Med., 1995; 19, 227–250.
14. Wohaieb, S. A., Godin, D. V.: Diabetes, 1987; 36, 1014–1018.
15. Roy, S., Seghal, R., Padhy, B. M., Kumar, V. L.: J. Ethnopharmacol., 2005; 102, 470–473.
17. Anděl, M. et al.: Diabetes mellitus. 1. vyd. Praha: Galen, 2001, s. 78.
18. Indyah, S. A., Timmerman, H., Samhoedi, M. et al.: Eur. J. Med. Chem., 2000; 35, 449.
19. Chen, M., Christensen, S. B., Zhai, L. et al.: J. Infect. Dis., 1997; 176, 1327.
20. Nielsen, S. F., Christensen, S. B., Cruciani, G. et al.: J. Med. Chem., 1998; 41, 4819.
21. Hsin-Kaw, H., Tai-Hua, L., PyanWang, J. et al.: Pharma Res., 1998; 15, 39.
22. Kumar, S. H., Hager, E., Catherine, P. et al.: J. Med. Chem., 2003; 46, 2813.
23. Satyanarayana, M., Tiwari, P., Tripathi, B K. et al.: Bioorg. Med. Chem., 2004; 12, 883–889.
24. Shukla, P., Singh, A. B., Srivastava, A. K., Pratap, R.: Bioorg. Med. Chem., 2007; 17, 799–802.
25. Rastelli, G., Antolini, L., Benvenuti, S., Constantino, L.: Bioorg. Med. Chem., 2000; 8, 1151–1158.
26. Nozawa, H.: Biochem. Biophys. Res. Commun., 2005; 336, 754–761.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2008 Číslo 6- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Vliv hlohového extraktu na funkci mitochondrií srdce
- Spotřeba hypolipidemik v České republice v letech 2000–2007
- Testování efektu 2’, 3, 4’-trihydroxychalkonu u experimentálního diabetes mellitus – pilotní studie
- Stanovení metoprololu a jeho metabolitu α-hydroxymetoprololu v séru metodou HPLC s fluorescenční detekcí
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Ze zasedání Výboru České farmaceutické společnosti
- Zasedání Rady EUFEPS 2008
- RNDr. PhMr. Václav Mareš (6. září 1927–12. srpna 2008)
- KNIHY
- AUTORSKÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



