-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radiografická progrese u pacientů s revmatoidní artritidou při léčbě inhibitory JAK
Radiographic progression in patients with rheumatoid arthritis treated with JAK inhibitors
Rheumatoid arthritis (RA) is a chronic inflammatory autoimmune condition leading to irreversible joint destruction and deformities. In addition to the assessment of therapeutic response using composite disease activity scores, radiographic progression remains an important parameter of effective treatment. Inhibitors of Janus kinases (JAK) target intracellular signaling pathways of many mediators with an essential role in the pathogenesis of RA. Clinical efficacy, safety, and inhibition of radiographic progression of four JAK inhibitors of different selectivity used in our daily practice tofacitinib, baricitinib, upadacitinib, and filgotinib were demonstrated in clinical trials in RA. Data from baricitinib and tofacitinib clinical trials show their effect on inhibition of radiographic progression irrespective of disease activity or concomitant therapy with glucocorticoids supporting an important disease-modifying effect of JAK inhibitors.
Keywords:
rheumatoid arthritis – JAK inhibitors – radiographic progression
Autoři: M. Filková
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 30, 2022, No. 4, p. 158-165.
Kategorie: Přehledový článek
Souhrn
Revmatoidní artritida (RA) je chronické zánětlivé autoimunitní onemocnění spojené s ireverzibilním strukturálním poškozením kloubu a vznikem kloubních deformit. Kromě hodnocení účinnosti terapie podle kompozitních indexů je proto inhibice radiografické progrese neméně důležitým parametrem účinnosti léčby. Inhibitory Janusových kináz (JAK) tlumí nitrobuněčnou signalizaci řady mediátorů s významnou úlohou v patogenezi RA. Účinnost, bezpečnost a vliv na inhibici strukturální progrese v běžné praxi používaných čtyř inhibitorů JAK tofacitinibu, baricitinibu, upadacitinibu a filgotinibu, které mají odlišnou selektivitu, byla prokázána v řadě klinických hodnocení u celého spektra pacientů s RA. Data získaná z klinických hodnocení s baricitinibem a tofacitinibem ukazují, že inhibice radiografické progrese se zdá být nezávislá na aktivitě RA nebo souběžné terapii glukokortikoidy, což podporuje významný chorobu modifikující účinek inhibitorů JAK.
Klíčová slova:
revmatoidní artritida – inhibitory JAK – radiografická progrese
ÚVOD
Revmatoidní artritida (RA) je chronické zánětlivé autoimunitní onemocnění spojené se vznikem kloubních deformit a ireverzibilním strukturálním poškození kloubu (1). Synoviální hyperplazie a tvorba pannu je základní charakteristikou RA, která odráží nejen nadměrnou proliferaci synoviálních fibroblastů a jejich resistenci k apoptóze, ale také migraci zánětlivých buněk do synoviální tkáně (2). Kloubní destrukce, která má na rentgenovém snímku korelát v podobě kostních erozí, je dalším charakteristickým znakem RA. Synoviální fibroblasty prostřednictvím metaloproteináz (MMP, zejména MMP1 a MMP3) a dalších matrix-degradačních enzymů ze skupiny katepsinů přímo vedou k degradaci chrupavky, k aktivaci chondrocytů a ve spolupráci s makrofágy uvolňováním cytokinů, např. tumor nekrotizujícího faktoru alfa (TNF-α), interleukinu (IL)-1 a IL-17 ke katabolismu chrupavky (3). Aktivace synoviálních fibroblastů je řízena prozánětlivými cytokiny, jako je např. TNF-α, IL-6, IL-1 a stejně jako IL-17, IL-18, IL-22 a IL-23, ale také mechanismy nezávislé na cytokinech, které zahrnují vrozený imunitní systém (Toll-like receptory – TLR), jedinečnou komunikační síť mikročástic a epigenetické změny. Degradace kosti je důsledkem zrání prekurzorů osteoklastů aktivací drah RANKL (Receptor activator of nuclear factor κ-Β ligand), vlivem prozánětlivých cytokinů např. TNF-α, M-CSF (macrophage colony-stimulating factor) a i přímým účinkem aktivovaných T-lymfocytů na osteoklasty (2). Kromě snížení aktivity onemocnění je tak i prevence destrukce chrupavky a kosti důležitým terapeutickým cílem v léčbě RA.
Nejnovější a expandující skupinou léků v terapii RA jsou cílené syntetické chorobu modifikujících léky (targeted synthetic disease modifying antirheumatic drugs – tsDMARD), které představují inhibitory Janusových kináz (JAK). Inhibitory JAK jsou malé syntetické molekuly, které pronikají dovnitř buňky a inhibují transdukci signální dráhy JAK/STAT (signal transducer and activator of transcription). Signalizace cytokinů, např. IL-2, IL-6, IL-12 a IL-23 přes dráhu JAK vede k párování dvou ze čtyř enzymů skupiny JAK (JAK1, JAK2, JAK3 a TYK2), kdy po navázání cytokinu na buněčné receptory dochází k fosforylaci JAK a intracelulárních částí receptorů s následnou aktivací STAT, jejich přesunu do buněčného jádra, kde ovlivňují expresi cílových genů (4).
HODNOCENÍ ÚČINNOSTI A RADIOGRAFICKÉ PROGRESE V KLINICKÉM HODNOCENÍ
Data z posledních 20 let ukazují, že v klinických hodnoceních u pacientů s RA můžeme pozorovat zpomalení strukturální progrese (5). Tento fakt plyne z časnější diagnózy a nasazení účinné léčby RA a z etických důvodů z co nejkratšího trvání zaslepené části s placebem (maximálně 12–16 týdnů). Minimalizace expozice placebu představuje metodické problémy s prokázáním míry terapeutického účinku a strukturálního postižení, protože pomalá radiografická progrese v kontrolních skupinách může mít vliv na statistickou sílu. Vzhledem k potřebě poskytnout údaje o dlouhodobé účinnosti léčby (≥ 1 rok) výzkumníci nemají někdy jinou možnost než extrapolovat data o účinnosti, včetně strukturální progrese. Takové extrapolace mají tendenci vést k širším intervalům spolehlivosti (CI) a zvýšit pravděpodobnost, že se grafy pro referenční a srovnávací ramena budou překrývat. Z metodologického hlediska je možným řešením zvýšení počtu pacientů a/nebo zahrnutí pacientů s RA, kteří mají vysoké riziko radiografické progrese.
Většina randomizovaných klinických hodnocení má obvykle jako primární cíl vyhodnocení účinnosti, které je obvykle hodnoceno podle kritérií Americké koleje revmatologů (American College of Rheumatology – ACR 20/50/70) a vyjádřeno jako podíl pacientů s ≥ 20/50/70 % snížením počtu bolestivých a oteklých kloubů a ≥ 20/50/70% zlepšení ve třech z pěti dalších kritérií: pacientovo hodnocení bolesti, úroveň funkčního postižení, hladiny C-reaktivního proteinu (CRP) nebo sedimentace erytrocytů (FW), celkové hodnocení onemocnění pacientem a globální hodnocení onemocnění lékařem.
Hodnocení radiografické progrese většinou patří mezi sekundární cíle, méně často mezi cíle primární. Obvykle je hodnoceno již po 12 či 24 týdnech klinického hodnocení v porovnání s placebem, ale pro klinickou praxi je jistě validnější hodnocení po delším časovém úseku v porovnání s aktivním komparátorem. V klinických hodnoceních se za tímto účelem obvykle používá celkové Sharpovo skóre modifikované podle van der Heijde (total modified Sharp/van der Heijde score – mTSS), které se pohybuje od 0 do 448, přičemž vyšší skóre znamená větší strukturální poškození kloubů). Skóre zohledňuje erozivní změny v kloubech (v rozpětí 0 až 280, kde vyšší skóre indikuje větší erozivní postižení) a zúžení kloubního prostoru (joint space narrowing – JSN, v rozmezí od 0 do 168, kde vyšší skóre indikující větší zúžení kloubní štěrbiny). Žádná radiografická progrese je definovaná jako změna od vstupních hodnot ≤ 0,5 jednotky a žádná nová eroze je definována jako změna skóre od vstupních hodnot ≤ 0,5 jednotky (6).
VLIV LÉČBY JAK INHIBITORY NA RADIOGRAFICKOU PROGRESI U PACIENTŮ S RA
V současnosti jsou pro použití v léčbě RA v České republice schváleny čtyři inhibitory JAK: tofacitinib, baricitinib, upadacitinib a filgotinib.
Tofacitinib
Klinická účinnost tofacitinibu jako prvního z generace JAK inhibitorů, který inhibuje JAK3 a JAK1 s funkční selektivitou oproti JAK2, byla prokázána v programu ORAL u pacientů s časnou neléčenou RA (ORAL Start) (7), u pacientů s RA s nedostatečnou odpovědí na methotrexát (MTX, ORAL Standard (8), ORAL Scan (9), včetně přímého „head-to-head“ porovnání s adalimumabem v ORAL Strategy (10)), konvenční syntetické DMARD (csDMARD, ORAL Sync) (11) nebo biologické DMARD (bDMARD, ORAL Sync) (11) a ORAL Step) (12), případně u pacientů s RA s nedostatečnou odpovědí na více než 1 csDMARD nebo bDMARD (ORAL Solo) (13).
V programu pro vývoj tofacitinibu bylo v hodnocení ORAL Start (7) u doposud neléčených pacientů s RA jako primárního cíle dosaženo klinického zlepšení ACR70 v 6. měsíci u 25,5 % a 37,7 % pacientů léčených 5 mg a 10 mg tofacitinibu 2krát denně a 12 % pacientů léčených MTX (p < 0,001 pro obě srovnání). I přes mírnou radiografickou progresi ve všech skupinách vedla terapie tofacitinibem ke zpomalení rentgenové progrese dle mTSS v 6. měsíci (0,2 bodu ve skupině s 5 mg tofacitinibu a < 0,1 bodu ve skupině s 10 mg tofacitinibu ve srovnání s 0,8 bodu ve skupině MTX, p < 0,001 pro obě srovnání). Stejně tak i v sekundárních cílech, kterými byla změna v mTSS v měsíci 12 (+0,4 vs. +0,2 vs. +1,2, p < 0,001 pro všechna srovnání) a měsíci 24 (+0,5 vs. +0,3 vs. +2,1, p < 0,001 pro všechna srovnání), byla radiografická progrese výrazně menší v obou skupinách s tofacitinibem než ve skupině léčené MTX.
V jinak koncipovaném klinickém hodnocení ORAL Scan (9) vedla léčba oběma dávkami tofacitinibu k menší radiografické progresi dle mTSS oproti placebu, ale statisticky významné rozdíly celkového mTSS skóre byly ve 12. měsíci oproti placebu pouze pro tofacitinib v dávce 10 mg 2krát denně (+0,92 vs. +0,05, p < 0,01), ale ne při dávce 5 mg 2krát denně (+0,29, p = 0,056). Statistického rozdílu pro obě skupiny léčené tofacitinibem bylo dosaženo pro JSN, ale ne pro erozivní skóre. Podíl pacientů bez rentgenové progrese byl statisticky významně vyšší u obou skupin léčených tofacitinibem v porovnání s placebem (86,4 % vs. 86,0 % vs. 74,1 %, p < 0,01). V post hoc analýzách prognostické faktory predikující větší progresi poškození kloubu byly pozitivita protilátek proti citrulinovanému proteinu (anti-CCP), aktivita podle skóre DAS28-FW > 5.1 a anti-CCP pozitivita a/nebo pozitivita revmatoidních faktorů (RF) současně se skóre erozí ≥ 3.
I přesto, že dlouhodobá terapie glukokortikoidy (GK) není v léčbě RA indikována a doporučuje se jejich časné vysazení (14), má terapie nízkou dávkou GK určitý chorobu-modifikující efekt. Post hoc analýza šesti klinických hodnocení programu ORAL hodnotila účinek GK na klinickou účinnost a radiografickou progresi u pacientů léčených tofacitinibem (15). Souběžná terapie GK neměla vliv na klinickou účinnost dle ACR kritérií či dalších kompozitních indexů, ani na radiografickou progresi u pacientů léčených tofacitinibem bez předchozí expozice MTX, ale kombinace MTX a GK částečně zpomalila rentgenovou progresi oproti monoterapii MTX (obr. 1). V rámci každé jednotlivé léčebné skupiny (tofacitinib 5 mg a 10 mg a MTX), bylo % zastoupení pacientů bez radiografické progrese ve 24. měsíci podobné bez ohledu na použití GK, ale větší procento pacientů léčených tofacitinibem nemělo žádnou radiografickou progresi ve srovnání s MTX, bez ohledu na současné použití GK (81,1 % a 78,5 % léčených 5 mg tofacitinibu s/bez terapie GK, p < 0,05; 82,1 % a 84,7 % léčených 10 mg tofacitinibu s/bez terapie GK, p < 0,001) v porovnání s MTX (62,8 % a 65,9 % léčených MTX s/bez terapie GK).
Obr. 1. Rentgenová progrese u pacientů léčených tofacitinibem v klinickém hodnocení ORAL Start v závislosti od konkomitantní terapie glukokortikoidy. Zatím co kombinace methotrexátu s glukokortikoidy částečně zpomalila rentgenovou progresi oproti monoterapii methotrexátem (a), tak konkomitantní terapie glukokortikoidy neměla vliv na radiografickou progresi u pacientů léčených tofacitinibem v dávce 5 mg (b) či 10 mg 2krát denně (upraveno podle (15)). 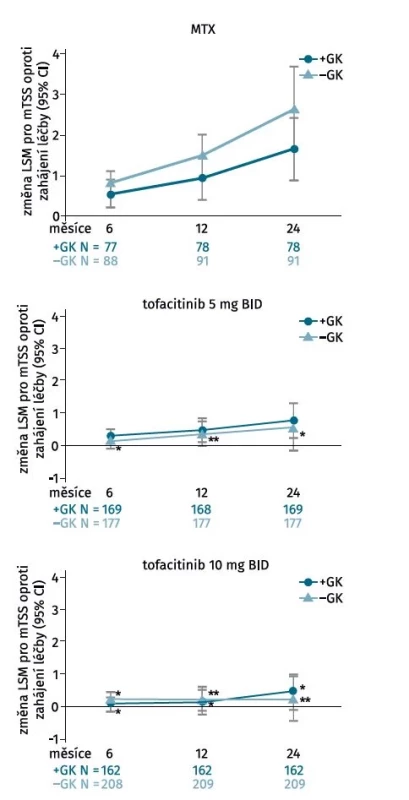
BID – dvakrát denně, GK – glukokortikoidy, LSM – střední hodnota nejmenších čtverců (least squares mean), mTSS – modifikované Sharpovo skóre (modified total Sharp score), MTX – methotrexát
*p < 0,05; **p < 0,001 v porovnání s MTX v každé skupiněS ohledem na chronický průběh RA má obrovskou hodnotu analýza rentgenové progrese po několika letech od zahájení terapie (16). Radiografická progrese u pacientů s RA dlouhodobě léčených tofacitinibem byla vyhodnocena po 3 letech ve dvou dlouhodobých prodloužených studiích (ORAL Sequel, primární analýza) a po 5 letech s použitím dat integrovaných z jednoho klinického hodnocení fáze 2, dvou studií fáze 3 a dvou prodloužených studií (průzkumná analýza). U všech pacientů léčených tofacitinibem s rentgenovými údaji dostupnými po 3 letech byla průměrná rentgenová progrese mTSS +1,14 a 74,3 % pacientů nevykazovalo žádnou rentgenovou progresi podle mTSS skóre. Podobné hodnoty byly pozorovány bez ohledu na dávku tofacitinibu, nebo zda pacienti dostávali tofacitinib v monoterapii nebo s csDMARD. V průzkumné analýze integrovaných klinických hodnocení byla po 5 letech zaznamenaná rentgenová progrese se zhoršením mTSS +3,34 bodu.
Baricitinib
Klinická účinnost baricitinibu jako selektivního inhibitoru JAK1 a JAK2 byla prokázána u dosud neléčených pacientů s časnou RA (RA-BEGIN) (17), u pacientů se selháním terapie MTX (RA-BEAM) (18), jiných csDMARD (RA BUILD) (19) a bDMARD (RA-BEACON) (20).
V klinickém programu pro vývoj baricitinibu bylo v klinickém hodnocení RA-BUILD (19) dosaženo primárního cíle, kdy odpovědi ACR20 dosáhlo více pacientů léčených baricitinibem v porovnání s placebem (62 % vs. 39 %, p ≤ 0,001). Vedlejším cílem této studie byl i vliv baricitinibu na rentgenovou progresi. Statisticky významně pomalejší radiografická progrese dle mTSS byla v týdnu 24 u obou skupin léčených baricitinibem v dávce 2 mg a 4 mg v porovnání s placebem (+0,33 vs. +0,15 vs. +0,77, p ≤ 0,05 pro 2 mg a p ≤ 0,01 pro 4 mg baricitinibu). Zároveň ve skupinách léčených baricitinibem bylo signifikantně více pacientů bez radiografické progrese (81,7 % pro 2 mg a 88,9 % pro 4 mg baricitinibu vs. 77,4 % ve skupině s placebem, p ≤ 0,01).
V klinické studii RA-BEAM (18) bylo v týdnu 12 dosaženo primárního cíle, kterým byla klinická odpověď ACR20 u signifikantně většího počtu pacientů léčených baricitinibem 4 mg v porovnání s placebem (70 % vs. 40 %, p ≤ 0,001). Dále bylo dosaženo i sekundárních cílů, kde ve srovnání s adalimumabem byla dosažena hranice non-inferiority baricitinibu vůči adalimumabu, podle DAS28 byla dosažena hranice superiority ve prospěch baricitinibu. Dále byla rentgenová progrese po 24 týdnech ve skupině léčené 4 mg baricitinibu výrazně pomalejší než ve skupině s placebem (+0,41 pro 4 mg baricitinibu vs. +0,90 pro placebo p ≤ 0,001, +0,33 pro adalimumab).
Pacienti, kteří ukončili jednu ze tří studií fáze 3 s baricitinibem (RA-BEGIN, RA-BEAM a RA-BUILD), byli posléze zařazeni do dlouhodobého sledování s názvem RA-BEYOND (21), kde byli léčeni baricitinibem 2 mg nebo 4 mg. Pacienti, kteří zpočátku užívali placebo, byli převedeni na baricitinib 4 mg ve 24. týdnu. Rentgenová progrese byla dle nejnovějších publikovaných dat hodnocena po 5 letech od zahájení studie. Od 3. do 5. roku sledování nemělo žádnou rentgenovou progresi více pacientů dosud neléčených DMARD na iniciální terapii baricitinibem – ať už v monoterapii, nebo v kombinaci s MTX (ΔmTSS ≤ 0 v roce 5 : 59,6 % v skupině s 4 mg baricitinibu vs. 66,2 % v skupině 4 mg baricitinibu + MTX vs. 40,7 % ve skupině s MTX). Vyšší podíl pacientů s předchozí nedostatečnou odpovědí na MTX s následnou léčbou baricitinibem nebo adalimumabem neměl oproti placebu žádnou progresi (ΔmTSS ≤ 0 v roce 5 : 54,8 % ve skupině s 4 mg baricitinibu vs. 55,0 % ve skupině s adalimumabem vs. 50,3 % ve skupině s placebem). Podobně nemělo žádnou rentgenovou progresi více pacientů s nedostatečnou odpovědí na csDMARD s následnou léčbou 4 mg baricitinibu v porovnání s 2 mg baricitinibu nebo placebem (ΔmTSS ≤ 0 v roce 5 : 66,7 % ve skupině s 4 mg baricitinibu vs. 58,2 % ve skupině s 2 mg baricitinibu vs. 60,0 % ve skupině s placebem).
I přes časnou diagnózu a léčbu má obecně značná část pacientů s etablovanou RA, kteří vstupují do klinických hodnocení, poměrně pokročilé rentgenové poškození (22, 23). Zatímco otok nebo synovitida reflektují lokální zánět, tak reaktanty akutní fáze odrážejí systémové zánětlivé procesy. Ty jdou sice obvykle ruku v ruce, ale rentgenová progrese je více asociována s otoky kloubů než s humorální aktivitou. Ačkoliv účinná léčba csDMARD signifikantně snižuje závažnost rentgenové progrese, eventuálně ji při dosažení remise dle nejstriktnějších parametrů zastaví, určitá míra strukturální progrese při terapii csDMARD obvykle i přesto pokračuje, a to v závislosti od reziduální aktivity onemocnění (24–27). Před několika lety bylo pozorováno, že na rozdíl od lineární strukturální progrese u pacientů s RA na terapii MTX, která korelovala s aktivitou nemoci, nebyla radiografická progrese u pacientů léčených infliximabem v kombinaci s MTX zaznamenána, a to i přesto, že aktivita nemoci se pohybovala v pásmu střední až vysoké aktivity (28). Podobný efekt byl pozorován i u rituximabu nebo u tocilizumabu (29, 30).
Předpokládá se, že důvodem narušení těsného spojení mezi aktivitou nemoci a strukturálním poškozením je tzv. prahový efekt, kdy aktivace osteoklastů zodpovědných za vznik kostních erozí vyžaduje vyšší koncentrace zánětlivých cytokinů (např. TNF), než jsou hladiny potřebné na udržení zánětlivého procesu. Proto, pokud dojde k inhibici těchto cytokinů pomocí bDMARD, může být následné snížení jejich hladin zcela dostatečné na potlačení aktivace osteoklastů (a tím i potlačení destrukce kloubů), ale nedostatečné k potlačení synovitidy (a tím perzistenci artritidy) (31). To naznačuje, že bDMARD mají větší potenciál na snížení zánětlivých cytokinů (např. TNF a IL-6) než csDMARD a tím pádem více eliminují mechanismy vedoucí k osteoklastogenezi (32).
V tomto kontextu se otázkou strukturální progrese u pacientů léčených baricitinibem s a bez konkomitantní terapie MTX zabývala analýza dat klinických hodnocení RA-BEGIN a RA-BEAM (obr. 2) (22). U pacientů s nedostatečnou odpovědí na MTX v studii RA-BEAM byla radiografická progrese v 24. týdnu při léčbě baricitinibem pomalá bez ohledu na aktivitu nemoci (–0,09 (95% CI –0,41 až –0,22), p = 0,6), zatímco u pacientů ve větvi s placebem byla jasná souvislost s aktivitou nemoci: výrazně nižší u pacientů v remisi a s nízkou aktivitou ve srovnání s pacienty se střední/ vysokou aktivitou onemocnění (–0,53 (95% CI –0,98 až –0,09), p = 0,02). Dále pacienti se střední nebo vysokou aktivitou léčení baricitinibem měli menší progresi než pacienti se střední/vysokou aktivitou ve větvi s placebem (–0,50 (95% CI –0,78 až –0,23), p < 0,001). U pacientů ve studii RA-BEGIN, kteří nebyli dosud léčeni csDMARD, byla v týdnu 52 u pacientů při léčbě MTX v remisi nebo s nízkou aktivitou radiografická progrese nižší oproti pacientům se střední či vysokou aktivitou (–1,26 (95% CI –1,96 až –0,57), p < 0,001). Nicméně ve skupinách léčených baricitinibem v kombinaci s MTX (–0,22 (95% CI –0,85 až 0,41), p = 0,5) nebo baricitinibem v monoterapii (–0,65 (95% CI –1,36 až 0,06), p = 0,07) byla progrese podobná bez ohledu na aktivitu onemocnění. U pacientů se střední a vysokou aktivitou byla v porovnání s MTX radiografická progrese signifikantně nižší ve skupině léčené baricitinibem v kombinaci s MTX (–1,19 (95% CI –1,85 až –0,53), p < 0,001) a numericky nižší u pacientů léčených monoterapií baricitinibem (–0,64 (95% CI –1,33 až –0,05), p = 0,07). Podobných výsledků bylo dosaženo i po adjustaci na hodnoty CRP (≤ 5 mg/l a > 5 mg/l).
Obr. 2. Rentgenová progrese u pacientů léčených baricitinibem v klinických hodnoceních RA-BEAM (a) a RA-BEGIN (b) v závislosti od klinické aktivity dle skóre Clinical Disease Activity Index (CDAI). U pacientů léčených baricitinibem v kombinaci s methotrexátem nebo baricitinibem v monoterapii byla radiografická progrese podobná bez ohledu na aktivitu onemocnění, zatím co u pacientů ve větvi s placebem byla radiografická progrese pomalejší u pacientů v remisi/s nízkou aktivitou ve srovnání s pacienty se střední/ vysokou aktivitou onemocnění (upraveno podle (22)). 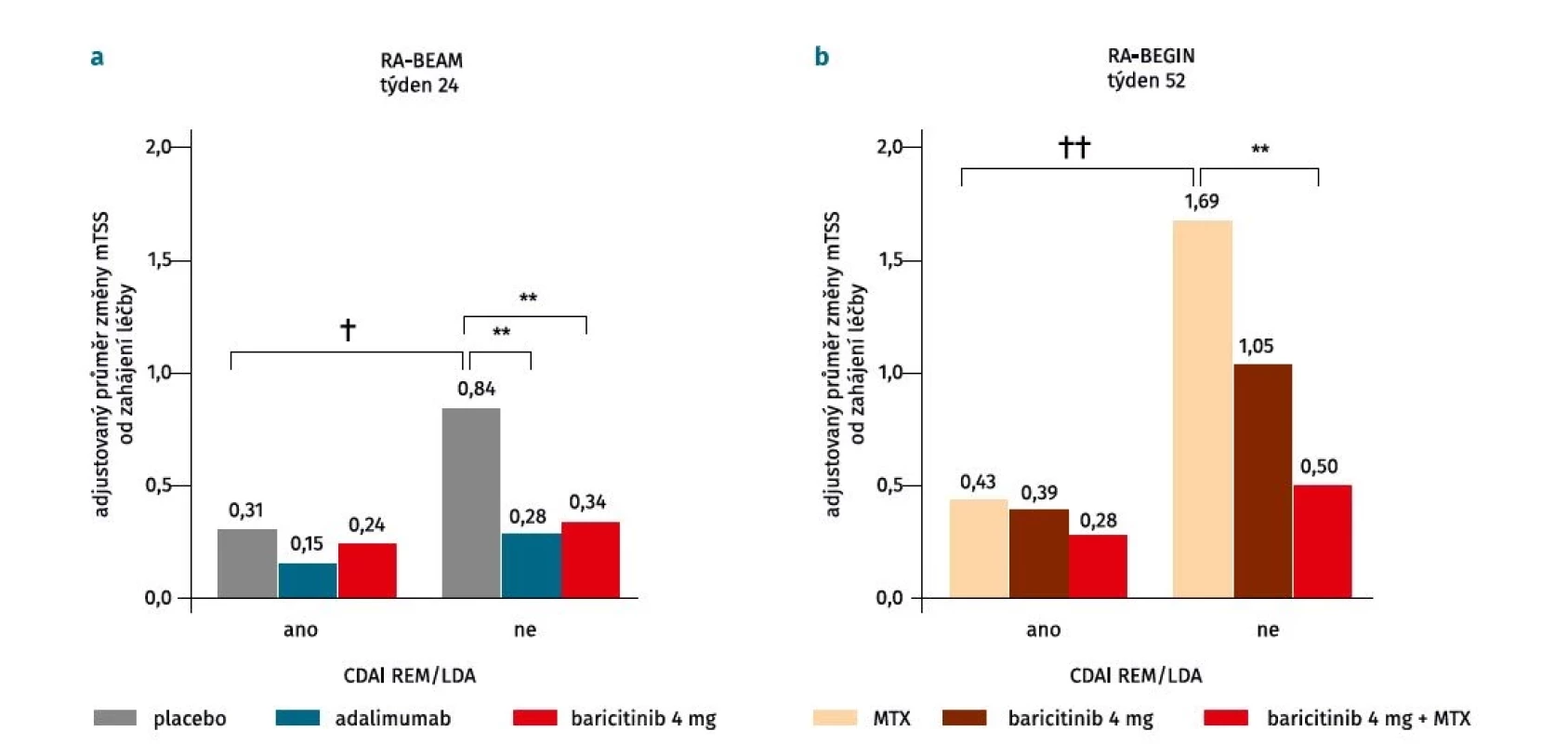
CDAI – Clinical Disease Activity Index, LDA – nízká aktivita (low disease acitivity), mTSS – modifikované Sharpovo skóre (modified total Sharp score), MTX – methotrexát, REM – remise REM/LDA byla klasifikována jako CDAI ≤ 10.
**p < 0,001 v porovnání s placebem nebo methotrexátem
†p < 0,05 a ††p < 0,001 porovnání v rámci léčené skupinyBaricitinib tak snižuje strukturální progresi v porovnání s placebem s i bez terapie MTX, a to i u pacientů se střední a vysokou aktivitou, a vykazuje tak chorobu modifikující účinek napříč celým spektrem aktivity RA.
Upadacitinib
Účinnost upadacitinibu jako inhibitoru JAK1 s funkční selektivitou oproti JAK2 a JAK3 byla prokázána v programu SELECT u dosud neléčených pacientů s RA (SELECT-EARLY) (33), s nedostatečnou odpovědí na předchozí léčbu MTX (SELECT-MONOTHERAPY) (34) a SELECT-COMPARE) (35), u pacientů se selháním terapie csDMARD (SELECT-NEXT) (36)) či bDMARD (SELECT-BEYOND) (37).
U pacientů s RA s nedostatečnou odpovědí na terapii MTX ve studii SELECT-COMPARE (35) bylo v týdnu 12 u pacientů léčených upadacitinibem v porovnání s placebem dosaženo obou primárních cílových parametrů jak klinické odpovědi ACR20 (71% vs. 36%, p < 0,001, tak remise podle DAS28-CRP < 2,6, (29 % vs. 6 %, p < 0,001). Podle ukazatelů ACR50, DAS28-CRP ≤ 3,2, míry bolesti a funkčních schopností dle HAQ (Health Assessment Questionnaire) bylo dosaženo superiority upadacitinibu vůči adalimumabu. Léčba upadacitinibem v dávce 15 mg vedla v týdnu 26 k významně větší inhibici progrese strukturálního poškození kloubů dle mTSS ve srovnání s placebem v kombinaci s MTX (+0,24 vs. +0,92, p ≤ 0,001, ve skupině s adalimumabem mTSS +0,1 bez signifikantního rozdílu oproti upadacitinibu, p = 0,448), a to jak pro skóre erozí (+0,03 vs. +0,44, p ≤ 0,001, +0,02 ve skupině s adalimumabem), tak zúžení kloubní štěrbiny (+0,22 vs. +0,58, p ≤ 0,001, +0,14 ve skupině s adalimumabem). Signifikantně více pacientů ve skupině s upadacitinibem (83 %) a s adalimumabem (87 %) nemělo žádnou radiografickou progresi během 26 týdnů ve srovnání se skupinou s placebem (76 %, p ≤ 0,01).
V klinickém hodnocení SELECT-EARLY (33) u dosud neléčených pacientů s RA byl splněn primární cíl, kdy ve 12. týdnu bylo klinické odpovědi dle ACR50 dosaženo pro upadacitinib 15 mg a 30 mg oproti MTX (52 % vs. 56 % vs. 28 %, p < 0,001), tak ve 24. týdnu remise dle DAS28-CRP < 2,6 (48 % vs. 50 % vs. 19 %, p < 0,001). Celkově ve 24. týdnu u 88 % pacientů užívajících 15 mg upadacitinibu a 89 % pacientů léčených 30 mg upadacitinibu nedošlo k radiografické progresi v porovnání se 78 % ve skupině s MTX (p < 0,01) s pomalejší radiografickou progresí ve skupinách léčených upadacitinibem v porovnání s MTX (mTSS +0,14 vs. +0,07 vs. +0,67, p < 0,01 a p < 0,001 v tomto pořadí) (33).
Filgotinib
Filgotinib je selektivní inhibitor JAK1 se sníženou aktivitou vůči JAK2. Jeho účinnost a bezpečnost byla prokázána v klinickém programu FINCH u pacientů s RA bez předchozí léčby MTX (FINCH 3) (38), s nedostatečnou terapeutickou odpovědí na MTX (FINCH 1) (39) a bDMARD (FINCH 2) (40).
Ve studii FINCH 3 (38) u pacientů dosud neléčených MTX mělo v týdnu 24 terapeutickou odpověď ACR20 signifikantně více pacientů léčených filgotinibem 200 mg + MTX v porovnání s placebem (81 % vs. 71 %, p < 0,001), čímž bylo dosaženo primárního cíle, ale i u pacientů léčených 100 mg filgotinibu (80 %, p = 0,017). V týdnu 24 bylo pozorováno i zpomalení rentgenové progrese dle mTSS, kdy pacienti léčeni figotinibem 200 mg a 100 mg v kombinaci s MTX nebo filgotinibem 200 mg bez MTX měli pomalejší progresi než pacienti ve skupině s placebem a MTX (+0,13 vs. +0,13 vs. –0,13 vs. +0,42, p < 0,01 pro monoterapii filgotinibem 200 mg, ostatní porovnání byla statisticky nevýznamná, NS). Statisticky významné zpomalení rentgenové progrese bylo v týdnu 52 pro všechny skupiny léčené filgotinibem v porovnání s placebem (+0,21 vs. +0,27 vs. +0,23 vs. +0,74, p < 0,001, p < 0,05, p < 0,01 v tomto pořadí). Více pacientů léčených filgotinibem oproti pacientům léčeným MTX nemělo v týdnu 24 žádnou radiografickou progresi definovanou jako ΔmTSS ≤ 0 (81 % vs. 77 % vs. 83 % vs. 73 %, p < 0,05, NS, p < 0,05 v tomto pořadí).
V klinickém hodnocení FINCH 1 (39) bylo dosaženo primárního cíle, a to signifikantně vyššího podílu pacientů s klinickou odpovědí ACR20 v týdnu 12 ve skupinách léčenými filgotinibem v dávce 200 mg a 100 mg v porovnání s placebem (76,6 % vs. 69,8 % vs. 49,9 %, p < 0,001 pro obě srovnání). Filgotinib v dávce 200 mg dosáhl non-inferiority vůči adalimumabu v parametru nízké aktivity dle DAS28-CRP ≤ 3,2 (p < 0,001). Jedním ze sekundárních cílů byla analýza rentgenové progrese v týdnu 24, kde pacienti léčeni filgotinibem v dávce 200 mg i 100 mg měli signifikantně pomalejší radiografickou progresi než pacienti ve skupině s placebem (+0,13 vs. +0,17 vs. +0,37, p < 0,001 a p = 0,001 v tomto pořadí; +0.16 ve skupině s adalimumabem). V rámci skóre bylo dosaženo signifikantně nižšího erozivního poškození, ale pomalejší zúžení kloubní štěrbiny nedosáhlo statistické významnosti.
MECHANISMUS INHIBICE KOSTNÍ DESTRUKCE POMOCÍ INHIBITORŮ JAK
I když je imunomodulační efekt inhibitorů JAK dobře definován, současné znalosti o tom, jak ovlivňují kostní homeostázu, jsou omezené. Jak bylo zmíněno výše, RANKL hraje ústřední roli v kostním metabolismu, kde interakce mezi RANKL a RANK (aktivátor receptoru NF-κB) exprimovaným na prekurzorech osteoklastů indukuje jejich diferenciaci na osteoklasty (3). Osteoprotegerin (OPG) je solubilním produktem, který je schopen jako blokující receptor vázat RANKL, a zabránit tak vazbě RANKLna RANK a tím jeho působení na osteoklasty a jejich prekurzory. Velké množství prozánětlivých cytokinů (např. TNF-α, IL-6, IL-17, a IL-1β) a HIF-1α (hypoxií indukovaný faktor 1α) vede k abnormálně vysoké expresi RANKL a M-CSF v osteoblastech a inhibici exprese OPG (41). I přes klíčovou roli TNF-α bylo prokázano, že TNF-α, IL-17 a a IL-1β indukují expresi RANKL prostřednictvím IL-6. Navíc IL-6 a HIF-1α, které působí přes JAK/STAT signální dráhu, přímo regulují diferenciaci osteoklastů a zvyšují kostní resorpci (41). Inhibitory JAK tak mohou ovlivněním signalizace těchto mediátorů inhibovat diferenciaci osteoklastů nebo ovlivnit chování osteoblastů. Myší modely prokázaly, že in vivo léčba inhibitory JAK zvýšila kostní hmotu v souladu se snížením poměru RANKL/OPG v séru (42). V in vitro analýzách byl ale prokázán účinek JAK inhibitorů na zvýšenou anabolickou funkci osteoblastů se snížením produkce RANKL (42, 43), ale bez přímého účinku na osteoklasty (42).
ZÁVĚR
Inhibitory JAK tlumí intracelulární signální dráhy indukované navázáním ligandu na buněčné receptory imunitních buněk. Vlivem na tvorbu prozánětlivých mediátorů a RANKL/OPG inhibují zánětlivé procesy uvnitř synoviální tkáně a zároveň ovlivňují homeostázu kosti. Působením inhibitorů JAK tak jde ruku v ruce s potlačením aktivity RA i zpomalení destrukce kloubu, která je ireverzibilní a je úzce spojena s funkčním postižením pacienta. Účinnost, bezpečnost a vliv na inhibici strukturální progrese v běžné praxi používaných čtyř JAK inhibitorů tofacitinibu, baricitinibu, upadacitinibu a filgotinibu, které mají odlišnou selektivitu, byla prokázána v řadě klinických hodnocení u celého spektra pacientů s RA. Data získaná z klinických hodnocení s baricitinibem a tofacitinibem ukazují, že vliv na radiografickou progresi se zdá být nezávislý na aktivitě RA nebo souběžné terapii glukokortikoidy, což podporuje významný chorobu modifikující účinek inhibitorů JAK.
Adresa pro korespondenci:
doc. MUDr. Mária Filková, Ph.D.
Revmatologický ústav Klinika revmatologie 1. LF UK
Na Slupi 4
128 50 Praha 2
e-mail: filkova@revma.cz
Autorka prohlašuje, že není v konfliktu zájmů.
Do redakce doručeno: 25. 9. 2022
Práce vznikla za institucionální podpory MZ ČR pro Revmatologický ústav č. 023728.
Čes. Revmatol. 2022; 30(4): 158–165
Zdroje
1. Smolen JS, Aletaha D, Barton A, Burmester GR, Emery P, Firestein GS, et al. Rheumatoid arthritis. Nat Rev Dis Primers 2018; 4 : 18001.
2. Karouzakis E, Neidhart M, Gay RE, Gay S. Molecular and cellular basis of rheumatoid joint destruction. Immunol Lett 2006; 106(1): 8–13.
3. Firestein GS, McInnes IB. Immunopathogenesis of Rheumatoid Arthritis. Immunity 2017; 46(2): 183–196.
4. Schwartz DM, Kanno Y, Villarino A, Ward M, Gadina M, O‘Shea JJ. JAK inhibition as a therapeutic strategy for immune and inflammatory diseases. Nature reviews Drug discovery 2017; 16(12): 843–862.
5. Landewe RB, Connell CA, Bradley JD, Wilkinson B, Gruben D, Strengholt S, et al. Is radiographic progression in modern rheumatoid arthritis trials still a robust outcome? Experience from tofacitinib clinical trials. Arthritis Res Ther 2016; 18(1): 212.
6. van der Heijde D, Simon L, Smolen J, Strand V, Sharp J, Boers M, et al. How to report radiographic data in randomized clinical trials in rheumatoid arthritis: guidelines from a roundtable discussion. Arthritis Rheum 2002; 47(2): 215–218.
7. Lee EB, Fleischmann R, Hall S, Wilkinson B, Bradley JD, Gruben D, et al. Tofacitinib versus methotrexate in rheumatoid arthritis. N Engl J Med 2014; 370(25): 2377–2386.
8. van Vollenhoven RF, Fleischmann R, Cohen S, Lee EB, Garcia Meijide JA, Wagner S, et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med 2012; 367(6): 508–519.
9. van der Heijde D, Tanaka Y, Fleischmann R, Keystone E, Kremer J, Zerbini C, et al. Tofacitinib (CP-690,550) in patients with rheumatoid arthritis receiving methotrexate: twelve-month data from a twenty-four-month phase III randomized radiographic study. Arthritis Rheum 2013; 65(3): 559–570.
10. Fleischmann R, Mysler E, Hall S, Kivitz AJ, Moots RJ, Luo Z, et al. Efficacy and safety of tofacitinib monotherapy, tofacitinib with methotrexate, and adalimumab with methotrexate in patients with rheumatoid arthritis (ORAL Strategy): a phase 3b/4, double-blind, head-to-head, randomised controlled trial. Lancet 2017; 390(10093): 457–468.
11. Kremer J, Li ZG, Hall S, Fleischmann R, Genovese M, Martin - Mola E, et al. Tofacitinib in combination with nonbiologic disease – modifying antirheumatic drugs in patients with active rheumatoid arthritis: a randomized trial. Ann Intern Med 2013; 159(4): 253–261.
12. Burmester GR, Blanco R, Charles-Schoeman C, Wollenhaupt J, Zerbini C, Benda B, et al. Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet 2013; 381(9865): 451–460.
13. Fleischmann R, Kremer J, Cush J, Schulze–Koops H, Connell CA, Bradley JD, et al. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med 2012; 367(6): 495–507.
14. Smolen JS, Landewe RBM, Bijlsma JWJ, Burmester GR, Dougados M, Kerschbaumer A, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann Rheum Dis 2020; 79(6): 685–699.
15. Charles-Schoeman C, van der Heijde D, Burmester GR, Nash P, Zerbini CAF, Connell CA, et al. Effect of Glucocorticoids on the Clinical and Radiographic Efficacy of Tofacitinib in Patients with Rheumatoid Arthritis: A Posthoc Analysis of Data from 6 Phase III Studies. J Rheumatol 2018; 45(2): 177–187.
16. van der Heijde D, Landewe RBM, Wollenhaupt J, Strengholt S, Terry K, Kwok K, et al. Assessment of radiographic progression in patients with rheumatoid arthritis treated with tofacitinib in long-term studies. Rheumatology (Oxford) 2021; 60(4): 1708 – 1716.
17. Fleischmann R, Schiff M, van der Heijde D, Ramos-Remus C, Spindler A, Stanislav M, et al. Baricitinib, Methotrexate, or Combination in Patients With Rheumatoid Arthritis and No or Limited Prior Disease–Modifying Antirheumatic Drug Treatment. Arthritis & Rheumatology 2017; 69(3): 506–517.
18. Taylor PC, Keystone EC, van der Heijde D, Weinblatt ME, Del Carmen Morales L, Reyes Gonzaga J, et al. Baricitinib versus Placebo or Adalimumab in Rheumatoid Arthritis. N Engl J Med 2017; 376(7): 652–662.
19. Dougados M, van der Heijde D, Chen YC, Greenwald M, Drescher E, Liu J, et al. Baricitinib in patients with inadequate response or intolerance to conventional synthetic DMARDs: results from the RA-BUILD study. Ann Rheum Dis 2017; 76(1): 88–95.
20. Genovese MC, Kremer J, Zamani O, Ludivico C, Krogulec M, Xie L, et al. Baricitinib in Patients with Refractory Rheumatoid Arthritis. N Engl J Med 2016; 374(13): 1243–1252.
21. van der Heijde D, Kartman CE, Xie L, Beattie S, Schlichting D, Mo D, et al. Radiographic Progression of Structural Joint Damage Over 5 Years of Baricitinib Treatment in Patients With Rheumatoid Arthritis: Results From RA-BEYOND. J Rheumatol 2022; 49(2): 133–141.
22. Lopez-Romero P, de la Torre I, Haladyj E, Aletaha D, Smolen JS. Baricitinib further enhances disease-modifying effects by uncoupling the link between disease activity and joint structural progression in patients with rheumatoid arthritis. Ann Rheum Dis 2022; 81(5): 622–631.
23. Smolen JS. Treat to Target in Rheumatology: A Historical Account on Occasion of the 10th Anniversary. Rheumatic diseases clinics of North America 2019; 45(4): 477–485.
24. Aletaha D, Smolen JS. Joint damage in rheumatoid arthritis progresses in remission according to the Disease Activity Score in 28 joints and is driven by residual swollen joints. Arthritis Rheum 2011; 63(12): 3702–3711.
25. Smolen JS, Kalden JR, Scott DL, Rozman B, Kvien TK, Larsen A, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. European Leflunomide Study Group. Lancet 1999; 353(9149): 259–266.
26. Strand V, Cohen S, Schiff M, Weaver A, Fleischmann R, Cannon G, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Leflunomide Rheumatoid Arthritis Investigators Group. Arch Intern Med 1999; 159(21): 2542–2550.
27. Aletaha D, Funovits J, Breedveld FC, Sharp J, Segurado O, Smolen JS. Rheumatoid arthritis joint progression in sustained remission is determined by disease activity levels preceding the period of radiographic assessment. Arthritis Rheum 2009; 60(5): 1242–1249.
28. Smolen JS, Han C, van der Heijde DM, Emery P, Bathon JM, Keystone E, et al. Radiographic changes in rheumatoid arthritis patients attaining different disease activity states with methotrexate monotherapy and infliximab plus methotrexate: the impacts of remission and tumour necrosis factor blockade. Ann Rheum Dis 2009; 68(6): 823–827.
29. Aletaha D, Alasti F, Smolen JS. Rituximab dissociates the tight link between disease activity and joint damage in rheumatoid arthritis patients. Ann Rheum Dis 2013; 72(1): 7–12.
30. Smolen JS, Avila JC, Aletaha D. Tocilizumab inhibits progression of joint damage in rheumatoid arthritis irrespective of its anti-inflammatory effects: disassociation of the link between inflammation and destruction. Ann Rheum Dis 2012; 71(5): 687–693.
31. Binder NB, Puchner A, Niederreiter B, Hayer S, Leiss H, Bluml S, et al. Tumor necrosis factor-inhibiting therapy preferentially targets bone destruction but not synovial inflammation in a tumor necrosis factor-driven model of rheumatoid arthritis. Arthritis Rheum 2013; 65(3): 608–617.
32. Redlich K, Smolen JS. Inflammatory bone loss: pathogenesis and therapeutic intervention. Nature reviews Drug discovery 2012; 11(3): 234–250.
33. van Vollenhoven R, Takeuchi T, Pangan AL, Friedman A, Mohamed MF, Chen S, et al. Efficacy and Safety of Upadacitinib Monotherapy in Methotrexate-Naive Patients With Moderatelyto-Severely Active Rheumatoid Arthritis (SELECT-EARLY): A Multicenter, Multi-Country, Randomized, Double-Blind, Active Comparator-Controlled Trial. Arthritis & Rheumatology 2020; 72(10): 1607–1620.
34. Smolen JS, Pangan AL, Emery P, Rigby W, Tanaka Y, Vargas JI, et al. Upadacitinib as monotherapy in patients with active rheumatoid arthritis and inadequate response to methotrexate (SELECTMONOTHERAPY): a randomised, placebo-controlled, double-blind phase 3 study. Lancet 2019; 393(10188): 2303–2311.
35. Fleischmann R, Pangan AL, Song IH, Mysler E, Bessette L, Peterfy C, et al. Upadacitinib Versus Placebo or Adalimumab in Patients With Rheumatoid Arthritis and an Inadequate Response to Methotrexate: Results of a Phase III, Double-Blind, Randomized Controlled Trial. Arthritis & Rheumatology 2019; 71(11): 1788–1800.
36. Burmester GR, Kremer JM, Van den Bosch F, Kivitz A, Bessette L, Li Y, et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2018; 391(10139): 2503–2512.
37. Genovese MC, Fleischmann R, Combe B, Hall S, Rubbert-Roth A, Zhang Y, et al. Safety and efficacy of upadacitinib in patients with active rheumatoid arthritis refractory to biologic disease-modifying anti-rheumatic drugs (SELECT-BEYOND): a double-blind, randomised controlled phase 3 trial. Lancet 2018; 391(10139): 2513–2524.
38. Westhovens R, Rigby WFC, van der Heijde D, Ching DWT, Stohl W, Kay J, et al. Filgotinib in combination with methotrexate or as monotherapy versus methotrexate monotherapy in patients with active rheumatoid arthritis and limited or no prior exposure to methotrexate: the phase 3, randomised controlled FINCH 3 trial. Ann Rheum Dis 2021; 80(6): 727–738.
39. Combe B, Kivitz A, Tanaka Y, van der Heijde D, Simon JA, Baraf HSB, et al. Filgotinib versus placebo or adalimumab in patients with rheumatoid arthritis and inadequate response to methotrexate: a phase III randomised clinical trial. Ann Rheum Dis 2021; 80(7): 848–858.
40. Genovese MC, Kalunian K, Gottenberg JE, Mozaffarian N, Bartok B, Matzkies F, et al. Effect of Filgotinib vs Placebo on Clinical Response in Patients With Moderate to Severe Rheumatoid Arthritis Refractory to Disease-Modifying Antirheumatic Drug Therapy: The FINCH 2 Randomized Clinical Trial. JAMA 2019; 322(4): 315–325.
41. Hu L, Liu R, Zhang L. Advance in bone destruction participated by JAK/STAT in rheumatoid arthritis and therapeutic effect of JAK/ STAT inhibitors. Int Immunopharmacol 2022; 111 : 109095.
42. Adam S, Simon N, Steffen U, Andes FT, Scholtysek C, Muller DIH, et al. JAK inhibition increases bone mass in steady–state conditions and ameliorates pathological bone loss by stimulating osteoblast function. Sci Transl Med 2020; 12(530).
43. Murakami K, Kobayashi Y, Uehara S, Suzuki T, Koide M, Yamashita T, et al. A Jak1/2 inhibitor, baricitinib, inhibits osteoclastogenesis by suppressing RANKL expression in osteoblasts in vitro. PLoS One 2017; 12(7): e0181126.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek ÚVODNÍK
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2022 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- ÚVODNÍK
- Prof. MUDr. Ctibor Dostál, DrSc.
- Prof. MUDr. Stanislav Havelka, CSc.
- Validace české verze dotazníku hodnotícího časný záchyt střevních a mimostřevních projevů u pacientů s axiální spondyloartritidou s rizikem vývoje idiopatického střevního zánětu: screeningová kritéria IBD pro pacienty se SpA
- Radiografická progrese u pacientů s revmatoidní artritidou při léčbě inhibitory JAK
- Folikulostimulační hormon a jeho účinky na kost a chrupavku
- Chronické rány jako komplikace revmatologických onemocnění
- MUDr. Marie Macků oslavila významné životní jubileum
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronické rány jako komplikace revmatologických onemocnění
- Folikulostimulační hormon a jeho účinky na kost a chrupavku
- Radiografická progrese u pacientů s revmatoidní artritidou při léčbě inhibitory JAK
- Validace české verze dotazníku hodnotícího časný záchyt střevních a mimostřevních projevů u pacientů s axiální spondyloartritidou s rizikem vývoje idiopatického střevního zánětu: screeningová kritéria IBD pro pacienty se SpA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



