-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam nových prozánětlivých a/nebo profibrotických molekul v patogenezi systémové sklerodermie
The role of new pro-inflammatory and/or pro-fibrotic molecules in the pathogenesis of systemic sclerosis
Introduction:
Systemic sclerosis (SSc) is a generalized connective tissue disease affecting the skin and internal organs. The pathogenesis of SSc is characterized by inflammation, vasculopathy and fibrosis. To date, none of the tested drugs have demonstrated convincing efficacy in the treatment of SSc. S100A4 is involved in the regulation of cell motility, proliferation, apoptosis, angiogenesis and remodeling of the extracellular matrix. It was originally described as a promoter of metastasis in tumors, however, its pro-inflammatory properties have recently been demonstrated in inflammatory rheumatic diseases. The aim of this study was to assess the role of S100A4 in pathological activation of fibroblasts in SSc and in experimental models of dermal fibrosis.Results:
The expression of S100A4 was increased in the skin of SSc patients, in SSc fibroblasts and in experimental fibrosis in a TGF-ß / Smad dependent manner. Overexpression of S100A4 or stimulation with recombinant S100A4 induced an activated phenotype in resting normal fibroblasts. In contrast, inhibition of S100A4 or its complete deficit abrogated the pro-fibrotic effects of TGF-ß and decreased the release of collagen. S100A4 knock-out mice (S100A4-/-) were protected from bleomycin-induced skin fibrosis with reduced dermal thickening, decreased hydroxyproline content and lower counts of activated fibroblasts, so called myofibroblasts. Similarly, deficiency of S100A4 also ameliorated fibrosis in the Tight skin-1 (Tsk-1) mouse model. Anti-fibrotic effects of the inactivation of S100A4 in both experimental models of dermal fibrosis were mediated by inhibition of TGF-ß / Smad signaling.Conclusion:
Our results characterize S100A4 as a positive regulator of the stimmulatory effects of TGF-ß on fibroblasts in SSc. S100A4 is induced by TGF-ß and in turn amplifies the stimulatory effects of canonical TGF-ß / Smad signaling on collagen synthesis by SSc fibroblasts and on induction of fibrosis. Since S100A4 is essentially required for the pro-fibrotic effects of TGF-ß and neutralizing antibodies against S100A4 are currently evaluated in tumors, S100A4 might become a candidate molecule for novel anti-fibrotic therapies.Key words:
S100A4, fibrosis, scleroderma, Smad3, fibroblasts
Autoři: M. Tomčík
Působiště autorů: 1. lékařská fakulta Univerzity Karlovy v Praze
Vyšlo v časopise: Čes. Revmatol., 22, 2014, No. 3, p. 127-142.
Kategorie: Autoreferát disertační práce
Souhrn
Úvod:
Systémová sklerodermie (SSc) je generalizované onemocnění pojivové tkáně postihující kůži a vnitřní orgány. V patogenezi SSc se uplatňuje zánět, vaskulopatie a fibróza. Žádný z dosud zkoušených léku zatím neprokázal přesvědčivou účinnost v léčbě SSc. S100A4 se účastní regulace buněčné motility, proliferace, apoptózy, angiogeneze a remodelace extracelulární matrix. Původně byl popsán jako promotor metastazování u nádorů, avšak nedávno byly dokumentovány i jeho prozánětlivé vlastnosti u zánětlivých revmatických onemocnění. Cílem této práce bylo prozkoumat roli S100A4 při patologické aktivaci fibroblastů u SSc a v modelech experimentální kožní fibrózy.Výsledky:
Exprese S100A4 byla zvýšená v kůži pacientů se SSc, v SSc fibroblastech i v myších modelech experimentální kožní fibrózy způsobem závislým na TGF-ß / Smad signální kaskádě. Zvýšení exprese S100A4 anebo stimulace pomocí rekombinantního S100A4 proteinu indukovaly v klidových normálních fibroblastech aktivovaný fenotyp. Snížení exprese S100A4 nebo jeho kompletní deficit naopak utlumily profibrotické účinky TGF-ß a potlačili tvorbu kolagenu. S100A4 knock-out myši (S100A4-/-) byly uchráněny před rozvojem experimentální kožní fibrózy indukované bleomycinem a měly redukované ztluštění dermis, snížený obsah hydroxyprolinu a menší počet aktivovaných fibroblastů, tzv. myofibroblastů. Deficit S100A4 podobně utlumil rozvoj kožní fibrózy u Tight skin-1 (Tsk-1) myšího modelu. Antifibrotické účinky inaktivace S100A4 v obou experimentálních modelech kožní fibrózy byly zprostředkované inhibicí TGF-ß / Smad signální kaskády.Závěr:
Naše výsledky ukazují, že S100A4 je pozitivním regulátorem stimulačních účinků TGF-ß na fibroblasty u SSc. Exprese S100A4 je indukovaná pomocí TGF-ß a S100A4 zpětně potencuje stimulační účinky TGF-ß / Smad signální kaskády na tvorbu kolagenu SSc fibroblasty a indukci fibrózy. Jelikož je S100A4 důležitým mediátorem profibrotických účinků TGF-ß a efekt protilátek neutralizujících S100A4 je momentálně zkoumán u nádorových onemocnění, mohl by se S100A4 protein stát kandidátní molekulou nové antifibrotické terapie.Klíčová slova:
S100A4, fibróza, sklerodermie, Smad3, fibroblastyÚvod
Systémová sklerodermie (SSc) je vzácné chronické potenciálně letální systémové onemocnění pojiva nejasné etiologie postihující kůži, srdce, tepny, plíce, gastrointestinální trakt, ledviny a sexuální funkce. Mezi hlavní patologické procesy v patogenezi SSc patří autoimunita a zánět, vaskulopatie a progresivní intersticiální a perivaskulární fibróza (1). I když se kvalita života a přežívání pacientů se SSc v posledních letech stále zlepšuje, SSc pořád zůstává nevyléčitelnou nemocí (2). Fibróza bývá dominantním rysem SSc a dochází při ní k postupnému nahrazení funkční tkáně kolagenními vlákny a dalšími složkami extracelulární matrix (ECM). Hlavním efektorem fibrogeneze jsou fibroblasty, které mají abnormální, aktivovaný fenotyp, jenž je signál-independentní a přetrvává po několik pasáží in vitro (3). Je pro něj typická nadměrná produkce složek ECM, konstitutivní sekrece cytokinů a chemokinů a zvýšená exprese membránových receptorů vážících profibrotické mediátory (4). U SSc fibroblastů také častěji dochází k transdiferenciaci v myofibroblasty (aktivované fibroblasty) obsahující α-smooth muscle actin (α-SMA). Mezi hlavní mediátory fibrózy patří transformující růstový faktor beta (TGF-β), jenž je produkován jako latentní komplex četnými buňkami včetně destiček, monocytů/makrofágů, T lymfocytů a fibroblastů. Po navázání aktivního TGF-β na TGF-β receptor II. typu (TGFβRII) dochází k heterodimerizaci a aktivaci transmembránové serin-treoninové kinázy TGF-β receptoru I. typu (TGFβRI). Ten následně aktivuje klasickou Smad-dependentní TGF-β signální transdukci i Smad-nedependentní signální cesty. Cestou Smad-dependentní signální kaskády jsou aktivovány geny kódující kolagen typu I, inhibitor aktivátoru plazminogenu-1 (PAI-1), α-SMA, tkáňový pojivový růstový faktor (CTGF) a Smad7 (4–6).
Pro lepší porozumění komplexních vztahů mezi třemi klíčovými procesy v patogenezi SSc a pro studium potenciálních terapeutických agens se v bazálním výzkumu používá několik etablovaných zvířecích modelů. Každý z nich napodobuje jen určité aspekty SSc a zatím neexistuje ideální model, který by zahrnoval všechny procesy lidské SSc (7). V této práci byly použity 2 modely SSc: model bleomycinem indukované kožní fibrózy, který napodobuje zánětlivé změny přítomné v časné fázi SSc (8), a Tight skin-1 (Tsk-1) myší, u nichž autozomálně dominantní mutace – tandemová duplikace v genu pro fibrillin 1 vede k hyperplazii a tuhnutí podkoží a produkci autoprotilátek. Tsk-1 model napodobuje pozdější nezánětlivou fázi SSc (9).
S100A4 (metastasin 1) byl původně izolován u myší jako protein tvořený metastatickými buňkami adenokarcinomu mléčné žlázy (10). V intracelulárním prostředí se podílí na regulaci řady buněčných procesů, např. buněčné proliferace, apoptózy, motility a remodelace ECM (11–13). Extracelulární S100A4 reguluje proces angiogeneze, produkci proteolytických enzymů remodelujících ECM a stimuluje růst neuritu primárních hipokampálních neuronů (14–16). Asociace mezi expresí proteinu S100A4 a rozvojem metastáz byla prokázána u nemalobuněčného nádoru plic, rakoviny prostaty, močového měchýře, duktálního adenokarcinomu pankreatu, rakoviny žaludku a u některých typů melanomu (17–23). Mezi mechanismy metastatické progrese indukované proteinem S100A4 patří regulace buněčné motility, invaze, adheze, angiogeneze, buněčné smrti a přeměny epiteliálních buněk v mezenchymální (24). V posledních letech byla role S100A4 popsána u četných nenádorových onemocnění, např. fibrózy plic, jater, retroperitonea a ledvin, hypertrofie a fibrózy myokardu, regenerace poškozených neuronů a rohovky, psoriázy i revmatoidní artritidy a idiopatických zánětlivých myopatií. Společným jmenovatelem většiny zmíněných onemocnění jsou fibrotické a zánětlivé procesy (15, 25–27).
Cíle práce
Cílem této disertační práce bylo prozkoumat roli S100A4 v patogenezi SSc, hlavně v aktivaci fibroblastů produkujících nadbytečné množství složek ECM vedoucí ke tkáňové fibróze, ztrátě funkce a orgánovému selhání a zhodnotit antifibrotické účinky inaktivace S100A4 na myších modelech experimentální kožní fibrózy.
Metodika
Pacienti, kožní biopsie a tkáňové kultury fibroblastů. Bioptické vzorky byly odebrány z postižené kůže pacientů se SSc (n = 20) a zdravých kontrol (n = 18) se srovnatelným věkem a pohlavím. Všichni pacienti splnili kritéria pro SSc podle ACR (28). Pacienti a zdraví jedinci předem podepsali informovaný souhlas schválený místní etickou komisí.
Stimulace pomocí rekombinantního S100A4 a TGF-β. Fibroblasty byly inkubované s rekombinantním TGF-β (10 ng/ml) nebo s rekombinantním S100A4 proteinem v různých koncentracích (0,01; 0,1; 1 a 10 µg/ml).
Klonování lidského genu pro S100A4. Gen pro S100A4 byl amplifikován z lidské cDNA pomocí PCR. Produkty PCR byly natráveny pomocí BamHI a XhoI a ligovány do expresního vektoru pcDNA3.1. Rekombinantní plazmidy byly vneseny do E. coli Dh5α elektrokompetentních buněk a vyočkovány na tuhé (agarové) selekční půdy obsahující ampicilin. S100A4 expresní plazmid (pcDNA3.1_S100A4) anebo kontrolní plazmid pcDNA3.1 byly transfekovány do fibroblastů s použitím 4D-Nucleofector. Účinnost transfekce byla potvrzena pomocí ko-transfekce s pSv-β-galaktozidázovými vektory.
Utlumení exprese S100A4 a Smad3. Byly transfekovány 3 µg siRNA duplexů proti S100A4 nebo Smad3 do fibroblastů pomocí Nucleofector Kit s použitím přístroje 4D-Nucleofector. Transfekce s kontrolní siRNA sloužila jako kontrola.
Reporterové eseje. Byly použity 2 reporterové eseje: (I) pro promotor genu pro kolagen 1a2 pomocí Lipofectamine 2000 a (II) pro Smad Binding Element (SBE), který se nachází v promotorech genů přímo indukovatelných TGF-β, pomocí transdukce adenovirovým vektorem nesoucím sekvenci CAGA charakteristickou pro SBE (4–6). Luciferázová aktivita byla stanovena pomocí mikrodestičkového luminometru.
Izolace RNA a reverzní transkripce. Kůže byla homogenizována v lyzačním pufru s použitím homogenizátoru Precellys 24 homogenizer. RNA byla izolována pomocí komerčního kitu NucleoSpin® RNA II Total RNA Isolation Kit podle návodu výrobce. RNA byla reverzně přepsána do cDNA.
Kvantitativní polymerázová řetězová reakce (real time PCR). Exprese genů byla kvantifikovaná pomocí SYBR Green real time-PCR s použitím detekčního systému Stratagene Mx 3005P. Pro relativní kvantifikaci byla použita komparativní Ct metoda. „Housekeeping“ gen β-actin sloužil jako endogenní kontrola.
Stanovení koncentrace kolagenu v supernatantu. Celkový rozpustný kolagen v supernatantech buněčných kultur byl kvantifikován pomocí SirCol kolagenové eseje podle návodu výrobce.
Westernblot. Koncentrace proteinu byla stanovena pomocí amidočerně B 10. 10 µg proteinu bylo separováno pomocí 12,5 % SDS-PAGE a přeneseno na PVDF membránu podle standardních protokolů. Po blokování nespecifické vazby byly membrány inkubovány s anti-S100A4 protilátkami (27). Protilátky konjugované s křenovou peroxidázou (HRP) byly použity jako sekundární protilátky. Proteiny byly vizualizovány pomocí detekčního systému ECL plus. „Housekeeping“ protein β-actin sloužil jako endogenní kontrola.
Imunohistochemie imunofluorescence. Po blokování nespecifické vazby byly řezy nebo fibroblasty inkubovány s protilátkami proti S100A4 (27), α-SMA, prolyl-4-hydroxyláze-beta (P4H) a p-Smad2/3. HRP-protilátky anebo fluorescenční protilátky Alexa Fluor byly použity jako sekundární protilátky. Řezy byly vizualizovány pomocí substrátu DAB nebo Fast Blue BB. Jádra byla vizualizovaná pomocí DAPI. Intenzita fluorescence byla kvantifikovaná pomocí software ImageJ, verze 1.44.
Model bleomycinem indukované kožní fibrózy. Použili jsme S100A4 knock-out myši (S100A4-/-) s nulovou expresí S100A4 a S100A4 wild-type myši (S100A4+/+) s normální expresí S100A4 (29). Bleomycin (0,5 mg/ml) byl aplikován subkutánně do vyholené oblasti mezi lopatkami (1 cm2) šestitýdenních myší každý druhý den po dobu 4 týdnů. 0,9 % NaCl sloužil jako kontrola. Analyzovali jsme 28 myší ve 4 skupinách.
Model Tight skin-1 myší. Křížili jsme S100A4-/ - a S100A4+/+ myši (29) s myšmi Tsk-1 a pa/pa (nenesou mutaci Tsk-1). Analyzovali jsme 39 myší ve 4 skupinách. Ve věku 10 týdnů byla provedena eutanazie. Všechny experimenty na myších byly předem schváleny místní etickou komisí.
Histologická analýza tloušťky kůže. Histologické preparáty kůže byly obarveny hematoxylinem a eozinem. Byly pořízeny fotografie 4 náhodných úseků každého vzorku kůže. Stanovení tloušťky kůže bylo provedeno dvěma nezávislými absolventy Ph.D. zaslepeným způsobem.
Stanovení obsahu hydroxyprolinu v kůži. Stanovení hydroxyprolinu je běžnou metodou pro kvantifikaci obsahu kolagenu (30). Biopsie kůže(ø 3 mm) byly natráveny pomocí 6M HCl, smíchány s 0,06M chloraminu T, byla přidána 3,15M HClO4 a 20% p-dimetylaminobenzaldehyd. Po inkubaci v teplé vodní lázni byla absorbance změřena mikrodestičkovým spektrofotometrem. Histologické preparáty byly obarveny modrým Weigertovým trichromem.
Stanovení počtu myofibroblastů v kůži. Myofibroblasty byly detekovány barvením s anti-αSMA protilátkami a dobarvením jader hematoxylinem. Z fotografií 6 náhodných úseků kůže byl stanoven počet α-SMA pozitivních myofibroblastů v kůži dvěma nezávislými absolventy Ph.D. studia zaslepeným způsobem.
Statistická analýza. Data jsou prezentována jako medián s 25.-75. percentilem (IQR, interquartile range). Byl použit neparametrický Mann-Whitney test a software GraphPad Prism 5. Hladiny významnosti (p-hodnoty): *, 0,05 > p > 0,01; **, 0,01 > p > 0,001; ***, p < 0,001; NS, nesignifikantní.
Výsledky
Exprese S100A4 je zvýšená u SSc
Prokázali jsme, že exprese S100A4 byla zvýšená v SSc kůži ve srovnání se zdravou kůží na úrovni mRNA (obr. 1A) i proteinu (obr. 1B). Dále jsme prokázali, že jak SSc fibroblasty (obr. 2A, barveny P4H) tak zejména aktivované fibroblasty, tzv. myofibroblasty v SSc kůži (obr. 2B, barveny α-SMA) výrazně exprimují S100A4 protein. S100A4 byl zvýšeně exprimován i u experimentálních modelů kožní fibrózy. Ve fibrotické kůži myší indukované bleomycinem byla exprese S100A4 vyšší na úrovni mRNA (obr. 3A) i proteinu (obr. 3B) ve srovnání s kontrolní kůží (NaCl). U Tsk-1 myší byl S100A4 rovněž zvýšeně exprimován na úrovni mRNA (obr. 3C) i proteinu (obr. 3D) ve srovnání s kontrolní kůží myší, které nenesly mutaci Tsk-1 (pa/pa).
Obr. 1. Exprese S100A4 je zvýšená v SSc kůži. 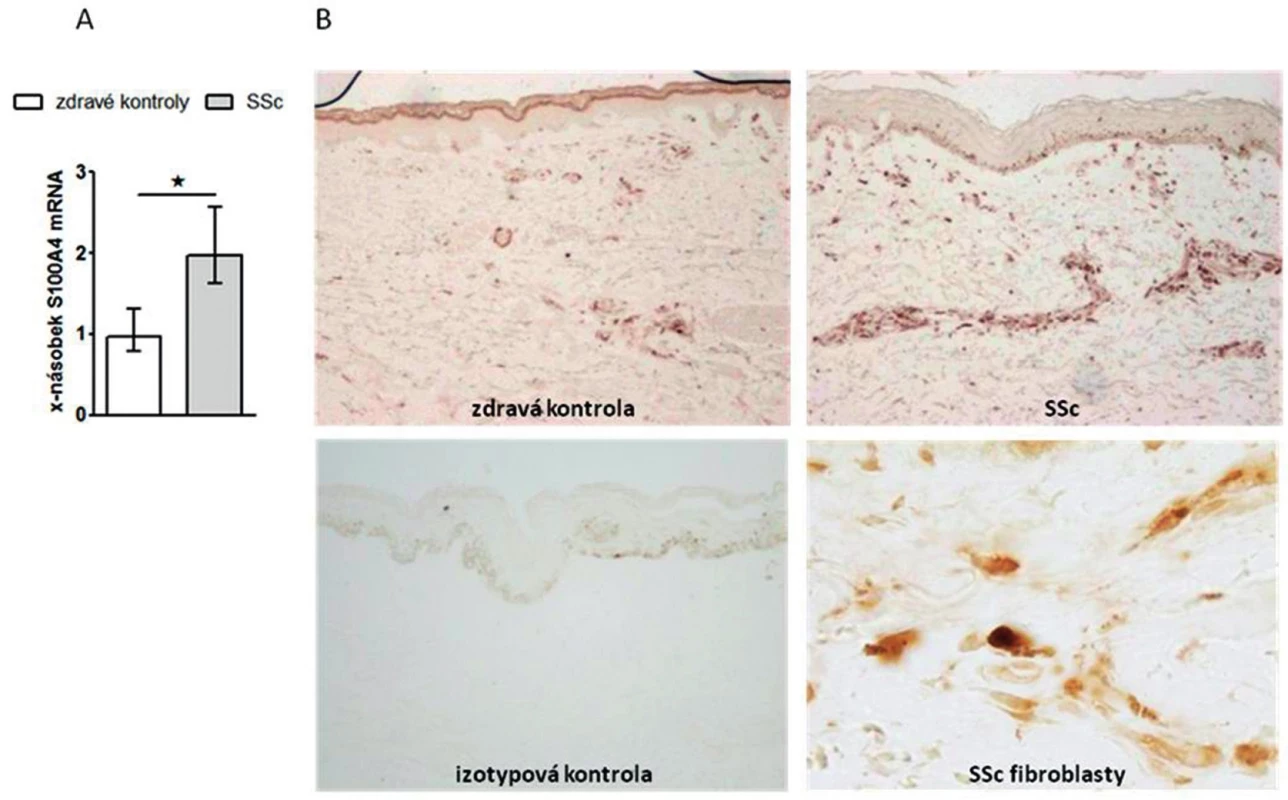
Obr. 2. Kolokalizace exprese S100A4 s fibroblasty a myofibroblasty v SSc kůži. 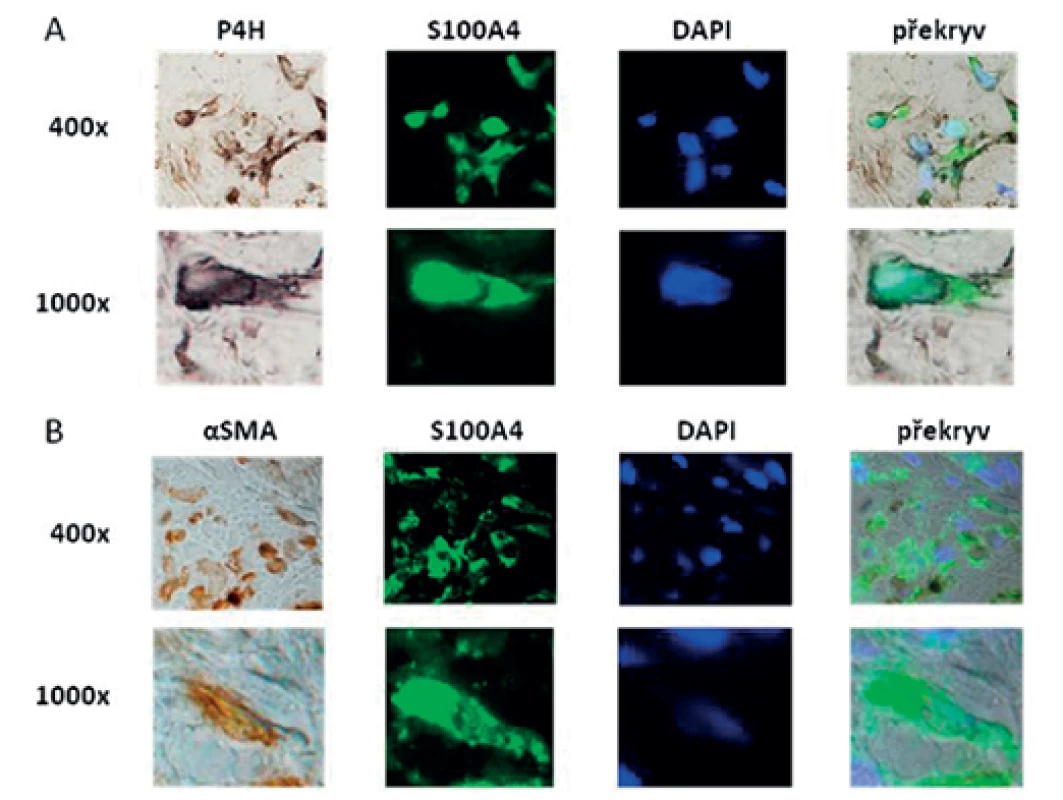
Obr. 3. Exprese S100A4 je zvýšená u experimentální kožní fibrózy. 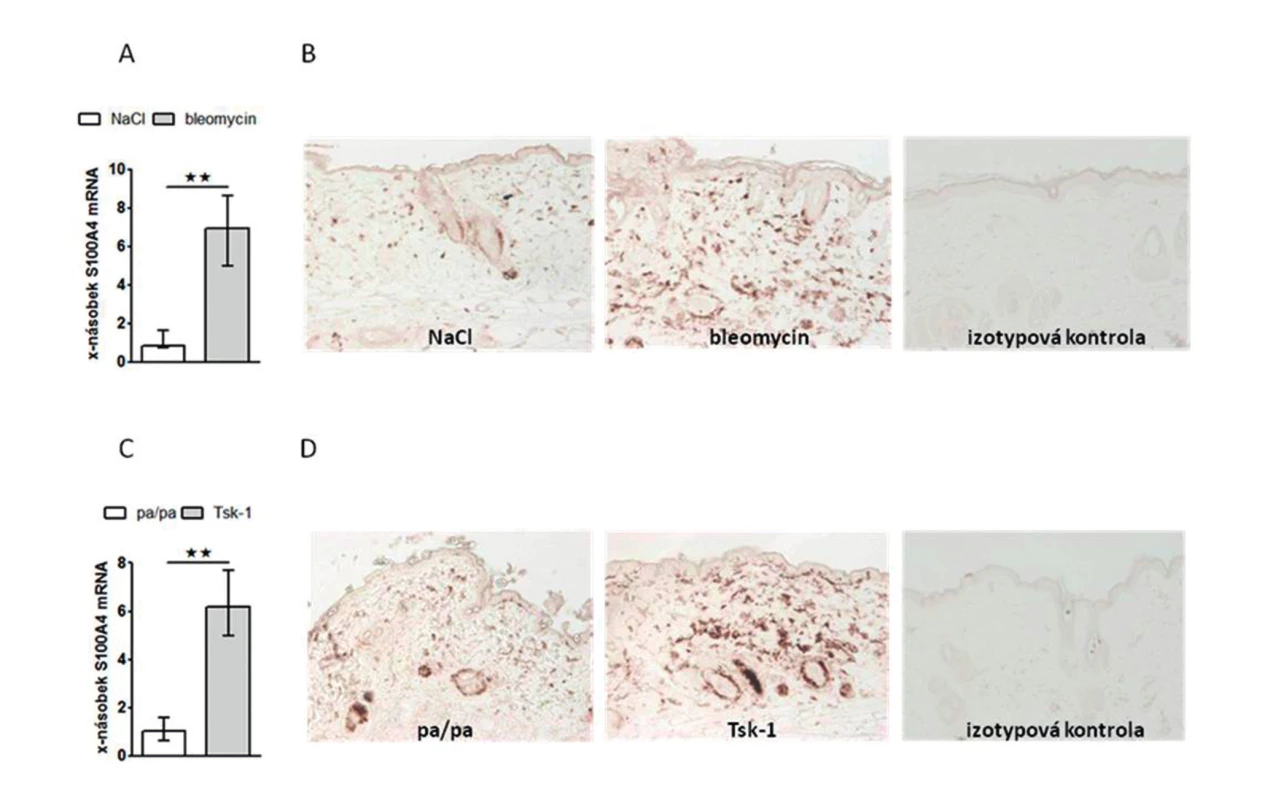
TGF-β indukuje expresi S100A4 v závislosti na Smad3
Zjistili jsme, že zvýšená exprese S100A4 byla zachována i v kultivovaných SSc fibroblastech, na úrovni mRNA (obr.4A) i proteinu (obr. 4B) ve srovnání se zdravými fibroblasty i po několika pasážích in vitro. Dále jsme prokázali, že S100A4 pozitivní fibroblasty v SSc kůži jednotně exprimují fosforylovaný Smad2/3, což demonstruje aktivaci kanonické TGF-β signální kaskády v těchto fibroblastech (obr. 5A). Obdobnou kolokalizaci exprese p-Smad2/3 a S100A4 proteinu jsme prokázali v kultivovaných zdravých dermálních fibroblastech stimulovaných pomocí TGF-β (obr. 5B). Proto jsme dále předpokládali, že aktivovaná TGF-β signální kaskáda v SSc fibroblastech může stimulovat expresi S100A4. Abychom potvrdili tuto hypotézu, stimulovali jsme zdravé dermální fibroblasty pomocí TGF-β, což vedlo ke zvýšení exprese S100A4 na úrovni mRNA (obr. 6A) i proteinu (obr. 6B). Toto zvýšení exprese S100A4 po stimulaci TGF-β je závislé na TGF-β / Smad signální kaskádě, protože inhibice exprese Smad3 pomocí Smad3 siRNA utlumilo stimulační účinky TGF-β na expresi S100A4 na úrovni mRNA (obr. 7A) i proteinu (obr. 7B).
Obr. 4. Exprese S100A4 je zvýšená v SSc fibroblastech 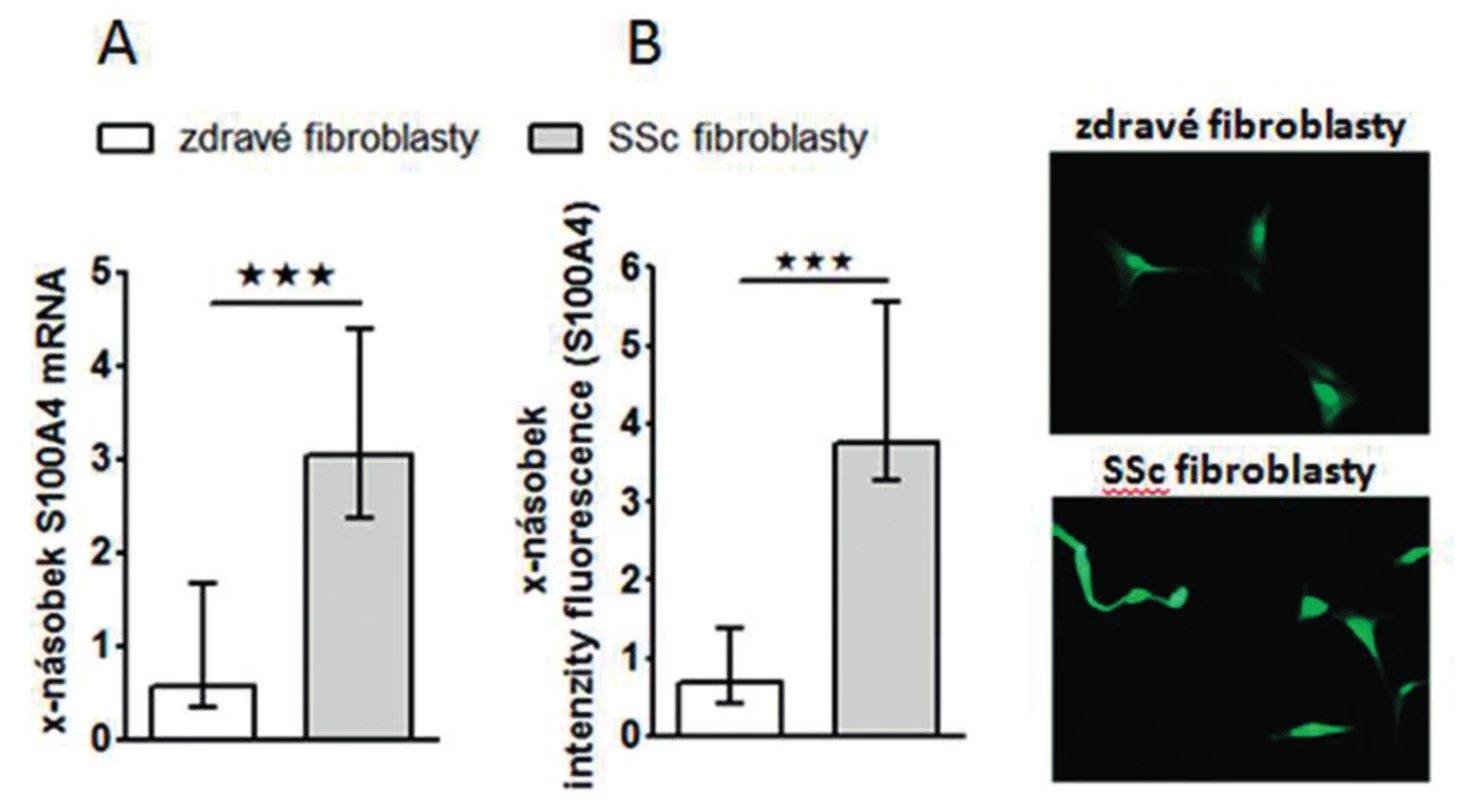
Obr. 5. Kolokalizace exprese S100A4 a p-Smad2/3 v SSc kůži a v aktivovaných fibroblastech. 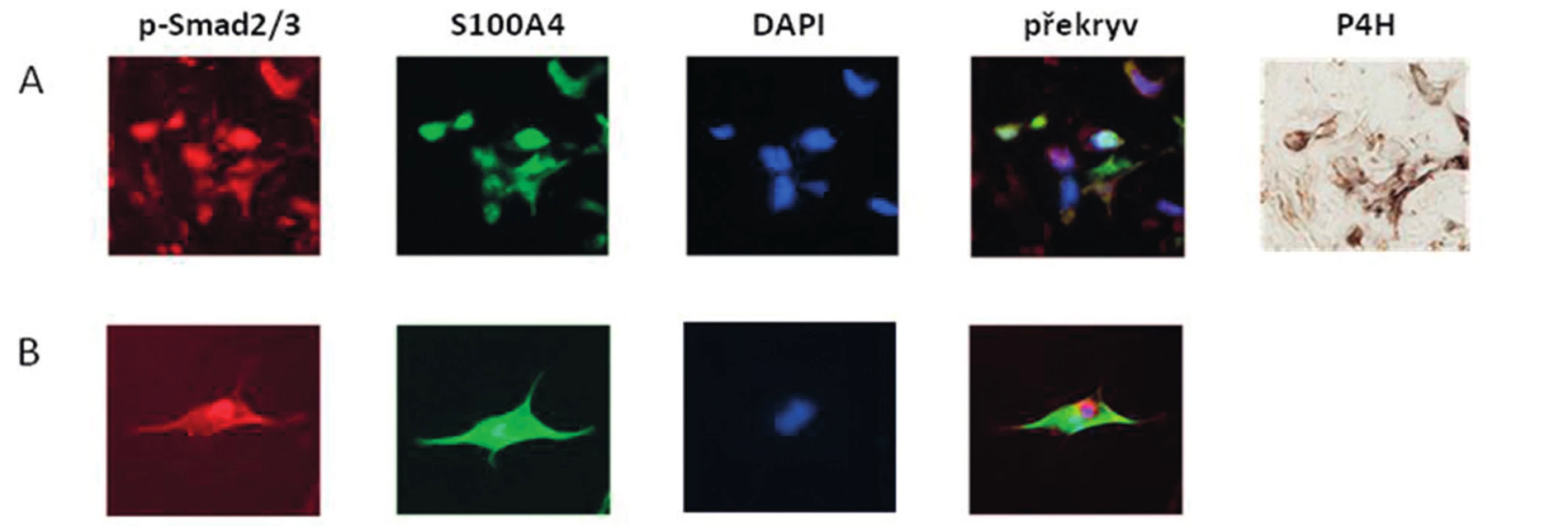
Obr. 6. Exprese S100A4 je zvýšená ve zdravých fibroblastech stimulovaných TGF-ß 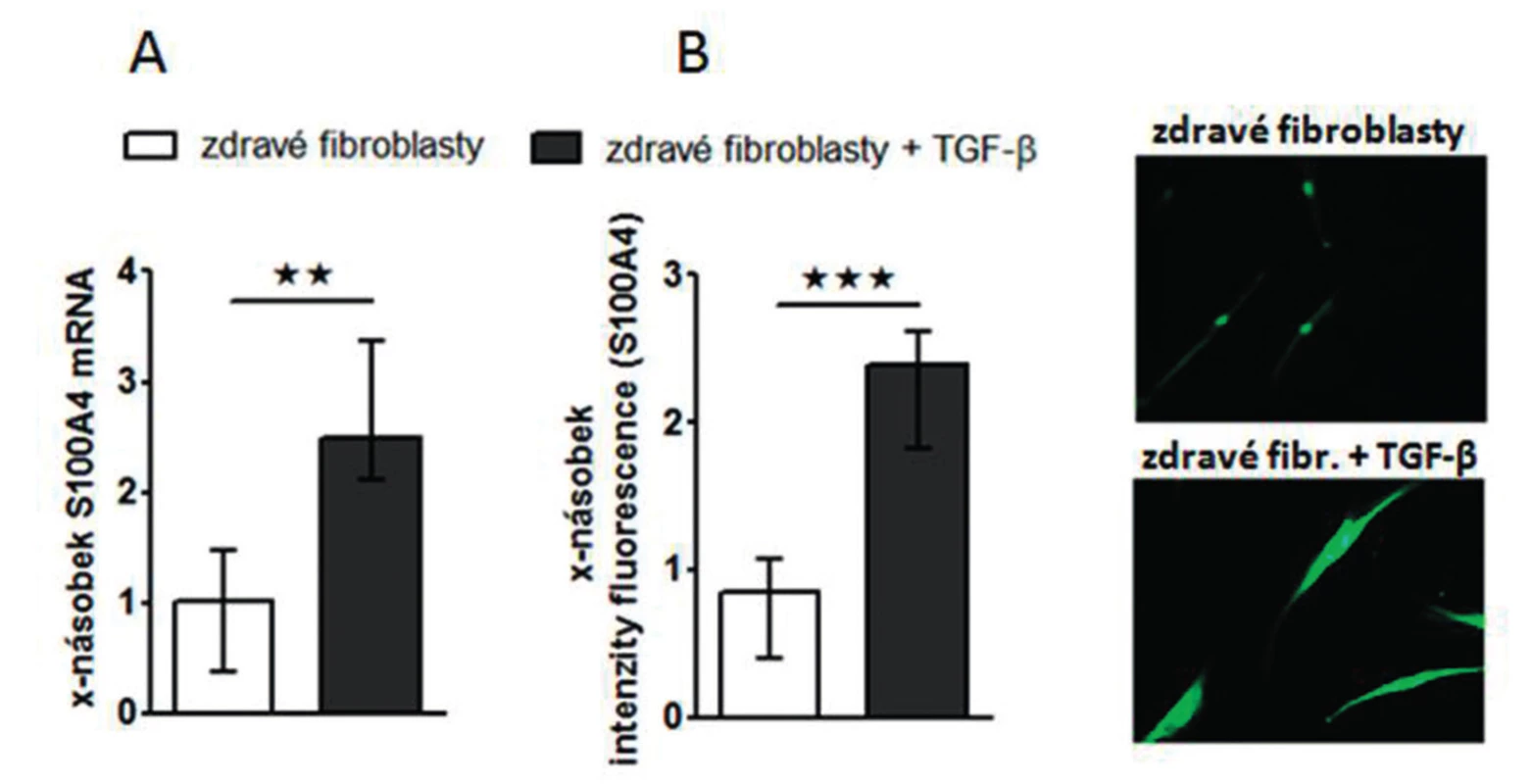
Obr. 7. Exprese S100A4 je indukovaná ve zdravých fibroblastech pomocí TGF-ß v závislosti na Smad3. 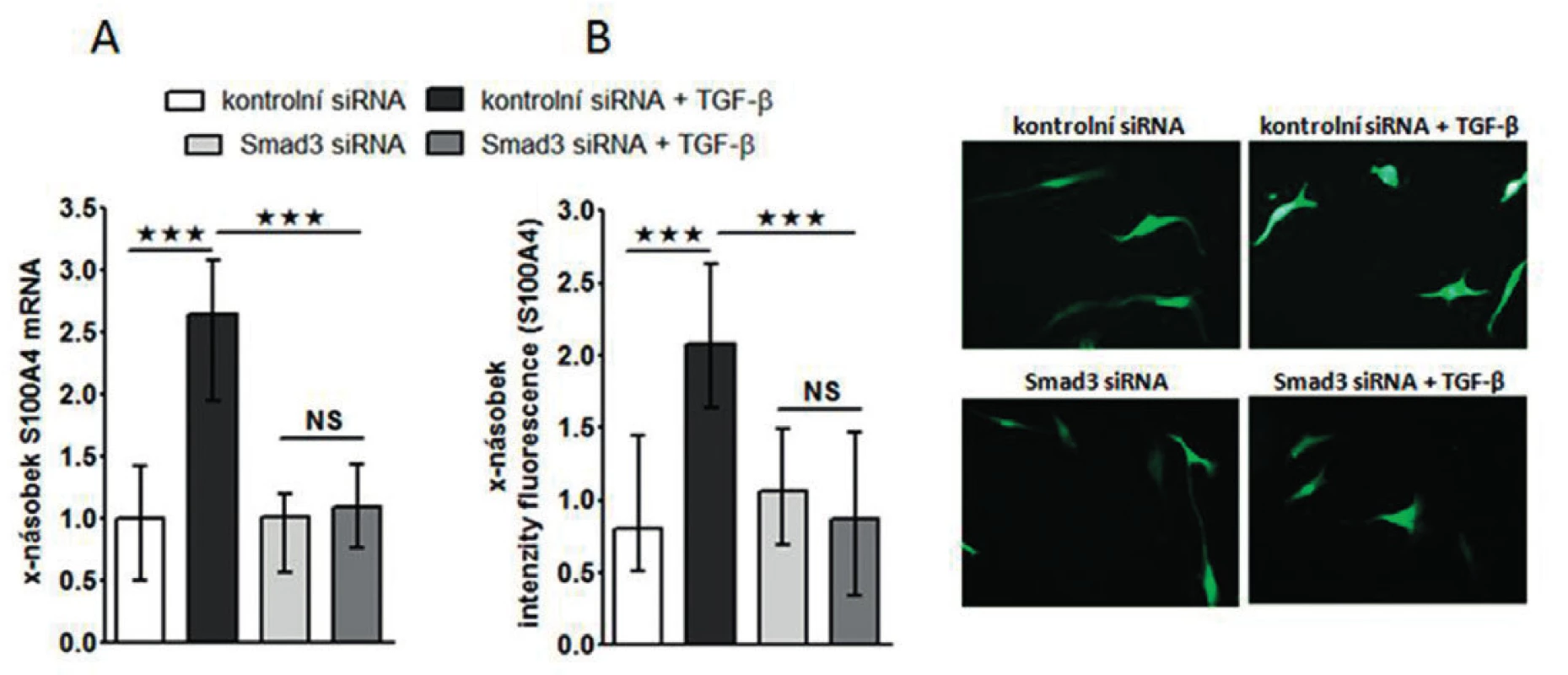
S100A4 indukuje aktivaci fibroblastů a syntézu kolagenu
(I) Zvýšení exprese S100A4 pomocí S100A4 expresního plazmidu (pcDNA3.1_S100A4) vedlo k aktivaci kanonické TGF-β / Smad signální dráhy ve fibroblastech [se zvýšením aktivity SBE reporteru (obr. 8A), se zvýšenou akumulací p-Smad2/3 (obr. 8B) a s indukcí mRNA exprese typických TGF-β / Smad indukovatelných genů – PAI-1 a Smad7 (obr. 8C pro oba)] a k indukci produkce kolagenu [se zvýšenou aktivitou col1a2 reporteru (obr. 9A), s indukcí exprese mRNA pro kolagen 1a1 a 1a2 (obr. 9B pro oba) a se zvýšením produkce kolagenu do supernatantu (obr. 9C)].
Obr. 8. S100A4 indukuje aktivaci TGF-ß / Smad signální kaskády. 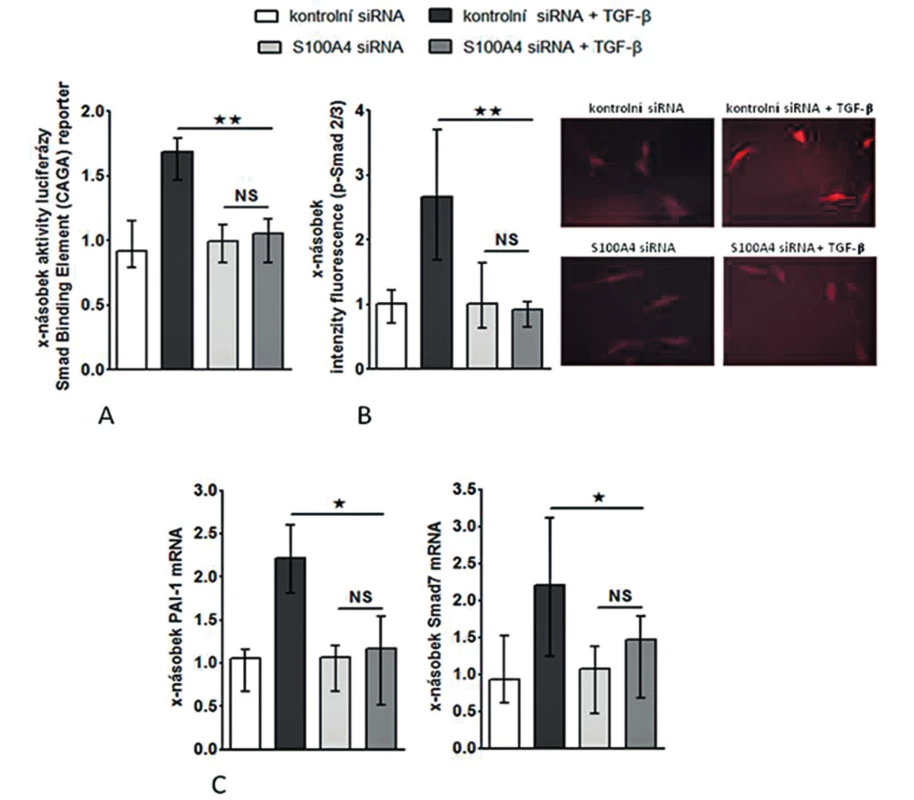
Obr. 9. S100A4 indukuje produkci kolagenu ve fibroblastech. 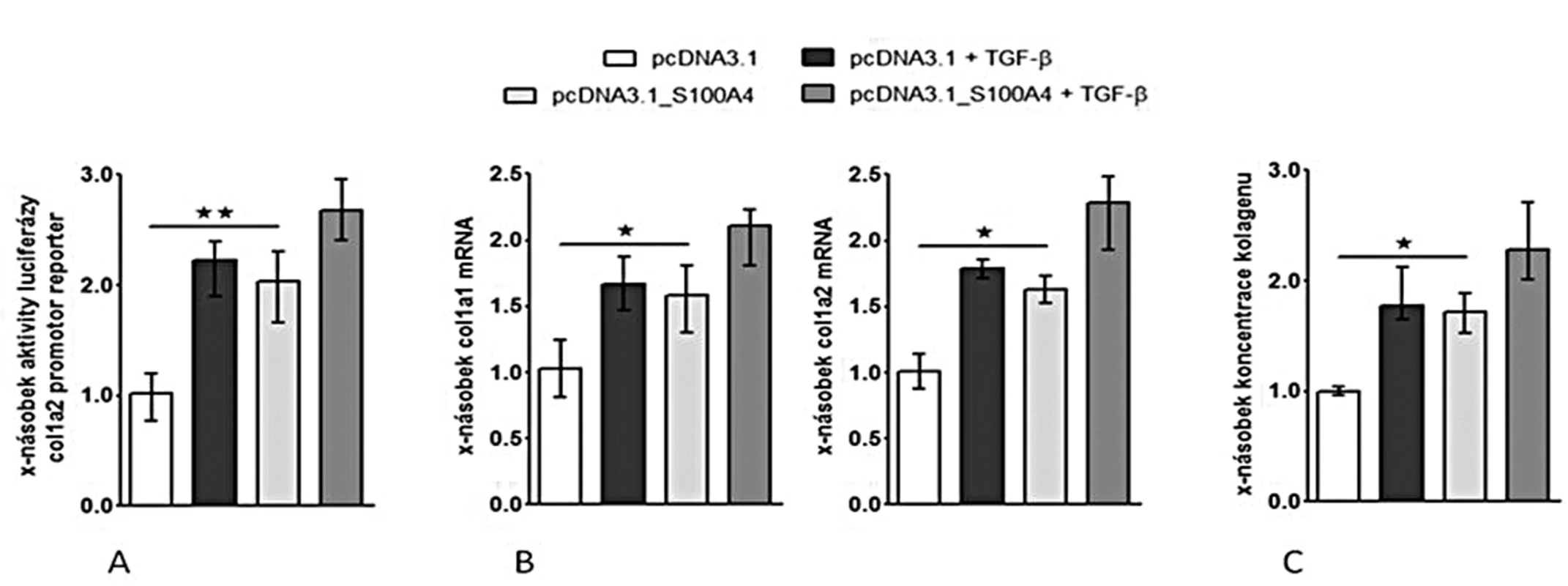
(II) Za účelem zhodnocení účinků extracelulárního S100A4 jsme inkubovali zdravé fibroblasty s různými koncentracemi rekombinantního S100A4 proteinu, což vedlo k aktivaci kanonické TGF-β / Smad signální dráhy ve fibroblastech [se zvýšenou akumulací p-Smad2/3, s indukcí mRNA exprese PAI-1 a Smad7 a se zvýšením exprese α-SMA] a ke zvýšení produkce kolagenu [se zvýšenou expresí mRNA pro kolagen 1a1 a kolagen 1a2 a se zvýšenou produkcí kolagenu do supernatantu] v závislosti na koncentraci rekombinantního S100A4 proteinu. Výsledky obou přístupů demonstrují, že S100A4 aktivuje fibroblasty, je pozitivním regulátorem TGF-β / Smad signální kaskády a amplifikuje stimulační účinky TGF-β na produkci kolagenu.
Inhibice S100A4 tlumí stimulační účinky TGF-β na fibroblasty
Abychom otestovali, zdali je S100A4 „downstream” mediátorem profibrotických účinků TGF-β, zkoumali jsme funkční důsledky inaktivace S100A4 dvěma různými přístupy. (I) Transfekce fibroblastů s S100A4 siRNA neovlivnila signifikantně expresi TGF-β / Smad indukovatelných genů ani nesnížila bazální sekreci kolagenu v klidových, tj. nestimulovaných, fibroblastech (obr. 10C, 11A-C). Avšak snížení exprese S100A4 u fibroblastů inkubovaných s TGF-β utlumilo signální dráhu TGF-β / Smad [s potlačením: indukce aktivity SBE reporteru (obr. 10A), exprese p-Smad2/3 (obr. 10B) a indukce mRNA exprese PAI-1 a Smad7 (obr. 10C pro oba)] a potlačilo produkci kolagenu [s potlačením: aktivity reporteru pro promotor kolagenu 1a2 (obr. 11A), indukce mRNA exprese kolagenu 1a1 a 1a2 (obr. 11B pro oba) a produkce kolagenu do supernatantu (obr. 11C)]. (II) Ve druhém přístupu uchránil deficit S100A4 (u fibroblastů izolovaných z S100A4-/ - myší) fibroblasty od stimulačních účinků TGF-β, které u kontrolních S100A4+/+ fibroblastů vedly ke zvýšení exprese p-Smad2/3, PAI-1 a Smad7 mRNA, col1a1 a col1a2 mRNA a zvýšení produkce kolagenu do supernatantu. Výsledky obou přístupů demonstrují, že S100A4 je důležitým mediátorem profibrotických účinků TGF-β a že inaktivace S100A4 má potentní antifibrotické účinky in vitro.
Obr. 10. Inhibice S100A4 pomocí siRNA tlumí stimulační účinky TGF-ß na Smad signální kaskádu. 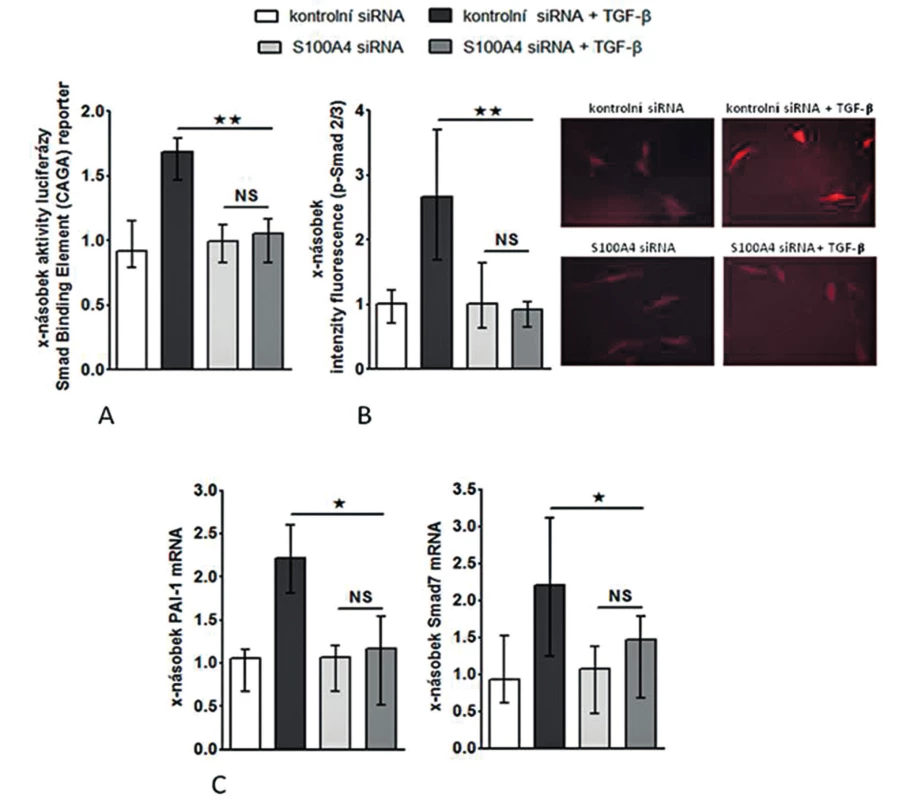
Obr. 11. Inhibice S100A4 pomocí siRNA tlumí stimulační účinky TGF-ß na produkci kolagenu. 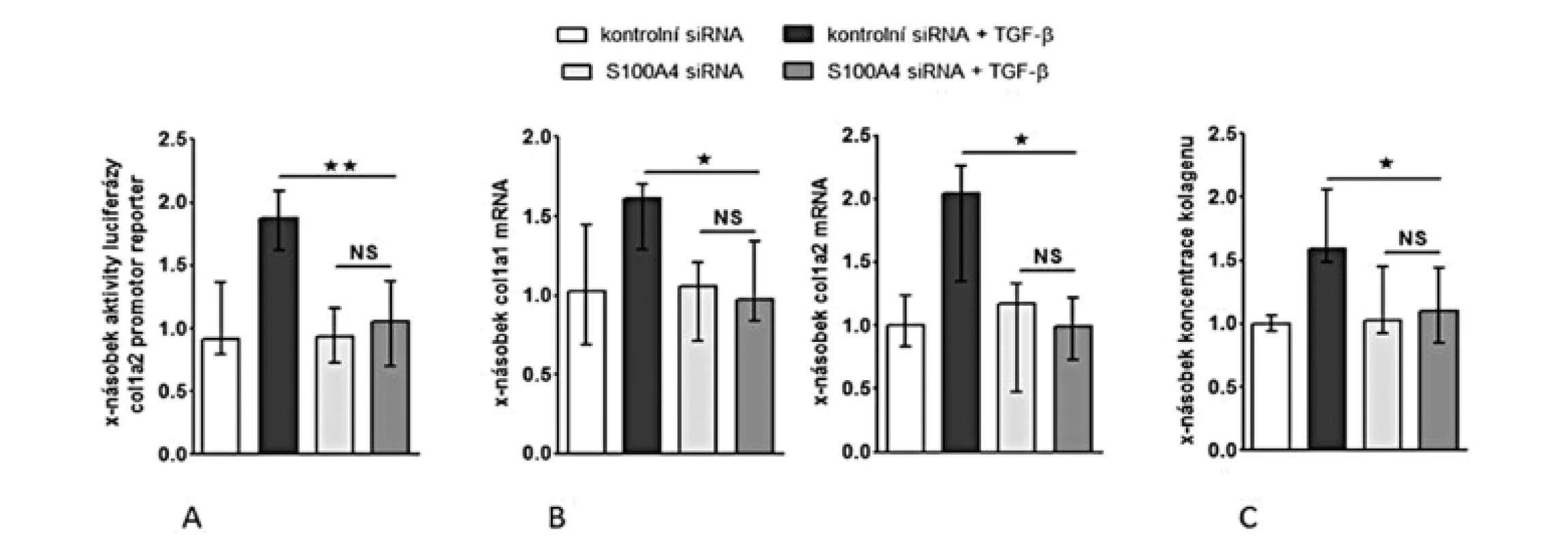
S100A4 knock-out myši jsou chráněny před rozvojem kožní fibrózy indukované bleomycinem
Opakované subkutánní aplikace bleomycinu vedly u S100A4 wild-type myší (S100A4+/+) k očekávané indukci kožní fibrózy charakterizované ztluštěním dermis, masivní proliferací myofibroblastů a zvýšeným ukládáním složek ECM. Tyto účinky bleomycinu byly zprostředkovány aktivací TGF-β / Smad signální dráhy s indukcí transkripce PAI-1 a Smad7 (obr. 12–13). Avšak S100A4 knock-out myši (S100A4-/-) byly uchráněny před rozvojem kožní fibrózy indukované bleomycinem. Ve srovnání s S100A4+/+ myšmi došlo po opakované aplikaci bleomycinu u S100A4-/- myší k signifikantní redukci ztluštění dermis (obr. 12A a B), k redukci obsahu hydroxyprolinu v kůži (obr. 12C), ke snížení počtu myofibroblastů v kůži (obr. 12D), k utlumení aktivace TGF-β / Smad signální kaskády s redukovanou akumulací p-Smad2/3 (obr. 13A) a utlumením indukce mRNA exprese PAI-1 a Smad 7 (obr. 13B pro oba). Deficit S100A4 nevedl k signifikantnímu snížení bazální úrovně sledovaných parametrů při kontrolní aplikaci NaCl (obr. 12, 13).
Obr. 12. Deficit S100A4 brání rozvoji fibrózy indukované bleomycinem. 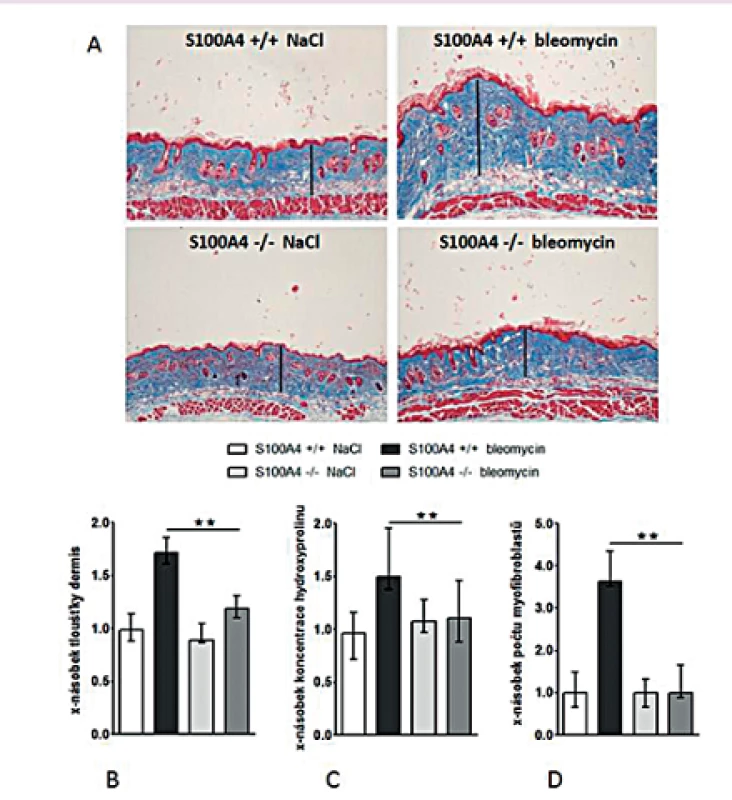
Obr. 13. Deficit S100A4 brání aktivaci Smad signální kaskády v kůži indukované bleomycinem. 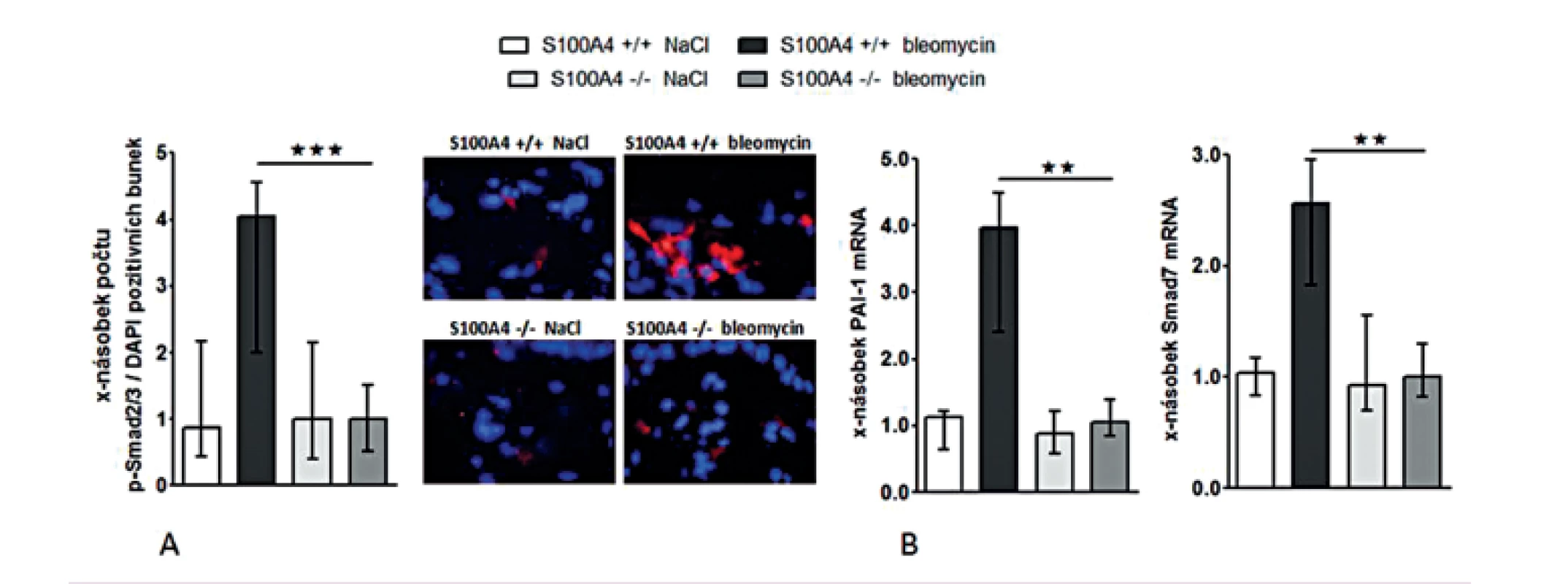
Deficit S100A4 brání rozvoji fibrózy u Tsk-1 myší
Antifibrotické účinky inaktivace S100A4 jsme posléze potvrdili v dalším modelu experimentální kožní fibrózy. Přítomnost mutace Tsk-1 vedla u S100A4+/+ myší k očekávané indukci kožní fibrózy charakterizované ztluštěním hypodermis, masivní proliferací myofibroblastů a zvýšeným ukládáním složek ECM zprostředkovaným aktivací TGF-β / Smad signální dráhy (obr. 14, 15). Avšak S100A4-/- myši byly uchráněny před rozvojem kožní fibrózy indukované mutací Tsk-1. Ve srovnání s S100A4+/+ Tsk-1 myšmi došlo u S100A4-/- Tsk-1 myší k signifikantní redukci ztluštění hypodermis (obr. 14A a B), k redukci obsahu hydroxyprolinu v kůži (obr. 14C), ke snížení počtu myofibroblastů v kůži (obr. 14D) a utlumení aktivace TGF-β / Smad signální kaskády s redukovanou akumulací p-Smad2/3 (obr. 15A) a utlumením indukce mRNA exprese PAI-1 a Smad 7 (obr. 15B). Deficit S100A4 nevedl k signifikantnímu snížení bazální úrovně sledovaných parametrů u kontrolních pa/pa myší (obr. 14, 15).
Obr. 14. Deficit S100A4 brání rozvoji kožní fibrózy u Tsk-1 myší. 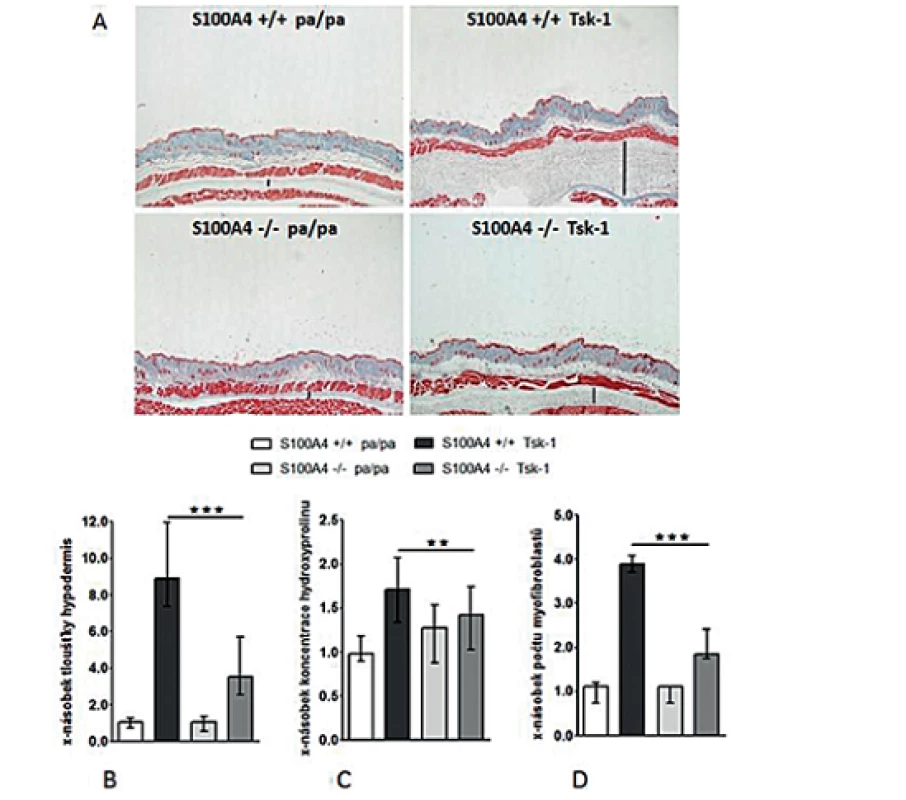
Obr. 15. Deficit S100A4 brání aktivaci Smad signální kaskády v kůži Tsk-1 myší. 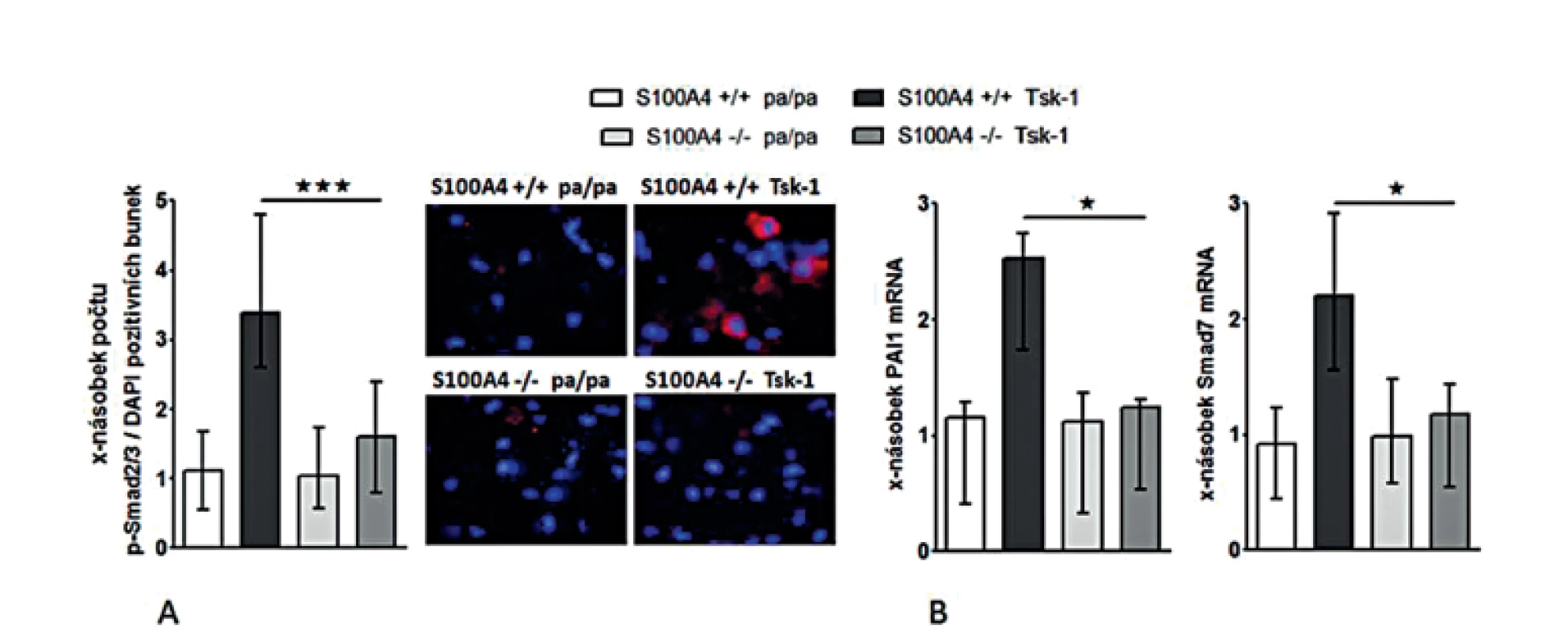
Diskuze
V naší práci o roli S100A4 proteinu v patogenezi SSc demonstrujeme jako první, že exprese S100A4 proteinu je zvýšená v postižené kůži pacientů se SSc, v kultivovaných SSc fibroblastech a ve dvou různých modelech experimentální kožní fibrózy. Ve srovnání s kůží zdravých jedinců byla exprese S100A4 výrazně zvýšená ve fibrotické kůži, zejména ve fibroblastech a v aktivovaných fibroblastech papilární vrstvy dermis. Naše výsledky demonstrují na několika úrovních experimentů in vitro a in vivo, že zvýšená exprese S100A4 je zprostředkována kanonickou signální kaskádou TGF-β: (I) Exprese S100A4 v SSc kůži kolokalizovala s expresí p-Smad2/3, centrálních mediátorů TGF-β signální kaskády. (II) Inkubace kultivovaných zdravých dermálních fibroblastů s TGF-β zvýšila expresi S100A4. (III) Snížení exprese Smad3 kompletně utlumilo stimulační účinky TGF-β na expresi S100A4. (IV) Zvýšená exprese S100A4 byla zachována v kultivovaných SSc fibroblastech ve srovnání se zdravými fibroblasty – i po několika pasážích ve tkáňových kulturách, což je v souladu s endogenní aktivací TGF-β signální kaskády v kultivovaných SSc fibroblastech (3). Stimulační účinky TGF-β na expresi S100A4 však nejsou omezeny jen na fibrolasty. TGF-β rovněž indukuje expresi S100A4 i v epiteliálních buňkách - jako je tomu u buněk endometriálních nádorů či u multipotentních progenitorových buněk rohovky (31, 32). Výsledky těchto studií taktéž demonstrují, že TGF-β je důležitým regulátorem tvorby S100A4. I další faktory, jako je například hypoxie, mohou rovněž přispívat k regulaci exprese S100A4 u SSc. V postižené kůži pacientů se SSc byl prokázán výrazně snížený parciální tlak kyslíku a nedávno bylo prokázáno, že hypoxie indukuje expresi S100A4 (33–35).
Naše práce dále demonstruje, že S100A4 může zesílit kanonickou TGF-β signální dráhu u SSc. Exprese S100A4 je nejenom indukovaná pomocí TGF-β, ale rovněž aktivně potencuje TGF-β signální kaskádu ve fibroblastech. Zvýšení exprese S100A4 pomocí expresního plazmidu i stimulace zdravých fibroblastů pomocí rekombinantního S100A4 proteinu vedou k potentní aktivaci signální dráhy TGF-β i bez přítomnosti exogenního TGF-β. Naproti tomu vedla inhibice exprese S100A4 pomocí siRNA nebo jeho kompletní deficit ve fibroblastech izolovaných z kůže S100A4-/- myší k utlumení stimulačních účinků TGF-β na fibroblasty. I když molekulární mechanizmy, kterými S100A4 reguluje Smad-dependentní transkripci v SSc fibroblastech, ještě musí být objasněny, výsledky recentně publikované práce u (HEK)-293T (human embryonic kidney) buněk demonstrují, že S100A4 může fyzicky interagovat se Smad proteiny způsobem závislým na vápníku (36). S100A4 tak pravděpodobně může modulovat vazbu Smad proteinů na DNA či interakci mezi Smad proteiny a kofaktory zprostředkující regulaci exprese klasických TGF-β / Smad-dependentních genů (36).
Naše výsledky dále prokázaly, že inaktivace S100A4 má silné antifibrotické účinky. Deficit S100A4 vede k útlumu TGF-β / Smad-dependentní transkripce v kultivovaných fibroblastech a brání aberantní aktivaci kanonické TGF-β signální dráhy v myších modelech SSc. Deficit S100A4 u S100A4-/- myší bránil v rozvoji experimentální kožní fibrózy ve dvou různých modelech a vedl k signifikantní redukci ztluštění kůže, k nižší akumulaci kolagenu a k omezení diferenciace klidových fibroblastů v myofibroblasty. Myší modely, které jsme v této studii použili, napodobují různé aspekty SSc u lidí. Model bleomycinem indukované kožní fibrózy napodobuje časnou – zánětlivou fázi SSc, ve které jsou fibroblasty aktivovány zejména profibrotickými mediátory uvolněnými z leukocytů infiltrujících postižené tkáně (7,8). Model Tsk-1 myší napodobuje pozdní fázi SSc, ve které již došlo k vymizení zánětlivé infiltrace a fibroblasty se staly endogenně aktivovanými (7, 37). Silné antifibrotické účinky inaktivace S100A4 v obou modelech naznačují, že by inhibice S100A4 mohla být účinná jak u podskupin pacientů se SSc, u kterých momentálně dominuje zánětlivá složka patogeneze, tak i u těch, u kterých je již zánět na ústupu a hlavním patomechanismem je fibróza. Inaktivace S100A4 nemusí mít antifibrotické účinky jen v modelech kožní fibrózy, ale i u dalších fibrotických onemocnění jako je například plicní fibróza nebo fibróza srdce (38,39). Inhibice S100A4 by se tak mohla stát zajímavým cílem nových antifibrotických terapií. Navíc je důležité zmínit, že inaktivace S100A4 neovlivňuje bazální fyziologickou produkci kolagenu u myších modelů experimentální kožní fibrózy, a proto by teoreticky neměla omezit ani normální homeostázu kolagenu u pacientů se SSc. In vitro nevedlo utlumení exprese S100A4 ke snížení bazální produkce kolagenu typu I u nestimulovaných fibroblastů. In vivo měly kontrolní S100A4-/- myši podobnou strukturu kůže a vnitřních orgánů a zejména srovnatelné hodnoty obsahu kolagenu v kůži jako S100A4+/+ myši. Další podrobnější studie však budou zapotřebí k objasnění všech účinků inaktivace S100A4 na homeostázu kolagenu ve tkáních in vivo.
Prostředků k inaktivaci S100A4 in vivo nebylo dosud popsáno mnoho. Zibert a spoluautoři nedávno použili k účinnému potlačení rozvoje experimentální psoriázy u myšího modelu polyklonální protilátky proti S100A4 (27). Sack a spoluautoři demonstrovali, že inhibitor transkripce S100A4, kalcimycin, brání formaci metastáz karcinomu tlustého střeva v myším modelu (40). Kolektiv prof. Grigorian v Institute of Cancer Biology v Kodani momentálně zkoumá účinnost inhibice S100A4 pomocí monoklonálních protilátek blokujících S100A4 u myších experimentálních modelů různých druhů nádorů s velmi slibnými výsledky (zatím nepublikovaná data). Jelikož je S100A4 bezpochyby velmi atraktivním cílem nových přístupů molekulární terapie hlavně u nádorových onemocnění, četné studie zacílené na zkoumání tohoto proteinu by mohly brzy přispět dalšími možnostmi účinné inaktivace S100A4 in vivo.
Výsledky naší analýzy role S100A4 u SSc, která je podkladem mé disertační práce, mohou být dále podpořeny naší další klinicky zaměřenou studií, která je plynulým pokračováním zde prezentovaných dat. Analyzovali jsme koncentraci S100A4 proteinu v sérech pacientů se SSc a zdravých kontrol. Zjistili jsme signifikantně vyšší koncentrace S100A4 u pacientů se SSc ve srovnání se zdravými dárci a dokonce i významně vyšší koncentrace S100A4 u podskupiny pacientů s difúzní formou SSc (dcSSc) oproti podskupině pacientů s limitovanou formou SSc (lcSSc). Koncentrace S100A4 v séru pozitivně korelovaly s modifikovaným Rodnanovým kožním skóre (mRSS), které kvantifikuje rozsah a stupeň ztluštění kůže celého těla. Dále jsme prokázali i signifikantně pozitivní korelaci sérových koncentrací S100A4 se skórem aktivity nemoci (EULAR SSc disease activity score) (41). Vzhledem k nedostatku vhodných biomarkerů u SSc, které by byly spolehlivým ukazatelem aktivity nemoci nebo úspěšnosti léčby, by se S100A4 mohl stát i potenciálním biomarkerem této komplikované nemoci. Preliminární data této studie však bude nutno nejdříve potvrdit na větším počtu pacientů se SSc a zdravých kontrol.
Závěr
Ve své disertační práci demonstruji, že S100A4 je klíčovým regulátorem aktivace fibroblastů u SSc. Exprese S100A4 je indukovaná pomocí TGF-β a S100A4 zpětně zesiluje profibrotické účinky kanonické TGF-β / Smad signální dráhy. Inaktivace S100A4 účinně tlumí aktivaci fibroblastů indukovanou TGF-β a brání rozvoji experimentální kožní fibrózy u dvou myších modelů SSc. Naše výsledky mají i translační potenciál, protože různé přístupy inaktivace S100A4 jsou momentálně analyzovány in vivo u experimentálních modelů nádorových i nenádorových onemocnění.
Poděkování
Na závěr bych velmi rád poděkoval svému školiteli doc. MUDr. Radimovi Bečvářovi, CSc., a odbornému konzultantovi prof. MUDr. Ladislavu Šenoltovi, Ph.D., za příkladné vedení, pomoc při postgraduálním studiu, profesním růstu a uvedení do oboru revmatologie, konkrétně systémové sklerodermie. Chci poděkovat prof. MUDr. Karlu Pavelkovi, DrSc., řediteli Revmatologického ústavu v Praze, za podporu a umožnění zahraničního studijního pobytu v Department for Internal Medicine 3 v Erlangenu. Mé poděkování patří i PD Dr. med. Joergovi Distlerovi v Department for Internal Medicine 3 v Erlangenu, pod jehož vedením jsem měl možnost získat základní znalosti v oblasti bazálního výzkumu u SSc a pracovat na různých výzkumných projektech. Poděkování patří i třem kolegům z Erlangenu, M.Sc. Pawel Zerr, M.Sc. Katrin Palumbo-Zerr a MD Jérôme Avouac, PhD., za zasvěcení do základních laboratorních metod a pomoc a podporu nejenom při práci v laboratoři. Děkuji všem kolegům a spoluautorům v Revmatologickém ústavu v Praze, především Mgr. Lucii Andrés Cerezo, Ph.D., Mgr. Markétě Kuklové a MUDr. Márii Filkové, Ph.D., za spolupráci a pomoc při řešení projektů. Výzkumné projekty, ze kterých vychází tato disertační práce, a pobyt v Erlangenu by se neobešly bez finanční podpory následujících institucí: Výzkumné záměry MZČR (00023728), EULAR Research Training Bursary, Fond Mobility Univerzity Karlovy v Praze, Abbott, OPPA European Social Fund Prague & EU: Supporting Your Future (CZ.2.17/1.1.00/32698) a SVV: 262512.
Adresa pro korespondenci:
MUDr. Michal Tomčík, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: tomcik@revma.cz
Zdroje
1. Abraham DJ, Varga J. Scleroderma: from cell and molecular mechanisms to disease models. Trends Immunol 2005; 26(11): 587–595.
2. Mayes MD, et al. Prevalence, incidence, survival, and disease characteristics of systemic sclerosis in a large US population. Arthritis Rheum 2003; 48(8): 2246–2255.
3. LeRoy EC. Increased collagen synthesis by scleroderma skin fibroblasts in vitro: a possible defect in the regulation or activation of the scleroderma fibroblast. J Clin Invest 1974; 54(4): 880–889.
4. Pannu J, Trojanowska M. Recent advances in fibroblast signaling and biology in scleroderma. Curr Opin Rheumatol 2004; 16(6): 739–745.
5. Massague J, Gomis RR. The logic of TGFbeta signaling. FEBS Lett 2006; 580(12): 2811–2820.
6. Varga J, Bashey RI. Regulation of connective tissue synthesis in systemic sclerosis. Int Rev Immunol 1995; 12(2–4): 187–199.
7. Beyer C, et al. Animal models of systemic sclerosis: prospects and limitations. Arthritis Rheum 2010; 62(10): 2831–2844.
8. Yamamoto T, et al. Animal model of sclerotic skin. I: Local injections of bleomycin induce sclerotic skin mimicking scleroderma. J Invest Dermatol 1999; 112(4): 456–462.
9. Saito E., et al. CD19–dependent B lymphocyte signaling thresholds influence skin fibrosis and autoimmunity in the tight–skin mouse. J Clin Invest 2002; 109(11): 1453–1462.
10. Ebralidze A, et al. Isolation and characterization of a gene specifically expressed in different metastatic cells and whose deduced gene product has a high degree of homology to a Ca2+–binding protein family. Genes Dev 1989; 3(7): 1086–1093.
11. Moore BW. A soluble protein characteristic of the nervous system. Biochem Biophys Res Commun 1965; 19(6): 739–744.
12. Santamaria–Kisiel L, et al. Calcium–dependent and –independent interactions of the S100 protein family. Biochem J 2006; 396(2): 201–214.
13. Donato R. Intracellular and extracellular roles of S100 proteins. Microsc Res Tech 2003; 60(6): 540–551.
14. Ambartsumian N, et al. The metastasis–associated Mts1(S100A4) protein could act as an angiogenic factor. Oncogene 2001; 20(34): 4685–4695.
15. Senolt L, et al. S100A4 is expressed at site of invasion in rheumatoid arthritis synovium and modulates production of matrix metalloproteinases. Ann Rheum Dis 2006; 65(12): 1645–1648.
16. Novitskaya V, et al. Oligomeric forms of the metastasis–related Mts1 (S100A4) protein stimulate neuronal differentiation in cultures of rat hippocampal neurons. J Biol Chem 2000; 275(52): 41278–41286.
17. Kimura K, et al. Clinical significance of S100A4 and E-cadherin-related adhesion molecules in non–small cell lung cancer. Int J Oncol 2000; 16(6): 1125–1131.
18. Saleem M, et al. Prognostic significance of metastasis–associated protein S100A4 (Mts1) in prostate cancer progression and chemoprevention regimens in an autochthonous mouse model. Clin Cancer Res 2005; 11(1): 147–153.
19. Davies BR, et al. Expression of S100A4 protein is associated with metastasis and reduced survival in human bladder cancer.J Pathol 2002; 196(3): 292–299.
20. Rosty C, et al. Overexpression of S100A4 in pancreatic ductal adenocarcinomas is associated with poor differentiation and DNA hypomethylation. Am J Pathol 2002; 160(1): 45–50.
21. Yonemura Y, et al. Inverse expression of S100A4 and E-cadherin is associated with metastatic potential in gastric cancer. Clin Cancer Res 2000; 6(11): 4234–4242.
22. Andersen K, et al. Expression of S100A4 combined with reduced E–cadherin expression predicts patient outcome in malignant melanoma. Mod Pathol 2004; 17(8): 990–997.
23. Boye K, et al. Nuclear S100A4 is a novel prognostic marker in colorectal cancer. Eur J Cancer 2010; 46(16): 2919–2925.
24. Boye K, Maelandsmo GM. S100A4 and metastasis: a small actor playing many roles. Am J Pathol 2010; 176(2): 528–535.
25. Schneider M, et al. S100A4: a common mediator of epithelial-mesenchymal transition, fibrosis and regeneration in diseases?J Mol Med (Berl) 2008; 86(5): 507–522.
26. Cerezo LA, et al. The metastasis promoting protein S100A4 is increased in idiopathic inflammatory myopathies. Rheumatology (Oxford) 2011; 50(10): 1766–1772.
27. Zibert JR, et al. Significance of the S100A4 protein in psoriasis. J Invest Dermatol 2010; 130(1): 150–160.
28. LeRoy EC, Medsger TA, Jr. Criteria for the classification of early systemic sclerosis. J Rheumatol 2001; 28(7): 1573–1576.
29. EL Naamam C, et al. Cancer predisposition in mice deficient for the metastasis-associated Mts1(S100A4) gene. Oncogene 2004; 23(20): 3670–3680.
30. Woessner JF, Jr. The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid. Arch Biochem Biophys 1961; 93 : 440–447.
31. Xie R., et al. S100A4 mediates endometrial cancer invasion and is a target of TGF–beta1 signaling. Lab Invest 2009; 89(8): 937–947.
32. Kawakita T., et al. Activation of Smad–mediated TGF–beta signaling triggers epithelial-mesenchymal transitions in murine cloned corneal progenitor cells. J Cell Physiol 2013; 228(1): 225–234.
33. Beyer C., et al. Hypoxia. Hypoxia in the pathogenesis of systemic sclerosis. Arthritis Res Ther 2009; 11(2): 220.
34. Distler J.H., et al. Hypoxia-induced increase in the production of extracellular matrix proteins in systemic sclerosis. Arthritis Rheum 2007; 56(12): 4203–4215.
35. Copple BL. Hypoxia stimulates hepatocyte epithelial to mesenchymal transition by hypoxia–inducible factor and transforming growth factor-beta-dependent mechanisms. Liver Int. 2010; 30(5): 669–682.
36. Matsuura I., et al. Functional interaction between Smad3 and S100A4 (metastatin-1) for TGF-beta-mediated cancer cell invasiveness. Biochem J 2010; 426(3): 327–335.
37. Green MC, et al. Tight-skin, a new mutation of the mouse causing excessive growth of connective tissue and skeleton. Am J Pathol 1976; 82(3): 493–512.
38. Lawson WE, et al. Characterization of fibroblast–specific protein 1 in pulmonary fibrosis. Am J Respir Crit Care Med 2005; 171(8): 899–907.
39. Zeisberg EM, et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nat Med 2007; 13(8): 952–961.
40. Sack U, et al. S100A4-induced cell motility and metastasis is restricted by the Wnt/beta-catenin pathway inhibitor calcimycin in colon cancer cells. Mol Biol Cell. 2011; 22(18): 3344–3354.
41. Valentini G., et al. Assessment of disease activity. Clin Exp Rheumatol. 2003; 21(3 Suppl 29): S39–41.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2014 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Zpráva o převzetí péče o hrob prof. MUDr. Františka Lenocha, DrSc.
- Zpráva z kongresu EULAR
- Význam nových prozánětlivých a/nebo profibrotických molekul v patogenezi systémové sklerodermie
- Zánětlivá bolest v zádech – význam při screeningu a diagnostice spondyloartritid
- XI. seminář mladých revmatologů
- Erratum
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zánětlivá bolest v zádech – význam při screeningu a diagnostice spondyloartritid
- XI. seminář mladých revmatologů
- Význam nových prozánětlivých a/nebo profibrotických molekul v patogenezi systémové sklerodermie
- Zpráva o převzetí péče o hrob prof. MUDr. Františka Lenocha, DrSc.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



