-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mimokloubní projevy revmatických onemocnění a možnosti jejich ovlivnění biologickou léčbou
Extraarticular manifestations of rheumatic diseases and the possibilities of their alleviation by biological therapy
Rheumatoid arthritis and ankylosing spondylitis are chronic inflammatory rheumatic diseases manifesting mainly by pain of joints and spine. Extraarticular manifestations such as involvement of entheses, skin, gut, eye, and others can be an important part of the disease. Systemic manifestations such as amyloidosis, vasculitis, more frequent occurrence of osteoporosis and accelerated development of atherosclerosis can occur simultaneously with the extraarticular manifestations. It was found that anti-TNFα therapy successfully affects the incidence of enthesitis, skin manifestations, uveitis and intestinal involvement in patients with ankylosing spondylitis, in both fully expressed and subclinical form of idiopathic inflammatory bowel disease. Patients treated with anti-TNFα antibodies were shown to have decreased incidence of uveitis compared to patients treated with etanercept. Treatment with infliximab or adalimumab is also indicated in patients with spondylarthritis with concomitant intestinal involvement. Anti-TNFα therapy in rheumatoid arthritis and ankylosing spondylitis has a beneficial effect on the increase of bone density compared to placebo treated individuals. The results from some studies and national registries imply that this therapy could reduce the incidence of cardiovascular events in comparison with untreated individuals. However, biological therapy may paradoxically cause development of autoimmune diseases, namely both organ specific and systemic diseases.
Key words:
biological therapy, anti-TNFα therapy, extraarticular manifestations, autoimmune diseases, atherosclerosis, osteoporosis
Autoři: Š. Forejtová
Působiště autorů: Revmatologický ústav Praha a Revmatologická klinika 1. LF UK, Praha
Vyšlo v časopise: Čes. Revmatol., 19, 2011, No. 2, p. 80-85.
Kategorie: Příspěvky z kongresu
Souhrn
Revmatoidní artritida i ankylozující spondylitida jsou chronická zánětlivá revmatická onemocnění, projevující se především bolestí kloubů a páteře. Důležitou součástí onemocnění mohou být i extraartikulární manifestace, jako je postižení entezí, kůže, střeva, oka atd., současně se mohou vyskytovat i systémové projevy, jako je amyloidóza, vaskulitida, častější výskyt osteoporózy i akcelerovaný vývoj aterosklerózy. Bylo zjištěno, že ani-TNFα terapie úspěšně ovlivňuje výskyt entezitid, kožních projevů, uveitid i střevního postižení u pacientů s ankylozující spondylitidou, a to u plně vyjádřené i subklinické formy nespecifického střevního zánětu. U pacientů léčených protilátkami proti TNFα byl prokázán nižší výskyt uveitid v porovnání s pacienty, kteří byli léčeni etanerceptem. Také u pacientů se současným střevním postižením u spondylartritid je indikováno podávání infliximabu nebo adalimumabu. Anti-TNFα léčba u revmatoidní artritidy i ankylozující spondylitidy úspěšně ovlivňuje vzestup kostní denzity v porovnání s jedinci léčenými placebem. Z výsledků některých studií i národních registrů také vyplývá, že by tato terapie mohla snižovat výskyt kardiovaskulárních příhod v porovnání s neléčenými jedinci. Biologická léčba ovšem paradoxně může vyvolávat vznik autoimunitních onemocnění, a to orgánově specifických i systémových.
Klíčová slova:
biologická léčba, ani-TNFα terapie, mimokloubní manifestace, autoimunitní onemocnění, ateroskleróza, osteoporózaÚvod
Revmatoidní artritida (RA) i ankylozující spondylitida (AS) jsou chronická zánětlivá revmatická onemocnění, projevující se typicky kloubními i mimokloubními manifestacemi. Mimokloubní postižení u chronických zánětlivých revmatických onemocnění se může vyskytovat jako postižení jednotlivých orgánů (např. oční, gastrointestinální, kožní), případně jako systémové extraartikulární manifestace (ateroskleróza, amyloidóza, vaskulitida atd).
AS je asociována s výskytem Crohnovy choroby nebo ulcerózní kolitidy u 5–10 % pacientů (1, 2), asymptomatické postižení střeva je přítomno u 25–49 % pacientů s AS (3). U 50–60 % pacientů s AS byla prokázána přítomnost mikroskopických zánětlivých lézí na střevě (3–6). Naopak bylo zjištěno, že u pacientů s Crohnovou chorobou i ulcerózní kolitidou má asi 30 % pacientů postižen axiální skelet, 16 % pacientů u obou onemocnění má plně vyvinutý obraz AS, přičemž manifestace na skeletu může předcházet manifestaci střevního zánětu.
Také postižení očí je častou komplikací, uveitida se vyskytuje u 25–40 % pacientů s AS (7), z toho v 85 % případů má podobu akutní přední uveitidy (8). Výskyt uveitidy je 1,5–2,5krát častější u mužů, většinou se objevuje unilaterálně a toto oční postižení obvykle samo ustupuje. Vyšší riziko vzniku mají HLA-B27 pozitivní pacienti (9) a výskyt se zvyšuje s délkou trvání choroby (10). U HLA-B27 pozitivních pacientů se nejčastěji vyskytuje mezi 20.–40. rokem života, u HLA-B27 negativních je tomu průměrně o 10 let později (11).
Biologická léčba a idiopatický střevní zánět
Zatímco bylo prokázáno, že monoklonální protilátky (infliximab, adalimumab) jsou účinné při léčbě Crohnovy nemoci a ulcerózní kolitidy (12–16), není tomu tak u etanerceptu. Naopak se v literatuře objevily kazuistické případy, kde byly popsány případy manifestace střevního zánětu při léčbě etanerceptem (17, 18). Otázkou zůstává, zda se při léčbě etanerceptem manifestovalo dosud skryté střevní onemocnění, na jehož aktivitu nemá podávaný etanercept efekt, nebo zda případně může etanercept vznik střevního zánětu podporovat. Dosud jediná provedená metaanalýza studií u pacientů s AS léčených anti-TNFα terapií po dobu celkem 150 tzv. pacientských roků však neprokázala signifikantní snížení výskytu IBD (Idiopathic Bowel Diseases) u žádného z anti-TNFα preparátů v porovnání s placebem (19). Jednalo se o metaanalýzu celkem 9 studií u pacientů s AS léčených anti-TNFα léčbou, z toho bylo 7 placebem-kontrolovaných studií a 2 studie byly otevřené. K dispozici byla dostupná data celkem u 419 pacientů léčených etanerceptem (625 pacientských roků), u 366 pacientů léčených infliximabem (618 pacientských roků) a u 295 pacientů léčených adalimumabem (132 pacientských roků). Dále bylo sledováno 434 pacientů (150 pacientských roků), kteří dostávali placebo. Anamnéza IBD byla zaznamenána celkem u 6,7% pacientů. Byly zjištěny 2 případy nového výskytu nebo vzplanutí IBD u pacientů léčených placebem, 1 případ u pacientů léčených infliximabem a 3 případy u pacientů, kteří dostávali adalimumab. U pacientů, kteří dostávali etanercept, bylo zaznamenáno 14 případů IBD (z toho 9 vzplanutí a 5 nových případů). Počet případů nově vzniklého IBD nebo jeho vzplanutí se tak signifikantně lišil u pacientů léčených etanerceptem od pacientů léčených infliximabem (P = 0,01), ale nelišil se od placeba. Signifikantní byl také rozdíl mezi výskytem nového IBD u pacientů léčených adalimumabem a infliximabem (P = 0,02), autoři však dodávají, že kalkulace byla provedena u relativně malého množství pacientů léčených adalimumabem, v tomto ohledu bude potřeba provést další klinické hodnocení. Pacienti s anamnézou IBD léčení etanerceptem měli riziko vzniku nového vzplanutí rovno 18,0 (95 % CI 2-154) v porovnání s infliximabem, v porovnání s adalimumabem bylo pro etanercept riziko rovno 4,2 (95 %CI 0,4–44). V porovnání s placebem nebyl pro etanercept zaznamenán signifikantní rozdíl ve vzniku nového IBD. Autoři metaanalýzy ale dodávají, že největší limitací této práce bylo srovnávání pacientů ze studií s naprosto odlišným designem, v tomto smyslu bude potřeba provést další klinické sledování. V závěru konstatují, že pacienti s anamnézou IBD by spíše neměli být léčeni etanerceptem, nicméně si nemyslí, že by pozitivní anamnéza měla být absolutní kontraindikací podávání etanerceptu. Také nedoporučují provádět screeninig pro existenci skryté IBD před nasazením anti-TNF α léčby.
Biologická léčba a uveitida
Metaanalýza studií u pacientů s ankylozující spondylitidou ukazuje, že anti-TNFα léčba působí jako prevence vzniku uveitid (20), jiné zprávy hovoří o tom, že užití TNFα blokátorů snižuje aktivitu již existujících uveitid (21–23). Z výsledků jedné studie vyplývá, že etanercept je pravděpodobně asociován s vyšším rizikem vzniku uveitid při léčbě ve srovnání s infliximabem a adalimumabem (24). Autoři vycházeli ze dvou databází biologické léčby v USA. Bylo analyzováno celkem 2006 případů pacientů s AS léčených anti-TNFα léčbou, přičemž bylo zaznamenáno 43 případů uveitid při léčbě etanerceptem, 14 případů při léčbě infliximabem a 2 případy při terapii adalimumabem. Po adjustaci podle počtu pacientů léčených jednotlivými preparáty bylo zjištěno, že při etanerceptu se vyskytovala uveitida signifikantně častěji v porovnání s infliximabem (p < 0,001) a v porovnání s adalimumabem (p < 0,01), nebyl zjištěn signifikantní rozdíl mezi adalimumabem a infliximabem (p < 0,5). Autoři této studie ale dospívají k názoru, že vyšší výskyt uveitidy není důvodem k tomu, aby byly protilátky proti solubilnímu receptoru upřednostňovány v léčbě AS. Pouze pokud se vyvine uveitida při léčbě etanerceptem, je přechod na infliximab nebo adalimumab žádoucí (24). Ke stejnému závěru docházejí i čínští autoři, kteří provedli review literatury týkající se této problematiky (25).
V prospektivní studii bylo prokázáno, že adalimumab redukuje počet vzplanutí akutní přední uveitidy u pacientů s aktivní AS. Počet vzplanutí akutní přední uveitidy byl snížen o 51 % u všech pacientů, o 58% procent u pacientů s anamnézou akutní přední uveitidy a o 68 % u pacientů s recentně probíhající uveitidou (26). Jiná observační studie prokázala efekt adalimumabu v léčbě chronické přední uveitidy u pacientů s juvenilní idiopatickou artritidou (27).
Také u pacientů s Behcetovou chorobou a zadní uveitidou byl opakovaně prokázán efekt infliximabu při léčbě této mimokloubní manifestace (28).
Ovlivnění entezitid u spondylartritid biologickou léčbou
Účinnost infliximabu na aktitivitu entezitid u AS prokázala již studie publikovaná v roce 2002. V této studii byla potvrzena účinnost infliximabu podávaného po dobu 12 týdnů v léčbě AS a mimo jiné zde byla hodnocena i aktivita v oblasti entezitid (29). Také v recentní studii byla prokázána účinnost anti-TNF léčby na aktivitu entezitid u pacientů se spondylartitidou. U 24 pacientů s refrakterní patní entezitidou byl zjištěno signifikantně větší zlepšení obtíží u pacientů léčených etanerceptem s porovnání s jedinci, kteří byli léčeni placebem. Bylo sledováno globální hodnocení aktivity onemocnění pacientem, míra bolesti pat a funkce měřená pomocí WOMAC (Western Ontario and McMaster Universities Osteoarthritis index) a ve všech těchto parametrech bylo prokázáno signifikantní zlepšení po 12 týdnech podávání etanerceptu. Nebyly však zjištěny signifikantní rozdíly observované na MRI (30).
Biologická léčba a osteoporóza
Je známo, že aktivní RA i AS jsou spojeny s osteoporózou. Předpokládá se, že příčinou je lokální nebo systémová nadprodukce prozánětlivých cytokinů včetně TNFα (31–35). Bylo prokázáno, že léčba pomocí blokátorů TNFα vede ke statisticky významnému vzestupu kostní denzity, a to jak v oblasti axiálního skeletu, tak i v oblasti proximálního femuru u pacientů se spondylartritidou (36). Během 6 měsíců léčby infliximabem bylo potvrzeno signifikantní zvýšení BMD (Body Mass Denzity) v oblasti páteře (3,6 %, p = 0,001), kyčle (2,2 %, p = 0,0012) a trochanteru (2,3 %, p = 0,0012), současně byl prokázán trend ke zvýšení BMD v oblasti krčku femuru (1,1 %). Bylo také prokázáno zvýšení osteokalcinu mezi dnem 0 a 6. týdnem podávání (3 infuze), nebyla ale zjištěna změna v hladině ukazatelů kostní resorpce. Celkově nebyla prokázána změna v hladinách kostních markerů mezi začátkem a koncem podávání infliximabu.
V randomizované placebem kontrolované studii u pacientů léčených infliximabem po dobu 96 týdnů u pacientů s AS byla prokázáno signifikantní zvýšení BMD v oblasti páteře (2,5 %, p < 0,001) a kyčle (0,5 %, p = 0,033) oproti placebu v týdnu 24 (0,5 % a 0,2 %). Se zvýšení BMD korelovalo i zvýšení hladiny interleukinu-6, VEGF (vascular endothelial growth factor), osteokalcinu, kostní alkalické fosfatázy a CTX (C-terminal cross-links telopeptid kolagenu 1 (37).
Také v další 24týdenní studii infliximab redukoval kostní resorpci pomocí OPC (prekurzorové buňky osteoklastů) u pacientů s revmatoidní artritidou i ankylozující spondylitidou, tato inhibice byla větší u revmatoidní artritidy. Inhibice OPC časově koincidovala s redukcí zánětlivé aktivity AS a RA, zvýšením hladin osteokalcinu a relativním poklesem CTX (38).
Ovlivnění aterosklerózy biologickou léčbou
Je známo, že revmatoidní artritida je provázená zvýšeným výskytem morbidity a mortality (38), a to hlavně v důsledku akcelerované koronární aterosklerózy. Zvýšení rizika úmrtí se ve výsledcích z různých studií liší a je odhadováno v rozmezí 1,28–3x (39–41). K rozvoji akcelerované aterosklerózy přispívají jistě takové faktory, jako je fyzická inaktivita a obezita, diabetes mellitus, hypertenze a léčba kortikoidy, nicméně imunitní dysregulace, zánět a metabolické odchylky charakteristické pro RA hrají při rozvoji aterosklerózy u RA také podstatnou roli. Vývoj aterosklerózy je typicky popisován u několik let trvající RA, ale vyšší výskyt infarktu myokardu v porovnání s kontrolní skupinou byl zjištěn již u časné RA. Rozvoj je rychlejší také u séropozitivních pacientů v porovnání se séronegativní RA a je závislý na výši zánětlivých parametrů. Bylo prokázáno, že C-reaktivní protein (CRP) na počátku zánětlivé polyartritidy je důležitým prediktorem mortality z kardiovaskulárních (KV) příčin, a to nezávisle na jiných faktorech svědčících o aktivitě onemocnění. Pacienti s RA mají také, podobně jako například diabetici, méně často přítomnu anginu pectoris a bolestivé průvodní syndromy při ischemii myokardu, a hrozí tak u nich více riziko nerozpoznaného infarktu myokardu a náhlé smrti (41).
Také pacienti s ankylozující spondylitidou mají stejně jako nemocní s RA zkrácenou délku života, a to především díky zvýšení KV mortality. Dle výsledků provedených studií se riziko úmrtí na srdeční příhodu u pacientů s ankylozující spondylitidou zvyšuje 1,5–1,93krát (42–43).
Vliv anti-TNFα terapie na výskyt KV příhod u zánětlivých revmatických onemocnění je různorodý. V prospektivních studiích se nepodařilo prokázat, že by anti-TNFα léčba snižovala výskyt srdečního selhání, naopak může její podání v určitých fázích srdečního insuficience vést k jejímu zhoršení (44). Na druhou stranu radikálním snížením zánětu snižuje tato léčba riziko vzniku aterosklerotických změn. V mnoha studiích bylo prokázáno, že biologická léčba ovlivňuje různými mechanismy mnohé faktory, které mají vliv na rozvoj aterosklerózy (tab. 1) (45). Současně byly zveřejněny výsledky studií vyplývající z národních registrů nemocných léčených biologickou léčbou. Ve švédském registru bylo prokázáno, že podávání TNF-α blokátorů vede ke snížení výskytu první kardiovaskulární příhody (46), výsledky z britského registru prokázaly snížení rizika infarktu myokardu u pacientů léčených anti-TNF-α v porovnání s léčbou chorobu modifikujícími léky. Toto zvýšení bylo ovšem signifikantní u pacientů, kteří odpověděli dobře na léčbu po kloubní stránce (3,5 příhod na 1 000 pacientských roku u těch, kteří měli dobrou odpověď na léčbu v porovnání s 9,4 příhodami na 1 000 pacientských let u těch, kteří neměli dobrou odpověď na léčbu). Adjustovaný poměr rizika (RR) pro ty, kteří odpověděli vůči těm, kteří neodpověděli, byl 0,36 (95%CI 0,19–0,69) (47). Tyto studie ale neporovnávaly u sledovaných skupin výskyt tradičních i nových rizikových faktorů pro aterosklerózu. Bude tedy nutné provést prospektivní studie zabývající se přímo výskytem KV příhod u pacientů léčených biologickými léky a srovnat je s odpovídajícími kontrolními skupinami, aby bylo možné definitivně potvrdit kardioprotektivní efekt podávané anti-TNFα léčby.
Tab. 1. Vliv biologické terapie na aterosklerózu u RA a jiných forem artritidy ( dle literatury 45) 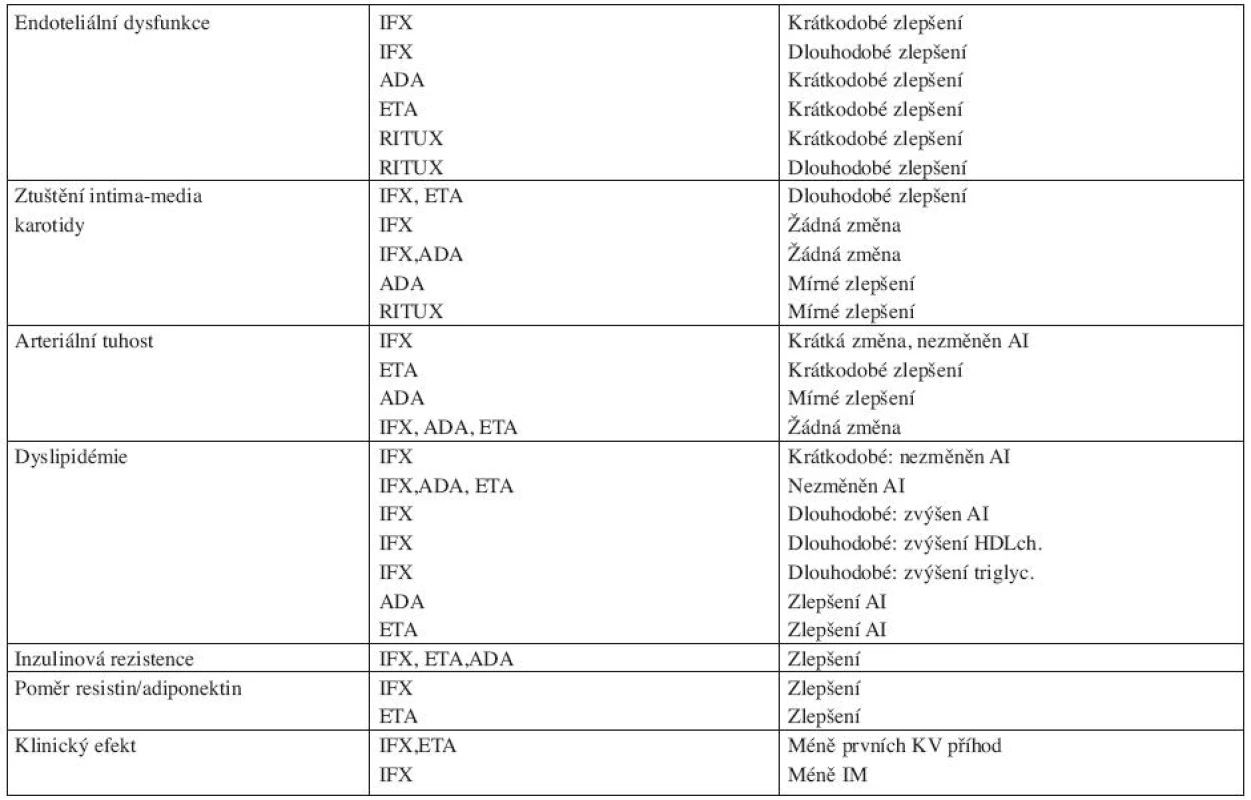
AI – aterogenní index IFX – infliximab ADA - adalimumab ETA - etanercept RITUX - rituximab KV – kardiovaskulární Biologická léčba a autoimunitní onemocnění
Přestože biologická léčba ovlivňuje významně mimokloubní manifestace zánětlivých revmatických onemocnění, může ale paradoxně vyvolávat také vznik nejrůznějších autoimunitních projevů, a to jak asymptomatické imunologické abnormality, tak i různá orgánově specifická i systémová onemocnění, která mohou vést až k život ohrožujícím stavům. Někdy bývá zpočátku těžké odlišit, zda se jedná o mimoskleletální projev původně léčené revmatické choroby, nebo zda se vyvinula autoimunitní komplikace vyvolaná podávanou biologickou terapií. V literatuře je nejvíce záznamů o vyvolání těchto autoimunitních příznaků anti-TNFα terapií, byly ale popsány i jednotlivé případy vzniku těchto onemocnění například po podání anakinry, rituximabu a abataceptu (48–49).
Biologická léčba může vyvolávat systémové automimunitní projevy, jako je systémový lupus erythematodes, vaskulitida, sarkoidóza. antifosfolipidový syndrom, dermatomyozitida atd., nebo se může autoimunitní onemocnění projevovat pouze v jednom orgánu (intersticiální plicní postižení, neuritida optiku, uveitida, orbitální myozitida, periferní neuropatie, roztroušená skleróza, autoimunitní hepatitida atd.). Autoimuinitní projevy mohou vznikat již první den po podání biologické terapie nebo až po několika letech aplikace, nejčastěji se projevují ovšem v 1.–12. měsíci terapie. Ve 29 % onemocnění vzniká i po výměně biologického preparátu. Kompletní vymizení příznaků po vysazení terapie bylo pozorováno u 72 % pacientů, parciální zlepšení u 15 % pacientů a nezlepšení bylo popsáno u 13 % jedinců. Nejhorší prognózu má intersticiálná plicní nemoc, zánětlivé oční postižení a CNS demyelinizační onemocnění (49).
Při léčbě autoimunitních projevů vyvolaných biologickou léčbou stačí ve většině případů biologickou léčbu vynechat, u těžších postižení volíme pak kortikosteroidy a imunosupresiva.
Závěr
Výskyt extraartikulárních manifestací zánětlivých revmatických onemocnění koreluje s aktivitou a závažností základního onemocnění. Biologická léčba úspěšně brání aktivitě onemocnění včetně extraartikulárních manifestací, jako je idiopatické střevní postižení, uveitida, psoriáza, osteoporóza, entezitida, dle výsledků některých studií může zpomalovat i rozvoj aterosklerózy. Pacienti s orgánovým extraartikulárním postižením jsou tak vzhledem k aktivitě onemocnění kandidáty k léčbě biologickýmu léky. Tato terapie ovšem může zároveň indukovat vznik autoimunitních onemocnění, a to orgánově specifických i systémových. V budoucnu bude nutné v rámci prospektivních i postmarketingových studií srovnat pacienty léčené biologickými preparáty s kontrolními jedinci léčenými konvenční terapií a vyhodnotit tak riziko vývoje těchto autoimunitních onemocnění.
Podpořeno výzkumnými záměry MZ ČR No: 00023728
Předneseno na Kongresu biologické léčby v Praze 13. 11. 2010
MUDr. Šárka Forejtová
Revmatologický ústav
Na Slupi 4
128 050 Praha 2
email: fore@revma.cz
Zdroje
1. Brophy S, Pavy S, Lewis P, et al. Inflammatory eye, skin, and bowel disease in spondylartropatis: genetic, phenotypic, and enviromental factors. J Rheumatol 2001; 28 : 2667-2673.
2. de Vlam K, Mielants H, Cuvelier C, et al. Spondylartropathy is underestimated in inflammatory bowel disease: prevalence and HLA assotiation. J Rheumatology 2000 : 27 : 2860-2865.
3. Leirisalo-Repo M, Turunen U, Stenman S, et al. High frequency of silent inflammatory bowel disease in spondylartropathy. Arthritis Rheum 1994; 37 : 23-31.
4. Mielants H, Veys EM, De Vos M, et al. The evaluation of spondylartropaties in relation tu gut histology. I: Clinical aspects. J Rheumatol 1995 : 22 : 2266-2272.
5. Mielants H, Veys EM, De Vos M, et al. The evaluation of spondylartropaties in relation tu gut histology. II: Histological aspects. J Rheumatol 1995 : 22 : 2273-2278.
6. Mielants H, Veys EM, De Vos M, et al. The evaluation of spondylartropaties in relation tu gut histology. III: Relation between gut and joint. J Rheumatol 1995 : 22 : 2279-2284.
7. Boonen A, van der Linden SM. The burden of ankylosing spondylitis. J Rheumatol (Suppl.) 2006;78 : 4-11.
8. Zeboulon N, Dougados M, Gossec L. Prevalence and characteristics of uveitis in the spondyloarthropathies: a systematic literature review. Ann Rheum Dis. 2008;67 : 955-959.
9. Jaakkola E, Herzberg I, Laiho K, et al. Finnish HLA studies confirm the increased risk conferred by HLA-B27 homozygosity in ankylosing spondylitis. Ann Rheum Dis 2006; 65 : 775-780.
10. Chen CH, Lim KC, Chen HA, et al. Assotiation of acute anterior uveitis with disease activity, functional ability a physical mobility in patients with ankylosing spondylitis: a cross-sectional study of Chines patients in Taiwan. Clin Rheumatol 2007;26 : 953-957.
11. Rothova A, Buitenhuis HJ, Christiaans BJ, et al. Acute anterior uveitis (AAU) and HLA-B27. Br J Rheumatol 1983; 22 : 144-145.
12. Baert FJ, DęHaens GR, Peeters M, et al. Tumour necrosis factor α antibody (infliximab) therapy profoundly down-regulates the inflammation in Crohnęs ileocolitis. Gastroenterology 1999; 116 : 22-28.
13. Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohnęs disease: the ACCENT I randomised trial. Lancet 2002; 359 : 1541-1549.
14. Rutgeerts P, Sandborn WJ, Feagan BG, et al.Infliximab for induction and maintenance therapy for ulcerative colitis.N Engl J Med 2005 8;353(23): 2462-76. Erratum in: N Engl J Med 2006 May 18; 354(20): 2200.
15. Hanauer SB, Sandborn WJ, Rutgeerts P, Fedorak RN, Lukas M, MacIntosh D, Panaccione R, Wolf D, Pollack P Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s disease: the CLASSIC-I trial Gastroenterology 2006 Feb;130(2): 323-333.
16. Afif W, Leighton JA, Hanauer SB, et al. Open-label study of adalimumab in patients with ulcerative colitis including those with prior loss of response or intolerance to infliximab. Inflamm Bowel Dis 2009; 15(9): 1302-7.
17. Wiegering V, Morbach H, Dick A, Girschick HJ. Crohn’s disease during etanercept therapy in juvenile idiopathic arthritis: a case report and review of the literature. Rheumatol Int 2010; 30(6): 801-804.
18. Haraoui B, Krelenbaum M.Emergence of Crohn’s Disease During Treatment with the Anti-Tumor Necrosis Factor Agent Etanercept for Ankylosing Spondylitis: Possible Mechanisms of Action.Semin Arthritis Rheum 2009; 39(3): 176-181.
19. Braun J, Baraliakos X, Listing J, et al. Differences in the incidence of flares or new onset of inflammatory bowel disease in patients with ankylosing spondylitis exposed to therapy with antitumour necrosis factor alpha agents. Arthritis Rheum 2007; 57 : 639-647.
20. Braun J, Baralioakos X, Listing J, Sieper J. Decreased incidence of anterior uveitis in patients with ankylosing spondylitis treated with anti-tumor necrosis factor agents infliximab and etanercept. Arthritis Rheum 2005; 52 : 2447-2451.
21. Smith JR, Levinson RD, Holland GN, et al. Differential efficacy of tumor necrosis factor inhibition in the management of inflammatory eye disease and associated rheumatis disease. Arthritis Rheum 2001; 45 : 252-257.
22. Reiff A, Takei S, Sadeghi S et al. Etanercept therapy in childern with treatment-resistent uveitis. Arthritis Rheum 2001; 44 : 1411-1415.
23. Tynjälä P, Lindahl P, Honkanen V. et al. Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann Rheum Dis 2007; 66 : 548-550.
24. Lim LL, Fraunfelder FW, Rosenbaum JT. Do tumor factor inhibitors cause uveitis? Arthritis Rheum 2007; 56 : 3248-3252.
25. Wang F, Wang N.-S. Etanercept therapy associated acute uveitis: a case report and literature review. Clin Exp Rheumatol 2009; 27 : 838-839.
26. Rudwaleit M, RŅdevand E, Holck P, et al. Adalimumab effectively reduces the rate of anterior uveitis flares in patients with aktive ankylosing spondylitis: results of a prospective open-label trial. Ann Rheum Dis 2009; 68 : 696-701.
27. Tynjälä P, Kontaniemi K, Lindahl P, et al. Adalimumab in juvenilie idiopathic artjritis – associated chronic anterior uveitid. Rheumatology 2008; 47 : 339-344.
28. Lee RW, Dick AD. Treat early and embrace the evidence in favour of anti-TNF-alpha therapy for Behćet’s uveitis. Br J Ophthalmol 2010; 94 : 269-70.
29. Braun J, Brandt J, Listing J, et al. Treatment of active ankylosing spondylitis with infliximab: a randomised controlled multicentre trial. Lancet 2002; 359(9313): 1187-93.
30. Dougados M, Combe B, Braun J, et al. A randomised, multicentre, double-blind, placebo - controlled trial of etanercept in adults with refractory heel entezitis in spondylarthritis: the HEEL trial. Ann Rheum Dis 2010; 69 : 1430-35.
31. Toussirot E, Wnding D. Bone mass in ankylosing spondylitis. Clin Exp Rheumatol 2000;18 Suppl 21: S16-S20.
32. Gratacos J, Collado A, Pons F, et al. Significant loss of bone mass in patients with early, active ankylosing spondylitis: a follow up study. Arthritis Rheum 1999; 42 : 2319-2324.
33. El Maghraoui A. Osteoporosis and ankylosing spondylitis. Joint Bone Spine 2004; 71 : 291-295.
34. Cooper C, Carbone L, Michet C, Atkinson E, OęFallon W, Melton L. Fracture risk in patients with ankylosing spondylitis – a population based study. J Rheumatol 1994;53 : 117-121.
35. Donnelly S, Doyle DV, Denton A, Rolfe I, Mc Closkey EV, Spector TD. Bone mineral density and vertebral compresiion fracture rates in ankylosing spondylitis. Ann Arheum Dis 1994; 53 : 117-121.
36. Allali F, Breban M, Porcher R, Maillefert JF, Dougados M, Roux C. Increase in bone mineral density of patients with spondyloarthropathy treated with anti-tumour necrosis factor alpha. Ann Rheum Dis 2003; 62 : 347-9.
37. Visvanathan S, van der Heijde D, Deodhar A, Wagner C, Baker DG, Han J, Braun J. Effects of infliximab on markers of inflammation and bone turnover and associations with bone mineral density in patients with ankylosing spondylitis. Ann Rheum Dis 2009; 68 : 175-82.
38. Gengenbacher M, Sebald HJ, Villiger PM, Hofstetter W, Seitz M. Infliximab inhibits bone resorption by circulating osteoclast precursor cells in patients with rheumatoid arthritis and ankylosing spondylitis. Ann Rheum Dis 2008; 67 : 620-4.
39. Goodson NJ, Wales NJ, Lunt M et al. Mortality in early inflammatory polyartritis: cardiovascular mortality is increased in seropositive patients. Arthritis Rheum 2002; 46 : 2010-2019.
40. Goodson NJ, Symmond DP, Scoty DG et al. Baseline levels of C-reactive protein and prediction of death from cardiovascular disease in patients with inflammatory polyartritis: a ten-year follow up study of primary care-based inception cohort. Arthritis Rheum 2005; 52 : 2293-2299.
41. Maradit-Kremers H, Crowson CS, Nicola PJ, et al. Unrecognized coronary hearth disease and sudden deaths inn rheumatoid arthritis : a population based cohort study. Arthritis Rheum 2005; 52 : 402-11.
42. Zochling J, Braun J. Mortality in ankylosing spondylitis. Clin Exp Rheumatol 2008; 26(Suppl. 51) S80-S84.
43. Lehtinen K. Mortality and causes of death in 398 patients admitted to hospital with ankylosing spondylitis. Ann Rheum Dis 1993; 52 : 174-176.
44. Sarzi-Puttini P, Arzeni F, Doria A, et al. Tumour necrosis factor-alpha, biologic agents and cardiovascular risk. Lupus 2005;14 : 780-4.
45. Szekanecz Z, Kerekes D, Soltész P. Vascular effects of biologic agents in RA and spondylartropaties. Nat Rev Rheumatol 2009; 5 : 677-684.
46. Jacobsson LT, Turesson G, Gulfe A, et al. Tratment with tumor necrosis factor blockers is associated with lower incidence of first cardiovascular events in patients with rheumatoid arthritis. J Rheumatol 2005; 32 : 1213-8.
47. Dixon WG, Watson KD, Lunt M, Hyrich KL; British Society for Rheumatology Biologics Register Control Centre Consortium, Silman AJ, Symmons DP; British Society for Rheumatology Biologics Register. Reduction in the incidence of myocardial infarction in patients with rheumatoid arthritis who respond to anti-tumor necrosis factor alpha therapy: results from the British Society for Rheumatology Biologics Register. Arthritis Rheum 2007; 56(9): 2905-12.
48. Ramos-Casals M, Brito-Zerón P, Soto MJ, Cuadrado MJ, Khamashta MA. Autoimmune diseases induced by TNF-targeted therapies. Best Practise &Research Clinical Rheumatology 2008; 22 : 847-861.
49. Ramos - Casals N, Roberto-Perez-Alverez, Diaz-Lageres C et al. Autoimmune diseases induced by biologia agents A double-edged sword? Autoimmunity Reviews 2010; 9 : 188-193.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2011 Číslo 2- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Malé molekuly RNA a jejich význam v imunitní odpovědi organismu
- Příspěvky z kongresu Biologická léčba
- Existují prediktivní ukazatele úspěšnosti biologické léčby?
- Jak vybrat preparát mezi biologickými léky?
- Jak se dívat na strukturální progresi u biologické léčby?
- Mimokloubní projevy revmatických onemocnění a možnosti jejich ovlivnění biologickou léčbou
- Výskyt infekcí při léčbě antagonisty TNF alfa v registru ATTRA
- Biologická léčba revmatoidní artritidy a riziko nádorových onemocnění
- Biologická léčba a speciální situace (těhotenství, kojení, vakcinace a perioperační období)
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biologická léčba a speciální situace (těhotenství, kojení, vakcinace a perioperační období)
- Mimokloubní projevy revmatických onemocnění a možnosti jejich ovlivnění biologickou léčbou
- Biologická léčba revmatoidní artritidy a riziko nádorových onemocnění
- Výskyt infekcí při léčbě antagonisty TNF alfa v registru ATTRA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



