-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výsledky volumetrického měření patologických ložisek mozku u nemocných se systémovým lupus erythematodes
The results of volumetry measurement of brain pathological lesions in patients with systemic lupus erythematosus
Objective:
Our project study presents the results of measuring the volume of pathological foci in the brain tissue of patients suffering from systemic lupus erytematosus (SLE) with or without neuropsychiatric manifestations (NP). Magnetic resonance (MR) scans of patients with SLE and, in particular, signs of neuropsychiatric involvement show pathological foci in the cerebral white matter. Methods: A total of 53 SLE patients, 29 with signs of neuropsychiatric syndromes (NPSLE), 24 without, and 16 healthy controls underwent prospective volumetric magnetic resonance imaging in a flow attenuated inversion recovery (FLAIR) sequence. The disease activity was expressed in terms of the Systemic Lupus Erythematosus Disease Activity Index (SLEDAI). Results: All of the patients in this study were found to have a larger volume of pathological foci in the brain tissue than the healthy controls. The NPSLE subgroup had a larger volume of pathological foci than the SLE patients without NP (p < 0.001). The largest volume of such foci was found in patients with a history of cerebrovascular disease (p < 0.05). These were also noted for a correlation between the duration of the disease and the period of time elapsed from the onset of the first signs of neuropsychiatric lupus (p < 0.01).Correlation with SLEDAI-rated disease activity was found statistically significant in all of the patients (p < 0.05), in those with NPSLE at a level of p < 0.01. Conclusion: We found that lesion load was significantly larger in NPSLE patients than in non-NPSLE patients and controls. Lesion load correlated with SLEDAI in the whole group of SLE patients and in the subgroup with NP manifestation. MR is so far the most sensitive method for visualising pathological foci in the brain tissue as abnormalities are demonstrable also in SLE patients free from NP. In the future, longitudinal volumetry might conceivably facilitate therapeutical effect rating.Key words:
systemic lupus erythematosus, neuropsychiatric lupus, magnetic resonance, volumetry, „lesion load“, FLAIR sequence
Autoři: L. Podrazilová 1; V. Peterová 2; D. Tegzová 1; M. Olejárová 1; J. Krásenský 2; Z. Seidl 3; P. Kozelek 4; A. Dohnalová 5; C. Dostál 1
Působiště autorů: Revmatologický ústav, Praha, 2MR oddělení Radiodiagnostické kliniky, 1. LF UK Praha, 3Neurologická klinika 1. LF UK Praha, 4Psychiatrická klinika, 1. LF UK Praha, 5Fyziologický ústav, 1. LF UK Praha 1
Vyšlo v časopise: Čes. Revmatol., 16, 2008, No. 2, p. 74-80.
Kategorie: Původní práce
Souhrn
V práci předkládáme výsledky volumetrického měření patologických ložisek mozku u nemocných se systémovým lupus erythematodes (SLE) s a bez neuropsychiatrických projevů (NP). U nemocných se SLE a zejména s vyjádřenými neuropsychiatrickými projevy jsou v obraze magnetické rezonance (MR) patrná patologická ložiska v bílé hmotě mozku. Metodika: Celkem 53 SLE nemocných, z toho 29 s neuropsychiatrickými projevy (NPSLE) a 24 bez neuropsychiatrických projevů a 16 zdravých kontrol, bylo vyšetřeno prospektivně volumetricky magnetickou rezonancí v sekvenci flow attenuated inversion recovery (FLAIR). Aktivita onemocnění byla vyjádřena indexem Systemic Lupus Erythematosus Disease Activity Index (SLEDAI). Výsledky: V práci jsme prokázali větší objem patologických ložisek mozku u všech vyšetřených nemocných oproti zdravým kontrolám. NPSLE nemocní měli větší objem patologických ložisek než SLE nemocní bez NP (p < 0,001), největší objem ložisek byl u těchto nemocných po prodělané cévní mozkové příhodě (p < 0,05). Současně byla u těchto nemocných zjištěna korelace mezi trváním nemoci a dobou od výskytu prvních neuropsychiatrických projevů (p < 0,01). Ve skupině všech vyšetřených nemocných jsme zjistili závislost na aktivitě nemoci vyjádřené SLEDAI (p < 0,05) a u nemocných NPSLE (p < 0,01). Závěr: Prokázali jsme větší objem patologických ložisek mozku u nemocných s NPSLE oproti SLE bez neuropsychiatrických projevů a zdravým kontrolám. Zjistili jsme závislost celkového objemu patologických ložisek na indexu aktivity SLEDAI u obou skupin nemocných, zvláště u NPSLE. MR je dosud nejcitlivější metoda k zobrazení patologických ložisek tkáně mozku, abnormality jsou prokazatelné též u SLE nemocných bez NP. V budoucnu by mohlo longitudinální volumetrické měření umožnit hodnocení efektu léčby.
Klíčová slova:
systémový lupus erythematodes, neuropsychiatrický lupus, magnetická rezonance, volumetrie, „lesion load“, FLAIR sekvenceÚvod
Systémový lupus erythematodes (SLE) je autoimunitní mnohaorgánové onemocnění, které postihuje především ženy ve fertilním věku. Neuropsychiatrické projevy se u SLE pacientů vyskytují od 11 % do 95 % podle různých autorů (1, 2) a jsou jednou z hlavních příčin morbidity a mortality u SLE nemocných. Velký rozptyl ve frekvenci NPSLE může být způsoben rozdíly ve výběru nemocných či použitím různých diagnostických kritérií pro NPSLE. V minulosti užívané nejednotné klasifikace neuropsychiatrických projevů byly v roce 1999 nahrazeny návrhem nových kritérií (3), která obsahují devatenáct klinických jednotek jak neurologických postihující centrální, periferní i autonomní nervový systém, tak i psychiatrických. Jednotlivé klinické projevy se mohou vyskytnout kdykoliv v průběhu choroby a mohou se vzájemně kombinovat. Avšak jako prvotní projev lupusové nemoci mohou být přítomny až u 20 % pacientů (4).
Ke stanovení diagnózy a sledování v průběhu nemoci je nezbytné sledovat autoprotilátkovou aktivitu v séru, v indikovaných případech i v likvoru. Další pomocné vyšetřovací metody jako elektromyografické vyšetření, vyšetření evokovaných potenciálů, elektroencefalografické vyšetření a baterie kognitivních testů jsou u pacientů dále doplněny podle klinických projevů.
Nejsenzitivnější metodou k zobrazení patologických ložisek mozku je vyšetření magnetickou rezonancí (MR) (5–8). V MR nálezech se rozlišují tři nejčastější typy abnormalit zejména v T2 vážených obrazech a sekvenci FLAIR. Klínovitá ložiska zvýšené intenzity v bílé hmotě větší než 6 mm jsou korelátem mozkového infarktu. Projevy vaskulitidy/vaskulopatie se zobrazují jako drobné vícečetné ložiskové hyperintenzity (do 6 mm). Třetí nejčastější typ abnormalit jsou difuzní ložiska hyperintenzní v T2 váženém obraze větší než 6 mm lokalizovaná i v šedé hmotě odpovídající edému mozku a při léčbě bývají reverzibilní.
Abnormality v obraze MR jsou popisovány nejen u NPSLE pacientů ve 33 až 100%, ale i u SLE pacientů bez NP v 16 až 53 % (9–11).
V rámci diferenciální diagnózy musíme brát v úvahu všechna ložisková postižení bílé hmoty mozku. Nejčastěji to je roztroušená skleróza s odlišnou lokalizací ložisek a jejich diseminací v čase i prostoru (12–15), dále neuroinfekce, či jiná systémová onemocnění včetně vaskulitid (16) a prosté postischemické a hypertenzní změny (17), které přibývají s rostoucím věkem nemocných.
Četné volumetrické studie z posledních let jsou publikovány zejména u pacientů s roztroušenou sklerózou (18–20) a jsou vhodné k detekci časných změn ložisek v mozku při diagnostice a hodnocení průběhu léčby. U pacientů s epilepsií se měří objem amygdaly a hipokampu (21, 22). Volumetrické studie se provádí i u pacientů s Alzheimerovou či jinou demencí (23, 24).
V současné době se této problematice u SLE pacientů věnuje řada studií, které se zabývají stanovením celkového rozsahu postižení mozku pomocí volumetrických metod. Bosma (25, 26) ve svých pracích užívá metodu magnetizačního transferu (MTI). Ainiala v roce 2005 uveřejnil obdobnou práci, která u 43 pacientů se SLE s i bez NP projevů porovnávala rozsah mozkové atrofie a objem lézí v T1 i T2 vážených obrazech. Všechny sledované parametry byly statisticky vyšší u nemocných se SLE oproti zdravým kontrolám, zvláště potom u NPSLE (27).
Cílem naší studie bylo určit předně celkový objem patologických ložisek u nemocných se SLE. Dále zjistit, zda existuje závislost objemu patologických ložisek mozku na věku vyšetřovaných, na aktivitě onemocnění vyjádřené indexem SLEDAI (28), na době trvání onemocnění a době od výskytu prvních neuropsychiatrických projevů.
Pacienti a metodika
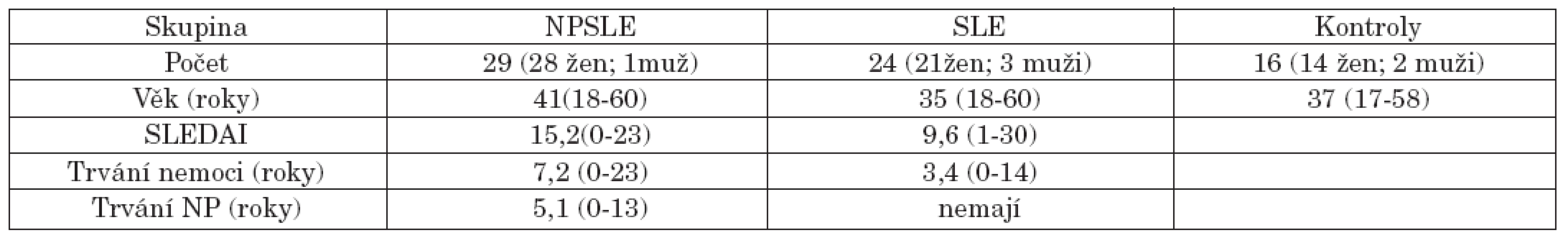
Celkem bylo vyšetřeno 53 nemocných, kteří splnili upravená kritéria pro stanovení diagnózy SLE z roku 1997 (29) z klinické databáze nemocných se SLE v Revmatologickém ústavu v Praze. 29 z nich prodělalo některou z neuropsychiatrických manifestací (NPSLE 54,7 %) dle kritérií Americké revmatologické společnosti z roku 1999 (3) a 24 nemocných (45,3 %) bylo bez jakékoliv neuropsychiatrické manifestace. Stejným způsobem bylo vyšetřeno 16 zdravých kontrol odpovídajících pohlavím i věkem, bez současně probíhajícího či v minulosti prodělaného neuropsychiatrického a systémového onemocnění či bez výskytu cirkulujících specifických autoprotilátek. Nemocní s překryvnými syndromy jako revmatoidní artritida, smíšené onemocnění pojiva, Sjögrenův syndrom nebo progresivní systémová skleróza nebyli zařazeni. Celý projekt byl schválen etickou komisí.
Demografická data vyšetřených a údaje o nemoci jsou shrnuty v tabulce 1.
Klinické vyšetření proběhlo u každého nemocného ve shodě s ACR doporučeními (3). Ve sloupcovém grafu (graf 1) je patrný výskyt jednotlivých neuropsychiatrických projevů u NPSLE nemocných.
Graf 1. Neuropsychiatrické projevy u NPSLE (n=29). 
Vybraní nemocní v obou skupinách měli aktivní (SLEDAI < 10) i neaktivní (SLEDAI < 10) formu onemocnění a podle délky trvání onemocnění buď akutní (do půl roku), nebo chronickou formu (více než půl roku) v době MR vyšetření.
U každého vyšetřeného bylo provedeno vyšetření mozku magnetickou rezonancí Gyroscan NT 1,5T firmy Philips Radiodiagnostické kliniky 1. lékařské fakulty Univerzity Karlovy. Použita byla standardní cirkulární polarizační hlavová cívka. Vyšetřovací protokol zahrnoval sagitální T1 i T2 vážené obrazy, sekvenci FLAIR tenkými 1,5mm řezy v transverzálních i 3mm v sagitálních rovinách.
Výsledky byly hodnoceny poloautomaticky v sekvenci FLAIR pomocí počítačového programu Scanview, který pracuje s chybou 1–5 % a dovoluje rozlišení lézí minimální velikosti 1mm3 (30). Počítačový program umožňuje vytvoření z tenkých řezů o šířce 1,5mm silnější řezy o šířce 6mm, na kterých jsou lépe rozlišitelná a zobrazitelná ložiska. Při hodnocení se nejprve odstraní signál tuku v oblasti podkoží a dřeně kalvy a vytvoří se segmenty mozkové tkáně, tak aby se odstranil signál kalcifikací, mozkových plen i likvoru. Tím jedinými hyperintenzními lézemi zůstanou pouze patologická ložiska v mozkové tkáni, tzv. region of interest (ROI), jež vyšetřující obtáhne kurzorem. Po aplikaci filtrů (smooth, Gauss) se musí velmi přesně vyrovnat průměrný signál bílé mozkové hmoty k nucleus caudatum. Jehož signál je považován za téměř konstantní na určitou hodnotu, tím se odstraní změny způsobené náhodnými chybami. Pro tyto účely se používá při hodnocení objemu lézí termín „lesion load“ (30).
V době vyšetření jsme také u nemocných porovnávali výskyt antifosfolipidových autoprotilátek, tzv. antikardiolipinových ve třídě IgG a IgM (aCL IgG a IgM), lupusového antikoagulans (LA) a protilátky proti β2-glykoproteinu I (β2-GPI IgG a IgM). Stanovení aktivity LA bylo provedeno podle pravidel Mezinárodní společnosti pro trombózu a hemostázu (International Society on Thrombosis and Haemostasis) (31). Antikardiolipinové autoprotilátky a autoprotilátky proti ß2-glycoproteinu I byly detekovány komerčně dostupnými testy metodou ELISA (enzyme-linked immunosorbent assay, Orgentex, Germany). Stanovení diagnózy antifosfolipidového syndromu (APS) bylo provedeno podle klasifikačních kritérií navržených na mezinárodním kongresu v Sapporu, Japonsko (32). U obou skupin nemocných jsme porovnávali výskyt rizikových faktorů pro akcelerovanou aterosklerózu, např. arteriální hypertenze, kardiovaskulární onemocnění, dyslipidémie, diabetes mellitus, kouření a obezita (body mass indexem BMI > 30).
Veškeré statistické testy byly aplikovány na celý soubor primárních dat bez předchozího vylučování hodnot a pacientů. Hodnota p < 0,05 je považována za statisticky významnou ve všech použitých testech. Ke statistickému zpracování výsledků byla použita analýza rozptylu (ANOVA) a Kruskal-Wallisův neparemetrický test pro testování kvantitativních parametrů mezi více než dvěma soubory. T test s Bonferroniho korekcí a Mann-Whitney test pro testování shody průměrů mezi dvěma nezávislými soubory, Spearmanův koeficient korelace, test chí-kvadrát a Fischerův test pro test závislosti kvalitativních parametrů.
Výsledky
Při použití shora uvedené volumetrické metody určující celkový objem patologických ložisek mozku jsme zjistili statisticky významný rozdíl mezi vyšetřovanými v sekvenci FLAIR (p < 0,001). Grafické vyjádření výsledků je znázorněno ve sloupcovém grafu (graf 2). Největší „lesion load“ byl zjištěn u NPSLE nemocných, a to 19,49 ± 27,72 cm3 s velkým rozptylem samotných hodnot (0,26–94,43 cm3). Měření u skupiny nemocných bez klinických NP projevů byl „lesion load“ ∅3,35 ± 5,40 cm3 (rozptyl hodnot 0,01–23,90 cm3), u zdravých kontrol to však byly hodnoty ∅0,69 ± 0,81 cm3 (rozptyl hodnot 0–2,86 cm3). U všech nemocných (NPSLE i bez NP) byla zjištěna korelace celkového objemu lézí s aktivitou onemocnění vyjádřené SLEDAI indexem (p < 0,05). Současně byla zjištěna pozitivní korelace u NPSLE nemocných, kde koreloval „lesion load“ se SLEDAI (p < 0,01) (graf 3). Doba trvání onemocnění též korelovala s celkovou dobou trvání neuropsychiatrických projevů (p < 0,01).
Graf 2. Orgánové postižení u vyšetřených nemocných (n=53) v procentech. 
Graf 3. Porovnání “lesion load” u vyšetřovaných skupin, p < 0,001. 
Pokud jde o věk vyšetřených, trvání nemoci či dobu od výskytu prvních neuropsychiatrických projevů neprokázala se v našem souboru žádná statisticky významná závislost na „lesion load“. Nemocní, kteří prodělali cévní mozkovou příhodou v průběhu onemocnění 8/29 (27,6 %), měli statisticky vyšší objem lézí 36,6 oproti 7,8 cm3 (p < 0,05).
Další formy orgánového postižení byly u obou skupin nemocných obdobné (graf 4).
Graf 4. Závislost lesion load na SLEDAI u NPSLE (n=29), p < 0,01. 
Diskuse
Tato studie navazuje na již publikované volumetrické studie u nemocných se SLE (25, 33). V našem souboru jsme vyšetřili celkem 53 SLE nemocných s i bez NP projevů. Výskyt neuropsychiatrických projevů v našem souboru NPSLE pacientů se shoduje s literárně udávanou četností (33–35).
V naší sestavě byl objem patologických ložisek určovaný v sekvenci FLAIR statisticky významně vyšší u NPSLE oproti SLE bez klinických projevů NP a zdravým kontrolám (p < 0,001). V každé skupině byl velký rozptyl mezi výsledky. Dokonce i u zdravých vyšetřených jedinců jsou přítomny drobné změny v bílé hmotě mozku ve 3–4 % bez neuropsychiatrických projevů či onemocnění vysvětlující tento nález (17).
Pozoruhodný je nález patologických ložisek mozku v obraze magnetické rezonance prokazatelných i u SLE nemocných bez dosud vyjádřených klinických NP projevů.
K vysvětlení nadále zůstává, zda se u nich jedná o latentní preklinické postižení NP zjistitelné vysoce senzitivním MR vyšetřením. Stejně nevyjasněná je souvislost patologických ložisek mozku s aktivitou základního onemocnění.
Sibbitt (36) i Chinn (37) ve svých publikacích předpokládají, že pacienti se SLE dosud bez vyjádřeného neuropsychiatrického postižení jsou v průběhu let vystaveni riziku možnosti výskytu některého NP klinického projevu. Tuto hypotézu podporují i naše výsledky. V naší sestavě mají pacienti s NPSLE delší trvání nemoci 7,2 let oproti pacientům bez NP projevů 3,4 let (p < 0,05). A zároveň byla zjištěna ve skupině NPSLE korelace mezi délkou trvání nemoci a dobou od výskytu neuropsychiatrických projevů.
Index SLEDAI, který jsme použili k hodnocení aktivity onemocnění, má vysoké ohodnocení pro každý z neuropsychiatrických projevů – křeče, psychóza, organický psychosyndrom, poruchy visu, kraniální neuropatie, bolesti hlavy a cévní mozková příhoda (28). Z tohoto důvodu někteří vysoce klinicky aktivní pacienti se SLE bez NP měli nižší hodnotu indexu SLEDAI než téměř neaktivní pacienti s NPSLE.
Námi provedené měření prokázalo pozitivní korelaci „lesion load“ se SLEDAI ve skupině všech SLE (p < 0,05) i ve skupině NPSLE (p < 0,01) (graf 3). Tyto výsledky jsou ve shodě s prací Taccariho (39). Ten ve své práci u 21 SLE nemocných zjistil korelaci patologických ložisek mozku s indexy aktivity ECLAM (European Consensus Lupus Activity Measure) i SLEDAI. Ačkoliv se neprokázala korelace na klinických znacích ani na specifické autoprotilátkové aktivitě. MR ložiska byla přítomna nejen u pacientů s NPSLE, ale i bez NP s vysokým indexem aktivity (38).
Naproti tomu Ainiala a spol. (27) nezjistil korelaci mozkové atrofie i „lesion load“ na aktivitě onemocnění vyjádřeném ECLAM. Rozporné výsledky prací jsou dány jednak omezenými počty vyšetřených v publikovaných souborech a dále možností výběru rozdílného indexu k hodnocení aktivity onemocnění.
Podobně jako v práci Bosmy (26) jsme neprokázali žádnou závislost volumetrických parametrů mozkového postižení u pacientů se SLE na věku vyšetřených v době vyšetření ani na celkové době trvání lupusového onemocnění, ale ani na době od výskytu prvních neuropsychiatrických projevů.
Námi zjištěná pozitivní závislost mezi délkou trvání lupusové nemoci a dobou od výskytu prvních neuropsychiatrických projevů (p < 0,01) by mohla znamenat, že v průběhu onemocnění u SLE pacientů postupně může kdykoliv dojít k některé NP manifestaci. Tuto hypotézu podporuje i námi zjištěné delší trvání nemoci u NPSLE nemocných oproti nemocným se SLE bez NP. Dosud však nejsou známy žádné predikční okolnosti, které by nás varovaly před rozvojem klinických NP projevů u ohrožených nemocných.
Námi zjištěný větší objem lézí u nemocných, kteří prodělali CMP (8/29–27,6 %), se shoduje s výsledky finské volumetrické studie (27). Ta popisuje větší objem lézí v T2 váženém obraze u pacientů s cerebrovaskulárním postižením v rámci NPSLE. Vyšší věk pacientů s prodělaným iktem podporuje představu o akcelerované aterogenezi u pacientů v průběhu SLE (39).
Závěr
Naše komplexní studie je jedna z mála volumetrických prací v Evropě u pacientů se systémovým lupus erythematodes ve srovnání s referenční skupinou odpovídající pohlavím i věkem. Výsledky našeho pozorování u nemocných se SLE se shodují se stávajícími literárními údaji. Oproti minulým starším pracím jsme zjistili korelaci „lesion load“ na aktivitě onemocnění vyjádřené indexem SLEDAI u nemocných se SLE. Největší celkový objem patologických ložisek v obraze magnetické rezonance byl ve skupině pacientů s neuropsychiatrickým lupusem, zvláště u těch, kteří prodělali cévní mozkovou příhodu. Výskyt NP projevů u SLE vyšetřených nemocných byl pozitivně závislý na délce trvání lupusové nemoci.
Dosud není známo, jakým patofyziologickým mechanismem dochází k postižení mozku u nemocných se SLE. Vzhledem k těžké přístupnosti mozkové tkáně přímému vyšetření jsou naše znalosti o vlastním mechanismu postižení velmi omezené, proto nastupuje význam nepřímých zobrazovacích metod. Z nich pak MR volumetrie, téměř stejně časově náročná jako standardní vyšetření, je přínosná k posouzení míry postižení mozku a mohla by mít v budoucnu význam k longitudinálnímu sledování a hodnocení účinku léčby. Další studie zabývající se problematikou postižení CNS v rámci SLE jsou žádoucí, aby poskytly informaci nejen o patogenezi postižení, ale zároveň aby doporučily nejlepší metody k diagnostikování NPSLE.
Práce vychází z grantového projektu Ministerstva zdravotnictví České republiky Interní grantové agentury NR8459-3.
MUDr. Lucie Podrazilová
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: lucie.linkova@seznam.cz
Zdroje
1. West SG. Neuropsychiatric lupus. Rheum Dis Clin North Am 1994; 20 : 129-158.
2. Sibbitt WL Jr, Brandt JR, Johnson CR, et al. The incidence and prevalence of neuropsychiatric syndromes in pediatric onset systemic lupus erythematosus. J Rheumatol 2002; 29 : 1536–1542.
3. ACR Ad hoc Committee on Neuropsychiatric Lupus Nomenclature: The American College of Rheumatology Nomenclature and Case Definitions for Neuropsychiatric Syndromes. Arthritis Rheum 1999; 42 : 1649–1652.
4. Wolf J, Niedermaier A, Bergner R, Lowitzsch K. Zerabrale vaskulitis als Erstmanifestation eines systemischen Lupus erythematodes. Dtsch Med Wschr 2001; 126 : 947–950.
5. Sewell KL, Livneh A, Aranow CB, Grayze AI. Magnetic resonance imaging versus computed tomographic scanning in neuropsychiatric systemic lupus erythematosus. Am J Med 1989; 86(5): 625–626.
6. Sibbitt WL Jr, Sibbitt RR, Grifey RH, Eckel C, Bankhurst AD. Magnetic resonance and computed tomographic imaging in the evaluation of acute neuropsychiatric disease in systemic lupus erytethematosus. Ann Rheum Dis 1989 : 48 : 1014–1022.
7. Sibbitt WL, Schmidt PJ, Blaine LH, Brooks WM. Fluid Attenuated Inversion Recovery (FLAIR) Imaging in Neuropsychiatric Systemic Lupus Erythematosus. J Rheumatol 2003; 30 : 1983–1989.
8. Tourbah A, Deschamps R, Stievenart JL. Magnetic resonance imaging using FLAIR pulse sequence in white matter diseases. J Neuroradiol 1996; 23 : 217–222.
9. Bruyn GA. Controversies in lupus: nervous systém involvement. Ann Rheum Dis 1995; 54 : 159–167. Ed. Mosby 1999; USA 1255–1274.
10. Jarek MJ, West SG, Baker MR, Rak KM. Magnetic resonance imaging in systemic lupus erythematosus patients without a history of neuropsychiatric lupus erythematosus. Arthritis Rheum 1994; 37 : 1609–1613.
11. Sanna G, Piga M, Terryberry JW, Peltz MT, Giagheddu S, Satta L. Central nervous system involvement in systemic lupus erythematosus: cerebral imaging and serological profile in patients with and without overt neuropsychiatric manifestations. Lupus 2000; 9 : 573–583.
12. Ferreira S, Cruz DPD, Hughes GRV. Multiple sclerosis, neuropsychiatric lupus and antiphospholipid syndrom: where do we stand? Rheumatology 2005; 44 : 434–442.
13. Mc Donald WI, Compston A, Edan G, et al. Recommeded Criteria for multiple sclerosis: guidelines from International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001; 50 : 121–127.
14. Peterová V, Dostál C, Linková L, et al. The distribution of MR lesions in neuropsychiatrc lupus erythematosus and multiple sclerosis patients. Riv Neuroradiol 2003;16 : 788–91.
15. Traboulsee AL, Li DK. The role of MRI in the diagnosis of multiple sclerosis. Adv Neurol 2006; 98 : 125–146.
16. Rovaris M, Inglese M, Viti B, Ciboddo G. The contribution of fast FLAIR MRI for lesion detection in the brain of patients with systemic autoimmune disease. J Neurol 2000; 2347 : 29–33.
17. Jensen MC. Brant-Zawadski MN, Jacobs BC. Ischemiea. In Mosby (Eds.): Magnetic resonance imaging of the brain and spine. USA 1999 : 1255–1274.
18. Lee MA, Smith S, Palace J, et al. Spatial mapping of T2 and gadolinium-enhancing T1 lesion volumes in multiple sclerosis: evidence for distinct mechanisms of lesion genesis. Brain 1999; 122 : 1261–1270.
19. Saindane AM, Ge BAY, Udupa JK, Babb JS, Mannon LJ, Grossman RI. The effect of gadolinium-enhancing lesions on whole brain atrophy in relapsing-remitting MS. Neurology 2000; 55 : 61–65.
20. Saiz A, Carreras E, Berenguer J, Yague J, Martinez C. MRI and CSF oligoclonal bands after autologous hematopoetic stem cell transplantation in MS. Neurology 2001; 56 : 1084–1089.
21. Scott RC, Gadian DG, Gross JH, Wood SJ, Neville BGR, Connely A. Quantitative magnetic resonance characterisation of mesial temporal sclerosis in childhood. Neurology 2001; 56 : 1659–1665.
22. Tarkka R, Paakko E, Pyhtinen J, Uhari M, Rantala H. Febrile seizures and mesial temporal sclerosis. Neurology 2003; 60 : 215–218.
23. Callen DJA, Black SE, Gao F, Caldwell CB, Szalain JP. Beyond the hippocampus. MRI volumetry confirms widespread limbic atrophy in AD. Neurology 2001; 57 : 1669–1674.
24. Schocke MFH, Sepp K, Esterhammer R, et al. Diffusion-weighted MRI differentiates the Parkinson variant of multiple system atrophy from PD. Neurology 2002; 58 : 575–580.
25. Bosma GP, Rood MJ, Huizinga TW, de Jong BA, Bollen EL, van Buchem MA. Detection of cerebral involvement i patients with active neuropsychiatric systemic lupus erythematosus by the use of volumetric magnetization transfer imaging. Arthritis Rheum 2000; 43(11): 2428–2436.
26. Bosma GP, Meddelkoop HA, Rood MJ, Bollen EL, Huizinga TW, van Buchem MA. Association of global brain damage and clinical functioning in neuropsychiatric systemic lupus erythematosus. Arthritis Rheum 2002; 46(10): 2665–2672.
27. Ainiala H, Dastidar P, Loukkola J, et al. Cerebral MRI abnormalities and their association with neuropsychiatric manifestations in SLE: a population based study. Scand J Rheumatol 2005; 34 : 376–382.
28. Bombardier C, Gladman DD, Urowitz MB, Caron D, Chang CH and the Committee on Prognosis Studies in SLE: Derivation of the SLEDAI: a disease activity index for lupus patients. Arthritis Rheum 1992; 35 : 630–640.
29. Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997; 40(9): 1725.
30. Vaněčková M, Seidl Z, Krásenský J, et al. Nové trendy v zobrazování magnetickou rezonancí u roztroušené sklerózy mozkomíšní. Technika MR volumometrie vyvinutá a prováděná naším pracovištěm. Čes Radiolog 2002; 56(6): 327–330.
31. Brandt JT, Tripplett DA, Alving B, Scharrer I. Criteria for the diagnosis of lupus anticoagulants: an update. Thromb Heamost 1995; 74 : 1185–90.
32. WilsonWA, Gharavi AE, Koike T, et al. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop. Arthritis Rheum 1999; 42 : 1309–11.
33. Ainiala H, Hietaharju A, Loukkola J, et al. Validity of the new American College of Rheumatology criteria for neuropsychiatric lupus syndromes: a population-based evaluation. Arthritis Rheum 2001; 45 : 419–423.
34. Sanna G, Berolaccini ML, Cuadrado MJ, et al. Neuropsychiatric manifesrations in systemic lupus erythematosus: prevalence and association with antiphospholipid antibodies. J Rheumatol 2003; 30 : 985–992.
35. Hanly JG, McCurdy G, Fougere L, Douglas J-A, Thompson K. Neuropsychiatric events in Systemic Lupus Erythematosus (SLE): attribution and clinical significance. J Rheumatol 2004; 31 (11): 2156–2162.
36. Sibbitt WL Jr, Brooks WM, Haseler LJ, et al. Spin-spin relaxation of brain tissues in systemic lupus erythematosus: a method for increasing the sensitivity of magnetic resonance imaging for neuropsychiatric lupus. Arthritis Rheum 1995; 38 : 810–818.
37. Chinn RJS, Wilkinson ID, Hall-Craggs MA, et al. Magnetic resonance imaging of the brain and cerebral proton spectroscopy in patients with systemic lupus erythematosus. Arthritis Rheum 1997; 40 (I): 36–46.
38. Taccari E, Scavalli AS, Spadaro A, et al. Magnetic resonance imaging (MRI) of the brain in SLE: ECLAM and SLEDAI correlations. Clin Exper Rheum 1994; 12 : 23–28.
39. Bruce IN. Atherogenesis and autoimmune disease: the model of lupus. Lupus 2005; 14 : 687–690.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Ošetření extenzorů zápěstí
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2008 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Kohortová studie u ankylozující spondylitidy v regionu střední Evropy: aktivita nemoci, způsoby léčby a možnosti uplatnění biologické léčby
- Ošetření extenzorů zápěstí
- Výsledky volumetrického měření patologických ložisek mozku u nemocných se systémovým lupus erythematodes
- Možnosti ochrany reprodukčních funkcí žen a mužů podstupujících léčbu cytotoxickými léky
- Skórovací systémy při hodnocení progrese revmatoidní artritidy
- Wegenerova granulomatóza s trombotickou trombopenickou purpurou – neurologické projevy
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ošetření extenzorů zápěstí
- Wegenerova granulomatóza s trombotickou trombopenickou purpurou – neurologické projevy
- Skórovací systémy při hodnocení progrese revmatoidní artritidy
- Výsledky volumetrického měření patologických ložisek mozku u nemocných se systémovým lupus erythematodes
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání