-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCharakteristika české kohorty pacientů s familiární dysbetalipoproteinemií a zhodnocení využitelnosti diagnostických algoritmů v klinické praxi
Characteristics of the Czech cohort of patients with familial dysbetalipoproteinemia and evaluation of the applicability of diagnostic algorithms in clinical practice
Familial dysbetalipoproteinemia (FD) is not only a very atherogenic dyslipidemia (DLP) that leads to premature atherosclerosis (both coronary and peripheral), but may also be a potential risk factor for development of acute pancreatitis (in patient with very high triglyceride levels). In the Czech Republic, up to 10,000 patients with this diagnosis can be expected, unfortunately their detection is very low. FD must always be considered in patients with heavier mixed DLP (total cholesterol (T-C) > 5 mmol/L, TG > 3 mmol/L), in whom the T-C/TG ratio is approximately 2(1) : 1. Patients suitable for further, especially genetic, testing can be selected using a number of diagnostic algorithms; according to our results, the ratio of nonHDL-cholesterol/apolipoprotein B (nonHDL-C/apoB) > 5 mmol/g seems to be the most suitable. Definitive diagnosis can be made by apolipoprotein E genotyping, more rarely by lipoprotein ultracentrifugation or polyacrylamide gradient electrophoresis. Treatment is based on consistent regimen measures; the pharmacotherapy of choice is the combination of a statin plus fibrate. The aim of our work is to characterize the Czech cohort of patients with FD, describing their laboratory findings, the occurrence of comorbidities or treatment regimens, and then to evaluate the usability of literature-described diagnostic algorithms in patients with FD.
Keywords:
statin – fenofibrate – cardiovascular disease – cardiovascular risk – familial dysbetalipoproteinemia
Autoři: Martin Šatný 1; Tereza Altschmiedová 1; Veronika Todorovová 1; Ondřej Kyselák 2,3; Vladimír Soška 2,3; Michal Vrablík 1
Působiště autorů: III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze 1; Oddělení klinické biochemie FN U sv. Anny v Brně 2; II. interní klinika LF MU a FN U sv. Anny v Brně 3
Vyšlo v časopise: AtheroRev 2022; 7(2): 91-99
Kategorie: Přehledové práce
Souhrn
Familiární dysbetalipoproteinemie (FD) představuje nejen velmi aterogenní dyslipidemii (DLP), která vede k předčasné manifestaci aterosklerózy (jak koronární, tak periferní), ale může být, zvláště u pacientů, kteří mají velmi vysoké hodnoty triglyceridů (TG), také možným rizikovým faktorem rozvoje akutní pankreatitidy. Dá se předpokládat, že v České republice žije až 10 000 pacientů s touto diagnózou, bohužel jejich záchyt je velmi nízký. Na FD musíme pomýšlet vždy u pacientů s těžší smíšenou DLP při hodnotách celkového cholesterolu (T-C) > 5 mmol/l a TG > 3 mmol/l, u kterých je poměr T-C/TG přibližně 2(1) : 1. Pacienty vhodné k dalšímu, zejména genetickému, vyšetření lze vybrat pomocí řady diagnostických algoritmů; dle našich výsledků se nejvhodnějším jeví poměr nonHDL-cholesterolu/apolipoproteinu B (nonHDL-C/apoB) > 5 mmol/g. Definitivní diagnóza může být stanovena pomocí genotypizace apolipoproteinu E, vzácněji ultracentrifugací lipoproteinů nebo polyakrylamidovou gradientní elektroforézou. Základem léčby jsou důsledná režimová opatření, farmakoterapií volby pak kombinace statinu s fibrátem. Cílem naší práce je charakteristika české kohorty pacientů s FD popisující jejich laboratorní nálezy, výskyt komorbidit a léčebná schémata a dále pak zhodnocení využitelnosti literárně popsaných diagnostických algoritmů u pacientů s FD.
Klíčová slova:
statin – kardiovaskulární onemocnění – fenofibrát – kardiovaskulární riziko – familiární dysbetalipoproteinemie
Úvod – charakteristika familiární dysbetalipoproteinemie
Kardiovaskulární onemocnění (KVO), zejména podmíněná aterosklerózou (ASKVO), představují i přes veškeré léčebně preventivní snahy jednu z hlavních příčin morbidity a mortality ve většině zemí. V ČR se podílela na standardizované úmrtnosti takřka poloviny populace [1]. ASKVO jsou determinována řadou (ne)ovlivnitelných rizikových faktorů. Jediným kauzálním rizikovým faktorem byl však určen cholesterol v aterogenních lipoproteinech, a to zejména ten nesený LDL-částicemi [2]. V souvislosti s geneticky determinovanými dyslipidemiemi (DLP) se nejčastěji hovoří o familiární hypercholesterolemii (FH), jakožto nejčastější monogenně dědičné poruše metabolizmu lipidů a lipoproteinových částic. Avšak nesmí být opomenuta ani relativně častá, ale velmi málo diagnostikovaná familiární dysbetalipoproteinemie (FD). FD je autosomálně recesivně (AR; vzácněji dominantně) dědičnou poruchou metabolizmu lipidů a lipoproteinových částic, která je podmíněna polymorfizmem v genu pro apolipoprotein E (APOE) [3]. Díky abnormalitám apolipoproteinu E (apoE) dochází k narušení clearance na triglyceridy (TG) bohatých (včetně remnantních) částic, které se tak podílejí nejen na akceleraci aterosklerotického cévního postižení, ale také na možném vzniku akutních pankreatitid [4].
Gen APOE (lokalizovaný na 19. chromozomu) se vyskytuje ve 3 alelách (E2, E3, E4), přičemž alela E3 je v běžné populaci nejčastější (77–82 %), následována alelou E4 (11–15 %) a alelou E2 (7–8 %). Kombinací výše popsaných alel vzniká 6 možných alelických párů – 3 homozygotní, 3 heterozygotní. Ve většině případů je FD asociována s typickým genotypem APOE2/E2 (90 %) [4,5].
K manifestaci FD však dochází pouze u 5–15 % pacientů s APOE2/E2, protože pro manifestaci FD je většinou nutná přítomnost dalších agravujících metabolických či dosud jasně nepopsaných genetických faktorů (tab. 1) [1,6]. Kromě výše popsaného autosomálně recesivního přenosu onemocnění je až 10 % případů FD způsobeno autosomálně dominantní mutací v genu APOE [5].
Tab. 1. Faktory asociované s manifestací dyslipidemie u pacientů s APOE2/E2 familiární dysbetalipoproteinemií. Upraveno dle [30] ![Faktory asociované s manifestací dyslipidemie u pacientů s APOE2/E2 familiární dysbetalipoproteinemií.
Upraveno dle [30]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/04684ff019eaab754b447167ca03de36.jpg)
DM – diabetes mellitus HL – hepatální lipáza LPL – lipoproteinová lipáza APOC3 – apolipoprotein C3 APOA5 – apolipoprotein A5 Apolipoprotein E je součástí většiny plazmatických lipoproteinů včetně malé subpopulace LDL-částic a slouží jako ligand LDL-receptorů (LDL-R) nebo heparansulfát-proteoglykanů (plní funkci „receptorů“ – HSPG-R). V játrech je tak zapojen do clearance částic bohatých na TG (VLDL-částice, chylomikrony) včetně remnantních (zbytky VLDL-částic, IDL-částice, zbytky chylomikronů) [7–9]. Jednotlivé genotypy apoE se však váží k výše uvedeným receptorům s různou afinitou, přitom právě genotyp APOE2/E2 vykazuje afinitu menší než 2% ve srovnání s nejběžnějším genotypem APOE3/E3 [10]. Proto se předpokládá, že u pacientů s FD hraje nejzásadnější roli clearance částic bohatých na TG přes HSPG-R [4].
Typickým fenotypem FD je smíšená DLP, podmíněná akumulací na TG bohatých (remnantních) částic (zejména remnantů VLDL-částic a chylomikronů). Uvádí se, že pokud je poměr celkového cholesterolu (T-C) ke triglyceridům (TG) – T-C/TG 2(1) : 1, měli bychom pomýšlet na možnou FD [4].
Prevalence FD se různí dle definice tohoto onemocnění. Dle posledních dostupných zdrojů (za předpokladu, že je brána v potaz i autosomálně dominantní dědičná forma) se udává prevalence 0,12–2 % [4,11]. Předpokládá se tedy, že v ČR žije přibližně 10 000 pacientů s touto diagnózou. Záchyt pacientů je relativně nízký, dle literárních pramenů pouze 25% [4].
Klinické známky FD jsou vzácné, avšak pokud se objeví, mohou být patognomické. Pro FD jsou typické xantomy v palmárních záhybech (xantoma palmare striatum); vzácněji pak nacházíme xantomy šlachové, tuberózní, eruptivní, tuberoeruptivní, či dokonce květákovité [12–14].
Většina pacientů s FD je dlouhou dobu zcela asymptomatická a primomanifestací toho onemocnění může být až předčasný výskyt ASKVO nebo akutní pankreatitidy, jakožto možné komplikace hypertriglyceridemie (HTG) [15]. Závěry studií zabývajících se vztahem FD a ASKVO se značně různí. Dle studií případů a kontrol mohou mít jedinci s FD až 10násobně vyšší riziko předčasné manifestace aterosklerózy, a to jak koronární, tak periferní [4]. Dále byl popsán lineární vztah mezi genotypem apoE, hladinou LDL-cholesterolu (LDL-C) a rizikem rozvoje ASKVO, přičemž platí: APOE2/E2 > APOE2/ E3 > APOE2/E4 > APOE3/E3 > APOE3/E4 > APOE4/E4 [12].
Zlatý standard diagnostiky FD představuje ultracentrifugace lipoproteinů, díky které lze stanovit na cholesterol bohaté VLDL-částice. FD je pak definována poměrem VLDL-C/TG > 0,3 [16,17]. Užitečnou a spolehlivou alternativou ultracentrifugace je polyakrylamidová gradientní gelová elektroforéza (PGGE) separující lipoproteiny dle jejich elektrického náboje a velikosti. Pro svou náročnost jsou však v klinické praxi obě modality využívány zcela okrajově [4]. Z pohledu klinika je zcela zásadní výběr pacientů vhodných k dalšímu vyšetření. Prvním vodítkem k zamyšlení nad možnou diagnózou FD by měla být situace, při které přichází pacient se smíšenou DLP, u nějž je poměr mezi T-C/TG 2(1) : 1 (za podmínek T-C > 5 mmol/l, TG > 3 mmol/l) [4]. Při vyslovení podezření na FD lze využít diagnostických kritérií, jež mohou pomoci vybrat vhodné kandidáty k dalšímu (zejména genetickému) testování. K hojně užívaným kritériím patří poměr apoB/T-C < 0,15 g/mmol (senzitivita 89%, specificita 97%) nebo tzv. apoB algoritmus definující FD jako apoB < 1,2 g/l, TG > 2,3 mmol/l, TG/apoB < 10 a T-C/apoB > 6,2 (senzitivita 93%, specificita 99%) [18]. Srovnatelnou senzitivitu a specificitu má také poměr nonHDL-C/apoB, přitom je jako cut-off stanovena hodnota > 5 mmol/g [19]. Druhou část diagnostiky FD zaujímá samozřejmě genotypizace APOE, případně další genové analýzy. Typickým nálezem u pacientů s FD je genotyp APOE2/E2, který lze stanovit izoelektrickou fokusací nebo analýzou DNA. Nepřítomnost recesivního genotypu však diagnózu FD nevylučuje. Je známo, že až 10 % případů FD je autosomálně dominantně dědičných, proto ve velmi suspektních případech provádíme sekvenaci celého genu APOE [20].
Základem léčby jsou důsledná režimová opatření (vhodná dieta – preferenčně diabetická, zanechání kouření a pravidelná pohybová aktivita), eliminace nebo spíše kompenzace případných vyvolávajících metabolických faktorů FD (diabetes mellitus, hypotyreózy atd) [3,4,21]. Pilíř farmakologické léčby tvoří kombinace statinu s fibrátem. Protože u FD nelze změřit ani vypočítat koncentraci LDL-C (výsledky přímého měření i výpočtu LDL-C jsou zavádějící), nemůže být u pacientů s touto diagnózou použit LDL-C ani k monitorování terapie, ani jako cíl terapie. Vždy je třeba se řídit hodnotou nonHDL-C, jehož cílová hodnota je pro osoby ve vysokém KV-riziku < 2,6 mmol/l, resp. ve velmi vysokém riziku < 2,2 mmol/l [3].
Pacienti a metody
Studie byla koncipována jako retrospektivní analýza dat české kohorty pacientů s FD získaných z databáze MEDPED (Make Early Diagnosis Prevent Early Death in MEDical PEDigrees), a to na dvou pracovištích, a to na III. interní klinice – klinice endokrinologie a metabolizmu 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze a ambulance pro poruchy metabolizmu lipidů při Oddělení klinické biochemie Fakultní nemocnice u sv. Anny v Brně. Cílem práce byla charakteristika vyšetřených se zaměřením na jejich laboratorní parametry (jak před zahájením léčby, tak v době jejich nejlepší kompenzace), výskyt komorbidit nebo preklinické aterosklerózy, léčebná schémata a v neposlední řadě také zhodnocení využitelnosti diagnostických algoritmů FD v běžné klinické praxi (jejich výčet je uveden v tab. 2). Diagnóza FD byla stanovena ve většině případů jako přítomnost smíšené DLP u pacientů s genotypem APOE2/ E2 (dále v textu označeni jako „non-definite“), pouze u několika pacientů byla provedena ultracentrifugace lipoproteinů, respektive genotypizace APOE spolu s ultracentrifugací lipoproteinů jako zlatý standard diagnostiky FD (pozn.: tito pacienti byli použiti jako referenční skupina pro hodnocení jednotlivých diagnostických algoritmů, v textu označeni jako „definite“). Cílové hodnoty nonHDL-C vycházely ze Stanoviska České společnosti pro aterosklerózu z roku 2019, tj. pro osoby ve vysokém KV-riziku < 2,6 mmol/l, resp. ve velmi vysokém riziku < 2,2 mmol/l [22].
Tab. 2. Diagnostická kritéria k selekci pacientů se suspektní FD. Upraveno dle [4,18–20] ![Diagnostická kritéria k selekci pacientů
se suspektní FD. Upraveno dle [4,18–20]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/12c0fd9648de9eca6abd61d456509b30.jpg)
apo – apolipoprotein nonHDL-C – nonHDL-cholesterol T-C – Total Cholesterol/celkový cholesterol TG – triglyceridy Data byla získána ze zdravotnické dokumentace během minimálně 2 návštěv (vstupní vyšetření a kontrola v době nejlepší kompenzace) a dále zpracována na dvou výše uvedených pracovištích. Studie byla schválena etickou komisí a pacienti podepisovali s účastí ve studii informovaný souhlas. Data byla analyzována metodami popisné statistiky s využitím t-testu nebo ANOVA.
Definice dílčích rizikových faktorů je sumarizována v tab. 3. Je třeba doplnit, že smíšená DLP u FD byla v rámci naší studie definována jako T-C > 5 mmol/l a TG > 3 mmol/l, přičemž pacienti s těžkou hypertriglyceridemií (TG setrvale a opakovaně > 10 mmol/l) nebyli do sledování zařazeni, jelikož by se u nich mohlo jednat o vzácné monogenně dědičné poruchy metabolizmu lipidů, např. deficit lipoproteinové lipázy nebo jejich kofaktorů.
Tab. 3. Definice dílčích rizikových faktorů 
AH – arteriální hypertenze DLP – dyslipidemiemi DM2T – diabetes mellitus 2. typu RA – rodinná anamnéza U všech vyšetřených byla také vstupně vyloučena možná sekundární etiologie smíšené DLP, tj. mimo jiné hypotyreóza, nefrotický syndrom nebo těžká hepatopatie.
Výsledky
Základní charakteristika
Do analýzy bylo zahrnuto 135 pacientů s FD, přičemž u 123 probandů byla diagnóza stanovena na základě přítomnosti smíšené DLP a typického genotypu APOE2/E2 (non-definite FD), u 12 pak ultracentrifugací lipoproteinů/ultracentrifugací a genotypizací APOE (definite FD). Základní vstupní charakteristika vyšetřené kohorty pacientů s FD je pro přehlednost shrnuta v tab. 4.
Tab. 4. Souhrnná vstupní charakteristika sledované populace s FD 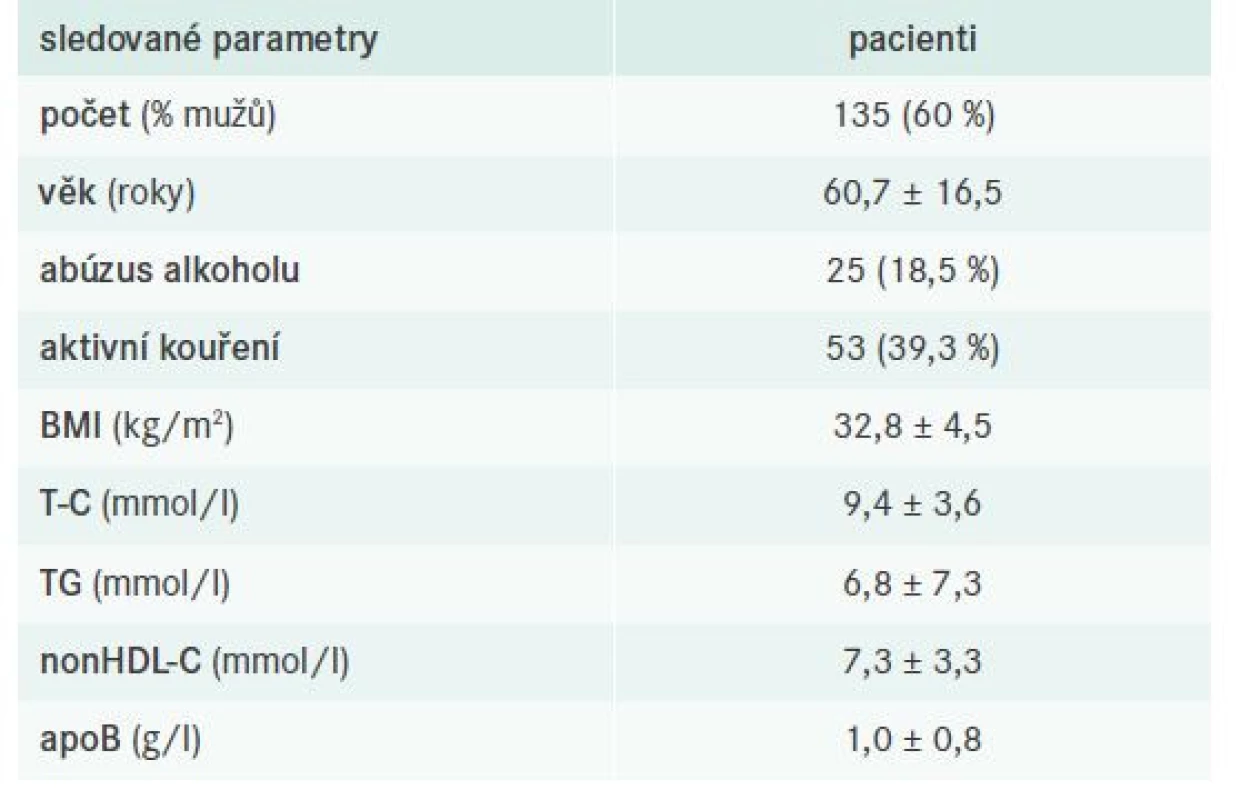
apo– apolipoprotein BMI – Body Mass Index/index tělesné hmotnosti
nonHDL-C – nonHDL-cholesterol T-C – Total Cholesterol/celkový cholesterol TG – triglyceridyKomorbidity
Součástí klinického hodnocení bylo také sledování přítomných komorbidit včetně již manifestních kardiovaskulárních (KV) příhod, tj. ischemické choroby srdeční (ICHS), ischemické choroby dolních končetin (ICHDK) nebo ischemické cévní mozkové příhody (iCMP). U pacientů bez dosud manifestní aterosklerózy byla hodnocena přítomnost preklinické aterosklerózy, tj. přítomnost signifikantních aterosklerotických plátů (zesílení intimomediální tloušťky > 1,5 mm) při duplexní ultrasonografii karotid (tab. 5). Akutní pankreatitida jako možná komplikace těžké smíšené DLP se nevyskytla u žádného ze sledovaných pacientů.
Tab. 5. Charakteristika komorbidit sledované populace s FD 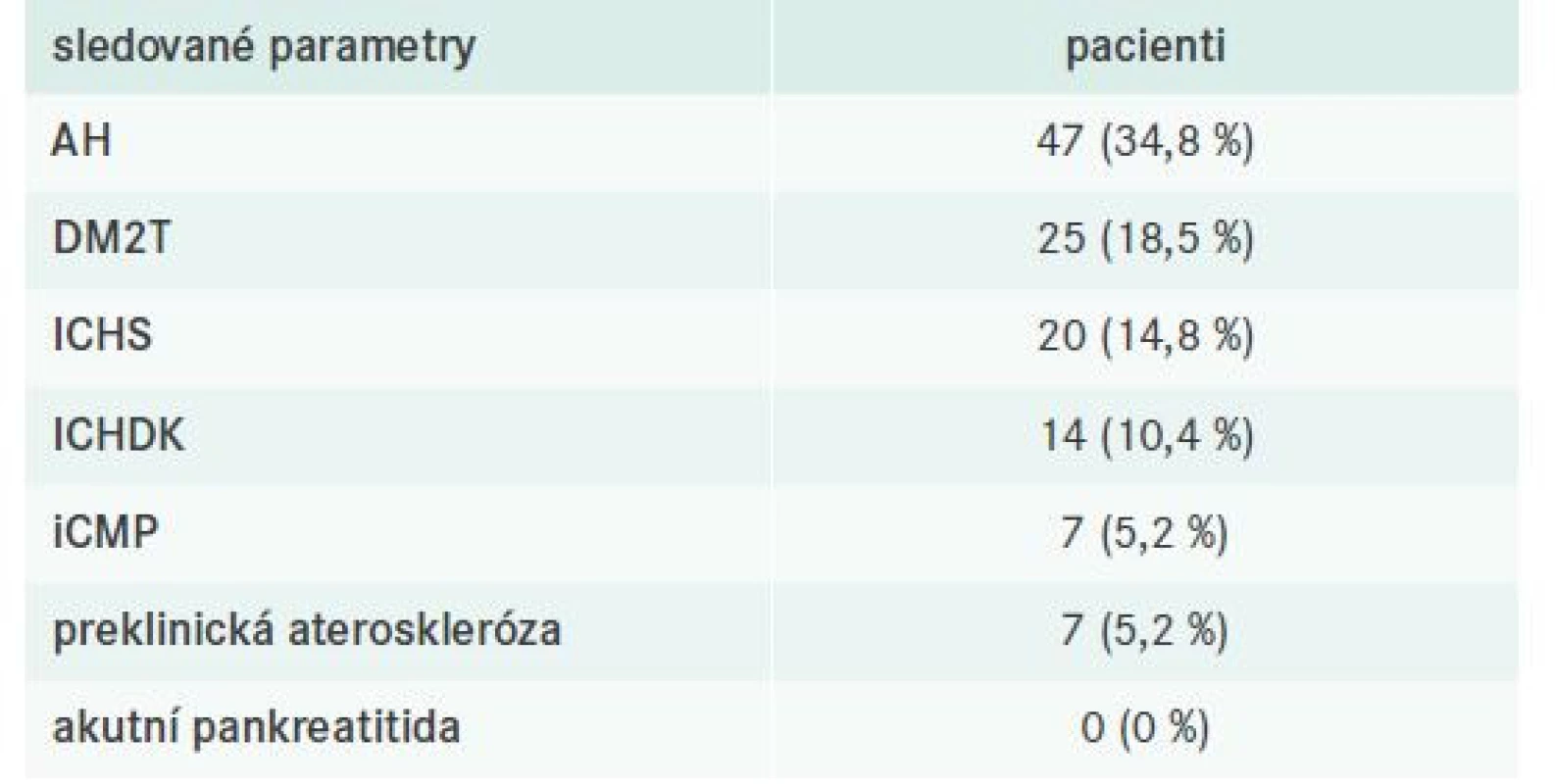
AH – arteriální hypertenze DM2T – diabetes mellitus 2. typu
ICHDK – ischemická choroba dolních končetin ICHS – ischemická choroba srdeční iCMP – ischemická cévní mozková příhodaZhodnocení diagnostických kritérií
Vzhledem k tomu, že studie nezahrnovala apriori referenční skupinu pacientů se smíšenou DLP bez typického genotypu APOE2/E2, byla při hodnocení diagnostických kritérií volena jiná strategie, a sice jejich porovnání v rámci 2 výše uvedených různě diagnostikovaných pacientů s FD (tj. non-definite vs definite FD). Porovnávané algoritmy shrnuje výše uvedená tab. 2. Dle našich pozorování lze konstatovat, že ve shodě s jinými autory, např. Paquette et al [24], se v klinické praxi jeví nejvhodnějším poměr nonHDL-C/apoB (tab. 6).
Tab. 6. Přehled dílčích diagnostických algoritmů 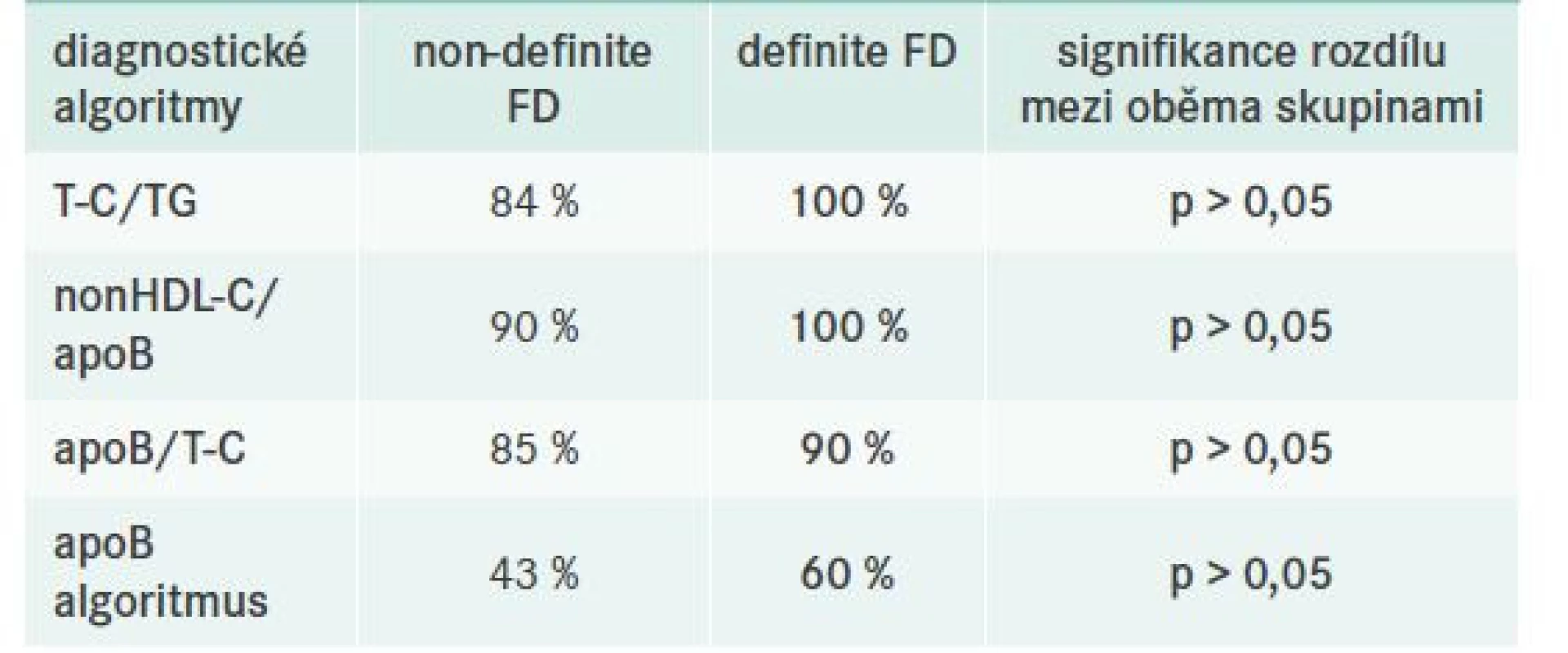
apo – apolipoprotein nonHDL-C – nonHDL-cholesterol T-C – Total Cholesterol/celkový cholesterol TG – triglyceridy Kontrola FD a charakteristika léčebných schémat – obecně
Z celkového počtu 135 vyšetřených bylo při poslední zaznamenané kontrole léčeno 87 z nich (tj. 64,4 %), a to povětšinou zvyklou kombinací statinu s fibrátem (viz dále). Kontrola FD včetně charakteristiky léčebných schémat je pro přehlednost shrnuta v tab. 7–8.
Tab. 7. Kontrola FD při poslední dokumentované kontrole – obecně 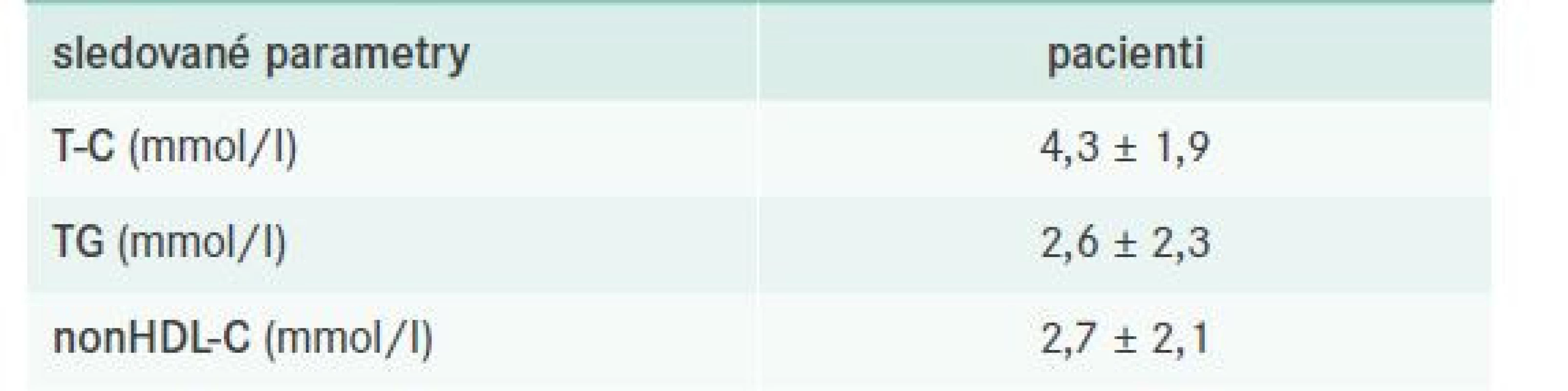
nonHDL-C – nonHDL-cholesterol T-C – Total Cholesterol/celkový cholesterol TG – triglyceridy Tab. 8. Farmakoterapie FD – obecně 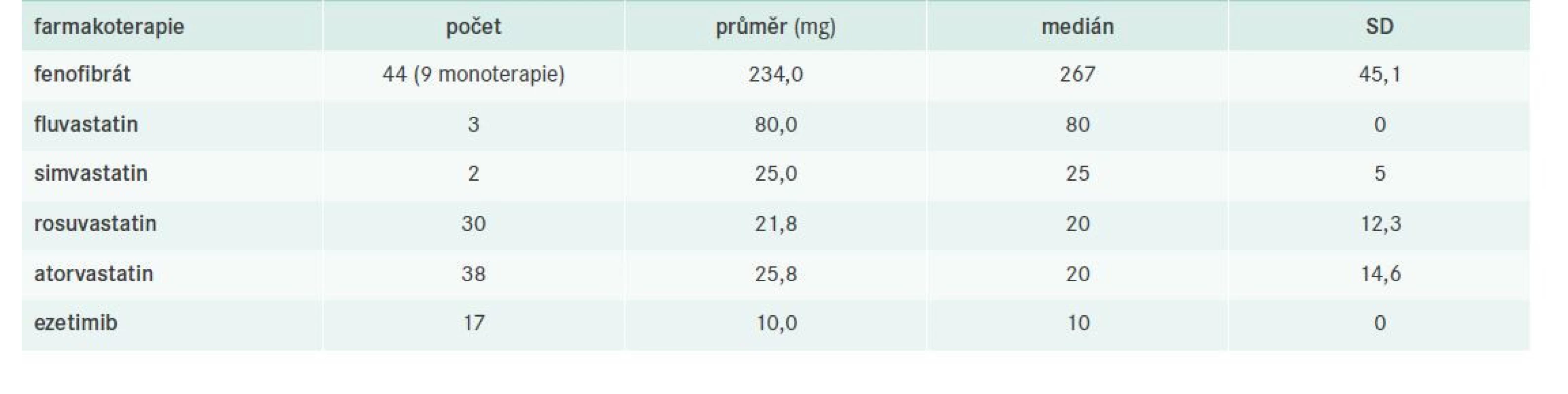
Kontrola FD u pacientů s manifestní koronární aterosklerózou a evaluace jejich farmakoterapie
V celém souboru bylo identifikováno 20 pacientů s ICHS, z toho 16 bylo léčeno a 12 dosahovalo cílových hodnot nonHDL-C. Podrobnější charakteristiku nemocných s již manifestní koronární aterosklerózou včetně evaluace jejich léčby sumarizují tab. 9–10.
Tab. 9. Charakteristika pacientů s ICHS 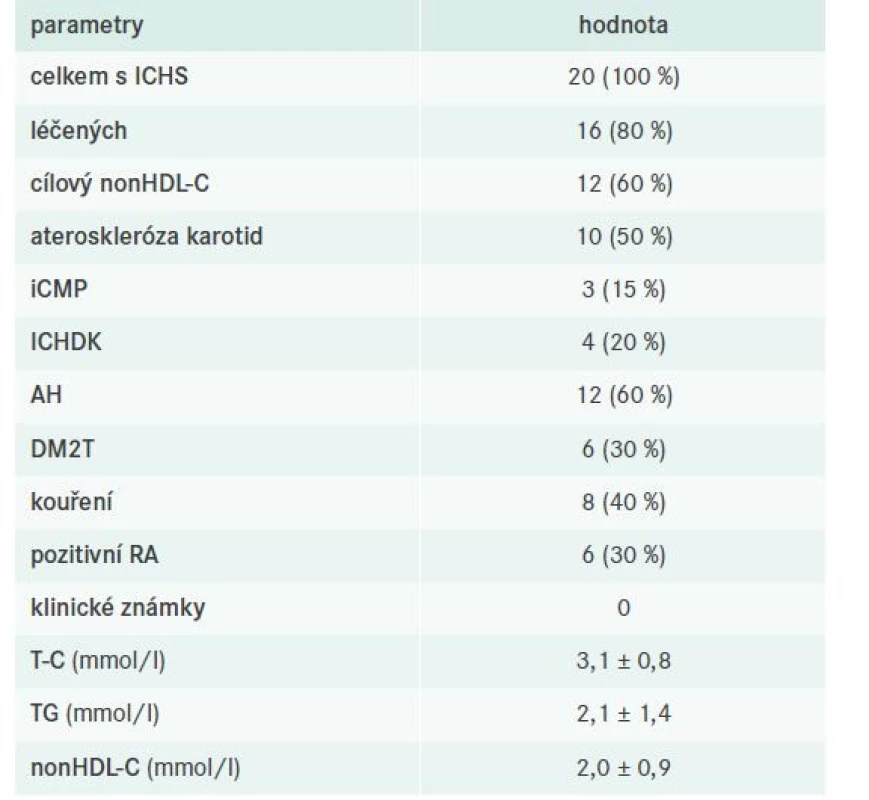
AH – arteriální hypertenze DLP – dyslipidemie ICHDK – ischemická choroba dolních končetin ICHS – ischemická choroba srdeční iCMP – ischemická cévní mozková příhoda DM2T – diabetes mellitus 2. typu
nonHDL-C – nonHDL-cholesterol RA – rodinná anamnéza
T-C – Total Cholesterol/celkový cholesterol TG – triglyceridyTab. 10. Charakteristika farmakoterapie pacientů s ICHS 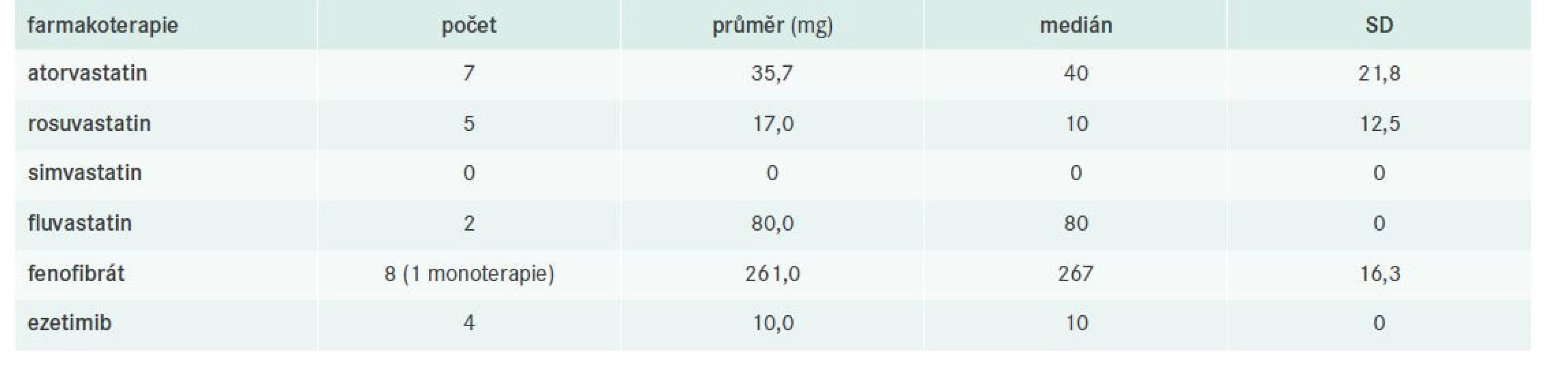
Kontrola FD u pacientů s ICHDK a evaluace jejich farmakoterapie
V našem souboru bylo celkem 14 pacientů s ICHDK, z toho 10 léčených a 5 s cílovým nonHDL-C. Detaily týkající se dílčích komorbidit, laboratorních nálezů a použité farmakoterapie uvádějí tab. 11–12.
Tab. 11. Charakteristika pacientů s ICHDK 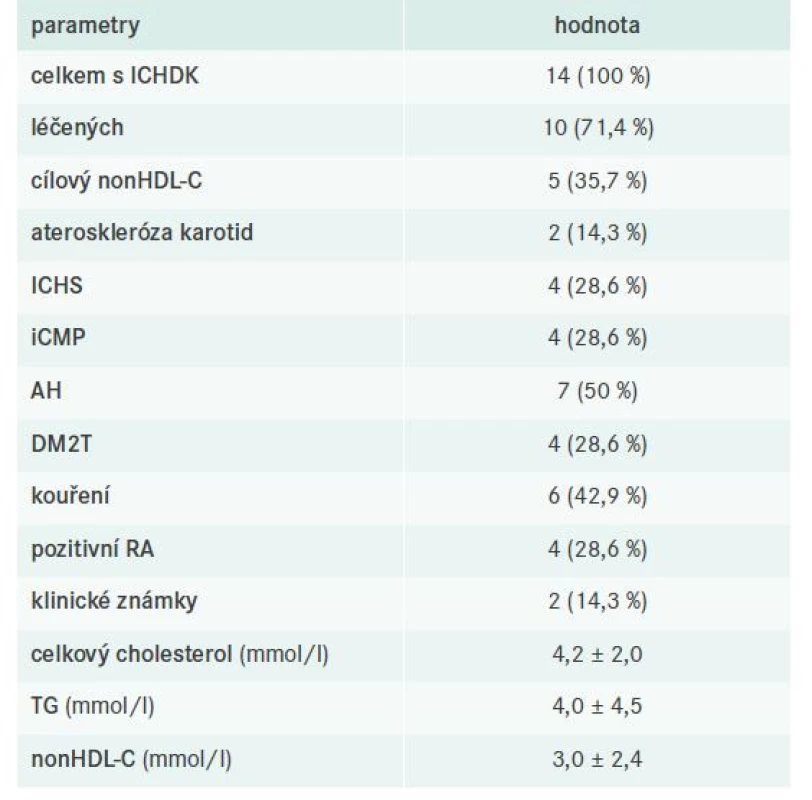
Kontrola FD u pacientů s iCMP a evaluace jejich farmakoterapie
Celkem bylo v souboru dokumentováno 7 pacientů s ischemickou CMP, z nichž 5 bylo léčeno, ale pouze 2 dosahovali cílových hodnot nonHDL-C. Charakteristika dané subpopulace včetně zhodnocení její léčby je shrnuta v tab. 13–14.
Tab.13 Charakteristika pacientů s CMP 
Tab. 14 Charakteristika farmakoterapie pacientů s CMP 
Charakteristika pacientů s aterosklerotickým postižením karotid a evaluace jejich léčby
V souboru bylo zachyceno 7 pacientů s preklinickou aterosklerózou (tj. přítomnost signifikantních plátů při ultrasonografickém vyšetření karotid – viz výše); 6 probandů bylo léčeno, 4 dosahovali cílových hodnot nonHDL-C. Přehledný popis této subpopulace je uveden v tab. 15–16.
Tab. 15 Charakteristika pacientů s preklinickou aterosklerózou 
Tab. 16 Charakteristika farmakoterapie pacientů s preklinickou aterosklerózou 
Diskuse
Studijní populace byla tvořena takřka srovnatelným počtem mužů a žen ve věku 60,5 ± 16,5 let. V souladu s obecně známými kritérii pro diagnózu FD byl poměr průměrných (vstupních) hodnot T-C (9,4 ± 3,6 mmol/l) a TG (6,8 ± 7,3 mmol/l) přibližně 2(1) : 1. Průměrná hodnota BMI byla 32,8 ± 4,5 kg/m2, tj. populace zahrnovala vesměs pacienty s nadváhou nebo obezitou, u nichž mohla sehrát klíčovou roli při manifestaci FD přítomná inzulinová rezistence, která se zdá být klíčovým hráčem v patogenezi FD. Díky inzulinové rezistenci dochází k inhibici clearance na TG bohatých (včetně remnantních) částic přes HSPG-R, kdy se předpokládá, že dochází k aktivaci genu heparansulfát-glukosamin-6-O-endosulfatázy 2 (SULF2), jež podmiňuje degradaci těchto struktur, čímž je zásadně ovlivněna tíže FD [23]. Je tedy zřejmé, že u jedinců s genotypem APOE2/E2 dochází ke kompenzatornímu navýšení clearance remnantních částic cestou HSPG-R (pozn. nikoliv přes LDL-receptory, k jejichž vazbě je zapotřebí apoB100 a apoE), avšak jedná se o děj limitovaný koexistující inzulinoresistencí.
Ve sledované populaci dokumentujeme také třetinu kuřáků a pětinu pacientů s anamnézou abúzu alkoholu. Současně vidíme nejen vysokou prevalenci rizikových faktorů ASKVO – ve sledované kohortě s FD bylo přítomno přibližně 34 % hypertoniků, resp. 20 % diabetiků, ale také vysoké procento (cca 30 %) pacientů s již manifestní aterosklerózou. Analyzováno podrobněji – ICHS se vyskytovala u takřka 14 %, ICHDK 10 % a ischemická CMP 5 % vyšetřených probandů. Solitární signifikantní aterosklerotické postižení karotid pak bylo zaznamenáno pouze u 7 nemocných s FD. Akutní pankreatitida, jakožto možná komplikace těžké smíšené DLP, nebyla diagnostikována u žádného z vyšetřených. Obecně lze shrnout, že v souladu s dříve publikovanými daty pozorujeme ve sledované kohortě pacientů s FD vysokou prevalenci enviromentálních i „hormonálních“ agravujících faktorů rozvoje FD u pacientů s genotypem APOE2/E2 [13,16].
Klinické známky FD, tj. různé formy kožních xantomů, se vyskytovaly sporadicky, a to očekávaně u nejrizikovějších nemocných. Ve shodě s historicky tradovaným faktem tomu bylo nejčastěji u pacientů s ICHDK, jakkoli dle nejnovější literatury není rozdílu ve výskytu kožní projevů FD ve vztahu k lokalizaci cévního postižení [4,16,20].
Zaměříme-li se detailněji na pacienty s již manifestní aterosklerózou, pozorujeme v naší skupině probandů obdobnou prevalenci ASKVO jako v jiné dříve publikované evropské kohortě pacientů s FD (shodně cca 29 %). Nutno však podotknout, že závěry studií zabývající se vztahem FD a ASKVO se značně různí a dosud nebyla publikována jasná data týkající se této problematiky. Studie případů a kontrol uvádějí, že jedinci s FD mají až 10násobně vyšší riziko předčasné manifestace aterosklerózy, a to jak koronární, tak periferní [4]. Zatímco ve sledování 305 evropských pacientů s FD byla prevalence předčasného výskytu ASKVO 29 % a v jiné – africké – kohortě byl výskyt koronárního postižení dokonce u 47 % probandů. Ischemická choroba dolních končetin pak byla diagnostikována u 20 % výše uvedené populace [13,16].
Jedním z cílů námi prezentované práce bylo zhodnocení využitelnosti diagnostických schémat a algoritmů k selekci pacientů se suspektní FD, jež by byli vhodní k dalšímu, zejména genetickému, dalšímu vyšetření. Celkem byla analyzována 4 diagnostická kritéria, u nichž je uváděna velmi vysoká senzitivita a specifita, a to ve srovnání k provedené ultracentrifugaci lipoproteinů – zlatému standardu diagnostiky FD. Zásadní limitací naší práce je fakt, že vzhledem k designu studie nebyla k dispozici vhodná referenční skupina pacientů se smíšenou DLP bez typického genotypu APOE2/E2. Bylo však využito skutečnosti, že část zařazených pacientů měla kromě typického fenotypu a genotypu FD provedenu také ultracentrifugaci lipoproteinů (definite FD). Skupina těchto jedinců pak byla použita jako referenční pro zbylou populaci pacientů s FD (non-definite FD). V tab. 5 jasně vidíme velmi dobrou diskriminační schopnost prostého poměrů T-C/TG. Pokud je tento 2(1) : 1, vždy bychom měli po vyloučení možné sekundární DLP pomýšlet na FD. Z pohledu sofistikovanějších diagnostických kritérií se zdá být nejlepším prediktorem možné FD poměr nonHDL-C/apoB, u nějž se jako cut-off uvádí hodnota > 5 mmol/g. Toto pozorování je zcela v souladu s publikovanými daty autorů Boot et al nebo Paquette et al [19,24]. Zajímavostí je, že v české kohortě vycházel velmi špatně apoB - -algoritmus, jež má dle Koopal et al senzitivitu 93% a specificitu 99% [4]. Jasné vysvětlení této skutečnosti však nemáme.
Všichni vyšetření pacienti byli vstupně edukováni nutriční sestrou o vhodné dietě. Doporučována byla kombinace středomořské diety s diabetickou. Oba dietní režimy disponují slibnými daty z klinických sledování, což nám dokazuje např. Retterstol et al nebo studie PREDIMED [21,25].
Jedna z analýz studie se zabývala farmakoterapií a jejími dopady na hladiny krevní lipidů a lipoproteinových částic. Přibližně čtvrtina vyšetřených pacientů nebyla ani na jedné z dokumentovaných návštěv léčena žádnou medikací, což lze vysvětlit následovně: jednalo se zřejmě o nově diagnostikované pacienty, u nichž se vyčkávalo efektu režimových opatření, případně mohlo jít o subjekty netolerující zvyklou léčbu statin/fibrát. Většinová studijní populace byla správně léčena kombinací statinu s fibrátem, přičemž převažovalo užití moderních potentních statinů (atorvastatinu a rosuvastatinu) v dávce kolem 20 mg denně a fenofibrátu v jeho mikronizované podobě. Léčba statin/fibrát velmi dobře kombinuje pleiotropní účinky obou molekul nejen na metabolizmus lipidů, ale také na řadu imunopatologických aterosklerotických pochodů v cévní stěně. Monoterapie fenofibrátem našla své využití zejména u méně rizikových nemocných, tj. bez manifestní aterosklerózy, u nichž bylo pomýšleno spíše na prevenci těžké HTG a jejich možných konsekvencí. Indikace ezetimibu v této kohortě pacientů byla spíše okrajová. Pacienti byli tedy léčeni zcela v souladu s doporučenými postupy pro léčbu DLP vydanými Evropskou společností pro aterosklerózu (European Atheroslerosis Society – EAS) v roce 2019 [3]. Tyto apelují na povšechnou indikaci statinu u pacientů se smíšenou DLP, přičemž při přetrvávající hypertriglyceridemii > 2,3 mmol/l má být do kombinace přidán fibrát (preferenčně fenofibrát). Další terapeutické ovlivnění TG je přísně individuální a pramení do jisté míry také z možností jednotlivých zemí. Využití PSCK9-inhibitorů (PSCK9i) naráží na úhradové podmínky, protože FD není zařazena mezi jejich indikace. U pacientů s FD s již manifestním ASKVO by sice bylo teoreticky možné PCSK9i indikovat, ale podmínkou pro jejich nasazení je hodnota LDL-C > 2,5 mmol/l při maximální tolerované dávce statinu, avšak jak již bylo uvedeno výše – LDL-C nelze u FD stanovit. Nově bude také na trhu inklisiran – malá interferující RNA proti PCSK9, avšak dosud není stanovena ani jeho úhrada, ani jeho preskripční omezení.
Vhodně titrovanou kombinační léčbou FD bylo docíleno redukce vstupní hladin T-C, TG i primárního léčebného cíle – nonHDL-C o cca 50 %. LDL-C hodnocen nebyl, jelikož jeho hodnoty nelze stanovit, a navíc nekorelují s aterogenním potenciálem FD. Analýza subpopulací s již manifestní aterosklerózou, tj. ICHS, ICHDK nebo CMP, ukazuje uspokojivou kontrolu FD u těchto nemocných. Z observačních studií zabývajících se obecně kontrolou DLP u nejrizikovějších částí populace víme, že pouze necelých 10 % populace dosahuje cílových hodnot lipidových parametrů – tedy LDL-C nebo nonHDL-C (např. série studií EUROASPIRE, Lipi - CONTROL 1,2 či LipitenCliDec 1,2) [26–29].
V kohortě pacientů s již manifestní ICHS dosahovala takřka polovina populace cílových hodnot nonHDL-C, přičemž numericky byla kontrola FD velmi uspokojivá. Jednalo se vesměs o nemocné s kumulací dalších rizikových faktorů jak ASKVO, tak ev. agravace FD, ovšem u žádného nebyly pozorovány klinické známky FD. Léčbu volby samozřejmě představovala kombinace statinu s fibrátem.
Obdobná data jako pro pacienty s ICHS máme také pro pacienty s ICHDK. Diagnóza ICHDK byla stanovena v necelých 11 % případů, z nichž přibližně třetina měla FD dobře kompenzovanou. Klinické známky se vyskytovaly ve 2 případech, což je sice také velmi raritní, avšak zcela v souladu s dříve publikovanými postuláty, které typicky FD charakterizovaly koexistencí palmárních xantomů a predilekčního postižení tepen DK [4,16,20].
Závěr
Familiární dysbetalipoproteinemie představuje nejen aterogenní DLP, ale také možný rizikový faktor rozvoje akutní pankreatitidy (u pacientů, kteří mají velmi vysoké hodnoty TG). V ČR se předpokládá až 10 000 pacientů s touto diagnózou, avšak jejich záchyt je sotva 25%.
Ve sledované kohortě pacientů byla dokumentována nejen vysoká prevalence rizikových faktorů ASKVO a již manifestní aterosklerózy, ale také řada agravujících RF nutných k rozvoji FD. U pacientů byl přítomen typický fenotyp těžší smíšené DLP, která byla správně léčena kombinací statinu s fibrátem. Kombinační léčba pak vedla k dobré kontrole FD až u poloviny sledovaných.
Nejvhodnějším diagnostickým kritériem k selekci pacientů se suspektní FD vhodných k dalšímu (zejména genetickému) vyšetření se dle našich dat jeví poměr nonHDL-C/ apoB.
Poděkování
Na tomto místě bychom rádi poděkovali všem ošetřujícím lékařům, jejichž pacienti byli do našeho sledování zahrnuti.
Výzkum byl podpořen Grantovou agenturou Univerzity Karlovy (projekt č. 70220).
Doručeno do redakce | Doručené do redakcie | Received 18. 5. 2022
Přijato po recenzi | Prijaté po recenzii | Accepted 27. 5. 2022
MUDr. Martin Šatný
www.vfn.cz
Zdroje
1. Zemřelí 2019. Praha: ÚZIS ČR 2020. Dostupné z WWW: <http://www. uzis.cz>.
2. Yusuf S, Hawken S, Ôunpuu S et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. The Lancet 2004; 364(9438): 937–952. Dostupné z DOI: <http://doi: 10.1016/S0140–6736(04)17018–9>.
3. Mach F, Baigent C, Catapano AL et al. ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020; 41(1): 111–188. Dostupné z DOI: <http://doi: 10.1093/eurheartj/ehz455>.
4. Koopal CH, Marais AD, Westerink J et al. Autosomal dominant familial dysbetalipoproteinemia: A pathophysiological framework and practical approach to diagnosis and therapy. Journal of Clinical Lipidology 2017; 11(1): 12–23. Dostupné z DOI: <http://doi: 10.1016/j.jacl.2016.10.001. ISSN19332874>.
5. Zannis VI. Genetic polymorphism in human apolipoprotein E. Methods Enzymol 1986; 128 : 823–851. Dostupné z DOI: <http://doi:10.1016/0076–6879(86)28109–4>.
6. McConnell J, Thiselton D. Familial Dysbetalipoproteinemia. In: USA: Decision Support in Medicine, 2017. Dostupné z WWW: <https://www.pulmonologyadvisor.com/home/decision-support-in-medicine/labmed/familial-dysbetalipoproteinemia/>.
7. Sacks FM. The crucial roles of apolipoproteins E and C-III in apoB lipoprotein metabolism in normolipidemia and hypertriglyceridemia. Curr Opin Lipidol 2015; 26(1): 56–63. Dostupné z DOI: <http://dx.doi.org/10.1097/MOL.0000000000000146>.
8. Ji ZS, Fazio S, Mahley RW. Variable heparan sulfate proteoglykan binding of apolipoprotein E variants may modulate the expression of type III hyperlipoproteinemia. J Biol Chem 1994; 269(18): 13421–13428.
9. Wilsie LC, Gonzales AM, Orlando RA. Syndecan-1 mediates internalization of apoE-VLDL through a low density lipoprotein receptor-related protein (LRP)-independent, non-clathrin-mediated pathway. Lipids Health Dis 2006; 5 : 23. Dostupné z DOI: <http://dx.doi.org/10.1186/1476–511X-5–23>.
10. Siest G, Pillot T, Régis-Bailly A et al. Apolipoprotein E: an important gene and protein to follow in laboratory medicine. Clin Chem 1995; 41(8 Pt):1068–1086.
11. Pallazola VA, Sathiyakumar V, Park J et al. Modern prevalence of dysbetalipoproteinemia (Fredrickson-Levy-Lees type III hyperlipoproteinemia). Arch Med Sci 2020; 16(5): 993–1003. Dostupné z DOI: <http://dx.doi.org/10.5114/aoms.2019.86972>.
12. Blom DJBP, Jones S, Marais AD. Dysbetalipoproteinemia – clinical and pathophysiological features. S Afr Med J 2002; 92(11): 892–897.
13. LaRosa JC, Chambless LE, Criqui MH et al. Patterns of dyslipoproteinemia in selected North American populations. The Lipid Research Clinics Program Prevalence Study. Circulation 1986; 73(1 Pt 2):I12–I29.
14. Naghavi-Behzad M, Aliasgerzadeh A, Ghorbanian M. Familial dysbetalipoproteinaemia presenting with cauliflower xanthoma. Nigerian Medical Journal 2013, 54(4): 268–270. Dostupné z DOI: <http://dx.doi.org/10.4103/0300–1652.119661>.
15. Williams KJ, Chen K. Recent insights into factors affecting remnant lipoprotein uptake. Curr Opin Lipidol 2010 : 21(3): 218–228. Dostupné z DOI: <http://dx.doi.org/10.1097/MOL.0b013e328338cabc>.
16. Fredrickson DS. An international classification of hyperlipidemias and hyperlipoproteinemias. Ann Intern Med 1971; 75(3): 471–472. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–75–3–471>.
17. Beaumont JL, Carlson LA, Cooper GR et al. Classification of hyperlipidaemias and hyperlipoproteinaemias. Bull World Health Organ 1970; 43(6):891–915.
18. Hopkins PN, Brinton EA, Nanjee MN. Hyperlipoproteinemia Type 3: The Forgotten Phenotype. Curr Atheroscler Rep 2014 : 16(9): 440. Dostupné z DOI: <http://dx.doi.org/10.1007/s11883–014–0440–2>.
19. Boot CH, Holmes E, Neely RD. Serum non-HDL cholesterol to apolipoprotein B ratio as a screening test for familial dysbetalipoproteinaemia (Type III hyperlipidaemia) in patients with mixed hyperlipidaemia. Atherosclerosis 2016; 255: P7. Dostupné z DOI: <http://dx.doi.org/10.1016/j.atherosclerosis.2016.09.022>.
20. Koopal CH, Marais AD, Visseren FLJ. Familial dysbetalipoproteinemia. Curr Opin Endocrinol Diabetes Obes 2017; 24(2): 133–139. Dostupné z DOI: <http://dx.doi.org/10.1097/MED.0000000000000316>.
21. Retterstol K, Henning CB, Iversen PO. Improved plasma lipids and body weight in overweight/obese patients with type III hyperlipoproteinemia after 4 weeks on a low glycemic diet. Clin Nutr 2009; 28(2): 213–215. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clnu.2009.01.018>.
22. Vrablík M, Piťha J, Bláha V et al. Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019. Vnitr Lek 2019; 65(12): 743–754. Dostupné z DOI: <http://doi: 10.36290/vnl.2019.131>.
23. Chen K, Liu ML, Schaffer L et al. Type 2 diabetes in mice induces hepatic overexpression of sulfatase 2, a novel factor that suppresses uptake of remnant lipoproteins. Hepatology 2010; 52(6): 1957–1967. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23916>.
24. Paguette M, Bernard S, Blank D et al. A simplified diagnosis algorithm for dysbetalipoproteinemia. J Clin Lipidol 2020; 14(4): 431–437. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacl.2020.06.004>.
25. Estruch R, Eos E, Salas-Salvadó J et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. New England Journal of Medicine 2018; 378: e34. Dostupné z DOI: <http://doi/10.1056/NEJMoa1800389>.
26. Kotseva K, De Backer G, De Bacquer et al. Lifestyle and impact on cardiovascular risk factor control in coronary patients across 27 countries: Results from the European Society of Cardiology ESC-EORP EUROASPIRE V registry. Eur J Prev Cardiol 2019; 26(8): 824–835. Dostupné z DOI: <http://doi: 10.1177/2047487318825350>.
27. Šatný M, Vrablík M, Tůmová E. LIPIcontrol: daří se zlepšovat úroveň kontroly hlavních rizikových faktorů kardiovaskulárních onemocnění v každodenní praxi? Hypertenze a KV prevence 2018; 7(1): 15–21.
28. Šatný M, Vrablík M. LIPIcontrol 2 aneb co se změnilo po 3 letech. AtheroRev 2020; 5(3): 185–190.
29. Šatný M, Vrablík M, Tůmová E et al. Srovnání profilu a léčby pacientů s nekontrolovanou arteriální hypertenzí a/nebo dyslipidemií v péči specialistů a v primární péči v Česku: srovnání výsledků studie LipitenCliDec 1 a LipitenCliDec 2. AtheroRev 2021; 6(3): 154–162.
30. Kei A. Dysbetalipoproteinemia: Two cases report and a diagnostic algorithm. World J Clin Cases. 2015; 3(4): 371–376. Dostupné z DOI: <http://dx.doi.org/10.12998/wjcc.v3.i4.371>.
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospělé
Článek vyšel v časopiseAthero Review
Nejčtenější tento týden
2022 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Agonisty receptorov GLP1 a ateroskleróza
- Tuky v potravinových pyramidách a talířích
- Ako sme na tom s dosahovaním cieľových hladín LDL-cholesterolu na Slovensku u vysokorizikovej populácie: retrospektívna štúdia
- Rešerše zajímavých článků ze zahraniční literatury
- 25. kongres o ateroskleróze – opět virtuální, opět dobrý
- Editorialy
- Deficit lyzosomální kyselé lipázy – diferenciální diagnostika a možnosti léčby v roce 2022
- Rizikové faktory, jejich celoživotní expozice a trajektorie – nový směr v odhadu rizika ASKVO
- Onkologická léčba jako netradiční rizikový faktor aterosklerózy
- Vliv inhibitorů SGLT2 na kardiovaskulární onemocnění
- Přínosy léčby agonisty GLP1-receptorů pro pacienty s kardiovaskulárním onemocněním
- Charakteristika české kohorty pacientů s familiární dysbetalipoproteinemií a zhodnocení využitelnosti diagnostických algoritmů v klinické praxi
- Athero Review
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přínosy léčby agonisty GLP1-receptorů pro pacienty s kardiovaskulárním onemocněním
- Deficit lyzosomální kyselé lipázy – diferenciální diagnostika a možnosti léčby v roce 2022
- Ako sme na tom s dosahovaním cieľových hladín LDL-cholesterolu na Slovensku u vysokorizikovej populácie: retrospektívna štúdia
- Rizikové faktory, jejich celoživotní expozice a trajektorie – nový směr v odhadu rizika ASKVO
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



