-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Porucha kognitivních funkcí a hrozba pandemie demence aneb cesta hypertoniků k nesoběstačnosti
Cognitive impairment and the threat of dementia pandemic or the journey of hypertensive patients to self-care deficit
In the Czech Republic, due to the population aging, the prevalence of cognitive dysfunction is increasing. Researchers estimate that by 2050 the number of patients with dementia in the Czech Republic will more than double. Since dementia cannot be cured, it is important to prevent the cognitive dysfunction development by influencing modifiable risk factors. Arterial hypertension (AH) is one of the main risk factors for the development of cognitive dysfunction and dementia. Elevated blood pressure values in youth are associated with a higher risk of cognitive decline in middle age and with the development of dementia in old age. Blood pressure control in low-risk patients with stage I hypertension reduces the risk of dementia development, including Alzheimer’s disease. Therefore, improving the AH control in the population since younghood will be needed to influence the emerging cognitive dysfunction pandemic.
Keywords:
dementia – prevention – arterial hypertension – cognitive dysfunction – blood pressure control
Autoři: Peter Wohlfahrt
Působiště autorů: Pracoviště preventivní kardiologie, IKEM, Praha
Vyšlo v časopise: Vnitř Lék 2022; 68(8): 532-536
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2022.112Souhrn
V České republice vlivem stárnutí populace dochází k nárůstu prevalence kognitivní dysfunkce. Odhaduje se, že do roku 2050 se počet pacientů s demencí v ČR více než zdvojnásobí. Protože demenci není možné vyléčit, je důležité ovlivněním modifikovatelných rizikových faktorů předcházet rozvoji kognitivní dysfunkce. Arteriální hypertenze (AH) je jedním z hlavních rizikových faktorů rozvoje kognitivní dysfunkce a demence. Zvýšené hodnoty krevního tlaku v mládí jsou spojeny s vyšším rizikem poklesu kognitivních funkcí ve středním věku a rozvojem demence ve stáří. Důsledná kontrola AH u nízkorizikových pacientů s hypertenzí I. stupně snižuje riziko rozvoje demence, a to včetně Alzheimerovy choroby. K ovlivnění nastupující pandemie kognitivní dysfunkce proto bude zapotřebí zlepšit kontrolu AH v populaci již od mládí.
Klíčová slova:
arteriální hypertenze – demence – prevence – kognitivní dysfunkce – kontrola tlaku
Úvod
S prodlužující se průměrnou délkou života dochází k nárůstu počtu osob s kognitivním deficitem v populaci. Lehká kognitivní porucha (MCI – mild cognitive impairment) je mezistupeň mezi normálním stárnutím a demencí. Při MCI dochází k objektivní poruše paměti (amnestická forma), nebo k poruše jiných kognitivních funkcí mimo paměť, kdy je postižena například oblast používání nebo chápání řeči a jazyka, zrakově‑prostorových dovedností, konstrukčních a praktických dovedností, schopnosti plánovat a organizovat složitější činnosti (neamnestická forma). Na rozdíl od demence při MCI nejsou narušeny aktivity denního života. Ve srovnání s osobami s normální kognitivní funkcí je MCI spojena s 3 až 5× vyšším rizikem progrese do demence. V průběhu jednoho roku u 12–20 % osob s MCI dojde k progresi do demence. Vzhledem k možným terapeutickým intervencím, které zabrání progresi do demence, je důležité provádět screening MCI v rizikové populaci. Demence je jedním z hlavních determinant ztráty autonomie v činnostech každodenního života, hlavním důvodem institucionalizace starších lidí a pátou nejčastější příčinou úmrtí ve světě.
Prevalence MCI je ve věkové skupině 60–64 let 6,7 % a stoupá až na 25,2 % ve věkové skupině 80–84 let (1). V současnosti se v ČR léčí s demencí přibližně 140 tisíc osob, z toho 60 % má demenci Alzheimerova typu. Druhým nejčastějším typem je vaskulární demence. Oba uvedené typy se ale často překrývají do smíšené formy demence. Předpokládá se, že v následujících letech prevalence demence v ČR stoupne více než dvojnásobně, s odhadovanou prevalencí v roce 2050 300 tisíc osob. Ve světě každé 3–4 sekundy přibude jeden nový pacient s demencí.
Vzhledem k hrozící pandemii kognitivních poruch je důležité aktivně ovlivňovat modifikovatelné rizikové faktory. V ČR vznikl Národní akční plán pro Alzheimerovu nemoc a obdobná onemocnění pro roky 2020–2030, který si dává za cíl podporovat osvětu, prevenci, zvyšovat dostupnost včasné diagnostiky a následné zdravotní i sociální podpory. V rámci prevence je důležitá znalost ovlivnitelných rizikových faktorů pro vznik kognitivní dysfunkce. Podle expertní komise Lancet, 40 % případů demence souvisí s přítomností 12 modifikovatelných rizikových faktorů (Tab. 1) (2). Arteriální hypertenze (AH) je jedním z hlavních modifikovatelných faktorů rozvoje kognitivní dysfunkce. I když komise Lancet považuje za rizikovou AH pouze ve středním věku, recentní evidence poukazuje na důležitost ovlivnění AH již od mládí. Cílem předkládaného článku je popsat recentní evidenci o vlivu arteriální hypertenze na poškození mozku a rozvoj kognitivního deficitu. Současně diskutujeme evidenci o vlivu kontroly krevního tlaku (TK) na progresi kognitivního deficitu.
Tab. 1. Dvanáct modifikovatelných rizikových faktorů pro rozvoj demence 
Upraveno dle (2) Hypertenze a strukturální změny mozku
Vzhledem k nízké vaskulární rezistenci je mozek jedním z hlavních cílových orgánů poškození AH. Mozek bývá jediným orgánem s hypertenzí mediovaným orgánovým poškozením až u 30 % osob s AH. Toto poškození ale bývá často nepoznané, protože zobrazovací metody mozku a hodnocení kognitivních testů se běžně u pacientů s AH neprovádí.
Existuje několik možných mechanismů poškození mozku vlivem AH. Přehled možných mechanismů zobrazuje obrázek 1. Zaprvé, AH zvyšuje aortální tuhost. Ztráta pružníkové funkce aorty vede k transmisi pulzatilního tlaku a průtoku do periferie mozku. Zadruhé, AH je jedním z hlavních rizikových faktorů rozvoje aterosklerózy, která ovlivňuje mozkovou perfuzi i mikroembolizaci do periferie. Zatřetí, v mozkových tepnách středního kalibru AH vede k hypertrofii hladkosvalových buněk, redukci lumina a následné ischemii. Začtvrté, v cévách malého kalibru AH způsobuje lipohyalózu (ztrátu hladkosvalových buněk, které jsou nahrazeny fibro‑hyalinním materiálem), s následnou redukcí lumina. Při pokročilejších formách lipohyalózy dochází k fibroidní nekróze cévní stěny s následnou rupturou stěny a krvácením. Důsledkem uvedených cévních změn je subklinické poškození mozku, které se na zobrazovacích metodách projeví jako léze bílé hmoty, lakunární infarkt, mikrokrvácení, tichá mozková mrtvice a atrofie mozku (3). Spolu s cévní mozkovou mrtvicí jsou uvedené subklinické strukturální změny mozku úzce propojené s rizikem rozvoje kognitivního deficitu.
Obr. 1. Možné mechanismy vzniku kognitivní dysfunkce/demence u pacientů s arteriální hypertenzí 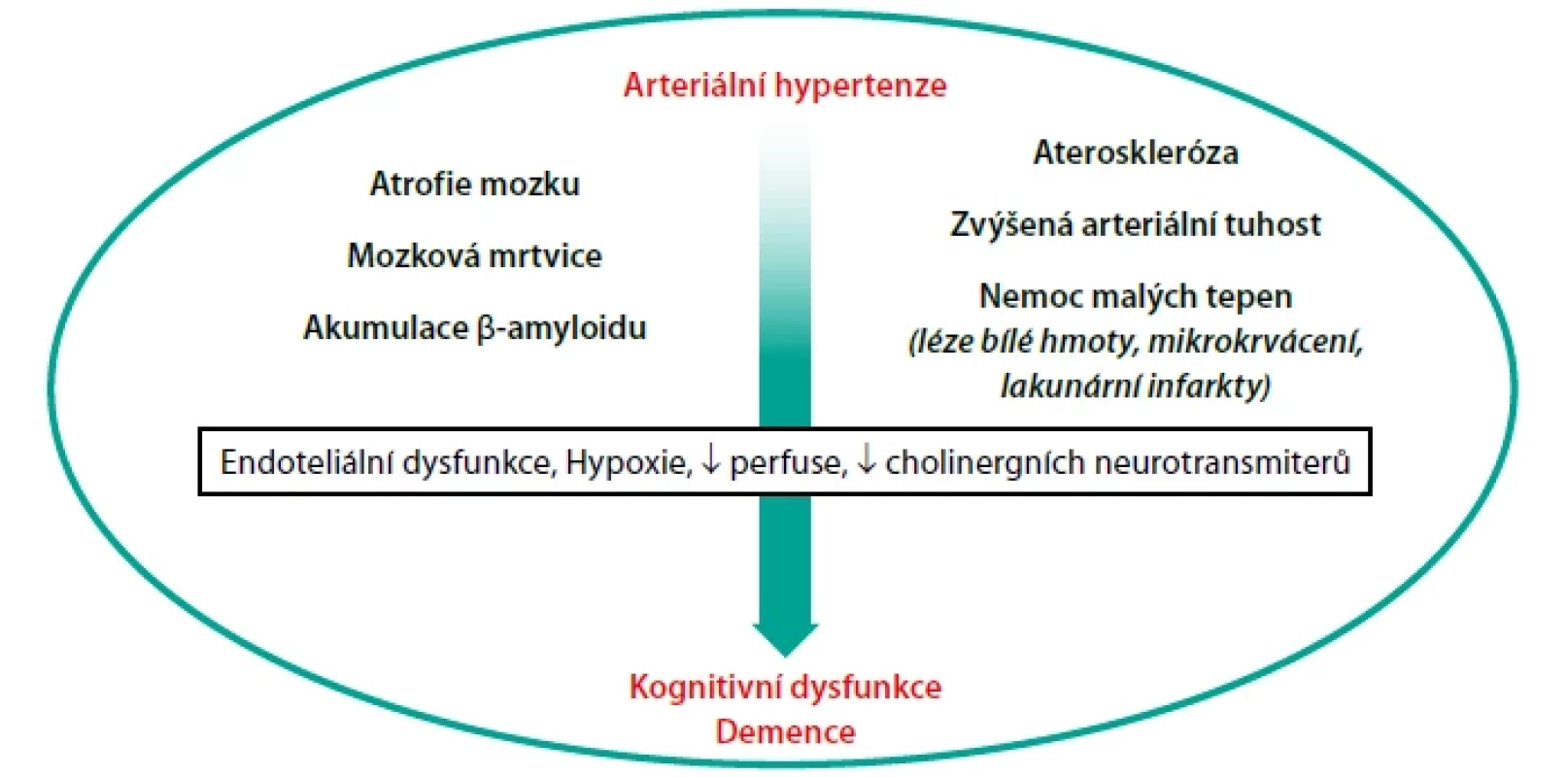
Upraveno dle (23) Donedávna jsme se domnívali, že k poškození mozku AH je nutné dlouhodobé působení vysokých hodnot tlaku. Nedávná analýza zdravých osob ve věku 19 až 40 let ale ukázala, že již hodnoty TK ≥ 120/80 mm Hg jsou spojeny s redukcí objemu šedé hmoty mozku hodnocené pomocí magnetické rezonance (4). To dokazuje, že k poškození mozku stačí relativně krátkodobé působení i lehce zvýšených hodnot tlaku. K podobnému závěru dospěla i britská studie 5 362 osob narozených v jednom týdnu v roce 1946, která sledovala vztah mezi hodnotou TK v různých věkových kategoriích s poškozením mozku ve stáří. Ukázalo se, že vyšší hodnoty TK v rané dospělosti a středním věku jsou spojeny s nižším objemem a mikrovaskulárním poškozením mozku ve stáří (5). V recentní analýze 22 798 osob z UK BIOBANK autoři zjistili, že časný vznik AH před 35. rokem je spojen s nižším objemem šedé i bílé hmoty mozku ve věku kolem 50 let (6). U mladých zdravých osob z Framingham Heart Study průměrného věku 45 let byla zvýšená arteriální tuhost (projev subklinického poškození cévní stěny) spojena s poškozením mozku v oblastech, které jsou odpovědny za kognitivní funkce a vznik Alzheimerovy nemoci (7).
Vliv hypertenze na kognitivní funkce
Negativní vliv AH na kognitivní funkce je znám již od 60. let 20. století, kdy studie u pilotů a řídících letového provozu prokázala nižší psychometrickou rychlost u osob s AH. Další studie prokázaly, že z kognitivních funkcí AH ovlivňuje hlavně exekutivní funkce a rychlost zpracování.
Recentní data prokazují, že vznik AH v mládí vede brzy k úbytku kognitivních funkcí. Studie CARDIA sledovala po dobu až 30 let mladé osoby ve věku 18–30 let na začátku studie. Osoby s časným rozvojem AH nastupující před 35. rokem věku měly horší kognitivní funkce (sluchová paměť, exekutivní funkce a rychlost zpracování) ve věku 55 let než osoby bez AH (8). Výsledky studie CARDIA naznačují, že v rámci prevence kognitivní dysfunkce je důležitá kontrola TK již od mládí.
Řada dalších studií prokázala vztah mezi hodnotou TK ve středním věku a horší kognitivní funkcí a demencí ve stáří (9–11). Například u žen středního věku vyšetřených v rámci Women’s Health and Aging Project již vyšší normální TK (120–139/80–89 mm Hg) byl spojen s horší slovní pamětí a rychlostí zpracování v odstupu 10 let (12). V analýze dat z UK Biobank osoby s nástupem AH do 44. roku měly vyšší riziko rozvoje demence ve stáří (Obr. 2) (6).
Obr. 2. Věk nástupu arteriální hypertenze a riziko rozvoje demence ve stáří 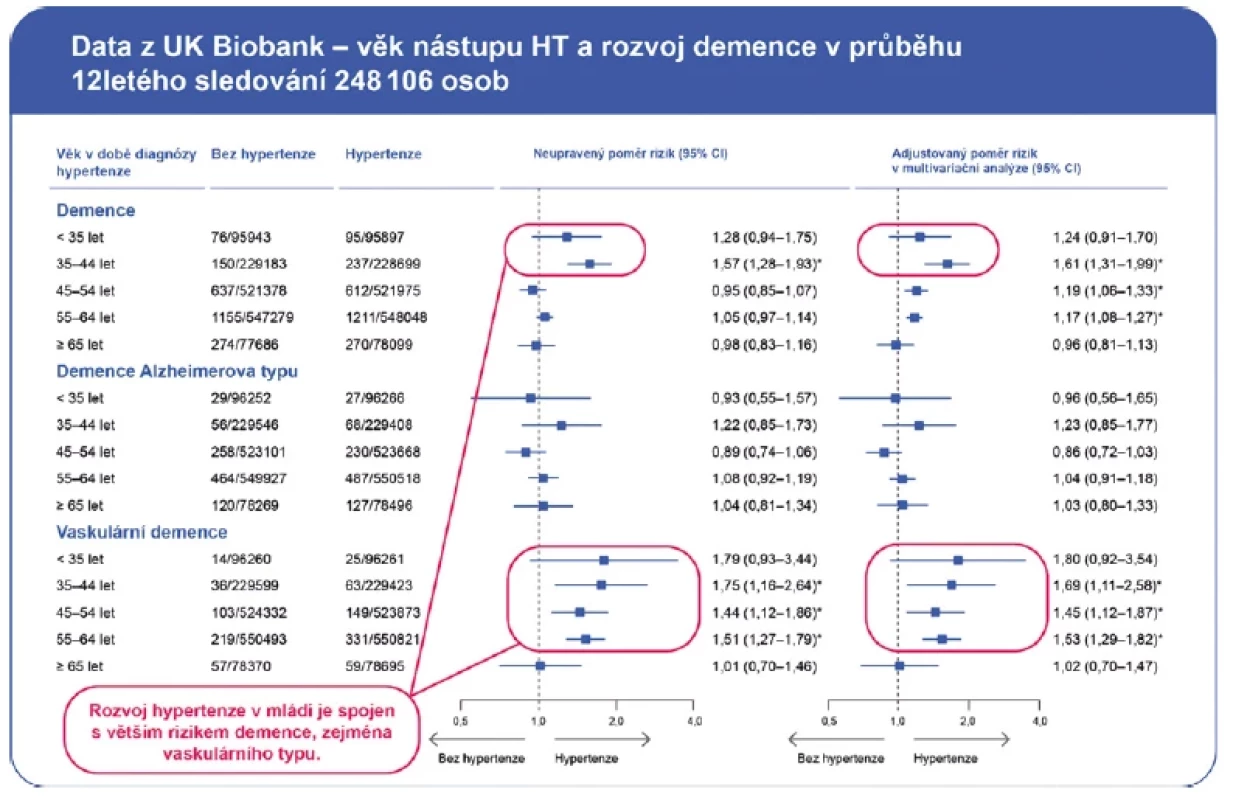
Upraveno dle (6) Naopak existují rozporuplná data o vztahu mezi AH ve vyšším věku a kognitivní dysfunkcí/demencí. Zatímco v některých studiích nebyl žádný vztah mezi TK a kognitivní funkcí (13, 14), jiné studie prokázaly U‑křivku nebo vyšší riziko poklesu kognitivních funkcí u starších pacientů s nižším TK (15, 16). Tento paradox lze vysvětlit pozorováním, že vzniku demence předchází pokles TK (17, 18). Prospektivní sledování v průběhu 24 let v rámci studie ARIC ukázalo, že nejvyšší riziko vzniku demence mají osoby s AH ve středním věku a hypotenzí ve vyšším věku (19). Hodnocení samotných hodnot TK ve vyšším věku bez přihlédnutí k hodnotám TK v mládí a středním věku proto může zkreslit vztah mezi TK a kognitivní dysfunkcí ve stáří. Jednou z možných příčin poklesu TK ve vyšším věku u pacientů s předchozí anamnézou AH je porucha autoregulace TK vlivem neurodegenerace, která předchází rozvoji demence.
Kognitivní dysfunkce jako častý projev hypertenzí mediovaného orgánového poškození bývá často nepoznána. Proto expertní skupina Evropské společnosti pro hypertenzi a Evropské společnosti geriatrické medicíny vypracovala doporučení provádět periodická screeningová vyšetření kognitivních funkcí u pacientů s AH nad 65 let. V případě výsledku MMSE (Mini Mental State Examination) < 24 a MoCA (Montreal Cognitive Assessment) < 26 autoři doporučují neurologické vyšetření (Obr. 3) (20). V ČR v rámci preventivních vyšetření praktickým lékařem se provádí screening demence u osob ve věku 65–80 let. Screening kognitivních funkcí i u mladších pacientů s AH by mohl zlepšit záchyt časných stadií kognitivní dysfunkce a identifikovat osoby ve zvýšeném kardiovaskulárním riziku.
Obr. 3. Algoritmus pro screening kognitivní dysfunkce u pacientů s arteriální hypertenzí 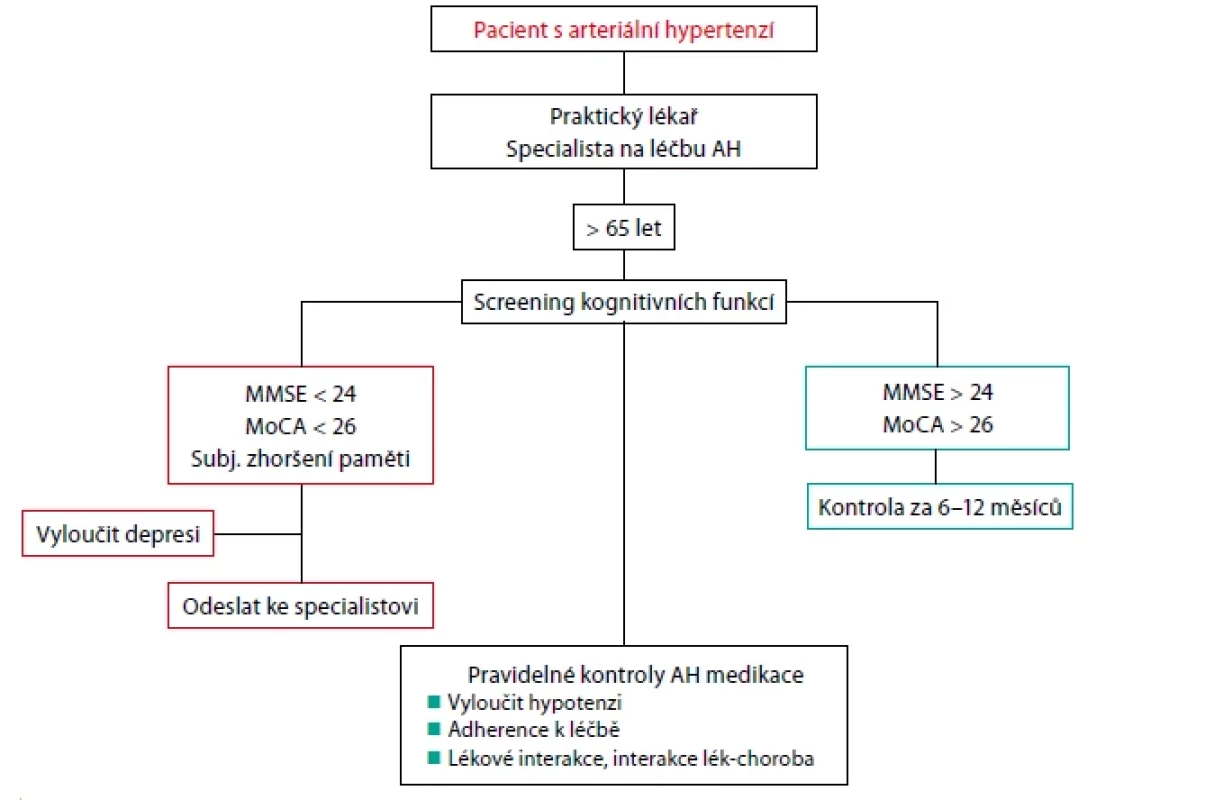
Upraveno dle (20)
MMSE – Mini–Mental State Examination; MoCA – Montreal Cognitive AssessmentAntihypertenzní terapie ovlivňuje pokles kognitivních funkcí
Výsledky randomizovaných intervenčních studií hodnotících vliv antihypertenzní terapie na kognitivní funkce u starších osob a osob po cévní mozkové příhodě jsou rozporuplné. Studie SHEP, MOSES, HYVET‑COG a PROFESS neprokázaly žádný vliv antihypertenzní terapie na kognitivní funkce. Naopak ve studii Syst‑Eur u starších osob s izolovanou systolickou hypertenzí antihypertenzní terapie snížila riziko demence o 50 % ve srovnání s placebem. Uvedené rozdíly lze vysvětlit krátkým trváním studií, použitím málo senzitivních nástrojů pro detekci kognitivní dysfunkce (většina studií používala MMSE test) jako i nízkou senzitivitou a statistickou sílou (vliv na kognitivní funkce byl sekundárním sledovaným cílem). Dalším problémem může být pozdní nasazení antihypertenzní terapie v době rozvinutých ireverzibilních strukturálních změn mozku. Kontrola TK od mládí má větší potenciál zamezit rozvoji strukturálních změn mozku a poklesu kognitivních funkcí. V recentní studii nízkorizikových osob s hypertenzí I. stupně (TK 140–159/90–99 mm Hg) osoby s kontrolovanou hypertenzí měly nižší riziko rozvoje demence, a to jak vaskulární, tak i Alzheimerova typu (Obr. 4) (21). V podstudii studie SPRINT (SPRINT MIND) u osob průměrného věku 68 let intenzivní antihypertenzní terapie s cílovým STK 120 mm Hg vedla k 15% redukci kompozitního cíle MCI a demence ve srovnání s konvenční terapií s cílovým STK < 140 mm Hg.
Obr. 4. Vliv kontroly arteriální hypertenze (HT) na výskyt demence u osob v nízkém kardiovaskulárním riziku s HT I. stupně 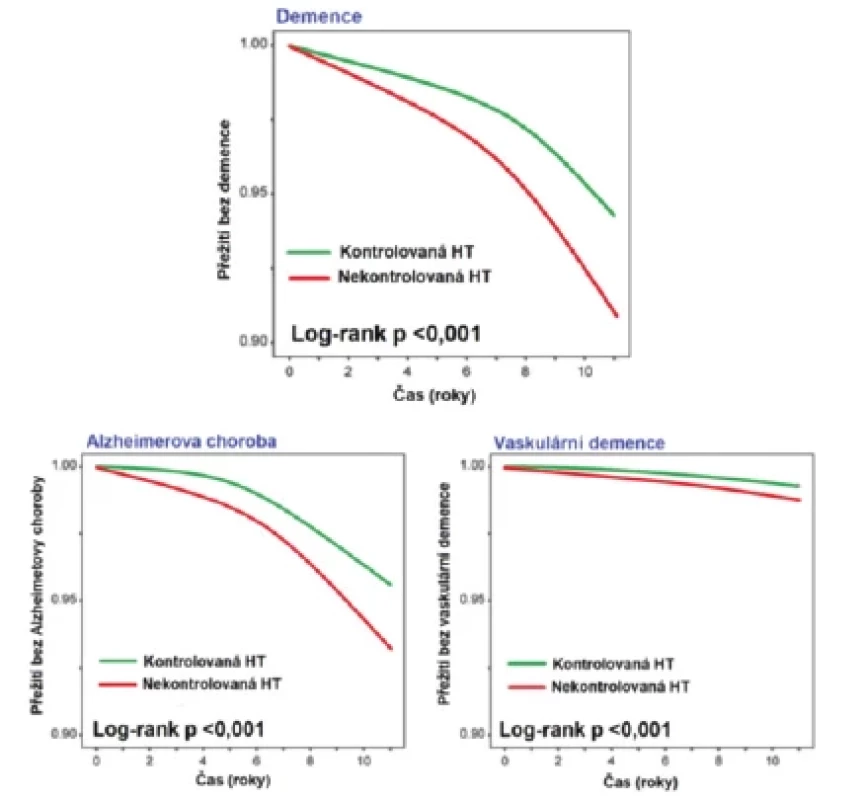
Upraveno dle (21) Dalším důležitým faktorem, který ovlivňuje riziko rozvoje demence, je adherence k antihypertenzní terapii. V prospektivní kohortové studii zahrnující 4368 účastníků ve věku alespoň 65 let bylo riziko demence třikrát vyšší u pacientů s horší adherencí k antihypertenzní léčbě ve srovnání se skupinou s dobrou adherencí. Naopak adherence k hypolipidemické terapii neměla vliv na riziko rozvoje demence. To poukazuje na skutečnost, že asociace mezi horší adherencí k antihypertenzní terapii a demencí nebyla důsledkem horších kognitivních funkcí vedoucích k non‑adherenci. Zlepšení adherence k antihypertenzní terapii tedy může být dalším nástrojem boje s epidemií demence.
Zkvalitnění managementu hypertenze by mělo být cílem každého lékaře
Aktuální evropská doporučení uvádějí jako cílovou hodnotu krevního tlaku u osob do 65 let 120–130/70–80 mm Hg (22). Terapie hypertenze má být podle současných doporučení (22) u naprosté většiny pacientů zahájena dvojkombinací antihypertenziv a intenzifikována do tří měsíců na trojkombinaci antihypertenziv, pokud nedojde k dosažení cílových hodnot krevního tlaku, preferenčně pomocí fixních kombinací.
Závěry
V následujících letech očekáváme výrazný nárůst počtu pacientů s lehkým kognitivním deficitem a demencí v ČR. I když demenci nedokážeme vyléčit, lze jí předcházet. Arteriální hypertenze je významným ovlivnitelným rizikovým faktorem rozvoje kognitivního deficitu. Včasná diagnostika a terapie AH v mládí může zabránit nebo oddálit ireverzibilní poškození mozku a rozvojí kognitivního deficitu. Recentní data naznačují, že u mladých nízkorizikových pacientů s lehce vyšším TK kontrola AH k cílovým hodnotám TK snižuje riziko vzniku demence. Proto je s kontrolou TK nutné začít včas.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Peter Wohlfahrt, PhD.
peter.wohlfahrt@ikem.cz
Pracoviště preventivní kardiologie, IKEM
Vídeňská 1958/9, 140 21 Praha 4Cit. zkr: Vnitř Lék. 2022;68(8):532-536
Článek přijat redakcí: 24. 10. 2022
Článek přijat po recenzích: 15. 11. 2022
Zdroje
1. Petersen RC, Lopez O, Armstrong MJ et al. Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 2018;90(3):126-135.
2. Livingston G, Huntley J, Sommerlad A et al. Dementia prevention, intervention, and care: 2020 report of the <em>Lancet</em> Commission. The Lancet. 2020;396(10248):413-446.
3. Iadecola C, Yaffe K, Biller J et al. Impact of Hypertension on Cognitive Function: A Scientific Statement From the American Heart Association. Hypertension (Dallas, Tex : 1979). 2016;68(6):e67-e94.
4. Schaare HL, Kharabian Masouleh S, Beyer F et al. Association of peripheral blood pressure with gray matter volume in 19 - to 40-year‑old adults. Neurology. 2019;92(8):e758-e773.
5. Lane CA, Barnes J, Nicholas JM et al. Associations between blood pressure across adulthood and late‑life brain structure and pathology in the neuroscience substudy of the 1946 British birth cohort (Insight 46): an epidemiological study. The Lancet Neurology. 2019;18(10):942-952.
6. Shang X, Hill E, Zhu Z et al. The Association of Age at Diagnosis of Hypertension With Brain Structure and Incident Dementia in the UK Biobank. Hypertension. 2021;78(5):1463-1474.
7. Maillard P, Mitchell GF, Himali JJ, et al. Effects of Arterial Stiffness on Brain Integrity in Young Adults From the Framingham Heart Study. Stroke. 2016;47(4):1030-1036.
8. Suvila K, Lima JAC, Yano Y, Tan ZS, Cheng S, Niiranen TJ. Early‑but Not Late‑Onset Hypertension Is Related to Midlife Cognitive Function. Hypertension. 2021;77(3):972-979.
9. Swan GE, Carmelli D, Larue A. Systolic blood pressure tracking over 25 to 30 years and cognitive performance in older adults. Stroke. 1998;29(11):2334-2340.
10. Gottesman RF, Schneider AL, Albert M et al. Midlife hypertension and 20-year cognitive change: the atherosclerosis risk in communities neurocognitive study. JAMA neurology. 2014;71(10):1218-1227.
11. Emdin CA, Rothwell PM, Salimi‑Khorshidi G et al. Blood Pressure and Risk of Vascular Dementia: Evidence From a Primary Care Registry and a Cohort Study of Transient Ischemic Attack and Stroke. Stroke. 2016;47(6):1429-1435.
12. Chen KH, Henderson VW, Stolwyk RJ, Dennerstein L, Szoeke C. Prehypertension in midlife is associated with worse cognition a decade later in middle‑aged and older women. Age and ageing. 2015;44(3):439-445.
13. Hebert LE, Scherr PA, Bennett DA et al. Blood pressure and late ‑ life cognitive function change: a biracial longitudinal population study. Neurology. 2004;62(11):2021-2024.
14. Solfrizzi V, Panza F, Colacicco AM, et al. Vascular risk factors, incidence of MCI, and rates of progression to dementia. Neurology. 2004;63(10):1882-1891.
15. Lee CJ, Lee JY, Han K et al. Blood Pressure Levels and Risks of Dementia: a Nationwide Study of 4.5 Million People. Hypertension (Dallas, Tex : 1979). 2022;79(1):218-229.
16. van Dalen JW, Brayne C, Crane PK et al. Association of Systolic Blood Pressure With Dementia Risk and the Role of Age, U‑Shaped Associations, and Mortality. JAMA internal medicine. 2022;182(2):142-152.
17. Skoog I, Lernfelt B, Landahl S et al. 15-year longitudinal study of blood pressure and dementia. Lancet (London, England). 1996;347(9009):1141-1145.
18. Qiu C, von Strauss E, Winblad B, Fratiglioni L. Decline in blood pressure over time and risk of dementia: a longitudinal study from the Kungsholmen project. Stroke. 2004;35(8):1810-1815.
19. Walker KA, Sharrett AR, Wu A et al. Association of Midlife to Late ‑ Life Blood Pressure Patterns With Incident Dementia. JAMA. 2019;322(6):535-545.
20. Scuteri A, Benetos A, Sierra C et al. Routine assessment of cognitive function in older patients with hypertension seen by primary care physicians: why and how - —a decision‑making support from the working group on ‘hypertension and the brain’ of the European Society of Hypertension and from the European Geriatric Medicine Society. Journal of hypertension. 2021;39(1).
21. Lee CJ, Hwang J, Kang CY et al. Protective effect of controlled blood pressure on risk of dementia in low ‑ risk, grade 1 hypertension. Journal of hypertension. 2021;39(8):1662-1669.
22. Williams B, Mancia G, Spiering W et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). European heart journal. 2018; 39(33): 3021-3104.
23. Sierra C. Hypertension and the Risk of Dementia. Front Cardiovasc Med. 2020 Jan 31;7 : 5.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Hlavní téma – HematologieČlánek Plicní střádání
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Hlavní téma – Hematologie
- Dnešní pohled na dědičné trombofilie
- Venózní tromboembolismus u antifosfolipidového syndromu
- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Vývoj léčby žilní trombózy od pijavic k mechanické trombektomii
- Tradiční a nové biomarkery kongesce u srdečního selhání
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Plicní střádání
- Porucha kognitivních funkcí a hrozba pandemie demence aneb cesta hypertoniků k nesoběstačnosti
- Antitrombotická léčba a digestivní endoskopie
- Jak dobře jsme léčili hypertenzi v posledních 25 letech?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Dnešní pohled na dědičné trombofilie
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Antitrombotická léčba a digestivní endoskopie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



