-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
Reklama3. Nejčastější projevy nemoci a vyšetření vedoucí k rozpoznání a ke stanovení rozsahu nemoci
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. Supplementum 2, p. 27-34.
3.1. Nejčastější projevy nemoci, které jsou indikací k dalšímu vyšetření
Mnohočetný myelom se nejčastěji ohlašuje bolestmi kostí, příznaky zhoršené funkce ledvin, anémií, případně častými a závažnými infekcemi. Na možnost MM je nutno pomyslet u osob s neočekávanou či novou bolestí v zádech, která spontánně neustupuje, při snižování tělesné výšky a dalších známkách akcelerované osteoporózy. Vzácnějšími prvními příznaky je hyperviskozita nebo poruchy koagulace, ať už ve smyslu hypo - či hyperkoagulace. MM se může projevovat i dalšími, méně obvyklými příznaky, které jsou podrobně popsány v odborné literatuře. Někteří nemocní mohou být dlouho bez projevů nemoci a diagnóza je nezřídka odhalena při náhodném vyšetření krve nebo rentgenovém vyšetření, indikovaném z jiného důvodu.
Pro přehlednost shrneme příznaky MM do 5 bodů, každý z nich je důvodem k vyšetření s cílem potvrdit či nepotvrdit tuto nemoc. U jednotlivého pacienta může být přítomen pouze jeden, ale většinou i více příznaků současně (Adam, 2006).
1. Příznaky destrukce kostí:
- déle trvající, nevysvětlené bolesti páteře, obzvláště pokud jsou spojené se zmenšením tělesné výšky, nebo bolesti jiných kostí;
- osteoporóza, obzvláště u mužů anebo u premenopauzálních žen (tj. akcelerovaná);
- symptomy odpovídající kompresi míchy nebo kompresi kořenů míšních nervů.
2. Projevy oslabené imunity a (nebo) zhoršené funkce kostní dřeně:
- opakované, nebo dlouhodobé infekce;
- anémie, typicky normochromní se sklonem k makrocytóze, případně spojená s leukopenií a trombocytopenií.
3. Trvale vysoká hodnota sedimentace erytrocytů, zvýšená viskozita plazmy, případně zvýšená koncentrace celkové bílkoviny v séru.
4. Zhoršená funkce ledvin.
5. Hyperkalcémie.
3.2. Vyšetření, která by měl provést obvodní (praktický) lékař u nemocných s podezřením na MM
Rentgenové vyšetření skeletu cílené na bolestivou lokalizaci (vždy před odesláním nemocného k rehabilitaci, či aplikaci obstřiků, či jiné empirické léčby). Pokud rentgenový snímek neobjasní bolest a příznaky trvají déle než měsíc, zvážit dle dalších okolností odeslání na pracoviště, která mohou indikovat vyšetření MR či CT skeletu, případně PET/CT event. PET/MR.
Sedimentace erytrocytů (velmi vysoká sedimentace u nemocných s MM souvisí s přítomností monoklonálního imunoglobulinu, ale nemusí být zvýšena u nemocných s oligo - a nesecernující formou MM).Kompletní krevní obraz (anémie, případně trombocytopenie, ale i neutropenie mohou být projevem myelomu).
Hladina celkové bílkoviny a albuminu v séru (vysoká koncentrace celkové bílkoviny signalizuje myelom, nízký albumin signalizuje obecně patologický proces).
Hladina urey, kreatininu, a elektrolytů vč. kalcia v séru (zhoršení funkce ledvin signalizuje mimo jiné možnou myelomovou ledvinu, hyperkalcémie signalizuje vysoce agresívní myelom s mnohočetným postižením skeletu).
Běžná elektroforéza bílkovin séra (detekuje monoklonální imunoglobulin ve vyšších koncentracích = spolehlivě nad 1 g/l).
Kvantitativní vyšetření imunoglobulinů v séru (izolované zvýšení jednoho typu imunoglobulinu se současným snížením ostatních typů dalších označované jako imunoparéza signalizuje možnost myelomu).
Vyšetření přítomnosti monoklonálního imunoglobulinu, nejčastěji pouze lehkých řetězců v moči (Bence-Jonesovy bílkoviny) pomocí běžné elektroforézy.
Pokud jsou přítomny příznaky a některé z vyšetření potvrdí podezření na MM, musí být nemocný co nejdříve odeslán na specializované pracoviště, které má možnost toto podezření potvrdit.
3.3. Rozsah vyšetření prováděných NA SPECIALIZOVANÝCH PRACOVIŠTÍCH s cílem potvrdit MM, stanovit klinické stádium onemocnění a jeho prognózu
Kompletní vyšetření, které provede specializované pracoviště s cílem potvrdit nebo vyloučit MM, by mělo obsahovat následující informace z akreditovaných laboratoří:
3.3.1. Hematologická vyšetření
Kompletní krevní obraz vč. manuálního diferenciálního rozpočtu;
základní koagulační vyšetření doplněné případně o speciální vyšetření na hyperkoagulaci resp. hypokoagulaci.
3.3.2. Základní biochemická vyšetření
Urea, kreatinin, kyselina močová, Ca, ionizované Ca, Na, K, Cl, P, bilirubin, jaterní enzymy, glykémie, CRP a LDH;
sérová koncentrace celkové bílkoviny a albuminu;
kvantitativní proteinurie ze sběru moči za 24 h;
kreatininová clearence (měřená nebo vypočítaná);
NTproBNP a troponin (k vyloučení současné AL amyloidozy srdce).
3.3.3. Speciální vyšetření bílkovin
Elektroforéza séra a zahuštěné moči následovaná provedením imunofixace; imunofixaci je nutno provést vždy u pacientů, u nichž je podezření na tuto chorobu a elektroforéza jak séra, tak i moči je negativní (Maisnar, 2012);
kvantitativní denzitometrické stanovení monoklonálního imunoglobulinu;
kvantitativní stanovení koncentrace volných lehkých řetězců v séru vč. stanovení k/l indexu;
kvantitativní stanovení polyklonálních (neizotypických) imunoglobulinů;
kvantitativní stanovení koncentrace beta2-mikroglobulinu v séru, kdy při interpretaci výsledku je nutno vždy přihlédnout k funkci ledvin (Tichý, 2006).
3.3.4. Zobrazovací vyšetření
Při podezření na MM stále patří do standardního vyšetření prováděného lékařem prvního kontaktu rentgenové vyšetření bolestivé oblasti. Pro celkové vyšetření skeletu je již od roku 2015 jako vstupní vyšetření u MM využíváno celotělové nízkodávkové CT (low-dose CT) (Hillengass, 2017; Terpos, 2015).
Vyšetření pomocí MR je esenciální pro nemocné s podezřením na kompresi míchy nebo kořenů míšních nervů, případně pro nemocné s bolestí zad a nejednoznačným výsledkem radiografického vyšetření, MR má potenciál informovat o patologické infiltraci kostní dřeně i mimo kostní propagaci (Mysliveček 2006; Walker, 2007). CT je vhodná v cílených indikacích vyplývajících z klinického podezření nebo rentgenového nálezu, CT znázorňuje kostní strukturu nejpřesněji, oproti MR však nerozpozná tak dobře měkkotkáňovou infiltraci v kosti.
PET/CT – radionuklidové vyšetření pomocí pozitronové emisní tomografie v kombinaci s CT vyšetřením je dnes již považováno za jedno ze standardních vyšetření u MM. Lze jej s výhodou využít zvláště k detekci extramedularních ložisek, k monitorování nemoci, kde to není možné jinou metodou (např. nesekreční myelom s magnetickým kovem v těle ztěžujícím MR vyšetření), a nově je doporučeno provedení PET/CT za účelem vyloučení MRD (minimální reziduální choroba) (Caers, 2018; Kumar, 2016; Terpos. 2015; Zamagni, 2011). Ve stejné indikace lze použít i vyšetření PET/MR (Heidemeier, 2022; Gariani, 2018; Mesguich, 2020; Havel, 2023).
Radionuklidové vyšetření pomocí technecia sestamibi (MIBI) je využíváno v detekci kostních i mimo kostních ložisek dnes již spíše výjimečně, pokud má pracoviště dostatečné zkušenosti v interpretaci jeho výsledků, principem vyšetření je vychytávání radionuklidu v myelomových mitochondriích, kdy míra kumulace souvisí s rozsahem nádorové infiltrace (Mysliveček, 2006).
CAVE! Klasické radionuklidové vyšetření skeletu technecium difosfátem není pro diagnózu MM přínosné, neboť na rozdíl od karcinomů se tato látka v myelomových osteolytických ložiscích pravidelně nevychytává.
3.3.5. Morfologická a další vyšetření kostní dřeně
Aspirát kostní dřeně – výsledný počet plazmocytů (%) závisí na velikosti příměsi periferní krve (lze odhadnout z počtu neutrofilů), relativní počty plazmocytů (%) v myelogramu jsou pravidelně nižší než počty plazmocytů v histologickém preparátu. Vzhledem k diagnostickému významu průkazu přítomnosti klonu myelomových plazmocytů v kostní dřeni je vhodné provedení nátěru k mikroskopickému hodnocení infiltrace z prvního náběru kostní dřeně, který se současně odešle k vyšetření pomocí průtokové cytometrie.
Cytogenetické vyšetření metodou FISH případně sekvenováním nové generace (next generation sequencing – NGS) cílené na průkaz přítomnosti klíčových genetických změn ovlivňujících individuální prognózu nemocného.
Biopsie lopaty kosti kyčelní s histologickým vyšetřením počtu plazmatických buněk a jejich klonality (kappa nebo lambda restrikce). Biopsie by měla být provedena vždy, je-li podezření na MM a přitom v myelogramu nejsou splněna kritéria nemoci (u hraničních stavů). Výhodou trepanobiopsie je možnost odběru dostatečného množství materiálu k dalším vyšetřením, která přinášejí informace o prognóze. V rámci histologie kostní dřeně můžeme prokázat i event. přítomnost amyloidu.
V případě, že lékař zjistí některý z výše uvedených symptomů, které by mohly odpovídat MM, měl by provést skríningové vyšetření, a pokud je některý výsledek z nich patologický, pokračovat dalšími vyšetřeními, které mají potenciál potvrdit diagnózu, zjistit rozsah nemoci a poškození organizmu touto nemocí (Ščudla, 2006). Přehled vyšetření, která zodpovídají jednotlivé otázky, uvádí tab. 3.1.
3.3.6. Cytogenetické vyšetření
MM je klinicky a geneticky heterogenním onemocněním. Někteří pacienti přežívají více než 10 let, zatímco jiní rychle progredují a celkové přežití je méně jak 2 roky. Tento rozdíl je způsoben řadou faktorů, mezi nimiž významnou roli hrají genetické aberace, které vedou ke změně biologického chování myelomových buněk (Robiou du Pont, 2017). Cytogenetické změny jsou u MM rekurentní a mohou být rozděleny na změny primární, spojené se vznikem onemocnění, a změny sekundární, které mají vztah k progresi onemocnění. Primárními změnami jsou translokace zahrnující gen pro těžký řetězec imunoglobulinu (IgH) a početní změny chromozomů – hyperdiploidie (Kuehl, 2012).
U MM je základní metodou určování chromozomových změn metoda fluorescenční in situ hybridizace (FISH) na interfázních buňkách. Těmi mohou být separované CD138+ buňky kostní dřeně nebo plazmatické buňky identifikované barvením cytoplazmatického imunoglobulinu v kombinaci s metodou FISH (cIg FISH). Pro určení nebalancovaných změn v nádorovém genomu se využívá metoda arrayCGH. Na základě genetických studií bylo prokázáno, že hyperdiploidní MM se vyskytuje v 45–55 % a je spojen s dobrou prognózou (Corre, 2021; Rajkumar, 2022). Hyperdiploidie představují zisky celých lichých chromozomů sady, především chromozomů 3, 5, 7, 9, 11, 15 a 21. I v této samotné podskupině existuje heterogenita, kdy trisomie chromozomů 3 a 5 zlepšuje prognózu, zatímco trisomie 21 má na prognózu negativní vliv (tab. 3.2) (Corre, 2021; Rajkumar, 2022). Ve skupině nemocných s translokacemi byla prokázaná nepříznivá prognóza pro translokace t (4; 14), t (14; 16) a t (14; 20) (tab. 3.2). Tyto nálezy společně s nálezy sekundárních změn jako je delece del (17p), zisk/amplifikace 1q nebo mutace P53 představují vysoce rizikovou podskupinu MM (high-risk multiple myeloma). Také další změny, jako delece 1p32, může jako přídatná změna u t (4; 14) zhoršit prognózu (Corre, 2021), proto je její klinický význam nezanedbatelný. Delece 17p se u nově diagnostikovaných MM vyskytuje v 8–11 % (Dimopoulos, 2021; Wiedmeier-Nutor, 2022) a tato delece má klinický význam především při vyšším procentuálním nálezu, avšak pevná hranice pro klinickou relevanci nebyla stanovena. S prognosticky nepříznivým významem je spojena bialelická inaktivace TP53 např. mutací a delecí.
Do rizikové podskupiny dále patří společný nález jakýchkoliv dvou aberací z podskupiny „high risk“ a onemocnění je označeno „double-hit“ myelom a v případě nálezu tří nepříznivých genetických změn pak hovoříme o „triple-hit“ myelomu (Rajkumar, 2022; Dimopoulos, 2021). Mnohem častěji, než se předpokládalo, se vyskytují u MM komplexní změny a chromotrypsií, které jsou spojené s nepříznivou prognózou (Voronina, 2020).
Současné rutinní vyšetření nemocných s MM metodou FISH zahrnují vyšetření vysoce rizikových aberací nepříznivého prognostického dopadu: t (4; 14), t (4; 16), t (14; 20), zisk 1q/delece 1p a delece 17p (Rajkumar, 2022).
V případě relapsu onemocnění se frekvence a typy chromozomových, resp. genových aberací mohou vyvíjet a měnit. Proto je vhodné zjistit aktuální stav před léčbou relapsu. Platí obecná zásada, že při použití každého nového léku či nové kombinace léků musí být stávající prognostické markery znovu validovány a musí být potvrzena jejich prognostická síla v nových podmínkách.
3.3.7. Sekvenování nové generace (next generation sequencing)
Další genetické změny lze dnes sledovat pomocí metod molekulární biologie. Velmi účinným nástrojem se stalo NGS, které umožní analyzovat celý nádorový genom. Lze vytvořit komplexní sekvenační panely, které umožní detekci nejen mutací v klíčových genech, ale detekovat i jednonukleotidové záměny (SNV) a krátké inserce či delece v DNA, variabilitu v počtu kopií genů (copy number variation – CNV). Metodou NGS můžeme zmapovat diverzitu přestaveb genu pro těžké i lehké řetězce imunoglobulinů v populaci buněk (Bolli, 2014; Walker, 2018). Lze přesně určit sekvenci a množství klonálních imunoglobulinů. Stanovení přesné sekvence a množství klonálních imunoglobulinů lze následně využít pro sledování léčebné odpovědi, resp. monitorování minimální reziduální nemoci.
Pro MM je typické, že postupně přibývá známých a klinicky relevantních genomických změn. Nedávno byly popsány jako nové rizikové markery bialelické změny v genech v TP53 nebo DIS3 (mutace nebo delece druhé alely) (Walker, 2019; Boyle, 2020). Stratifikace rizika pomocí genomických markerů může být aplikována také na asymptomatické stavy – MGUS a a doutnající myelom (SMM). Bylo prokázáno, že IGH translokace, mutace v genech NRAS, KRAS a FAM46C, stejně jako translokace MYC nebo abnormality na 8q24, mohou definovat skupinu pacientů s vysokým rizikem, kteří mají tendenci rychle progredovat do myelomu a to nezávisle na současných rizikových faktorech Mezinárodní skupiny pro mnohočetný myelom (IMWG) (Bustoros, 2020).
V České republice je pro vyšetření mnohočetného myelomu experimentálně používán NGS panel LYNX (Navrkalová, 2021), který byl původně navržen všeobecně pro lymfoidní malignity. Jeho současná verze je upravena a doplněna pro použití u monoklonálních gamapatií.
V literatuře byly popsány a validovány nejméně dva cílené panely specificky pro MM (Sudha, 2022; Bolli, 2016). Na jejich základě je možné vytvořit diagnostický panel, který bude zahrnovat prognosticky a biologicky relevantní geny a genomické oblasti. Pro zvýšení účinnosti sekvenování by měl být panel navržen jako dvě sady hybridizačních sond: jedna pro časté translokace MM a druhá pro informace o mutacích a CNAs (copy number alteration) (tab. 3.3 A). Dále by mělo být navrženo několik set dalších SNP v různých oblastech genomu (tab. 3.3 B) pro detekci CNV, velkých delecí a amplifikací a pro identifikaci hyperdiploidie. Soubor sond pro translokace by měl pokrýt přibližně 1,7 Mb genomu a zahrnovat segmenty V, D a J, stejně jako celou konstantní oblast. Pro detekci translokací MYC by měly být sondy navrženy jak upstream, tak downstream od genu MYC (od CASC19 po LINC00824) (tab. 3.3 C). Oblast NGS se neustále vyvíjí a reaguje na nejnovější poznatky o patogenezi MM a onkogenezi obecně. Je pravděpodobné, že komplexnost panelů se bude vyvíjet a doplňovat o další doplňkové geny jako např. obecné nádorové drivery (Sudha, 2022).
Bioinformatické hodnocení změn by mělo být provedeno podle dostupných vědeckých publikací nebo pomocí komerčních programů. Vyšetření NGS je doporučené provést u nově diagnostikovaných nemocných s MM, zvláště v kombinaci se standadním FISH vyšetřením. V případě relapsu onemocnění se frekvence a typy chromozomových, resp. genových aberací mohou vyvíjet a měnit. Proto je vhodné zjistit aktuální stav před léčbou relapsu.
3.3.8. Imunofenotypizace
Diagnostika monoklonálních gamapatií
Průtoková cytometrie hraje zásadní roli ve stanovení množství, fenotypu a zejména klonality plazmatických buněk (PC) ať už v kostní dřeni (KD) či v jiných biologických materiálech. Panel protilátek, pomocí kterého provádí cytometrická laboratoř vyšetření, by měl vždy zahrnovat základní znaky pro detekci PC a stanovení základních fenotypových charakteristik – CD45, CD38, CD138, CD19, CD56 a CD27 (tab. 3.4), vhodné je doplnit i expresi znaků CD81 a CD117 (Flores-Montero, 2017; Jelinek, 2017). Možné je doplnit i vyšetřeních dalších molekul, které konkretizují fenotyp patologické populace a mohou mít vztah k prognóze choroby (CD28, CD44, CD20, CD200). Je zcela nezbytné, aby panel pro diagnostiku i stanovení minimální reziduální choroby (MRD) zahrnoval i protilátky proti lehkým řetězcům kappa a lambda, jejichž exprese musí být detekována v cytoplazmě PC, nikoliv na jejich povrchu. Tyto protilátky slouží ke spolehlivému průkazu klonality PC a pomáhají tak odlišit klonální charakter PC od nálezů polyklonální populace PC např. při infekčních stavech. Zejména pro monoklonální gamapatie nejasného významu (MGUS) je typický výskyt více fenotypově odlišných populací PC, přičemž klonální charakter obvykle vykazují jen některé. Aby nedošlo k přehlédnutí klonální populace na polyklonálním pozadí je proto vždy nutné posuzovat klonalitu pro každou fenotypově odlišnou populaci odděleně. Analýze klonality tak musí předcházet analýza fenotypu. Celkový počet PC a poměr klonálních a polyklonálních PC v rámci PC je navíc důležitým prognostickým faktorem (Burgos, 2023).
Vzorek zaslaný pro imunofenotypizační vyšetření by měl být ošetřen antikoagulačním činidlem EDTA. Odebraný vzorek by měl být co nejrychleji dopraven do příslušné laboratoře bez výrazných teplotních výkyvů a do 24–48 h od odběru zpracován.
Tab. 1. Přehled vyšetření využívaných v rámci diagnostiky pacienta s mnohočetným myelomem. Upraveno a doplněno (dle Kumar, 2016; Munshi, 2017). 
Tab. 2. Primární a sekundární změny u MM a doporučení pro vyšetření (modifi kováno dle Rajkumar, 2022). 
Tab. 3. Pro genetické vyšetření pomocí NGS cíleného panelu (upraveno dle Sudha, 2022 a Bolli, 2016). 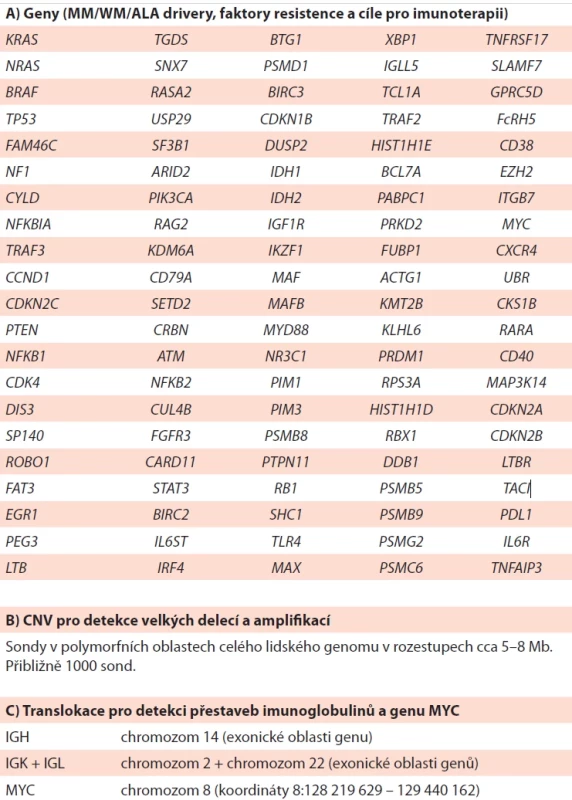
Tab. 4. Doporučené kombinace molekul pro diagnostiku a monitoraci monoklonálních gamapatií. 
Tab. 5. Doporučené formy zápisu výsledků z průtokové cytometrie. 
Hodnocení minimální reziduální nemoci (MRD)
Spolu s technikou NGS je průtoková cytometrie dle Mezinárodní myelomové pracovní skupiny (IMWG) ustanovena jako vhodná metoda pro detekci MRD. Nález bez průkazu klonálních PC v KD je označován jako stav flow MRD-negativity. Při vyšetření MRD pomocí průtokové cytometrie by mělo být postupováno podle zásad tzv. next generation flow, které definovalo evropské cytometrické konsorcium EuroFlow. Citlivost vyšetření by měla dosáhnout minimální hladiny 10–5, ovšem ideálně 10–6. V rámci jednoho měření by tak měly být pro analýzu získány řádově miliony jaderných buněk, ideálně 10 milionů dle doporučení EuroFlow (Kumar, 2016). Pro stanovení MRD by měl být použit první aspirát KD, aby byl získán co nekvalitnější vzorek s minimální kontaminací periferní krví. Nezbytnou součástí výsledkového reportu musí být hladina MRD vyjádřená jako % klonálních reziduálních PC z jaderných buněk KD (tzv. level); a v případě negativního výsledku tzv. limit detekce metody (LOD), definován jako 20/počet jaderných buněk × 100 (vyjádřeno v %). Důležitou výhodou průtokové cytometrie při stanovení MRD oproti NGS je možnost hodnocení kvality vzorku KD a event. kontaminace vzorku periferní krví. Zhodnocení kvality vzorku by tak mělo být nedílnou součástí výsledkového reportu (Puig, 2021).
Stále se ujasňuje optimální frekvence vyšetření MRD v rámci monitorování nemocných s MM v rutinní klinické praxi. Zásadním limitujícím faktorem je nezbytnost odběru kostní dřeně. V rámci České republiky je doporučeno provést hodnocení MRD u všech pacientů s nově diagnostikovaným MM, v den + 100 po provedení ASCT, dále vždy, kdy je ošetřujícím lékařem indikován odběr KD k potvrzení kompletní remise (CR). V případě negativity MRD je doporučeno zopakovat toto vyšetření s odstupem 12 měsíců k potvrzení tzv. sustained MRD negativity, dle oficiálních IMWG MRD kritérií (Kumar, 2016). Rovněž je doporučeno využít obecně nejprve jakoukoliv ověřenou metodu vyšetřující periferní krev (např. stanovení cirkulujících nádorových plazmatických buněk nebo NGS, atd.), které při nižší citlivosti jsou-li pozitivní jednoznačně znamenají pozitivitu MRD a tudíž není třeba odběr kostní dřeně.
Cirkulující nádorové plazmatické buňky (CTCs)
Vysoce senzitivní průtokovou cytometrii je možné využít i pro stanovení klonálních PC cirkulujících v periferní krvi (CTCs), přičemž množství CTCs je zásadním nezávislým prognostickým faktorem u monoklonálních gamapatie (Jelinek, 2023; Garcés, 2022; Sanoja-Flores, 2018). I v tomto případě je doporučeno naměřit co nejvyšší počet buněk. Relativní (%) i absolutní počet CTCs je nutné udávat z CD45+ leukocytů, přičemž v případě neprokázání CTCs je nutné definovat LOD.
Stanovení CTCs je indikováno u všech pacientů s nově diagnostikovaným MM, doutnajícím MM, MGUS a AL amyloidózou, rovněž u pacientů s relapsem MM v rámci restagingu nemoci.
Zápis výsledků imunofenotypizačního vyšetření
Závěrem každého laboratorního vyšetření je informovat lékaře o jeho výsledku. Laboratorní report by měl přinést stručné a jasné informace o počtu a normalitě PC a měl by umožnit i jednoduché zadání výsledku vyšetření do registru monoklonálních gamapatií (RMG) pro potřeby dalších analýz. Pracovní skupina průtokové cytometrie při České myelomové skupině (CMG) tak doporučila formu, v jaké by měly být reporty pro jednotlivé typy vyšetření prezentovány (tab. 3.5). V rámci diagnostiky by měl výsledek obsahovat vždy informaci o celkovém relativním zastoupení všech PC ve vzorku, a relativním zastoupení klonálních PC a polyklonálních PC v rámci populace PC. Rovněž by měl být uveden fenotyp patologické klonální populace PC. Samozřejmostí je uvedení panelu vyšetřených molekul.
Výsledek vyšetření zaměřeného na MRD musí obsahovat i informaci o LOD, a u pozitivních nálezů i již zmíněný level, tedy hladinu zastoupení MRD. Výsledek vyšetření KD bez ohledu na jeho zaměření (diagnostika, MRD) by měl obsahovat i informaci o kvalitě vzorku. Tuto kvalitu může pomoci odhadnout celková buněčnost vzorku, absence prekurzorů červené řady, prekurzorů B lymfocytů, nezralých forem granulocytů či mastocytů (Puig, 2021).
Monitorace anti-BCMA CAR-T lymfocytů
Průtoková cytometrie hraje důležitou roli i v rámci monitorace moderní buněčné terapie – tzv. CAR-T lymfocytů. V rámci monitorace anti-BCMA CAR-T lymfocytů je doporučen 8 barevný panel vyvinutý v rámci konsorcia České společnosti pro analytickou cytometrii (ČSAC), obsahující kombinaci lyofilizovaných protilátek (CD16/CD56, CD3, CD4, CD8, CD19, CD20, CD45 – Exbio, Praha, ČR) a detekci BCMA CAR (Acrobiosystems, Newark, USA). Je doporučeno provádět monitoraci anti-BCMA CAR-T lymfocytů v periferní krvi den 7, 14, 21 po podání preparátu, následně měsíc 1, 2, 3, 6, 9, 12. V případě opakované negativity (2× negativní) je doporučeno zanechat sledování. Ve výsledkovém reportu musí být absolutní počet CAR-T lymfocytů /µl. a v případě neprokázání přítomnosti CAR-T lymfocytů i LOD. Dále je doporučeno sledovat zastoupení NK buněk, T a B lymfocytů v periferní krvi ve stejných časových bodech plus navíc před zahájením lymfodeplece a den –1 před podáním CAR-T lymfocytů.
Zdroje
1. Adam Z, Bednařík J, Neubauer J, et al. Doporučení pro časné rozpoznání postižení skeletu maligním procesem a pro časnou diagnostiku mnohočetného myelomu. Vnitř Lék. 2006; 52 : 9–31.
2. Bolli N, Avet-Loiseau H, Wedge DC, et al. Heterogeneity of genomic evolution and mutational profiles in multiple myeloma. Nat Commun. 2014; 5 : 2997.
3. Bolli N, Li Y, Sathiaseelan V, Raine K, et al. A DNA target-enrichment approach to detect mutations, copy number changes and immunoglobulin translocations in multiple myeloma. Blood Cancer J. 2016; 2; 6 (9): e467.
4. Boyle EM, Ashby C, Tytarenko RG, et al. Clin BRAF and DIS3 mutations associate with adverse outcome in a long-term follow-up of patients with multiple myeloma. Cancer Res. 2020; 15; 26 (10): 2422–2432.
5. Burgos L, Tamariz-Amador L.-E, Puig N, et al. Definition and clinical significance of the monoclonal gammopathy of undetermined significance–like phenotype in patients with monoclonal gammopathies. J Clin Oncol. 2023; 41 (16): 3019–3031.
6. Bustoros M, Sklavenitis-Pistofidis R, Park J, et al. Genomic profiling of smoldering multiple myeloma identifies patients at a high risk of disease progression. J Clin Oncol. 2020; 20; 38 (21): 2380–2389.
7. Caers J, Garderet L, Kortüm KM, et al. European Myeloma Network recommendations on tools for the diagnosis and monitoring of multiple myeloma: what to use and when. Haematologica. 2018; 103 (11): 1772–1784.
8. Corre J, Munshi NC, Avet-Loiseau H. Risk factors in multiple myeloma: is it time for a revision? Blood. 2021; 137 : 16–19.
9. Dimopoulos MA, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021; 32 (3): 309–322.
10. Flores-Montero J, Sanoja-Flores L, Paiva B, et al. Next generation flow for highly sensitive and standardized detection of minimal residual disease in multiple myeloma. Leukemia. 2017; 31 (10): 2094–2103.
11. Garcés J.-J, Cedena M.-T, Puig N, et al. Circulating tumor cells for the staging of patients with newly diagnosed transplant-eligible multiple myeloma. J Clin Oncol. 2022; 40 : 3151–3161.
12. Gariani J, Westerland O, Natas S, et al. Comparison of whole body magnetic resonance imaging (WBMRI) to whole body computed tomography (WBCT) or 18F-fluoro-deoxyglucose positron emisson tomography/CT (18F-FDG PET/CT) in patients with myeloma: Systematic review of diagnostic performance. Crit Rev Oncol Hematol. 2018; 124 : 66–72.
13. Hájek R, Mužík J, Maisnar V, et al. Mnohočetný myelom. MKN klasifikace a Národní onkologický registr České republiky. Klin Onkol. 2007; 20 (Suppl.1): 147–151.
14. Havel M, Jelínek T, Pour L, et al. Standardizace PET/CT u pacientů s mnohočetným myelomem – Společné doporučení České myelomové skupiny a České společnosti nukleární medicíny. Transfuze Hematol Dnes. 2023; 2 : 148–152.
15. Heidemeier A, Schloetelburg W, Thurner A, et al. Multi-parametric whole-body MRI evaluation discerns vital from non-vital multiple myeloma lesions as validated by 18F-FDG and 11C-methionine PET/CT. Eur J Radiol 2022; 155 : 110493.
16. Hillengass J, Moulopoulos LA, Delorme S, et al. Whole-body computed tomography versus conventional skeletal survey in patients with multiple myeloma: a study of the International Myeloma Working Group. Blood Cancer J. 2017; 7 (8): e599.
17. Jelinek T, Bezdekova R, Zatopkova M, et al. Current applications of multiparameter flow cytometry in plasma cell disorders. Blood Cancer J. 2017; 7 (10): e617.
18. Jelinek T, Bezdekova R, Zihala D, et al. More than 2% of circulating tumor plasma cells defines plasma cell leukemia-like multiple myeloma. J Clini Oncol. 2023; 41 : 1383–1392.
19. Kuehl WM, Bergsagel PL. Molecular pathogenesis of multiple myeloma and its premalignant precursor. J Clin Invest. 2012; 122 (10): 3456–3463.
20. Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multipla myeloma. Lancet Oncol. 2016; 17 (8): e328–e346.
21. Landgren O, Kyle RA, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood. 2009; 113 (22): 5412–5417.
22. Maisnar V, Tichý M. Monoklonální imunoglobuliny – výskyt, význam a možnosti jejich průkazu.1.vyd. Nucleus HK, Hradec Králové 2012, 125s.
23. Malúšková D, Svobodová I, Kučerová M, et al. Epidemiologie mnohočetného myelomu v České republice. Klin Onkol. 2017; 30 : 35–42.
24. Mesguich C, Hulin C, Latrabe V, et al. Prospective comparison of 18-FDG PET/CT and whole-body diffusion-weighted MRI in the assessment of multiple myeloma. Ann Hematol. 2020; 99 (12): 2869–2880.
25. Mysliveček M, Bačovský J, Nekula J, et al. Scintigrafie pomocí 99mTc-MIBI v diagnostice mnohočetného myelomu: senzitivní ukazatel biologické aktivity a rozsahu choroby. Nukl Med. 2003; 220–230.
26. Mysliveček M, Nekula J, Bačovský J. Zobrazovací metody v diagnostice a sledování mnohocetného myelomu. Vnitř Lek. 2006; 52 Suppl 2 : 46–54.
27. Munshi NC, Avet-Loiseau H, Rawstron AC, et al. Association of minimal residual disease with superior survival outcomes in patients with multiple myeloma: a meta-analysis. JAMA Oncol. 2017; 3 (1): 28–35.
28. Národní onkologický registr, aktuální analýza z roku 2023, nepublikováno.
29. Navrkalova V, Plevova K, Hynst J, et al. LYmphoid NeXt-generation sequencing (LYNX) panel: a comprehensive capture-based sequencing tool for the analysis of prognostic and predictive markers in lymphoid malignancies. J Molec Diagnostics. 2021; 23 (8): 959–974.
30. Puig N, Flores-Montero J, Burgos L, et al. Reference values to assess hemodilution and warn of potential false-negative minimal residual disease results in myeloma. Cancers. 2021; 13 : 4924.
31. Rajkumar SV. Multiple myeloma: 2022 update on diagnosis, risk stratification, and management. Am J Hematol. 2022; 97 (8): 1086–1107.
32. Robiou du Pont S, Cleynen A, Fontan C, et al. Genomics of multiple myeloma. J Clin Oncol. 2017; 35 (9): 963–967.
33. Sanoja-Flores L, Flores-Montero J, Garcés JJ, et al. Next generation flow for minimally-invasive blood characterization of MGUS and multiple myeloma at diagnosis based on circulating tumor plasma cells (CTPC). Blood Cancer J. 2018; 8 : 117.
34. Sudha P, Ahsan A, Ashby C, et al. Myeloma genome project panel is a comprehensive targeted genomics panel for molecular profiling of patients with multiple myeloma. Clin Cancer Res. 2022; 28 (13): 2854–2864.
35. Ščudla V. Diagnostický význam a úskalí hodnocení roztěrového preparátu kostní dřeně u mnohočetného myelomu. Vnitř Lék. 2006; 52 : 55–65.
36. Terpos E, Kleber M, Engelhardt M, et al. European Myeloma Network guidelines for the management of multiple myeloma-related complications. Haematologica. 2015; 100 (10): 1254–1266.
37. Tichý M, Maisnar V. Laboratorní průkaz monoklonálních imunoglobulinů. Vnitřní Lék. 2006; 52 : 41–45.
38. Voronina N, Wong JKL, Hubschmann D, et al. The landscape of chromothripsis across adult cancer types. Nat Comm. 2020; 11 : 2320.
39. Walker BA. Whole exome sequencing in multiple myeloma to identify somatic single nucleotide variants and key translocations involving immunoglobulin Loci and MYC. Methods Mol Biol. 2018; 1792 : 71–95.
40. Walker BA, Mavrommatis K, Wardell CP, et al. A high-risk, double-hit, group of newly diagnosed myeloma identified by genomic analysis. Leukemia. 2019; 33 : 159–170.
41. Walker R, Barlogie B, Haessler J, et al. Magnetic resonance imaging in multiple myeloma: diagnostic and clinical implications. J Clin Oncol. 2007; 25 (9): 1121–1128.
42. Wallington-Beddoe C, Mynott1 R. Prognostic and predictive biomarker developments in multiple myeloma, J Hematol Oncol. 2021; 14 : 151.
43. Wiedmeier-Nutor JE, Bergsagel BL. Review of multiple myeloma genetics including effects on prognosis, response to treatment, and diagnostic workup. Life. 2022; 12 : 812.
44. Zamagni E, Patriarca F, Nanni C, et al. Prognostic relevance of 18-F FDG PET/CT in newly diagnosed multiple myeloma patients treated with up-front autologous transplantation. Blood. 2011; 118 (23): 5989–5995.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2023 Číslo Supplementum 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Souhrn doporučení 2023: Diagnostika a léčba mnohočetného myelomu
- 10. Alogenní transplantace krvetvorných buněk
- 11. Udržovací a konsolidační léčba
- 12. Léčba nemocných s mnohočetným myelomem a renálním selháním
- 13. Vybrané oblasti z komplexní podpůrné léčby mnohočetného myelomu
- 14. Léky inhibující osteolýzu u mnohočetného myelomu
- 15. Komplexní podpůrná léčba – anémie
- 16. Profylaxe tromboembolické nemoci u pacientů s mnohočetným myelomem
- 17. Profylaxe infekčních komplikací
- 18. Fyzioterapie u nemocných s mnohočetným myelomem
- 19. Monoklonální gamapatie nejasného významu (MGUS) – doporučení pro diagnostiku a sledování
- 1. Metodické postupy tvorby doporučení
- 2. Epidemiologie
- 3. Nejčastější projevy nemoci a vyšetření vedoucí k rozpoznání a ke stanovení rozsahu nemoci
- 4. Kritéria pro stanovení diagnózy mnohočetného myelomu a jeho klinického stádia, kritéria dalších plazmocelulárních chorob
- 5. Kritéria pro hodnocení léčebného efektu a dlouhodobé úspěšnosti léčby
- 6. Obecné informace o léčbě mnohočetného myelomu
- 7. Léčebné strategie
- 8. Léčba mnohočetného myelomu
- Editorial
- 9. Vysokodávkovaná chemoterapie s transplantací autologních kmenových buněk
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Souhrn doporučení 2023: Diagnostika a léčba mnohočetného myelomu
- 19. Monoklonální gamapatie nejasného významu (MGUS) – doporučení pro diagnostiku a sledování
- 8. Léčba mnohočetného myelomu
- 6. Obecné informace o léčbě mnohočetného myelomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



