-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dlouhodobě úspěšná léčba obstrukční hypertrofické kardiomyopatie pomocí mavakamtenu – kazuistika
7. 11. 2024
Následující kazuistika dokumentuje odstranění významné symptomatické obstrukce ve výtokovém traktu levé komory srdeční (LVOT) u pacienta s hypertrofickou kardiomyopatií (HCM) po přidání mavakamtenu ke standardní léčbě betablokátorem (BB). Tato terapie vedla k významnému zlepšení symptomatologie, jež spolu s hemodynamickým efektem přetrvávalo během skoro 5letého sledování v rámci extenze studie Explorer-HCM. Léčba mavakamtenem byla dobře tolerována a nemusela být přerušována pro pokles ejekční frakce nebo jiné nežádoucí účinky. V článku dále diskutujeme postavení inhibice srdečního myosinu v léčbě obstrukční HCM, doporučení pro vedení léčby mavakamtenem a její úskalí.
Úvod
Hypertrofická kardiomyopatie (HCM) je definována u dospělých jedinců zesílením stěny levé komory srdeční (LKS) dosahujícím ≥ 15 mm. Diagnózu HCM můžeme stanovit jen tehdy, pokud hypertrofii stěn nelze vysvětlit tlakovým či objemovým přetížením LKS, tedy při absenci závažné arteriální hypertenze, chlopenní vady nebo koarktace aorty (1). U typické formy HCM je hypertrofie doprovázena hyperkontraktilitou LKS, poruchou diastolické funkce a variabilním výskytem obstrukce výtokového traktu LKS (2). LVOT se vyskytuje zhruba u jedné třetiny pacientů s HCM v klidu a u další třetiny nemocných ji můžeme provokovat zátěží nebo Valsalvovým manévrem. Při průkazu obstrukce (gradient ≥ 30 mmHg) diagnostikujeme takzvanou obstrukční formu HCM, která je spojená s výraznější symptomatologií a horší prognózou než neobstrukční formy onemocnění (2, 3).
Tento nejčastější fenotyp HCM označujeme termínem sarkomerová forma HCM, neboť se typicky vyskytuje u nositelů patogenních mutací genů kódujících strukturu sarkomery. Uvedené patogenní varianty můžeme zastihnout jen u 30–40 % nemocných s HCM (2). U řady pacientů s typickým fenotypem HCM však patogenní sarkomerovou variantu nezachytíme, onemocnění se ale z klinického a prognostického hlediska chová stejně a reaguje na léčbu podobně jako genotypově pozitivní případy. Na buněčné a molekulární úrovni lze u sarkomerové formy zachytit hyperkontraktilitu a poruchu relaxace kardiomyocytů, na níž se podílí zvýšený počet interakcí mezi aktinem a myosinem při nedostatečném zastoupení superrelaxované formy srdečního myosinu (2, 4, 6).
InzerceV experimentálních modelech genetických forem HCM inhibice ATPázy srdečního myosinu mavakamtenem redukovala nadměrné množství aktin-myosinových interakcí, zvyšovala zastoupení superrelaxované formy srdečního myosinu a snižovala spotřebu energie. Tímto mechanismem upravovala hyperkontraktilitu a porušenou relaxaci kardiomyocytů a při časném podání zabraňovala vzniku fenotypu HCM (6–9). Klinické studie s mavakamtenem u obstrukční formy HCM tyto výsledky potvrdily. V randomizovaných studiích fáze III (Explorer-HCM, Valor-HCM) mavakamten zlepšoval symptomatologii a toleranci zátěže, dále snižoval gradient v LVOT a potřebu invazivní septální ablace (10–14). Proto byl jako první inhibitor srdečního myosinu zařazen do algoritmu léčby symptomatických pacientů s HCM a přetrvávající významnou obstrukcí LVOT (gradient ≥ 50 mmHg) na konvenční léčbě BB, disopyramidem, verapamilem nebo diltiazemem (1, 10).
Cílem této práce je prezentovat kazuistiku dlouhodobě úspěšné léčby mavakamtenem u pacienta s obstrukční hypertrofickou kardiomyopatií. Budeme diskutovat místo inhibice srdečního myosinu v terapii obstrukční HCM, doporučení pro vedení léčby mavakamtenem a její úskalí.
Popis případu
Jedná se o 41letého muže, který byl referován na naše pracoviště v lednu 2018 s diagnózou obstrukční hypertrofické kardiomyopatie. Měl pozitivní rodinnou anamnézu HCM, neobstrukční forma HCM byla zjištěna u matky pacienta v 61 letech. Později byla u něj i u matky potvrzena patogenní varianta myosin vázajícího proteinu C3 (MYBPC3).
Osobní anamnéza pacienta byla kromě vitiliga a stavu po apendektomii negativní. Od června 2017 však začal být symptomatický s námahovou dušností (NYHA II–III). V lednu 2018 byla na spádovém pracovišti diagnostikována obstrukční HCM s asymetrickou hypertrofií levé komory srdeční s tloušťkou septa komor 18 mm a významným klidovým gradientem ve LVOT (60 mmHg).
Pro přetrvávání symptomatologie a významné obstrukce LVOT i po titraci dávky betablokátoru byl v srpnu 2018indikován ke koronarografii a pokusu o alkoholovou septální ablaci. Při normálním koronarografickém nálezu byl aplikován 1,0 ml 96% ethanolu do první septální větve s její kompletní okluzí. Anatomicky se jednalo o jedinou vhodnou větev k alkoholové ablaci. Laboratorně byla detekována nekróza myokardu s maximální hodnotou troponinu T 2085 ng/l. Krátce po výkonu byla přechodně zachycena atrioventrikulární disociace bez poklesu tepové frekvence pod 40/min, s rychlou normalizací.
Během dalšího sledování však přetrvávala námahová dušnost (NYHA II). Při echokardiografii nedošlo k zásadnímu poklesu gradientů v LVOT. Při kontrole v lednu 2019 byla přítomná dynamická obstrukce v LVOT s vrcholovým gradientem v klidu 67 mmHg, při Valsalvově manévru 77 mmHg (viz obr. 1 a 2). Ejekční frakce (EF) LK se tehdy pohybovala nad 60 % a hypertrofie septa komor dosahovala midseptálně až 22 mm. Skóre rizika náhlé srdeční smrti bylo < 4 %. Při sinusové bradykardii byla tolerována dávka metoprolol-sukcinátu maximálně 50 mg denně.
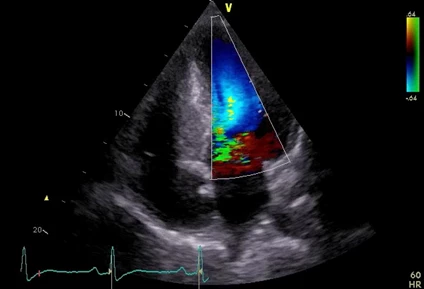
Obr. 1 Echokardiografický nález. Apikální čtyřdutinová projekce s barevným dopplerovským mapováním ukazuje významnou hypertrofii septa komor a systolickou turbulenci ve výtokovém traktu. Vyšetření bylo provedeno u referovaného pacienta v lednu 2019, snímek z archivu IKEM.
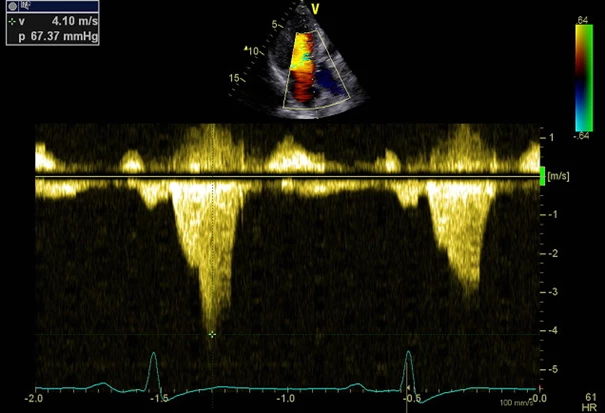
Obr. 2 Záznam z kontinuálního Dopplera ukazuje přetrvávání významné obstrukce ve výtokovém traktu po provedení alkoholové septální ablace. Vyšetření z ledna 2019, snímek z archivu IKEM.
Dne 21. března 2019 byl pacient randomizován ve studii Explorer-HCM k podávání mavakamtenu či placeba. Sledování v rámci studie pokračovalo do října 2019, během něhož jsme pozorovali významné zlepšení symptomatologie, až do třídy NYHA I. Byli jsme ale zaslepeni k výsledkům echokardiografie a biomarkerů. Placebem kontrolovaná část studie byla ukončena vysazením studijní medikace na 6 týdnů, následně pacient souhlasil s přechodem do extenze studie Explorer HCM (MAVA-LTE), kde měl být všem účastníkům podáván mavakamten. V rámci extenze jsme byli zaslepeni k dávce studijní medikace, ale měli jsme již přístup k echokardiografickým nálezům. Při vysazené studijní medikaci jsme v prosinci 2019 zaznamenali rekurenci námahové dušnosti NYHA II–III a recidivu významné obstrukce v LVOT, klidový gradient přesahoval 80 mmHg, po Valsalvově manévru přesahoval 90 mmHg. EF LK byla kalkulována na 69 % (viz obr. 3).
Od 19. prosince 2019 bylo zahájeno podávání mavakamtenu v extenzi studie Explorer-HCM (MAVA-LTE). Již v lednu 2020 jsme pozorovali významné zlepšení symptomatologie do třídy NYHA I a významný pokles gradientů v LVOT, které zůstávaly nevýznamné po celou dobu trvání studie až do října 2024 (viz obr. 3). Během celého sledovaného období nedošlo k poklesu EF LK pod 50 %, a nebylo tedy nutné přerušit léčbu. Nevyskytly se ani žádné jiné nežádoucí příhody, které by měly vztah k podávání mavakamtenu.
V září 2020 byl pacient zajištěn dvoudutinovým kardioverterem-defibrilátorem (ICD) z indikace primární prevence náhlé srdeční smrti pro záchyt běhů nesetrvalé komorové tachykardie s kalkulovaným rizikem 5 %. V říjnu 2020 byl v paměti ICD zachycen paroxysmus fibrilace síní (FiS) v trvání skoro 4 hodiny, od té doby byl nemocný antikoagulován rivaroxabanem. Na konci skoro 5 let trvající extenze studie byl nadále asymptomatický s nevýznamnými gradienty v LVOT a EF LK 61 % (viz obr. 3). Od výzkumného týmu jsme následně obdrželi informaci o dávkování mavakamtenu u referovaného pacienta v extenzi studie – jednalo se o dávku 2,5 mg denně. Genotyp izoenzymu CYP2C19 odpovídal u tohoto jedince rychlému metabolizátorovi.
Dne 24. října 2024 byl pacient převeden na komerční preparát s obsahem mavakamtenu (2,5 mg/den), který recentně získal úhradu pro centrovou léčbu. Klinika kardiologie IKEM v Praze je jedním z center, jež tuto léčbu poskytují.
Obr. 3 Vývoj gradientů LVOT (v klidu a po Valsalvově manévru) a hodnot EF LK u referovaného pacienta během extenze studie Explorer HCM od prosince 2019 do října 2024. Byla podávána malá dávka metoprolol-sukcinátu 50 mg denně a mavakamten 2,5 mg 1× denně.

Diskuse
Kazuistika dokumentuje odstranění významné symptomatické obstrukce ve výtokovém traktu LKS u pacienta s HCM po přidání mavakamtenu ke standardní léčbě betablokátorem. Tato terapie vedla k významnému zlepšení symptomatologie, které spolu s hemodynamickým efektem přetrvávalo během skoro 5letého sledování v rámci extenze studie Explorer-HCM. Léčba mavakamtenem byla dobře tolerována a nemusela být přerušována pro pokles EF LK ani jiné nežádoucí příhody.
Toto pozorování je v souladu s nedávno publikovanými výsledky z extenze studie Explorer-HCM (MAVA-LTE) s mediánem sledování 3,2 roku (14). V době vzniku této publikace bylo na terapii mavakamtenem 91 % z 231 pacientů původně zařazených do uvedené studie. V týdnu 180 trvalo zlepšení třídy NYHA, významné snížení klidového i provokovaného gradientu v LVOT, byla významně redukována hladina NT-proBNP a trvalo zlepšení kvality života dle EQ-5D-5L. Během sledování byl ve 22 případech u 20 pacientů (8,7 %) zaznamenán reverzibilní pokles EF LK na < 50 %, který si vyžádal jen přechodné přerušení léčby. Zemřelo 5 pacientů (2,2 %), bez kauzálního vztahu k podávání mavakamtenu. Dlouhodobá léčba tímto preparátem u obstrukční HCM vedla podle investigátorů k setrvalému zlepšení symptomatologie a kardiologických nálezů.
Současná doporučení pro léčbu obstrukční HCM
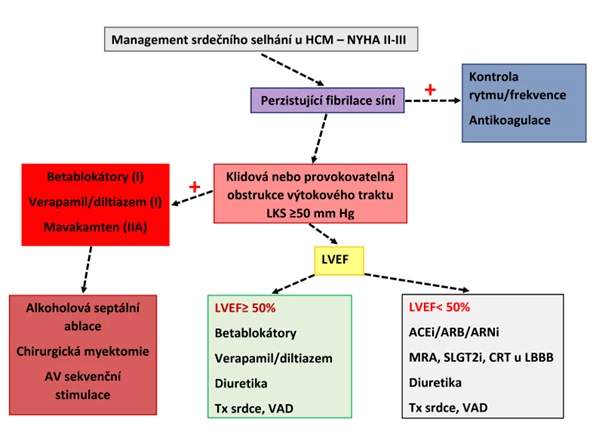
Podle doporučení Evropské kardiologické společnosti (ESC) pro management kardiomyopatií z roku 2023 (1) byl mavakamten nově zařazen do léčby obstrukční HCM u symptomatických pacientů ve třídě NYHA II–III (viz obr. 4). Následně byl preparát s obsahem této účinné látky registrován v Česku a od 1. října 2024 získal úhradu zdravotních pojišťoven jako léčba poskytovaná ve specializovaných centrech pro kardiomyopatie.
Podle SPC a úhradových podmínek je podávání mavakamtenu indikované u jedinců s obstrukční HCM ve třídě NYHA II–III, pokud mají EF LK ≥ 55 % a přetrvává u nich významná obstrukce v LVOT (≥ 50 mmHg) na nejvyšší tolerované dávce betablokátoru, verapamilu nebo diltiazemu (disopyramid není v Česku dostupný). Terapie inhibitory srdečního myosinu má u vhodných pacientů předcházet nutnosti invazivních septálních redukčních výkonů. Česká kardiologická společnost (ČKS) vytvořila síť 10 pracovišť zaměřených na problematiku kardiomyopatií, jež budou tuto léčbu poskytovat.
Obr. 4 Management obstrukce ve výtokovém traktu LKS u pacientů s HCM je jedním z důležitých bodů léčby srdečního selhání u těchto nemocných. Je ukázáno postavení mavakamtenu v této indikaci. Modifikováno podle guidelines ESC pro management kardiomyopatií (1).
Požadavky na vedení léčby mavakamtenem
Podle SPC (15) má léčba mavakamtenem probíhat pod dohledem lékaře specializovaného na problematiku kardiomyopatií. Pro stanovení úvodní dávky mavakamtenu a následné vedené léčby s ohledem na lékové interakce je třeba provést genotypizaci izoenzymu 2C19 cytochromu P450 (CYP2C19). Hlavně u pomalých metabolizátorů CYP2C19 a při lékových interakcích ovlivňujících CYP3A4 a/nebo CYP2C19 hrozí kumulace léčiva spojená se zvýšeným rizikem vzniku srdečního selhání. Pro riziko embryotoxicity musejí mít ženy ve fertilním věku před zahájením léčby negativní těhotenský test, během terapie potom užívat účinnou antikoncepci a v té pokračovat až 6 měsíců po poslední dávce mavakamtenu.
Léčba mavakamtenem je kontraindikovaná:
- při známé alergii na mavakamten nebo jakoukoliv pomocnou látku;
- během těhotenství a u žen ve fertilním věku, které neužívají účinnou antikoncepci;
- při souběžné léčbě silnými inhibitory CYP3A4 u pacientů s fenotypem pomalého metabolizátora CYP2C19 a s neurčeným fenotypem CYP2C19;
- při souběžné léčbě kombinací silného inhibitoru CYP2C19 a silného inhibitoru CYP3A4.
U pomalého metabolizátora CYP2C19 nebo při neznámém genotypu CYP2C19 je doporučená počáteční dávka 2,5 mg perorálně 1× denně a maximální dávka činí 5 mg denně. U ostatních fenotypů metabolizátorů přes CYP2C19 je doporučena úvodní dávka 5 mg denně a maximální dávka 15 mg denně. V SPC jsou podrobně rozebrány dávkovací algoritmy včetně přehledných diagramů pro vedení léčby. Kdykoliv dojde k poklesu EF LK pod 50 %, musí být léčba na 4 týdny přerušena, dokud se nevrátí na ≥ 50 %. Mavakamten potom restartujeme v gramáži o 1 stupeň nižší; při předchozí dávce 2,5 mg denně pokračujeme v dávce stejné.
Léčbu trvale ukončíme, klesne-li při dávce 2,5 mg denně EF LK 2× po sobě < 50 %. Dalším důvodem pro ukončení léčby je absence jakéhokoliv zlepšení klinického stavu nebo gradientu v LVOT po 4–6 měsících podávání mavakamtenu. EF LK kontrolujeme také při závažné infekci nebo tachyarytmii (včetně FiS) – v takové situaci se rovněž nedoporučuje zvýšení dávky mavakamtenu.
Dávku mavakamtenu nemusíme upravovat proti standardnímu dávkování u nemocných s lehkou až středně těžkou renální insuficiencí. U pacientů s těžkou poruchou funkce ledvin (odhad glomerulární filtrace [eGFR] < 30 ml/min/1,73 m2) nelze dávku doporučit, neboť tito jedinci nebyli zařazeni do klinických studií. U pacientů s lehkou a středně těžkou poruchou funkce jater (třídy A a B podle Childa a Pugha) má být počáteční dávka mavakamtenu 2,5 mg, protože se předpokládá zvýšená expozice účinné látce. U pacientů s těžkou poruchou funkce jater (třída C podle Childa a Pugha) nelze dávku doporučit pro jejich absenci v klinických studiích.
Úskalí léčby mavakamtenem
Z výše uvedeného vyplývají následující úskalí při léčbě mavakamtenem:
- Je nezbytná genotypizace izoenzymu 2C19 cytochromu P450 (CYP2C19).
- Zásadní je sledování lékových interakcí přes CYP2C19 a CYP3A4 s úpravou dávek podle SPC (15), ideálně ve spolupráci s klinickým farmaceutem. Pokud to není schůdné, je třeba ověřit si lékové interakce alespoň pomocí on-line prostředků (např. na webu drugs.com/drug-interactions/mavacamten.html).
- Je také vhodné edukovat pacienty o interakci mavakamtenu s potravou. Nevhodná je grapefruitová šťáva, který vede ke středně silné inhibici CYP3A4, a dále produkty z třezalky tečkované, jež jsou silným induktorem CYP2C19 i CYP3A4.
- Jsou nutné frekventní echokardiografické kontroly, zpočátku v měsíčních intervalech, dále trvale v 3měsíčních intervalech. Pokud by nemocný nechtěl nebo z logistických důvodů nemohl tyto kontroly absolvovat, je třeba volit jiné léčebné metody.
- Mavakamten není vhodný pro ženy fertilního věku, které plánují graviditu. U těchto pacientek je lepší v indikovaných případech provést invazivní septální ablaci před plánováním gravidity.
Zvláštní upozornění
SPC obsahují následující zvláštní upozornění (15):
Hlavní z nich se týká rizika vzniku systolické dysfunkce LKS. Je zdůrazněn možný výskyt dysfunkce LKS při interkurentních onemocněních, jako jsou infekce a arytmie, a kromě toho také riziko srdečního selhání u pacientů, kteří podstupují velkou operaci srdce. Na vznik srdečního selhání má kromě symptomů a echokardiografie vliv také vzestup NT-proBNP, jehož hladina za normálních okolností při léčbě mavakamtenem klesá.
Druhým důležitým upozorněním je informace o riziku srdečního selhání nebo ztráty odpovědi na mavakamten v důsledku lékových interakcí, jež jsou podrobně rozebrány v SPC (15).
Třetí zvláštní upozornění se týká současného použití negativně inotropních léčiv. Bezpečnost současného použití mavakamtenu s disopyramidem nebo použití mavakamtenu u pacientů užívajících betablokátory v kombinaci s verapamilem či diltiazemem není doložena.
Čtvrté zvláštní upozornění se poukazuje na embryofetální toxicitu, která již byla zmíněna v předchozím textu.
Závěr
Inhibitor srdečního myosinu mavakamten představuje důležitou novinkou v léčbě obstrukční formy hypertrofické kardiomyopatie. Specificky zasahuje do patofyziologie sarkomerové formy HCM. Významně zlepšuje symptomatologii a toleranci zátěže, dále snižuje gradient ve výtokovém traktu levé komory srdeční a potřebu invazivní septální ablace. Byl proto zařazen do algoritmu léčby obstrukční formy HCM při selhání konvenční farmakoterapie.
Prezentovaný případ spolu s výsledky extenze studie Explorer-HCM ukazuje, že dlouhodobá léčba mavakamtenem je u pacientů s obstrukční HCM efektivní a bezpečná. Při jeho podávání je ovšem třeba dodržet řadu podmínek. Nezbytné je pečlivé echokardiografické sledování k nastavení dávky léku a záchytu poklesů EF LK na < 50 %, které vyžadují alespoň dočasné přerušení léčby. Zásadní je genotypizace izoenzymu CYP2C19 k volbě startovací a maximální dávky léku. Dále je důležité sledování interakcí s jinými léky a stravou. Ženy ve fertilním věku mohou mavakamten začít užívat jen za předpokladu negativního těhotenského testu a vysoce efektivní antikoncepce.
doc. MUDr. Miloš Kubánek, Ph.D.
Klinika kardiologie IKEM, PrahaLiteratura:
1. Arbelo E, Protonotarios A, Gimeno JR et al. 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J 2023; 44 (37): 3503–3626.
2. Marian AJ, Braunwald E. Hypertrophic cardiomyopathy: genetics, pathogenesis, clinical manifestations, diagnosis, and therapy. Circ Res 2017; 121 (7): 749–770.
3. Maron MS, Olivotto I, Betocchi S et al. Effect of left ventricular outflow tract obstruction on clinical outcome in hypertrophic cardiomyopathy. N Engl J Med 2003; 348 (4): 295–303.
4. Kubánek M. Nové postupy v diagnostice hypertrofické kardiomyopatie. Vnitřní lékařství 2024; 70 (6): 376–383.
5. Kubánek M. Novinky v patofyziologii a léčbě hypertrofické kardiomyopatie. Vnitřní lékařství 2024; 70 (2): 113–119.
6. Spudich JA. Hypertrophic and dilated cardiomyopathy: four decades of basic research on muscle lead to potential therapeutic approaches to these devastating genetic diseases. Biophys J 2014; 106 (6): 1236–1249.
7. Adhikari AS, Trivedi DV, Sarkar SS et al. β-cardiac myosin hypertrophic cardiomyopathy mutations release sequestered heads and increase enzymatic activity. Nat Commun 2019; 10 (1): 2685.
8. Green EM, Wakimoto H, Anderson RL et al. A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. Science 2016; 351 (6273): 617–621.
9. Toepfer CN, Garfinkel AC, Venturini G et al. Myosin sequestration regulates sarcomere function, cardiomyocyte energetics, and metabolism, informing the pathogenesis of hypertrophic cardiomyopathy. Circulation 2020; 141 (10): 828–842.
10. Braunwald E, Saberi S, Abraham TP et al. Mavacamten: a first-in-class myosin inhibitor for obstructive hypertrophic cardiomyopathy. Eur Heart J 2023; 44 (44): 4622–4633.
11. Olivotto I, Oreziak A, Barriales-Villa R et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2020; 396 : 759–769.
12. Desai MY, Owens A, Geske JB et al. Myosin inhibition in patients with obstructive hypertrophic cardiomyopathy referred for septal reduction therapy. J Am Coll Cardiol 2022; 80 : 95–108.
13. Desai MY, Owens AT, Geske JB et al. Dose-blinded myosin inhibition in patients with obstructive HCM referred for septal reduction therapy: outcomes through 32-weeks. Circulation 2023; 147 : 850–863.
14. Garcia-Pavia P, Oręziak A, Masri A et al. Long-term effect of mavacamten in obstructive hypertrophic cardiomyopathy. Eur Heart J 2024 Sep 1: ehae579.
15. SPC Camzyos. Dostupné na: https://prehledy.sukl.cz/prehled_leciv.html#/detail-reg/02717913500-CZ-2400099
Zkrácené informace o přípravku naleznete zde
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Interní lékařství Kardiologie
Nejnovější kurzy
Autoři: doc. MUDr. David Zemánek, Ph.D., MUDr. Anna Chaloupka, Ph.D.
Přejít do kurzů
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




