-
Medical journals
- Career
Dopplerovské ultrazvukové vyšetření cévního řečiště penisu v klinické praxi – základní principy pro urology
: S. Derisavifard; B. Gilbert
: Urol List 2016; 14(1): 13-18
Dopplerovské ultrazvukové vyšetření cévního řečiště penisu je univerzální a levný test. Naším cílem je prezentovat vlastní zkušenosti a představit způsob provádění správné techniky a užívání správného nastavení pro dosažení maximálního užitku této diagnostické modality. Tento přehledový článek poskytuje zásadní informace týkající se využití penilního dopplerovského ultrazvukového vyšetření při diagnostice a léčbě erektilní dysfunkce, priapizmu, Peyronieho choroby a rovněž doplňkové role této modality při vyšetřování fraktur penisu, rezistence v penisu a uretrální striktury. Uvádíme základní principy dopplerovského ultrazvukového vyšetření v kontextu důkazů podporujících využití této modality při vyšetřování patologických stavů penisu.
Klíčová slova:
penilní dopplerovské ultrazvukové vyšetření, hodnocení erektilní dysfunkce, Peyronieho choroba, priapizmus, diagnózaÚvod
Ultrazvukové vyšetření (UZ) penisu se užívá primárně při vyšetřování pacientů s erektilní dysfunkcí (ED). Vzhledem k tomu, že vyšetření umožňuje zobrazit anatomické a funkční aspekty cévního řečiště penisu, zahrnuje jeho indikace i řadu dalších onemocnění, jako jsou např. vysokoprůtokový priapizmus, fraktura penisu, zúženiny močové trubice a močové kameny, divertikl močové trubice a rezistence v hluboko uložených tkáních penisu. Penilní dopplerovské ultrazvukové vyšetření (PDU) poskytuje informace o arteriálním průtoku a kvalitě venookluzivního mechanizmu, jejichž společná funkce je nezbytná pro zajištění uspokojivé erekce. Nejnovější publikace zaměřující se na PDU zdůrazňují roli této modality v rámci diagnostiky onemocnění věnčitých tepen v časném stadiu u mužů, u nichž se zpočátku manifestují pouze symptomy ED. Dále bylo zjištěno, že sonoelastografie umožňuje lépe ozřejmit Peyronieho plaky. UZ penisu představuje snadno dostupnou, minimálně invazivní a levnou zobrazovací modalitu pro hodnocení anatomie struktur v penisu a hodnocení funkční hemodynamiky.
Nastavení ultrazvukového vyšetření
V ideálním případě se UZ penisu provádí při frekvenci 7,5–18 MHz pomocí vysokofrekvenční lineární sondy, což zajišťuje zobrazení anatomie a cévního zásobení penisu při vysokém rozlišení. Nejdůležitějšími parametry PDU jsou nastavení zobrazení v B módu a barevné a spektrální dopplerovské zobrazení.
Pokud je k dispozici, rozdělené zobrazení na monitoru umožňuje snadné srovnání parametrů, jako jsou průměr cév, rychlost průtoku krve a index odporu na obou stranách.
Polohování a technika snímání
Před vyšetřením je pacient umístěn do polohy na zádech nebo dorzální litotomické polohy. Dorzální litotomická poloha umožňuje lepší ventrální a proximální vyšetření corpora cavernosa, zejména ve ztopořeném stavu.
Nejprve je proveden rutinní UZ penisu v příčném a podélném řezu na dorzální straně penisu. Cíl vyšetření spočívá v příčném a podélném zobrazení obou kavernózních těles dorzálně a spongiózního tělesa ventrálně podél celé délky penisu od báze až po proximální konec glans penis.
Corpora cavernosa jsou zobrazena dorzálně jako dvě homogenní, hypoechogenní cirkulární struktury uzavřené slabou (obvykle méně než 2 mm) hyperechogenní vrstvou tuniky albuginea [1]. Corpus spongiosum, lokalizované více ventrálně, je rovněž cirkulární homogenní struktura vykazující větší echogenicitu než corpora cavernosa. Spongiózní těleso lze nejlépe zobrazit umístěním sondy na ventrální stranu penisu. Vzhledem k tomu, že močová trubice je velmi snadno stlačitelná, je nutné při snímání této oblasti vyvíjet co nejmenší tlak. Při rutinním vyšetření ochablého penisu však lze všechna tři korporální tělesa adekvátně zobrazit pomocí jednoho dorzálního přístupu (obr. 1).
1. A. Normální levostranná a pravostranná corpora cavernosa (CC) a corpus spongiosum (CS) uprostřed těla penisu zobrazené pomocí sondy na ventrální straně ochablého penisu. B. Dorzální strana ochablého penisu na úrovni báze a C. ve střední části těla penisu. 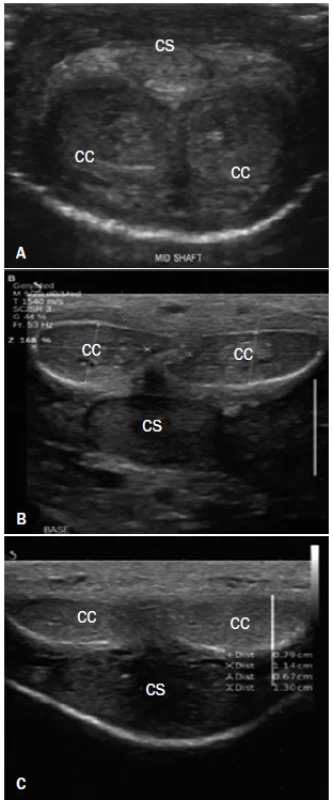
Počáteční přehledné vyšetření penisu je nezbytné pro identifikaci případných plaků, intrakavernózních lézí, patologií v močové trubici a abnormalit dorzálních penilních cév. Vyšetření se doporučuje provádět před vytvořením statických snímků, které dokumentují topořivá tělesa v proximální části (bázi), střední části a distální části (špička) penisu.
Dopplerovský úhel
Při PDU hraje zásadní roli tzv. dopplerovský úhel (angle of incidence nebo také insonation), pod kterým je sonda přiložena k penisu. Dopplerovský zdvih se užívá pro měření rychlosti krevního průtoku (obr. 2). Vyšetřující tak kontroluje dopplerovský úhel, což je úhel, který svírá ultrazvukový paprsek s vektorem krevního toku. Pokud se úhel blíží 90°, dopplerovský zdvih se blíží nule. Kalkulovaná rychlost krevního průtoku se pak rovněž artificiálně blíží nule. Pro nejpřesnější měření rychlosti proudu krve by se tedy dopplerovský úhel měl pohybovat v rozmezí 0–60°.
Obr. 2a. Dopplerovský zdvih je definován frekvencí vyslané (F<sub>T</sub>) a přijaté (F<sub>D</sub>) zvukové vlny, rychlostí průtoku krve (V<sub>BT</sub>), dopplerovským úhlem (Θ), a rychlostí šíření zvuku v tkáni (C). Zdvih je rovněž definován jako rozdíl frekvencí vyslané (F<sub>T</sub>) a přijaté (F<sub>D</sub>) zvukové vlny, který rovněž přímo koreluje s rychlostí toku krve (V<sub>BT</sub>), cosinem Dopplerovského úhlu (Θ) a je nepřímo úměrný rychlosti šíření zvuku ve tkáni (C). 
Obr. 2b. Dopplerovský úhel – Změna Dopplerovy frekvence (ΔF) je přímo úměrná dopplerovskému úhlu (Θ), který musí být pro přesné měření rychlosti průtoku krve < 60°. 
PDU a erektilní dysfunkce
Při vyšetřování ED má PDU zásadní roli při hodnocení kavernózních arterií, které se nacházejí uvnitř corpora cavernosa. Barevné dopplerovské vyšetření penisu se doporučuje provádět v příčné i podélné rovině. Pomocí příčného zobrazení se hodnotí hloubka kavernózních arterií, zatímco pomocí longitudinálního zobrazení se stanoví jejich průměr, který se obvykle v ochablém penisu pohybuje v rozmezí 0,2–1 mm [2]. Na základě maximální systolické rychlosti (peak systolic flow velocity – PSV) a konečné diastolické rychlosti (end-diastolic flow velocity – EDV) se následně spočítá odporový index (resistive index – RI) kavernózní arterie. V různých místech probíhající arterie může být naměřena rozdílná PSV. Obecně platí, že čím více proximálně se měření provádí, tím vyšší je rychlost průtoku [3]. Měření PSV a EDV se tedy obvykle provádí na rozhraní proximální třetiny a distálních dvou třetin těla penisu. PSV kavernózní arterie penisu v ochablém stavu se obvykle pohybuje mezi 5 a 15 cm/s. Následně by měly být výchozí hodnoty porovnány s údaji naměřenými při medikamentózně navozené erekci [4].
Dále je pacientovi intrakavernózně aplikována vazoaktivní látka (intracavernosal injection with a vasoactive agent – ICI). Laterální aspekt těla penisu je očištěn alkoholem nebo jodovým roztokem na úrovni třetí nebo deváté hodiny ciferníku. Přesně odměřená dávka vazoaktivní látky je poté injekčně aplikována do jednoho korporálního tělesa podél distálních dvou třetin těla penisu. Medikace by se měla natáhnout do 1mm stříkačky a aplikovat pomocí 29G nebo 30G jehly. Aby nedošlo ke vzniku hematomu, je třeba v místě vpichu 1–2 min po aplikaci injekce vyvíjet tlak.
Pro farmakologickou stimulaci erekce lze užívat následující vazoaktivní látky: prostaglandin E1 (PGE), papaverin nebo TriMix (papaverin 30 mg/ml; fentolamin 1 mg/ml; PGE1 10 µg/ml). Před injekcí je třeba pacienta poučit o riziku vzniku nízkoprůtokového priapizmu a jak v tomto případě postupovat [5]. Množství aplikované vazoaktivní látky je individuální. Např. u pacientů s ED po radikální prostatektomii, kteří měli před operací normální erekci, stačí velmi malá dávka kolem 0,05 ml standardního TriMixu. U pacientů s ED a se závažným kardiovaskulárním onemocněním a rizikovými faktory je vhodnější mnohem vyšší počáteční dávka (0,2 ml) [6].
Po aplikaci ICI se v různých intervalech opět měří průměr kavernózní arterie a rychlost průtoku krve a na základě těchto údajů je stanovena pacientova reakce na farmakologickou stimulaci (obr. 3). U pacientů, u nichž po injekci vazoaktivní látky dojde ke vzniku nízkoprůtokového priapizmu, je obvykle pro vyřešení priapizmu dostačující intrakorporální injekce fenylefrinu, aspirace a irigace.
2. Kavernózní arterie 15 min po injekční aplikaci TriMixu. Směr toku krve při dopplerovském nastavení. Zobrazeny jsou následující parametry: průměr arterie (0,89 mm), PSV (20,6 cm/s), EDV (8,9 cm/s) a kalkulovaný RI (0,57). Úhel vyšetřovací sondy je 60°. Pro optimální měření je vzdálenost mezi kalipery přizpůsobena 3/4 šíře arterie. 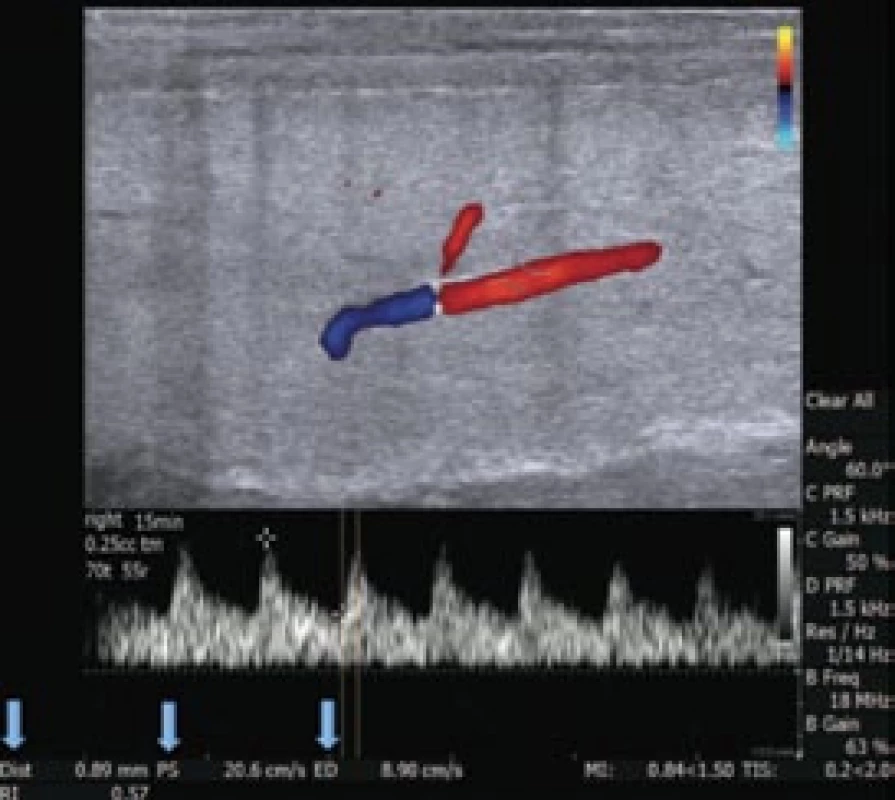
PSV – maximální rychlost systolického průtoku, EDV – konečná diastolická rychlost, RI – odporový index Arteriogenní erektilní dysfunkce
PSV představuje nejpřesnější marker arteriálního onemocnění jako příčiny ED. U zdravých jedinců bez ED se normální hodnota PSV po ICI pohybuje v průměru mezi 35 a 47 cm/s. PSV ≥ 35cm/s nasvědčuje arteriální dostatečnosti po farmakostimulaci [7]. V rozmezí 25–35 cm/s lze výsledek PSV považovat za nejednoznačný. V této kategorii lze považovat asymetrii průtoku > 10 cm/s mezi oběma kavernózními arteriemi za možnou fokální stenózu. Kavernózo-spongiózní reverzní toky naznačují nedostatečnou odpověď [8]. Arteriogenní ED je definována jako PSV < 25 cm/s, dilatace kavernózní arterie < 75 % původní hodnoty nebo čas zrychlení více než 100 ms [7].
Venookluzivní erektilní dysfunkce
Venookluzivní ED je diagnostikována pomocí EDV a RI při absenci jakéhokoli typu arteriální dysfunkce. V případě venózního úniku je EDV vždy více než 0 [9]. Jako definitivní průkaz venózního úniku slouží dynamická infuzní kavernosografie a kavernosometrie. U 95 % pacientů ukazuje RI 0,75 při PDU 20 min po maximální farmakostimulaci na přítomnost venózního úniku [10]. U pacienta s úplně ztopořeným penisem bez venózního úniku se EDV blíží nule a RI by měla dosahovat nebo překročit (v případě reverzního toku) 1,0. U pacientů s RI > 1,0 se doporučuje po ICI delší sledování kvůli riziku vzniku priapizmu [11].
Erektilní dysfunkce a kardiovaskulární onemocnění
Jak ukázalo několik populačních studií, arteriogenní ED přímo souvisí s onemocněním věnčitých tepen i periferním cévním onemocněním [12,13]. Předpokládá se, že narušená signální dráha oxidu dusnatého arteriální vazodilatace, která je při poškození endotelu zodpovědná za vznik kardiovaskulárních onemocnění, přispívá stejnou měrou i k ED. Na vzniku arteriogenní ED se podílejí i běžné rizikové faktory kardiovaskulárních onemocnění (tj. kouření, hypertenze, hyperlipidemie atd.) [14]. U pacientů se závažným cévním onemocněním se po aplikaci ICI průměr kavernózní arterie zvětší o méně než 75 % a celkový průměr výjimečně překračuje 0,7 mm [15]. Bylo zjištěno, že hodnoty PSV naměřené v ochablém stavu < 13 cm/s predikují následující hodnoty PSV po stimulaci pomocí vazoaktivní látky: < 25 cm/s (s 89% přesností) a < 35 cm/s (s 82% přesností). Na základě hodnot PSV < 13 cm/s lze navíc usuzovat narušený průtok věnčitými tepnami s 80% přesností (p < 0,05) [16].
UZ v B módu může ukázat na přítomnost endoteliální dysfunkce, arteriální insuficience a aterosklerotického onemocnění [17]. U mužů s ED byl prokázán větší výskyt rozsáhlejších plaků a ztluštění muscularis intima media intrakavernózních arterií (IMT) (více než 0,3 mm) než u mužů bez ED. Tato hranice více než 0,3 mm vykazuje vyšší senzitivitu a specificitu než PSV při predikci postižení karotických a femorálních cév [18].
Vzhledem k důkazům prokazujícím souvislost mezi ED a kardiovaskulárním onemocněním nabízí ED časovou výhodu v diagnostikování a následné léčbě počátečních stadií jinak klinicky němého kardiovaskulárního onemocnění [12]. Časným diagnostikováním vaskulogenní ED tak lze předejít signifikantní morbiditě související s kardiovaskulárním onemocněním (díky identifikaci a léčbě souvisejících rizikových faktorů) [19]. Pacientům, u nichž je po maximální dávce vazoaktivní látky naměřena maximální PSV < 24cm/s, tedy doporučujeme kompletní kardiovaskulární vyšetření.
Priapizmus
Priapizmus se dělí na dva typy: nízkoprůtokový (ischemický) nebo vysokoprůtokový (arteriální). PDU lze užít pro rozlišení obou forem. Vysokoprůtokový priapizmus vzniká v důsledku pánevního nebo perineálního traumatu, při němž dojde k vytvoření píštěle mezi kavernózní arterií a lakunami corpus cavernosum (obr. 4). PDU umožňuje lokalizovat zdroj vysokoprůtokového priapizmu, a může tak urychlit indikaci definitivní léčby v podobě selektivní angioembolizace [20]. U těchto pacientů prokáže PDU přítomnost píštěle v podobě hypoechogenní léze ohraničené echogenní kavernózní tkání. V této oblasti je uvnitř kavernózních arterií detekován výrazný průtok krve s turbulentním charakterem toku. Naopak u pacientů s nízkoprůtokovým priapizmem prokáže PDU absenci vysokého arteriálního průtoku. U intermitentního priapizmu je v ochablém stavu naměřena trvale pozitivní diastolická rychlost (2–7 cm/s) ve srovnání s normální kontrolní skupinou (0–2 cm/s) [21].
3. Nález na barevném dopplerovském a spektrálním ultrazvuku u pacienta s vysokoprůtokovým priapizmem ukazuje maximální systolickou a nejvyšší konečnou diastolickou rychlost v kavernózní arterii (CA) zásobující arteriovenózní píštěl (AVF). 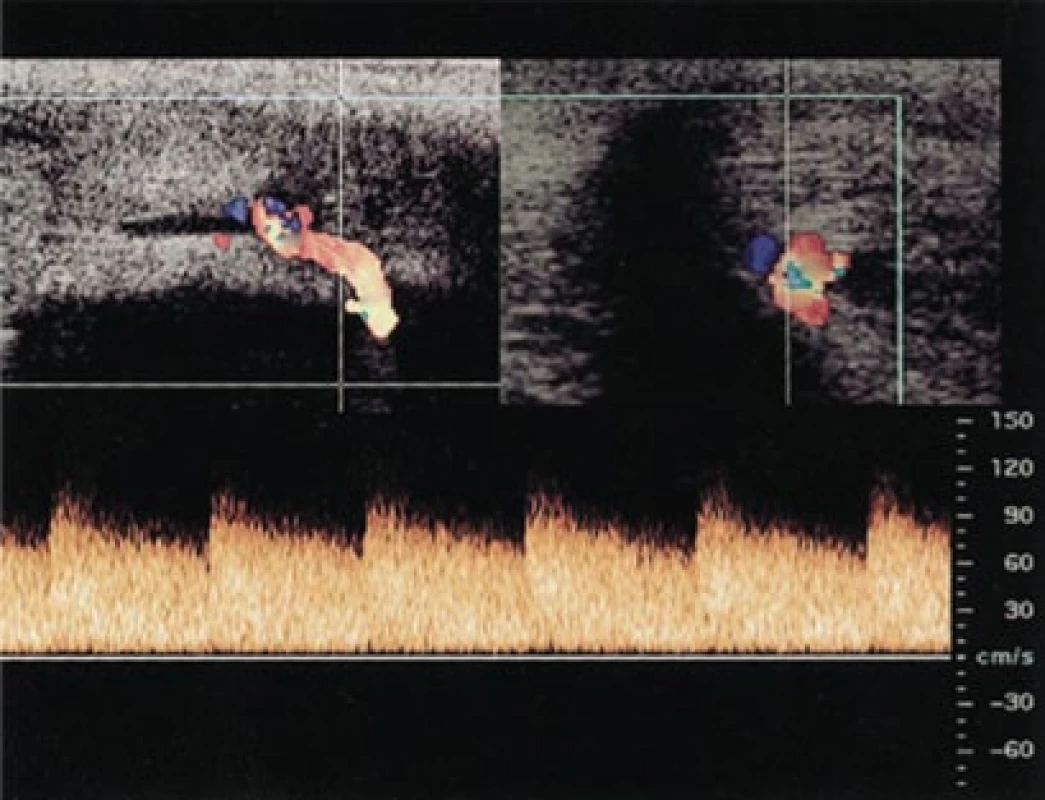
Peyronieho choroba
Obvyklý postup u pacientů s Peyronieho chorobou zahrnuje odebrání kompletní lékařské anamnézy, fyzikální vyšetření a UZ. Fibrotický plak charakteristický pro toto onemocnění se jeví jako nepravidelná hypo - nebo hyperechogenní oblast se zesílenou tunikou albuginea v postižených oblastech [22]. V plaku mohou být přítomny kalcifikace, které se na UZ jeví jako zřetelné hyperechogenní oblasti s posteriorním stínem. Kalcifikace plaku nemusí nutně vyjadřovat stupeň vyzrálosti nebo stabilizace onemocnění, rozsáhlá kalcifikace však bude s větší pravděpodobností vyžadovat v budoucnosti korekční operaci nebo použití štěpu [23]. Při PDU ukazuje hyperperfuze v oblasti kolem plaku na aktivní zánět. UZ může potvrdit přesnou polohu plaku odhadovanou při fyzikálním vyšetření a pomoci při přesné dokumentaci onemocnění. Mezi nejnovější techniky v této oblasti, které mohou najít uplatnění při vyšetřování pacientů s Peyronieho chorobou, patří sonoelastografie a zobrazení elasticity tkáně. Podobně jako při PDU se nález zobrazí v barevné škále, barva v tomto případě nevyjadřuje průtok, ale měkkost nebo tvrdost tkáně. Tímto způsobem je možné identifikovat menší nebo hlouběji uložené plaky, méně zřetelné při fyzikálním vyšetření, které lze potenciálně léčit pomocí injekční terapie [24].
ED často doprovází Peyronieho chorobu. Nejčastěji onemocnění souvisí s venookluzivní insuficiencí vyvolanou přítomností fibrotických plaků, byly prokázány i případy arteriální insuficience nebo smíšené cévní etiologie [25]. UZ tak představuje užitečný nástroj při volbě nejvhodnější modality podle individuálních okolností. Jak již bylo uvedeno, vaskulogenní příčinu ED se doporučuje vyšetřovat a řešit pomocí UZ. V případě, že farmakoterapie ani intrakavernózní injekce nedokáží zajistit dostatečnou erekci, doporučuje se zvážit implantaci penilní protézy.
Další možnosti využití
UZ je snadno dostupná a rovněž levná zobrazovací modalita. Vyšetření umožňuje potvrdit přítomnost penilní patologie a diagnostikovat celou řadu urologických onemocnění (kromě těch zmiňovaných výše). U pacientů s frakturou penisu může PDU pomoci upřesnit diagnózu v nejednoznačných případech, a urychlit tak časnou operační léčbu [26]. PDU má svou roli rovněž při monitorování procesu hojení, resorpci hematomu a obnově krevního průtoku a erektilní funkce během kontrolních vyšetření. V případě trombózy dorzální penilní žíly nebo tromboflebidity (morbus Mondor) prokáže UZ okluzi žíly bez jakýchkoli známek krevního průtoku. Při monitorování ústupu flebitidy, k němuž obvykle dojde spontánně po obnově krevního průtoku po 6–8 týdnech, je nezbytné zobrazovací vyšetření opakovat [27].
Maligní onemocnění na penisu se vyskytují poměrně vzácně a mohou se manifestovat v podobě primární léze invadující do hlubších tkání nebo metastazujících lézí. Na UZ se primární karcinom penisu jeví jako hypoechogenní oblast se špatně definovanými okraji a zvýšeným průtokem krve ve srovnání s okolními tkáněmi. Je velmi důležité stanovit, zda tumor zasahuje do tuniky albuginea nebo topořivých těles [28]. Metastatické šíření z jiných primárních neoplazmat do penisu je velmi ojedinělý jev, byly však popsány případy u pacientů s karcinomem prostaty, rekta i lymfomy. Na UZ se tyto léze jeví jako hypoechogenní oblasti s hyperperfuzí podobně jako v případě primárního karcinomu penisu, na rozdíl od primárního karcinomu však metastatické léze vzácně postihují kůži a obvykle jsou dobře ohraničené [29].
Za zlatý standard mezi zobrazovacími modalitami pro vyšetření poranění močové trubice se považuje retrográdní uretrografie. UZ penisu však poskytuje přesnější údaj o délce striktury a průměru anteriorní části močové trubice [30]. UZ penisu navíc umožňuje mnohem lépe přehlédnout spongiózní tkáň, která obklopuje poranění, díky lepšímu zobrazení perfuze této tkáně (obr. 5), a tak poskytuje benefit oproti klasickému uretrogramu [31]. Striktura se jeví jako hyperechogenní oblast se známkami dopplerovského průtoku v případě hyperemie v důsledku zánětu a bez známek dopplerovského průtoku v případě fibrózy. Distenze močové trubice pomocí fyziologického roztoku nebo lubrikačního gelu umožňuje správně identifikovat přesnou lokalizaci striktury a vyšetřit potenciální výskyt divertiklu nebo cyst. Aplikované médium umožňuje více kontrastní zobrazení těchto struktur s větší senzitivitou. UZ rovněž umožní snadno potvrdit obstrukci způsobenou cizími tělesy nebo močovými kameny zaklíněnými v močové trubici, předpokládanou na základě anamnézy a fyzikálního vyšetření [32].
Obr. 5a. Uretrální striktura (šipka) při sonouretrografii. 
Obr. 5b. Sonouretrografie v kombinaci s barevným dopplerovským vyšetřením. Povšimněte si detailu perfuze při zobrazení pomocí sonouretrografie. 
Závěr
UZ penisu představuje univerzální, levnou a snadno dostupnou zobrazovací modalitu pro hodnocení anatomie, patologie a fyziologie penisu. Při správném porozumění statickým i dynamickým principům představuje toto vyšetření nenahraditelnou pomůcku pro diagnostiku i léčbu poruch, jako jsou např. ED, Peyronieho onemocnění, trauma, rezistence nebo striktury. Nejnovější technologie, jako např. sonoelastografie, jsou důkazem neustálého zdokonalování UZ, což v budoucnu poskytne další benefity při vyšetřování onemocnění penisu.
Vysvětlení termínů
ED – erektilní dysfunkce
PDU – penilní dopplerovské ultrazvukové vyšetření
RI – odporový index
PSV – maximální rychlost systolického průtoku
EDV – konečná diastolická rychlost
ICI – intrakavernózní injekce vazoaktivní látky
CAD – onemocnění věnčitých tepen
PVD – periferní cévní onemocněníBruce Gilbert, MD, PhD
The Arthur Smith Institute for Urology
Hofstra North Shore-Long Island Jewish School of Medicine
450 Lakeville Road
New Hyde Park, NY 11042
USA
bgilbert@gmail.com
Sources
1. Doubilet PM, Benson CB, Silverman SG et al. The penis. Semin Ultrasound CT MR 1991; 12(2): 157–175.
2. Patel U, Lees WR. Penile sonography. In: Solibiati L, Rizzzatto G (eds). Ultrasound of Superficial Structures. London: Churchill Livingstone 1995; 229–242.
3. Kim, SH, Paick JS, Lee SE et al. Doppler sonography of deep cavernosal artery of the penis: variation of peak systolic velocity according to sampling location. J Ultrasound Med 1994; 13(8): 591–594.
4. Roy C, Saussine C, Tuchmann C et al. Duplex Doppler sonography of the flaccid penis: potential role in the evaluation of impotence. J Clin Ultrasound 2000; 28(6): 290–294.
5. Patel U, Amin Z, Friedman E et al. Colour flow and spectral Doppler imaging after papaverine-induced penile erection in 220 impotent men: study of temporal patterns and the importance of repeated sampling, velocity asymmetry and vascular anomalies. Clin Radiol 1993; 48(1): 18–24.
6. van Ahlen H, Peskar BA, Sticht G et al. Pharmacokinetics of vasoactive substances administered into the human corpus cavernosum. J Urol 1994; 151(5): 1227–1230.
7. Broderick GA, Lue TF. The penile blood flow study: evaluation of vasculogenic impotence. In: Jonas U, Thon WF, Stief CG (eds). Erectile dysfunction. Berlin: Springer-Verlag Berlin Heidelberg 1991 : 1224.
8. Benson CB, Aruny JE, Vickers MA Jr. Correlation of duplex sonography with arteriography in patients with erectile dysfunction. AJR Am J Roentgenol 1993; 160(1): 71–73.
9. Bassiouny HS, Levine LA. Penile duplex sonography in the diagnosis of venogenic impotence. J Vasc Surg 1991; 13(1): 75–83.
10. Naroda T, Yamanaka M, Matsushita K et al. Clinical studies for venogenic impotence with color Doppler ultrasonography – evaluation of resistance index of the cavernous artery. Nippon Hinyokika Gakkai Zasshi 1996; 87(11): 1231–1235.
11. Cormio L, Bettocchi C, Ricapito V et al. Resistance index as a prognostic factor for prolonged erection after penile dynamic colour Doppler ultrasonography. Eur Urol 1998; 33(1): 94–97.
12. Feldman HA, Johannes CB, Derby CA et al. Erectile dysfunction and coronary risk factors: prospective results from the Massachusetts male aging study. Prev Med 2000; 30(4): 328–338.
13. Blumentals WA, Gomez-Caminero A, Joo S et al. Should erectile dysfunction be considered as a marker for acute myocardial infarction? Results from a retrospective cohort study. Int J Impot Res 2004; 16(4): 350–353.
14. Sullivan ME, Thompson CS, Dashwood MR et al. Nitric oxide and penile erection: is erectile dysfunction another manifestation of vascular disease? Cardiovasc Res 1999; 43(3): 658–665.
15. Mueller SC, Lue TF. Evaluation of vasculogenic impotence. Urol Clin North Am 1988; 15(1): 65–76.
16. Corona G, Fagioli G, Mannucci E et al. Penile doppler ultrasound in patients with erectile dysfunction (ED): role of peak systolic velocity measured in the flaccid state in predicting arteriogenic ED and silent coronary artery disease. J Sex Med 2008; 5(11): 2623–2634. doi: 10.1111/j.1743-6109.2008.00982.x.
17. Rocha-Singh KJ, Zeller T, Jaff MR. Peripheral arterial calcification: prevalence, mechanism, detection, and clinical implications. Catheter Cardiovasc Interv 2014; 83(6): E212–220. doi: 10.1002/ccd.25387.
18. Caretta N, Palego P, Schipilliti M et al. Cavernous artery intima-media thickness: a new parameter in the diagnosis of vascular erectile dysfunction. J Sex Med 2009; 6(4): 1117–1126. doi: 10.1111/j.1743-6109.2008.01112.x.
19. Shin D, Pregenzer G Jr, Gardin JM. Erectile dysfunction: a disease marker for cardiovascular disease. Cardiol Rev 2011; 19(1): 5–11. doi: 10.1097/CRD.0b013e3181fb7eb8.
20. Kang BC, Lee DY, Byun JY et al. Post-traumatic arterial priapism: colour Doppler examination and superselective arterial embolization. Clin Radiol 1998; 53(11): 830–834.
21. Patel U, Sujenthiran A, Watkin N. Penile Doppler ultrasound in men with stuttering priapism and sickle cell disease – a labile baseline diastolic velocity is a characteristic finding. J Sex Med 2015; 12(2): 549–556. doi: 10.1111/jsm.12756.
22. Brock G, Hsu GL, Nunes L et al. The anatomy of the tunica albuginea in the normal penis and Peyronie’s disease. J Urol 1997; 157(1): 276–281.
23. Levine L, Rybak J, Corder C et al. Peyronie’s disease plaque calcification – prevalence, time to identification and development of a new grading classification. J Sex Med 2013; 10(12): 3121–3128. doi: 10.1111/jsm.12334.
24. Richards G, Goldenberg E, Pek H et al. Penile sonoelastography for the localization of a non-palpable, non-sonographically visualized lesion in a patient with penile curvature from Peyronie’s Disease. J Sex Med 2014; 11(2): 516–520. doi: 10.1111/jsm.12396.
25. Kadioglu A, Tefekli A, Erol H et al. Color Doppler ultrasound assessment of penile vascular system in men with Peyronie’s disease. Int J Impot Res 2000; 12(5): 263–267.
26. Asgari MA et al. Penile fractures: evaluation, therapeutic approaches and long-term results. J Urol 1996; 155(1): 148–149.
27. Dicuio M, Pomara G, Ales V et al. Doppler ultrasonography in a young patient with penile Mondor’s disease. Arch Ital Urol Androl 2005; 77(1): 58–59.
28. Horenblas S, Kröger R, Gallee MP et al. Ultrasound in squamous cell carcinoma of the penis; a useful addition to clinical staging? A comparison of ultrasound with histopathology. Urology 1994; 43(5): 702–707.
29. Lan SK, Lin CW, Ho HC et al. Penile metastasis secondary to nasal NK/T-cell lymphoma. Urology 2008; 72(5): 1014–1015. doi: 10.1016/j.urology.2008.05.029.
30. Gallentine ML, Morey AF. Imaging of the male urethra for stricture disease. Urol Clin North Am 2002; 29(2): 361–372.
31. Morey AF, McAninch JW. Sonographic staging of anterior urethral strictures. J Urol 2000; 163(4): 1070–1075.
32. Kim B, Kawashima A, LeRoy AJ. Imaging of the male urethra. Semin Ultrasound CT MR 2007; 28(4): 258–273.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2016 Issue 1-
All articles in this issue
- Partial nephrectomy – review update of indications, risks and surgical approach advances
- Female urethral diverticulum – a difficult diagnosis and a big challenge for the surgeon
- Penile doppler ultrasound in clinical practice – a primer for urologists
- The use of robotic technology in female pelvic floor reconstruction
- Bone formation in renal tumors – unraveling the mystery
- Penile cancer and penile sparing surgery – current concepts
- Bladder cancer and smoking – a review article
- Treatment of moderate to severe lower urinary tract symptoms associated with benign prostatic hyperplasia
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Female urethral diverticulum – a difficult diagnosis and a big challenge for the surgeon
- Penile doppler ultrasound in clinical practice – a primer for urologists
- Penile cancer and penile sparing surgery – current concepts
- The use of robotic technology in female pelvic floor reconstruction
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

