-
Medical journals
- Career
Léčba hyperaktivního měchýře u žen
Authors: J. Krhut; O. Havránek
Authors‘ workplace: Urologické oddělení FN Ostrava – Poruba
Published in: Urol List 2009; 7(4): 55-58
Overview
Pojem hyperaktivní měchýř (OAB – overactive bladder) označuje komplex symptomů dolních močových cest charakterizovaný závažnou urgencí zpravidla provázenou i frekventním močením s urgentní inkontinencí nebo bez ní. OAB patří k nejčastějším zdravotním problémům, jeho prevalence se odhaduje na 16 % dospělé populace v Evropě. OAB má zásadní dopad na kvalitu života, proto je mu v poslední době věnována velká pozornost. Cílem práce je podat přehled poznatků v oblasti patofyziologie, diagnostiky a zejména terapie hyperaktivního měchýře.
Klíčová slova:
hyperaktivní měchýř, muskarinové receptory, farmakoterapie, anticholinergikaDEFINICE HYPERAKTIVNÍHO MĚCHÝŘE
Hyperaktivní měchýř (overactive bladder – OAB) je definován jako soubor symptomů ukazujících na možnou dysfunkci dolních močových cest. Charakteristickým symptomem je závažná urgence, zpravidla doprovázená frekvencemi, nykturiemi, v některých případech rovněž urgentní inkontinencí.
Urgence je definována jako náhle vzniklý pocit silného nucení na močení, kterému nelze odolat. Urgence je považována za vedoucí symptom OAB – většinou až sekundárně v závislosti na urgencích se rozvíjí symptomy další (frekvence, nykturie, urgentní inkontinence). Frekvenci definujeme jako močení častější než osmkrát v průběhu 24 hod.
Za nykturii je považována každá epizoda močení, která přeruší spánek.
Urgentní inkontinence je definována jako únik moči spojený s neodolatelným pocitem nucení na močení. V poslední době je prosazován termín mokrý hyperaktivní měchýř (wett OAB) pro případy, kdy je součástí symptomů OAB urgentní inkontinence, naopak termínem suchý hyperaktivní měchýř (dry OAB) užíváme, pokud urgentní inkontinence v komplexu symptomů OAB chybí. Komplex symptomů hyperaktivního měchýře je třeba vnímat v kontextu symptomů dolních močových cest (DMC) podle definice mezinárodní společnosti pro kontinenci (International Continence Society – ICS) (Tab. 1).
Table 1. Symptomy dolních cest močových. 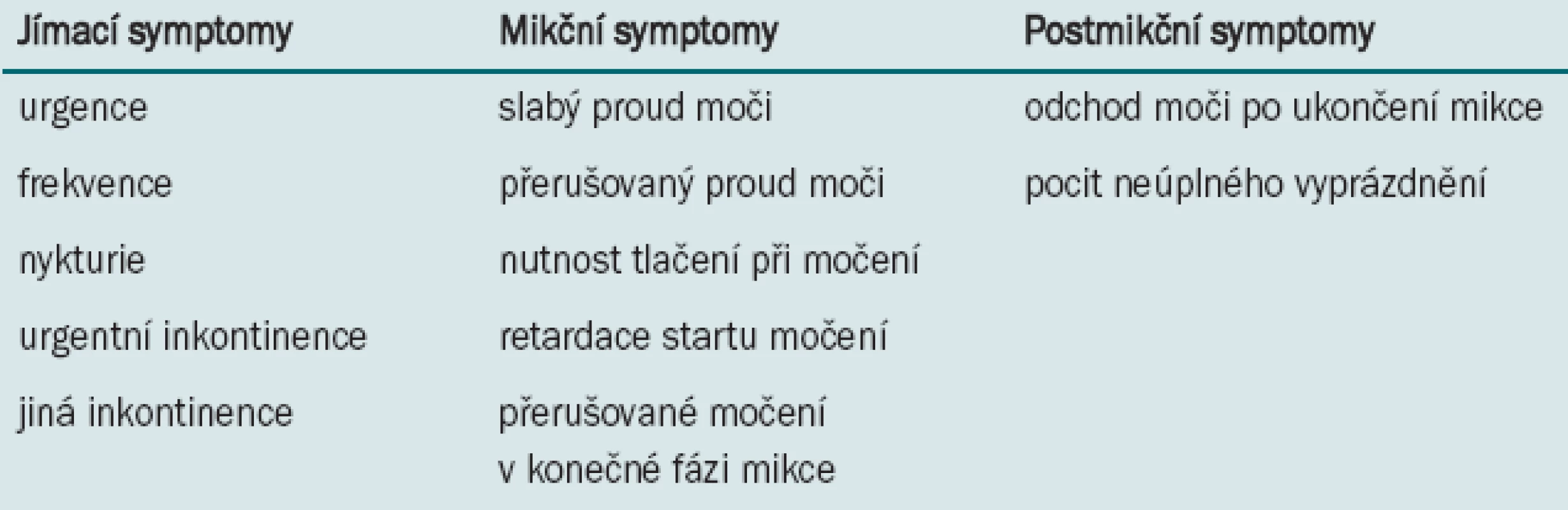
PREVALENCE HYPERAKTIVNÍHO MĚCHÝŘE
Symptomy hyperaktivního měchýře trpí podle posledních průzkumů asi 16–17 % evropské dospělé populace [1]. Podobný výskyt udává i Stewart ve Spojených státech [2].
Muži i ženy jsou postiženi stejně často, u žen se však symptomy OAB začínají projevovat významně dříve. Ve všech dosavadních epidemiologických studiích byla prokázána jednoznačná korelace prevalence OAB s narůstajícím věkem. Milsom udává v longitudinální studii u dospělých žen sledovaných kontinuálně po 16 let (v období 1991–2007) roční incidenci symptomů OAB 20 %. Prevalence symptomů OAB narostla ve sledovaném období o 9 % [3].
Tyto údaje potvrzují, že OAB je jedním z nejčastějších zdravotních problémů současné dospělé populace.
PATOFYZIOLOGIE HYPERAKTIVNÍHO MĚCHÝŘE
V patogenezi hyperaktivního měchýře hraje nejspíše roli porucha aferentní inervace močového měchýře. Spekuluje se rovněž o roli poruchy funkce urotelu v etiopatogenezi OAB.
DIAGNOSTIKA HYPERAKTIVNÍHO MĚCHÝŘE
Mezi obligatorní součásti diagnostiky OAB patří anamnéza, mikční kalendář, vyšetření moči celkově a kultivačně, uroflowmetrie se stanovením postmikčního rezidua a u žen rovněž lokální urogynekologické vyšetření.
V současnosti lze využít v diagnostice též řady dotazníků zaměřených jednak na symptomy hyperaktivního měchýře, jednak na kvalitu života pacientů. Nejvhodnější jsou dotazníky Overactive Bladder Questionnaire (OAB-q), Incontinence Impact Questionnaire (IIQ) a Incontinence Quality of Life Questionnaire (I-QOL) [4].
V minulosti hojně používaný Gaudentzův dotazník je v současné době považován již za naprosto obsolentní.
Podtrhnout je třeba zejména význam mikčního kalendáře, do kterého pacient zaznamenává po dobu cca tří dnů čas a množství vypité tekutiny, čas a množství vymočené moči, počet urgencí, počet epizod inkontinence, počet spotřebovaných vložek atd.
Pomocí mikčního kalendáře můžeme velmi rychle získat přehled o frekvenci močení, množství urgencí a epizod urgentní inkontinence, funkční kapacitě močového měchýře, můžeme vyloučit polyurii a excesy v příjmu tekutin atd. Lze ji využít v behaviorální terapii OAB, slouží rovněž k posouzení efektivity terapie. V běžné praxi se používá dvou až třídenního mikčního kalendáře pro potřeby klinických studií a pro nejasné a atypické případy se doporučuje sedmidenní mikční kalendář.
Nedílnou součástí vyšetřovacího algoritmu OAB je vyšetření moči k vyloučení možných primárních příčin hyperaktivního měchýře (infekce, nádor).
Uroflowmetrie je základní vyšetřovací metodou v diagnostice dysfunkcí DMC včetně OAB. Je neinvazivní, snadno opakovatelná, jejím účelem je především vyloučení subvezikální obstrukce jako příčiny OAB.
Ke stanovení postmikčního rezidua využíváme většinou sonografii. Slouží především k vyloučení poruchy evakuace močového měchýře (subvezikální obstrukce, hypokontraktilita detruzoru). Donedávna se hlavní důraz v diagnostice hyperaktivního měchýře kladl na invazivní urodynamické vyšetřovací metody. V současné době vládne konsenzus v tom, že pacient by měl být vyšetřen nejprve metodami tzv. neinvazivní urodynamiky (mikční kalendář, lokální klinické vyšetření a uroflowmetrie se stanovením postmikčního rezidua).
Invazivní urodynamické vyšetření je indikováno u pacientů, u nichž je podezření na přítomnost neurogenní dysfunkce dolních cest močových, subvezikální obstrukce nebo hypokontraktility detruzoru, dále u pacientů, u nichž je zvažována invazivní terapie a konečně v případě neúspěchu léčby první volby.
TERAPIE HYPERAKTIVNÍHO MĚCHÝŘE
Behaviorální opatření
Doporučujeme redukci příjmu nápojů s obsahem kofeinu a redukci hmotnosti.
Cvičení svalů pánevního dna a mikční trénink
Základním teoretickým východiskem pro využití fyzioterapie v léčbě hyperaktivního měchýře je poznatek, že opakovaná volní kontrakce svalů pánevního dna může inhibovat kontrakci detruzoru. Cílem cvičení je proto dosažení schopnosti pacienta volně aktivovat pánevní dno a pomocí jeho kontrakce potlačit pocit nucení na močení. V první fázi je tedy nutno stejně jako u terapie stresové inkontinence naučit pacienta volně, cíleně a izolovaně aktivovat svaly pánevního dna. Ve chvíli, kdy toto dokáže, je možno přistoupit k další fázi terapie, kterou lze označit jako mikční trénink. Jeho základem je vedení mikčního kalendáře pacientem, který tak získá velmi přesnou informaci o mikčních intervalech a porcích. Ve druhé fázi doporučujeme pacientům mikci „podle hodin“ – stanovíme intervaly v rozmezí 15 min až 1 hod přiměřeně podle údajů získaných z mikčního kalendáře. Cílem je, aby se pacient snažil vydržet stanovený čas nemočit. Pocity nucení na močení se snaží překonat kontrakcí svalů pánevního dna. Ve třetí fázi pak nabádáme pacienty k vědomému prodlužování intervalů mezi močením za občasného vedení mikční karty, která umožňuje kontrolu dosažených výsledků.
Řada studií dokázala lepší efektivitu farmakoterapie v kombinaci s mikčním tréninkem oproti farmakoterapii samotné [5].
Farmakoterapie
Farmakoterapie je nejrozšířenější a nejúčinnější metodou léčby OAB. Podle současných poznatků působí anticholinergika především blokádou muskarinových receptorů urotelu a suburoteliálních myofibroblastů, čímž snižují uvolňování acetylcholinu z uroteliálních buněk, a následně tak ovlivňují aktivaci aferentních nervových struktur. To může též vysvětlovat, proč anticholinergika v terapeutických dávkách jen minimálně ovlivňují kontraktilitu detruzoru [6].
Oxybutynin působí primárně na muskatrinové receptory subtypů M1, M2 a M3 a kromě toho má i přímé spasmolytické účinky na buňky detruzoru.
Po perorálním podání je oxybutynin v žaludku velmi dobře absorbován, následuje však extenzivní „first-pass“ metabolizmus v játrech, při kterém je metabolizován z více než 90 % na aktivní N-desthyl-oxybutynin. Maximálních plazmatických koncentrací je dosahováno po cca 2 hod, biologický poločas je rovněž asi 2 hod, ale se širokou interindividuální variabilitou. Oxybutynin je hydrofilní, a proto prostupuje hematoencefalickou bariérou, což může mít za následek nežádoucí účinky na centrální nervový systém.
Největší metaanalýzu uveřejnil v roce 1998 Thüroff, který sumarizuje výsledky 15 randomizovaných multicentrických studií. Při léčbě oxybutyninem bylo dosaženo 52% redukce výskytu epizod urgentní inkontinence, počet mikcí za 24 hod se snížil o 33 %. Subjektivní zlepšení svého stavu udávalo 74 % (61–100 %) pacientů.
Problémem oxybutyninu je vysoká míra výskytu nežádoucích účinků. Thüroff ve výše citované metaanalýze uvádí výskyt nežádoucích účinků až 70 % (17–93 %). Nejčastějším a také nejhůře snášeným vedlejším účinkem je sucho v ústech, které vede až 25 % pacientů k ukončení léčby [7].
Dávkování oxybutyninu je 2–3 × 5 mg, ale zejména u geriatrických pacientů je s ohledem na možné kognitivní ovlivnění a další nežádoucí účinky mnohdy výhodné začít dávkou 1–2 × 2,5 mg a nejvýhodnější je dávku individuálně titrovat.
Další novou možností před nedávnem registrovanou i u nás je oxybutynin ve formě náplasti pro transdermální podání. Oxybutynin v náplasti obsahuje 3,9 mg účinné látky, což je dostatečné pro udržení trvalého transportu pro interval dávkování každé tři až čtyři dny. Oxybutynin je transportován intaktní kůží do systémové cirkulace pasivní difuzí. Výhodou je eliminace hepatálního metabolizmu, čímž se snižuje možnost interakce s dalšími léky. Účinnost transdermálního a perorálního oxybutininu je shodná, výskyt suchosti v ústech byl významně nižší u skupiny léčené transdermální formou. Nevýhodou transdermálního podání je iritace kůže v místě nalepení popisovaná až u 17 % pacientů [8].
Propiverin je terciální amin s kombinovaným anticholinergním a lokálně anestetickým účinkem. In vitro byl prokázán vliv propiverinu jak na acetylcholinem indukovanou svalovou kontrakci (anticholinergní/neurotropní efekt), tak svalovou kontrakci indukovanou KCl (spasmolytický/ muskulotropní efekt) [9].
Velmi rychle se vstřebává z gastrointestinálního traktu, jeho biologická dostupnost je asi 40 % a maximálních sérových hladin dosahuje již za 2,3 hod. Propiverin je vylučován hlavně hepatálním metabolizmem, degradační poločas je asi 15 hod.
Z klinického hlediska má propiverin poměrně vysokou efektivitu, subjektivního zlepšení symptomatologie je dosahováno až u 77 % pacientů. Je uváděn 33% pokles frekvence močení, 65% pokles frekvence epizod denní inkontinence a 60% pokles nykturií. Z nežádoucích účinků je popisována v 45 % většinou lehká hyposalivace, v 15 % poruchy akomodace a v 23 % zvýšená únava [10].
Jünemann srovnával „head to head“ propiverin s tolterodinem s prodlouženým uvolňováním a dospěl k závěru, že oba preparáty mají shodnou efektivitu i bezpečnostní profil [11].
K dispozici jsou tablety 5 a 15 mg, běžné dávkování je 2 × 15 mg.
Trospium se od ostatních anticholinergik liší zejména strukturou molekuly – jedná se o kvartérní amin. Má vysokou afinitu k periferním muskarinovým receptorům typu M1 a M3, v menší míře pak i k receptorům typu M2. Dalším rozdílem oproti ostatním anticholinergikům je fakt, že se na metabolizmu trospia nepodílí cytochrom P450, což snižuje pravděpodobnost lékových interakcí.
Výhodou je malá liposolubilita, a tudíž i velmi omezený přestup přes hematoencefalickou bariéru. K tomu přispívá i pozitivní elektrický náboj molekuly. Z klinického hlediska to znamená zejména malý výskyt nežádoucích účinků na centrální nervový systém a malou míru ovlivnění kognitivních funkcí.
Objektivně to prokázal například Pietzko, který studoval EEG dobrovolníků užívajících trospium [12].
Herberg ve své studii neprokázal jakýkoliv vliv trospia na vizuální orientaci, bdělost, koordinaci pohybů a reakční čas při stresové zátěži, resp. vliv trospia byl stejný jako vliv placeba [13]. Z těchto důvodů se doporučuje podávání trospia v léčbě OAB u seniorů a geriatrických pacientů.
V posledních deseti letech bylo publikováno asi 20 klinických studií zkoumajících účinky trospia dle různých protokolů u více než 10 000 pacientů.
Největší metaanalýzu post-marketingových studií publikoval Madersbacher [14]. U 4 022 pacientů léčených trospiem v dávce 2 × 20 mg po dobu čtyř týdnů pozoroval odeznění frekvencí u 51 %, signifikantní zlepšení nykturií u 41 %. U 78 % pacientů došlo k vymizení epizod urgentní inkontinence.
Dávkování se řídí závažností symptomů, u nás nejběžnější je dávka 45 mg denně, ale dle klinického obrazu lze dávku zvýšit na 90 mg, eventuálně až na 135 mg/den.
Trospium lze díky odlišné struktuře a vlastnostem kombinovat s ostatními anticholinergiky (terciárními aminy) s cílem dosáhnout většího klinického efektu při zachování vysoké bezpečnosti.
Tolterodin je terciární amin, který má vysokou afinitu k muskarinovým receptorům močového měchýře, selektivita k jednotlivým subtypům muskarinových receptorů nebyla zatím prokázána. Tolterodin je metabolizován first-pass metabolizmem v játrech za přítomnosti cytochromu P450, eliminován je zejména renální sekrecí (77 %).
Tolterodin je registrován v klasické formě s bezprostředním uvolňováním (IR – intermediate release) a ve formě s prodlouženým uvolňováním (SR – slow release). Prodloužené uvolňování zajišťuje stabilní sérové hladiny aktivních metabolitů, což umožňuje dávkování jedenkrát denně. V současné době je ale již místo tolterodinu stále častěji užíván fesoterodin. Fesoterodin je po perorálním podání rychle hydrolyticky štěpen nespecifickými esterázami na aktivní metabolit – 5-hydroxymethyl-tolterodin, jehož biologická dostupnost je 52 %. Je minimálně prostupný hematoencefalickou bariérou. V plazmě je dosaženo maximální koncentrace za 5 hod. Podává se v dávce 4–8 mg jedenkrát denně.
Ve studiích II. fáze byla prokázána vysoká účinnost fesoterodinu proti placebu ve všech sledovaných doménách [15].
Chapple srovnával Fesoterodin 8 mg s tolterodinem 4 mg se závěrem, že obě látky účinně potlačují symptomy OAB, ale fesoterodine dosáhl lepších výsledků v redukci počtu epizod inkontinence, nárůstu mikčního objemu a nárůstu počtu kontinentních dnů. Ve skupině pacientů léčených fesoterodinem rovněž zaznamenal signifikantně větší zlepšení parametrů dotazníků kvality života [16].
Přímé srovnávací head-head studie s dalšími moderními selektivními anticholinergiky dosud nejsou k dispozici.
Solifenacin se vyznačuje výhodnými farmakologickými vlastnostmi, zejména vysokou selektivní afinitou k M3 receptorům detruzoru [17]. Po perorálním podání se solifenacin velmi dobře absorbuje, jeho celková biologická dostupnost činí až 90 %. Absorpce není ovlivněna současným příjmem potravy, věkem ani pohlavím. Maximálních sérových hladin je dosahováno cca 3–8 hod po podání. Vzhledem k dlouhému biologickému poločasu 45–68 hod jsou sérové hladiny velmi stabilní i při podávání jedenkrát denně.
Podle Chappleovy analýzy čtyř velkých multicentrických studií provedených na více než 2 800 pacientech bylo dosaženo u pacientů léčených solifenacinem v dávce 5 mg/den redukce epizod urgence o 66,1 %, redukce epizod inkontinence o 100 %, redukce frekvence mikcí o 19,4 %. Mikční objem se zvýšil o 19 %. Poprvé byla též zaznamenána statisticky významná redukce počtu nykturií, a to o 36,4 %. Ve 29 % případů z těch pacientů, kteří na počátku studie udávali urgence, tyto po třech měsících léčby zcela odezněly, v 51 % případů z těch pacientů, kteří na počátku udávali inkontinenci, se již tato po třech měsících léčby nevyskytovala. Ve všech parametrech solifenacin statisticky vysoce signifikantně převýšil placebo.
Rovněž z hlediska bezpečnosti byly dosaženy pozoruhodné výsledky. Léčbu v důsledku nežádoucích účinků předčasně ukončilo 2,8 % pacientů léčených solifenacinem v dávce 5 mg denně, což je dokonce méně než ve skupině léčené placebem (4,4 %). Mezi nejčastější nežádoucí účinky patří sucho v ústech, obstipace a rozmazané vidění [18].
Doporučuje se zahajovat léčbu dávkou 5 mg jedenkrát denně, v případě potřeby lze dávkování zvýšit na 10 mg. K dispozici jsou tablety s obsahem 5 a 10 mg solifencinu.
Další možnosti terapie OAB
V případech, kdy výše uvedená terapie nevede k úspěchu, je na místě zvažovat další možnosti, jako je instilační terapie, neurostimulace, aplikace botulinumtoxinu, případně chirurgická terapie. Všechny tyto metody by se však měly koncentrovat na pracovištích, která jsou materiál-ně i personálně dostatečně vybavena a specializována na komplexní diagnos-tiku a terapii dysfunkcí dolních cest močových.
ZÁVĚR
I přes současný rozsah našich znalostí o patofyziologii hyperaktivního měchýře a relativně širokou paletu léčebných možností nelze považovat problém hyperaktivního měchýře za vyřešený. Naopak lze vzhledem k jeho vysoké prevalenci předpokládat, že se bude zájem na tuto oblast koncentrovat do budoucna v ještě větší míře.
MUDr. Jan Krhut, Ph.D.
Urologické oddělení FN
Ostrava – Poruba
jan.krhut@fnspo.cz
Sources
1. Milsom I, Abrams P, Cardozo L et al. How widespread are the symptoms of an overactive bladder and how are they managed? A population-based prevalence study. BJU Int 2001; 87(9): 760–766.
2. Stewart WF, van Rooyen JB, Cundiff GW et al. Prevalence and burden of overactive bladder in the United States.World J Urol 2003; 20(6): 327–336.
3. Milsom I. Lower urinary tract symptoms in women. Curr Opin Urol 2009; 19(4): 337–341.
4. Zachoval R, Krhut J, Zámečník L et al. Dotazníky hodnotící kvalitu života u pacientů s inkontinencí moči a hyperaktivním měchýřem. Urolog pro Praxi 2006; 7(6): 286–292.
5. Klutke CG, Burgio KL, Wyman JF et al. Combined effects of behavioral intervention and tolterodine in patients dissatisfied with overactive bladder medication. J Urol 2009; 181(6): 2599–2607.
6. Yamaguchi O. Antimuscarinics and overactive bladder: other mechanism of action. Neurourol Urodyn 2009 Aug 19. [Epub ahead of print]
7. Yarker YE, Goa KL, Fitton A. Oxybutynin. A review of its pharmacodynamic and pharmacokinetic properties, and its therapeutic use in detrusor instability. Drugs Aging 1995; 6(3): 243–262.
8. Appell RA. Efficacy and safety of transdermal oxybutynin in patients with urge and mixed urinary incontinence. Curr Urol Rep 2003; 4(5): 343.
9. Riotte J, Mutschler E. Untersuchungen zur Spasmolytischen Aktivität von Propiverin und einigen seiner Strukturanaloga. Arzneimittelforschung 1987; 37 : 300–302.
10. Halaška M, Dorschner W, Frank M. Treatment of urgency and incontinence in elderly patients with propiverine hydrochloride. Neurourol Urodyn 1994; 13 : 428–430.
11. Jünemann KP, Halaska M, Rittstein T et al: Propiverine versus tolterodine: efficacy and tolerability in patients with overactive bladder. Eur Urol 2005; 48(3): 478–482.
12. Pietzko A, Dimpfel W, Schwantes U et al. Influences of trospium chloride and oxybutinin on quantitative EEG in healthy volunteers. Eur J Clin Pharmacol 1994; 47(4): 337–343.
13. Herberg K-W. Alltags - und Verkehrssicherheit unter Inkontinenz-Medikation: Neue Untersuchungen zum Sicherheitspotential urologischer Anticholinergika. Med Welt 1999; 50 : 217–222.
14. Madersbacher H, Ahnig L, Rettig K. Reizblasensymptomatik und Harndranginkontinenz – wirksame Therapie mit Spasmo – lyt – Dragees. Allgemeinarzt 1995; 17 : 501–503.
15. Nitti VW, Dmochowski R, Sand PK et al. Efficacy, safety and tolerability of fesoterodine for overactive bladder syndrome. J Urol 2007; 178(6): 2488–2494.
16. Chapple CR, van Kerrebroeck PE, Jünemann KP et al. Comparison of fesoterodine and tolterodine in patients with overactive bladder. BJU Int 2008; 102(9): 1128–1132.
17. Ikeda K, Kobayashi S, Suzuki M et al. M(3) receptor antagonist by the novel antimuscarinic agent solifenacin in the urinary bladder and salivary gland. Naunyn Schmiedebergs Arch Pharmacol. 2002; 366(2): 97–103.
18. Chapple CR, Cardozzo L, Steers WD et al Solifenacin significantly improves all symptoms of overactive bladder syndrome. Int J Clin Pract 2006; 60(8): 959–966.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2009 Issue 4-
All articles in this issue
- Vývoj a implementace laparoskopické simulace na zvířecím modelu v rámci urologických tréninkových programů
- Jak lépe pracovat s odbornou literaturou
- Technika se zachováním cév při operaci striktury v proximální anteriorní části močové trubice: primární anastomóza a augmentovaná anastomóza
- Léčba hyperaktivního měchýře u žen
- Roboticky asistovaná laparoskopická prostatektomie: kritické hodnocení výsledků
- Srovnání peroperačního průběhu, časných komplikací a funkčních výsledků robotické a otevřené radikální prostatektomie
- Operační anatomie prostaty a pánevního dna pro účely provádění radikální prostatektomie a radikální cystektomie: nejdůležitější body pro dosažení onkologické bezpečnosti, kontroly močové kontinence a erektilní funkce
- Kryochirurgická operace lokalizovaného karcinomu prostaty v počátečním stadiu: přechod od léčby celé prostatické žlázy k fokální kryoablaci
- Možnosti léčby kostního postižení u karcinomu prostaty
- Roboticky asistované a laparoskopické urologické operační výkony ve Spojených Státech: současný stav
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Srovnání peroperačního průběhu, časných komplikací a funkčních výsledků robotické a otevřené radikální prostatektomie
- Operační anatomie prostaty a pánevního dna pro účely provádění radikální prostatektomie a radikální cystektomie: nejdůležitější body pro dosažení onkologické bezpečnosti, kontroly močové kontinence a erektilní funkce
- Roboticky asistovaná laparoskopická prostatektomie: kritické hodnocení výsledků
- Kryochirurgická operace lokalizovaného karcinomu prostaty v počátečním stadiu: přechod od léčby celé prostatické žlázy k fokální kryoablaci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

