-
Medical journals
- Career
Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
Authors: MUDr. Viktor Vik 1; Mgr. Pavel Šácha 2,3; MUDr. František Koukolík; DrSc. 4; doc. RNDr. Jan Konvalinka; CSc. 2,3; prof. MUDr. Dalibor Pacík; CSc. 5; Doc. MUDr. Roman Zachoval, Ph.D. 1
Authors‘ workplace: Urologické oddělení FTN 1; Ústav organické chemie a biochemie AV ČR, Praha 2; Katedra biochemie PF UK, Praha 3; Oddělení patologie a molekulární medicíny FTN, Praha 4; Vídeňská 800, 10 9 Praha viktor. vik@ftn. cz 4; Urologická klinika LF MU a FN Brno 5
Published in: Urol List 2007; 5(4): 10-13
Overview
GCPII (glutamátkarboxypeptidáza II) resp. PSMA představuje z medicínského pohledu mimořádně zajímavou molekulu. V jejím výzkumu byl v posledních 10 letech zaznamenán zásadní posun. V současné době lze konstatovat, že GCPII, resp. PSMA představuje vysoce specifický nádorový marker pro karcinom prostaty s jasnou korelací k agresivitě nádoru a prognostickými možnostmi. Dále je prokázán jeho vztah k angiogenezi většiny solidních tumorů a jeho souvislost s neurologickým postižením při ischemických atakách centrálního nervového systému.
Další celá řada prací byla publikována o diagnostickém či terapeutickém využití GCPII, ale s ohledem na všudypřítomnost a mnohočetné využití tohoto enzymu je literatura roztříštěná téměř ve všech oborech od molekulární biochemie přes farmakologii až patologii. I přesto, že současné klinické využití je velmi omezené, nemělo by toto téma stát na okraji zájmu klinických oborů a zejména urologie.
Klíčová slova:
PSMA (prostatický specifický membránový antigen), GCPII (glutamátkarboxypeptidáza II), karcinom prostatyÚvod
S ohledem na incidenci a prevalenci karcinomu prostaty ve vyspělém světě je zcela zřejmé, že adekvátní diagnostika a terapie tohoto onemocnění je zásadní socioekonomický a zdravotnický problém. Není potřeba zdůrazňovat, že incidence karcinomu prostaty je daleko více závislá na věku, než je tomu u jiných nádorových onemocnění. S ohledem na neustále se prodlužující věk ve vyspělých zemích je zřejmé, že potřeba dokonalejších diagnostických a léčebných nástrojů představuje základní krok v dalším vývoji. Není pochyb o tom, že tento cíl může být naplněn pouze v tom případě, budeme-li patogenezi tohoto onemocnění dokonale rozumět a budeme-li, a to především, schopni správně stanovit diagnózu, prognózu a rozsah onemocnění. Přes značné pokroky v diagnostice, terapii i prognózování pacientů s karcinomem prostaty, přesné stanovení diagnózy a rozsahu onemocnění, a to zejména u pacientů s lokalizovaným onemocněním, zůstává značným problémem. Klasický staging pomocí digitálního rektálního vyšetření, TRUS (transrektální ultrasonografie) v kombinaci s dopplerovským mapováním, biopsie, MRI (zobrazení magnetickou rezonancí), CT (výpočetní tomografie), PSA (prostatický specifický antigen) a v kombinaci s Gleasonovým skórem velmi často selhává při stanovení lokálního rozsahu či přítomnosti mikrometastáz.
Z těchto důvodů neustále probíhá hledání proteinů specifických pro nádor, které by mohly přispět k řešení této problematiky. Jeden z velmi rozsáhle zkoumaných a velmi zajímavých proteinů se zdá být PSMA.
PSMA je transmembránový glykoprotein s krátkou intracelulární částí (aminokyseliny 1. až 18.), transmembránovým helixem (aminokyselina 19. až 43.) a velkou extracelulární doménou (aminokyselina 44. až 750.).
PSMA jako nádorový marker byl identifikován na konci 80. let minulého století [1]. V letech následujících byla popsána tzv. PSM—forma — konkrétně mRNA, kódující větší část extracelulární domény od aminokyseliny číslo 58 až po konečnou 750. aminokyselinu — tj. bez intracelulární i transmembránové části. Poměr množství mRNA PSMA/PSM‘ se zvyšuje v řadě: normální prostatická tkáň, benigní hyperplazie prostaty a adenokarcinom prostaty [2]. Po přesné kvantifikaci PSM‘ a PSMA pomocí kvantitativní PCR bylo potvrzeno, že poměr mRNA PSM/PSM‘ se může stát vhodným prognostickým indikátorem pro adenokarcinom prostaty, nebož byla prokázána přímá úměra mezi dediferenciací tumoru a expresí PSMA.
Přítomnost PSMA v prostatě byla ještě donedávna prokázána pouze u člověka a psa, tedy jediných 2 živočichů, u kterých je vysoká incidence karcinomu prostaty. Rovenská ve své práci pomocí selektivních protilátek GCP-04 prokázala stopové množství GCPII v prostatě také u jiných živočišných druhů — prase, krysa [3]. Dále byla potvrzena přítomnost PSMA u adenokarcinomu prostaty s negativním PSA barvením [4]. Podle doposud největšího publikovaného souboru [5] je možné tvrdit, že zvýšenou expresi PSMA lze považovat za samostatný prognostický faktor při nádorovém onemocnění prostaty. Pacienti se zvýšenou expresí PSMA byli v uvedeném souboru ve významně vyšším procentu případů nositeli agresivních forem karcinomu se signifikantně vyšším rizikem recidivy.
Co je PSMA a jakou má funkci aneb jeden enzym, mnoho jmen
PSMA, správněji glutamátkarboxypeptidáza II (GCPII) je enzym, který se v lidském těle vyskytuje zejména v centrálním nervovém systému, prostatě a tenkém střevě.
Jedná se o membránový glykoprotein, sestávající se z 750 aminokyselin o celkové hmotnosti 90—120 kDa. Gen pro GCPII se nazývá FOLH1 a je lokalizován na chromozomu 11p11.2. Je to proteolytický enzym, který patří mezi metalopeptidázy: v aktivním místě má vázány 2 atomy zinku, které jsou nezbytné pro jeho enzymovou aktivitu.
Tento enzym a jeho aktivita byly postupně objevovány různými laboratořemi v různých tkáních, čímž vznikl jistý zmatek v názvosloví. Jako první byla charakterizována aktivita GCPII v mozku: tam štěpí jeden z neurotransmiterů, N-acetyl-L-aspartyl-L-glutamát, za vzniku nejdůležitějšího excitačního neurotransmiteru L-glutamátu, jednoho z protipólů kyseliny γ-amino máselné. Tehdy byl tento enzym označen jako NAALADasa [6]. Experimenty bylo prokázáno, že inhibice GCPII, a tím snížení volného L-glutamátu, vede k zmenšení neurologického poškození při ischemickém postižení. Další experimentální práce s inhibitory GCPII prokázaly antikonvulzivní efekt, tedy potenciální terapeutický krok proti epileptickým záchvatům [7].
GCPII lokalizovaná ve střevní sliznici se podílí na štěpení obtížně vstřebatelného substrátu poly-gama-glutamylovaného folátu za vzniku volné kyseliny listové, která může být dále vstřebávána a utilizována enterocyty. Tento protein byl proto nazván „folát hydroláza“.
Konečně, průkaz GCPII v prostatě a adenokarcinomu prostaty vedl k označení „prostate specific membrane antigen“ — PSMA. Dlouho se nevědělo nic o možné funkci PSMA v prostatě. Je možné, že GCPII má zde obdobnou funkci jako v tenkém střevě. Lze se domnívat, že schopnost štěpit poly-gama-glutamylovaný folát by mohla dávat nádorovým buňkám prostaty výhodu růstu oproti normální prostatické tkáni [8], protože kyselina listová představuje základní metabolický kámen při syntéze DNA, čili jeden ze základních kroků buněčného dělení, který je tak nezbytný pro nádorové bujení.
Normální tkáň prostaty produkuje zejména PSM´ formu, tedy s největší pravděpodobností enzymaticky inaktivní část. Při vzniku nádorového onemocnění prostaty se poměr mezi inaktivní PSM´-formou a enzymaticky aktivním PSMA zásadně mění ve prospěch účinného enzymu. Lze se tedy domnívat, že PSMA má přímou souvislost s karcinogenezí adenokarcinomu prostaty. O dalších možných funkcích GCPII v tkáni prostaty není doposud mnoho známo.
V roce 1998 došlo k všeobecnému konsenzu, že všechny uvedené aktivity a enzymy jsou projevem jediného proteinu, pro který bylo navrženo systematické jméno glutamátkarboxypeptidáza II (GCPII), které vystihuje jeho enzymatickou funkci. Všechny ostatní názvy se však paralelně používají i nadále.
Výskyt GCPII není omezen pouze na CNS, enterocyty a prostatu, ale podařilo se ho prokázat i v neovaskulaturách většiny solidních tumorů. Angiogeneze je typický proces pro vývoj organizmu a nikoli pro dospělý věk, kdy se vyskytuje téměř výhradně v souvislosti s patologickými procesy (revmatoidní artritis, nádorové bujení, psoriáza, diabetická retinopatie a další). Angiogeneze, jakožto velmi komplexní proces, sestávající z aktivačních a proliferačních procesů, které jsou následovány migrací a invazí s diferenciací endoteliálních buněk, je kontrolována celou řadou regulačních mechanizmů. Jak bylo prokázáno [9] PSMA v těchto mechanizmech hraje významnou roli. Experimentem bylo potvrzeno, že angiogeneze nádorového růstu u laboratorních zvířat, u kterých byl gen pro PSMA experimentálně vyřazen, je angiogeneze výrazně alterována, a to na úrovní endoteliální invaze. Na druhou stranu je potřeba zdůraznit, že u těchto laboratorních zvířat nedošlo během embryonálního a postnatálního vývoje k žádným abnormalitám a všechna laboratorní zvířata byla životaschopná a fertilní. Z tohoto sledování lze usuzovat, že PSMA není nezbytný pro angiogenezi jako takovou, ale hraje důležitou roli při angiogenezi patologických procesů. Na základě těchto zkušeností se lze domnívat, že inhibice PSMA, resp. GCPII může představovat velmi efektivní terapeutický cíl u celé řady patologických procesů.
Opakovaně popsaná korelace mezi expresí PSMA a diferenciací, resp. dediferenciací karcinomu prostaty může souviset s oběma popsanými funkcemi GCPII. Na jedné straně zvýšená suplementace kyseliny listové nádorovým buňkám, jakožto základního substrátu pro buněčné dělení, a na straně druhé vliv na angiogenezi jako jeden ze základních kroků maligního růstu. S ohledem na fakt, že GCPII se vyskytuje téměř v každém solidním tumoru, zůstává otázkou, zdali PSMA může fungovat jako univerzální marker agresivity nádoru.
Image 1. PSMA a jeho různé formy. 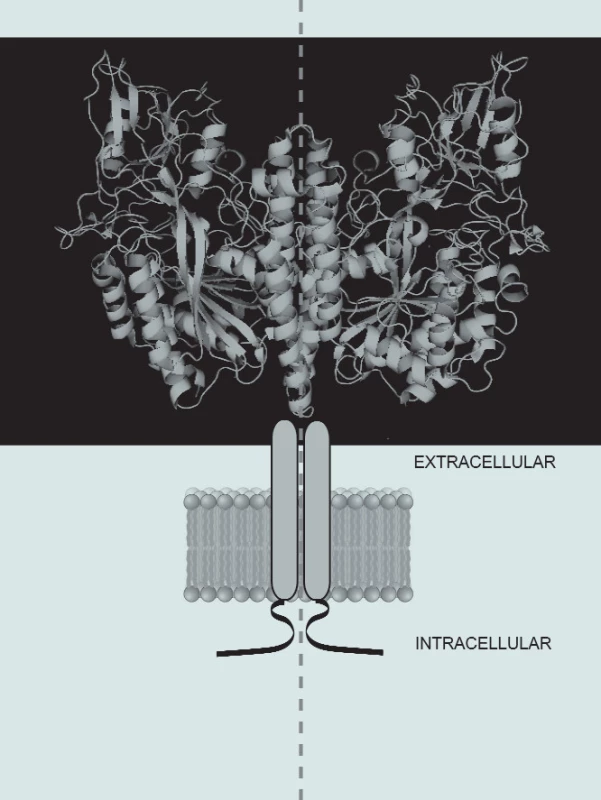
PSMA v diagnostice a terapii
PSMA s ohledem na jeho lokalizaci v buněčné membráně můžeme označit téměř za prototyp buněčného markeru pro karcinom prostaty. Z tohoto pohledu se nabízí celá škála diagnosticko-terapeutických využití. Již byla publikována celá řada prací popisující využití monoklonálních protilátek na bázi imunoterapie či aplikace radioizotopů. Stejně tak využití PSMA v diagnostice splňuje současná kritéria zobrazovacích metod, v rámci nichž je hlavní snahou postihnout patologický proces v nádorové buňce na molekulární úrovni tzv. molekulární zobrazení, a nikoli prosté zobrazení útvaru či patologické masy ve smyslu anatomického zobrazení. Dobrým příkladem je ProstaScintTM, radiodiagnostikum vyuěívající protilátku proti PSMA značenou 111In, s jehož použitím Raj et al [10] diagnostikoval progresi CaP po radikální terapii bez biochemické progrese. Senzitivita této metody byla vyšší než ostatních rutinů prováděných vyšetření, a to i přesto, že užitá protilátka (7E11-C5.3) se vázala pouze na intracelulární fragment PSMA (PSMAint), tedy pouze na PSMA uvolněné z nekrotických či jinak destruovaných buněk. Novější protilátky zaměřené na extracelulární část PSMA (PSMAext, J591 značené 131I) [11] umožňují detekci ěivých, metabolicky aktivních buněk CaP, a toto nabízí další diagnosticko-terapeutické možnosti.
Další diagnostické využití se nabízí při vyuěití PET-CT, kdy stávající nejčastěji používaný indikátor metabolické aktivity, 18F-fluorodeoxyglukóza (18F-FDG), nepřináší u CaP žádné výhody v porovnání s jinými, dostupnějšími diagnostickými metodami. Je to dáno zejména velmi variabilním, zpravidla velmi nízkým metabolickým obratem dané látky v buňkách karcinomu prostaty. Nové indikátory metabolické aktivity, na základě popsaných metabolických pochodů, spojených s GCPII aktivitou, by jistě znamenaly výrazný posun v časné a exaktní diagnostice CaP.
Závěr
GCPII představuje z medicínského pohledu mimořádně zajímavou molekulu. V jejím výzkumu, jak strukturálním tak funkčním, byl v posledních 10 letech zaznamenán zásadní posun. Není pochyb o tom, že v blízké budoucnosti o této látce a o jejím medicínském využití uslyšíme stále častěji. V současné době lze konstatovat, že GCPII resp. PSMA představuje vysoce specifický buněčný nádorový marker pro CaP s jasnou korelací k agresivitě nádoru a prognostickými možnostmi. Dále je prokázán jeho vztah k angiogenezi většiny solidních tumorů a jeho souvislost s neurologickým postižením při ischemických atakách CNS.
Další celá řada prací byla publikována o diagnostickém či terapeutickém využití GCPII, ale s ohledem na všudypřítomnost a mnohočetné využití tohoto enzymu je literatura roztříštěná téměř ve všech oborech od molekulární biochemie přes farmakologii až patologii. Možná právě z tohoto důvodu zájem klinických oborů o tuto problematiku stál doposavad doposud poněkud na okraji.
Jistě je ještě mnoho co zbývá o této molekule objasnit, a tím umožnit její klinické využití, ale přesto dosavadní výsledky zkoumání nás vedou k tomu, abychom se o tuto problematiku zajímali.
J. Konvalinka a P. Šácha jsou zčásti podporováni MŠMT ČR v programu „Centrum nových antivirotik a antineoplastik“ 1M0508 a Výzkumným centrem Gilead a UOCHB AV ČR v Praze.
MUDr. Viktor Vik
Urologické oddělení FTN
Vídeňská 800, 140 59 Praha 4
viktor.vik@ftn.cz
Sources
1. Horoszewicz JS, Kawinski E, Murphy GP. Monoclonal antibodies to a new antigenic marker in epithelial prostatic cells and serum of prostatic cancer patients. Anticancer Res 1987; 7 : 927-936.
2. Su SL, Huang IP, Fair WR et al. Alternatively spliced variants of prostate-specific membrane antigen RNA: ratio of expression as a potential measurement of progression. Cancer Res 1995; 55 : 1441-1443.
3. Rovenská M, Hlouchová K, šácha P et al. Tissue expression and enzymologic characterization of human prostate-specific membrane antigen and its rat and pig orthologs. Prostate 2007; in press.
4. Birtle AJ, Freeman A, Masters JRW et al. Tumour markers for managing men who present with metastatic prostate cancer and serum prostate-specific antigen levels < 10ng/mL. BJU Int 2005; 96 : 303-307.
5. Perner S, Hofer DM, Kim R et al. Prostate-specific membrane antigene antigen expression as a predictor of prostate cancer progression. Hum Pathol 2007; 38 : 696-701.
6. Robinson MB, Blakely RD, Couto R, Coyle JT. Hydrolysis of the brain dipeptide N-acetyl-L-aspartyl-L-glutamate. Identification and characterisation of a novel N-acetylated alphalinked acidic dipeptidase activity from rat brain. J Biol Chem 1987; 262 : 14498-14506.
7. Luszczki JJ, Mohamed M, Czuczwar SJ. 2-phosphonometyl-pentanedioic acid (glutamate carboxypeptidase II inhibitor) increases threshold for electroconvulsions and enhances the antiseizure action of valproate against maximal electroshock-induced seizures in mice. Eur J Pharmacol 2006; 531 : 66-73.
8. Yao V, Bacich DJ. Prostate-specific membrane antigen (PSMA) expression gives prostate cancor cancer cells a growth advantage in a physiologically relevant folate environment in vitro. Prostate 2006; 66 : 867-875.
9. Conway RE, Petrovic N, Li Z et al. Prostate-specific membrane antigen regulates angiogenesis by modulating integrin signal transduction. Mol Cell Biol 2006; 26 : 5310-5324.
10. Raj GV, Partin AW, Polascik TJ. Clinical utility of indium 111-capromab pendetide immunoscintigraphy in the detection of early, recurrent prostate carcinoma after radical prostatectomy. Cancer 2002; 94 : 987-996.
11. Smith-Jones PM, Vallabhajosula S, Navarro V et al. Radiolabled monoclonal antibodies specific to the extracellular domain of the prostate-specific membrane antigen: Preclinical studies in nude mice bearing LNCaP human prostate tumor. J Nucl Med 2003; 44 : 610-617.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2007 Issue 4-
All articles in this issue
- EPCA a EPCA-2 jako potencionální biomarkery karcinomu prostaty
- Současné možnosti provedení nefroureterektomie
- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Transrektální ultrazvukem vedené biopsie prostaty
- Možnosti chemoterapie u pacientů s karcinomem prostaty refrakterním na hormonální léčbu
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Transrektální ultrazvukem vedené biopsie prostaty
- Současné možnosti provedení nefroureterektomie
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

