-
Medical journals
- Career
Rozvoj Richterovy transformace u nemocného s refrakterní chronickou lymfocytární leukemií na léčbě ibrutinibem
Authors: L. Smolej 1; M. Šimkovič 1; A. Zavřelová 1; Petra Kašparová 2; P. Hoffmann 3; P. Dvořák 3; M. Slanina 3; E. Krčálová 4; D. Belada 1; P. Žák 1
Authors‘ workplace: Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy, Hradec Králové ; IV. interní hematologická klinika 1; Fingerlandův ústav patologie 2; Radiologická klinika 3; Oddělení nukleární medicíny 4
Published in: Transfuze Hematol. dnes,26, 2020, No. 1, p. 56-58.
Category: Case Reports
Overview
Moderní perorální inhibitory signálních drah B-buněčného receptoru ibrutinib a idelalisib a inhibitor bcl-2 venetoklax představují účinné léčebné možnosti pro nemocné s relapsem/refrakterní chronickou lymfocytární leukemií (CLL). Richterova transformace (RT, progrese CLL do agresivní lymfoproliferace, nejčastěji difuzního velkobuněčného B-lymfomu, DLBCL) představuje zpravidla prognosticky vysoce nepříznivou událost s omezenými možnostmi léčby a krátkým přežitím, zejména dojde-li k RT na léčbě některým z nových inhibitorů. Prezentujeme kazuistiku Richterova syndromu u nemocného s CLL na terapii ibrutinibem. U 58letého nemocného s relapsem CLL po alogenní transplantaci léčeného ibrutinibem došlo po 11 měsících k progresi v podobě masivní nitrobřišní lymfadenopatie. Pozitronová emisní tomografie/počítačová tomografie (PET/CT) prokázala významný hypermetabolismus glukózy v paketu nitrobřišních uzlin, proto byla provedena jehlová biopsie s průkazem RT ve formě DLBCL. Byla proto zahájena chemoimunoterapie R-CHOP a posléze pro neefektivitu R-GD (rituximab, gemcitabin, dexametazon), která však musela být po 1 cyklu ukončena pro těžkou trombocytopenii. Léčba byla změněna na symptomatický přístup a nemocný zemřel v hospici 2,5 měsíce po stanovení diagnózy RT. Tato kazuistika dokládá vysoce nepříznivou prognózu Richterova syndromu vzniklého na léčbě ibrutinibem u nemocného s pokročilou CLL.
Klíčová slova:
chronická lymfocytární leukemie – Richterova transformace – ibrutinib – prognóza
ÚVOD
Tyrozinkinázové inhibitory signálních drah B-buněčného receptoru ibrutinib (inhibitor Brutonovy kinázy) a idelalisib (inhibitor fosfatidylinositol-3-kinázy) a inhibitor bcl-2 venetoklax představují účinnou léčebnou možnost pro nemocné s relapsem/refrakterní chronickou lymfocytární leukemií (CLL) [1–4]. Richterova transformace (RT, progrese CLL do agresivní lymfoproliferace, nejčastěji difuzního velkobuněčného B-lymfomu – DLBCL) představuje zpravidla prognosticky vysoce nepříznivou událost s omezenými možnostmi léčby a krátkým přežitím [5], zejména dojde-li k RT u relabující/refrakterní CLL, včetně nemocných na léčbě některým z nových inhibitorů [6].
POPIS PŘÍPADU
50letý muž s CLL bez závažných přidružených onemocnění podstoupil v září 2008 alogenní nepříbuzenskou transplantaci krvetvorných kmenových buněk (aloT) od plně shodného (10/10) dárce (v té době bylo onemocnění z hlediska orgánového postižení ve fázi lymfomu z malých lymfocytů – SLL). Důvodem k provedení aloT byla refrakterita na režim FCR (fludarabin, cyklofosfamid, rituximab) podaný v rámci léčby 2. linie. Po aloT dosáhl nemocný kompletní remise s negativitou minimální reziduální nemoci (MRN) v obvodové krvi hodnocené čtyřbarevnou průtokovou cytometrií v říjnu 2009. Pro počínající relaps onemocnění v říjnu 2011 obdržel nemocný opakovaně infuze dárcovských lymfocytů (DLI). K plně rozvinuté progresi CLL došlo v lednu 2017 (tedy 100 měsíců po aloT) s trombocytopenií, nočním pocením a masivní symptomatickou nitrobřišní lymfadenopatií; cytogenetické vyšetření prokázalo komplexní karyotyp včetně delece 17p. Vzhledem k selhání chemoimunoterapie (1 cyklus rituximab + cyklofosfamid + dexametazon, 2 cykly bendamustin + rituximab) byl od června 2017 po schválení revizním lékařem nasazen ibrutinib v klasické dávce dávce 420 mg p. o. denně; při léčbě ibrutinibem dosáhl nemocný parciální remise s významným zmenšením nitrobřišních uzlin, plnou úpravou krevního obrazu a zřetelným zlepšením kvality života. V květnu 2018 (po 11 měsících léčby ibrutinibem) však onemocnění opět progreduje ve smyslu B-příznaků (noční pocení) a progrese retroperitoneální lymfadenopatie. Nemocný byl v dobrém stavu (výkonnostní stav 1 podle WHO). Při fyzikálním vyšetření dominovala hmatná nitrobřišní masa cca 10 × 10 cm; zevní uzliny dosahovaly velikosti do 2 cm, slezina nebyla hmatná. Biochemické vyšetření séra odhalilo hyperkalcemii (Ca 3,27 mmol/l; ionizovaný Ca 2,02 mmol/l) s normální sérovou koncentrací parathormonu a normální sérovou laktátdehydrogenázou; C-reaktivní protein byl zvýšen na 49 mg/l, prokalcitonin normální. Krevní obraz byl prakticky normální, bez leukocytózy či anémie; přítomna byla mírná trombocytopenie (87 × 109/l). Do výsledku PET/CT jsme z důvodu nebezpečí z prodlení nasadili chemoimunoterapii ve složení rituximab + dexametazon + cyklofosfamid (RCD) a posléze po schválení revizním lékařem venetoklax v úvodní dávce 20 mg/den p. o. s postupným navyšováním dávky podle standardního schématu. PET/CT ukázalo masivní lymfadenopatii nitrobřišně: paraaortokavální lymfadenopatie o maximálním rozměru 24 × 17 × 7 cm a mezenteriální lymfadenopatie 15 × 4 × 16 cm s částečně zavzatým pankreatem (obr. 1–3). Vzhledem k vysoké nehomogenní FDG aviditě paketu břišních uzlin (maximální SUV, tedy standardizovaná hodnota utilizace 11,9 – obr. 2, 3) byla provedena jehlová biopsie s odběrem tří vzorků z oblasti s nejvyšší akumulací FDG bioptickým dělem o tloušťce 16 G (obr. 4). Histologicky bylo zjištěno, že nejméně 50 % infiltrátu tvořily velké buňky (obr. 5) s difuzní pozitivitou CD79, bcl-2 a CD5; většina CD23+, část CD20+ (obr. 6). Zhruba 70 % infiltrátu vykazovalo střední až silnou pozitivitu MUM1 a slabou pozitivitu bcl-6. Ukazatel mitotické aktivity Ki-67 činil až 70 % (obr. 7). Bioptický nález byl tedy uzavřen jako Richterova transformace – difuzní velkobuněčný B-lymfom, CD5 pozitivní s non-germinal center fenotypem. Z tohoto důvodu jsme léčbu změnili na režim R-CHOP (rituximab, cyklofosfamid, doxorubicin, vinkristin, prednizon), který však byl komplikován neutropenickou sepsí; pro známky progrese RT na léčbě byla podána záchranná léčba R-GD (rituximab, gemcitabin, dexametazon). Další terapie však byla kontraindikována pro selhání kostní dřeně: přetrvávající závažná trombocytopenie 3 × 109/l. Léčebný přístup jsme tedy po domluvě s nemocným změnili na symptomatickou péči s důrazem na maximální ovlivnění symptomů; nemocný byl předán do hospicové péče, kde posléze zemřel (2,5 měsíce od stanovení diagnózy RT).
Image 1. Koronární řez z CT zobrazující masivní nitrobřišní lymfadenopatii 
Image 2. Trojrozměrná projekce dat z PET, dokladující hypermetabolismus fluorodeoxyglukózy v paketující nitrobřišní lymfadenopatii 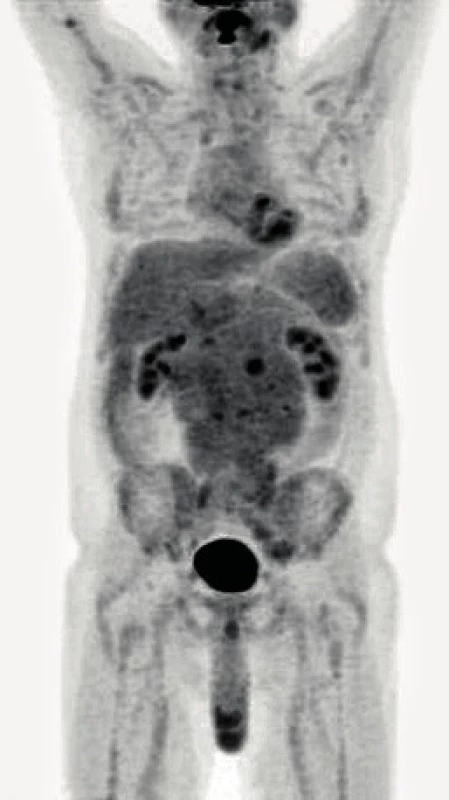
Image 3. Axiální řez z fúze PET/CT ukazující masivní nitrobřišní lymfadenopatii s vysokou akumulací fluorodeoxyglukózy 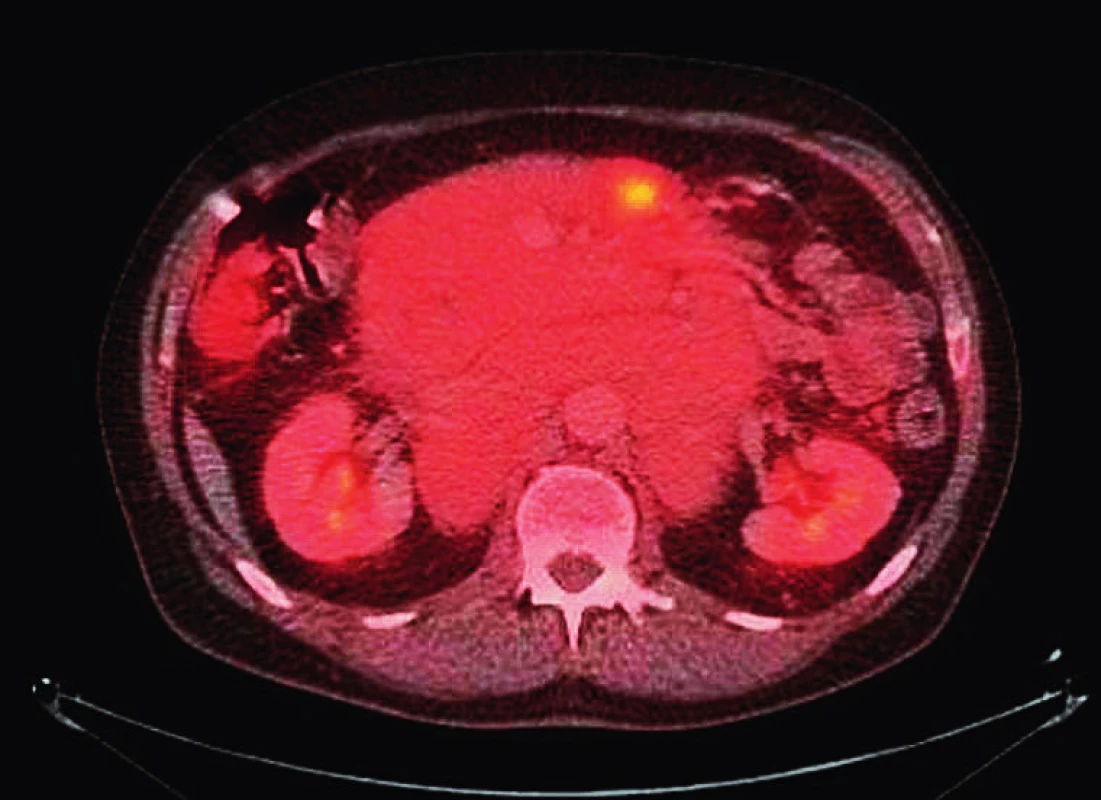
Image 4. Axiální řez CT z jehlové biopsie nitrobřišní lymfadenopatie pod CT kontrolou 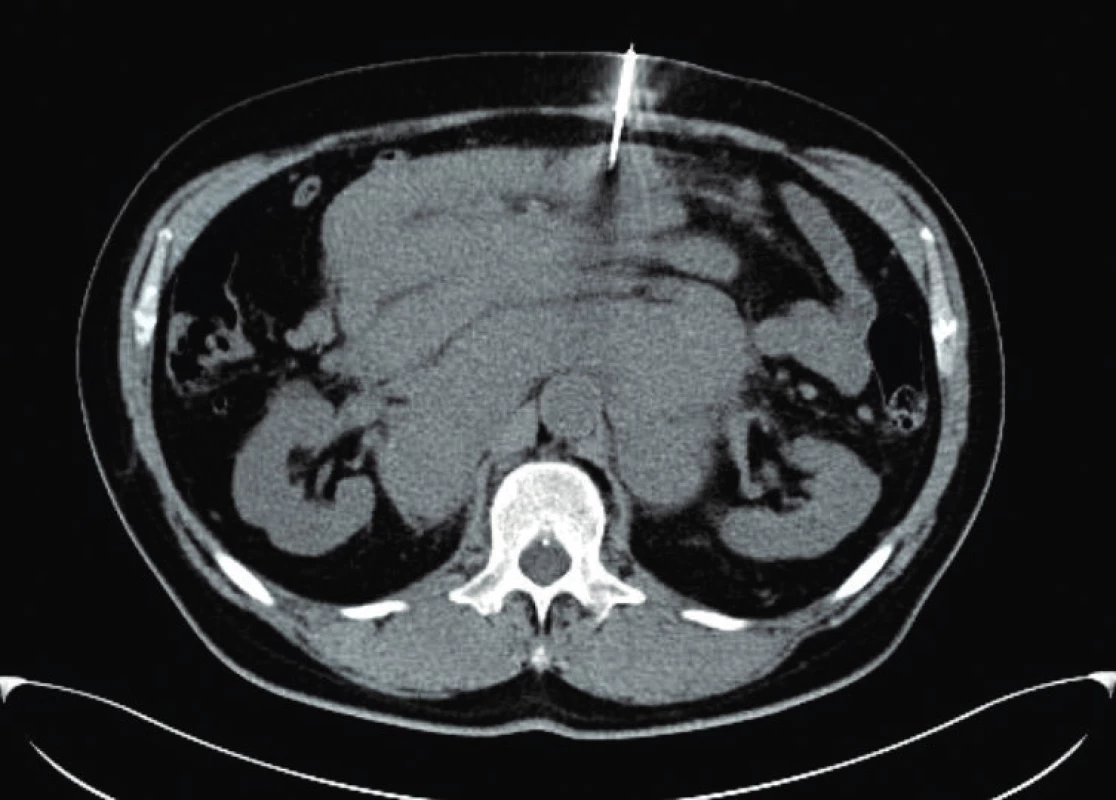
Image 5. Histologie z biopsie mízní uzliny, zvětšení 200×, patrná zřetelná velkobuněčná transformace, barvení hematoxylin – eozin 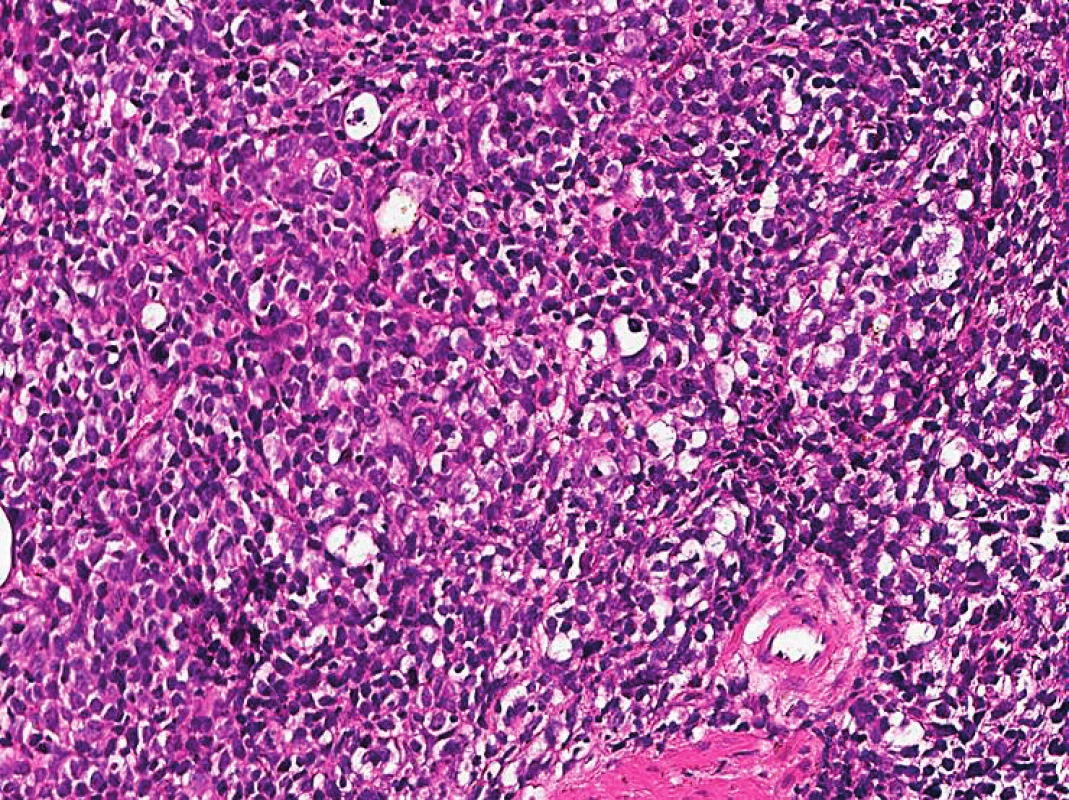
Image 6. Histologie z biopsie mízní uzliny, zvětšení 200×, pozitivita CLL pozadí i velkobuněčné komponenty při imunohistochemickém barvení CD20 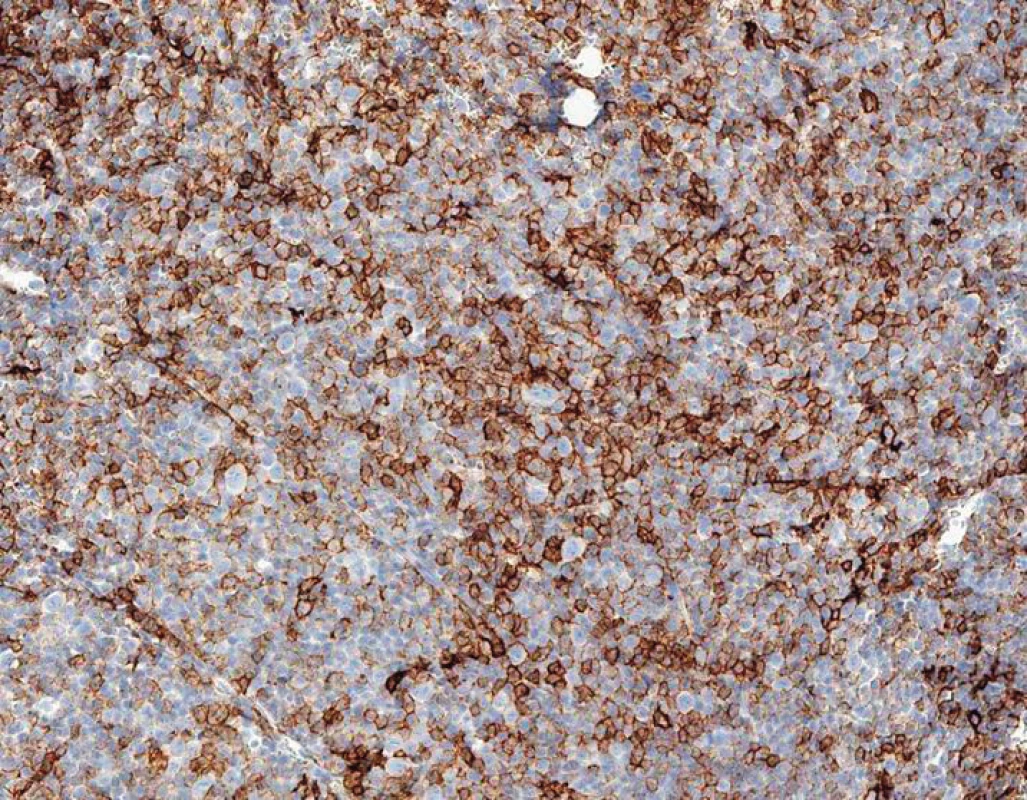
Image 7. Histologie z biopsie mízní uzliny, zvětšení 100×, vysoká pozitivita Richterova syndromu při imunohistochemickém barvení Ki-67 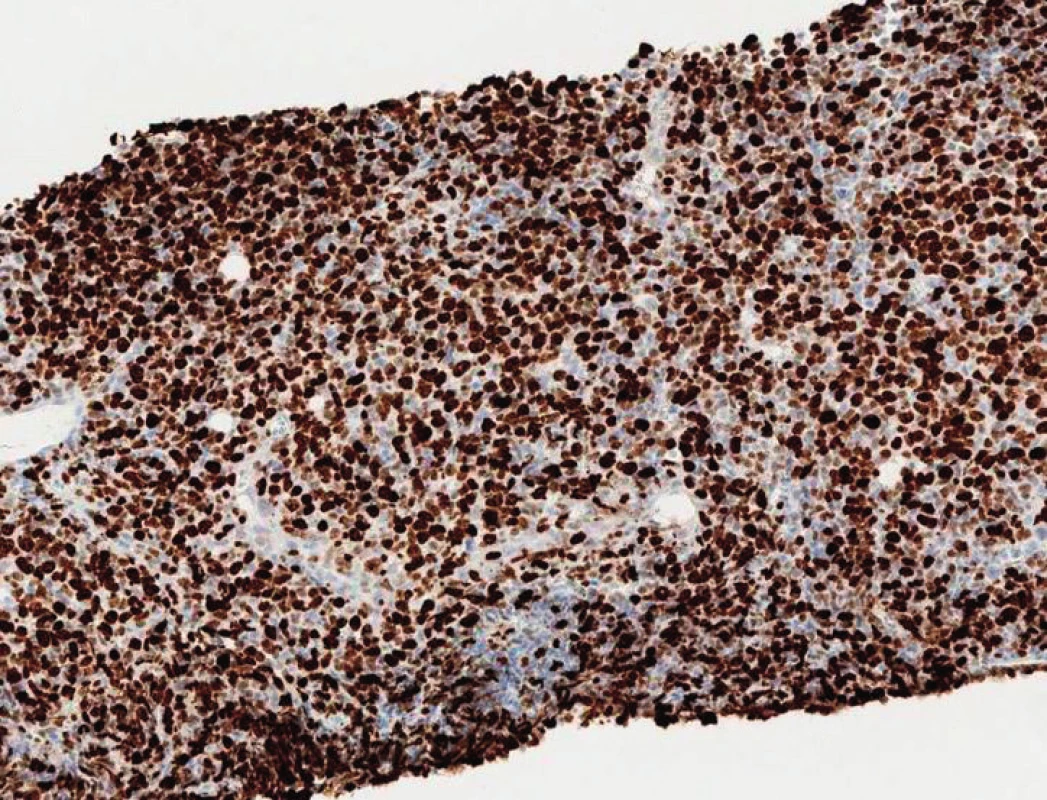
DISKUZE
Na Richterovu transformaci je u nemocných s CLL nutno pomýšlet v případě rozvoje masivní lymfadenopatie, zejména pokud jde o nárůst velikosti uzlin pouze v jedné oblasti, jsou zároveň přítomny B-příznaky a zvýšení laktátdehydrogenázy [4–7]. Zhruba u 80 % případů RT jde zpravidla o tzv. klonálně příbuzný RT, tedy lymfomové buňky mají původ u CLL. Typické je pro klonálně příbuzný RT rozvoj ve fázi relabující/refrakterní CLL, kdy jde zpravidla o terminální komplikaci charakterizovanou nízkou účinností léčby a extrémně krátkým přežitím v řádu měsíců. Naopak u cca 20 % nemocných se jedná o tzv. klonálně nesouvisející RT (jde tedy de facto o další primární malignitu); pro tyto nemocné je charakteristický rozvoj RT poměrně brzy v průběhu CLL, včetně dosud neléčené CLL. Prognóza je pak výrazně lepší než u klonálně příbuzného RT a zhruba odpovídá prognóze de novo DLBCL [5–7]. U prezentovaného nemocného nebyla klonální příbuznost vyšetřována – nejde dosud o rutinní vyšetření u RT a neovlivnilo by léčebnou strategii. Z histologického hlediska má DLBCL v 95 % RT fenotyp aktivovaných B-lymfocytů (activated B-cell – ABC). Vzhledem k tomu, že prognózu RT se za posledních 20 let nepodařilo významně zlepšit režimy chemoimunoterapie, jako R-CHOP či platinovými režimy, např. OFAR [8–9], představuje tato komplikace CLL zásadní léčebnou výzvu do budoucna. Výsledky klinických hodnocení probíhajících v současnosti [10] jsou tedy očekávány s nadějí, že povedou ke zřetelnému zlepšení osudu nemocných s Richterovou transformací.
Poděkování
Podpořeno programem PROGRES Q40/08 a RVO MZ ČR (FNHK, 00179906).
Podíl autorů na přípravě rukopisu
ZA, BD, ŽP, SL: léčba nemocného.
KP: hodnocení bioptického nálezu.
DP, HP, SM, KE: hodnocení CT či PET/CT, provedení biopsie.
sl: sepsání článku.
SL, ŠM, ZA, KP, HP, DP, SM, KE, BD, ŽP: kritická revize článku, finální odsouhlasení.
Čestné prohlášení
LS, MŠ a DB obdrželi honoráře za přednášky a cestovní granty od společností Roche, Janssen, AbbVie a Gilead. Ostatní autoři nedeklarují žádný konflikt zájmů. Vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 16. 11. 2019.
Přijato po recenzi dne 11. 12. 2019.
prof. MUDr. Lukáš Smolej, Ph.D.
IV. interní hematologická klinika
Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy
Sokolská 581
500 05 Hradec Králové
e-mail: lukas.smolej@fnhk.cz
Sources
- Munir T, Brown JR, O‘Brien S, et al. Final analysis from RESONATE: Up to six years of follow-up on ibrutinib in patients with previously treated chronic lymphocytic leukemia or small lymphocytic lymphoma. Am J Hematol. 2019;94(12):1353–1363.
- Sharman JP, Coutré ES, Furman RR, et al. Final results of a randomized, phase III study of rituximab with or without idelalisib followed by open-label idelalisib in patients with relapsed chronic lymphocytic leukemia. J Clin Oncol. 2019;37 : 1391–1402.
- Roberts AW, Davids MS, Pagel JM. Targeting BCL2 with venetoclax in relapsed chronic lymphocytic leukemia. N Engl J Med. 2016;374 : 311–322.
- Doubek M, Špaček M, Pospíšilová Š, et al. Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) – 2018. Transfuze Hematol Dnes. 2018;24(3):208–220.
- Parikh SA, Kay NE, Shanafelt TD. How we treat Richter syndrome. Blood. 2014;123(11):1647–1657.
- Ayers EC, Mato AR. Richter‘s transformation in the era of kinase inhibitor therapy: A review. Clin Lymphoma Myeloma Leuk. 2017;17(1):1–6.
- Rossi D, Spina V, Gaidano G. Biology and treatment of Richter syndrome. Blood. 2018;131(25):2761–2772.
- Langerbeins P, Busch R, Anheier N, et al. Poor efficacy and tolerability of R-CHOP in relapsed/refractory chronic lymphocytic leukemia and Richter transformation. Am J Hematol. 2014;89(12):E239–E243.
- Tsimberidou AM, Wierda WG, Wen S, et al. Phase I-II clinical trial of oxaliplatin, fludarabine, cytarabine, and rituximab therapy in aggressive relapsed/refractory chronic lymphocytic leukemia or Richter syndrome. Clin Lymphoma Myeloma Leuk. 2013;13(5):568–574.
- Cclinicaltrials.gov [on-line]. U.S. National Library of Medicine, 2018. Dostupné na: http://clinicaltrials.gov. [Navštíveno 12. 11. 2019]
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today
2020 Issue 1-
All articles in this issue
- Novinky z redakce
- Editorial
- Richterova transformace chronické lymfocytární leukemie v éře léčby inhibitory buněčných drah
- Chromozomové změny u chronické lymfocytární leukemie, jejich prognostický a prediktivní význam
- Chromozomové aberace a jejich role v transformaci chronické lymfocytární leukemie v éře léčby inhibitory BCR signalizace
- Molekulárně genetické změny u Richterovy transformace chronické lymfocytární leukemie
- Mutace asociované s rezistencí u pacientů s chronickou lymfocytární leukemií léčených ibrutinibem, idelalisibem a venetoklaxem
- Rozvoj Richterovy transformace u nemocného s refrakterní chronickou lymfocytární leukemií na léčbě ibrutinibem
- Transformace chronické lymfocytární leukemie do Hodgkinovy varianty Richterova syndromu
- Vzdělávací workshop – uplatnění nových technologií v precizní medicíně CML a ALL
- Prof. MUDr. Ladislav Jebavý, CSc., slaví 70 let
- Životní jubileum MUDr. Věry Vozobulové
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chromozomové změny u chronické lymfocytární leukemie, jejich prognostický a prediktivní význam
- Molekulárně genetické změny u Richterovy transformace chronické lymfocytární leukemie
- Richterova transformace chronické lymfocytární leukemie v éře léčby inhibitory buněčných drah
- Transformace chronické lymfocytární leukemie do Hodgkinovy varianty Richterova syndromu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

