-
Medical journals
- Career
Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
Authors: J. Treglerová 1; J. Zelinka 1; Z. Adam 2; L. Pour 2; M. Krejčí 2; L. Ostřížková 2; V. Sandecká 2; M. Štork 2; Z. Král 2; A. Čermák 3
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Klinika ústní, čelistní a obličejové chirurgie FN Brno a LF MU 2; Urologická klinika LF MU a FN Brno 3
Published in: Transfuze Hematol. dnes,25, 2019, No. 3, p. 242-251.
Category: Review/Educational Papers
Overview
Bisfosfonáty jsou součástí kompletní léčby mnohočetného myelomu po více než tři desetiletí. Zpomalují osteolýzu, a přispívají tak k lepší kvalitě života. Jejich dlouhodobé podávání je však spojeno s dvěma závažnými, obvykle později nastupujícími komplikacemi, medikamentózně podmíněnou osteonekrózou čelisti (medication-related osteonecrosis of the jaws), vyskytující se u 6–9 % a vzácnějšími atypickými frakturami kostí. Obě tyto komplikace se velmi obtížně hojí, a proto o to větší důraz se klade na prevenci, na probrání rizika s pacientem a dále na vyšetření stomatologem před zahájením léčby a v průběhu léčby. Také je snaha omezit podávání těchto léků na dobu nezbytně nutnou. Osteonekróza čelisti nevzniká však jen v důsledku léčby bisfosfonáty. Také některé nové léky (denosumab a další), používané při léčbě onkologických onemocnění, způsobují tuto komplikaci. V textu je uveden přehled léků, které jsou dnes používány v onkologii a které také zvyšují riziko vzniku osteonekrózy čelisti. Vzácnější nežádoucí komplikací dlouhodobé léčby bisfosfonáty je atypická fraktura. Cílem textu je v přehledu informovat o těchto rizicích spojených s dlouhodobější léčbou bisfosfonáty, které je třeba zohlednit při rozhodování o jejím zahájení a délce této léčby.
Klíčová slova:
bisfosfonáty – léky indukovaná osteonekróza čelisti – atypické fraktury kostí
1 ÚVOD
Bisfosfonáty jsou stále standardní preparáty používané pro léčbu mnohočetného myelomu. Jsou to léky, které se používají dlouhodobě. Jejich případné nežádoucí účinky obvykle nikdy nevidíme po prvním či druhém podání či v prvních třech měsících léčby. Nežádoucí účinky se mohou objevit až po mnohaměsíční léčbě, kdy již poklesne ostražitost nemocného i lékaře, anebo kdy nově objevivší se potíže jsou mylně spojeny s jinou příčinou a nikoliv s doposud excelentně tolerovanou léčbou.
A proto cílem následujícího textu je připomenout tyto nežádoucí účinky [1]. Jde o osteonekrózu čelisti, obvykle následující po extrakci zubu, a pak o zvýšenou křehkost kostí, zcela výjimečně se projevující atypickými (únavovými frakturami), neboli zlomeninami bez odpovídajícího násilí. Osteonekróza čelisti v souvislosti s dlouhodobým užíváním bisfosfonátů byla poprvé popsána až v roce 2003 a 2004 (stomatochirurgem Marxem a Ruggierem) [2, 3], ačkoliv léčebný efekt pamidronatu byl popsán již v roce 1991 (první případy osteonekrózy byly hlášeny FDA v USA prof. Ruggierem v roce 2001).
Takže až po 12 letech používání pamidronatu dali právě stomatologové do souvislosti vyšší četnost osteo-nekrózy čelisti s užíváním bisfosfonátů. Po prvním popisu této komplikace ke konci roku 2003 pak následovala exploze článků s touto tematikou a dnes víme, že postihuje 6–9 % pacientů s mnohočetným myelomem, kteří dostávají bisfosfonáty. Osteonekróza čelisti nejčastěji vzniká jako důsledek extrakce zubu, ale tento proces může nastartovat i výkon spojený se zavedením zubního implantátu [5–7], nebo může být způsoben tlakem zubní náhrady.
V roce 2019 je již známo, že osteonekrózu čelisti mohou způsobit nejen bisfosfonáty, ale i četné další léky, jak rozvádíme v odstavci o osteonekróze.
Vznik atypických únavových fraktur je ještě vzácnější komplikací než osteonekróza čelisti.
Podávání bisfosfonátů zvyšuje kostní hustotu (denzitu), ale se zvyšování hustoty se však nezvyšuje lineárně pevnost kosti. Ta odvisí od optimální architektury kostních trámců a mimo jiné bisfosfonáty remodelaci brzdí. Tato komplikace je vzácnější než osteonekróza čelisti, a proto byla popsána ještě později než osteonekróza čelisti až v roce 2008, tedy po 18 letech používání těchto léků. Nejčastěji to bylo v oblasti femuru [8–10].
K atypické zlomenině může dojít i v oblasti metatarzálních kůstek (obdoba pochodových fraktur), jak jsme u jednoho našeho pacienta popsali. Vzácnost této komplikace signalizuje, že tato komplikace postihuje pouze některé osoby, ale jejich identifikace v průběhu léčby není žádnými dostupnými metodami možná.
2 BĚŽNÉ NEŽÁDOUCÍ ÚČINKY LÉČBY BISFOSFONÁTŮ
2. 1 Bisfosfonáty indukovaná hypokalcemie
Všechny preparáty mohou způsobovat symptomatickou nebo asymptomatickou hypokalcemii, a proto se doporučuje současná substituce kalcia a vitaminu D [11–14].
2. 2 Gastrointestinální nežádoucí účinky
Dráždění v oblasti horní části zažívacího traktu (jícnu, žaludku) je typické pro perorální preparáty dusík obsahujících bisfosfonátů. Z těch je v případě mnohočetného myelomu používán pouze ibandronat tablety. Pamidronat se v perorální formě nepodává. Zbývající dusík obsahující bisfosfonáty, risedronat a alendronat se během léčby maligní osteolýzu nepoužívají a v této indikaci nebyly testovány v žádné klinické studii. U těchto preparátů se doporučuje po polknutí tablety neuléhat do postele.
To však neplatí pro klodronat, u něhož nebyla toxicita v oblasti jícnu popsána. Klodronat může způsobit mírné dráždění v dolní části zažívacího traktu až řidší stolice. Pokud mají pacienti zácpu po jiných lécích (centrálně působících analgetikách), je urychlení pasáže klodronatem spíše výhodou. Doporučení neuléhat po polknutí zpět do postele po polknutí bisfosfonátu se klodronatu netýká, protože poškození jícnu nebylo nikdy po klodronatu popsáno [15].
2. 3 „Flu-like“ syndrom
Horečka se vzestupem reaktantů akutní fáze provází aplikaci dusík obsahujících bisfosfonátů asi zcela výjimečně, řádově v procentech. Je na to třeba pacienty upozornit, aby teplotu po této infuzi neinterpretovali jako infekci. Klodronat nezpůsobuje „flu-like“ syndrom, takže jej lze použít u osob s „flu-like“ syndromem po dusík obsahujících bisfosfonátech [1, 15].
2. 4 Poškození ledvin
Ledviny jsou hlavním místem vylučování těchto bisfosfonátů, buňky ledvin se dostávají do kontaktu s vyšší koncentrací bisfosfonátů než ostatní buňky v těle a to zřejmě umožňuje v některých případech jejich poškození.
První preparáty ze skupiny bezdusíkatých bisfosfonátů ohrožovaly ledviny jen při příliš rychlém podání, kdy poškození souviselo s vychytáním jejich komplexů v ledvinách. Při dodržení doporučené délky i. v. aplikace či při p. o. podání klodronatu není nefrotoxicita uváděna.
V případě dusík obsahujících bisfosfonátů (pamidronat, zoledronat) se nepravidelně objevuje postupně narůstající nefrotoxicita. Incidence zhoršování funkce ledvin v průběhu léčby zoledronatem dosahovala až 10 %. Ve studii, srovnávající 4 mg zoledronatu s placebem činila nefrotoxicita zoledronatu 10,9 % a nefrotoxicita placeba 6,7 %, rozdíl nebyl signifikantní. Nicméně nežádoucí působení zoledronatu na ledviny nelze ignorovat. Při každé aplikaci je nutné sledovat hodnotu urey i kreatininu a v případě jejich vzestupu léčbu přerušit a obnovit ji až po návratu na původní hodnoty nebo adekvátně snížit dávku zoledronatu.
Podstatné je, že toto poškození nenastupuje skokem, ale postupně se vyvíjí v průběhu aplikací. Z toho plyne doporučení pečlivě sledovat hodnoty kreatininu u všech pacientů léčených bisfosfonáty a při jejich vzestupu analyzovat příčiny a případně přerušit podávání použitého preparátu bisfosfonátu. Medián intervalu mezi zahájením léčby a zřetelnou nefrotoxicitou činí 4–5 měsíců [16, 17].
Zhoršování funkce ledvin obvykle pokračuje 1–2 měsíce po přerušení podávání bisfosfonátu.
U pacientů s poškozením ledvin v průběhu léčby těmito preparáty bylo popsáno jak glomerulární, tak i tubulární poškození [18].
3 LÉKY NAVOZENÁ OSTEONEKRÓZA ČELISTI
3. 1 Léky související se vznikem osteonekrózy
Léky navozená osteonekróza čelisti (medication-related osteonecrosis of the jaw) je velmi závažná komplikace s progresivní destrukcí kosti v oblasti maxillofaciální. Tato komplikace může být indukována jak léky inhibujícími osteolýzu, tedy bisfosfonáty, tak preparátem denosumab, ale také léky inhibujícími angioneogenezi. Proto v roce 2014 Asociace amerických maxilofaciálních chirurgů navrhla změnit název Bisphosphonate-related osteonecrosis of the jaw na medication-related osteonecrosis of the jaw (MRONJ), čili léky indukovanou osteonekrózu čelisti. A postupně přibývají další léky, které mohou přispět ke vzniku osteonekrózy – tabulka 1 [19, 20]. Osteonekrózu čelisti mohou způsobit i některé léky, které neovlivňují kostní resorpci [21]. U karcinomu prsu a karcinomu prostaty prokázala léčba denosumabem o něco vyšší incidenci osteonekrózy čelisti než léčba zoledronatem, jak ukázala metaanalýza sedmi klinických studií na 8 973 pacientech (1,7 % versus 1,1 %, RR 1,48, 95% CI 0,96–2,29) [22].
Table 1. Léky s rizikem indukce osteonekrózy dle tabulky Americké asociace maxilofaciálních chirurgů 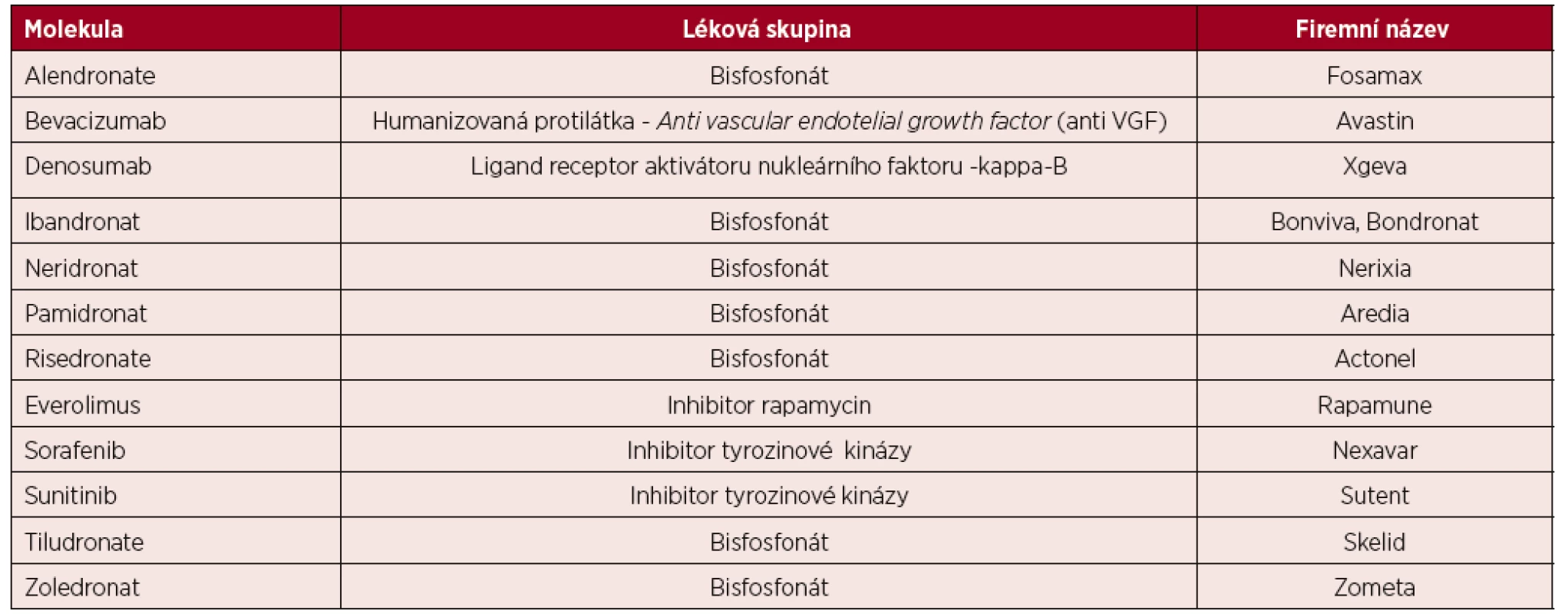
(podle [19, 20]). První informace o vzniku osteonekrózy čelisti vlivem inhibice angioneogeneze preparátem bevacizumab jsou z roku 2008 [23, 24]. A opětovně po prvním popisu následovaly četné další publikace s tímto tématem. AntiVEGFR inhibitor – bevacizumab zvyšuje riziko onemocnění osteonekrózy čelisti v kombinaci s bisfosfonáty na 2,4 %, při samostatném užití bez bisfosfonátu se vyskytuje tato komplikace jen u 0,2 % pacientů z 5 680 analyzovaných.
Sunitinib (inhibitor VEGF receptoru, PDGF receptoru, c-Kit, FLT3 a RET kináz) je používán u nádorů ledvin, pankreatického neuroektodermálního tumoru (NET) a u gastrointestinálního stromálního tumoru (GIST) v kombinaci s bisfosfonáty. Sunitinib výrazně zvýšil riziko vzniku osteonekrózy. První popis této komplikace je z roku 2009 [25–27].
Také lék s názvem Ziv-aflibercept byl dán do souvislosti s touto komplikací [28].
Carbozantinib (Cometriq) je také inhibitor tyrozinkináz, který je užíván u medulárního nádoru štítnice a u tumoru ledviny. Při použití tohoto léku byla osteonekróza čelisti hlášena u 1,4 % pacientů ve studii fáze III [29].
Stejně tak sorafenib je dáván v souvislosti s osteonekrózou [30]. Také v souvislosti s lékem everolimus byla popsána osteonekróza [31, 32].
Doposud není jasné, jakým mechanismem tyto léky ke vzniku osteonekrózy vedou. V literatuře se nejčastěji setkáme s případy, kdy léčbu těmito preparáty doprovázela nebo předcházela léčba bisfosfonáty. V současné době se odborná veřejnost spíše přiklání k názoru, že konkomitantní léčba těmito léky vede k časnějšímu vzniku a rychlejšímu a horšímu průběhu MRONJ.
Protože se stále objevují nové léky, jejichž aplikace zvyšuje riziko osteonekrózy čelisti, tak se ve stomatochirurgických pracovištích se s tímto problémem setkávají lékaři častěji než dříve.
Fotografie dutiny ústní s obnaženou dolní čelistí ukazuje obrázek 1. S velmi závažným případem jsme se setkali u starší pacientky, u níž došlo k nekróze tvrdého patra a vytvoření komunikace mezi dutinou ústní a nosní.
Image 1. Defekt v krytí dolní čelisti, obnažená kost, osteonekróza čelisti vzniká po nezhojené extrakci
Defekt byl značně bolestivý a limitoval možnost kousat stravu.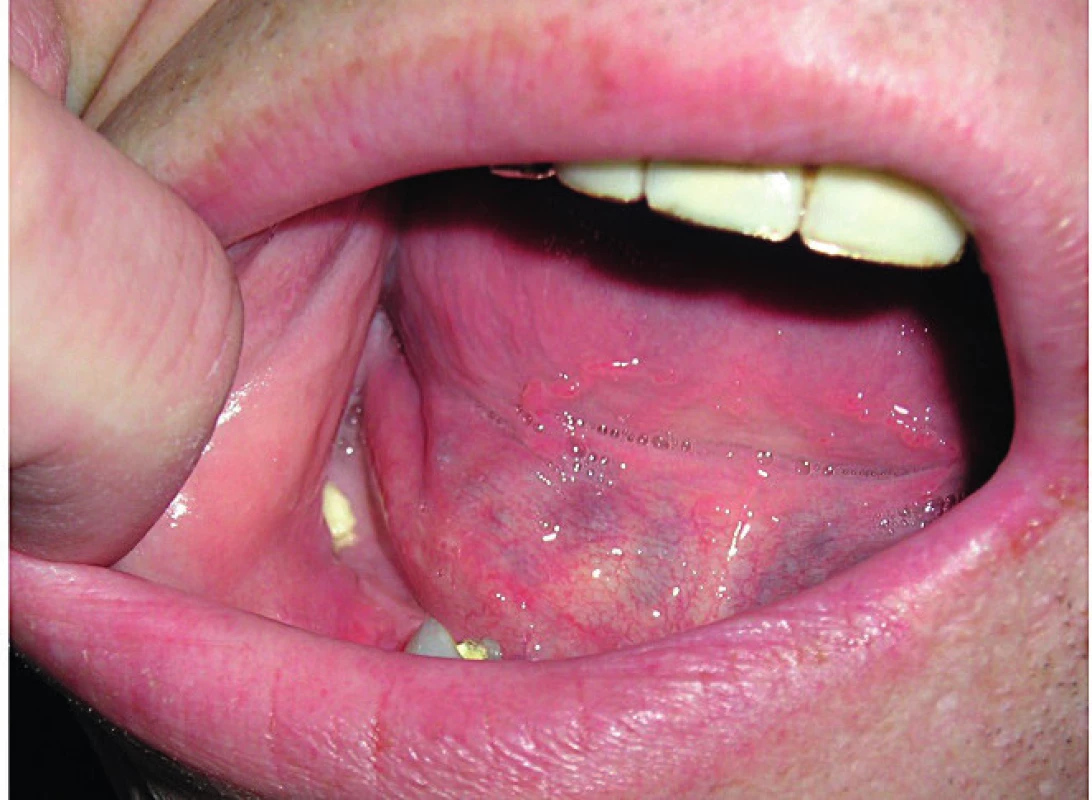
Na procesu vzniku osteonekrózy se podíjejí: zánět a infekce, mikrotrauma, alterace kostní remodelace, suprese kostní resorpce, inhibice angiogeneze, alterovaná imunita pacienta. K rizikovým faktorům patří typ molekuly, kumulativní dávka, genetická predispozice, kouření, trauma dásní a čelisti, invazivní výkony v oblasti čelisti. Riziko vzniku osteonekrózy stoupá se závažností imunosuprese (současná léčba glukokortikoidy případně další imunosuprimující léky). Riziko vzniku osteonekrózy potencují komorbidity snižující imunitu: diabetes mellitus, revmatická artritida, renální insuficience na dialýze, obezita, věk, alkoholismus. Rozvoj osteonekrózy potencuje tlak zubních protéz na dáseň a přítomnost zubních implantátů. Přesný mechanismus vzniku MRONJ nebyl dosud zcela objasněn, ale současné výzkumy naznačují, že klíčovou roli hraje lokální zánět. Zánět způsobený ať infekcí nebo jako následek hojení rány (po extrakci zubu) či traumatu (otlaky od protéz) vede k lokálnímu poklesu pH, což způsobuje v daném místě zvýšené uvolňování bisfosfonátů vázaných v kostech a k místnímu nárůstu jejich hladiny až k toxickým hodnotám, které ovlivňují nejen osteoklasty, ale i další buňky jako osteoblasty, fibroblasty, endoteliální buňky a mezenchymální kmenové buňky. Tyto okolnosti pak mohou vést až ke vzniku osteonekrózy.
Při srovnání léčby bisfosfonáty a denosumabem se míra rizika vzniku osteonekrózy zásadně neliší, ale zásadně se liší průměrný interval do vzniku osteo-nekrózy. V případě léčby zoledronatem byl medián počtu aplikací při vzniku osteonekrózy 33, zatímco osteonekróza v případě léčby denosumabem se může objevit časně po zahájení léčby, nezávisle na počtu aplikací denosumabu [20]. Ale na druhé straně riziko vzniku osteonekrózy po denosumabu v případě jeho ukončení rychle klesá, zatímco po léčbě bisfosfonáty zůstává stabilní po několik let.
3. 2 Vysazení bisfosfonátů před chirurgickým výkonem v dutině ústní
Názory na vysazení bisfosfonátů (tzv. „drug holiday“) před chirurgickým výkonem v dutině ústní nejsou jednotné. Kolektiv německých autorů z Mnichova Otto et al., provedl studii na velkých zvířecích modelech, která vedla k zajímavému zjištění, že již šestitýdenní vysazení bisfosfonátů vedlo u prasat k razantnímu snížení nově vzniklých případů MRONJ.
Tyto výsledky naznačují, že další účinky bisfosfonátů, zejména cytotoxicita, inhibice angiogeneze a imunomodulační efekt (tedy zejména jejich efekt na měkké tkáně) jsou, alespoň částečně, reverzibilní a tudíž ovlivnitelné. Výsledky tohoto experimentu naznačují, a autoři pokládají za racionální, vysazení bisfosfonátů 2–3 měsíce před chirurgickým výkonem v dutině ústní a jejich opětovné nasazení 2 měsíce po výkonu.
Jiná situace nastává u léčby denosumabem,který není vázaný v kosti a jehož biologický poločas činí 26 dní. Aktivita denosumabu je tak v organismu již po 3měsíčním přerušení léčby minimální. S poklesem aktivity denosumabu dochází k restartu kostní remodelace, což může usnadnit chirurgickou léčbu MRONJ (demarkace nekrotické kosti, odloučení sekvestru). Denosumab se tedy doporučuje také vysadit optimálně 3 měsíce před plánovaným chirugickým výkonem v dutině ústní a jeho užívání zahájit 3 měsíce po výkonu. Efekt antiangiogenní medikace se obvykle projeví těžším postižením a zhoršeným hojením měkkých tkání, proto se doporučuje jejich vysazení 1–2 měsíce před výkonem a jejich opětovné nasazení 1–2 měsíce po výkonu.
3. 3 Lokalizace a frekvence výskytu osteonekrózy
Ke vzniku osteonekrózy vede v 52–61 % případů extrakce zubu [20]. Riziko osteonekrózy v případě léčby perorálními bisfosfonáty se udává 0,5 %, riziko osteonekrózy po extrakci zubu při nitrožilní léčbě bisfosfonáty se udává od 1,6 do 14,8 % [20].
Osteonekróza postihuje v 73 % případů mandibulu, ve 22,5 % maxilu a v 4,8 % postihuje obě čelisti [20]. Riziko vzniku osteonekrózy v závislosti na léčbě a čase uvádí tabulka 2.
Table 2. Míry rizika vzniku osteonekrózy v různých skupinách pacientů 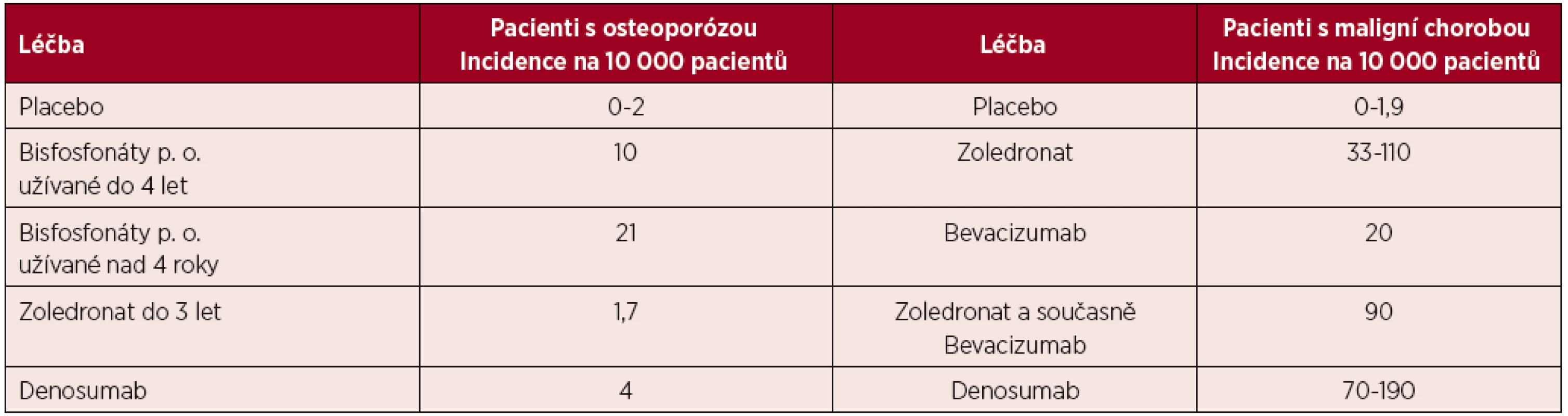
(podle [20]) Incidence osteonekrózy je podle dostupných údajů u nemocných s mnohočetným myelomem nejvyšší ze všech nádorů. Durie et al. uvádí v retrospektivním hodnocení provedeném na 1 203 pacientech s četností osteonekrózy u 6,8 % nemocných s mnohočetným myelomem a jen u 4,4 % nemocných s karcinomem prsu [33]. Bamias (2005) uvádí v prospektivním hodnocení souboru 252 nemocných incidenci osteonekrózy čelisti u 9,9 % pacientů s mnohočetným myelomem a jen u 2,9 % pacientek s karcinomu prsu [34]. V obou klinických hodnoceních byly podávanými bisfosfonáty pamidronat a zoledronat. Je prokázané, že riziko vzniku osteonekrózy čelisti stoupá s délkou podávání bisfosfonátu [34].
3. 4 Klinická stadia léky indukované osteonekrózy čelisti
Pro léky indukovanou osteonekrózu čelisti lze najít více definicí. Podmínkou definice podle AAOMS z roku 2014 je:
- Současná či předcházející léčba některým z antiangiogeních nebo antiresorpčních léků, uvedených v tabulce 1.
- Nepředcházela žádná radioterapie na oblasti čelistí.
- Viditelná nebo extraorální nebo intraorální píštělí sondovatelná kost čelisti v oblasti maxillofaciální, trvající déle než 8 týdnů. Přitom čelist není metastaticky postižená [19, 38].
Italští odborníci (Italian Society of Oral Pathology and Medicine) definují nejen na základě stomatologického vyšetření ale i na základě CT zobrazení a nevyžadují viditelně obnaženou čelistní kost. Definují léky indikovanou osteonekrózu čelisti jako progresivní destrukci a nekrózu kostí čelisti u pacientů léčených uvedenými léky. Opět podmínkou je nepřítomnost radioterapie [35].
Podle Evropské studie 76 % osteonekróz splnilo Ruggierova kritéria, zatímco 24 % by uniklo diagnóze, protože osteonekrotická kost nebyla zrakem patrná, ale byla zřetelná při CT vyšetření [36]. Speciální CT vyšetření čelisti má tedy pro její častou detekci dnes také svoje místo. Pro hodnocení rozsahu osteonekrózy čelisti byly vytvořeny také klasifikace, které uvádí tabulka 3.
Table 3. Hodnocení rozsahu osteonekrózy čelisti podle jednotlivých publikovaných kritérií 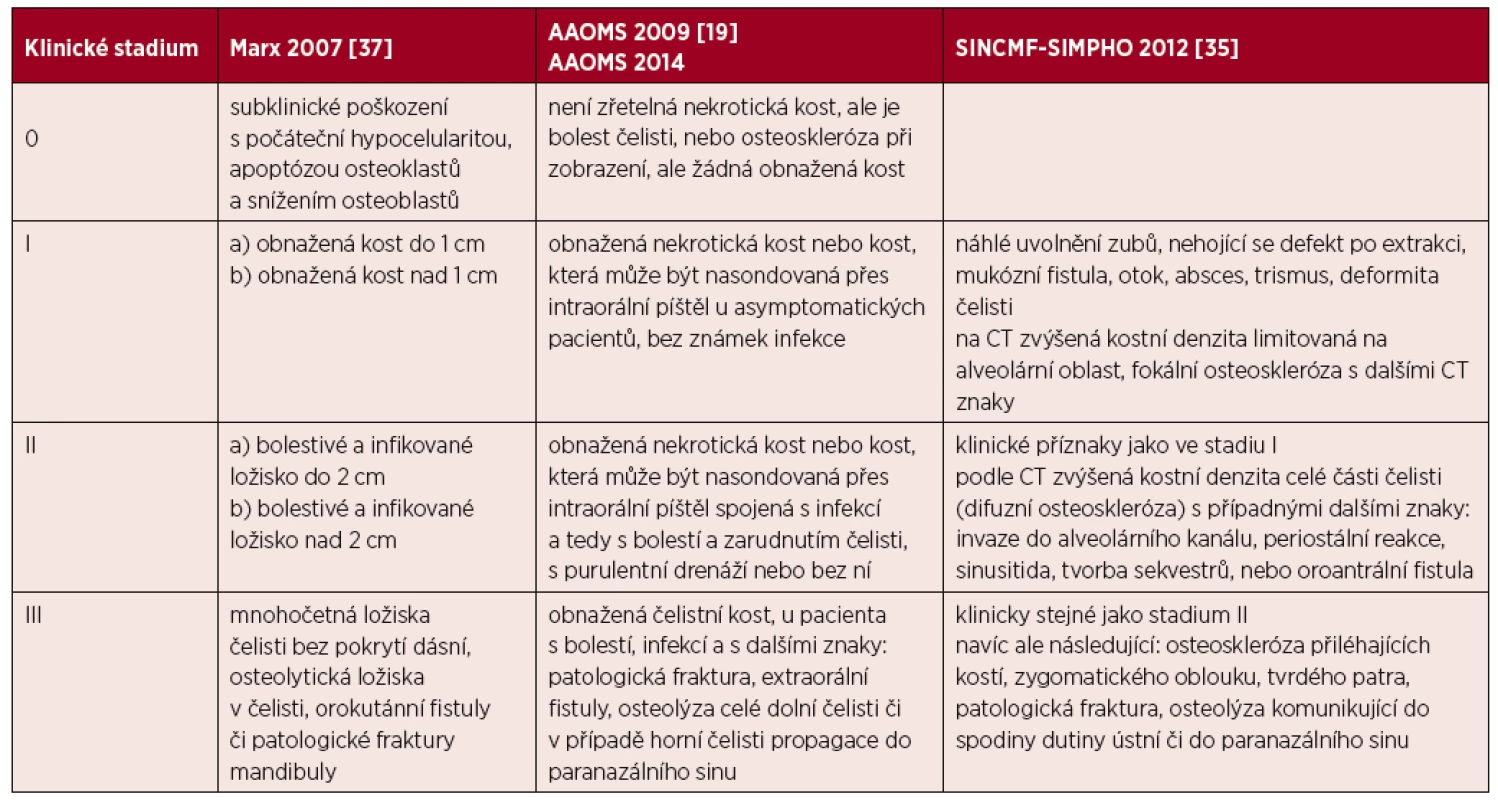
Diferenciálně diagnosticky musí stomatochirurg odlišit osteonekrózu čelisti od alveolární osteitidy, sinusitidy (zejména aspergilové), gingivitis/periodontitis, následků periapikálních zánětů, karcinom případně sarkom (nádorové onemocnění) dutiny ústní, chronickou sklerotizující osteomyelitis („proliferative periostitis“), nemoci temporomandibulárního kloubu a osteoradionekrózu.
3. 5 Preventivní opatření
Léčba již vzniklé osteonekrózy je omezeně úspěšná, a proto je důraz kladen na prevenci.
- Seznámit pacienta s riziky těchto léků a zvážit, co bude pro pacienta vhodnější.
- Před léčbou provést panoramatický snímek čelisti a vyšetření stomatologem se zkušenostmi s léčbou této komplikace. Doporučuje se extrakce zubů s velkou mobilitou, grade III, nebo zubu s periapikálním nálezem, vždy s antibiotickou profylaxí (u pacientů před zahájením léčby bisfosfonáty antibiotickou profylaxi neindikujeme, není-li doporučena z jiného důvodu).
- Také doporučujeme veškerá protetická ošetření, zejména zhotovení nových korunek, můstků a snímatelných náhrad, zhotovit před nasazením bisfosfonátů (cílené vyhledání otlaků a úprava náhrad než dojde k útlumu kostní remodelace).
- Pokud by však extrakce více zubů měla za následek dlouhodobější poruchu v příjmu stravy, musí se lékař domluvit s pacientem, a vyhodnotit co představuje větší negativum, zda nepodávání bisfosfonátů nebo provedení četných extrakcí s následnou neschopností kousat. Pacienti s myelomem jsou často špatně pohybliví, takže dostavit se na odpovídající protetické práce nemusí být snadno řešitelný problém. U těchto pacientů se proto uchylujeme k odložení aplikaci bisfosfonátů do doby, než se zlepší hybnost nemocného a tedy jeho schopnost docházet na protetické stomatologické ošetření.
- Před každou aplikací bisfosfonátů se ptáme pacienta, zda nemá nové problémy se zuby, které dříve neměl. V případě, že je třeba extrakce zubu, doporučuje se přerušení léčby až 2–3 měsíce před extrakcí, pokud to není urgentní výkon. Tento postup však není podpořen žádnou klinickou studií [39, 40]. Stomatochirurgický výkon (prosté vytržení zubu) se doporučuje provádět s antibiotickou profylaxí (např. Augmentin či Amoksilav á 1 g až 1 tabletu po 12 hodinách začít užívat 3 dny před výkonem a poté 1 g á 12 hod. po dobu zhruba týdne, než dojde ke slizničnímu zhojení extrakční rány). Při alergii na peniciliny lze použít Dalacin 300 mg 1 tbl. po 8 hod. Nezbytné je provést pečlivou egalizaci okrajů extrakčního lůžka a hermetickou suturu rány. Důležité jsou také pravidelné stomatologické kontroly, neboť i v oblasti primárně zhojeného extrakčního lůžka může následně dojít k rozvoji MRONJ.
- 1. Američtí stomatologové doporučují u nejrizikovějších, tedy u onkologických pacientů léčených i. v. bisfosfonáty nebo u pacientů léčených perorálními bisfosfonáty více než 4 roky provádět v intervalu 6–12 měsíců pravidelné klinické prohlídky zkušeným stomatologem i s případným panoramatickým snímkem čelisti [19, 40]. O kontrolní prohlídky stomatologem se snažíme v ročních intervalech i na našem pracovišti a provedení kontrolního panoramatického snímku čelisti necháme na rozhodnutí stomatologa.
- 2. S prodlužujícím se životem nemocných se častěji než dříve setkáváme s otázkou, zda může být u pacientů na antiresorpční terapii nebo u pacientů po úspěšné léčbě osteonekrózy zaveden dentální implantát. Pro tento výkon bisfosfonáty představují výrazné zvýšení rizika a nejde jen o riziko osteonekrózy, ale i o riziko odhojení implantátu. Míře rizika zubních implantátů u pacientů dostávajících bisfosfonáty se zatím nevěnovala žádné prospektivní randomizovaná studie, jsou zde k dispozici pouze popisy případů a přehledy zatím publikovaných sdělení. V roce 2016 se doporučuje pouze vysvětlit pacientovi, že v případě zubních implantátů u pacientů užívajících bisfosfonáty je zvýšené riziko vzniku osteonekrózy v místě implantátu. Doporučuje se individuálně zvážit, jak moc stávající choroba inhibuje imunitní procesy hojení a vždy použít perioperativní antimikrobiální profylaxe [41, 42]. Doporučení na téma implantace u pacientů na antiresorpční terapii jsou do dnešního dne poměrně nekonzistentní. Podle AAOMS 2014 je zavedení dentálních implantátů se zvýšeným rizikem možné u pacientů léčených perorálními bisfosfonáty pro osteoporózu, ale kontraindikované u onkologických pacientů léčených intravenózními bisfosfonáty. Také augmentace kosti se u pacientů užívajících bisfosfonáty nedoporučují. Podle jiných autorů mohou být implantáty zavedeny i pacientům po úspěšné léčbě MRONJ, u kterých mohou být jedinou možností protetické rehabilitace chrupu.
- 3. U vysoce rizikových pacientů (onkologické onemocnění, kortikosteroidy, imunosupresiva, dlouhodobá léčba bisfosfonáty), se implantace až na výjimky nedoporučuje. Podmínkou implantace je mimo jiné dobrá dentální hygiena a spolupráce pacienta a také možnost dlouhodobého přerušení antiresorpční terapie (podle literatury až na 6 let). Již oseointegrované implantáty zavedené před zahájením antiresorpční léčby, by, podle dostupných informací, neměly představovat pro vznik MRONJ vyšší riziko, než pacientovy vlastní zuby, ačkoliv nutnost opětovného zahájení antiresorpční terapie riziko vzniku MRONJ u oseointegrovaných implantátů zvyšuje.
3. 6 Léčba již vzniklé osteonekrózy
Léčba by měla probíhat na centrech, která mají s touto komplikací zkušenosti.
Oproti preventivním opatřením, kde panuje víceméně všeobecná shoda, je správný léčebný postup již vzniklé léky indukované osteonekrózy stále předmětem diskuse. AAOMS doporučuje léčebnou strategii řídit v závislosti na stadiu osteonekrózy. U nižších stadií se přiklání ke konzervativnímu postupu, chirurgické odstranění nekrotické kosti doporučuje jen v posledním stadiu onemocnění [43].
V poslední době se však stále více začíná uplatňovat zcela opačná léčebná strategie doporučující co nejčasnější odstranění nekrotické kosti, tento postup podporuje například Německá společnost pro maxilofaciální chirurgii.
Zdůvodněním tohoto přístupu je odstranění odhalené nekrotické kosti, která představuje vstupní bránu pro infekci podporující zánět, včasným odstraněním se také snižuje riziko progrese nekrózy, chirurgickou terapií je dosaženo zhojení ložiska v podstatně kratší době a s vyšší úspěšností (podle různých studií 85% úspěšnost chirurgické terapie oproti 20% konzervativní, pokud je za cíl považováno slizniční zhojení defektu a ne jen ústup obtíží).
Základním předpokladem úspěšné chirurgické terapie je odstranění veškeré devitální kosti, ohlazení všech ostrých okrajů a hermetický uzávěr defektu mukoperiostálním lalokem bez napětí. Výkon je prováděn v antibiotické cloně a v užívání antibiotik se doporučuje pokračovat do slizničního zhojení. K podpoře hojení se zkoušejí další adjuvantní postupy jako ozonoterapie, aplikace kmenových buněk, růstových faktorů, paratyroidního hormonu a další postupy, ke stanovení úspěšnosti těchto postupů je však zapotřebí vyhodnocení větších studií.
Na Klinice ústní, čelistní a obličejové chirurgie FN Brno se přikláníme k časné chirurgické terapii MRONJ s užitím fibrinu bohatého na destičky (PRF – „platelet rich fibrin“) k podpoře hojení kostního defektu i měkkých tkání a snížení rizika recidivy onemocnění.
4 ATYPICKÉ FRAKTURY
V roce 2008, pět let poté, co byla popsána osteonekróza čelisti při bisfosfonátech, si lékaři všimli, že dlouhodobá aplikace bisfosfonátů způsobuje zvýšenou křehkost kosti a že se objevují takzvané „atypické fraktury“, které vznikají v místech, kde nejsou žádná patologická osteolytická ložiska, bez odpovídajícího traumatického děje. První popisy této vzácné komplikace se tedy objevují po více než 20 letech podávání těchto léků. Tyto komplikace pravděpodobně existovaly i dříve, ale šlo zase o to, aby někdo z lékařů, kteří tyto léky svým pacientům předepisovali, zpozorněl, když se objevilo něco netypického a popsal tento jev [44–49]. Atypické fraktury kostí vznikají bez zvýšené fyzické zátěže či bez traumatu u osob dlouhodobě užívajících bisfosfonáty. Tyto léky totiž inhibují nejen patologickou osteolýzu a tak zmenšují počet kostních komplikací a zvyšují denzitu kosti, ale také blokují fyziologickou přestavbu kosti, což vede ke ztrátě pružnosti a zvýšené křehkosti. Typickými lokalizacemi jsou subtrochanterické fraktury femuru, fraktury pánve a femurů. O atypických frakturách v těchto lokalizacích je nejvíce publikací. Fraktury metatarzálních kostní jsou popisovány méně často, první popis je z roku 2006 [50].
A když se zeptáme literární databáze Medline-Pubmed, kdy byly atypické fraktury v důsledku bisfosfonátů popsány u pacientů s mnohočetným myelomem, tak první popisy se objevily až v roce 2008 a 2009. Popisují spontánní fraktury femuru u pacientů s mnohočetným myelomem, jeden dostával bisfosfonáty po dobu 9 let a druhý po dobu 11 let [51, 52].
Největší soubor pacientů s atypickými frakturami metatarzálních kostí zveřejnili autoři z Kalifornie. Popisují osud 6 pacientů s mnohočetným myelomem, kteří mimo jiné byli léčeni také dusík obsahujícími bisfosfonáty. K fraktuře metatarzálních kostní u těchto 6 pacientů došlo nejdříve po 5,5 letech podávání bisfosfonátů (5,5; 7,5; 7,5; 7,6; 8,8 a 11 let), medián intervalu podávání bisfosfonátů do vzniku první fraktury uvádějí 7,55 roku. Uvedených 6 pacientů patřilo do skupiny 300 pacientů, sledovaných v kalifornském centru. Z tohoto souboru pouze 49 pacientů dostávalo bisfosfonáty při mnohočetném myelomu déle než 5,5 let. Takže metatarzální fraktury se objevily u 12 % pacientů, kteří dostávali bisfosfonáty déle lež 5,5 let. Autoři z toho soudí, že tento typ fraktur po pěti letech nitrožilní aplikace bisfosfonátů nemůže být nijak vzácný [53]. Fraktury metatarzálních kostí byly dříve popisovány u zdravých osob, například u vojáků po dlouhých pochodech se zátěží, jako takzvané únavové fraktury. Nyní je můžeme vidět u osob užívajících dlouhodobě bisfosfonáty i bez zvýšené fyzické námahy. Jak osteonekrózu čelisti, tak atypické fraktury kostí jsme pozorovali také u našich pacientů [54, 55]. Na obrázku 2 je viditelná fraktura metatarzální kůstky vzniká bez odpovídající námahy u pacienta s mnohočetným myelomem.
Image 2. Atypická zlomenina (low energy fracture) v oblasti metatarzu vzniklá u pacienta dlouhodobě léčebného bisfosfonáty 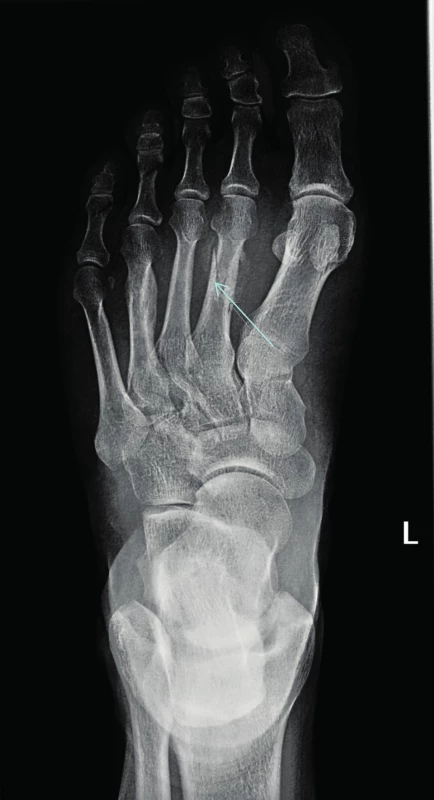
5 ZÁVĚRY PRO PRAXI
- Před podáním bisfosfonátů je nutné stomatologické vyšetření včetně panoramatického snímku čelistí a vhodné jsou i pravidelné kontroly stomatologem, který je informován o riziku osteonekrózy [56].
- V případě problematického chrupu s nutností četných extrakcí je na zvážení, co je pro pacienta závažnější, zda:
- a) provedení četných extrakcí i s očekávanými obtížemi při zajištění protetického řešení a podání bisfosfonátu;
- b) nebo ponechání problematického chrupu bez extrakcí a nepodání bisfosfonátů [56].
- V případně vzniku jedné ze dvou vzácných komplikací, osteonekrózy čelisti či atypické fraktury vlivem zvýšení křehkosti kostí je na lékaři, aby zvážil další potenciální přínos pokračování podávání bisfosfonátů oproti riziku progrese nežádoucích účinků a podle toho se rozhodl, zda v léčbě pokračovat či léčbu bisfosfonáty raději ukončit [56].
Podíl autorů na přípravě rukopisu
TJ – příprava první a finální verze rukopisu
ZJ, AZ, PL, KM, OL, SV, ŠM, KZ, ČA – revize rukopisu, schválení finální verze
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 15. 3. 2019.
Přijato po recenzi dne 13. 5. 2019.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
Brno-Bohunice
e-mail: adam.zdenek@fnbrno.cz
Sources
1. Russell RG. Bisphosphonates: the first 40 years. Bone 2011; 49(1): 2–19.
2. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003; 61(9): 1115–1117.
3. Ruggiero SL, Mehrota B. Osteonecrosis of the jaws associated with the use of bisphophonates; a review of 63 cases. J Oral Maxillofac Surg 2004; 62 : 527–534.
4. Marx RE, Sawatari Y, Fortin M, Broumand V. Bisphosphonates--induced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention and treatment. J Oral Maxillofac Surg 2005; 63 : 1567–1575.
5. Ferlito S, Liardo C, Puzzo S. Bisphosponates and dental implants: a case report and a brief review of literature. Minerva Stomatol 2011; 60(1–2): 75–81.
6. Montoya-Carralero JM, Parra-Mino P, Ramírez-Fernández P, et al. Dental implants in patients treated with oral bisphosphonates: a bibliographic review. Med Oral Patol Oral Cir Bucal 2010; 15(1): e65–e69.
7. Favia G, Piattelli A, Sportelli P, Capodiferro S, Iezzi G. Osteonecrosis of the posterior mandible after implant insertion: a clinical and histological case report. Clin Implant Dent Relat Res 2011; 13(1): 58–63.
8. Lenart BA, Lorich DG, Lane JM. Atypical fractures of the femoral diaphysis in postmenopausal women taking alendronate. N Engl J Med 2008; 358(12): 1304–1306.
9. Tonogai I, Goto T, Hamada D, Iwame T, et al. Bilateral atypical femoral fractures in a patient with multiple myeloma treated with intravenous bisphosphonate therapy. Case Rep Orthop 2014; 2014 : 452418. doi: 10.1155/2014/452418.
10. Puhaindran ME, Farooki A, Steensma MR, et al. Atypical subtrochanteric femoral fractures in patients with skeletal malignant involvement treated with intravenous bisphosphonates. J Bone Joint Surg Am 2011; 93(13): 1235–1242.
11. Epperla N, Pathak R. Hypocalcemia secondary to zoledronate therapy in a patient with low vitamin D level. WMJ 2015; 114(4): 163–166.
12. Noriega Aldave AP, Jaiswal S. Severe resistant hypocalcemia in multiple myeloma after zoledronic acid administration: a case report. J Med Case Rep 2014; 8 : 353.
13. Kreutle V, Blum C, Meier C, et al. Bisphosphonate induced hypocalcaemia – report of six cases and review of the literature. Swiss Med Wkly 2014; 144: w13979.
14. Do WS, Park JK, Park MI, et al. Bisphosphonate-induced severe hypocalcemia – a case report. J Bone Metab 2012; 19(2): 139–145.
15. Atula S, Powles T, Paterson A, McCloskey E: Extended safety profile of oral clodronate after long-term use in primary breast cancer patients. Drugs Safety 2003; 26 : 661–671.
16. Markowitz GS, Appel GB, Fine PL, et al. Collapsing focal segmental glomerulosclerosis wollowing treatment with high dose pamidronate J Am Soc Nephrol 2001; 12 : 1164–1172
17. Markowitz GS, Fine, PL, Stack FJ, et al. Toxic acute tubular necrosis following treatment with zolendronate (Zometa). Kidney Int 2003; 64 : 281–289.
18. Sauter M, Jülg B, Porubsky S, et al. Nephrotic-range proteinuria following pamidronate therapy in a patient with metastatic breast cancer: Mitochondrial toxicity as a pathogenetic koncept? Amer J Kidney Dis 2006; 47 : 1075–1080.
19. Ruggiero SL, Dodson TB Fantasia J, et al. American Association of Oral and Maxillofacial Surgeons position paper on medication releated ostenecrosis of the jaw 2014 update. J Oral Maxillofac Surg 2014; 72 : 1938–1956.
20. Rosella D, Papi P, Giardino R. Medication-related osteonecrosis of the jaw: clinical and practical guidelines. J Int Soc Prev Community Dent 2016; 6(2): 97–104.
21. Fusco V, Santini D, Armento G, et al. Osteonecrosis of jaw beyond antiresorptive (bone-targeted) agents: new horizons in oncology. Expert Opin Drug Saf 2016; 15(7): 925–935.
22. Qi WX, Tang LN, He AN, et al. Risk of osteonecrosis of the jaw in cancer patients receiving denosumab: a meta-analysis of seven randomized controlled trials. Int J Clin Oncol 2014; 19 : 403–408.
23. Estilo CL, Fornier M, Farooki A, et al. Osteonecrosis of the jaw related to bevacizumab. J Clin Oncol 2008; 26(24): 4037–4038.
24. Greuter S, Schmid F, Ruhstaller T, et al. Bevacizumab-associated osteonecrosis of the jaw. Ann Oncol 2008; 19(12): 2091–2092.
25. Brunello A, Saia G, Bedogni A, et al Worsening of osteonecrosis of the jaw during treatment with sunitinib in a patient with metastatic renal cell carcinoma. Bone 2009; 44(1): 173–175.
26. Koch FP, Walter C, Hansen T, et al. Osteonecrosis of the jaw related to sunitinib. Oral Maxillofac Surg 2011; 15(1): 63–66.
27. Fusco V, Porta C, Saia G, et al. Osteonecrosis of the jaw in patients with metastatic renal cell cancer treated with bisphosphonates and targeted agents: results of an Italian multicenter study and review of the literature. Clin Genitourin Cancer 2015; 13(4): 287–294.
28. Mawardi H, Enzinger P, McCleary N, et al. Osteonecrosis of the jaw associated with ziv-aflibercept. J Gastrointest Oncol 2016; 7(6): E81–E87.
29. Marino R, Orlandi F, Arecco F, et al. Osteonecrosis of the jaw in a patient receiving cabozantinib. Aust Dent J 2015; 60(4): 528–531.
30. Garuti F, Camelli V, Spinardi L, Bucci L, Trevisani F. Osteonecrosis of the jaw during sorafenib therapy for hepatocellular carcinoma. Tumori 2016; 102(Suppl 2): S69–S70.
31. Giancola F, Campisi G, Lo Russo L, et al. Osteonecrosis of the jaw related to everolimus and bisphosphonate: a unique case report? Ann Stomatol (Roma) 2013; 4(Suppl 2): 20–21.
32. Kim DW, Jung YS, Park HS, et al. Osteonecrosis of the jaw related to everolimus: a case report. Br J Oral Maxillofac Surg 2013; 51(8): e302–e304.
33. Durie BG, Katz, M, Crowley J. Osteonecrosis of the jaw and bisphosphonate. N Engl J Med 2005; 353 : 99–102.
34. Bamias A, Kastritis E, Bamia C, et al. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates: incidence and risk factors. J Clin Oncol 2005; 23 : 8580–8587.
35. Bedogni A, Fusco V, Agrillo A, Campisi G. Learning from experience. Proposal of a refined definition and staging system for bisphosphonate-related osteonecrosis of the jaw (BRONJ) Oral Dis 2012; 18 : 621–623.
36. Fedele S, Bedogni G, Scoletta M, et al. Up to a quarter of patients with osteonecrosis of the jaw associated with antiresorptive agents remain undiagnosed. Br J Oral Maxillofac Surg 2015; 53(1): 13–17.
37. Marx RE. Oral & intravenous bisphosphonate-induced osteonecrosis of the jaws: history, etiology, prevention, and treatment. 1st Ed. New Malden, Quintessence Publishing, 2007;1–160.
38. Ruggiero SL, Dodson TB, Assael LA, Landesberg R, Marx RE, Mehrotra B. American Association of Oral and Maxillofacial Surgeons position paper on bisphosphonate-related osteonecrosis of the jaws – 2009 update. J Oral Maxillofac Surg 2009; 67(5 Suppl): 2–12.
39. Damm DD, Jones DM. Bisphosphonate-related osteonecrosis of the jaws: A potential alternative to drug holidays. Gen Dent 2013; 61 : 33–38.
40. Hellstein JW, Adler RA, Edwards B, et al. Managing the care of patients receiving antiresorptive therapy for prevention and treatment of osteoporosis: executive summary of recommendations from the American Dental Association Council on Scientific Affairs. J Am Dent Assoc 2011; 142 : 1243–1251.
41. Walter C, Al-Nawas B, Wolff T, Schiegnitz E, Grötz KA. Dental implants in patients treated with antiresorptive medication - a systematic literature review. Int J Implant Dent 2016; 2(1): 9.
42. de-Freitas NR, Lima LB, de-Moura MB, et al. Bisphosphonate treatment and dental implants: A systematic review. Med Oral Patol Oral Cir Bucal 2016; 21(5): e644–e651.
43. Rugani P, Acham S, Kirnbauer B, Truschnegg A, Obermayer-Pietsch B, Jakse N. Stage-related treatment concept of medication-related osteonecrosis of the jaw-a case series. Clin Oral Investig 2015; 19 : 1329–1338.
44. Visekruna M, Wilson D, McKiernan FE. Severely suppressed bone turnover and atypical skeletal fragility. J Clin Endocrinol Metab 2008; 93(8): 2948–2952.
45. Kwek EB, Koh JS, Howe TS. More on atypical fractures of the femoral diaphysis. N Engl J Med 2008; 359(3): 316–317.
46. Lee P, Seibel MJ. More on atypical fractures of the femoral diaphysis. N Engl J Med 2008; 359(3): 317–318.
47. Whyte MP. Atypical femoral fractures, bisphosphonates, and adult hypophosphatasia. J Bone Miner Res 2009; 24(6): 1132–1134.
48. Black DM, Kelly MP, Genant HK, et al. Fracture Intervention Trial Steering Committee; HORIZON Pivotal Fracture Trial Steering Committee. Bisphosphonates and fractures of the subtrochanteric or diaphyseal femur. N Engl J Med 2010; 362(19): 1761–1771.
49. Breglia MD, Carter JD. Atypical insufficiency fracture of the tibia-associated with long-term bisphosphonate therapy. J Clin Rheumatol 2010; 16(2): 76–78.
50. Schneider JP. Should bisphosphonates continued indefinitely. An unusual fracture in healthy woman ond long-term bisphosphonate. Geriatrics 2006; 61 : 31–33.
51. Wernecke G, Namduri S, DiCarlo EF, et al. Case report of spontaneous nonspinal fracture in multiple myeloma pacient on long term pamidronate and zoledronic acid. HSS J 2008; 4 : 123–127
52. Grasko JM, Hermann RP, Vasikaran SD. Recurrent low-energy femoral shift fratures and osteonecrosis of the jaw in a case of multiple myeloma treated with bisphosphonates. J Oral Maxillofac Surg 2009; 67 : 645–649.
53. Waterman GN, Yellin O, Jamshidinia K, et al. Metatarsal stress fractures in patients with multiple myeloma treated with long-term bisphosphonates: a report of six cases. J Bone Joint Surg Am 2011; 93(18): e106. doi: 10.2106/JBJS.J.00455.
54. Adam Z, Sprláková-Puková A, Chaloupka R. et al. Atypická fraktura metatarsální kostni u pacienta s mnohočetným myelomem, který byl dlouhodobě léčeb bisfosfonáty. Vnitr Lek 2013; 59(11): 1022–1026.
55. Adam Z, Kozumpliková M, Pour L, et al. Osteonekróza čelisti v průběhu podávání léčby mnohočetného myelomu bisfosfonáty. Vnitř Lék 2006; 52(2): 176–180.
56. Maisnar V, Pour L, Krejčí M, et al. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou Myelómovou Spoločností pro diagnostiku a léčbu mnohočetného myelomuu mnohočetného myelomu. Transfuze Hematol dnes 2018; 24(Supl 1): 1–157.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2019 Issue 3-
All articles in this issue
- Klinické obrazy histiocytózy z Langerhansových buněk v dospělosti
- Farmakokinetika v léčbě hemofilie
- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Nábor dárců krvetvorných buněk do Českého národního registru dárců dřeně v letech 2013–2017 (demografická data)
- Externí hodnocení kvality stanovení CD34+ buněk v České a Slovenské republice – dlouhodobé zkušenosti z osmiletého období
- Sirolimus – alternativa pro léčbu autoimunitní hemolytické anémie způsobené tepelnými protilátkami (WAIHA)
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Farmakokinetika v léčbě hemofilie
- Sirolimus – alternativa pro léčbu autoimunitní hemolytické anémie způsobené tepelnými protilátkami (WAIHA)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

