-
Medical journals
- Career
Vplyv nádorového metabolizmu na terapiu detských leukémií
Authors: I. Heřmanová 1,2; J. Stárková 1,2
Authors‘ workplace: CLIP – Childhood Leukaemia Investigation Prague 1; Klinika dětské hematologie a onkologie, 2. lékařská fakulta, Univerzita Karlova a FN Motol, Praha 2
Published in: Transfuze Hematol. dnes,24, 2018, No. 4, p. 253-267.
Category: Review/Educational Papers
Overview
L-asparagináza je kľúčovým cytostatikom používaným v liečbe detskej akútnej lymfoblastickej leukémie od 70. rokov minulého storočia. Citlivosť odpovede na L-asparaginázu korešponduje s úspešnosťou terapie a celkovým prežívaním pacientov. L-asparagináza je enzým, ktorý depletuje asparagín a glutamín v sére pacientov. Leukemické bunky nie sú schopné si tento nedostatok nahradiť a prechádzajú do bunkovej smrti. Nie všetci pacienti však reagujú rovnako citlivo na podanie tohto cytostatika. Štúdium účinku L-asparaginázy je preto zásadné pre odstránenie inter-individuálnych rozdielov medzi pacientmi a vylepšenie terapie. V tomto prehľadovom článku sa pokúsime popísať nový mechanizmus účinku L-asparaginázy a jeho potenciálny dopad na citlivosť leukemických buniek k tomuto liečivu.
KľÚČOVÉ SLOVÁ:
detská leukémia – L-asparagináza – chemoterapia – nádorový metabolizmus – rezistencia
TERAPIA DETSKEJ AKÚTNEJ LYMFOBLASTICKEJ LEUKÉMIE
Úspešnosť liečby detskej akútnej lymfoblastickej leukémie (ALL) sa v posledných desaťročiach dramaticky zlepšila. Do polovice 70. rokov minulého storočia išlo o ochorenie s veľmi vysokou úmrtnosťou. V súčasnej dobe dosahuje remisiu (vymiznutie blastov z kostnej drene a mimodreňových priestorov) 99 % pacientov, prežitie bez relapsu choroby (prežívanie bez udalosti; event free survival, EFS) takmer 80 % a celkové prežitie 85 %[1]. Najčastejšou príčinou neúspechu liečby ALL je relaps ochorenia, ktorý postihuje 15–20 % pacientov. Za týmto úspechom stojí zavedenie nových liečebných protokolov a stratifikácia pacientov podľa rizikových faktorov. Zaujímavé je, že repertoár cytostatík, ktorý sa používa, pozostáva z rovnakých prípravkov už od začiatku zavedenia štandardizovaného liečebného protokolu.
Jednou z kľúčových látok, ktorá sa používa pri terapii detskej ALL je L-asparagináza (ASNáza). ASNáza preukázateľne zlepšuje úspešnosť liečby, v monoterapii dosahuje kompletnú remisiu 40–60 % pacientov. Extenzívne klinické štúdie potvrdili benefit intenzívnej ASNázovej terapie v porovnaní s menej intenzívnou [2, 3]. Liečebný protokol DFCI 91-01 preukázal signifikantne lepší výsledok liečby detských pacientov s ALL, pravdepodobne vďaka intenzifikácii podávania ASNázy. Konkrétne, pacienti, ktorí tolerovali 25 a menej týždňov ASNázu mali horšie výsledky ako tí, ktorí dostávali ASNázu najmenej 26 týždňov. V ďalšej štúdii boli porovnané výsledky dvoch protokolov – COALL (nemecká pracovná skupina) a DCOG (Dutch Childhood Oncology Group). COALL používa vyššiu kumulatívnu dávku ASNázy. To možno vysvetľuje lepší EFS u ETV6-RUNX1 pozitívnych pacientov liečených COALL (5 ročné EFS 80 %) v porovnaní s ETV6-RUNX1 pozitívnymi pacientmi liečenými DCOG protokolom (5 ročné EFS 73 %). Napriek tomu, že sa používa už niekoľko desiatok rokov, mechanizmus cytotoxického účinku a príčiny rezistencie neboli dosiaľ dostatočne objasnené. Rezistencia na ASNázu je negatívny prognostický faktor [4, 5].
L-ASPARAGINÁZA
Základná charakteristika ASNázy a mechanizmus účinku
ASNáza je enzým, ktorý sa vyskytuje v rastlinách, živočíchoch a mikroorganizmoch. Primárne hydrolyzuje asparagín za vzniku aspartátu a amoniaku (obr. 1). Väčšina typov ASNáz má však i glutaminázovú aktivitu, čo znamená, že metabolizuje aj glutamín na glutamát a amoniak. Glutaminázová aktivita tvorí len 3–9 % asparaginázovej aktivity, v závislosti na zdroji enzýmu [6]. Antileukemický účinok bol pôvodne prisudzovaný predovšetkým asparaginázovej aktivite enzýmu. Deplécia glutamínu bola považovaná za príčinu niektorých nežiaducich účinkov a bola snaha vyvinúť ASNázu bez glutaminázovej aktivity. Nové štúdie však ukazujú, že deplécia glutamínu je pre cytotoxický účinok tiež potrebná [7]. Existujú štúdie, ktoré ukázali, že čím viac sú bunky citlivé na ASNázu, tým viac sú závislé výlučne na asparagíne. A navyše, účinnosť glutaminázovej aktivity ASNázy nie je dôležitá pre bunky s nízkou hladinou asparagín syntetázy (ASNS), antagonistu ASNázy [8].
Image 1. Mechanizmus účinku L-asparaginázy v normálnych a leukemických bunkách 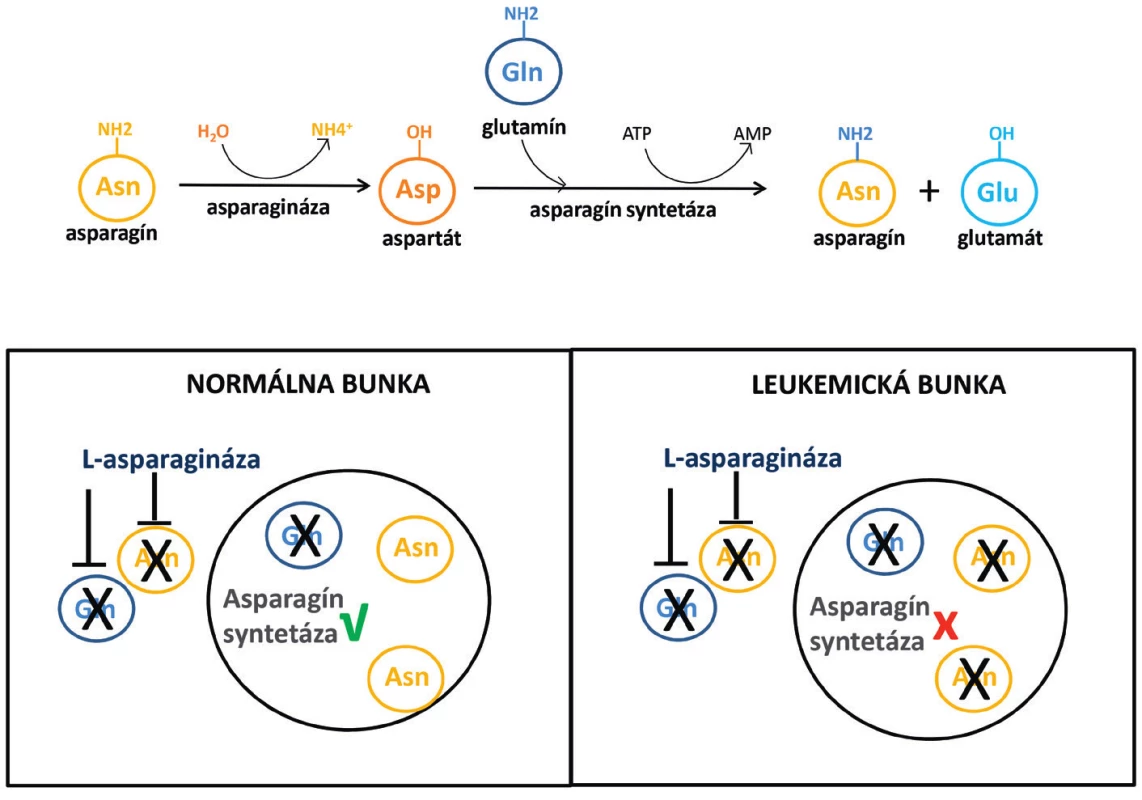
Objav terapeutického účinku L-asparaginázy
Protinádorový účinok ASNázy bol prvýkrát popísaný už v roku 1953, kedy Kidd et al. zistili, že podanie morčacieho séra inhibuje v myšiach rast lymfómu [9]. Ďalšie štúdie ukázali, že príčinou regresie tumoru je enzým ASNáza. V roku 1964 bolo zistené, že je možné ASNázu izolovať z baktérie Escherichia coli (E. coli), vďaka tomu bolo možné začať produkovať a používať tento enzým vo väčšom množstve. Súčasne boli zahájené klinické štúdie, ktoré potvrdili protinádorový účinok ASNázy. ASNáza bola následne zaradená do liečebných protokolov. Pri porovnávacích štúdiách bolo potvrdené, že ASNáza signifikantne zvýšila EFS a OS (celkové prežívanie, overall survival) [2, 3].
Mechanizmy vzniku rezistencie na L-asparaginázy
Napriek tomu, že je ASNáza v terapii ALL veľmi účinná, medzi jednotlivými pacientmi existujú rozdiely v citlivosti, vrátane prípadov rezistencie k tomuto liečivu. Rozdielna bazálna hladina génu pre ASNS bola považovaná za jednu z možných príčin interindividuálnych rozdielov. Experimenty na modeloch leukemických bunkových línií najprv potvrdili predpoklad korelácie expresie ASNS s citlivosťou k ASNáze. Pri snahe aplikovať tieto poznatky vo vzorkách pacientov sa však situácia značne skomplikovala. Pri analýze expresných profilov ALL pacientov nebola expresia génu pre ASNS medzi prvými 35 génmi, ktoré rozdelili pacientov podľa citlivosti k ASNáze do skupín pomocou hierarchického klastrovania [10]. Dalšie nezrovnalosti vo vzťahu ASNS a ASNázy sa ukázali počas štúdia senzitivity k tomuto liečivu u pacientov s fúznym génom ETV6-RUNX1. In vitro testy u týchto pacientov poukázali na vyššiu citlivosť na ASNázu v porovnaní s blastami ETV6-RUNX1-negatívnych pacientov [11]. Naša pracovná skupina [12] paralelne s holandskou skupinou Stams et al. [13] publikovala paradoxne zvýšenú expresiu génu pre ASNS u ETV6-RUNX1-pozitívnych pacientov. Nasledujúce štúdie odhalili, že problematika vzťahu medzi expresiou ASNS a citlivosťou ALL blastov k ASNáze je komplexnejšia. Práce publikovaná Finem et al. prezentujú klastrovanie ALL bunkových línií rezistentných, resp. senzitívnych k ASNáze na základe bazálnej expresie ASNS [14]. Klinické vzorky pacientov sa však pri rovnakom type analýzy takto nerozdelili. Bazálna expresia génu pre ASNS teda nebola prediktívna pre odpoveď primárnych vzoriek k ASNáze. Po podaní ASNázy však došlo k veľmi podobným zmenám expresie veľkého množstva génov v spomínaných líniách aj v klinických vzorkách.
Je zrejmé, že sa na účinku ASNázy i na vzniku rezistencie podieľa okrem ASNS viac faktorov. Jedným z nich môže byť aktivačný transkripčný faktor 5 (activating transcription factor 5, ATF5). ATF5 je súčasťou signalizačnej dráhy, ktorá je aktivovaná pri nedostatku aminokyselín a vedie k zvýšeniu expresie génu pre ASNS. Leukemické bunky rezistentné k ASNáze majú v porovnaní so senzitívnymi bunkami zvýšenú expresiu ATF5. Navyše bol u ALL pacientov objavený polymorfizmus v ATF5. Pacienti s týmto polymorfizmom majú nižší EFS, pričom táto spojitosť bola dokázaná len u pacientov liečených ASNázou [15].
Medzi ďalšie príčiny rozdielnej citlivosti ALL pacientov k ASNáze môže patriť strata proteínovej kinázy GCN2 (general control nonderepressible kinase 2). Táto kináza má jediný známy substrát, α-podjednotku eukaryotického iniciačného faktoru 2 (eIF2), a je nutná pri bunkovej adaptácii na nedostatok aminokyselín. Na myšom modeli bolo dokázané, že poškodenie funkcie GCN2 zvyšuje citlivosť k ASNáze [16, 17].
Úspešnosť terapie môže byť ovplyvnená tiež rozdielnou farmakokinetikou. ASNáza môže byť degradovaná lyzozomálnymi proteázami asparaginyl endopeptidázou a Cathepsinom B. Uvedené proteázy sú produkované lymfoblastmi. Štiepenie vedie k inaktivácii a vystaveniu epitopov imunitnej odpovede [18]. Predĺžená účinnosť ASNázy bola objavená u pacienta s germline mutáciou v géne kódujúcom Cathepsin B [19].
Svoju úlohu môže tiež zohrávať mikroprostredie kostnej drene. Mezenchymálne bunky kostnej drene majú schopnosť sekrécie asparagínu a in vitro ochrániť blasty pred následkami podania ASNázy [20]. Meraním obsahu asparagínu vo vzorkách pacientov však bolo dokázané, že po podaní ASNázy nedochádza k zvýšeniu obsahu asparagínu v kostnej dreni [21]. Protektívna úloha mezenchymálnych kmeňových buniek je preto diskutabilná.
Recentné publikované dáta poukazujú na vplyv adipocytov v kostnej dreni, ktoré sú schopné syntetizovať glutamín a do veľkej miery znižovať citlivosť pacientov na ASNázu [22].
Použitie l-asparaginázy u iných malígnych ochorení
ASNáza je zahrnutá do liečebných protokolov výhradne u ALL a non-Hodgkinových lymfómov. Jej potenciálny terapeutický účinok sa však študuje aj u iných typov hematologických malignít. Cytotoxický účinok ASNázy bol potvrdený na primárnych AML (akútna myeloidná leukémia) bunkách [23]. ASNáza je obmedzene transportovaná z vaskulárneho do extravaskulárneho prostredia, preto je komplikované jej využitie u solídnych nádorov [24]. Napriek tomu existujú štúdie, ktoré sa prípadným použitím ASNázy pre liečbu solídnych tumorov zaoberajú. Jedná sa predovšetkým o nádory ovarií, u ktorých preklinické štúdie dokázali anti-angiogénnu aktivitu ASNázy a senzitivitu ovariálnych nádorových línií k ASNáze [25, 26]. Druhá fáza klinických štúdií však bola pre vysokú toxicitu ASNázy ukončená [27]. Účinok ASNázy je ďalej študovaný u hepatocelulárneho karcinómu, u nádorov pankreasu, nádorov prostaty a nádorov mozgu [28–31].
METABOLICKÉ ZMENY NÁDOROVÝCH BUNIEK
Nepretržitý vývoj v oblasti charakterizácie nádorových buniek ukazuje, že nádorové ochorenia sú značne heterogénne. Môžeme ich rozdeliť podľa orgánového alebo tkanivového pôvodu, prípadne podľa molekulárneho subtypu, čím získame veľké množstvo podskupín, ktoré sa líšia prognózou, terapiou a výsledkom liečby. Pokrok v sekvenovaní DNA a v ďalších analytických technológiách umožnil rozlíšiť genetickú heterogenitu medzi histologicky podobnými tumormi a rozdielne fenotypy buniek z jednej nádorovej populácie. Avšak existuje skupina spoločných čŕt zahrňujúca biologické vlastnosti a schopnosti, ktoré súvisia s nádorovým bujnením. Jedna z týchto čŕt, ktorú prvýkrát popísali už skoro pred sto rokmi, jej rola však bola oficiálne uznaná až v roku 2011, je deregulovaný metabolizmus (obr. 2) [32].
Image 2. Hallmarks of cancer Popísané Hannahan a Weinberg, Cell 2011, kde priradili novú črtu nádorových buniek, a to deregulovaná bioenergetika. 
Thompson et al. ukázali, že mutácie v protoonkogénoch a nádorovo supresorových génoch sú priamo spojené s príjmom výživy a bioenergetickými požiadavkami nádorových buniek. Z toho vyplýva, že podobne ako iné abnormálne vlastnosti nádorových buniek, aj nádorový metabolizmus je prvotne ovplyvnený prítomnosťou genetických zmien [33, 34].
Tie vedú k dysregulácii hlavných signálnych dráh ovplyvňujúcich bioenergetické a biosyntetické procesy. Príkladom genetických lézií identifikovaných u leukemických pacientov, ktoré tieto javy ovplyvňujú, sú IDH1/2, MYC, AKT, PTEN a p53. PTEN, AKT, a zmeny PI3K boli zistené v 47,7 % prípadov akútnej T-bunkovej lymfoblastickej leukémie (T-ALL) [35, 36]. Znížená aktivita alebo úplná strata PTEN v myších modeloch indukovala T-ALL a T-bunkový lymfóm a strata PTEN určovala závažnosť myeloidných malignít [37, 38]. PTEN inhibuje jeden z hlavných regulačných prostriedkov bioenergetiky a biosyntetických procesov, dráhu PI3K/AKT/mTOR. Mutovaný MYC sa vyskytuje u B-bunkových neoplazií a s vysokou frekvenciou u chronickej lymfoblastickej leukémie (CLL) [39]. Okrem toho hladina MYC je indukovaná mnohými dráhami, ktoré sú u leukémie pozmenené, ako napríklad NOTCH1 alebo PI3K [40,41]. Zvýšená expresia MYC zvyšuje glykolýzu, katabolizmus glutamínu a mitogenézu [42–44]. Navyše MYC-indukované nádory u myších modelov sú závislé na metabolizme glutamínu [45]. Mutácie v TP53 sú asociované s nepriaznivou prognózou CLL a s rezistenciou na terapiu [46, 47]. Proteín TP53 vyvažuje glykolýzu a OXPHOS, aby obmedzil uvoľňovanie voľných radikálov – ROS [48, 49]. Všetky tieto genetické zmeny vedú onkogénny metabolický program, ktorý udržuje bunky nažive, poskytuje stavebné kamene pre neobmedzený rast buniek a mitogenézu.
CHARAKTERISTIKA NÁDOROVÉHO METABOLIZMU
Nádorové bunky majú v porovnaní so zdravými bunkami iný metabolický profil, respektíve uprednostňujú iné metabolické dráhy [32]. Zdravé diferencované bunky tvoria ATP v aeróbnych podmienkach prostredníctvom oxidatívnej fosforylácie. V anaeróbnych podmienkach využívajú menej efektívnu glykolýzu. Počas oxidatívnej fosforylácie vzniká z jednej molekuly glukózy 36 molekúl ATP, anaeróbnou glykolýzou vzniknú z jednej molekuly glukózy dve molekuly ATP. Nádorové bunky majú zvýšenú spotrebu glukózy, pričom len jej menšia frakcia je oxidovaná v Krebsovom cykle. Väčšina glukózy je použitá na produkciu laktátu, a to aj v prítomnosti kyslíka, preto sa táto reakcia nazýva aeróbna glykolýza. Zvýšenie aeróbnej glykolýzy na úkor oxidatívnej fosforylácie bola podľa objaviteľa pomenovaná Warburgov efekt [50, 51]. Dôvody, prečo nádorové bunky s preukázateľne vyššími energetickými nárokmi využívajú menej efektívnu glykolýzu, sa stále študujú. Pôvodná hypotéza, že nádorové bunky majú poškodené mitochondrie už bola vyvrátená [52]. Prečo teda k Warburgovmu efektu dochádza? Zvýšený obrat glukózy je pre nádorové bunky výhodný. Napriek tomu, že v priebehu glykolýzy vzniká menej molekúl ATP ako počas oxidatívnej fosforylácie, glykolytický tok je dostatočne rýchly nato, aby pokryl energetické nároky. Počas degradácie glukózy navyše vzniká množstvo medziproduktov potrebných pre biosyntetické dráhy, vrátane ribózových cukrov na tvorbu nukleotidov; glycerolu a citrátu na syntézu lipidov; neesenciálnych aminokyselín; a redukovanej formy Nikotinamidadenindinukleotidfosfátu (NADPH). Tieto medziprodukty vznikajú v rozvetvených reakciách glykolýzy, ako je napríklad pentózový cyklus [53, 54].
ZÁVISLOSŤ NA GLUTAMÍNE A ASPARAGÍNE
Významným substrátom je okrem glukózy tiež glutamín. Glutamín bol dlhodobo považovaný za neesenciálnu aminokyselinu, ktorej primárna funkcia je ukladať dusík vo svaloch a cirkulovať medzi orgánmi. Cicavčie bunky môžu syntetizovať glutamín vo väčšine tkanív, pokiaľ sa však v priebehu rastu alebo ochorenia zvýšia nároky na prítomnosť glutamínu, stáva sa aminokyselinou esenciálnou, preto sa nazýva podmienečne esenciálny. Proliferujúce bunky majú vysokú spotrebu glutamínu, čo dokazuje, že je glutamín ako substrát veľmi univerzálny. Metabolizmus glutamínu je možné rozdeliť podľa využitia γ-dusíka (syntéza nukleotidov, hexosamínov), α-dusíka alebo uhlíkového reťazca. Druhé dva typy reakcií využívajú ako substrát glutamát. Hoci majú nádorové bunky vysoký obsah intracelulárneho glutamátu, udržanie jeho hladiny závisí od schopnosti konvertovat glutamín na glutamát, pretože glutamínu je v extracelulárnom prostredí na rozdiel od glutamátu dostatok. Tento proces umožňuje prítomnosť glutaminázy, mitochondriálneho enzýmu, ktorý je vysoko exprimovaný v nádorových bunkách. Na experimentálnych modeloch bolo potvrdené, že inhibícia glutaminázovej aktivity vedie k poklesu rastu nádorových buniek a xenograftov [55, 56]. Glutamín je preto považovaný v prípade nádorového rastu za esenciálny [57]. V niektorých nádorových bunkách je glutamín primárny mitochondriálny substrát a je potrebný pre udržanie mitochondriálneho membránového potenciálu. Deamináciou glutamínu na pyruvát navyše vzniká NADPH, ktorý je nutný pre syntézu lipidov a pre redoxnú kontrolu. Dochádza tak tiež k doplneniu intermediátov Krebsovho cyklu (anaplerosis). Ďalej je potrebný pre vstrebávanie aminokyselín a aktiváciu kinázy mTOR. Glutamín sa podieľa na metabolizme, bunkovej signalizácii a génovej expresii, preto je snaha využiť terapeutiká, ktoré zasahujú do metabolizmu glutamínu, veľmi atraktívna a opodstatnená.
Asparagín je neesenciálna aminokyselina využívaná pri biosyntéze proteínov. Prekurzorom asparagínu je oxaloacetát. Transamináza prenesie amino skupinu z glutamátu na oxaloacetát za produkcie aspartátu a 2-ketoglutarátu. ASNS zasa prenesie amino skupinu z glutamínu na aspartát za vzniku asparagínu. V eukaryotických bunkách ASNS nepoužíva iný zdroj amino skupiny, preto je označovaná ako glutamín-dependentná. Asparagín vstupuje do Krebsovho cyklu zvyčajne ako oxaloacetát.
Pri skúmaní protinádorového účinku ASNázy sa najprv zistilo, že leukemické bunky v porovnaní s bunkami zdravými majú nižšiu aktivitu ASNS [58, 59]. Ďalej bola potvrdená nízka hladina expresie génu pre ASNS, zhodná s nízkou hladinou proteínu. Vznikla tak hypotéza, potvrdená niekoľkými publikáciami [11], že za účinkom ASNázy stojí závislosť leukemických buniek na extracelulárnom asparagíne. Zdravé tkanivá sú podľa tejto teórie schopné stratu asparagínu kompenzovať vďaka dostatočne aktívnej ASNS, prípadne zvýšením expresie tohto enzýmu v odpovedi na asparagínovú depléciu (viď obr. 1). Nedostatok asparagínu vedie v leukemických bunkách k poškodeniu proteosyntézy, syntézy DNA, RNA a následne k apoptóze.
Závislosť na asparagíne a glutamíne je úzko spojená. Adipocyty, ktoré produkujú signifikantné množstvo glutamínu inhibujú cytotoxický efekt ASNázy. Navyše, v myšiach transplantovaných ALL bunkami bolo preukázané, že obezita významne znižuje účinok ASNázy [22]. Schopnosť asparagínu kompenzovať stratu glutamínu pri dlhotrvajúcom deficite bola popísaná u bunkových línií nádorov mozgu [60].
ÚČINOK L-ASPARAGINÁZY NA METABOLICKÉ PREPROGRAMOVANIE LEUKEMICKÝCH BUNIEK
Práce, ktoré poukazujú na vplyv ASNázy na bioenergetické a biosyntetické procesy v bunkách, siahajú už do 70. rokov minulého storočia. Saunders popísal, že ASNáza inhibuje syntézu RNA a DNA, a tým zvyšuje svoj cytotoxický účinok [61]. V ďalšej práci autori ukázali inhibičný účinok ASNázy na syntézu inzulínu, ktorej následkom došlo u niektorých pacientov k hyperglykémii [62]. V tom istom období vyšli práce popisujúce ASNázu ako dysregulátora glykozylácie, ktorá je zásadná pre aktivitu bielkovín [63]. Proces glykozylácie vychádza z jednej z rozvetvených reakcií glykolýzy. Novšia práca ukázala, že cez pozmenenú glykozyláciu proteínov ASNáza ovplyvňuje mikroprostredie, a tým inhibuje invazivitu a angiogenézu u ovariálneho karcinómu [64]. Vplyv ASNázy na syntézu proteínu bol tiež popísaný vo viacerých prácach [65, 66].
V našej poslednej publikácii sme popísali komplexnejší obraz účinku ASNázy na metabolické procesy leukemických buniek (obr. 3). Študovali sme efekt ASNázy na tri hlavné bioenergetické dráhy: oxidatívna fosforylácia, glykolýza a oxidácia mastných kyselín. Leukemické bunky ošetrené ASNázou vykazovali zníženú glykolýzu, zvýšenú oxidáciu mastných kyselín, ktorej následkom došlo pravdepodobne k zvýšenej aktivite respiračného reťazca. Zaujímavé bolo, že ATP sa nezvýšilo, takže sa nejednalo o zvýšenie oxidatívnej fosforylácie, ktorej výsledným produktom je práve ATP. Inhibíciu glykolýzy sme dokázali na zníženom príjme glukózy značenej radioaktívne a tiež zníženou hladinou extracelulárneho laktátu, produktu glykolýzy. Tiež sme detekovali zníženú hladinu proteínu c-MYC ako aktivátora glykolýzy a glukózového transportéra 1. Zmeny v oxidácii mastných kyselín sme detekovali ako zmenu množstva 3H-H2O pomocou radioaktívnej metódy. 3H-H2O vzniká ako produkt oxidovaného radioaktívne značeného 3H-palmitátu v mitochondriách. Oxidácia mastných kyselín slúži k produkcii NADH, FADH2 a acetyl-CoA, ktoré doplňujú Krebsov cyklus, čo následne vedie k aktivácii mitochondriálnej oxidatívnej fosforylácii. Oxidácia mastných kyselín je preto dôležitá pre bunkový rast nádorových buniek v normálnych aj deprivovaných podmienkach [67,68]. Podiel oxidácie mastných kyselín na bunkovom prežívaní bol popísaný u rôznych typov nádorov, ako je difúzny veľkobunkový B lymfóm, mnohopočetný myelóm a glioblastóm [69–71]. Aktivita oxidácie mastných kyselín môže tiež spôsobovať chemorezistenciu, čo bolo ukázané na adenokarcinóme pľúc. Inhibítor oxidácie mastných kyselín etomoxir zvýšil citlivosť tohto nádoru k paklitaxelu [72]. Farmakologická inhibícia oxidácie mastných kyselín by mohla byť prospešná aj pri liečbe hematologických ochorení, na myšom modeli s myeloidnou leukémiou bolo ukázané, že potencuje účinok konvenčnej chemoterapie [73].
Image 3. Výsledky z publikácie Heřmanová et al., Leukemia 2016 zhrňujúce vplyv L-asparaginázy na hlavné bioenergetické procesy leukemických buniek OXPHOS – oxidatívna fosforylácia, FAO – fatty acid oxidation, oxidácia mastných kyselín. 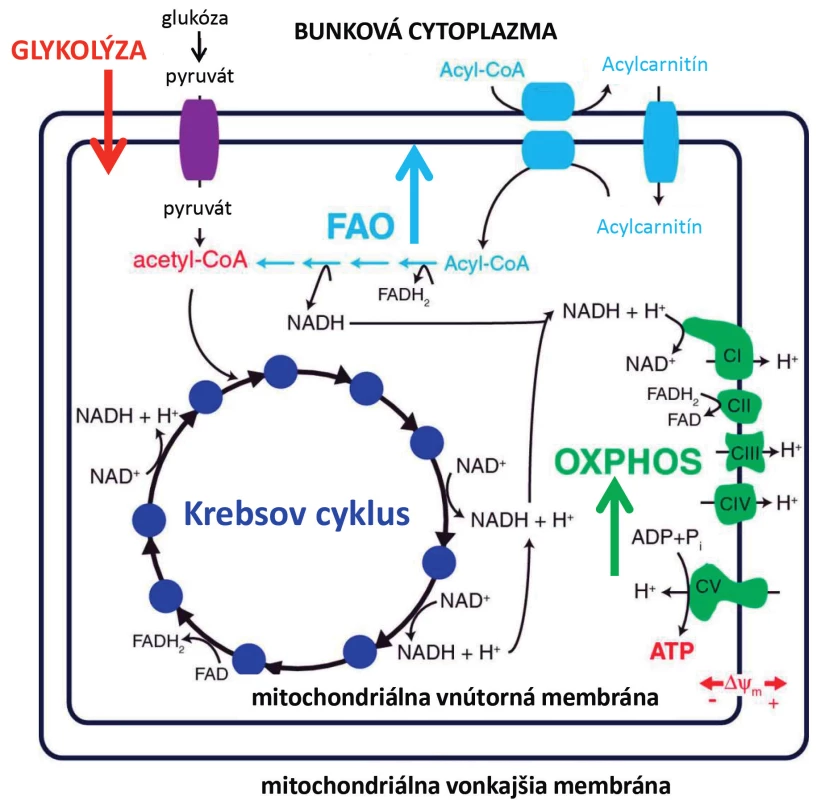
Potenciálne klinický zaujímavý výsledok sme dosiahli, keď sme leukemické línie a tiež leukemické bunky izolované z kostnej drene pacientov kultivovali samostatne s ASNázou alebo pre porovnanie v kombinácii s etomoxirom v ex vivo podmienkach. Ukázali sme, že inhibítor oxidácie mastných kyselín zvyšuje citlivosť leukemických buniek na ASNázu. Z týchto výsledkov vyplýva, že ASNáza okrem anti-leukemického účinku spúšťa tiež záchranné procesy, medzi ktoré môžeme zaradiť aktiváciu oxidácie mastných kyselín. Ďalší proces, ktorý bol v našom modeli po podaní ASNázy zmenený, bola autofágia. Autofágia bola v súvislosti s účinkom ASNázy opakovane popisovaná a tiež bolo ukázané, že inhibícia autofágie pomocou hydrochloroquinu vedie k zlepšeniu cytotoxických účinkov ASNázy v in vitro aj in vivo podmienkach na myších xenograftoch [74].
ZÁVER
Pozmenený metabolizmus sa účastní leukemogénneho procesu a tiež samotného priebehu ochorenia. Súčasné publikácie popisujú metabolické preprogramovanie nádorových buniek, ktoré je schopné znížiť efektívnosť terapie a eventuálne viesť k vzniku rezistencie. Rezistencia na cytostatiká je jednou z príčin vzniku relapsu. V tomto prehľadovom článku sme sa snažili podrobne popísať účinok ASNázy, ktorej podanie je kľúčové v liečbe detskej ALL. Ďalej sme popísali zmeny v metabolizme leukemických buniek pri podaní ASNázy, ktoré nebudú výnimočné len pre toto liečivo. Existujú aj iné cytostatiká, u ktorých bol tento jav popísaný: dexametazón u chronickej lymfoblastickej leukémie, imatinib u chronickej myeloidnej leukémie a bortezomib u mnohopočetného myelómu [75–77]. Veríme, že pochopenie metabolických zmien v dôsledku adaptácie na podávanú cytostatickú liečbu by mohlo:
- a) lepšie stratifikovať pacientov podľa citlivosti/rezistencie,
- b) odhaliť procesy zapojené do mechanizmu rezistencie a
- c) znížiť závažné vedľajšie účinky.
Nádorový metabolizmus sa v súčasnosti študuje ako nová možnosť cielenej terapie. Klinické štúdie testujúce účinok anti-metabolických látok v monoterapii alebo v kombinácii so súčasnou terapiou v nasledujúcich rokoch odhalia jej výhody, ale aj nevýhody a možnosti využitia v klinickej praxi.
Podíl autorů na přípravě rukopisu
IH – napísala celú časť o objavení, účinku a využitia L-asparaginázy v terapii ALL
JS – napísala časť o nádorovom metabolizme, účinku L-asparaginázy na metabolický stav buniek a zhrňujúci záver
Poděkování
Práca bola podporená grantovou agentúrou AZV ČR Ministerstva zdravotníctva Českej republiky (NV15-28848A), inštitucionálnou podporou Nemocnice Motol, Praha, Česká republika (00064203) a Ministerstvom školstva, mládeže a telovýchovy Českej republiky NPU I nr.LO1604.
Čestné prohlášení autorů
Autori práce prehlasujú, že v súvislosti s témou, vznikom a publikáciou tohto článku nie sú v strete záujmu a vznik a ani publikácia článku neboli podporené žiadnou farmaceutickou firmou.
Doručeno do redakce dne 15. 5. 2018.
Přijato po recenzi dne 17. 7. 2018.
RNDr. Júlia Starková, PhD.
CLIP laboratorní centrum
Klinika dětské hematologie a onkologie
2. lékařská fakulta, Univerzita Karlova a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: julia.starkova@lfmotol.cuni.cz
Sources
1. Stary J, Zimmermann M, Campbell M, et al. Intensive chemotherapy for childhood acute lymphoblastic leukemia: Results of the randomized intercontinental trial ALL IC-BFM 2002. J Clin Oncol 2014;32(3):174–184.
2. Pession A, Valsecchi MG, Masera G, et al. Long-term results of a randomized trial on extended use of high dose L-asparaginase for standard risk childhood acute lymphoblastic leukemia. J Clin Oncol 2005;23(28):7161–7167.
3. Silverman LB, Gelber RD, Dalton VK, et al. Improved outcome for children with acute lymphoblastic leukemia: results of Dana-Farber Consortium Protocol 91-01. Blood 2001;97(5):1211–1219.
4. Kaspers GJ, Pieters R, Van Zantwijk CH, et al. Prednisolone resistance in childhood acute lymphoblastic leukemia: vitro-vivo correlations and cross-resistance to other drugs. Blood 1998;92(1):259–266.
5. Appel IM, Kazemier KM, Boos J, et al. Pharmacokinetic, pharmacodynamic and intracellular effects of PEG-asparaginase in newly diagnosed childhood acute lymphoblastic leukemia: results from a single agent window study. Leuk Off. J Leuk Soc Am Leuk Res Fund, 2008;22(9):1665–1679.
6. Krasotkina J, Borisova A, Gervaziev YV, Sokolov NN. One-step purification and kinetic properties of the recombinant L-asparaginase from Erwinia carotovora. Enzyme 2004;221 : 215–221.
7. Offman MN, Krol M, Patel N, et al. Rational engineering of L-asparaginase reveals importance of dual activity for cancer cell toxicity Rational engineering of L-asparaginase reveals importance of dual activity for cancer cell toxicity. Protein Eng 2012;117(5):1614–1621.
8. Chan WK, Lorenzi PL, Anishkin A, et al. The glutaminase activity of L - Asparaginase is not required for anticancer activity against ASNS-negative cells. Blood 2014;123(23):3596–3606.
9. Ohnuma T, Holland JF, Freeman A, Sinks LF. Biochemical and pharmacological studies with asparaginase in man biochemical in man and pharmacological studies with asparaginase. Cancer Res 1970;30 : 2297–2305.
10. Holleman A, Cheok MH, den Boer ML, et al. Gene-expression patterns in drug-resistant acute lymphoblastic leukemia cells and response to treatment. N Engl J Med 2004;351(6):533–542.
11. Ramakers-van Woerden NL, Pieters R, Loonen AH, et al. TEL/AML1 gene fusion is related to in vitro drug sensitivity for L-asparaginase in childhood acute lymphoblastic leukemia. Blood 2000;96(3):1094–1099.
12. Krejci O, Starkova J, Otova B, et al. Upregulation of asparagine synthetase fails to avert cell cycle arrest induced by L-asparaginase in TEL/AML1-positive leukaemic cells. Leukemia 2004;18(3):434–441.
13. Stams WAG, den Boer ML, Beverloo HB, et al. Sensitivity to L-asparaginase is not associated with expression levels of asparagine synthetase in t(12;21)+ pediatric ALL. Blood 2003;101(7):2743–2747.
14. Fine BM, Kaspers GJL, Ho M, Loonen AH, Boxer LM. A genome-wide view of the in vitro response to L-asparaginase in acute lymphoblastic leukemia. Cancer Res 2005;65(1):291–299.
15. Tanfous M Ben, Sharif-Askari B, Ceppi F, et al. Polymorphisms of asparaginase pathway and asparaginase-related complications in children with acute lymphoblastic leukemia. Clin Cancer Res 2015;21(2):329–334.
16. Bunpo P, Dudley A, Cundiff JK, et al. GCN2 protein kinase is required to activate amino acid deprivation responses in mice treated with the anti-cancer agent L-asparaginase. J Biol Chem 2009;284(47):32742–32749.
17. Wilson GJ, Bunpo P, Cundiff JK, Wek RC, Anthony TG. The eukaryotic initiation factor 2 kinase GCN2 protects against hepatotoxicity during asparaginase treatment. Am J Physiol Endocrinol Metab 2013;305(9):E1124–1133.
18. Patel N, Krishnan S, Offman MN, et al. A dyad of lymphoblastic lysosomal cysteine proteases degrades the antileukemic drug L-asparaginase. J Clin Invest 2009;119(7):1964–1973.
19. van der Meer LT, Waanders E, Levers M, et al. A germ line mutation in cathepsin B points toward a role in asparaginase pharmacokinetics. Blood 2014;124(19):3027–3029.
20. Iwamoto S, Mihara K. Mesenchymal cells regulate the response of acute lymphoblastic leukemia cells to asparaginase. J Clin Invest 2007;117(4):1049–1057.
21. Tong WH, Pieters R, Hop WCJ, et al. No evidence of increased asparagine levels in the bone marrow of patients with acute lymphoblastic leukemia during asparaginase therapy. Pediatr Blood Cancer 2013;60(2):258–261.
22. Ehsanipour EA, Sheng X, Behan JW, et al. Adipocytes cause leukemia cell resistance to L-asparaginase via release of glutamine. Cancer Res 2013;73(10):2998–3006.
23. Willems L, Jacque N, Jacquel A, et al. Inhibiting glutamine uptake represents an attractive new strategy for treating acute myeloid leukemia Inhibiting glutamine uptake represents an attractive new strategy for treating acute myeloid leukemia. Blood 2013;122(20):3521–3532.
24. McCredie KB, Ho DH, Freireich EJ. L-asparaginase for the treatment of cancer. CA Cancer J Clin 1973;23(4):220–227.
25. Lorenzi PL, Llamas J, Gunsior M, et al. Asparagine synthetase is a predictive biomarker of L-asparaginase activity in ovarian cancer cell lines. Mol Cancer Ther 2008;7(10):3123–3128.
26. Lorenzi PL, Reinhold WC, Rudelius M, et al. Asparagine synthetase as a causal, predictive biomarker for L-asparaginase activity in ovarian cancer cells. Mol Cancer Ther 2006;5(11):2613–2623.
27. Hays JL, Kim G, Walker A, et al. A phase II clinical trial of polyethylene glycol-conjugated L-asparaginase in patients with advanced ovarian cancer: Early closure for safety. Mol Clin Oncol 2013;1(3):565–569.
28. Panosyan EH, Wang Y, Xia P, et al. Asparagine depletion potentiates the cytotoxic effect of chemotherapy against brain tumors. Mol Cancer Res 2014;12(5):694–702.
29. Tardito S, Chiu M, Uggeri J, et al. L-Asparaginase and inhibitors of glutamine synthetase disclose glutamine addiction of β-catenin-mutated human hepatocellular carcinoma cells. Curr Cancer Drug Targets 2011;11(8):929–943.
30. Sircar K, Huang H, Hu L, et al. Integrative molecular profiling reveals asparagine synthetase is a target in castration-resistant prostate cancer. Am J Pathol 2012;180(3):895–903.
31. Dufour E, Gay F, Aguera K, et al. Pancreatic tumor sensitivity to plasma L-asparagine starvation. Pancreas 2012;41(6):940–948.
32. Hanahan D, Weinberg RAA. Hallmarks of cancer: The next generation. Cell 2011;144(5):646–674.
33. Lum JJ, Bui T, Gruber M, et al. The transcription factor HIF-1 plays a critical role in the growth factor-dependent regulation of both aerobic and anaerobic glycolysis. Genes Dev 2007;21(9):1037–1049.
34. Rathmell JC, Vander Heiden MG, Harris MH, Frauwirth KA, Thompson CB. In the absence of extrinsic signals, nutrient utilization by lymphocytes is insufficient to maintain either cell size or viability found to result in a large accumulation of small atrophic. Mol Cell 2000;6 : 683–692.
35. Palomero T, Sulis ML, Cortina M, et al. Mutational loss of PTEN induces resistance to NOTCH1 inhibition in T-cell leukemia. Nat Med 2007;13(10):1203–1210.
36. Gutierrez A, Sanda T, Grebliunaite R, et al. High frequency of PTEN, PI3K, and AKT abnormalities in T-cell acute lymphoblastic leukemia. Blood 2009;114(3):647–650.
37. Liu YL, Yan Y, Webster C, et al. Timing of the loss of Pten protein determines disease severity in a mouse model of myeloid malignancy. Blood 2016;127(15):1912–1922.
38. Mavrakis KJ, Wolfe AL, Oricchio E, et al. Genome-wide RNA-mediated interference screen identifies miR-19 targets in Notch-induced T-cell acute lymphoblastic leukaemia. Nat Cell Biol 2010;12(4):372–379.
39. Haberl S, Haferlach T, Stengel A, et al. MYC rearranged B-cell neoplasms: Impact of genetics on classification. Cancer Genet 2016;209(10):431–439.
40. Deng C, Lipstein MR, Scotto L, et al. Silencing c-Myc translation as a therapeutic strategy through targeting PI3K delta and CK1 epsilon in hematological malignancies. Blood 2017;129(1):88–99.
41. Chiang MY, Wang Q, Gormley AC, et al. High selective pressure for Notch1 mutations that induce Myc in T-cell acute lymphoblastic leukemia. Blood 2016;128(18):2229–2240.
42. Shim H, Dolde C, Lewis BC, et al. c-Myc transactivation of LDH-A: implications for tumor metabolism and growth. Proc Natl Acad Sci U. S. A. 1997;94(13):6658–6663.
43. Shim H, Chun YS, Lewis BC, Dang C V. A unique glucose-dependent apoptotic pathway induced by c-Myc. Proc Natl Acad Sci 1998;95(4):1511–1516.
44. Li F, Wang Y, Zeller KI, et al. Myc stimulates nuclearly encoded mitochondrial genes and mitochondrial biogenesis. Mol Cell Biol 2005;25(14):6225–6234.
45. Xiang Y, Stine ZE, Xia J, et al. Targeted inhibition of tumor-specific glutaminase diminishes cell-autonomous tumorigenesis. J Clin Invest 2015;125(6):2293–2306.
46. Zenz T, Eichhorst B, Busch R, et al. TP53 mutation and survival in chronic lymphocytic leukemia. J Clin Oncol 2010;28(29):4473–4479.
47. Zenz T, Habe S, Denzel T, et al. Detailed analysis of p53 pathway defects in fludarabine-refractory chronic lymphocytic leukemia (CLL): dissecting the contribution of 17p deletion, TP53 mutation, p53-p21 dysfunction, and miR34a in a prospective clinical trial. Blood 2009;114(13):2589–2597.
48. Green DR, Galluzzi L, Kroemer G. Metabolic control of cell death. Science 2014;345(6203):1250256–1250256.
49. Bensaad K, Tsuruta A, Selak MA, et al. TIGAR, a p53-inducible regulator of glycolysis and apoptosis. Cell 2006;126(1):107–120.
50. Warburg O. On respiratory impairment in cancer cells. Science 1956;124(3215):269–270.
51. Warburg O. On the origin of cancer cells. Science 1956;123(3191):309–314.
52. Moreno-Sánchez R, Rodríguez-Enríquez S, Marín-Hernández A, Saavedra E. Energy metabolism in tumor cells. FEBS J 2007;274(6):1393–1418.
53. Lunt SY, Vander Heiden MG. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Ann Rev Cell Dev Biol 2011;27(1):441–464.
54. Larrue C, Saland E, Vergez F, et al. Antileukemic activity of 2-deoxy-D-glucose through inhibition of N-linked glycosylation in acute myeloid leukemia with FLT3-ITD or c-KIT mutations. Mol Cancer Ther 2015;14(10):2364–2373.
55. Lobo C, Ruiz-Bellido MA, Aledo JC, et al. Inhibition of glutaminase expression by antisense mRNA decreases growth and tumourigenicity of tumour cells. Biochem J 2000;348 Pt 2 : 257–261.
56. Gao P, Tchernyshyov I, Chang T-C, et al. c-Myc suppression of miR-23a/b enhances mitochondrial glutaminase expression and glutamine metabolism. Nature 2009;458(7239):762–765.
57. Wang J, Erickson JW, Fuji R, et al. Targeting mitochondrial glutaminase activity inhibits oncogenic transformation. 2010;18(3):207–219.
58. Ricciardi MR, Mirabilii S, Allegretti M, et al. No title. Blood 2015;126(16):1925–1929.
59. Kiriyama Y, Kubota M, Takimoto T, et al. Biochemical characterization of U937 cells resistant to L-asparaginase: the role of asparagine synthetase. Leukemia 1989;3(4):294–297.
60. Zhang J, Fan J, Venneti S, et al. Asparagine plays a critical role in regulating cellular adaptation to glutamine depletion. Mol Cell 2014;56(2):205–218.
61. Saunders EF. The effect of L-asparaginase on the nucleic acid metabolism and cell cycle of human leukemia cells. Blood 1972;39(4):575–580.
62. Whitecar JP, Bodey GP, Hill CS, Samaan NA. Effect of L-asparaginase on carbohydrate metabolism. Metabolism 1970;19(8):581–586.
63. Kessel D, Bosmann HB. Effects of L-asparaginase on protein and glycoprotein synthesis. FEBS Lett 1970;10(2):85–88.
64. Yu M, Henning R, Walker A, et al. L-asparaginase inhibits invasive and angiogenic activity and induces autophagy in ovarian cancer. J Cell Mol Med 2012;16(10):2369–2378.
65. Iiboshi Y, Papst PJ, Hunger SP, Terada N. l-Asparaginase inhibits the rapamycin-targeted signaling pathway. Biochem Biophys Res Commun 1999;260(2):534–539.
66. Hermanova I, Arruabarrena-Aristorena A, Valis K, et al. Pharmacological inhibition of fatty-acid oxidation synergistically enhances the effect of l-asparaginase in childhood ALL cells. Leukemia 2016;30(1):209–218.
67. Estañ MC, Calviño E, Calvo S, et al. Apoptotic efficacy of etomoxir in human acute myeloid leukemia cells. Cooperation with arsenic trioxide and glycolytic inhibitors, and regulation by oxidative stress and protein kinase activities. PLoS One 2014;9(12):e115250.
68. Carracedo A, Cantley LC, Pandolfi PP. Cancer metabolism: fatty acid oxidation in the limelight. Nat Rev Cancer 2013;13 : 227–232.
69. Tirado-Vélez JM, Joumady I, Sáez-Benito A, Cózar-Castellano I, Perdomo G. Inhibition of fatty acid metabolism reduces human myeloma cells proliferation. PLoS One 2012;7(9):e46484.
70. Pike LS, Smift AL, Croteau NJ, Ferrick DA, Wu M. Inhibition of fatty acid oxidation by etomoxir impairs NADPH production and increases reactive oxygen species resulting in ATP depletion and cell death in human glioblastoma cells. Biochim Biophys Acta 2011;1807(6):726–734.
71. Huang J, Das SK, Jha P, et al. The PPAR agonist fenofibrate suppresses B-cell lymphoma in mice by modulating lipid metabolism. Biochim Biophys Acta - Mol Cell Biol Lipids 2013;1831(10):1555–1565.
72. Li J, Zhao S, Zhou X, et al. Inhibition of lipolysis by mercaptoacetate and etomoxir specifically sensitize drug-resistant lung adenocarcinoma cell to paclitaxel. PLoS One 2013;8(9):e74623.
73. Samudio I, Harmancey R, Fiegl M, et al. Pharmacologic inhibition of fatty acid oxidation sensitizes human leukemia cells to apoptosis induction. J Clin Invest 2010;120(1):142–156.
74. Takahashi H, Inoue J, Sakaguchi K, et al. Autophagy is required for cell survival under L-asparaginase-induced metabolic stress in acute lymphoblastic leukemia cells. Oncogene 2017;36(30):4267–4276.
75. Shinohara H, Kumazaki M, Minami Y, et al. Perturbation of energy metabolism by fatty-acid derivative AIC-47 and imatinib in BCR-ABL-harboring leukemic cells. Cancer Lett 2016;371(1):1–11.
76. Tung S, Shi Y, Wong K, et al. PPARα and fatty acid oxidation mediate glucocorticoid resistance in chronic lymphocytic leukemia. Blood 2013;122(6):969–980.
77. Zaal EA, Wu W, Jansen G, et al. Bortezomib resistance in multiple myeloma is associated with increased serine synthesis. Cancer Metab 2017;5(1):7.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2018 Issue 4-
All articles in this issue
- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Vplyv nádorového metabolizmu na terapiu detských leukémií
- Registr dárců plné krve – srovnání dat 12 zařízení transfuzní služby v letech 2008 a 2016
- Bezpečnost a efektivita léčby rituximabem u dětí s autoimunitním onemocněním
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
- Dlouhodobě skladované kryokonzervované transplantáty a jejich likvidace
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
- Dlouhodobě skladované kryokonzervované transplantáty a jejich likvidace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

