-
Medical journals
- Career
Neinfekční a nemaligní lymfadenopatie – idiopatická (HHV-8 negativní) multicentrická forma Castlemanovy nemoci
: Z. Adam 1; P. Volfová 2; M. Krejčí 1; R. Koukalová 3; Z. Řehák 3; A. Čermák 4; L. Pour 1
: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Interní hematologická a onkologická klinika – Centrum molekulární biologie a genové terapie, sekce oportunních infekcí, Dětská nemocnice LF MU a FN Brno 2; Oddělení nukleární medicíny, Centrum PET, Masarykův onkologický ústav 3; Klinika urologie LF MU a FN Brno 4
: Transfuze Hematol. dnes,24, 2018, No. 3, p. 152-165.
:
Castlemanova choroba byla popsána před více než 60 lety. Je to vzácná heterogenní skupina nemocí, charakterizovaná lymfadenopatií s charakteristickými morfologickými rysy, provázená celkovými zánětlivými příznaky a jim odpovídajícími laboratorními odchylkami. Unicentrická forma nemoci je obvykle řešitelná kompletní chirurgickou excizí. Multicentrická forma vyžaduje systémovou léčbu a může představovat terapeutický problém. Nové léky ze skupiny monoklonálních protilátek, hlavně proti interleukinu-6 a jeho receptoru umožnují cílenou léčbu a dosažení dlouhodobých kontrol. Přínosem pro léčbu této nemoci jsou i imunomodulační léky (thalidomid, lenalidomid a rituximab) a v posledních letech bylo popsáno několik případů uspěčně léčených anakinrou.
Klíčová slova:
Castlemanova choroba – POEMS syndrom – TAFRO syndrom – rituximab – thalidomid – lenalidomid – siltuximab – anakinra
ÚVOD
Castlemanova choroba je nemaligní proces (neklonální proliferace lymfocytů a plazmocytů), která svým průběhem a přítomnou lymfadenopatií může připomínat maligní lymfom a vysokou koncentrací celkové bílkoviny a imunoglobulinů někdy též mnohočetný myelom, zvláště pokud se prokáže i přítomnost monoklonálního imunoglobulinu. Castlemanova choroba se může projevit jen jedním ložiskem. Pro tyto případy se používá termínu lokalizovaná (unicentrická) forma Castlemamovy nemoci. Unicentrická forma je obvykle asymptomatická, nebo symptomy jsou jen mírné a dominantně je za ně odpovědný tlak zvětšených uzlin na okolní orgány a tkáně. Chirurgická léčba zpravidla vše vyřeší. Morfologicky odpovídá většina těchto unicentrických forem hyalině-vaskulárnímu typu.
Polyklonální proliferace lymfocytů a plazmocytů však může postihnout generalizovaně uzliny, slezinu i játra. Tato forma nemoci se nazývá multicentrická forma Castlemanovy nemoci a je obvykle spojena s různě intenzivními příznaky. Typické jsou neinfekční subfebrilie či febrilie, úbytek hmotnosti, noční pocení. Jsou tu však i četné další, nepravidelně se vyskytující příznaky, vaskulitida, osteosklerotické změny na skeletu, poškození funkce ledvin [1–3]. Typickými laboratorními nálezy jsou: anémie, trombocytóza (nebo trombocytopenie), leukocytóza s neutrofilií, hypoalbuminemie, polyklonální hypergamaglobulinemie a zvýšené markery zánětu.
Diferenciálně diagnosticky je nutné odlišit maligní lymfomy, sarkoidózu, chronické infekce, a IgG4 asociované autoimunitní nemoci. Na multicentrickou Castlemanovu chorobu je nutné myslet v rámci diagnózy anémie chronických chorob [1–3].
Histologická diagnostika multicentrické formy Castlemanovy nemoci je dosti obtížná, protože tato nemoc nemá typické buněčné znaky a nejedná se o klonální proliferaci, ale o proliferaci polyklonální neboli reaktivní. A tak jsou často třeba opakovaná histologická vyšetření, než se podaří tuto nemoc prokázat a odlišit od nespecifických reaktivních změn v lymfatické uzlině, a tím pádem i nasměrovat nemocné k odpovídající léčbě. Multicentrická forma Castlemanovy nemoci je dnes dobře léčitelná. V případech, kdy lékař pojme na tuto nemoc podezření, je proto třeba nedat se odradit nespecifickým závěrem prvního histologického hodnocení odebrané periferní lymfatické uzliny a snažit se při dalším vyšetřování odebrat uzlinu s největší akumulací fluorodeoxyglukózy, a tedy s nejvyšší pravděpodobností správného stanovení diagnózy [3–5]. Onemocnění sice nemá maligní charakter, ale má v sobě zvýšené riziko maligní transformace, což opodstatňuje následující dispenzarizaci i po ukončené léčbě.
V následujícím textu shrnujeme naše zkušenosti s projevy této nemoci, diagnostikou a léčbou této nemoci a v diskusi uvedeme přehled informací o této nemoci.
VÝVOJ POZNÁNÍ A ČLENĚNÍ CASTLEMANOVY NEMOCI
V roce 1954 popsal tuto chorobu Benjamin Castleman. Jednalo se o první popis lokalizované angiofolikulární hyperplazie léčitelné operací [6]. První podrobnější histologické hodnocení a rozlišení hyalině-vaskulárního a plazmocelulárního typu bylo zveřejněno v roce 1972 [7].
V roce 1978 bylo poprvé popsáno mnohočetné postižení lymfatických uzlin angiofolikulární hyperplazií, čili multicentrická forma Castlemanovy nemoci [8]. Od roku 1985 je známá koincidence Castlemanovy nemoci s infekcí HIV s pozdějším přechodem do Kaposiho sarkomu.
První popis souvislosti multicentrické formy Castlemanovy nemoci s humánním herpetickým virem typu 8 (virus Kaposiho sarkomu, HHV-8) popsal Soulier v roce 1995 a tato skutečnost byla posléze potvrzena dalšími autory [9,10]. Později se ukázalo, že téměř všichni HIV pozitivní pacienti s Castlemanovou chorobou mají přítomný HHV-8, ale že i u části pacientů s Castlemanovou chorobou, kteří nejsou infikováni virem HIV, je přítomný tento virus.
Od roku 2000 je jasné, že příčinou jak Castlemanovy nemoci, tak i příbuzné nemoci POEMS syndromu, je nadprodukce cytokinů a že tyto nemoci se mohou vyskytovat společně [11]. V roce 2013 vyšel popis nové varianty Castlemanovy nemoci, kterou japonští autoři nazvali TAFRO syndrom. TAFRO syndrom je akronym pro trombocytopenii, ascites (anasarku), fibrotické změny v kostní dřeni s mikrocytární anémií, renální insuficienci, organomegalii a histologický nález Castlemanovy nemoci – obvykle smíšený nebo hyalinně vaskulární typ. TAFRO varianta Castlemanovy nemoci nebývá provázena polyklonálním zmnožením imunoglobulinů a v kostní dřeni nebývá proliferace polyklonálních plazmocytů, jak bývá u klasické plazmocelulární formy Castlemanovy nemoci, ale spíše megakaryocytární hyperplazie [12, 13]. Po prvních popisech TAFRO syndromu se věřilo, že tato choroba je vázaná jen na japonskou rasu [14]. V roce 2015 se objevil první popis této nemoci u rozené obyvatelky Itálie, takže je nutno ji očekávat i v evropské bílé populaci [15].
EPIDEMIOLOGIE
Unicentrická forma Castlamanovy choroba je nejčastější, poslední publikace o její incidenci v USA uvádějí ročně 16 případů na 1 milion obyvatel.
Incidence idiopatické multicentrické formy Castlemanovy nemoci se odhaduje na 5 případů/1 milión obyvatel ročně, takže je výrazně vzácnější než unicentrická forma.
Incidence HHV-8 pozitivní multicentrické formy Castlemanovy choroby velmi kolísá, vyskytuje se hlavně u HIV pozitivních mužů [3, 4, 16].
PATOFYZIOLOGIE NEMOCI
Multicentrická forma Castlemanovy nemoci je termín pro heterogenní skupinu patologických stavů spojených s proliferací morfologicky benigních lymfocytů. Příčinou jsou výrazně zvýšené hladiny proinflamatorních cytokinů, dominantně interleukinu-6 (Il-6), s jehož koncentrací koreluje agresivita nemoci. Narušení signální kaskády Il-6 protilátkami proti Il-6 nebo protilátkami proti receptoru pro Il-6 vede k ústupům příznaků nemoci i velikosti lymfadenopatie. Il-6 je multifunkční cytokin, který indukuje plazmocytózu v kostní dřeni [17], hypergamaglobulinemii, zvýšenou tvorbu vaskulárního endoteliálního růstového faktoru (VEGF), trombocytózu, tvorbu proteinů akutního zánětu v játrech (tedy i CRP), aktivaci makrofágů a T-buněk. Il-6 je zodpovědný i za autoimunitní projevy, které Castlemanovu nemoc občas provázejí.
Na rozdíl od plazmocelulární varianty Castlemanovy nemoci se v případě pacientů s POEMS syndromem, (což je akronym pro Polyneuropathy, Organomegaly, Endocrinopathy, Monoclonal gammopathy, Skin changes), předpokládá zvýšení VEGF (vascular endothelial growth factor) nezávislé na Il-6 [17].
Určitou roli v patofyziologie hraje také interleukin-1, neboť byl popsán pacient nereagující na léčbu protilátkami proti Il-6, který zareagoval na protilátky proti interleukinu-1 [17] a dále byli popsáni nemocní, kteří při podávání inhibitoru receptoru pro interleukin-1 (anakinra) dosáhli remise.
Zatím je pouze známo, že HHV-8 indukuje tvorbu virového homologu Il-6, a tím zvýšení všech prozánětlivých cytokinů. Nejasnou otázkou zůstává, co je příčinou zvýšených hladin prozánětlivých cytokinů u HHV-8 negativních osob. Hypoteticky se připouští možnost systémové autoinflamatorní/autoimunitní choroby, způsobené autoprotilátkami či mutacemi proinflamatorních genů, nebo mechanismus paraneoplastického syndromu s ektopickou produkcí cytokinů. Jako třetí možnost se také připouští zvýšení produkce Il-6 následkem infekce zatím neidentifikovatelným virem [17, 18].
Z pohledu vyvolávajícího činitele lze rozdělit multicentricku formu Castlemanovy nemoci na nemoc způsobenou infekcí HHV-8 a na idiopatickou formu s neznámou vyvolávající příčinou [17, 18].
V roce 2017 se člení nemoc podle výsledků virologických vyšetření na:
- Idiopatickou Castlemanovu chorobu bez pozitivity HHV-8 a bez průkazu viru HIV.
- Castlemanovu chorobu s průkazem viru HHV-8 obvykle s pozitivitou HIV.
Přítomnost viru HIV byla prokázána jen u menšiny (u 15 %), přítomnost viru HHV-8 byla prokázána jen u 17 % pacientů [18].
MOLEKULÁRNĚ BIOLOGICKÁ DETEKCE HHV-8
Pozitivita HHV-8 je jedním z kritérií při diagnóze a klasifikaci Castlemanovy choroby. U pacientů se systémovými příznaky nemoci může mít detekovaná infekce způsobená virem HHV-8 zásadní vliv i na zvolení vhodné terapie. Ačkoliv je vyšetření HHV-8 součástí diagnostiky Castlemanovy choroby, v současné době neexistují obecná doporučení pro výběr diagnostické metody, biologického materiálu ani standardizované laboratorní postupy. Využívá se vyšetření pomocí metod imuhistochemických, sérologických a molekulárně biologických. Monitorování HHV-8 infekce je možné pomocí polymerázové řetězové reakce (PCR) v periferní krvi, ale pro stanovení diagnózy HHV-8 asociované Castlemanovy choroby je třeba průkaz latentního nukleárního antigenu LANA-1 pomocí imunohistochemického barvení [4]. Na pracovišti Centra molekulární biologie a genové terapie Interní hematologické a onkologické kliniky v Brně je detekce HHV-8 (gen ORF26) prováděna metodou kvantitativní PCR v reálném čase pomocí komerční soupravy CMV HHV6,7,8 R-gene firmy Argene (Biomerieux, Francie) ve vzorcích periferní krve. Pro toto vyšetření se předpokládá odběr cca 2 ml nesrážlivé periferní krve do zkumavky s EDTA činidlem. Vzorek je možné transportovat při laboratorní teplotě, stabilita vzorku je 1–2 dny při 4 °C. (Kontakt pro případné žádosti o vyšetření: Mgr. Pavlína Volfová, Ph.D., pavlina.volfova@fnbrno.cz.)
MEZINÁRODNÍ DIAGNOSTICKÁ KRITÉRIA Z ROKU 2017 PRO IDIOPATICKOU MULTICENTRICKOU FORMU CASTLEMANOVY NEMOCI
Morfologové stále rozlišují jen dva základní typy a další dva typy jako odvozené varianty. V souboru asi 198 HIV negativních případů multicentrické formy Castlemanovy nemoci byly stanoveny tyto histologické typy:
- hyalině-vaskulární typ 17–49 %,
- plazmocelulární typ 46–77 %,
- smíšený typ 4–20 %,
- vzácný plazmablastický typ, který se ale vyskytuje jedině při HHV-8 infekci, je možná transformace v plazmablastické lymfomy. V přehledu se morfologii věnuje Fajgenbaum [4] a další [19].
Histologický obraz hyalinně vaskulárního typu je poměrně typický, takže problémy se stanovením diagnózy jsou asi méně časté, než je tomu u plazmocelulární varianty Castlemanovy choroby. Ta je charakterizována výraznou interfolikulární plazmocytózou v lymfatické uzlině. Plazmocyty jsou polyklonální. Celková architektonika lymfatické uzliny je zachovaná. Interfolikulárně bývají zmnožené cévy. Lymfatické folikuly obsahují hyperplastická zárodečná centra. Malá část zárodečných center často vykazuje regresivní změny a může připomínat folikuly u hyalinně vaskulární varianty s koncentricky uspořádanými lymfocyty v plášťové zóně. Bioptická diagnostika Castlemanovy choroby je obtížná. Zejména u plazmocelulární varianty jsou morfologické znaky značně nespecifické. Existuje celá řada nádorových, autoimunitních a infekčních onemocnění, které mohou imitovat obraz Castlemanovy choroby. Na druhou stranu jsou málokdy všechny morfologické znaky plně vyjádřené a odlišení od reaktivně změněné lymfatické uzliny může být problematické [4, 19]. Pokud je bioptický nález nejednoznačný a podezření na multicentrickou formu Castlemanovy choroby trvá, je třeba exstirpovat a histologicky vyšetřit další lymfatickou uzlinu či více uzlin. Optimální je konfrontovat nalezený histologický obraz se spektrem možných histologických obrazů popisovaným v mezinárodních kritériích pro idiopatickou multicentrickou Castlemanovu chorobu [4]. Velmi často je nutno postupně provést více biopsií, než se podaří v některé z odebraných uzlin diagnostikovat změny, odpovídající Castlemanově nemoci. Patologa je třeba v žádance upozornit na to, že klinické příznaky odpovídají multicentrické formě Castlemanovy nemoci. Obzvláště pro stanovení této diagnózy je potřeba dialogu mezi patologem a klinikem.
V našem malém souboru u 5 ze 7 pacientů s multicentrickou formou Castlemanovy nemoci předcházely 1–2 biopsie s nespecifickým nálezem zánětlivých změn. Často pro první excize byly zvoleny dobře přístupné zvětšené uzliny na povrchu těla. A teprve, až jsme obdrželi jednou či opakovaně histologický závěr: „nespecifické reaktivní změny v uzlině“, tak jsme přistoupili k náročnějšímu odběru metodou thorakoskopie či laparotomie a cílem operačního výkonu byly patologické uzliny s nejvyšší akumulací flurodeoxyglukózy. Odběry cílené na nejvíce fluorodeoxyglukózu akumulující uzliny přinesly histologické potvrzení této diagnózy.
Japonští autoři udávají ve svém souboru interval od prvních symptomů nemoci do stanovení diagnózy 27,5 měsíce [20]. Tímto faktem chceme ilustrovat skutečnost, že stanovení diagnózy vyžaduje značné úsilí.
V roce 2017 byla definována a publikována diagnostická kritéria této nemoci uvedená v tabulce 1. Takže diagnózu stanovuje společně patolog a klinický lékař konfrontací morfologických, laboratorních a klinických nálezů s požadovanými kritérii.
1. Diagnostiká kritéria idiopatické multicentrické Castlemanovy nemoci [4] ![Diagnostiká kritéria idiopatické multicentrické Castlemanovy nemoci [4]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5fdaa68364a37f4101019b4c8765ec13.jpeg)
V případě TEFRO syndromu retikulinová fibróza v kostní dřeni.
S idiopatickou multicentrickou Castlemanovou chorohou mohou být asociovány tyto nemoci: paraneoplastický pemfigus, bronchiolitis obliterans, organizující se pneumonie, autoimunitní cytopenie, polyneuropatie, glomerulární nefropatie, inflamatorní myofibroblastový tumor. V případě překrývání diagnózy IgG4 příbuzného onemocnění a idopatické multicentrické Caslemanovy choroby se doporučuje stav uzavírat jako idiopatická multicentrická Castlemanova choroba, a to i v případě vysoké koncentrace podtřídy imunoglobulinu IgG4 [4].PŘÍZNAKY
Choroba má někdy mírné příznaky, takzvané „flu-like“, zatímco v jiných případech může mít závažné příznaky – „sepsis like“, s anasarkou, multiorgánovým selháním a smrtí.
Za pravidelné příznaky lze považovat neinfekční subfebrilie případně febrilie, noční pocení a úbytek hmotnosti neboli B-symptomy. Vyšetření obvykle odhalí periferní ale i mediastinální a abdominální lymfadenopatii a hepatosplenomegalii [19].
Laboratorní známky se shodují se známkami chronického zánětu – anémie, hypoalbuminemie polyklonální hypergamaglobulinemie, zvýšené zánětlivé reaktanty jako CRP. Byly prokázány i zvýšené hladiny cytokinů Il-6 a VEGF, byť tyto parametry nejsou běžně vyšetřitelné.
Zobrazovací vyšetření prokáže lymfadenopatii, někdy organomegalii a další příznaky nemoci, jako jsou sklerotická kostní ložiska a případně plicní infiltráty. Může být prokázána i retence tekutin. K diferenciální diagnóze, zda je retence kardiálního či nekardiálního původu, může pomoci vyšetření mozkového natriuretického faktoru (NT-ProBNP či BNP) a echokardiografické vyšetření srdce. Na akrech mohou být projevy vaskulitidy. Navržená kritéria TAFRO syndrom jsou uvedena v tabulce 2. Nejčastější příznaky nemoci a jejich frekvenci dokumentují výsledky zatím největšího souboru pacientů z Mayo Clinic v USA, tabulka 3. Typické laboratorní nálezy jsou v tabulce 4. Nemoc však může provázet více nepravidelně se vyskytujících projevů, které zde jen stručně vyjmenujeme.
2. Navržená kritéria pro TAFRO syndrom při idiopatické Castlemanově nemoci [33] ![Navržená kritéria pro TAFRO syndrom při idiopatické Castlemanově
nemoci [33]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5fdaa68364a37f4101019b4c8765ec13.jpeg)
3. Klinické nálezy popsané v souboru 113 pacientů s Castlemanovou chorobou na Mayo Clinic [35] ![Klinické nálezy popsané v souboru 113 pacientů s Castlemanovou chorobou na Mayo Clinic [35]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/099b204b32e5c6c7640259521df58b4a.jpeg)
UCN = unicentrická Castlemanova nemoc,
MCN = multicetrická Castlemanova nemoc4. Laboratorní nálezy nacházené u multicentrické formy Castlemanovy choroby [2, 35, 36] ![Laboratorní nálezy nacházené u multicentrické formy Castlemanovy
choroby [2, 35, 36]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/9981ff6e13edda1180aac9ff148b7f5d.jpeg)
Poškození ledvin
Mírné poškození funkce ledvin je popisováno relativně častěji, zatímco poškození funkce ledvin s retencí dusíkatých látek, vedoucí až k úplné anurii je u Castlemanovy nemoci výjimečné. Bioptická vyšetření těchto pacientů prokázala v podstatě dva typy poškození, v 60 % poškození drobných cév ledvin takzvanou endoteliózu a ve 20 % AA-amyloidózou [21–23].
Změny odpovídající POEMS syndromu
POEMS syndrom je akronym pro polyneuropatii, organomegalii, endokrinopatii, monoklonální gamapatii a kožní změny [24, 25]. Tato jednotka může existovat samostatně, ale může se také prolínat s Castlemanovou chorobou. Při POEMS syndromu bývá přítomný edém papily, nevýrazná neuropatie a při zobrazení skeletu jsou zřetelné osteosklerotické změny. Příznaky POEMS syndromu a Castlemanovy choroby se mohou překrývat, takže může být problém, jak nemoc nazvat.
Podle autorů z Mayo Clinic by se termín POEMS syndrom měl používat pouze pro nemocné s periferní neuropatií a dalšími znaky POEMS syndromu, kteří mají prokázanou klonální expanzi plazmocytů v kostní dřeni. Pro nemocné s Castlemanovou chorobou, kteří sice mají některé známky POEMS syndromu, ale nemají ani neuropatii, a ani klonální plazmocyty v kostní dřeni, doporučují používat termín „variantní forma Castlemanovy choroby se znaky POEMS syndromu“.
V souboru 113 pacientů s multicentrickou formou Castlemanovy choroby byly u 34 % zjištěny příznaky POEMS syndromu. K projevům patří tvorba kožních hemangiomů, které lze považovat za jeden ze znaků POEMS syndromu [26–32].
Nekardiální dušnost a retence tekutin
Dalšími popisovanými příznaky je dušnost, jejíž etiologie není zcela jasná, a měnlivé patologické nálezy v plicním parenchymu při vyšetření počítačovou tomografií s vysokým rozlišením [16, 19]. V souvislosti s Castlemanovou nemocí již byla dříve popisována retence tekutin (periferní edémy, ascites, plicní či perikardiální výpotek). Anasarka je jedním z hlavních příznaků Castleman-TAFRO syndromu. Pro TAFRO syndrom při idiopatické Castlemanově nemoci byla navržena (ale zatím ne přijata) kritéria uvedená v tabulce 2 [33, 34].
Vaskulitidy a cévní mozkové příhody
Vaskulitidy nejsou pravidelné, vyskytují se občas a jsou často příčinou cévních mozkových příhod [16, 29, 32].
Poruchy imunity
Castlemanova nemoc může vést k poruchám imunitní reakce a vzniku autoimunitních poruch. Nejčastější z autoimunitních onemocnění je autoimunitní anémie, trombocytopenie a již výše zmíněná vaskulitida. Je nutno však respektovat i snížení imunity, které může být příčinou infekčních komplikací.
Průjmy a zažívací problémy
Choroba má opravdu velice měnlivé příznaky, výjimečně se tato nemoc projevila jako delší dobu trvající průjmy s hmotnostním úbytkem [32].
PRŮBĚH IDIOPATICKÉ MULTICENTRICKÉ FORMY CASTLEMANOVY NEMOCI
Idiopatická multicetrická forma Castlemanovy nemoci se typicky objevuje ve 4. a 5. dekádě života, častěji u mužů než u žen. Z popisu případů je však zřetelné, že u většiny nemocných má choroba dlouholetý průběh, pacientům sice nebere rychle život, ale výrazně zhoršuje kvalitu jejich života. Projevy případné vaskulitidy mohou trvale invalidizovat (cévní mozkové příhody) a komplikují další léčbu i ošetřování. Vzhledem k narušení imunity se zvyšuje u těchto nemocných výskyt dalších maligních chorob ve srovnání s průměrnou populací [36].
V podstatně se popisují následné 4 formy klinického průběhu [36]:
- opakované relapsy a remise,
- stabilní perzistující choroba,
- progredující fatální choroba,
- transformace v maligní lymfom.
Poměrně často se objevují popisy komplikujících cévních mozkových příhod, které pravděpodobně souvisejí s vaskulitidou [36].
LÉČBA IDIOPATICKÉ MULTICENTICKÉ FORMY CASTLEMANOVY CHOROBY
Pro tuto choroby neexistují díky její nízké incidenci vyjma siltuximabu další registrované léky a léčebné postupy, takže léčebná rozhodnutí se zakládají na informacích plynoucích z popisů případů či malých skupin pacientů.
Glukokortikosteroidy
Glukokortikosteroidy jsou široce účinkující imunosupresivní léky, které tlumí jak akutní, tak i chronickou zánětlivou reakci. Snižují tvorbu proinflamatorních cytokinů a chemokinů a klíčových enzymů zánětlivé reakce, tedy Il-2, Il-6, TNF alfa. V případě monoterapie jsou účinné jen částečně a po jejich ukončení nemoc vzplane s původní intenzitou. Proto jsou dnes používány jako součást kombinační léčby.
Klasická chemoterapie
V letech před příchodem biologických léků do klinické praxe (anti-CD20 protilátky a thalidomidu a lenalidomidu) byly testovány klasické chemoterapeutické kombinace používané pro léčbu maligních lymfomů. Léčba založená na kombinaci cytostatik v některých případech vedla k vymizení symptomů nemoci, v případě alterované imunity provázející Castlemanovu nemoc a dlouhodobější neutropenie může být klasická chemoterapie provázena život ohrožujícími infekcemi. Přehled všech publikovaných zkušeností s klasickou chemoterapií lze nalézt v citované literatuře [37–39]. Použity byly režimy obvyklé u lymfoproliferací, monoterapie etoposidem podaným denně či intermitentně, aplikace cladribinu, chemoterapie CHOP (cyklofosfamid, doxorubicin vinkristin a prednison), případně COP (cyklofosfamid, vinkristin a prednison), chlorambucil v monoteapiii a podobné. Tyto léčebné režimy dosahovaly kolem 36 % léčebných odpovědí, nejsou však informace o délce trvání léčebných odpovědí. V některých případech se uvádí, že nemoc obnovila aktivity brzy po ukončení chemoterapie [3].
Anti-CD20 protilátka (rituximab)
Rituximab je monoklonální protilátka proti povrchovému antigenu CD20, který je lokalizovaný na fyziologických i transformovaných (maligních) B-lymfocytech. Po navázání dochází k destrukci těchto lymfocytů. Polyklonální B-lymfocyty tvoří převážnou část uzlin postižených Castlemanovou chorobou, je proto racionální použít cílené destrukce těchto buněk pomocí anti-CD20 protilátky. Rituximab je u této choroby účinný i v monoterapii, jak vyplývá z četných citovaných popisů případů, ale je možné také účinek rituximabu potencovat kombinací s dalšími léky, které se používají při léčbě maligních lymfomů, tedy s glukokortikoidy a dále s alkylačními či antracyklinovými cytostatiky. Rituximab má potenciál navodit léta trvající kompletní remisi a podstatné je, že účinnost této léčby byla potvrzena velkým počtem publikací, takže na rituximab v této indikaci lze nahlížet jako na léčbu volby [40–51]. Gerald (2007) popsal 92 % léčebných odpovědí při monoterapii rituximabem, přičemž léčebné odpovědi měly dlouhodobý charakter, 79 % pacientů bylo po dvou letech sledování stále v remisi [52]. Léčba rituximabem snižuje podle některých pozorování riziko pozdější transformace v maligní lymfom [52]. Před podáním rituximabu se doporučuje vyšetřit virové hepatitidy, protože léčba rituximabem může vést k reaktivaci těchto infekcí.
Imunomodulační léky (IMIDs)
Thalidomid byl jako první zařazen do skupiny IMIDs. V lidském organismu má velmi pestré účinky. Mimo jiné potlačuje tvorbu některých cytokinů, mezi nimi Il-1, Il-6, Il-12 a VEGF. Stimuluje naopak T buňky, cestou cereblonové inhibice.
A právě tato jeho vlastnost, potlačovat tvorbu prozánětlivých cytokinů, jej činní účinným proti Castlemanově nemoci, jak dokládají četné popisy případů [53–63]. Podání IMIDs vede k poklesu tvorby Il-6 a to má za následek pokles hodnoty CRP.
V literatuře lze najít několik prací, které popisují synergický účinek podání rituximabu a thalidomi-du. Thalidomid, imunomodulační, anti-inflamatorní a anti-angiogenní lék má silnou aktivitu proti této nemoci i v monoterapii. Je proto doporučována kombinovaná léčba rituximab a thalidomid [53, 54].
Bortezomib
Bortezomib je selektivní inhibitor proteazomu, preferenčně působící na plazmatické buňky, v nichž mimo jiné snižuje tvorbu Il-6 a také inhibuje NFkappaB. Úspěchy bortezomibu u mnohočetného myelomu vedly k testování bortezomibu u plazmocelulární varianty Castlemanovy nemoci. Podle tří publikací, které popisují tuto léčbu, bylo podání bortezomibu spojeno s dosažením kompletní remise. Bortezomib je tedy po rituximabu dalším novým účinným lékem pro tyto nemocné [64–66].
Protilátka proti interleukinu-6 a jeho receptoru
V literatuře lze nalézt popisy případů s multicentrickou formou Castlemanovy nemoci úspěšně léčených protilátkou proti receptoru interleukinu-6, zvanou tocilizumab. Tato látka je používána hlavně v Asii a Japonsku, jak plyne z citované literatury [67–74].
Tocilizumab je humanizovaný antagonista receptoru interleukinu-6, je schopen zablokovat trans-mebránovou signalizaci, kterou by normálně aktivoval interleukin-6. Tocilizumab snižuje zánětlivou reakci mediovanou signální kaskádou navázanou na receptor interleukinu-6. Tocilizumab je registrován pro léčbu idiopatické multicentrické Castlemanovy nemoci v Japonsku, v jiných zemích je registrován pro léčbu revmatoidní atritidy.
Po léčbě tocilizumabem byla také popsána regrese orgánového poškození při Castlemanově nemoci, ústup kardiomyopatie anebo zlepšení funkce ledvin [75–78].
V Evropské unii je od května roku 2014 registrována pro léčbu multicentrické formy Castlemanovy choroby protilátka proti interleukinu-6 zvaná siltuximab (SYLVANT).
Siltuximab je chimérická IgG1 protilátka, která tvoří komplexy s interleukinem-6, takže brání jeho vazbě na solubilní a membránové receptory. Siltuximab má registraci pro léčbu idiopatické multicentrické formy Castlemanovy nemoci v USA a v Evropě. Podmínkou pro jeho podání je diagnóza idiopatické formy Castlemanovy nemoci, tedy nepřítomnost infekce HHV-8 a i nepřítomnosti infekce HIV. Siltuximab tvoří stabilní komplexy s bioaktivními formami inter-leukinu-6 a brání jeho vazbě na rozpustné i membránové vazebné receptory. Siltuximab se podává v doporučené dávce 11 mg/kg formou intravenózní infuze 1krát za tři týdny až do případného selhání léčby (anebo nepřijatelné toxicity). Ošetřující lékař si musí být vědom, že přípravek siltuximab může maskovat známky akutního zánětu, včetně potlačení horečky a reaktantů akutní fáze, a naopak může vést ke zvýšení hodnoty triglyceridů a cholesterolu v séru. Požaduje se proto, aby pacienti vždy před podáním siltuximabu měli alespoň počet neutrofilů vyšší než 1,0 x 109/l a počet trombocytů vyšší než 50 x 109/1 a při závažné infekci by se léčba siltuximabem měla vždy přerušit [79–82].
V první klinické studii bylo léčeno 37 pacientů s multicentrickou Castlemanovu chorobou. Léčebné odpovědi bylo dosaženo u 32 pacientů (86 %). Celkový počet léčebných odpovědí v této studie během 2,4 roku byl 92 % [81]. V následující II. fázi klinického zkoušení bylo 79 pacientů randomizováno v poměru 2 : 1 do skupiny dostávající 11 mg/kg siltuximabu 1krát za 3 týdny nebo do skupiny dostávající placebo. Celkem 18 (34 %) pacientů dosáhlo léčebné odpovědi: 1krát kompletní remise a 17 parciálních remisí, definovaných nejen vymizením symptomů, ale také zmenšením lymfadenopatie. U dalších 30 pacientů (57 %) byl pozorován ústup symptomů beze změny při zobrazovacích vyšetřeních. Ve skupině s placebem bylo dosaženo léčebné odpovědi jen u 5 pacientů (19 %) pacientů [82]. Do prodloužené léčby bylo pak zařazeno 19 pacientů, kteří dostávali siltuximab dlouhodobě, až 7 let bez průkazu toxicity [83].
Nejčastější nežádoucí účinky byly pruritus (42 %), infekce horního dýchacího traktu (36 %), slabost (34 %), makulopapulózní vyrážka (34 %) a periferní edémy (32 %).
Randomizované srovnání léčby siltuximabu ve srovnání s placebem prokázalo u 53 hodnotitelných pacientů léčených siltuximabem celkem jen 34 % léčebných odpovědí, zatímco nemocní léčení placebem byli bez jakéhokoliv zlepšení [82].
Anakinra
Anakinra je monoklonální protilátka proti receptoru pro interleukin-1 (antagonista Il-1 receptoru). Její biologický poločas je ale jen 4–6 hodin. Anakinra je schválená agenturou FDA pro léčbu revmatoidní artritidy, ale v průběhu posledních let se prokázal účinek tohoto léku u četných dalších chorob včetně Stillovy nemoci, juvenilní artritidy a také u četných autoinflamatorních chorob s manifestací v dětství, a také u „Schnitzler syndrome“ který se do češtiny překládá jako syndrom Schnitzlerové, nebo Schnitzler syndrom. Podává se obvykle denně v dávce 100 mg denně. Jeho léčebné použití u Castlemanovy nemoci je založeno na faktu, že interleukin-1 stimuluje tvorbu interleukinu-6, který stimuluje projevy Castlemanovy nemoci. Siltuximab tlumí chorobu blokádou účinku interleukinu-6. Anakinra tlumí chorobu blokádou aktivity interleukinu-1, takže jednu úroveň nížeji, než siltuximab. V odborné literatuře není zatím žádná randomizovaná klinická studie analyzující účinek anakinry u Castlemanovy nemoci. K dispozici jsou tři publikace, popisující zásadní zlepšení po podání anakinry u pacientů s Castlemanovou chorobou, často již značně předléčených. První popis léčby Castlemanovy nemoci anakinrou je z roku 2008. U tohoto pacienta předcházela léčba chemoterapií a rituximabem, která však nedosáhla léčebné odpovědi. Až podání anakinry vedlo k vymizení příznaků nemoci [84].
V dalším případě byla ankinra s úspěchem použita u ještě více předléčeného pacienta, předcházela léčba cladribinem, rituximabem, steroidy, etanerceptem (protilátka proti TNF) a protilátkou proti interleukinu-6, a nemoc byla na vše uvedené refrakterní. Takže klasické léčebné možnosti byly u této pacientky, léčené v MD Anderson Cancer Center, vyčerpány. Byla proto použita anakinra (100 mg denně), příznaky do týdne vymizely, na kontrolních PET/CT zobrazeních vymizela i lymfadenopatie a vymizela zvýšená akumulace fluordeoxyglukózy v kostní dřeni [85].
Anakinru použili také francouzští autoři u případu Castlemanovy nemoci, spojeného s anasarkou a trombotickou trombocytopenickou purpurou odpovídající TAFRO syndromu [86]. Anakinra tedy představuje léčebnou alternativu, jejíž účinnost třeba dále ověřit, které ale z hlediska tolerance je excelentní a ekonomicky dostupnější.
Vysokodávkovaná chemoterapie s autologní transplantací krvetvorných buněk
V literární databázi Medline PUBMED není zmínka o použití alogenní transplantace krvetvorných buněk, k dispozici jsou jen tři zprávy o použití vysokodávkované chemoterapie: dvakrát šlo o melfalan v dávce 200 mg/m2 [87, 88] a jednou o kombinaci etoposidu, thiotepy, cytarabinu, cyklofosfamidu a melfalanu s podporou autologní transplantace krvetvorných buněk [89]. Všichni autoři popisují dosažení kompletní remise. Takže i vysokodávkovaná chemoterapie s autologní transplantací je alternativou, kterou nutno zvažovat.
LÉČBA LOKALIZOVANÉ FORMY CASTLEMANOVY NEMOCI
Kompletní chirurgická excise je kurativní léčba pro unicentrickou formu nemoci s excelentními dlouhodobými výsledky, bezpříznakové 10leté období se popisuje u 95 % operovaných. Pokud radikální operační léčba není možná, je nutno provést maximální možné operační odstranění tumoru s následnou léčbou medikamenty či radioterapií.
Částečná resekce je alternativou pro velké tumory, totálně neodstranitelné. Je možné použít před operací systémovou léčbu, která zmenší ložisko na velikost, kdy již může chirurg provést totální resekci [90].
Radioterapie je také alternativa pro neresekovatelné případy. Publikovaných zkušeností je relativně málo, literatura obsahuje data 17 pacientů, kteří byli léčeni radioterapií v dávce 40–45 (rozmezí 27–60) Gy. Radioterapie vedla v 35 % k dosažení kompletní remise a v 41 % k dosažení parciální remise [91–101]. Přehled publikovaných zkušeností s radioterapií včetně použitých dávek uvádíme v tabulce 5 jako základ pro zvažování léčby radioterapií. Přehled léčby unicentrické formy uvádí samostatná publikace [103–104].
5. Shrnutí zkušeností s radioterapií u neresekabilní unicentrické Castlemanovy nemoci 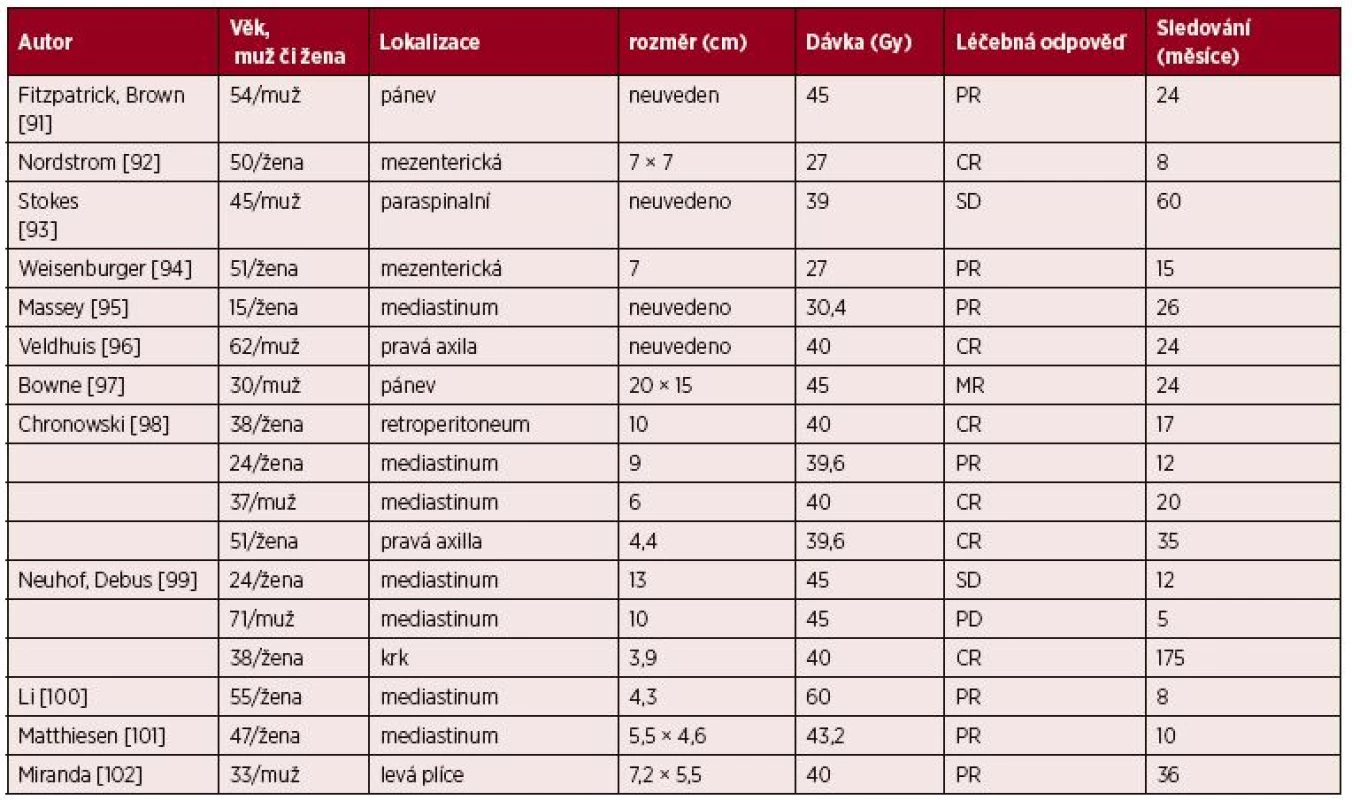
Závěry pro praxi
- Nejasná lymfadenopatie a teploty trvající déle než tři týdny mohou mít příčinu mimo jiné v Castlemanově nemoci.
- Polyklonální zvýšení imunoglobulinů a volných lehkých řetězců kappa-lambda a zvýšená koncentrace celkové bílkoviny, stejně jako zvýšené CRP bez příznaků infekce anebo anémie odpovídající anémii chronických chorob, může mít příčinu v Castlemanově nemoci.
- Chronická zánětlivá reakce s febriliemi či subfebriliemi, nočním pocením a úbytkem hmotnosti může mít příčinu v Castlemanově nemoci.
- Histologická diagnostika multicentrické formy nemoci je obtížná, protože jde o reaktivní proliferaci lymfocytů a plazmocytů, které musí vždy tvořit typický morfologický obraz a nemoc může být popsána jako nespecifické reaktivní změny. Pro úspěch histologické vyšetření se ukázalo přínosné zvolit pro odběr k histologickému vyšetření ty uzliny, které vykazují nejvyšší akumulace fluorodeoxyglukózy při PET CT vyšetření.
- PET-CT zobrazení je užitečné pro zjištění rozsahu nemoci i pro hodnocení léčebného efektu.
- Multicentrická forma Castlemanovy choroby může být spojena s defektem imunitní odpovědi, a proto klasická chemoterapie a léčba vysokými dávkami glukokortikoidů může přivodit závažné nežádoucí komplikace (běžné i oportunní infekce).
- Základními léky pro multicentrickou formu Castlemanovy choroby jsou: monoklonální protilátka antiCD20, rituximab (Mabthera), léky ze skupiny IMIDs (thalidomid, lenalidomid) a monoklonální protilátka proti interleukinu-6 (siltuximab) a proti receptoru pro interleukin-6 (tocilizumab).
- Ve formě popisů případu byla potvrzena účinnost protilátky proti receptoru interleukinu-1 (anakinra). Hypotetické zdůvodnění účinnosti anakinry u této nemoci je blokáda stimulace tvorby interleukinu-6 vlivem interleukinu-1.
- V případě, že nemoc nereaguje na jednu z výše uvedených alternativ, je třeba otestovat další ze jmenovaných léků, protože nemoc nereagující na jeden typ léčby může kompletně ustoupit po jiné léčbě. U některých pacientů nemoc lépe ustupuje po léčbě obsahující IMIDS zatímco u jiných po léčbě obsahující rituximab a praxe vždy ukáže, který z výše jmenovaných léků je pro konkrétního pacienta optimální.
Poděkování
Publikace vznikla za podpory těchto grantů: MZ-ČR RVO (FNBr 65269705),
MZ ČR-RVO (FNBr, 65269705), MOÚ: MZ ČR-RVO (MOÚ, 00209805), RECAMO: projekt LO 1413.
Podíl autorů na přípravě rukopisu
PV – příprava části rukopisu věnované vyšetření HHV8, připomínkování rukopisu.
RK, ZŘ – příprava části rukopisu o zobrazovacích vyšetřeních, zejména PET CT; připomínkování rukopisu
ZA, MK, AČ, LP – spoluprace na textu rukopisu, příprava první verze a revize.
Do redakce doručeno dne 8. 12. 2017.
Přijato po recenzi dne 28. 2. 2018.
doc. MUDr. Luděk Pour, Ph.D.
Interní hematologická a onkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: pour.ludek@fnbrno.cz
Sources
1. Dispenzieri A. Castleman disease. Cancer Treat Res 2008;142 : 293–330.
2. Liu AY, Nabel CS, Finkelman BS, et al. Idiopathic multicentric Castleman‘s disease: a systematic literature review. Lancet Haematol 2016;3(4):e163–e175.
3. Chan Kah-Lok, Lade S, Prince HM, et al. Update and new approaches in the threatment of Castleman disease. J Blood Med 2016;7 : 145–158.
4. Fajgenbaum DC, Uldrick TS, Bagg A, et al. International evidence-based consensus diagnostic criteria for HHV-8-negative/idiopathic multicentric Castleman disease. Blood 2017;129(12):1646–1657.
5. Simpson D. Epidemiology of Castleman disease. Hematol Oncol Clin North Am 2018;32(1):1–10.
6. Castleman B, Towe VW. Case report of the Massachusetts General Hospital weekly clinicopathological exercises, fouded by Richard C Cabot. N Engl J Med 1954;251(10):396–400.
7. Keller AR, Hochholzer L, Castleman B. Hyaline-vascular and plasma-cell types of giant lymph node hyperplasia of the mediastinum and other localisation. Cancer 1972;29 : 670–683.
8. Gaba AR, Stein RS, Sweet DJ, et al. Multicentric giant node hyperplasia. Amer J Clin Pathol 1978;69(1):86–90.
9. Soulier J, Grollet L, Oksenhendler E, et al. Kaposi‘s sarcoma-associated herpesvirus-like DNA sequences in multicentric Castleman‘s di-sease. Blood 1995;86(4):1276–1280.
10. Chadbum A, Cesarman E, Nador RG, et al. Kaposi´s sarcoma-associated herpesvirus sequences in benign lymphoid prolifera-tions not associated with human immunodeficiency virus. Cancer 1997;80 : 788–797.
11. Riu P, Noesl LH, Droz D, et al. Glomerular involvement in lymfoproliferative disorders with hyperproduction of cytokines (Castleman, POEMS). Adv Nephrol Necke Hosp 2000;30 : 305–331.
12. Masaki Y, Nakajima A, Iwao H, et al. Japanese variant of multicentric Castleman‘s disease associated with serositis and thrombocytopenia – a report of two cases: is TAFRO syndrome (Castleman-Kojima disease) a distinct clinicopathological entity? J Clin Exp Hematop 2013;53(1):79–85.
13. Kawabata H, Takai K, Kojima M, et al. Castleman-Kojima disease (TAFRO syndrome): a novel systemic inflammatory disease characterized by a constellation of symptoms, namely, thrombocytopenia, ascites (anasarca), microcytic anemia, myelofibrosis, renal dysfunction, and organomegaly. J Clin Exp Hematop 2013;53(1):57–61.
14. Inoue M, Ankou M, Hua J, at al. Complete resolution of TAFRO syndrome (thrombocytopenia, anasarca, fever, reticulin fibrosis and organomegaly) after immunosuppressive therapies using corticosteroids and cyclosporin A: a case report. J Clin Exp Hematop 2013;53(1):95–99.
15. Tedesco S, Postacchini L, Manfredi L, et al. Successful treatment of a Caucasian case of multifocal Castleman´s disease with TAFRO syndrome with pathophysiology targeted therapy – case report. Exp Hematol Oncol 2015;4(1):3–10.
16. Robinson D Jr, Reynolds M, Casper C, et al. Clinical epidemiology and treatment patterns of patients with multicentric Castleman disease: results from two US treatment centres. Br J Haematol 2014;165(1):39–48.
17. Fajgenbaum DC, vanRhee F, Nabel ChS. HHV-8 negative idiopathic multicentric Castleman disease: novel insight into biology pathogenesis and therapy. Blood 2014;123(19):2924–2933.
18. Bower M, Pria AD, Coyle C, etl al. Diagnostic criteria schemes for multicentric Castleman disease in 75 cases. J Acquir Immune Defic Syndr 2014;65(2):e80–e82.
19. Cronin DM, Warnke RA. Castleman disease: an update on classification and the spectrum of associated lesions. Adv Anat Pathol 2009;16 : 236–246.
20. Kawabata H, Kadowaki N, Nishikori M, et al. Clinical features and treatment of multicentric Castleman‘s disease: a retrospective study of 21 Japanese patients at a single institute. J Clin Exp Hematop 2013;53(1):69–77.
21. El Karoui K, Vuiblet V, Dion D, et al. Renal involvement in Castleman disease. Nephrol Dial Transplant 2011;26(2):599–609.
22. Sydor A, Madura M, Wagrowska-Danilewicz M. Amyloid a amyloidosis and renal failure in a course of Castleman disease. Nephrology (Carlton) 2007;12(6):620–621.
23. Leung KT, Wong KM, Choi KS, et al. Multiicentric Castleman‘s disease complicated by secondary renal amyloidosis. Nephrology (Carlton) 2004;9(6):392–393.
24. Dispenzieri A, Buadi FK. A review of POEMS syndrome. Oncology (Williston Park) 2013;27(12):1242–1250.
25. Dispenzieri A. POEMS syndrome: 2014 update on diagnosis, risk-stratification, and management. Am J Hematol 2014;89(2):214–223.
26. Fajgenbaum DC, Rosenbach M, van Rhee F, et al. Eruptive cherry hemangiomatosis associated with multicentric Castleman disease: a case report and diagnostic clue. JAMA Dermatol 2013;149(2):204–208.
27. Ruwan KP, Parakramawansha C, Wijeweera I, et al. A case of POEMS syndrome with mixed hyaline vascular and plasma cell type Castleman‘s disease. Ceylon Med J 2009;54(2):68–69.
28. Misri R, Kharkar V, Dandale A, et al. Multiple capillary hemangiomas: a distinctive lesion of multicentric Castleman‘s disease and POEMS syndrome. Indian J Dermatol Venerol Leprol 2008;74(4):364–366.
29. Garcia T, Dafer R, Hocker S, Schneck M, et al. Recurrent strokes in two patients with POEMS syndrome and Castleman‘s disease. J Stroke Cerebrovasc Dis 2007;16(6):278–284.
30. Owens CL, Weir EG, Ali SZ. Cytopathologic findings in „POEMS“ syndrome associated with Castleman disease. Diagn Cytopathol 2007;35(8):512–515.
31. Eisenbarth SC, Colegio OR, Iyer A, Cooper D, Bannykh S, Baehring J. Images in neuro-oncology: a case of POEMS (Polyneuropathy, Organomegaly, Endocrinopathy, Monoclonal protein and Skin changes) in a patient with multicentric Castleman‘s disease. J Neurooncol 2007;81(2):163–165.
32. Huang J, Wang L, Zhou W, Jin J. Hyaline vascular Castleman disease associated with POEMS syndrome and cerebral infarction. Ann Hematol 2007;86(1):59–61.
33. Iwaki N, Fajgenbaum DC, Nabel SCh, et al. Clinicopathological analysis of TAFRO syndrome demonstrates a distinct subtype of HHV-8 negative multicentric Castleman disease. Am J Hematol 2016;91 : 220–226.
34. Igawa T, Sato Y. TAFRO Syndrome. Hematol Oncol Clin North Am 2018;32(1):107–118.
35. Dispenzieri A, Armitage JO, Loes MJ, et al. The clinical spectrum of Castleman´s disease. Amer J Hematol 2012;87 : 997–1002.
36. Szalat R, Munshi NC. Diagnosis of Castleman disease. Hematol Oncol Clin North Am 2018;32(1):53–64.
37. van Rhee F, Greenway A, Stone K. Treatment of idiopathic Castleman disease. Hematol Oncol Clin North Am 2018;32(1):89–106.
38. Wolf M, Van Offel JF, Van de Velde A, et al. Multicentric plasma cell variant Castleman‘s disease presenting with cutaneous vasculitis and pulmonary parenchymal involvement in a patient with ankylosing spondylitis: case report and review of the literature. Acta Clin Belg 2011;66(4):305–310.
39. Dham A, Peterson BA. Castleman disease. Curr Opin Hematol 2007;14(4):354–359.
40. Peker D, Martinez AE, Schwartz MA, et al. Complete remission in 4 patients with human herpesvirus 8-associated multicentric Castleman disease using rituximab and liposomal doxorubicin, a novel chemotherapy combination. Clin Adv Hematol Oncol 2012;10(3):204–206.
41. Hoffmann C, Schmid H, Müller M, et al. Improved outcome with rituximab in patients with HIV-associated multicentric Castleman disease. Blood 2011;118(13):3499–3503.
42. Fragasso A, Mannarella C, Ciancio A, et al. Complete remission and virologic response to combined chemoimmunotherapy (R-CVP) followed by rituximab maintenance in HIV-negative, HHV-8 positive patient with multicentric Castleman disease. Leuk Lymphoma 2008;49(11):2224–2226.
43. Casquero A, Barroso A, Fernández Guerrero ML. Use of rituximab as a salvage therapy for HIV-associated multicentric Castleman disease. Ann Hematol 2006;85(3):185–187.
44. Ide M, Kawachi Y, Izumi Y, et al. Long-term remission in HIV-negative patients with multicentric Castleman‘s disease using rituximab. Eur J Haematol 2006;76(2):119–123.
45. Powles T, Stebbing J, Montoto S, et al. Rituximab as retreatment for rituximab pretreated HIV-associated multicentric Castleman disease. Blood 2007;110(12):4132–4133.
46. Bestawros A, Michel R, Séguin C, Routy JP. Multicentric Castleman‘s disease treated with combination chemotherapy and rituximab in four HIV-positive men: a case series. Am J Hematol 2008;83(6):508–511.
47. Buchler T, Dubash S, Lee V, et al. Rituximab failure in fulminant multicentric HIV/human herpesvirus 8-associated Castleman‘s disease with multiorgan failure: report of two cases. AIDS 2008;22(13):1685–1687.
48.Bower M, Veraitch O, Szydlo R, et al. Cytokine changes during rituximab therapy in HIV-associated multicentric Castleman disease. Blood 2009;113(19):4521–454.
49. Mian H, Leber B. Mixed variant multicentric Castleman disease treated with rituximab: case report. J Pediatr Hematol Oncol 2010;32(8):622.
50. Lee JP, Kim DK, Oh DY. Successfully treated multicentric Castleman‘s disease with renal thrombotic microangiopathy using rituximab and corticosteroid. Clin Nephrol 2011;75(2):165–170.
51. Gérard L, Bérezné A, Galicier L, et al. Prospective study of rituximab in chemotherapy-dependent human immunodeficiency virus associated multicentric Castleman‘s disease: ANRS 117 CastlemaB Trial. J Clin Oncol 2007;25(22):3350–3356.
52. Gérard L, Michot JM, Burcheri S, et al. Rituximab decreases the risk of lymphoma in patients with HIV-associated multicentric Castleman disease. Blood 2012;119(10):2228–2233.
53. Ramasamy K, Gandhi S, Flowers MT, et al. Rituximab and thalidomide combination therapy for Castleman disease. Brit J Haematol 2012;158 : 415–429.
54. Stary G, Kohrgruber N, Herneth AM, et al. Complete regression of HIV-associated multicentric Castleman disease treated with rituximab and thalidomide. AIDS 2008;22(10):1232–1234.
55. Fishman SJ, Feins NR, D’Amato RJ, et al. Long-term remission of Crohn’s disease treated with thalidomide: a seminal case report. Angiogenesis 1999;3(3):201–204.
56. Lee FC, Merchant SH. Alleviation of systemic manifestations of multicentric Castleman‘s disease by thalidomide. Am J Hematol 2003;73 : 48–53.
57. Starkey CR, Joste NE, Lee FC. Near-total resolution of multicentric Castleman disease by prolonged treatment with thalidomide. Am J Hematol 2006;81 : 303–304.
58. Kim SY, Lee SA, Ryoo HM, et al. Thalidomide for POEMS syndrome. Ann Hematol 2006;85 : 545–546.
59. Wang X, Ye S, Xiong C, Gao J, Xiao C, Xing X. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman‘s disease. Jpn J Clin Oncol 2011;41(10):1221–1224.
60. Menegato MA, Canelles MF, Tonutti E, et al. Remission of nephrotic syndrome after thalidomide therapy in a patient with Castleman‘s disease. Clin Nephrol 2004;61 : 352–356.
61. Miltenyi Z, Toth J, Gonda A, et al. Successful immunomodulatory therapy in Castleman disease with paraneoplastic pemphigus vulgaris. Pathol Oncol Res 2009;15 : 375–381.
62. Zhao X, Shi R, Jin X, Zheng J. Diffuse hyperpigmented plaques as cutaneous manifestation of multicentric Castleman disease and treatment with thalidomide: report of three cases. J Am Acad Dermatol 2011;65(2):430–432.
63. Jung CP, Emmerich B, Goebel FD, et al. Successful treatment of a patient with HIV-associated multicentric Castleman disease (MCD) with thalidomide. Am J Hematol 2004;75 : 176–177.
64. Yoshizaki K, Murayama S, Ito H, et al. The role of interleukin-6 in Castleman disease. Hematol Oncol Clin North Am 2018;32(1):23–36.
65. Hess G, Wagner V, Kreft A, et al. Effects of bortezomib on proinflamatory cytokine levels and transfusion dependency in patient with multicentric Castleman disease. Br J Haematol 2006;134 : 602–605.
66. Sobas MA, Alonso Vence N, Diaz Arias J, et al. Efficacy of bortezomib in refractory form of multicentric Castleman disease associated to POEMS syndrome (MCD-POEMS variant). Ann Hematol 2010;89(2):217–219.
67. Galeotti C, Boucheron A, Guillaume S, et al. Sustained remission of multicentric Castleman disease in children treated with tocilizumab, an anti-interleukin-6 receptor antibody. Mol Cancer Ther 2012;11(8):1623–1626.
68. Yuzuriha A, Saitoh T, Koiso H, Mitsui T, et al. Successful treatment of autoimmune hemolytic anemia associated with multicentric Castleman disease by anti-interleukin-6 receptor antibody (tocilizumab) therapy. Acta Haematol 2011;126(3):147–150.
69. Higuchi T, Nakanishi T, Takada K, et al. A case of multicentric Castleman‘s disease having lung lesion successfully treated with humanized anti-interleukin-6 receptor antibody, tocilizumab. J Korean Med Sci 2010;25(9):1364–1367.
70. Arita Y, Sakata Y, Sudo T, et al. The efficacy of tocilizumab in a patient with pulmonary arterial hypertension associated with Castleman‘s disease. Heart Vessels 2010;25(5):444–447.
71. Song SN, Tomosugi N, Kawabata H, et al. Down-regulation of hepcidin resulting from long-term treatment with an anti-IL-6 receptor antibody (tocilizumab) improves anemia of inflammation in multicentric Castleman disease. Blood 2010;116(18):3627–3634.
72. Nishimoto N, Terao K, Mima T, et al. Mechanisms and pathologic significances in increase in serum interleukin-6 (IL-6) and soluble IL-6 receptor after administration of an anti-IL-6 receptor antibody, tocilizumab, in patients with rheumatoid arthritis and Castleman disease. Blood 2008;112(10):3959–3964.
73. Williams SC. First IL-6-blocking drug nears approval for rare blood disorder. Nat Med 2013;19(10):1193.
74. Robey RC, Mletzko S, Colley C, et al. The use of monoclonal antibodies to treat Castleman‘s disease. Immunotherapy 2014;6(2):211–219.
75. Nagai K, Ueda A, Yamagata K. Successful use of tocilizumab in a case of multicentric Castleman‘s disease and end-stage renal disease. Ther Apher Dial 2014;18(2):210–211.
76. Man L, Goudar RK. Reversal of cardiomyopathy with tocilizumab in a case of HIV-negative Castleman‘s disease. Eur J Haematol 2013;91(3):273–276.
77. Fajgenbaum DC, Shilling D. Castleman disease pathogenesis. Hematol Oncol Clin North Am 2018;32(1):11–21.
78. Otani N, Morishita Y, Oh I, et al. Successful treatment of a mesangial proliferative glomerulonephritis with interstitial nephritis associated with Castleman‘s disease by an anti-interleukin-6 receptor antibody (tocilizumab). Intern Med 2012;51(11):1375–1378.
79. Liu YC, Stone K, van Rhee F. Siltuximab for multicentric Castleman disease. Expert Rev Hematol 2014;9 : 1–13.
80. van Rhee F, Fayad L, Voorhees P, et al. Siltuximab, a novel anti-interleukin-6 monoclonal antibody, for Castleman‘s disease. J Clin Oncol 2010;28(23):3701–37028.
81. Kurzrock R, Voorhees PM, Casper C, et al. A phase I, open-label study of siltuximab, an anti-IL-6 monoclonal antibody, in patients with B-cell non-Hodgkin lymphoma, multiple myeloma, or Castleman disease. Clin Cancer Res 2013;19(13):3659–3670.
82. Van Rhee F, Wong RS, Munshi N, et al. Siltuximab for multicentric Castleman´s disease. A randomized double blind placebo controlled trial. Lancet Oncol 2014;15(9):966–974.
83. Van Rhee F, Casper C, Voorhees PM, et al. Phase 2 open labaled multicenter study of long term safety of siltuximab in patients with multicentric Castleman´s disease. Oncotarget 2015;6(30):30408–30419.
84. Galeotti C, Tran TA, Franchi-Abella S, et al. IL-1RA agonist (anakinra) in the treatment of multifocal castleman disease: case report. J Pediatr Hematol Oncol 2008;30(12):920–924.
85. El-Osta H, Janku F, Kurzrock R. Successful treatment of Castleman‘s disease with interleukin-1 receptor antagonist (anakinra). Mol Cancer Ther 2010;9(6):1485–1488.
86. Jouvray M, Terriou L, Meignin V, et al. Pseudo-adult Still‘s disease, anasarca, thrombotic thrombocytopenic purpura and dysautonomia: An atypical presentation of multicentric Castleman’s disease. Discussion of TAFRO syndrome. Rev Med Interne 2016;37(1):53–57.
87. Repetto L, Jaiprakash MP, Selby PJ, et al. Aggressive angiofollicular lymph node hyperplasia (Castleman‘s disease) treated with high dose melphalan and autologous bone marrow transplantation. Hematol Oncol 1986;4(3):213–217.
88. Ganti AK, Pipinos I, Culcea E, et al. Successful hematopoietic stem-cell transplantation in multicentric Castleman disease complicated by POEMS syndrome. Am J Hematol 2005;79(3):206–210.
89. Tal Y, Haber G, Cohen MJ, et al. Autologous stem cell transplantation in a rare multicentric Castleman disease of the plasma cell variant. Int J Hematol 2011;93(5):677–680.
90. Bandera B, Ainsworth C, Shikle J, Rupard E, Roach M. Treatment of unicentric Castleman disease with neoadjuvant rituximab. Chest 2010;138(5):1239–1241.
91. Fitzpatrick PJ, Brown TC. Angiofollicular lymph node hyperplasia. Can Med Assoc J 1968;99(25):1259–1262.
92. Nordstrom DG, Tewfik HH, Latourette HB. Plasma cell giant lymph node hyperplasia responding to radiation therapy. Am J Roentgenol 1978;130(1):169–171.
93. Stokes SH, Griffith RC, Thomas PR. Angiofollicular lymph node hyperplasia (Castleman’s disease) associated with vertebral destruction. Cancer 1985;56(4):876–879.
94. Weisenburger DD, DeGowin RL, Gibson P, Armitage JO. Remission of giant lymph node hyperplasia with anemia after radiotherapy. Cancer 1979;44(2):457–462.
95. Massey GV, Kornstein MJ, Wahl D, Huang XL, McCrady CW, Carchman RA. Angiofollicular lymph node hyperplasia (Castleman’s disease) in an adolescent female. Clinical and immunologic findings. Cancer 1991;68(6):1365–1372.
96. Veldhuis GJ, van der Leest AH, de Wolf JT, de Vries EG, Vellenga E. A case of localized Castleman’s disease with systemic involvement: treatment and pathogenetic aspects. Ann Hematol 1996;73(1):47–50.
97. Bowne WB, Lewis JJ, Filippa DA, et al. The management of unicentric and multicentric Castleman’s disease: a report of 16 cases and a review of the literature. Cancer 1999;85(3):706–717.
98. Chronowski GM, Ha CS, Wilder RB, Cabanillas F, Manning J, Cox JD. Treatment of unicentric and multicentric Castleman disease and the role of radiotherapy. Cancer 2001;92(3):670–676.
99. Neuhof D, Debus J. Outcome and late complications of radiotherapy in patients with unicentric Castleman disease. Acta Oncol 2006;45(8):1126–1131.
100. Li YM, Liu PH, Zhang YH, et al. Radiotherapy of unicentric mediastinal Castleman’s disease. Chin J Cancer 2011;30(5):351–356.
101. Matthiesen C, Ramgopol R, Seavey J, et al. Intensity modulated radiation therapy (IMRT) for the treatment of unicentric Castlemans disease: a case report and review of the use of radiotherapy in the literature. Radiol Oncol 2012;46(3):265–270.
102. Miranda FA, Faria VH, Arruda GV, Silva LG. Radiation therapy in the treatment of unicentric Castleman’s disease. J Bras Pneumol 2013;39(1):116–118.
103. Wong RSM. Unicentric Castleman disease. Hematol Oncol Clin North Am 2018;32(1): 65–73.
104. Wu D, Lim MS, Jaffe ES. Pathology of Castleman disease. Hematol Oncol Clin North Am 2018;32(1):37–52.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2018 Issue 3-
All articles in this issue
- Uncertainty of measurement results
- Non-infectious and non-malignant lymphadenopathy – idiopathic (HHV-8 negative) Castleman disease
- Non-infectious non-malignant lymphadenopathy – sinus histiocytosis with massive lymphadenopathy, Rosai-Dorfman disease
- Next generation sequencing: basic bioinformatic terms and analytic protocols for DNA analysis
- The importance of physical activity for survival and quality of life in patients with lymphoproliferative disease
- Mutácie génu F8 u pacientov s ťažkým stupňom hemofílie A a výskyt inhibítorov FVIII
- Recommendations for the diagnosis and treatment of chronic lymphocytic leukaemia (CLL) – 2018
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Non-infectious non-malignant lymphadenopathy – sinus histiocytosis with massive lymphadenopathy, Rosai-Dorfman disease
- Next generation sequencing: basic bioinformatic terms and analytic protocols for DNA analysis
- Recommendations for the diagnosis and treatment of chronic lymphocytic leukaemia (CLL) – 2018
- Non-infectious and non-malignant lymphadenopathy – idiopathic (HHV-8 negative) Castleman disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

