-
Medical journals
- Career
Identifikace patogeneticky významných mutací u chronické lymfocytární leukemie pomocí „sekvenování nové generace“
Authors: M. Mráz 1,2,3; M. Trbušek 1,2; D. Doležalová 3; J. Malčíková 1,2; J. Šupíková 1,2; K. Staňo-Kozubík 1,2; B. Kantorová 1,2; J. Mayer 1,2; Š. Pospíšilová 1,2
Authors‘ workplace: Centrum molekulární biologie a genové terapie, Interní hematoonkologická klinika, FN Brno 1; CEITEC – Středoevropský technologický institut, Masarykova univerzita, Brno 2; University of California, San Diego, USA 3
Published in: Transfuze Hematol. dnes,18, 2012, No. 2, p. 72-75.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Chronická lymfocytární leukemie (CLL) patří mezi onemocnění, u nichž se po dlouhou dobu nedařilo identifikovat genové mutace, které souvisí s jejich vznikem a progresí. Nedostatečné pochopení patogeneze CLL zpomalovalo pokrok na poli cílené léčby. V nedávné době bylo publikováno několik klíčových prací, které s využitím přístupů „vysokokapacitního sekvenování nové generace“ (Next Generation Sequencing – NGS) popsaly mutace v cca 15 protein-kódujících genech potenciálně důležitých v biologii CLL. V následujícím přehledovém článku shrnujeme doposud získaná data a jejich relevanci pro patogenezi a prognózu CLL.
Klíčová slova:
CLL, SF3B1, NOTCH1, MYD88, sekvenování nové generace, NGSÚvod
Chronická lymfocytární leukemie (CLL) je charakterizována akumulací monoklonálních B-lymfocytů (CD5+CD19+CD23+smIgslabě) v periferní krvi, kostní dřeni a lymfatických orgánech (1). Jedná se onemocnění s výrazně variabilním klinickým průběhem, který byl spojen především s přítomností několika chromozomálních aberací (del13q14, del17p, del11q, trisomie 12). Žádná s těchto aberací (s výjimkou delece 13q14), ale pravděpodobně přímo nezpůsobuje vznik malignity. U CLL také nejsou přítomny chromozomální translokace zahrnující imunoglobulinové lokusy, které jsou typické pro jiné B-buněčné malignity (1). S patogenezí onemocnění byla doposud spojována především delece dvou mikroRNA (miR-15a, miR-16-1) v oblasti 13q14, která vede ke vzniku CLL u myšího modelu (shrnuto v 2). U pokročilých stadií onemocnění a u pacientů s chorobou refrakterní na terapii byly popsány mutace v genech pro p53 a ATM, které jsou ale málo časté u nově diagnostikovaných pacientů. Přes značnou snahu se nedařilo popsat další genové mutace, které by mohly být klíčové pro vznik onemocnění. Diskutabilní zůstala také otázka existence kmenové nádorové buňky s kauzální aberací, z níž pochází maligní B-lymfocyty (shrnuto v 3).
V posledních měsících bylo publikováno několik prací, které s využitím technologie „sekvenování nové generace“ indentifikovaly u CLL rekurentní mutace v protein-kódujících genech a částečně odpověděly na některé výše nastíněné otázky. V následujícím textu se věnujeme shrnutí těchto poznatků a jejich možnému významu pro biologii CLL.
Sekvenování genomu u pacientů s CLL
Zásadní posun v identifikaci mutací umožnila technologie „sekvenování nové generace“ (Next Generation Sequencing – NGS), která dovoluje získat informaci o sekvenci celého genomu jednotlivce nebo o sekvenci všech známých oblastí kódujících geny (tzv. exomové sekvenování – cca 5 % genomu) (shrnuto v 4). NGS nebo také „masivní paralelní sekvenování“ používá technologie, které obchází překážky klasického kapilárního sekvenování vycházejícího ze Sangerovy metody. Nejčastěji používané platformy NGS využívají principu tzv. pyrosekvenování (Roche-454), reverzibilních terminátorů syntézy DNA (Illumina-Genome Analyzer) nebo přístupu „sekvenování založené na ligaci a detekci“ (Life Technologies-SOLiD) (shrnuto v 4). Tyto metodiky představují nástroj pro systematickou identifikaci genetických aberací spojených s patogenezí onemocnění, potenciálních terapeutických cílů a molekulárních markerů. V nedávné době byly publikovány výsledky čtyř průlomových prací využívajících celogenomové a exomové sekvenování pro identifikaci genových aberací u CLL (5, 6, 7, 8). Byly takto popsány mutace v 15 protein-kódujících genech vyskytující se s frekvencí větší než ~ 2 %, jejichž úloha v patogenezi CLL předtím nebyla prakticky vůbec předpokládána (tab. 1).
V první práci publikované v časopise Nature (5) provedli autoři sekvenování celého genomu u 4 jedinců s CLL. Byly analyzovány 2 vzorky s mutovaným IgVH a 2 s nemutovaným IgVH, které tak reprezentovaly dva základní subtypy tohoto onemocnění definované přítomností resp. absencí somatických hypermutací ve variabilní oblasti těžkého řetězce imunoglobulinu (IgVH). U těchto 4 pacientů autoři detekovali mutace ve 45 protein-kódujících genech a následně se zaměřili na validaci 26 vybraných mutací, které byly nalezeny v genech exprimovaných v CLL buňkách. Tento přístup umožnil snížit množství sekvenování, které bylo provedeno na validačním souboru 169 pacientů. Byly identifikovány 4 mutace v genech NOTCH1, MYD88, XPO1 a KLHL6, které se vyskytly alespoň u dvou pacientů. Tyto čtyři geny byly dále studovány na větším souboru pacientů. Nejčastěji mutovaným genem (12 % pacientů) byl NOTCH1, kde se ve většině případů vyskytovala dvou-nukleotidová delece CT (p.P2515Rfs*4). Tato mutace, společně se dvěma dalšími méně častými záměnami v této oblasti, vede ke vzniku předčasného stop kodonu a akumulaci aberantního proteinu. Z výsledků vyplývá, že tyto mutace způsobují stabilizaci proteinu, což vede ke zvýšené aktivitě celé NOTCH-signalizační dráhy (analýza genové exprese pomocí DNA čipů). Je zajímavé, že existence mutací v NOTCH1 a konstitutivní aktivace této dráhy u CLL byla popsána již před nástupem NGS technologie pomocí klasického Sangerova sekvenování (10–11). Doposud publikované poznatky jsou v souladu se známou úlohou mutací v NOTCH1 u T-akutní lymfoblastické leukemie (T-ALL). Mutace v NOTCH1 jsou přítomny až u 60 % případů T-ALL a předpokládaným mechanismem je NOTCH1-dependentní aktivace protoonkogenu c-myc (12). NOTCH dráha je klíčová i v biologii kmenových buněk, což by mohlo být relevantní také pro CLL, kde byla postulována existence kmenové nádorové buňky (13).
Druhým nejčastěji mutovaným genem byl MYD88 (cca u 3 % pacientů), jehož mutace byly také popsány u lymfomů (14). Tento protein se účastní signalizační kaskády interleukinu 1 a Toll-receptoru. Podobně jako u NOTCH1 se předpokládá, že se jedná o mutaci aktivující, neboť buňky pacientů s mutací v MYD88 produkovaly po stimulaci Toll-like receptoru nebo interleukin-1 receptoru větší množství interleukinu 6 a chemokinových ligandů (CCL2, CCL3, CCL4). Je známo, že vysoká produkce těchto cytokinů napomáhá vytváření mikroprostředí, které podporuje přežívání CLL buněk. Je zajímavé, že mutace MYD88 byla mnohem častější u pacientů s mutovaným IgVH (7 z 8 detekovaných mutací), což bylo potvrzeno také další studií (6).
Zbývající dvě popsané mutace v genech XPO1 a KLHL6 byly přítomny u méně než 3 % pacientů. Stojí za povšimnutí, že všechny 4 detekované mutace v XPO1 genu (exportin receptor 1) byly lokalizovány v jednom kodonu a pravděpodobně ovlivňují funkce XPO1 v transportu mRNA z jádra. V případě KLHL6 vykazovaly mutace rysy charakteristické pro vznik mechanismem somatických hypermutací, což by u tohoto proteinu důležitého v tvorbě germinálního centra mohlo být logické.
Výsledky studie Puente a kolegů (5) byly následně rozšířeny dalšími publikacemi (tab. 1). Práce autorů Fabbri a kol. (7) potvrdila vysokou četnost mutací v genu NOTCH1 (zde u 15 % pacientů) a detailně analyzovala jejich vztah k transformaci do Richterova syndromu (RS). Frekvence mutací v NOTCH1 u RS byla dvojnásobná (31 %) ve srovnání s kohortou CLL pacientů (15 %). Tento rozdíl byl ještě markantnější při zohlednění CLL vzorků analyzovaných pouze při diagnóze – 10 % pacientů s mutací v NOTCH1 – vs 31 % pacientů při transformaci do RS. Autoři se také pokusili o analýzu evoluce NOTCH1 mutací u pacientů s RS a za tímto účelem sekvenovali NOTCH1 ve vzorcích před vznikem transformace. Tento přístup odhalil, že 11 z 16 pacientů mělo buď klonální mutaci NOTCH1 (n = 6), nebo mutaci genu v malém klonu CLL buněk (n = 5). Z toho vyplývá, že během průběhu choroby došlo k selekci agresivnějšího klonu, který nese mutaci. Podobné výsledky ve vztahu k evoluci mutací byly získány také při studiu aberací v genu TP53 (manuskript v přípravě).
Ve výše zmíněných studiích bylo vždy celogenomovému nebo exomovému sekvenování podrobeno jen několik pacientů. Autoři dvou recentně publikovaných studií (6, 8) zvolili přístup založený na exomovém sekvenování několika desítek CLL pacientů, což vedlo k objevu dalších mutací. Při sekvenaci exomů u 105 CLL pacientů byly identifikovány mutace celkově u 1100 různých protein-kódujících genů (7). Největším překvapením byla identifikace mutací v genu SF3B1, která je podobně častá jako mutace NOTCH1 (9,7 % CLL pacientů). Gen SF3B1 kóduje protein, který je součástí komplexu spliceosomu, nezbytného pro sestřih (splicing) RNA. Vysoká míra konzervovanosti sekvence SF3B1 genu naznačuje jeho důležitou úlohu v regulaci genové exprese. Je zajímavé, že mutace v SF3B1 byly prakticky souběžně popsány také u myelodysplastického syndromu (15). U CLL bylo také detekováno několik dalších mutací v jiných genech zapojených do sestřihu RNA. Neočekávaným pozorováním je úplná absence mutací v SF3B1 u 156 sekvenovaných nehodgkinských lymfomů (8) a zůstává tak zatím neobjasněno, proč by deregulace mechanismu sestřihu RNA měla být podstatná právě u CLL a MDS.
Distribuce nově popsaných mutací u subtypů CLL a jejich vztah k prognóze
Nejnověji zveřejněná studie Wanga a kolegů (6) se také zabývala identifikací mutací pomocí exomového sekvenování u CLL vzorků (n = 91) a specificky především jejich distribucí u jednotlivých subtypů CLL. Celkem bylo v této práci popsáno 9 genů (TP53, ATM, MYD88, NOTCH1, SF3B1, FBXW7, ZMYM3, DDX3X, a MAPK1) mutovaných ve více než 3 % vzorků, z nichž prvních pět bylo již zmíněno výše. Mutace SF3B1 byly v této kohortě přítomny u 15 % pacientů (více než ve studii Quesada et al.), což pravděpodobně reflektovalo specifické složení kohorty. Klíčovým poznatkem byla asociace mutací v SF3B1 s delecí či mutací ATM genu (mutace SF3B1 u 36 % pacientů s delecí 11q). Zároveň byly mutace v tomto genu spojeny s horší prognózou, což bylo potvrzeno také nezávislou studií na velkém souboru pacientů (n = 301) (16) (obr. 1A). Autoři také jako první demonstrovali funkční dopad mutace SF3B1, která způsobila neefektivní sestřih RNA u testovaných genů. Funkčnost komplexu spliceosomu je důležitá pro mnohé buněčné funkce včetně opravy DNA, což by mohlo být podkladem možné synergie mutací v SF3B1 a delece/mutace ATM.
Mutace v NOTCH1 byly spojeny s přítomností trisomií 12. chromozomu, což bylo pozorováno také v dalších studiích (5, 7, 17). Je zajímavé, že záměny v NOTCH1 jsou obecně spojeny s horší prognózou (obr. 1B) a pravděpodobně jsou zodpovědné za agresivní fenotyp onemocnění u některých CLL pacientů s trisomií 12, kteří jsou jinak považováni za relativně indolentní subtyp CLL. Pacienti s mutací v NOTCH1 mají podobně špatnou prognózu jako pacienti s mutací v TP53, NOTCH1 mutace jsou také spojeny s CLL refrakterní na chemoterapii (18) a s vyšší pravděpodobností transformace do Richterova syndromu (5, 7, 18).
Image 1. Vliv mutací v genech SF3B1 a NOTCH1 na celkové přežití pacientů s CLL (dle Rossi et al. 2011<sup>16</sup>, Rossi et al. 2011<sup>18</sup>) mut-mutovaný gen; wl - wild - type gen. *Přejato se souhlasem vydavatele. 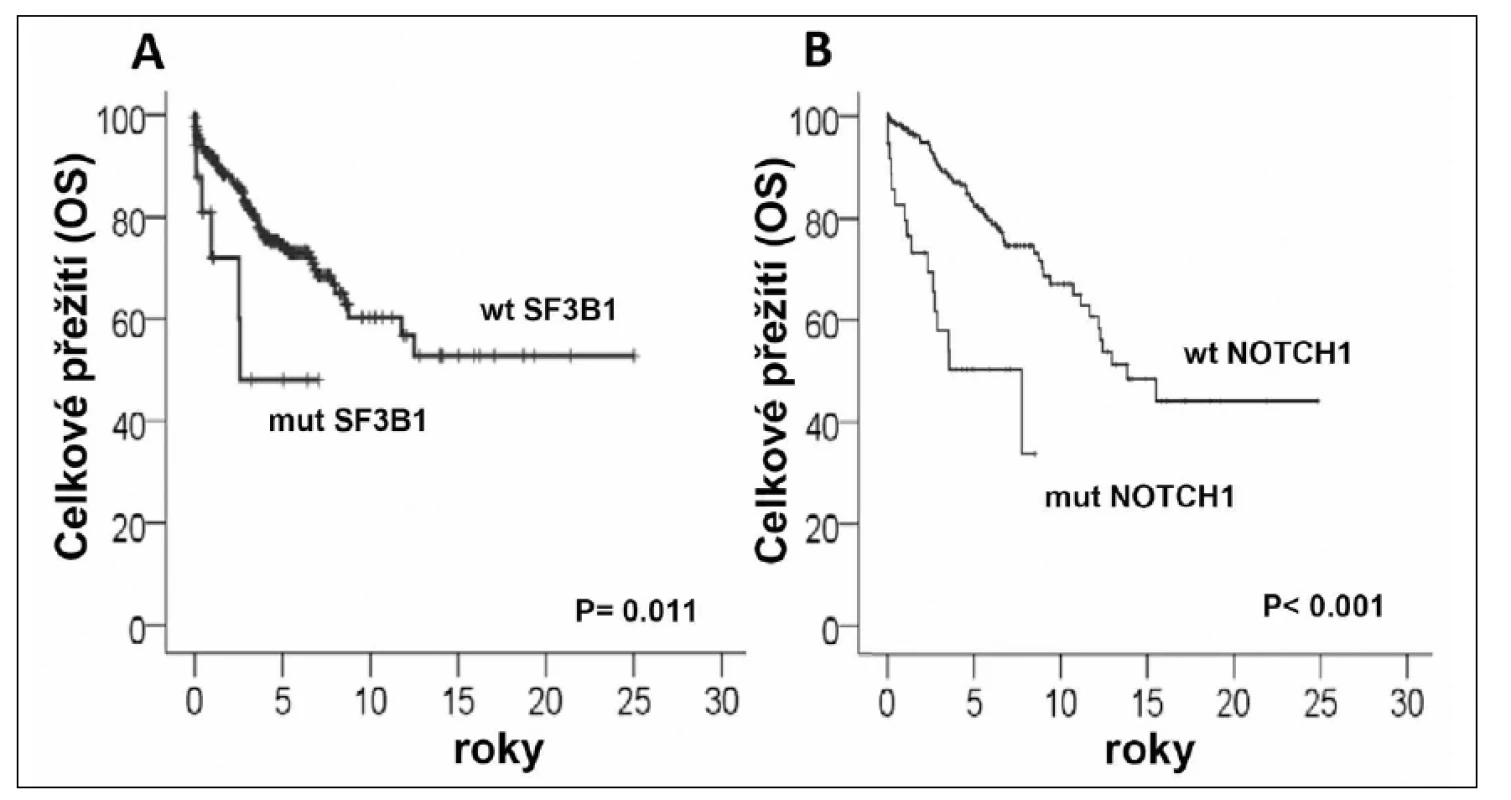
Důležitým poznatkem ze všech zmíněných studií je, že nově popsané mutace jsou ve většině případů vzájemně exkluzivní, tj. u pacienta je přítomna mutace jen v jednom z popsaných genů. Pacienti s TP53 abnormalitami jsou také specifickou skupinou, která má méně často mutovány jiné geny (mutace TP53 a mutace v nově identifikovaných genech se většinou vylučují).
Závěr
Ve velmi krátkém období došlo díky zavedení technologie „sekvenování nové generace“ k průlomovým objevům na poli chronické lymfocytární leukemie. V nádorových buňkách CLL pacientů byla identifikována řada mutací (tab. 1), které nejčastěji zasahují dráhy opravy DNA (dominantně již známé mutace TP53 a ATM), NOTCH dráhy (mutace NOTCH1, FBXW7), sestřihu a transportu RNA (mutace SF3B1, XPO1) a zánětlivých procesů (mutace MYD88, DDX3X, MAPK1). Mutace v NOTCH1 byly popsány také v preklinickém stadiu CLL u 3 % pacientů s monoklonální B-lymfocytózou (MBL) (19). Další přesná charakteristika důsledků nalezených mutací na funkce proteinů a molekulárních drah bude předmětem intenzivního studia a především nabízí nové možnosti cílené terapie pomocí inhibitorů/aktivátorů poškozených drah.
Table 1. Frekvence mutací nově popsaných pomocí NGS u CLL (zahrnuty pouze mutace validované a diskutované v jednotlivých publikacích). 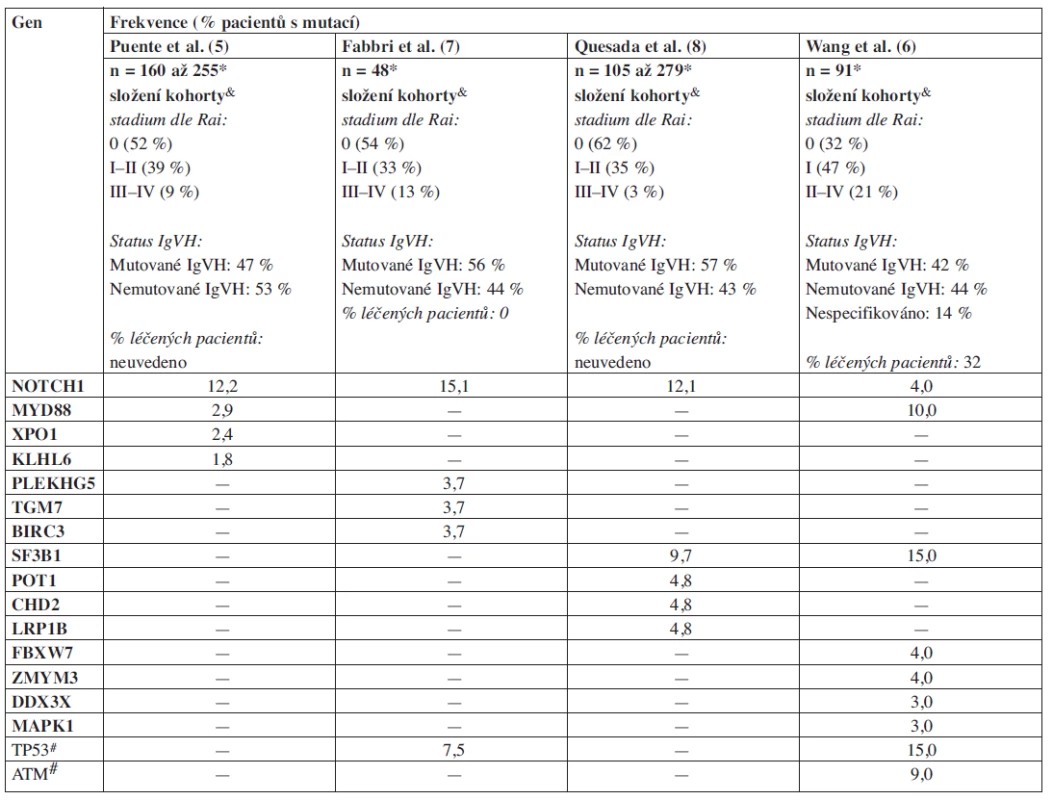
* počet pacientů ve studii, na nichž byla frekvence stanovena & pro detailní charakteristiku kohorty odkazujeme na materiály zvěřejněné jako příloha originální publikace # mutace již dříve popsané u CLL (20) Podíl autorů na rukopisu
M. M. sepsal rukopis. Ostatní autoři (T. M., D. D., M. J., Š. J., S. K-K., K. B., M. J., P. Š.) revidovali rukopis a přispěli k diskusi nad relevancí publikovaných studií.
Poděkování
Podpořeno grantem IGA MZ ČR NT11218-6/2010,
MŠMT MSM0011611430 a MUNI/A/0784/2011.
MUDr. Mgr. Marek Mráz
Interní hematoonkologická klinika FN Brno a LF MUČernopolní 9
625 00 Brno
e-mail: marek.mraz@email.cz
Doručeno do redakce: 16. 1. 2012
Přijato po recenzi: 20. 2. 2012
Sources
1. Zenz T, Mertens D, Küppers R, et al. From pathogenesis to treatment of chronic lymphocytic leukaemia. Nat Rev Cancer 2010; 10(1): 37–50.
2. Mraz M, Pospisilova S, Malinova K, et al. MicroRNAs in chronic lymphocytic leukemia pathogenesis and disease subtypes. Leuk Lymphoma 2009; 50(3): 506-509.
3. Mráz M, Pavlová Š, Malčíková J, et al. Molekulární patogeneze chronické lymfocytární leukemie. Transfuze Hematol dnes 2010; 16 : 16–20.
4. Pospíšilová Š, Tichý B, Mayer J. Sekvenování lidského genomu - technologie nové generace aneb budeme rutinně sekvenovat lidské genomy? Cas Lek Cesk 2009; 148 : 296–302.
5. Puente XS, Pinyol M, Quesada V, et al. Whole-genome sequencing identifies recurrent mutations in chronic lymphocytic leukaemia. Nature 2011; 475 : 101–105.
6. Wang L, Lawrence LS, Wan Y, et al. SF3B1 and other novel cancer genes in chronic lymphocytic leukemia. N Engl J Med, 2011; 365 : 2497–2506.
7. Fabbri G, Rasi S, Rossi D, et al. Analysis of the chronic lymphocytic leukemia coding genome: role of NOTCH1 mutational activation. J Exp Med 2011; 208 : 1389–1401.
8. Quesada V, Conde L, Villamor N, et al. Exome sequencing identifies recurrent mutations of the splicing factor SF3B1 gene in chronic lymphocytic leukemia. Nat Genet; publikováno elektronicky 11. prosince 2011 DOI 10.1038/ng1032.
9. Sportoletti P, Baldoni S, Cavalli L, et al. NOTCH1 PEST domain mutation is an adverse prognostic factor in B-CLL. Br J Haematol 2010; 151(4): 404–406.
10. Di Ianni M, Baldoni S, Rosati E, et al. A new genetic lesion in B-CLL: a NOTCH1 PEST domain mutation. Br J Haematol 2009; 146(6): 689–691.
11. Rosati E, Sabatini R, Rampino G, et al. Constitutively activated Notch signaling is involved in survival and apoptosis resistance of B-CLL cells. Blood 2009; 113(4): 856–865.
12. Weng AP, Ferrando AA, Lee W, et al. Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia. Science 2004; 306 : 269–271.
13. Kikushige Y, Ishikawa F, Miyamoto T, et al. Self-renewing hematopoietic stem cell is the primary target in pathogenesis of human chronic lymphocytic leukemia. Cancer Cell 2011; 20 : 246–259.
14. Ngo VN, Young RM, Schmitz R, et al. Oncogenically active MYD88 mutations in human lymphoma. Nature 2011; 470 : 115–119.
15. Papaemmanuil E, Cazzola M, Boultwood J, et al. Somatic SF3B1 mutation in myelodysplasia with ring sideroblasts. N Engl J Med 2011; 365 : 1384–1395.
16. Rossi D, Bruscaggin A, Spina V, et al. Mutations of the SF3B1 splicing factor in chronic lymphocytic leukemia: association with progression and fludarabine-refractoriness. Blood 2011; 118 : 6904–6908.
17. Balatti V, Bottoni A, Palamarchuk A, et al. NOTCH1 mutations in CLL associated with trisomy 12. Blood 2012; 119 : 329–331.
18. Rossi D, Rasi S, Fabbri G, et al. Mutations of NOTCH1 are an independent predictor of survival in chronic lymphocytic leukemia. Blood 2012; 119 : 521–529.
19. Rasi S, Monti S, Spina V, Foa R, Gaidano G, Rossi D. Analysis of NOTCH1 mutations in monoclonal B cell lymphocytosis. Haematologica 2012; 97 : 153–154.
20. Trbusek M, Smardova J, Malcikova J, et al. Missense mutations located in structural p53 DNA-binding motifs are associated with extremely poor survival in chronic lymphocytic leukemia. J Clin Oncol 2011; 29(19): 2703–2708.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2012 Issue 2-
All articles in this issue
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
- Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
- Identifikace patogeneticky významných mutací u chronické lymfocytární leukemie pomocí „sekvenování nové generace“
- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Kolapsový stav u 18leté dívky – kazuistika
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Kolapsový stav u 18leté dívky – kazuistika
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
- Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

