-
Medical journals
- Career
Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
Authors: H. Šváchová 1; L. Pour 2; M. Almaši 1; P. Němec 3; D. Králová 1; L. Kovářová 4; M. Penka 5; J. Vorlíček 2; R. Hájek 1,2,4
Authors‘ workplace: Univerzitní výzkumné centrum – Česká myelomová skupina, Lékařská fakulta MU Brno, 2Interní hematoonkologická klinika, FN a LF MU Brno, 3Oddělení genetiky a molekulární biologie, Ústav experimentální biologie, Přírodovědecká fakulta MU Brno, 4Laboratoř exp 1
Published in: Transfuze Hematol. dnes,16, 2010, No. 1, p. 30-34.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Úvod:
Mnohočetný myelom (MM) je krevní nádorové onemocnění, u něhož byla prokázána zvýšená míra angiogeneze. Zvýšená hladina hepatocytárního růstového faktoru (HGF) u konvenční léčby i u léčby thalidomidem je spojena s nepříznivou prognózou. Naše dřívější práce prokázala, že i snížená hladina inhibitoru trombospondinu souvisí s nepříznivou prognózou po autologní transplantaci. Cílem práce bylo ověřit hypotézu, že zvýšení hladiny trombospondinu a snížení hladiny HGF koreluje s dobrou léčebnou odpovědí po léčbě bortezomibem. Metodika a soubor pacientů: Byly hodnoceny hladiny hepatocytárního růstového faktoru v periferní krvi a trombospondinu v kostní dřeni v době stanovení diagnózy u celkem 58 pacientů, přičemž u některých pacientů byl vyšetřen jen jeden z faktorů. Pacienti byli rozděleni do skupin dle dosažené léčebné odpovědi: kompletní remise (CR), velmi dobrá parciální remise (VGPR), parciální remise (PR). Pacienti se stabilním onemocněním (SD) a s progresí (PG) byli sloučeni do skupiny nedostatečné odpovědi na léčbu (NoR). Výsledky: Pacienti, kteří dosáhli CR, měli signifikantně nižší hodnoty HGF v periferní krvi v době stanovení diagnózy než ostatní (p = 0,14), podobně platilo pro pacienty s VGPR (p = 0,012). Pacienti s CR, měli signifikantně vyšší hodnoty trombospondinu v kostní dřeni při stanovení diagnózy než ostatní (p = 0,002), podobně platilo pro pacienty s VGPR (p = 0,001). Koncentrace trombospondinu v kostní dřeni ani HGF v periferní krvi se nelišily ve skupinách rozdělených dle počtu předchozích léčebných linií s použití statistického testu ANOVA Kruskala-Wallise (p = 0,063) pro trombospondin, (p = 0,077) pro HGF. Závěr: Vysoká hladina trombospondinu v plazmě kostní dřeně u pacientů dobře reagujících na léčbu bortezomibem je novým doposud nepublikovaným prognostickým faktorem. Společně s potvrzením nižší hladiny aktivátoru angiogeneze HGF u pacientů s dobrou léčebnou odpovědí a významu dosažené léčebné odpovědi, mohou být hladiny trombospondinu a HGF při stanovení diagnózy významným prediktorem léčebné odpovědi.Klíčová slova:
mnohočetný myelom, angiogeneze, HGF, trombospondin, bortezomibÚvod
Mnohočetný myelom (MM) je druhým nejčastějším krevním nádorovým onemocněním, které je charakterizováno proliferací maligních plazmocytů. Je prvním krevním nádorovým onemocněním, kde byla prokázána zvýšená míra angiogeneze. Poprvé byla prokázána zvýšená mikrovaskulární denzita u pacientů s myelomem v devadesátých letech minulého století a dnes je již jednoznačně prokázána klíčová úloha angiogeneze v patogenezi mnohočetného myelomu (1, 2). Stupeň angiogeneze je závislý na rovnováze aktivátorů a inhibitorů. Při převaze inhibitorů je angiogeneze tlumena a naopak. U mnohočetného myelomu byly intenzivně zkoumány zejména aktivátory vaskulární endotelový růstový faktor (VEGF), bazický fibroblastový růstový faktor (bFGF), hepatocytární růstový faktor (HGF) (4–7). Výsledky nejsou u všech faktorů zcela jednoznačné, nicméně je patrné, že největší význam pro patogenezi i prognózu při použití konvenční léčby má HGF (4–7). Což bylo potvrzeno i naší prací na rozsáhlém souboru pacientů (8). Recentní práce upozorňují na zásadní vliv HGF na kostní nádorovou chorobu u MM (9).
Inhibitory jsou mnohem méně popsanou skupinou cytokinů zapojených do procesu angiogeneze. Jejich význam u mnohočetného myelomu nebyl rozsáhleji popsán. Pouze v našem souboru pacientů byl prokázán význam trombospondinu pro léčebnou odpověď po autologní transplantaci a jeho zvýšení po úspěšné léčbě (8).
V posledních letech se stává nedílnou součástí algoritmů pro léčbu mnohočetného myelomu inhibitor proteazomu bortezomib. Byl prokázán jeho zásadní přínos pro pacienty v relapsu i v primoléčbě (10, 11). V preklinických studiích byla pozorována inhibice angiogeneze tímto lékem u celé řady solidních nádorů tak i u krevních nádorových onemocnění (12, 13). Byly publikovány i práce, které hodnotí vliv bortezomibu na mikrovaskulární denzitu u pacientů s myelomem, nebyl však pozorován zásadní efekt na snížení tohoto ukazatele angiogeneze, ani nebyl prokázán vliv na hladiny aktivátorů angiogeneze (14–16).
Cílem této práce bylo sledování koncentrace trombospondinu v plazmě kostní dřeně (PKD) a HGF plazmě periferní krve (PP) před léčbou u pacientů s MM, kteří byli léčeni bortezomibem. Hodnocené cytokiny byly vybrány na základě našich výsledků u pacientů léčených autologní transplantací (8) a na základě publikovaných výsledků, které potvrzují význam HGF a trombospondinu v patogenezi MM (5, 7, 16). Práce si kladla za cíl potvrdit hypotézu, že nízké hladiny aktivátorů a zvýšené hladiny inhibitorů u pacientů podstupujích léčbu bortezomibem predikují dobrou léčebnou odpověď, tedy snížení stupně angiogeneze a nižší míru agresivity onemocnění.
Materiál a metody
Získání a zpracování materiálu: Po podepsání informovaného souhlasu byla provedena standardní sternální punkce, nebo trepanobiopsie s odběrem kostní dřeně, a odběr periferní žilní krve. Dřeň i periferní krev byly odebrány do EDTA. Nesrážlivá krev a dřen v odběrových zkumavkách byla centrifugována při pokojové teplotě 15 min. PKD použitá pro hodnocení faktorů angiogeneze byla vždy zpracována z prvního mililitru odebrané dřeně.
Měření hladin jednotlivých faktorů: Měření bylo prováděno metodikou ELISA podle firemních doporučení. Použity byly následující kity, pro HGF (Elisa kit Human HGF, R&D systems), pro Trombospondin (Elisa kit Human TSP -1, ChemoKine TM). Samotné měření proběhlo na přístroji ELISA Reader Asys Atlantis Expert Plus Biochrom. Koncentrace byly stanoveny za pomoci Software KIM.
Soubor pacientů
Byly měřeny vzorky od celkem 58 pacientů léčených bortezomibem. Jednalo se převážně o pacienty v relapsu 44/58 (76 %). Průměrný věk pacientů byl 64,8 let. Medián sledování od zahájení léčby bortezomibem činil 15,9 měsíců, a medián sledování od stanovení diagnózy byl 52,4 měsíců. Ne u všech pacientů bylo možné hodnocení vybraných faktorů angiogeneze, protože v průběhu zpracování došlo k hemolýze vzorku. Přesný počet pacientů je uveden v odstavci „Výsledky“. Ostatní charakteristiky souboru týkající se věku, pohlaví, klinického stadia jsou uvedeny v tabulce 1. Použito bylo standardní hodnocení léčebné odpovědi dle International Myeloma Working Group (17) s kategoriemi kompletní remise (CR), velmi dobrá parciální remise (VGPR), parciální remise (PR), stabilní onemocnění (SD) a progrese (PG). Pro potřeby našeho hodnocení byly skupiny pacientů se SD a PG sloučeni do skupiny nedostatečné odpovědi na léčbu (NoR).
Table 1. Charakteristika souboru pacientů (n = 58). 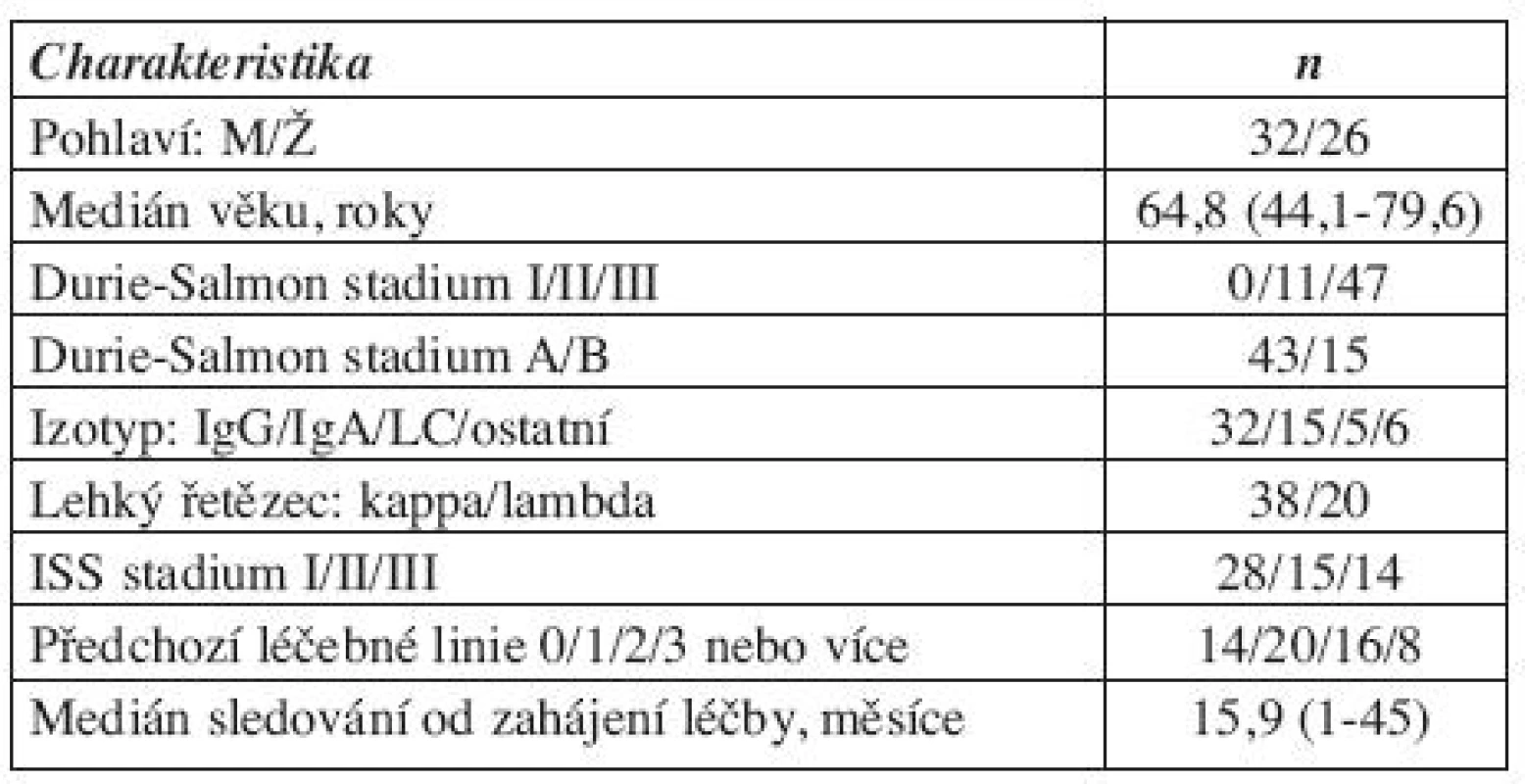
Statistické hodnocení: Výsledky byly hodnoceny s využitím programu Statistika 8.0 StatSoft, Inc. (2007), STATISTICA (data analysis software system), verze 8.0. Vztah parametru HGF byl hodnocen Mann-Whitneyho testem (pokud byly jen dvě kategorie) a statistickým testem ANOVA Kruskala-Wallise (u tří kategorií). Vztah trombospondinu byl hodnocen t-testem a Anovou.
Výsledky
Hladiny HGF byly měřeny u 52 pacientů v PP. Medián naměřených hodnot činil 1735,0 pg/ml s rozmezím 6,0–6000,0 pg/ml. U 38 % pacientů (20/52) s léčebnou odpovědí minimálně VGPR byl medián 1155,0 (6-2844) pg/ml, u 25 % pacientů (13/52), kteří dosáhli PR, 2670,0 (355–6000) pg/ml a u 37 % pacientů (19/52) s nedostatečnou odpovědí na léčbu bortezomibem 2980,0 (763–6000) pg/ml. Při porovnání všech tří skupin pacientů rozdělených dle léčebné odpovědi pomocí Anovy Kruskala Wallise byl prokázán statisticky signifikantní rozdíl (p = 0,042).
Pacienti, kteří dosáhli CR, měli signifikantně nižší hodnoty HGF v periferní krvi při zahájení diagnózy než ostatní (p = 0,014), podobně platilo pro pacienty, kteří dosáhli alespoň VGPR (p = 0,012). Podrobně tabulky 2 a 3.
Table 2. Koncentrace HGF před léčbou u pacientů s CR a ostatních. 
Vysvětlivky: Koncentrace HGF je uvedena v pg/ml. HGF – hepatocytární růstový faktor, CR – kompletní remise. Table 3. Koncentrace HGF před léčbou u pacientů s VGPR nebo lepší a ostatních. 
Vysvětlivky: Koncentrace HGF je uvedena v pg/ml. HGF – hepatocytární růstový faktor; CR – kompletní remise; VGPR – velmi dobrá parciální remise. Hladiny trombospondinu byly měřeny u 51 pacientů v plazmě kostní dřeně. Medián naměřených hodnot činil 446,0 pg/ml s rozmezím 103,0–816,0 pg/ml. U 41 % pacientů (21/51) s léčebnou odpovědí CR a VGPR byl medián koncentrací trombospondinu 582,0 (232–816) pg/ml, u 25 % pacientů (13/51), kteří dosáhli PR, činil medián 403,0 (103–672) pg/ml a u 34 % pacientů (19/52) s nedostatečnou odpovědí na léčbu bortezomibem 285,0 (96–572) pg/ml. Při porovnání všech tří skupin pacientů rozdělených dle léčebné odpovědi pomocí statistického testu ANOVA Kruskala-Wallise byl prokázán statisticky signifikantní rozdíl (p = 0,001).
Pacienti, kteří dosáhli CR, měli signifikantně vyšší hodnoty trombospondinu v kostní dřeni v době stanovení diagnózy než ostatní (p = 0,002), podobně platilo pro pacienty alespoň s VGPR (p = 0,001) Podrobně tabulky 4 a 5.
Table 4. Koncentrace trombospondinu před léčbou u pacientů s CR a ostatních. 
Vysvětlivky: Koncentrace trombospondinu je uvedena v pg/ml. CR – kompletní remise. Table 5. Koncentrace trombospondinu před léčbou u pacientů s VGPR nebo lepší a u ostatních. 
Vysvětlivky: Koncentrace HGF je uvedena v pg/ml. VGPR – velmi dobrá parciální remise; CR – kompletní remise. Koncentrace trombospondinu v kostní dřeni ani HGF v periferní krvi se nelišily ve skupinách pacientů rozdělených podle počtu předchozích léčebných linií při použití statistického testu ANOVA Kruskala-Wallise (p = 0,063) pro trombospondin, (p = 0,077) pro HGF.
Při stanovení prahové koncentrace pro HGF 3000 pg/ml a pro trombospondin 450 pg/ml bylo ve skupině pacientů, kteří dosáhli CR a/nebo VGPR celkem 71,4 % (15/21) pacientů s nižším HGF a vyšším trombospondinem než byla stanovená prahová koncentrace. Zároveň 80 % (12/15) pacientů, kteří dosáhli horší léčebné odpovědi, mělo vyšší hodnotu HGF a nižší hodnotu trombospondinu než stanovená prahová koncentrace.
Diskuse
Zvýšený stupeň angiogeneze v kostní dřeni je klíčovým krokem v patogenezi mnohočetného myelomu (3, 18). Angiogeneze je složitý proces, ve kterém je zapojena řada aktivátorů a inhibitorů a jejich rovnováha je podstatná pro finální výstup (18). Celý proces je ovlivňován řadou složitých interakcí mezi buňkami mikroprostředí s buňkami vlastního nádoru.
Jednou z možností monitorování angiogeneze je měření hladin faktorů zapojených do procesu angiogeneze (5, 18, 19). Hodnocení aktivátorů angiogeneze bylo opakovaně publikováno ve světovém písemnictví při použití konvenční léčby a rovněž při léčbě thalidomidem (3–5, 20). Významem inhibitorů angiogeneze se doposud zabývala pouze jedna práce dohledatelná v databázi Medline (19). Tato práce polských autorů porovnávala pouze hodnoty endostatinu v séru periferní krve u zdravých jedinců a pacientů s myelomem. V tomto souboru pacientů byla hodnota endostatinu zvýšena u pacientů s MM oproti kontrolám, jiné korelace nebyly zjištěny. Jednalo se však o soubor 84 pacientů a 13 kontrol a rozdíly v absolutních hodnotách nebyly významné, hodnocena byla hladina endostatinu v séru periferní krve, která může být patrně zásadně ovlivněna jinými faktory. Pouze dvě publikované práce se zabývají bortezomibem a měřením faktorů angiogeneze. Obě práce hodnotí význam aktivátorů před léčbou bortezomibem. Práce španělských autorů neprokázala vliv vstupní hladiny VEGF na prognózu nemocných léčených bortezomibem (16). Práce Terpose a kol. (2008) prokázala snížení hodnoty VEGF a bFGF po léčbě bortezomibem (14). Práce hodnotící hladiny jednotlivých faktorů angiogeneze mají poměrně rozdílné výsledky. Jedním z možných vysvětlení může být i fakt, že hodnocení z PKD je prováděno v různých fázích odběru. Jak jsme prokázali v naší předchozí práci, je nutné hodnotit jednotlivé faktory ihned z prvního mililitru odebrané dřeně (21). V naší práci byl u konvenční léčby zakončené autologní transplantací prokázán zásadní vliv HGF a trombospondinu na léčebnou odpověď, kdy pacienti s vysokou vstupní hodnotou trombospondinu a nízkou hodnotou HGF dosáhli lepší léčebné odpovědi než ostatní pacienti. Podle výsledků této práce je možno použít měření HGF v periferní plazmě, ale pro hodnocení trombospondinu je nutné použít plazmu získanou z kostní dřeně, protože hodnoty v periferii jsou značně zkresleny (8). Proto byly pro hodnocení angiogeneze při léčbě bortezomibem použity právě tyto dva faktory.
V našem souboru byly porovnány hladiny HGF a trombospondinu před zahájením léčby bortezomibem. Pacienti byli rozděleni na skupiny podle dosažené léčebné odpovědi. Pacienti s dosaženou VGPR a lepší měli statisticky signifikantně nižší hladiny HGF v PP a vyšší hodnoty trombospondinu v PKD než pacienti s horší léčebnou odpovědí na bortezomib. Výsledky naší práce jsou původní prací, která poprvé analyzuje význam aktivátoru (HGF) a inhibitoru (trombospondin) angiogeneze u MM při léčbě bortezomibem. Výsledky naznačují, že změny angiogenních faktorů jsou pravděpodobně jen odrazem dějů, které souvisí s přímým či nepřímým protinádorovým účinkem léčby na myelomové buňky obecně. K této domněnce nás vedou naše předchozí data získaná měřením koncentrace HGF a trombospondinu u pacientů před léčbou autologní transplantací. Hodnoty HGF v PPK a trombospondinu v PKD s ohledem na léčebnou odpověď byly stejné (8).
Vzhledem k analyzovanému počtu pacientů nelze zatím určit vypovídající prediktivní hodnotu pro naměřené hodnoty HGF a trombospondinu. Nicméně z naší analýzy jasně vyplývá, že pacienti s nízkou vstupní koncentrací HGF a vysokou koncentrací trombospondinu mají více než 70 % zastoupení alespoň VGPR. A naopak pacienti s vysokou vstupní koncentrací HGF a nízkou koncentrací trombospondinu v 80 % této odpovědi nedosahují. Což signalizuje, že při větším počtu pacientů by mohla být potvrzena vysoká specificita i senzitivita těchto vyšetření.
Při použití nových léků thalidomidu, bortezomibu a lenalidomidu většina klasických biochemických i cytogenetických parametrů používaných jako prognostické markery u konvenční léčby selhává. Zdá se, že nové léky, zejména pak bortezomib, překonává negativní dopad těchto parametrů (22–24). V podstatě tak neexistuje jednoduchý prognostický parametr hodnotitelný před léčbou a jednotný pro všechny používané léčebné modality. Avšak dosažení CR po jakékoliv léčbě je považováno za zásadní prognostický faktor (25–27). Při námi prokázaném vztahu HGF a trombospondinu a léčebné odpovědi při použití autologní transplantace a v této práci i bortezomibu by se tak tyto dva parametry mohly stát jedním z prediktivních parametrů pro léčebnou odpověď u všech léků MM nebo dokonce prognostickým markerem. K tomu se budeme moci vyjádřit po delší době sledování.
Práce byla podpořena projekty: MŠMT LC06027 a MSM0021622434.
Mgr. Hana Šváchová
Masarykova univerzita
Lékařská fakulta, URC-CMG
Kampus MU, ILBIT A3
Kamenice 5
625 00 Brno
e-mail: svachova@med.muni.cz
Sources
1. Vacca A, Ribatti D, Roncali L, et al. Bone marrow angiogenesis and, progression in multiple myeloma. Br J Haematol 1994; 87 : 503–508.
2. Rajkumar SV, Leong T, Roche PC, et al. Prognostic value of bone marrow angiogenesis in multiple myeloma. Clin Cancer Res 2000; 6 : 3111–3116.
3. Rajkumar SV, Yoon SY, Li CY, et al. Angiogenesis in myeloma: expression, of basic, fibroblast growth factor (bFGF), vascular endothelial growth factor (VEGF) and their receptors by neoplastic plasma cells. Blood 1999; 94 : 303b.
4. Neben K, Moehler T, Kraemer A, et al. Response to thalidomide in, progressive multiple, myeloma is not mediated by inhibition of angiogenic, cytokine secretion. Br J Haematol 2001; 115 : 605–608.
5. Sezer O, Jakob C, Eucker J, et al. Serum levels of the angiogenic cytokines basic fibroblast growth factor (bFGF), vascular endothelial growth factor (VEGF) and hepatocyte growth factor (HGF) in muliple myeloma. Eur J Haematol 2001; 66 : 83–88.
6. Ščudla V, Bačovský J, Papajík T, et al. Comparison of serum levels of, selected biological parameters in monoclonal gammopathy of, undetermined significance and multiple myeloma. Vnitr Lek 2006; 52 : 232–240.
7. Alexandrakis MG, Passam FH, Sfiridaki A, et al. Elevated serum concentration of hepatocyte growth factor in patients with multiple myeloma: correlation with markers of disease activity. Am J Hematol 2003; 72 : 229–233.
8. Pour L, Svachova H, Adam Z, et al. Pretreatment hepatocyte growth factor .and thrombospondin-1 levels predict response to high-dose chemotherapy for multiple myeloma, Neoplasma, in print.
9. Standal T, Abildgaard N, Fagerli U, et al. HGF inhibits BMP-induced osteoblastogenesis: possible implications for the bone disease of multiple myeloma. Blood 2007; 109 : 3024–3030.
10. Richardson PG, Barlogie B, Berenson J, et al. A phase 2 study of bortezomib in relapsed, refractory myeloma. N Engl J Med 2003; 348 : 2609–2617.
11. San Miguel JF, Schlag R, Khuageva NK, et al. VISTA Trial Investigators. Bortezomib plus melphalan and prednisone for initial treatment of multiple .myeloma. N Engl J Med 2008; 359 : 906–917.
12. Papageorgiou A, Kamat A, Benedict WF, et al. Combination therapy with IFN-alpha plus bortezomib induces apoptosis and inhibits angiogenesis in human bladder cancer cells. Mol Cancer Ther 2006; 5 : 3032–3041.
13. Roccaro AM, Hideshima T, Raje N. Bortezomib Mediates Antiangiogenesis in Multiple Myeloma via Direct and Indirect Effects on Endothelial Cells. Cancer Res 2006; 66 : 184–191.
14. Terpos E, Kastritis E, Roussou M, et al. The combination of bortezomib, melphalan, dexamethasone and intermittent thalidomide is an effective regimen for relapsed/refractory myeloma and is associated with improvement of abnormal bone metabolism and angiogenesis. Leukemia 2008; 22 : 247–256.
15. Politou M, Naresh K, Terpos E, et al. Anti-angiogenic effect of bortezomib in patients with multiple myeloma. Acta Haematol 2005; 114 : 170–173.
16. Cibeira MT, Rozman M, Segarra M et al. Bone marrow angiogenesis and angiogenic factors in multiple myeloma treated with novel agents. Cytokine 2008; 41 : 244–253.
17. Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia 2009; 23 : 3–9.
18. Vacca A, Ribatti D. Bone marrow angiogenesis in multiple myeloma. Leukemia 2006; 20 : 193–199.
19. Urbanska-Rys J. High serum level of endostatin in multiple myeloma at diagnosis but not in the plateau phase after treatment. Mediators Inflamm 2003; 12 : 229–235.
20. Dmoszynska A, Bojarska-Junak A, Domanski D, et al. Production of proangiogenic cytokines during thalidomide treatment of multiple myeloma. Leuk Lymphoma 2003; 44 : 1347–1351.
21. Pour L, Kovarova L, Buchler T, et al. Evaluation of hepatocyte growth factor and endostatin in the bone marrow of patients with multiple myeloma and the effect of peripheral blood admixture. Scripta medica 2009; in print.
22. Barlogie B, Anaissie E, van Rhee F, et al. Incorporating bortezomib into upfront treatment for multiple myeloma: early results of total therapy 3. Br J Haematol 2007; 138 : 176–185.
23. Němec P, Grešliková H, Smetana J, et al. The poor prognosis associated with gain/amplification of 1q21 in relapsed multiple myeloma patients may be overcome by Velcade based regimen in contrary of thalidomide based regimen. Haematologica/The Hematology Journal 2008; 93(Suppl 1): 227–228.
24. Sonneveld P, Hajek R, Nagler A, et al. Combined pegylated liposomal doxorubicin and bortezomib is highly effective in patients with recurrent or refractory multiple myeloma who received prior thalidomide/lenalidomide therapy. DOXIL-MMY-3001 Study Investigators Cancer 2008; 112 : 1529–.1537.
25. Barlogie B, Tricot GJ, van Rhee F, et al. Long-term outcome results of the first tandem autotransplant trial for multiple myeloma. Br J Haematol 2006; 135 : 158–164.
26. Attal M, Harousseau JL, Facon T, et al. InterGroupe Francophone du Myelome.: Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med, 2003; 349 : 2495–2502. Erratum in: N Engl J Med 2004; 350 : 2628.
27. Maisnar V, Radocha J, Büchler T, et al. Monotherapy with low-dose thalidomide for relapsed or refractory multiple myeloma: better response rate with earlier treatment. Eur J Haematol 2007; 79 : 305–309.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 1-
All articles in this issue
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
- Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

