-
Medical journals
- Career
Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
Authors: H. Mociková; B. Vacková; R. Pytlík; P. Obrtlíková; M. Trněný
Authors‘ workplace: Univerzita Karlova v Praze, 1. lékařská fakulta, I. interní klinika – klinika hematologie 1. LF a VFN
Published in: Transfuze Hematol. dnes,16, 2010, No. 1, p. 25-29.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Úvod.
V retrospektivní studii byly vyhodnoceny rizikové faktory, které mohou ovlivnit selhání léčby a přežívání po autologní transplantaci periferních kmenových buněk u pacientů s Hodgkinovým lymfomem. Hodnocené faktory: absolutní počet lymfocytů před separací, den +15 a den +90 po transplantaci, věk v době transplantace, klinické stadium v době relapsu, progrese/časný a pozdní relaps, odpověď na záchrannou léčbu, pozitivita pozitronové emisní tomografie před transplantací, počet podaných CD34+ buněk, úprava počtu neutrofilních leukocytů a výskyt závažných infekcí do 6 měsíců po transplantaci. Pacienti a metodika. Analyzováno bylo 33 pacientů po autologních transplantacích, které byly provedeny v letech 2000 až 2008. Medián věku pacientů byl 34 let, klinické stadium III nebo IV mělo v době relapsu 17 pacientů (51 %). Časný relaps do 1 roku od předchozí léčby byl diagnostikován u 15 pacientů (45 %). Chemosenzitivita tumoru byla prokázaná před transplantací u 21 pacientů (64 %). Pozitronová emisní tomografie byla provedena před transplantací u 21 pacientů, z toho u deseti z nich přetrvával pozitivní nález (48 %). Medián počtu podaných CD34+ buněk při transplantaci byl 6,8 x 106/kg. Medián počtu lymfocytů před separací kmenových buněk byl 1,2 x 109/l, den +15 po transplantaci 0,7 x 109/l a den +90 byl 1,35 x 109/l. Výsledky. Medián sledování pacientů byl 3,6 let, tříleté celkové přežívání a přežívání bez progrese/relapsu je 82 % a 71 %. V univariační analýze byl statisticky významný pro přežívání bez progrese nebo relapsu pouze absolutní počet lymfocytů den +90 ≥ 0,75 x 109/l (HR= 0,205, 95% CI: 0,055 – 0,757, P = 0,017). V multivariační analýze nebyl z analyzovaných faktorů žádný statisticky signifikantní pro celkové přežívání a pro přezívání bez relapsu nebo progrese. Závěr. V naší studii byl statisticky významně spojen se zlepšeným přežíváním bez progrese/relapsu pouze absolutní počet lymfocytů den +90 nad 0,75 x 109/l.Klíčová slova:
autologní transplantace kmenových buněk, léčebná odpověď, prognostické faktory, absolutní počet lymfocytůÚvod
Vysokodávkovaná chemoterapie s autologní transplantací periferních kmenových buněk (ASCT) je účinnou léčbou u pacientů s primární progresí/relapsem Hodgkinova lymfomu (HL) (1). Asi u jedné poloviny těchto pacientů dochází následně k selhání léčby a další progresi/relapsu tumoru. K prognostickým faktorům, které ovlivňují přežívání bez relapsu a celkové přežívání u pacientů s HL po ASCT patří: časný relaps do 12 měsíců od předchozí léčby, pokročilé klinické stadium (III nebo IV) v relapsu a chemosenzitivita HL v době relapsu (2, 3). Dalším faktorem, který ovlivňuje přežívání pacientů po ASCT je přetrvávající pozitivita pozitronové emisní tomografie (PET) po záchranné terapii před ASCT (4). Vyšší věk je prognostickým faktorem v prvoliniové léčbě, ale obvykle není zahrnut do studií u relabovaných HL (5). Přežívání mohou ovlivnit i faktory, které jsou spojeny přímo s vysokodávkovanou chemoterapií a ASCT: počet podaných CD34 pozitivních buněk ve štěpu, počet dní do přihojení neutrofilních leukocytů a výskyt závažných infekcí do 6 měsíců po ASCT (6). Literární údaje poukazují na význam časné úpravy lymfocytů den +15 po ASCT jako faktoru, který informuje o kontrole nádoru a ovlivňuje tím i přežívání u onkohematologických onemocnění včetně HL (6-10).
V naší retrospektivní studii byly hodnoceny absolutní počty lymfocytů den +15 a den +90 po transplantaci a další prognostické faktory, které jsou uváděny v literatuře a mohou ovlivnit selhání léčby u pacientů léčených vysokodávkovanou terapií a ASCT pro primární progresi/relaps HL.
Soubor nemocných a metodika
V období od ledna 2000 do prosince 2008 bylo retrospektivně vyhodnoceno 33 pacientů s primární progresí/relapsem HL, u kterých byla provedena autologní transplantace periferních kmenových buněk. Údaje pro analýzu byly získány ze zdravotní dokumentace pacientů.
Pacienti
33 pacientů podstoupilo autologní transplantaci periferních kmenových buněk po podání vysokodávkované terapie. Přípravný režim BEAM (karmustin, etoposid, cytarabin, melfalan) byl podán 31 pacientům, kombinace mitoxantronu a melfalanu byla použita v přípravném režimu u dvou pacientů, u kterých byla aplikována tandemová autologní transplantace (3, 11). Klinické údaje jsou shrnuty v tabulce 1. Ode dne +7 byl aplikován růstový faktor filgrastim v dávce 5 μg/kg podkožně až do přihojení neutrofilních leukocytů. U pacientů byla standardně zavedena perorální antiinfekční profylaxe ciprofloxacin 2x500 mg a flukonazol 100 mg. Léčebná odpověď byla hodnocena den +90 po ASCT. Pro hodnocení odpovědi lymfomu na léčbu byla použita kritéria z roku 1999 (12).
Table 1. Charakteristika pacientů. 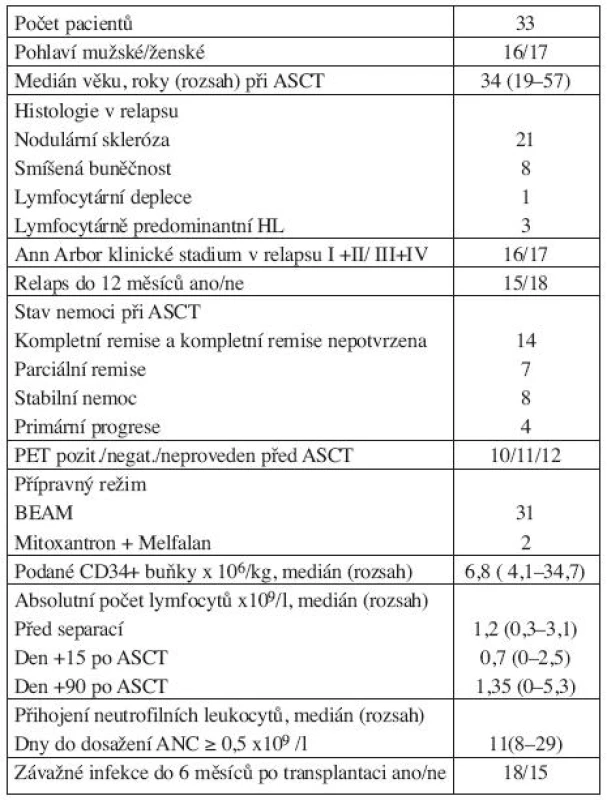
ASCT-autologní transplantace kmenových buněk, PET-positronová emisní tomografie, ANC – absolutní počet neutrofilních leukocytů Statistická analýza
Pro univariantní analýzu kategoriálních dat a pro spojité vysvětlující veličiny byla použita metoda podle Kaplana a Meiera a logrank test. Pro multivariantní analýzu byl použit Coxův model proporcionálního hazardu. Pro test vlivu jednotlivých charakteristik byl použit Waldův test a pro celkový model byl použit likelihood-ratio a chi kvadrát statistiky. Výpočty byly provedeny pomocí statistického programu SPSS v. 17. Statistická významnost byla hodnocena při P ≥ 0,05.
Výsledky
Medián sledování byl 3,6 let. Nejlepší dosažená odpověď po ASCT: kompletní remise u 21 pacientů, parciální remise u 3 pacientů, stabilní nemoc u 1 pacienta a relaps/progrese u 5 pacientů. Odpověď nebyla hodnocena u tří pacientů, kteří zemřeli do dne +90 po ASCT, ale nikdo z pacientů nezemřel před dnem +15 po ASCT. Příčinou úmrtí bylo u jednoho pacienta selhání štěpu (den +26), u druhého sepse (den +54) a třetí pacient zemřel na následky krvácení (den +71). Závažné infekce se vyskytly u 18 pacientů: sepse u 12 pacientů, u jednoho pacienta byla diagnostikovaná aspergilová pneumonie, u jednoho herpes zoster a u čtyř pacientů teploty nejasné etiologie. 3leté přežívání bez progrese/relapsu a celkové přežívání bylo 71 % a 82 % (graf 1, 2).
Graph 1. Celkové přežívání u pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk v letech. OS – celkové přežívání 
Graph 2. Přežívání bez progrese/relapsu u pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk v letech PFS – přežívání bez progrese/relapsu 
Univariační analýzy
Absolutní počet lymfocytů den +90 ≥ 0,75 x 109/l byl jediným faktorem, který byl v univariační analýze statisticky významně spojen s přežíváním bez progrese/relapsu (tab. 2).
Table 2. Univariační analýza pro celkové přežívání a přežívání bez progrese/relapsu. 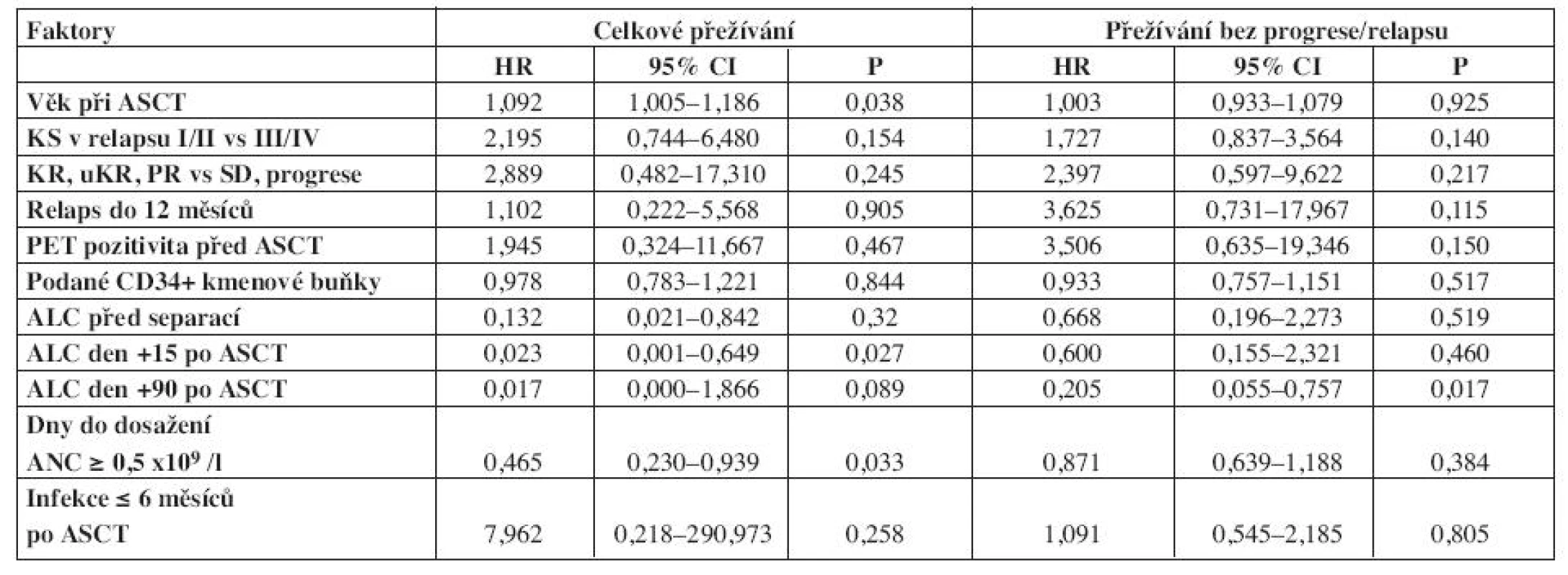
HR – hazard ratio, CI – confidence interval, ASCT – autologní transplantace kmenových buněk, KS – klinické stadium, KR – kompletní remise, uKR – kompletní remise nepotvrzena, PR – parciální remise, SD – stabilní nemoc, ALC – absolutní počet lymfocytů, ANC – absolutní počet neutrofilních leukocytů Table 3. Multivariační analýzy pro celkové přežívání a přežívání bez progrese/relapsu. 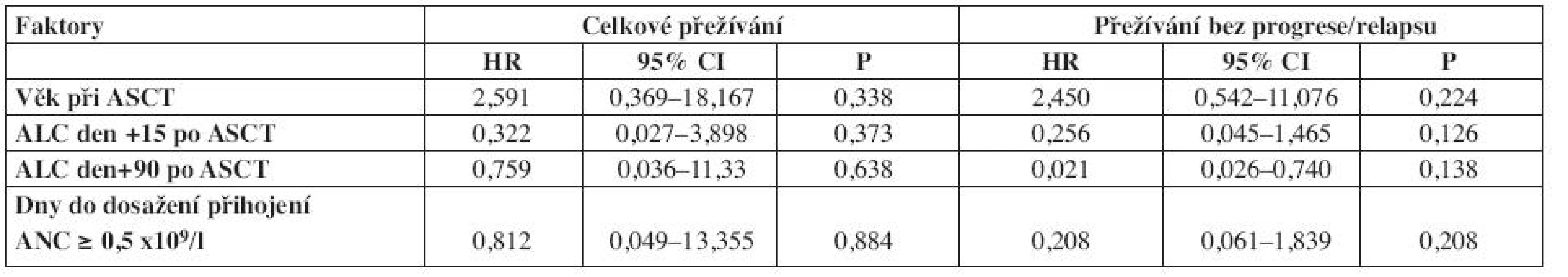
HR – hazard ratio, CI – confidence interval, ASCT – autologní transplantace kmenových buněk, ALC – absolutní počet lymfocytů, ANC – absolutní počet neutrofilních leukocytů Pro zjištění hraniční hodnoty počtu lymfocytů den + 90 po ASCT bylo použito porovnání PFS pro vybrané percentily počtu lymfocytů: statisticky významná hraničení hodnota (≥ 0,75 x 109/l) byla zjištěna na prvním kvartilu.
Ostatní sledované faktory nebyly v našem souboru pacientů statisticky významně spojeny s přežíváním bez progrese/relapsu. Statistické hodnocení limitoval nízký počet pacientů a krátký medián sledování.
Věk do 60 let v době ASCT, absolutní počet lymfocytů den +15 ≥ 0,5 x 109/l a počet dní do dosažení neutrofilních leukocytů ≥ 0,5 x 109/l byly v univariační analýze našeho souboru spojeny s lepším celkovým přežíváním (tab. 2).
Multivariační analýzy
Pro přežívání bez progrese/relapsu a celkové přežívání v multivariačních analýzách nebyl statisticky významný žádný ze sledovaných faktorů: věk v době ASCT, absolutní počet lymfocytů den +15, počet dní do dosažení přihojení neutrofilních leukocytů ≥ 0,5 x 109/l
Diskuse
V literatuře se uvádí několik prognostických faktorů v relapsu, které ovlivňují celkové přežívání pacientů s Hodgkinovým lymfomem: časný relaps do 12 měsíců od prvoliniové léčby, dále extranodální postižení, klinické stadium, anémie, B symptomy (2, 13, 14). Odpověď na záchrannou léčbu před autologní transplantací určuje chemosenzitivitu Hodgkinova lymfomu a je nejdůležitějším prognostickým faktorem ovlivňujícím další celkové přežívání pacientů (15).
Z dalších faktorů, které mohou ovlivnit celkové přežívání pacientů po ASCT to jsou charakteristiky štěpu, rychlost přihojení neutrofilních leukocytů a výskyt závažných infekcí do 6 měsíců po ASCT (6).
Podle literárních údajů počet podaných kmenových buněk CD34 pozitivních je nezávislým prognostickým faktorem pro přežívání, který souvisí s celkovou regenerací krvetvorby a i s úpravou počtu lymfocytů (16).
V současnosti se zkoumá i vliv celkového počtu lymfocytů a vliv subpopulací lymfocytů na přežívání pacientů po ASCT u HL. Mezinárodní prognostické skóre (IPS) u pokročilých stadií je tvořeno sedmi nezávislými klinickými rizikovými faktory. Jedním z nich je i absolutní počet lymfocytů pod 0,6 x 109/l (5). Nízký počet lymfocytů je důsledkem působení cytokinů, vytvářených nádorovými buňkami.
Nízký absolutní počet lymfocytů při úvodním stážování u pacientů s difuzním velkobuněčným B-nehodgkinským lymfomem (DLBCL) je považován za negativní prognostický znak a je spojen s kratším celkovým přežíváním a kratším přežíváním bez progrese/relapsu (17, 18). U této diagnózy je mechanismus vzniku úvodní lymfocytopenie a následně horšího přežívání nejasný. Počet NK buněk < 80/μl je jediná subpopulace lymfocytů v úvodním stážování NHL, která je statisticky významně spojena s délkou přežívání (19). Absolutní počet lymfocytů je u DLBCL faktorem, který ovlivňuje přežívání i u pacientů při diagnóze prvního relapsu (20). Obdobná studie u HL zatím nebyla publikována.
Gordan a spol. prokázali, že absolutní počet lymfocytů ≥ 0,667 x 109/l den +15 po ASCT je nezávislým faktorem, který je spojen s lepším přežíváním bez progrese/relapsu u lymfomů včetně HL (6). Další studie rovněž potvrdily lepší přežívání u lymfomů u pacientů s absolutním počtem lymfocytů den +15 po ASCT ≥ 0,5 x 109/l (21–24). Seshadri a spol. u 146 pacientů s relabovaným/refrakterním HL po ASCT nezjistil spojitost mezi absolutním počtem lymfocytů den+ 15 a den +90 a přežíváním bez progrese/relapsu. Tato souvislost byla statisticky významná pouze pro absolutní počet lymfocytů při separaci periferních kmenových buněk (25).
Absolutní počet lymfocytů před separací periferních kmenových buněk v našem souboru nebyl významným faktorem pro celkové přežívání ani pro přežívání bez progrese/relapsu. Naše data potvrzují význam věku méně než 60 let při ASCT, dále absolutního počtu lymfocytů d+15 ≥ 0,5 x 109/l po ASCT a počtu dní (medián 11 dní) do přihojení neutrofilních leukocytů jako faktorů, které jsou statisticky významně spojené s lepším celkovým přežíváním v univariační analýze. Tyto faktory se ale neprokázaly jako statisticky významné v multivariační analýze. Počet podaných CD34 pozitivních buněk neměl u našich pacientů vliv na přežívání, subpopulace kmenových buněk hodnoceny nebyly. Podle literatury přihojení spíš koreluje se subpopulacemi CD34 pozitivních kmenových buněk: CD34+Lin-Selectin+ je nejlepším faktorem pro určení rychlosti přihojení a CD34+Thy-1+ koreluje s dlouhodobým přihojením (26). Ostatní analyzované faktory: časný relaps do 12 měsíců od předchozí léčby, pokročilé klinické stádium v době relapsu, odpověď na záchrannou léčbu před ASCT a infekce do 6 měsíců po ASCT nebyly statisticky významné v univariační analýze pro celkové přežívání. Sekundární klinické rizikové skóre u pacientů s progresí/relapsem primárního HL a hodnocení odpovědi tumoru pomocí pozitronové emisní tomografie po 2 cyklech záchranné chemoterapie jsou nezávislými prognostickými faktory pro přežívání bez relapsu u lymfomů (2, 27), ale tyto faktory nebyly statisticky významné u našich pacientů. Příčinou může být nízký počet pacientů a relativně krátký medián sledování po ASCT.
Jediným faktorem, který ovlivnil přežívání bez progrese/relapsu v naší skupině pacientů byl absolutní počet lymfocytů den +90 po transplantaci nad 0,75x109/l. Analýza subpopulací lymfocytů den +15 a den+90 po ASCT nebyla v této retrospektivní studii provedena i když podle literatury počet NK buněk den +15 po ASCT je nezávislým faktorem přežívání u NHL (28).
MUDr. Heidi Móciková, Ph.D.
1. interní klinika
Všeobecná fakultní nemocnice
U nemocnice 2
128 08 Praha 2
e-mail: heidi.mocikova@seznam.czStudie byla podpořena výzkumním záměrem Ministerstva zdravotnictví č. MSM0021620808
Sources
1. Morschhauser F, Brice P, Ferme Ch, et al. Risk adapted salvage treatment with single or tandem autologous stem-cell transplantation for first relapse/refractory Hodgkin’s lymphoma: results of the prospective multicenter H96 trial by the GELA/SFGM Study Group. J Clin Oncol 2008; 26 : 5981–5987.
2. Josting A, Franklin J, May M, et al. New prognostic score based on treatment outcome of patients with relapsed Hodgkin’s lymphoma registered in the database of the German Hodgkin’s lymphoma study group. J Clin Oncol 2002; 20 : 221–230.
3. Schmitz N, Pfistner B, Sextro M, Sieber M, Carella AM, Haenel M, et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin’s disease: a randomised trial. Lancet 2002; 359 : 2065–2071.
4. Crocchiolo R, Canevari C, Assanelli A, et al. Pre-transplant 18FDG-PET predicts outcome in lymphoma patients treated with high-dose sequential chemotherapy followed by autologous stem cell transplantation. Leuk Lymphoma 2008; 49 : 727–733.
5. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on Advanced Hodgkin’s Disease. N Engl J Med 1998; 339 : 1506–1514.
6. Gordan LN, Sugrue MW, Lynch JW et al. Correlation of early lymphocyte recovery and progression-free survival after autologous stem cell transplant in patients with Hodgkin’s and Non-Hodgkin’s lymphoma. Bone Marrow Transplant 2003; 31 : 1009–1013.
7. Porrata LF, Litzow MR, Tefferi A, et al. Early lymphocyte recovery is a predictive factor for prolonged survival after autologous haematopoietic stem cell transplantation for acute myelogenous leukemia. Leukemia 2002; 16 : 1311–1318.
8. Porrata LF, Inwards DJ, Micallef IN, et al. Early lymphocyte recovery post-autologous haematopoietic stem cell transplantation is associated with better survival in Hodgkin’s disease. Br J Haematol 2002; 117 : 629–633.
9. Bouassel MR, Herr AL, de B Edwardes MD, et al. Early lymphocyte recovery following autologous peripheral stem cell transplantation is associated with better survival in younger patients with lymphoproliferative disorders. Hematology 2006; 11 : 165–170.
10. Kim H, Sohn HJ, Kim S, et al. Early lymphocyte recovery predicts longer survival after autologous peripheral blood stem cell transplantation in multiple myeloma. Bone Marrow Transplant 2006; 37 : 1037–1042.
11. Ovan B, Koc Y, Ozdemir E, et al. High dose sequential chemotherapy and autologous stem cell transplantation in patients with relapsed/refractory lymphoma. Leuk Lymphoma 2006; 47 : 1545–1552.
12. Cheson BD, Horning SJ, Coiffier B, et al. Report of an International Workshop to standardize response criteria for non-Hodgkin’s lymphomas. J Clin Oncol 1999; 17 : 1244–1253.
13. Brice P, Bouabdallah R, Moreau P, et al. Prognostic factors for survival after high-dose therapy and ASCT for patients with relapsing Hodgkin’s disease:analysis of 280 patients from the French Registry. Bone Marrow Transplant 1997; 20 : 21–26.
14. Moskowitz CH, Nimer SD, Zelentz AD, et al. A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood 2001; 97 : 616–623.
15. Josting A, Rudolph C, Mapara M, et al. Cologne high–dose sequential chemotherapy in relapsed and refractory Hodgkin lymphoma: results of a large multicenter study of the German Hodgkin Lymphoma Study Group (GHSG). Ann Oncol 2005; 16 : 116–123.
16. Yoon DH, Sohn BS, Jang G, et al. Higher infused CD34+ hematopoietic stem cell dose correlates with earlier lymphocyte recovery and better clinical outcome after autologous stem cell transplantation in non-Hodgkin’s lymphoma. Transfusion 2009 May 11. doi 10.1111/j.1537–2995.2009.02202.x.
17. Oki Y, Yamamoto K, Kato H, et al. Low absolute lymphocyte count is a poor prognostic marker in patients with diffuse large B-cell lymphoma and suggests patient’s survival benefit from rituximab. Eur J Haematol 2008; 81 : 448–453.
18. Cox MC, Nofroni I, Ruco L, et al. Low absolute lymphocyte count is a poor prognostic factor in diffuse-large-B-cell-lymphoma. Leuk Lymphoma 2008; 49 : 1745–1751.
19. Plonquet A, Haioun C, Jais JP, et al. Peripheral blood natural killer cell count is associated with clinical outcome in patients with aaIPI 2-3 diffuse large B-cell lymphoma. Ann Oncol 2007; 18 : 1209–1215.
20. Porrata LF, Ristow K, Habermann TM, et al. Absolute lymphocyte count at the time of first relapse predicts survival in patients with diffuse large B-cell lymphoma. Am J Hematol 2009; 84 : 93–97.
21. Joao C, Porrata LF, Inwards DJ, et al. Early lymphocyte recovery after autologous stem cell transplantation predicts superior survival in mantle-cell lymphoma. Bone Marrow Transplant 2006; 37 : 865–871.
22. Yoong Y, Porrata LF, Inwards DJ, et al. The effect of absolute lymphocyte count recovery kinetics on survival after autologous stem cell transplantation for non-Hodgkin’s lymphoma. Leuk Lymphoma 2005; 46 : 1287–1294.
23. Siddiqui M, Ristow K, Markovic SN, et al. Absolute lymphocyte count predicts overall survival in follicular lymphomas. Br J Haematol 2006; 134 : 596–601.
24. Porrata LF, Gertz MA, Inwards DJ, et al. Early lymphocyte recovery predicts superior survival after autologous hematopoietic stem cell transplantation in multiple myeloma or non-Hodgkin lymphoma Blood 2001; 98 : 579–585.
25. Seshadri T, Pintilie M, Keating A, et al. The relationship between absolute lymphocyte count with PFS in patients with Hodgkin’s lymphoma undergoing autologous hematopoietic cell transplant. Bone Marrow Transplant 2008; 42 : 29–34.
26. Pratt G, Rawstron AC, English AE, et al. Analysis of CD34+ cell subsets in stem cell harvests can more reliably predict rapidity and durability of engraftment than total CD34+ cell dose, but steady state levels do not correlate with bone marrow reserve. Br J Haematol 2001; 114 : 937–943.
27. Schot BW, Zjilstra JM, Sluiter WJ, et al. Early FDG-PET assessment in combination with clinical risk scores determines prognosis in recurring lymphoma. Blood 2007; 109 : 486–491.
28. Porrata LF, Inwards DJ, Ansell SM, et al. Early lymphocyte recovery predicts superior survival after autologous stem cell transplantation in non-Hodgkin lymphoma: a prospective study. Biol Blood Marrow Transplant 2008; 14 : 807–816.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 1-
All articles in this issue
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
- Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

