-
Medical journals
- Career
Využitie sekundárnej profylaxie s rekombinantným aktivovaným faktorom VII u hemofílie A s inhibítorom: naše skúsenosti a prehľad literatúry
Authors: P. Kubisz 1; I. Plameňová 1; J. Staško 1; P. Hollý 1; D. Mištuna 2; M. Mýtnik 3
Authors‘ workplace: Klinika hematológie a transfuziológie, Národné centrum hemostázy a trombózy, Jesseniova lekárska fakulta 1; Univerzity Komenského a Martinská fakultná nemocnica, Martin, SR, 1. chirurgická klinika, Jesseniova lekárska fakulta Univerzity Komenského a Martinská fakultná nemocnica, Martin, 3Chirurgická klinika Reimanovej fakultnej nemocnice s poliklinikou, Prešov, 2
Published in: Transfuze Hematol. dnes,15, 2009, No. 4, p. 210-215.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Inhibítory koagulačného faktora VIII (FVIII) sú vážnou získanou komplikáciou substitučnej liečby FVIII u hemofilie A. Liečba pacientov s hemofíliou A s inhibítorom, nevhodných na alebo po zlyhaní imunotolerančnej liečby (ITT), je problematická. Profylaxia prípravkami s “bypassovou“ aktivitou (FEIBA, rekombinantný aktivovaný koagulačný faktor VII (rFVIIa)) je v súčasnosti skúšaná ako perspektívna alternatíva. V práci sa opisuje prípad pacienta s vrodenou hemofíliou A, u ktorého bol vo veku 3 rokov po viac ako 50 podaniach ľudského plazmatického FVIII zistený inhibítor FVIII. Pacient absolvoval neúspešnú ITT podľa modifikovaného Bonnského protokolu a jeho stav bol komplikovaný rozvojom hemofilickej artropatie ľavého kolenného kĺbu. U pacienta bola aplikovaná lokálna liečba (synovektómia, intra-artikulárne podávanie glukokortikoidov) a intenzívna rehabilitácia pri súčasne prebiehajúcej profylaxii rFVIIa v dávke 120 μg/kg 2 až 3-krát týždenne nezávisle od fyzickej aktivity a preventívne pred zvýšenou fyzickou aktivitou. Profylaxia rFVIIa trvala 19 mesiacov a viedla k redukcii krvácania a zlepšeniu kvality života. Nepozorovala sa progresia artropatie ani závažného krvácania súvisiaceho s rehabilitáciou.
Kľúčové slová:
hemofília A, inhibítory FVIII, profylaxia, rFVIIa, hemofilická artropatiaInhibítory faktora VIII (FVIII), vyskytujúce sa u 10 až 20 % pacientov s vrodenou hemofíliou A, sú závažnou komplikáciou substitučnej liečby koncentrátmi FVIII, spojenej so zvýšeným rizikom krvácania a jeho komplikácií vrátane hemofilickej artropatie (1). Imunotolerančná liečba (ITT) je obvyklý postup využívaný na eradikáciu inhibítora s relatívne vysokou úspešnosťou (približne 70 %) (2). Liečebné možnosti u hemofilických pacientov, ktorí nie sú vhodní na ITT alebo u ktorých bola ITT neúspešná, sú problematické a značne obmedzené. Prípravky s „bypassovou“ aktivitou sú v tejto skupine pacientov bežne používané, obvykle “on-demand“. Profylaxia s “bypassovými“ prípravkami je menej obvyklá, avšak v poslednej dobe, po kladných skúsenostiach u hemofilických pacientov bez inhibítora a u niekoľkých prípadov pacientov s inhibítorom, zvažovaná liečebná modalita, či už ako súčasť ITT alebo ako samostatná liečba (2).
Rekombinantný aktivovaný faktor VII (rFVIIa; NOVOSEVEN, NovoNordisk, Dánsko), jeden z prípravkov s “bypassovou“ aktivitou, má preukázanú vysokú účinnosť (90 %) v liečbe krvácania u hemofilikov s inhibítorom (3) a súčasne priaznivý bezpečnostný profil (4). Používa sa najmä v liečbe akútnych krvácaní. Klinické skúsenosti s jeho použitím v profylaxii u hemofilikov s inhibítorom sú takmer výlučne obmedzené na krátkodobú prevenciu krvácania pri chirurgických výkonoch.
V práci je opísaná kazuistika pacienta s vrodenou hemofíliou A a inhibítorom a s hemofilickou artropatiou, u ktorého bol po neúspešnej ITT dlhodobo podávaný rFVIIa za účelom sekundárnej profylaxie.
U pacienta bola diagnostikovaná vo veku 3 rokov hemofília A, podľa klinických prejavov skôr ťažkého stupňa, s hraničnou hodnotou FVIII (iniciálne hemostazeologické laboratórne testovanie: aktivovaný parciálny tromboplastínový čas (aPTT) 93,1 s; koagulačná aktivita FVIII (FVIII:C) 1,3 IU/ml). Klinicky sa ochorenie manifestovalo opakovanými spontánnymi ako aj traumatickými krvácaniami do kĺbov, svalov a podkožia, vyskytujúcimi sa od 1. roku života.
Pacient bol iniciálne liečený na inom pracovisku ľudským, z plazmy derivovaným koncentrátom FVIII s nízkym obsahom von Willebrandovho faktora (vWF) (IMMUNATE, Baxter AG, Rakúsko), podávaným “on demand“, pričom počas 2 rokov od stanovenia bolo spolu uskutočnených viac ako 50 expozícií FVIII. Inhibítor FVIII bol prvýkrát zistený po 24 mesiacoch liečby. Iniciálny titer inhibítora (IT) bol 2,8 BU/ml, nasledovaný vzostupom na 38,2 BU/ml po masívnom podaní FVIII o mesiac neskôr z dôvodu život ohrozujúceho krvácania. Pre vzostup IT boli koncentráty FVIII vynechané z liečby a ďalšie epizódy krvácania boli liečené rFVIIa, podávanom “on demand“ v štandardnom dávkovaní podľa doporučenia výrobcu (90–120 μg/kg i.v. iniciálne s opakovaním rovnakej dávky v 2–3-hodinových intervaloch až do stabilizácie stavu). Po vynechaní FVIII z liečby došlo k postupnému spontánnemu poklesu IT; 12 mesiacov od prvej detekcie inhibítora bol IT 10,8 BU/ml. U pacienta bola následne zahájená ITT podľa modifikovaného Bonnského protokolu s vysokými dávkami FVIII (IMMUNATE, Baxter AG, Rakúsko; OCTANATE, Octapharma, Nemecko) (tab. 1).
Table 1. Imúnna tolerančná liečba (ITT). 
aPCC = koncentráty aktivovaného protrombinázového komplexu; BU = Bethesda jednotky; FVIII = faktor VIII; IT = titer inhibítora FVIII; ITT = imúnna tolerančná liečba; rFVIIa = aktivovaný rekombinantný faktor VII; vWF = von Willebrandov faktor ITT bola ukončená po 36 mesiacoch a vzhľadom na pretrvávanie vysokého IT (IT na začiatku ITT 10,8 BU/ml, IT 36 mesiacov od zahájenia ITT 52,5 BU/ml) hodnotená ako neúspešná. Po skončení ITT boli epizódy krvácania liečené rFVIIa alebo koncentrátmi aktivovaného protrombinázového komplexu (aPCC; FEIBA, Baxter AG, Rakúsko), eventuálne v kombinácii s hemostyptikami a antifibrinolytikami. Prípravky boli podávané “on demand“. V priebehu 1 roka po skončení ITT viedli opakované intra-artikulárne krvácania k vzniku hemofilickej artropatie ľavého kolena a obidvoch členkov. Vzhľadom k závažnému postihnutiu ľavého kolenného kĺbu bola vykonaná synovektómia a zahájená profylaktická liečba s aPCC (2000 IU (100 IU/kg) i.v. 2x/týždeň). Profylaxia s aPCC však trvala len 3 mesiace a bola predčasne ukončená pre nesúhlas rodičov a pacienta (negatívny postoj k opakovaným venepunkciám a zavedeniu permanentného venózneho katétra). Ďalšie podávanie aPCC bolo preto len pri akútnom krvácaní, aj keď pre nedostatočnú spoluprácu zo strany pacienta a jeho rodičov nie pri každej epizóde; z toho istého dôvodu nebol pacient pravidelne vyšetrovaný.
18 mesiacov po skončení profylaxie s aPCC bol pacient hospitalizovaný na našom pracovisku pre progresiu artralgií ľavého kolena a členka a zhoršenie mobility uvedených kĺbov. Vstupné fyzikálne vyšetrenie odhalilo neschopnosť samostatnej chôdze na vzdialenosti dlhšie ako niekoľko metrov, patologický vzorec chôdze so šetrením ľavej dolnej končatiny (ĽDK), edém ľavého kolena (+3cm), hypotrofiu svalstva ĽDK, flekčnú kontraktúru ĽDK a limitovanú mobilitu ľavého kolena s deficitom extenzie v rozsahu 40°. Sonografickým vyšetrením bola zistená voľná tekutina v ľavom kolennom kĺbe, svedčia s vysokou pravdepodobnosťou pre intra-artikulárne krvácanie. Laboratórny hemostazeologický nález potvrdil hemofíliu A ťažkého stupňa (aPTT 65,4 s; FVIII:C 0,006 IU/ml) s inhibítorom typu high-responder (IT 8,5 BU/ml).
U pacienta bola zahájená komplexná liečba artropatie, zahŕňajúca intra-artikulárnu aplikáciu glukokortikoidov (spolu 3x) a radioizotopovú synovektómiu (Ytrium-90) ľavého kolenného kĺbu. Uvedené invazívne zákroky boli vykonávané pod profylaktickou clonou rFVIIa, pričom rFVIIa bol podaný v dávke 240 μg/kg i.v. 30 minút pred výkonom, 120 μg/kg i.v. 2 hodiny po zákroku a potom v rovnakej dávke v 2hodinových intervaloch s postupným predlžovaním intervalu medzi jednotlivými podaniami (až na 8 hodín) a redukciou jednotlivej dávky (až na 90 μg/kg) podľa stavu. Pri uvedenej profylaxii sa nepozorovalo krvácanie neprimerané zákroku, a ani zhoršenie klinického nálezu ošetrovaného kĺbu. Popri lokálnej liečbe bola zahájená dlhodobá komplexná rehabilitácia, zahŕňajúca posilňovanie vybraných svalových skupín, laseroterapie, reedukáciu a nácvik správnej chôdze, s cieľom zmenšiť flekčnú kontraktúru ĽDK a dosiahnuť postupnú extenziu v kolennom kĺbe. Rehabilitácia bola vykonávaná podobne ako invazívne výkony pri súbežnej profylaxii rFVIIa (v dávke 90 μg/kg i.v. 3x/deň) a podávaní hemostyptík (etamsylát; Dicynone, OM Portuguesa, Portugalsko) a antifibrinolytík (kyselina 4-p-aminometylbenzoová; PAMBA, Nycomed Oranienburg GmbH, Nemecko) v štandardnom dávkovaní odporučenom výrobcom. Rehabilitácia s vyššie opísanou profylaxiou prebiehala 2 mesiace počas opakovaných hospitalizácií. Nasledujúce 3 mesiace sa pokračovalo v intenzívnej fyzioterapii v nemocničných a kúpeľných zariadeniach pri súbežnej profylaxii rFVIIa v upravenom dávkovaní (120 μg/kg 3x/týždeň a 30 minút pred plánovanou zvýšenou fyzickou aktivitou).
Po 5 mesiacoch rehabilitácie bol pacient schopný samostatnej chôdze na dlhšie vzdialenosti (cca 20–30 metrov) pri osvojenom správnom vzorci chôdze. Hypotrofia ĽDK a edém ľavého kolena pretrvávali, avšak rozsah flexie v ľavom kolenom kĺbe bol takmer normálny a pozorovalo sa taktiež zlepšenie extenzie (pretrvávajúci deficit v rozsahu 25°). Kontrolným ultrasonografickým vyšetrením sa nezistila prítomnosť voľnej tekutiny v ľavom kolennom kĺbe ani progresia zhrubnutia synovie. Počas obdobia intenzívnej fyzioterapie sa nezaznamenalo závažné intramuskulárne alebo intra-artikulárne krvácanie. Došlo taktiež k subjektívnej úľave bolesti kĺbov a miernemu zlepšeniu mobility.
Ďalších 14 mesiacov pokračovala rehabilitácia a profylaxia rFVIIa ambulantnou formou, resp. v domácom prostredí. Profylaxia s rFVIIa prvé 3 mesiace prebiehala podľa schémy uvedenej vyššie, ďalšie 4 mesiace sa počet podaní rFVIIa znížil na 2-krát týždenne z dôvodu limitácie finančných prostriedkov pracoviska a negatívneho prístupu pacienta a rodičov (traumatizácia pacienta opakovanými venepunkciami, trvanie rodičov na čo najmenšom počte i.v. podaní, nesúhlas s vytvorením permanentného venózneho prístupu). Nasledujúcich 7 mesiacov sa striedalo podávanie rFVIIa 2 - a 3-krát týždenne v závislosti od fyzickej aktivity a rizika krvácania. Počas týchto 14 mesiacov, či už pred alebo po úprave profylaktického režimu, nebola pozorovaná žiadne signifikantné zhoršenie ortopedického nálezu. Vyskytli sa viaceré drobné krvácania a 9 epizód závažného krvácania (4x makroskopická hematúria, 3x intra-artikulárne krvácanie do ľavého kolena, 2x intra-artikulárne krvácanie do pravého členka), pričom 3 hemorágie (1x do pravého členka, 1x do ľavého kolena, 1x makroskopická hematúria) sa objavili v období pred redukciou, 4 (3x makroskopická hematúria, 1x krvácanie do pravého členka) počas redukcie podávania rFVIIa na 2 krát týždenne a 2 (2x krvácanie do ľavého kolena) neskoršie. Všetky krvácania boli úspešne liečené konzervatívne s prechodným zvýšením dávky rFVIIa (120 μg/kg i.v. každé 3 hodiny s úpravou dávkovania podľa výsledkov kontrolných vyšetrení). Po 19 mesiacoch profylaxie s rFVIIa bol klinický nález pacienta nezmenený, pretrvávala hypotrofia ĽDK a mierny edém ľavého kolena, flekčná kontraktúra kolena s pretrvávajúcim deficitom extenzie do 35°, avšak flexia bola len terminálne obmedzená.
Počas profylaxie rFVIIa nedošlo k významnému vzostupu IT a pozorovala sa tendencia k jeho poklesu (obrázok 1). Profylaxia s rFVIIa bola pozitívne vnímaná pacientom aj jeho rodičmi; podľa ich subjektívneho hodnotenia došlo k zlepšeniu kvality života (KŽ), konkrétne k zlepšeniu mobility a chôdze a zníženiu závažnosti a častosti krvácania. Najväčšou subjektívnou nevýhodou, uvádzanou pacientom aj jeho rodičmi, bola nutnosť častej i.v. aplikácie liekov. Objektívne bolo zistené zníženie frekvencie epizód krvácania a mierne zlepšenie mobility s pretrvávaním defektu hybnosti ĽDK.
Image 1. 1. Vývoj titra inhibítora FVIII (IT) BU = Bethesda jednotky; IT = titer inhibítora FVIII; ITT = imúnna tolerančná liečba; rFVIIa = aktivovaný rekombinantný faktor VII * časové údaje sú uvedené v mesiacoch od prvej detekcie inhibítora FVIII; v zátvorkách sú uvedené mesiace od zahájenia ITT, resp. profylaxie s rFVIIa 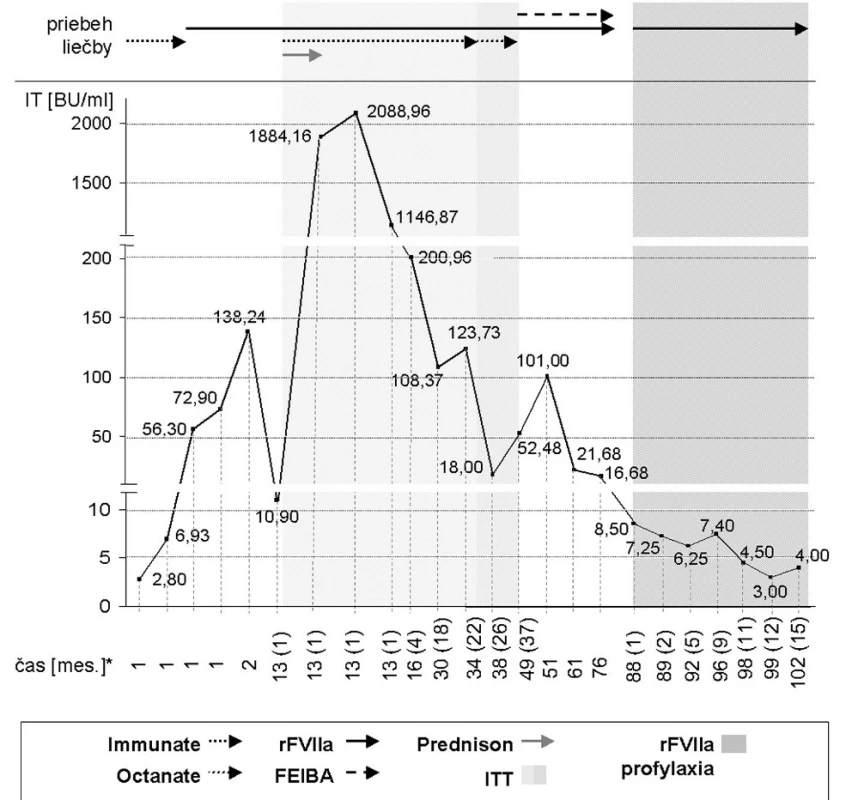
Sekundárna dlhodobá profylaxia s rFVIIa sa ukázala byť v opisovanom prípade efektívnou liečebnou modalitou. Viedla k zníženiu frekvencie krvácania, čiastočnému zlepšeniu mobility a zlepšeniu subjektívne hodnotenej KŽ. Neviedla k vzostupu IT a nepozorovali sa ani závažné komplikácie liečby rFVIIa vrátane tromboembolickej príhody.
Tieto zistenia sú v zhode s údajmi z odbornej literatúry, aj keď údaje o profylaxii rFVIIa, či už primárnej alebo sekundárnej, sú limitované – do konca júna 2009 bola v anglicky písanej odbornej literatúre (databázy PubMed, Medline, Medscape) publikovaná 1 väčšia randomizovaná štúdia (5) a niekoľko kazuistík, resp. malých sérií pacientov (6–19), venovaných tejto problematike a zahrňujúcich spolu menej ako 60 pacientov. Väčšina pacientov dostávala sekundárnu profylaxiu po vzniku hemofilickej artropatie, niektorí ako súčasť ITT (tab. 2).
Table 2. Prehľad profylaxie s rFVIIa pri hemofílii A podľa publikovanej odbornej literatúry. 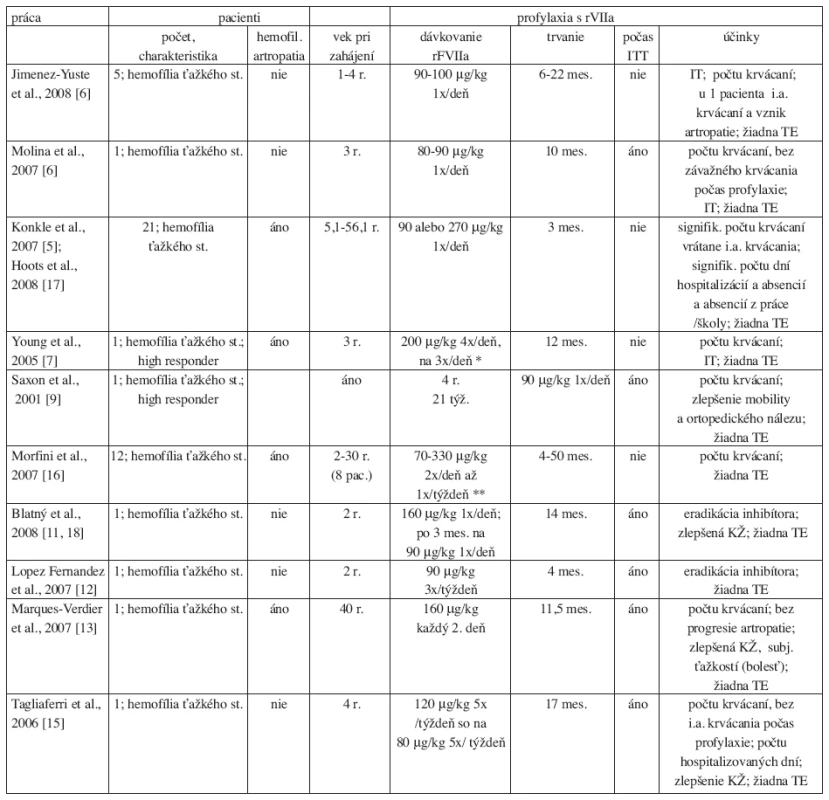
i.a. = intraartikulárne; IT = titer inhibítora FVIII; ITT = imúnna tolerančná liečba; mes. = mesiac; KŽ = kvalita života; r. = rok; rFVIIa = aktivovaný rekombinantný faktor VII; TE = tromboembolická príhoda; týž. = týždeň; = zníženie; = zvýšenie * zníženie rFVIIa len prechodné, pre zvýšenie počtu krvácaní opätovný návrat k pôvodnému dávkovaniu ** v 2 prípadoch redukcia dávky: z 160-170 μg/kg na 70 μg/kg a z 1x/deň (6 dní v týždni) na 1x/2 dni Dávkovanie rFVIIa – intervaly medzi podaniami (6 hodín až 7 dní), jednotlivé dávky (60–270 μg/kg), dĺžka liečby (4–50 mesiacov) – sa u jednotlivých pacientov značne líšilo a záviselo od klinického stavu pacienta, úsudku ošetrujúceho lekára a materiálnych zdrojov pracoviska. Použitý terapeutický režim sa u prevažnej väčšiny pacientov nemenil; zmena (predĺženie intervalu medzi dávkami, resp. redukcia dávky rFVIIa) bola uskutočnená len u 4 pacientov (7, 11).
Jediná prospektívna, randomizovaná, dvojito zaslepená štúdia zahŕňala 22 pacientov s ťažkou hemofíliou (z toho 21 s hemofíliou A), inhibítorom a hemofilickou artropatiou a s častými krvácaním (definovaným ako najmenej 4 krvácania vyžadujúce hemostatickú liečbu počas 1 mesiaca pred randomizáciou), ktorým bol podávaný rFVIIa v dávke 90 μg/kg alebo 270 μg/kg 1x/deň po dobu 3 mesiacov (5). V ramenách s rFVIIa sa pozorovalo signifikantné zníženie priemerného počtu krvácaní za 1 mesiac (z 5,6 na 3,0 v skupine s rFVIIa 90 μg/kg, a z 5,3 na 2,2 v skupine s rFVIIa 270 μg/kg; P = 0,0001 u oboch skupín). Krvácanie do kĺbov postihnutých hemofilickou artropatiou bolo taktiež signifikatne znížené (o 43 % a 61 %) (5).
Podobné pozitívne účinky profylaxie s rFVIIa sa pozorovali aj v ďalších skupinách pacientov, aj keď nešlo o klinické štúdie. Morfini so spolupracovníkmi v retrospektívnej analýze 13 hemofilikov s inhibítorom (z toho 12 s vrodenou hemofíliou A, všetci high responderi, s IT < 10 BU/ml v čase zahájenia profylaxie) zistil zníženie priemerného počtu krvácaní za 1 mesiac počas profylaxie rFVIIa (16). V ďalšej práci, zahŕňajúcej 5 ťažkých hemofilikov s inhibítorom (high responderi, s IT > 10 BU/mL v čase zahájenia profylaxie, mladší 18 rokov, 1 s hemofilickou artropatiou) na dlhodobej (6–22 mesiacov) profylaxii s rFVIIa, sa u 4 pozorovalo zníženie počtu krvácaní (6). Redukcia v počte krvácaní bola opísaná aj u väčšiny kazuistík (7–13).
Okrem redukcie krvácania sa vo vyššie spomínanej štúdii pozorovalo taktiež zlepšenie KŽ, a to pri subjektívnom aj objektívnom hodnotení. Zistila sa signifikantná redukcia počtu dní strávených v zdravotníckom zariadení (z 13,5 % na 5,9 %; P = 0,0026) a zníženie, aj keď nesignifikantné, počtu praceneschopných dní, resp. dní vymeškaných zo školskej dochádzky (z 38,7 % na 16,7 %) (4, 17). Pri subjektívnom hodnotení pomocou dotazníkov pacienti udávali najvýraznejšie zlepšenie v redukcii bolesti a zlepšení mobility. Spolupráca pacientov bola zdravotným personálom hodnotená ako dobrá. Osem z 9 pacientov, ktorí sa zúčastnili hodnotenia liečby, uvádzalo spokojnosť s liečbou a zlepšenie KŽ (17).
Zaujímavým a prekvapivým zistením Konkleho a spol. bolo, že počet krvácaní zostával signifikantne nižší v porovnaní s obdobím pred profylaxiou aj v 3-mesačnom postprofylaktickom období, počas ktorého neboli pravidelne podávané prípravky s bypassovou aktivitou (5). Podľa autorov bola za uvedený fenomén zodpovedná reziduálna plazmatická aktivita rFVIIa spolu s vhodným načasovaním podania, zohľadňujúcim diurnálne rozloženie krvácaní pozorované v tejto štúdii (podanie rFVIIa ráno; väčšina krvácaní pozorovaná v raňajších hodinách) (5). Iná hypotéza zdôrazňuje význam extravazácie rFVIIa a jej hemostatickú funkciu (20). Extravazácia koagulačných faktorov je fyziologickým procesom prebiehajúcim v mieste poranenia cievnej steny. U hemofilikov pravidelne dostávajúcich rFVIIa je predpoklad zvýšenia extravaskulárnej koncentrácie rFVIIa, pričom toto zvýšenie vedie k zvýšenej expresii tkanivového faktoru (TF) s následnou tvorbou funkčných komplexov rFVIIa-TF, čo je sprevádzané zvýšenou generáciou trombínu. Predpokladá sa, že extravaskulárny rFVIIa má predĺženú biologickú aktivitu v porovnaní s plazmatickým rFVIIa. Táto hypotéza bol podporená čiastkovými nálezmi – dôkazom koagulačných faktorov v extravaskulárnom tkanive in vivo a komplexov FVIIa-TF v experimentálnom modele umbilikálnej vény (21, 22).
Protrahovaný účinok rFVIIa podporuje aj zistenie v opisovanom prípade, že redukcia rFVIIa (predĺženie časového intervalu medzi podaniami rFVIIa) po 8 mesiacoch profylaxie neviedla k signifikantnému zvýšenému počtu krvácaní (vrátane intra-artikulárnych) a ani k zhoršeniu objektívneho ortopedického nálezu. Zmena dávkovania rFVIIa počas profylaxie, aj keď iným spôsobom ako v opisovanom prípade, sa uskutočnila v ďalších 5 publikovaných prípadoch (7, 11, 15, 16). V 2 prípadoch išlo o predĺženie intervalu medzi jednotlivými dávkami (z 1x/deň (6 dní v týždni) na 1x/2 dni a z 4x/deň na 3x/deň) (11, 16) a v 3 prípadoch o redukciu jednotlivej dávky (z 160–170 μg/kg na 70 μg/kg, z 160 μg/kg na 90 μg/kg a z 120 μg/kg na 80 μg/kg) (7, 15, 16). V 4 prípadoch zmena dávkovania rFVIIa neviedla k vzostupu krvácania ani komplikácií. V 1 prípade (zníženie počtu dávok rFVIIa z 4x/deň na 3x/deň) viedla zmena k vzostupu krvácania a vyžiadala si opätovné zvýšenie počtu dávok; u tohto pacienta sa krátko po úprave profylaxie zahájila ITT. Na základe uvedených prípadov je možné predpokladať, že určité individuálne charakteristiky pacienta, resp. ďalšia súčasná liečba (ITT) môžu mať vplyv na účinnosť profylaxie. Tieto faktory však zatiaľ neboli predmetom bližšej analýzy.
Uvedené klinické pozorovania svedčia, aspoň u časti pacientov, pre predĺžený účinok profylaxie s rFVIIa a nastoľujú provokatívnu otázku – či by iniciálna dávka rFVIIa nemohla byť znížená, resp. doba medzi podaniami rFVIIa predĺžená po istom časovom intervale bez toho, aby sa riskovalo zhoršenie klinického stavu pacienta. Praktickým výstupom tohto postupu by bola úspora liečebných nákladov a zlepšenie spolupráce pacientov (menší počet podaní lieku).
Niekoľko prác sa popri hodnotení terapeutických účinkov zameralo aj na posúdenie materiálnych a finančných nákladov profylaxie s rFVIIa (13, 14, 19). Profylaxia s rFVIIa sa podľa týchto pozorovaní javí ako finančne náročná liečba. Mala by byť preto využívaná len u vybraných skupín pacientov, prednostne tých s ťažkými krvácivými komplikáciami a zníženou kvalitou života (14).
Otvoreným problémom zostáva vzťah profylaxie s rFVIIa k progresii hemofilickej artropatie. Výsledky klinických štúdií s inými bypassovými prípravkami preukázali, že sekundárna profylaxia s prípravkom FEIBA vedie k redukcii počtu intra-artikulárnych krvácaní, avšak nevedie k signifikantnému zlepšeniu a ani nezastaví progresiu už existujúcej hemofilickej artropatie (23, 24). Nie je jasné, či má rFVIIa rovnaký alebo rozdielny účinok na hemofilickú artropatiu, keďže doteraz vykonané klinické sledovania sa nezameriavali na túto problematiku a počet pacientov s rozvinutou hemofilickou artropatiou dostávajúcich sekundárnu profylaxiu s rFVIIa je limitovaný. Okrem toho bola u väčšiny pacientov profylaxia relatívne krátkodobá. V opisovanom prípade nebolo po 19 mesiacoch profylaxie s rFVIIa pozorované zhoršenie existujúcej artropatie, avšak jej príznaky pretrvávali.
Dlhodobá sekundárna profylaxia s rFVIIa sa zdá byť účinnou v redukcii frekvencie a intenzity krvácania u pacientov s hemofíliou a inhibítorom a s pozitívným účinkom na KŽ.
Zoznam použitých skratiek
aPCC = koncentráty aktivovaného protrombinázového komplexu
aPTT = aktivovaný parciálny tromboplastínový čas
BU = Bethesda jednotky
FVIII = faktor VIII
FVIII:C = koagulačná aktivita FVIII
IT = titer inhibítora FVIII
ITT = imúnna tolerančná liečba
KŽ = kvalita života
ĽDK = ľavá dolná končatina
rFVIIa = rekombinantný aktivovaný koagulačný faktor VII
vWF = von Willebrandov faktor
Poznámka
Práca bola podporená grantom Centra excelentnosti pre perinatologický výskum, spolufinancovaného zo zdrojov Európskej únie (ERDF – Európsky fond regionálneho rozvoja).
Prof. MUDr. Peter Kubisz MD, DrSc.
Klinika hematológie a transfuziológie
Národné centrum hemostázy a trombózy
Martinská fakultná nemocnica
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: kubisz@jfmed.uniba.sk
Do redakce doručeno: 20. 7. 2009
Přijato: 6. 10. 2009
Sources
1. Wight J, Paisley S. The epidemiology of inhibitors in haemophilia A: a systemic review. Haemophilia 2003; 9 : 418-435.
2. Rocino A, Santagostino E, Mancuso ME, Mannucci PM. Immune tolerance induction with recombinant factor VIII in hemophilia A patients with high responding inhibitors. Haematologica, 2006; 91 : 558-561.
3. Rodriguez-Merchan EC, Rocino A. Literature review of surgery management in inhibitor patients. Haemophilia 2004; 10 (Suppl. 2): 22-29.
4. Abshire T, Kenet G. Safety update on the use of recombinant factor VIIa and the treatment of congenital and acquired deficiency of factor VIII or IX with inhibitors. Haemophilia 2008; 14 : 898-902.
5. Konkle BA, Ebbesen LS, Erhardtsen E, et al. Randomized, prospective clinical trial of recombinant factor VIIa for secondary prophylaxis in hemophilia patients with inhibitors. J Thromb Haemost 2007; 5 : 1904-1913.
6. Jimenez-Yuste V, Alvarez MT, Marín-Salces M, et al. Prophylaxis in 10 patients with severe haemophilia A and inhibitor: different approaches for different clinical situations. Haemophilia 2008; 14 : 1-7.
7. Young G, McDaniel M, Nugent D. Prophylactic recombinant factor VIIa in haemophilia patients with inhibitors. Haemophilia 2005; 11 : 203-207.
8. Cooper H, Jones C, Campion E, et al. Rationale for the use of high dose rFVIIa in a high-titre inhibitor patient with haemophilia B during major orthopaedic procedures. Haemophilia 2001; 7 : 517-522.
9. Saxon BR, Shanks D, Jory CB, et al. Effective prophylaxis with daily recombinant factor VII (rFVIIa-Novoseven) in a child with high titre inhibitors and a target joint. Thromb Haemost 2001; 86 : 1126-1127.
10. Jimenez-Yuste V, Quintana M, Alvarez MT, et al. “Primary prophylaxis“ with rFVIIa in a patient with severe haemophilia A and inhibitor. Blood Coagul Fibrinolysis 2008; 19 : 719-720.
11. Blatny J, Kohlerova S, Zapletal O, et al. rFVIIa is effective alternative to aPCC in prophylaxis of bleeding during immune tolerance protocol in haemophiliac with inhibitor. Abstract no. P-M-166, XXIst ISTH Congress, Geneva, July 6–11, 2007.
12. Lopez Fernandez M, Andon Saavedra C, Amor Otero MA, et al. “Primary“ prophylactic treatment with recombinant activated factor VII (rFVIIa) during immune tolerance in a haemophilic child. Abstract no. P-M-161, XXIst ISTH Congress, Geneva, July 6–11, 2007.
13. Marques-Verdier A, Chaleteix C, Soulie B, et al. Secondary prophylaxis with recombinant activated factor VII (rFVIIa) in a severe haemophilia A patient with anti-factor VIII inhibitors. Abstract no. P-T-168, XXIst ISTH Congress, Geneva, July 6–11, 2007.
14. Molina MQ, Bello IF, Jimenez-Yuste V, et al. Prophylaxis with recombinant FVIIa. Abstract no. P-T-170, XXIst ISTH Congress, Geneva, July 6–11, 2007.
15. Tagliaferri A, Rivolta G, De Fanti A, et al. Prophylaxis with rFVIIa during immune tolerance treatment in a haemophiliac child with a target joint. Haemophilia 2006; 12 (Suppl. 2): Abstract no. 23 PO 718.
16. Morfini M, Auerswald G, Kobelt RA, et al. Prophylactic treatment of haemophilia patients with inhibitors: clinical experience with recombinant factor VIIa in European Haemophilia Centres. Haemophilia 2007; 13 : 502-507.
17. Hoots WK, Ebbesen LS, Konkle BA, et al. Secondary prophylaxis with recombinant activated factor VII improves health-related quality of life of haemophilia patients with inhibitors. Haemophilia 2008; 14 : 466-475.
18. Blatny J, Kohlerova S, Zapletal O, et al. Prophylaxis with recombinant factor VIIa for the management of bleeding episodes during immune tolerance treatment in a boy with severe haemophilia A and high-response inhibitors. Haemophilia 2008; 14 : 1140-1142.
19. Brackmann HH, Effenberger E, Hess L, et al. NovoSeven in immune tolerance therapy. Blood Coagul Fibrinolysis 2000; 11 (Suppl. 1): 39-44.
20. Hedner U. Potential role of recombinant factor VIIa in prophylaxis in severe hemophilia patients with inhibitors. J Thromb Haemost 2006; 4 : 2498-2500.
21. Miller GJ, Howarth DJ, Attfield JC, et al. Haemostatic factors in human peripheral afferent lymph. Thromb Haemost 2000; 83 : 427-432.
22. Almus FE, Rao LV, Fleck RA, et al. Properties of factor VIIa/tissue factor complexes in an umbilical vein model. Blood 1990; 76 : 354-360.
23. Leissinger CA, Beeton DL, Ewing NP, et al. Prophylactic treatment with activated prothrombin complex concentrate (FEIBA) reduces the frequency of bleeding episodes in paediatric patients with haemophilia A and inhibitors. Haemophilia 2007; 13 : 249-255.
24. Hilgartner MW, Makipernaa A, DiMichele DM. Long-term FEIBA prophylaxis does not prevent progression of existing joint disease. Haemophilia 2003; 9 : 261-268.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2009 Issue 4-
All articles in this issue
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. chromozomu (del(5q), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy
- Využitie sekundárnej profylaxie s rekombinantným aktivovaným faktorom VII u hemofílie A s inhibítorom: naše skúsenosti a prehľad literatúry
- Vrozené polycytemie
- Význam polymorfismu buněčné protinádorové imunity u pacientů s B-nehodgkinským lymfomem léčených rituximabem
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
- Alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem – zkušenosti centra
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozené polycytemie
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

