-
Medical journals
- Career
Minimální reziduální nemoc u chronické lymfocytární leukemie: metody stanovení a klinický význam
: L. Bezdíčková 1; M. Špaček 1; S. Peková 2; T. Kozák 1
: Za Českou skupinu pro chronickou lymfocytární leukemii ; Oddělení klinické hematologie, 3. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnice Královské Vinohrady, Praha, 2Oddělení klinické biochemie, hematologie a imunologie, Nemocnice Na Homolce, Praha 1
: Transfuze Hematol. dnes,14, 2008, No. 3, p. 124-130.
: Comprehensive Reports, Original Papers, Case Reports
Přes veškeré úsilí a používání stále účinnějších léčebných protokolů zůstává chronická lymfocytární leukemie prakticky nevyléčitelným onemocněním (jedinou potenciálně kurativní metodu představuje alogenní transplantace krvetvorných buněk). Ačkoliv se u mnohých pacientů léčbou podaří dosáhnout kompletní klinické remise, konvenční terapie vede jen u malé části pacientů k vymizení minimální reziduální nemoci (snížení počtu nádorových buněk pod úroveň jejich detekce moderními metodami). Přetrvávání reziduálních buněk, které nejsou konvenčními způsoby (cytologie, histologie, konvenční průtoková cytometrie) zjistitelné, je podkladem relapsů onemocnění. S užitím nových léčebných postupů – podávání monoklonálních protilátek, chemoimunoterapie, transplantace hematopoetických kmenových buněk – bylo možné u významné části pacientů dosáhnout lepších léčebných odpovědí ve smyslu snížení počtu nádorových buněk detekovaných moderními metodami s vysokou citlivostí. Současné poznatky naznačují, že nepřítomnost minimální reziduální nemoci po léčbě je spojena s lepší prognózou a vymizení minimální reziduální nemoci se stále častěji stává cílem klinických studií. Práce shrnuje současné poznatky o sledování minimální reziduální nemoci u chronické lymfocytární leukemie a jeho možné využití v běžné klinické praxi.
Klíčová slova:
CLL, minimální reziduální nemoc, průtoková cytometrie, Real-Time PCRÚvod
Chronická lymfocytární leukemie (CLL), nejčastější leukemie v západním světě, byla tradičně považována za indolentní onemocnění postihující převážně starší populaci. Terapeutický postup se po dlouhou dobu opíral o strategii „watch and wait“ a podáváním alkylačních látek při progresi choroby bylo jen vzácně dosaženo kompletní hematologické remise. V posledním desetiletí byla rozpoznána heterogenní povaha CLL a na základě biologických ukazatelů (především mutačního stavu genů pro těžké řetězce imunoglobulinů (1, 2), přítomnosti specifických chromozomálních aberací (3) a exprese cytoplazmatického proteinu ZAP-70 (4) identifikovány skupiny pacientů s odlišnou prognózou. Možnosti léčby se rozšířily o purinová analoga, různé typy kombinované chemoterapie, chemoimunoterapii, monoterapii monoklonálními protilátkami a auto - i alogenní transplantaci krvetvorných buněk. Těmito prostředky bylo možné dosáhnout u významného podílu pacientů kompletní hematologické remise. Přesto jsou u naprosté většiny pacientů přetrvávající reziduální leukemické buňky zdrojem relapsu onemocnění, vyžadujícího další léčbu. Útočná terapie vede často ke snížení počtu leukemických buněk pod úroveň jejich detekce konvenčními metodami (cytologie, histologie, konvenční dvoubarevná průtoková cytometrie). Moderními, vysoce senzitivními metodami s citlivostí až 1/107-8 leukocytů (5), mohou být u části pacientů tyto leukemické buňky detekovány jako minimální reziduální nemoc (MRN). Vymizení MRN po léčbě bylo u jiných hematologických malignit (např. u akutní promyelocytární leukemie (6, 7), akutní lymfoblastické leukemie v dětském věku (8, 9) a chronické myeloidní leukemie (10) prokázáno jako prognosticky příznivé a na základě dosud publikovaných dat lze předpokládat, že totéž by mohlo platit i pro CLL (11–14).
Vzhledem k tomu, že dle amerického Národního institutu pro rakovinu (National Cancer Institute, NCI) tvoří 30 % nově diagnostikovaných osob s CLL pacienti mladší 65 let (15), a že právě tito nemocní mohou profitovat z agresivnější terapie, představuje do budoucna sledování minimální reziduální nemoci výhodný nástroj nejen k predikci prognózy, ale i k dlouhodobému monitorování a eventuálnímu časnému záchytu relapsu, ještě před jeho klinickou manifestací.
Metody detekce MRN
V současné době jsou ke sledování minimální reziduální nemoci u CLL využívány tři metody (12, 16): PCR s využitím konsensuálních (consensus, univerzálních) primerů k průkazu klonality IgH řetězců, ASO-PCR (allele-specific oligonucleotide – PCR s primery individuálně navrženými pro každého pacienta) a průtoková cytometrie (FCM). Vzhledem k absenci specifického cytogenetického markeru (jaké představují například fúzní geny u chronické myeloidní a akutní promyelocytární leukemie), není tento přístup ke sledování MRN u CLL používán. PCR s využitím konsensuálních primerů vykazuje v porovnání s ASO-PCR i vícebarevnou průtokovou cytometrií výrazně nižší senzitivitu, a proto se od ní v poslední době ustupuje. ASO-PCR je metodou nejcitlivější (je schopna detekovat 1 nádorovou buňku na 105–8 leukocytů), ale časově i ekonomicky nejnáročnější (viz níže). Porovnání obou posledně jmenovaných metod znázorňuje tabulka 1.
1. Srovnání nejčastěji užívaných metod detekce MRN. 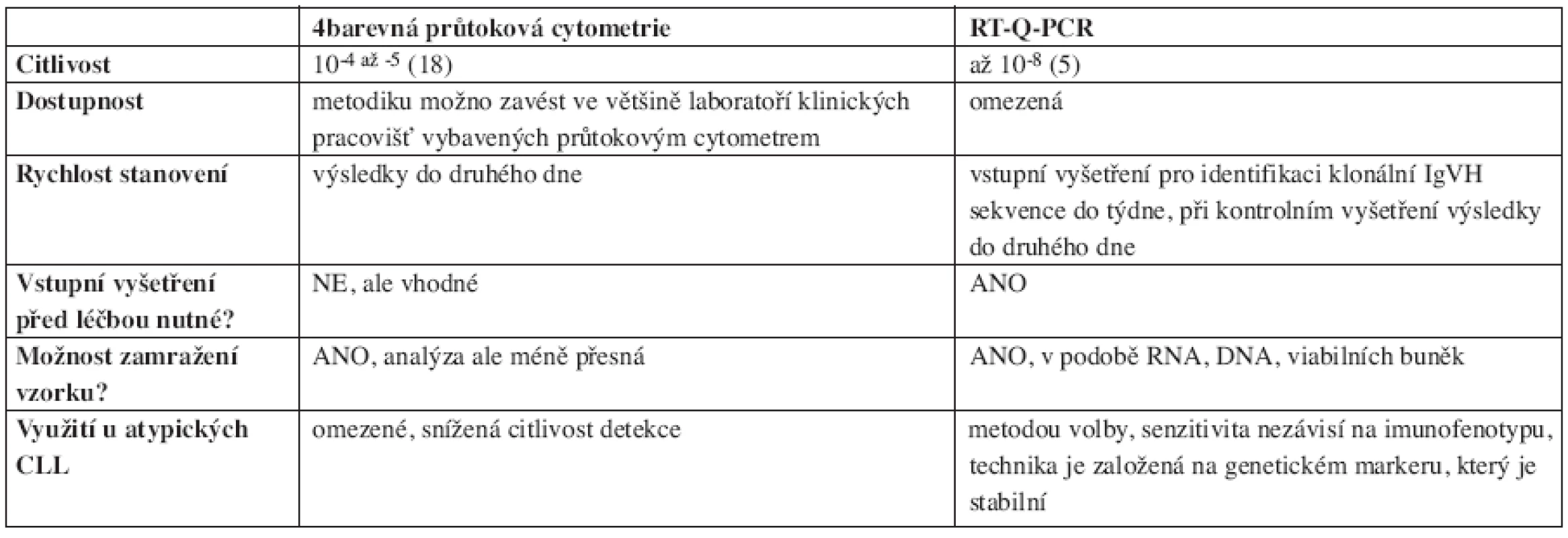
Průtoková cytometrie
Průtokovou cytometrií byly původně CLL buňky identifikovány na základě koexprese znaků CD5 a CD19 (17). Dvoubarevná FCM se ale stává méně přesnou při převaze normálních lymfocytů a přetrvávání jen malého počtu leukemických buněk (12). Čtyřbarevná FCM umožňuje lepší separaci nádorových buněk od zdravých lymfocytů, má dostatečnou citlivost (1 nádorová buňka/104-5 leukocytů), v porovnání s real-time kvantitativní PCR (RT-Q-PCR) je ekonomicky a časově méně náročná a v současné době se jeví jako v praxi nejlépe použitelná. V roce 2007 (18) byl pod hlavičkou Evropské výzkumné iniciativy pro CLL (ERIC) zveřejněn standardizovaný přístup ke sledování MRN pomocí průtokové cytometrie. Při sledování 728 vzorků periferní krve a kostní dřeně čtyřbarevnou FCM a RT-Q-PCR bylo dosaženo 87 % konkordance mezi oběma metodami u pacientů po léčbě. Byly vybrány čtyřbarevné kombinace monoklonálních protilátek (tab. 2) umožňující identifikaci CLL buněk s limitem detekce 0,01 % CLL buněk z leukocytů pro CLL s typickým imunofenotypem, přesností 96,7 %, senzitivitou 91,1 % a specificitou 98,8 %. Předpokladem k dosažení uvedených parametrů je zejména naměření dostatečného počtu událostí (500 000 leukocytů na zkumavku) a důkladná znalost charakteristiky gatovaných populací CLL buněk umožňující správné vyhodnocení. Srovnatelných výsledků lze dosáhnout při užití doporučených klonů jednotlivých monoklonálních protilátek (pro B-lymfocytární markery) (18).Metodiku lze s mimimálními úpravami aplikovat na jakýkoliv cytometr s možností čtyřbarevné FCM analýzy. Příklady výstupů 4barevné FCM analýzy jsou znázorněny na obrázcích 1a–1f. Výsledkem analýzy je stanovení procenta CLL buněk z leukocytů s uvedením limitu detekce pro dané měření (podstatné zejména u MRN negativních výsledků). Na internetu (http://www.cll-mrd.org) je v současné době dostupný kalkulátor s možností rychlého a jednoduchého výpočtu procenta reziduálních CLL buněk na základě standardně naměřených dat dle doporučeného postupu (obr. 2). Do budoucna lze předpokládat využití 5 a vícebarevného značení, které sice zřejmě nezlepší limit detekce, ale umožní zvýšit citlivost metody a provést kompletní analýzu vzorku v 1–2 zkumavkách. Nutnou součástí zavádění metodiky flow-cytometrického sledování MRN pomocí průtokové cytometrie je kontrola kvality (korelace s PCR, mezilaboratorní kontroly s výměnou vzorků, optimalizace vyhodnocování již naměřených dat – správnost hodnocení lze ověřit na příklad na výše zmiňovaných webových stránkách). U pacientů s atypickým imunofenotypem CLL buněk (nejčastěji bez prokazatelné exprese povrchového imunoglobulinu, s pozitivitou CD20, či nižší expresí CD5) je pro přesné stanovení procenta maligních buněk po léčbě nutná zejména znalost vstupního imunofenotypu (pro vyloučení jiné diagnózy a k správnému gatování neoplastické populace). Z hodnocení MRN je možné vyřadit zkumavky, kde CLL populace není jasně patrná – důsledkem je určité snížení citlivosti metody.
2. Vybrané kombinace monoklonálních protilátek ke stanovení MRN dle doporučení ERIC (European Research Initiative on CLL) (18). 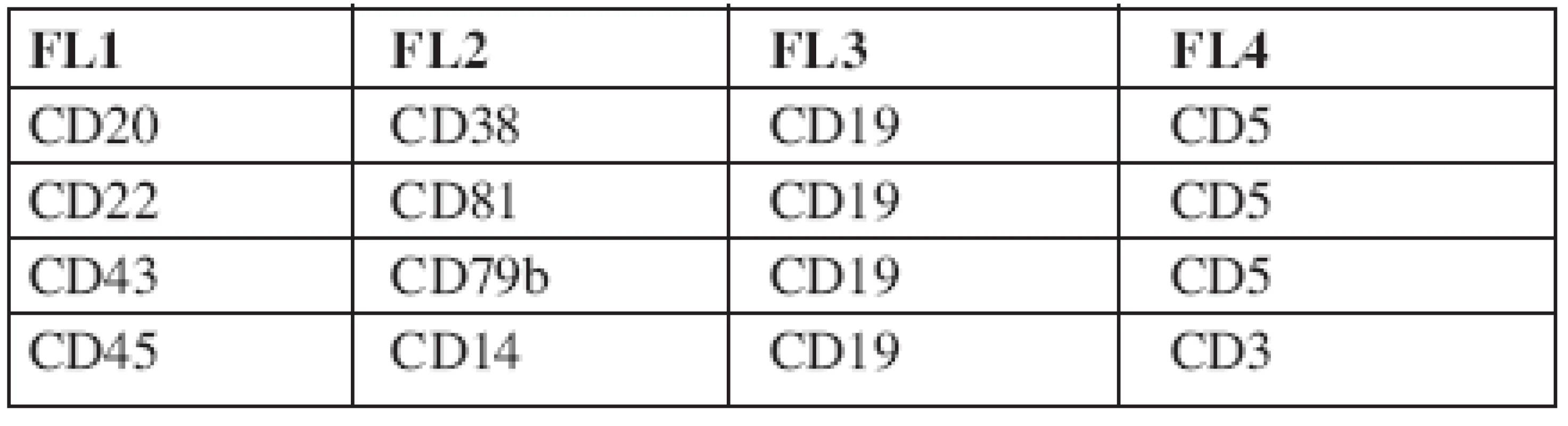
Poslední zkumavka slouží k přesnému stanovení procenta B-lymfocytů z leukocytů a k vyloučení kontaminace gate T-lymfocyty a monocyty. Doporučené klony monoklonálních protilátek viz Rawstron et al. (18). 1. a–f. Výstupy analýzy minimální reziduální nemoci sledované čtyřbarevnou průtokovou cytometrií (18) u pacienta s CLL po léčbě. Zobrazeny pouze grafy identifikující reziduální CLL populaci (černě, šedě normální B-lymfocyty). Gate na B-lymfocyty. 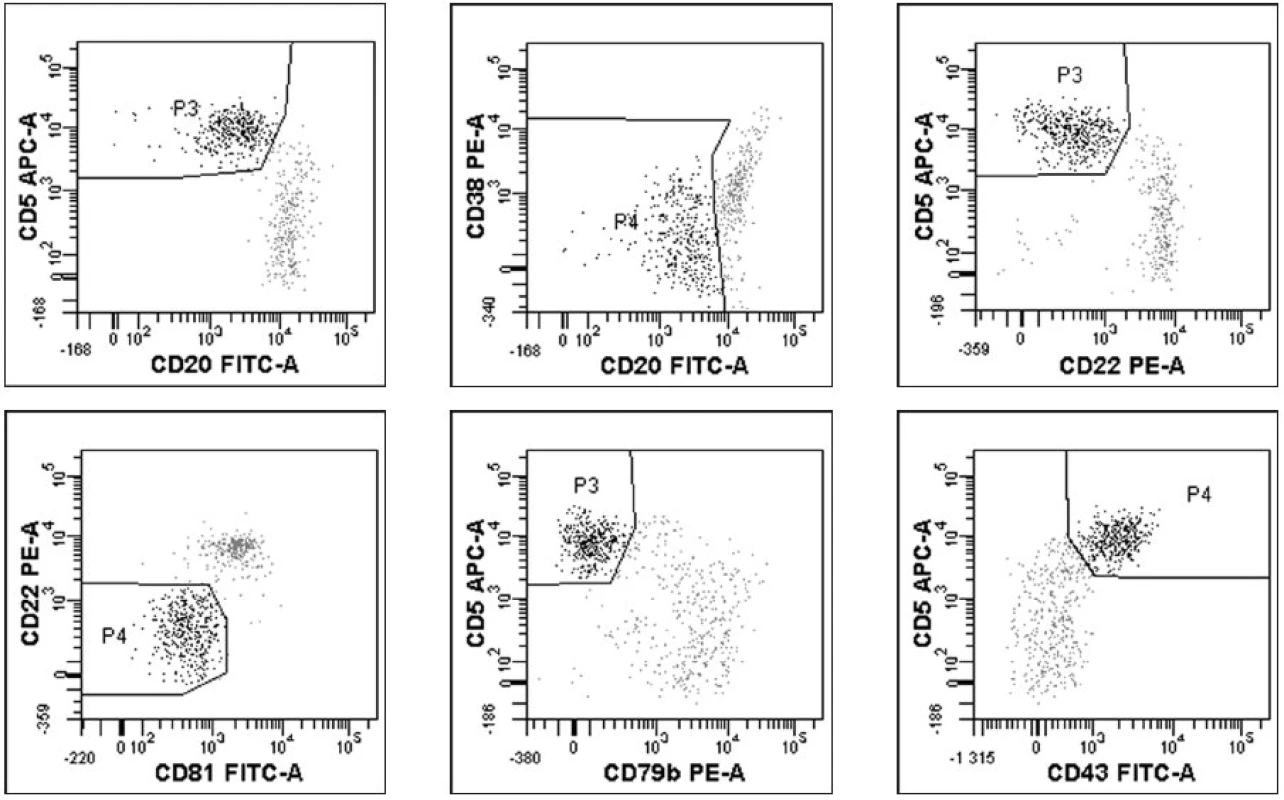
2. Výpočet procenta reziduálních CLL buněk v internetové aplikaci ( ). Kalkulátor informuje o procentu B-lymfocytů, limitu detekce konkrétní analýzy, procentu CLL buněk a případném nedostatečném naměřeném počtu leukocytů a relativně vysoké kontaminaci B-lymfocytárního gate T-lymfocyty. 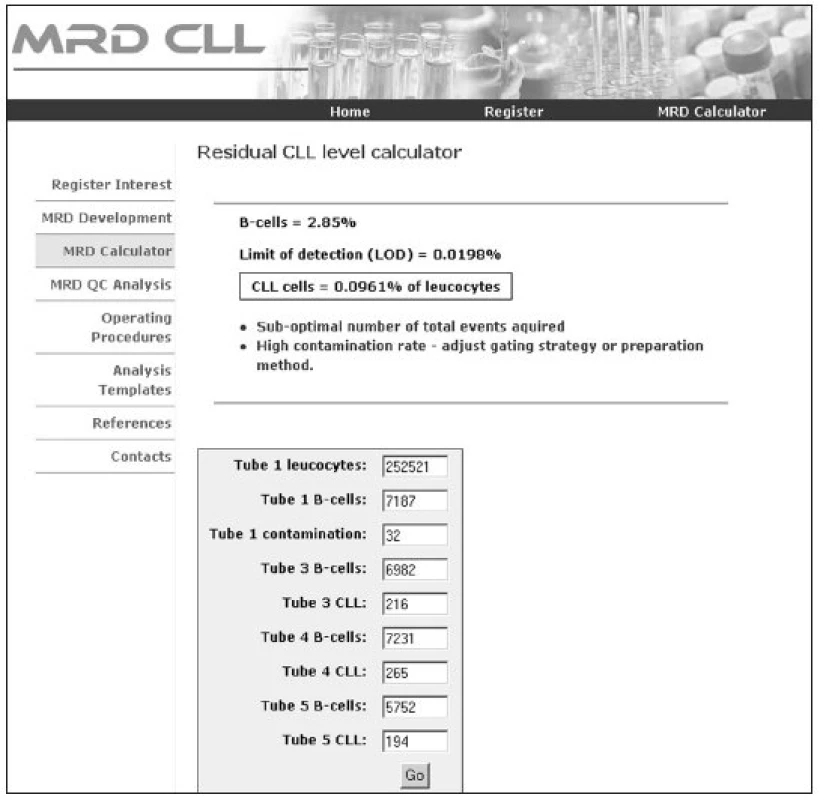
PCR
Technika detekce MRN pomocí konsensuálních primerů pro jednotlivé IgVH rodiny má relativně nízkou senzitivitu (10-3) a v současné době je považována za překonanou. Díky sekvenačnímu vyšetření IgVH přestavby identifikované při diagnóze ale máme možnost sledovat reziduální maligní populaci s vysokou senzitivitou a specifitou pomocí individuálních, pacient-specifických esejí, které jako molekulární cíl používají sekvence IgVH klonální populace (ASO-PCR). Tento přístup umožňuje „odfiltrovat“ pozadí zdravých B-lymfocytů a cíleně detekovat pouze reziduální CLL populaci. Příprava eseje je založena na navržení klon-specifických primerů a vyklonování standardu, který je v průběhu času používán k přesné kalibraci eseje. Každou esej je nutné před použitím otestovat pro detekční limit senzitivity (5).
Pro detekci a kvantifikaci klonální IgVH přestavby se používá techniky PCR v reálném čase, kde klonální CLL populace je detekována pomocí klon-specifických primerů a klon-specifické sondy. Standardně se v mnoha laboratořích jako templát používá DNA. Její výhoda spočívá především ve stabilitě (jednodušší logistika transportu vyšetřovaného materiálu), nicméně senzitivita vyšetření MRN při použití DNA jako templátu se pohybuje kolem 10-4, což odpovídá senzitivitě detekce MRN pomocí průtokové cytometrie.
Při použití RNA (cDNA) jako templátu pro kvantitativní PCR lze zvýšit senzitivitu detekce MRN o 3 - 4 řády, což představuje maximum senzitivity detekčních reakcí, které máme v současnosti k dispozici. Nevýhodou práce s RNA je fragilita této molekuly s nutností rychlejšího transportu (do 24 hodin, v chladu). Protože sekvence VH, proti které jsou namířeny sondy, je v mnoha případech silně hypermutovaná a potenciálně destruující místo pro hybridizaci sondy, lze s výhodou použít místo klasických TaqMan hybridizačních sond LNA-modifikované sondy (LNA = locked nucleic acid), které jsou krátké, mají vysokou Tm (teplota tání) a vynikající diskriminační schopnost (19). Kinetiku MRN sledovanou RT-Q-PCR (5) u dvou léčených pacientů zobrazuje obrázek 3.
3. Kinetika minimální reziduální nemoci sledované RT-Q-PCR (5) u pacienta s mutovanými (A) a nemutovanými (B) geny pro IgVH. 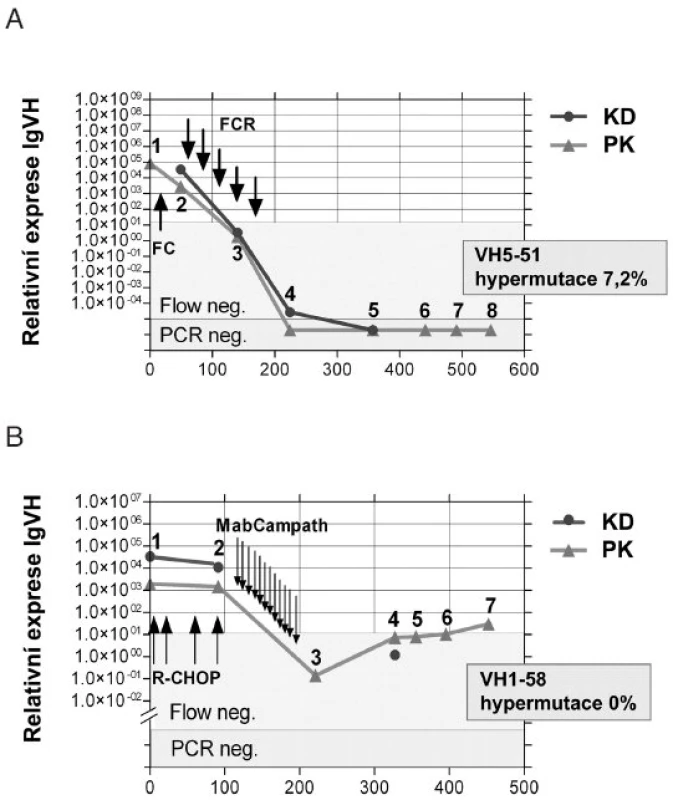
Klinický význam sledování MRN
Výsledky klinických studií
V rámci klinických studií stanovení MRN v poslední době stále častěji doplňuje hodnocení léčebné odpovědi podle kritérií NCI, a to jak ve studiích zahrnujících nemocné v 1. linii léčby (20-22), tak i pro CLL již léčené pacienty s progresí/relapsem onemocnění vyžadující další terapii (11, 13, 14).
Ve studii 69 pacientů s CLL (20), kteří v rámci první linie podstoupili léčbu režimem FCM (fludarabin, cyklofosfamid, mitoxantron – 6 cyklů i.v.) bylo u 26 % z nich dosaženo kompletní remise spojené s vymizením MRN na úrovni průtokové cytometrie. U těchto pacientů byla pozorována signifikantně delší odpověď na léčbu i celkové přežívání. V práci Keatinga et al. (21) vedla u 224 dříve neléčených pacientů kombinace fludarabinu, cyklofosfamidu a rituximabu (FCR) k dosažení CR u 70 % a vymizení MRN u dvou třetin pacientů. MRN byla v této studii sledována pouze dvoubarevnou průtokovou cytometrií s limitovanou senzitivitou. Výsledky prodlouženého sledování těchto pacientů (kdy byla MRN stanovena pomocí PCR s citlivostí 10-5) ukázaly, že u 41 % z celkem 192 pacientů, kteří dosáhli léčebné odpovědi došlo zároveň k vymizení MRN (22).
Prognostický význam vymizení MRN byl prokázán i u pacientů léčených pro relaps CLL (11, 13, 14). V práci Moretona et al. (13) byla MRN sledována čtyřbarevnou průtokovou cytometrií s citlivostí 10-5 u 91 pacientů, kteří byli léčeni alemtuzumabem i.v. (9 týdnů) pro relaps/refrakterní CLL. Vymizení MRN v periferní krvi i kostní dřeni bylo dosaženo u 18 (20 %) pacientů. Celkové přežívání (OS) i interval bez léčby byly významně delší u pacientů, kteří dosáhli MRN negativity (mediánu OS nebylo dosaženo) oproti těm, kteří na léčbu odpověděli MRN pozitivní CR (OS = 41 měsíců), PR (OS = 30 měsíců), nebo nereagovali vůbec (OS = 15 měsíců). Efekt imunochemoterapie FCR byl hodnocen u skupiny 177 již dříve pro CLL léčených pacientů (14). MRN byla stanovena pomocí pacient-specifické PCR (citlivost 10-5) u 75 pacientů, kteří na léčbu odpověděli, u 21 % z nich došlo k vymizení MRN. Medián času do progrese činil u MRN negativních pacientů 44 měsíců oproti 27 měsícům u MRN pozitivních.
MRN byla také sledována u pacientů léčených mono-klonálními protilátkami (alemtuzumabem nebo rituximabem) v rámci konsolidace po indukční chemoterapii (23–26) a u nemocných po autologní a alogenní transplantaci krvetvorných buněk (27–29).
V klinické studii O’Brien et al. (23) byla u 41 pacientů sledována léčebná odpověď na podání alemtuzumabu (i.v. po dobu 4 týdnů, při průkazu přetrvávající MRN navíc dalších 4 týdnů) v rámci konsolidace po první linii léčby. Byli zařazeni pouze pacienti, kteří na první linii léčby klinicky odpověděli. MRN byla monitorována PCR s citlivostí 10-6-10-5 u 29 osob, u 11 z nich (38 %) došlo k vymizení MRN. Při 24měsíčním sledování nebylo u MRN negativních osob dosaženo mediánu doby do progrese. U MRN pozitivních pacientů činil medián doby do progrese oproti tomu 15 měsíců. Podobných výsledků bylo dosaženo i v dalších studiích s alemtuzumabem v rámci konsolidace po léčbě fludarabinem v monoterapii, nebo v kombinaci s cyklofosfamidem (24, 26). Jako efektivní se ukázalo i podání rituximabu i.v. (4 týdny) v rámci konsolidace po 6 cyklech léčby fludarabinem i.v. u 60 dosud neléčených pacientů (25). Pomocí průtokové cytometrie (dokumentovaná citlivost 5 x 10-5) byla MRN sledovaná v kostní dřeni detekována u pouze 15 % takto léčených osob. Pacienti s prokazatelnou MRN vykazovali významně kratší interval do progrese a celkové přežívání v porovnání s MRN negativními (doba sledování činila 3 roky).
Alogenní transplantace hematopoetických kmenových buněk představuje v současné době jediný potenciálně kurativní přístup k léčbě CLL a jejím prostřednictvím lze dosáhnout dlouhodobého vymizení MRN dokonce u pacientů s nežádoucími prognostickými znaky (27–29). V práci Moreno et al. (29) byla MRN monitorována u 40 pacientů po transplantaci hematopoetických kmenových buněk pomocí konsensus PCR, čtyřbarevné průtokové cytometrie i RT-Q-PCR. Vysoce citlivá průtoková cytometrie a ASO-PCR se ukázaly jako vhodnější pro klinické užití v rámci predikce prognózy. Význam detekce MRN v časném období po transplantaci se při podání auto-, resp. alotransplantátu lišil. Průkaz MRN v období do 180 dnů po transplantaci předpovídal u autologního štěpu časný relaps, zatímco u alogenního bývá dosaženo setrvalého vymizení MRN až po uplynutí této doby (29).
Přestože bylo publikováno již více studií, ve kterých byla sledována MRN, do řady z nich bylo zařazeno jen velmi malé množství pacientů a jejich výsledky jsou vzájemně obtížně porovnatelné vzhledem k rozdílnému profilu zařazených pacientů (pacienti v 1. linii léčby vs. po relapsu/v progresi onemocnění) i kvůli použití odlišných metod stanovení MRN s různou citlivostí. Krátká doba sledování pacientů ve většině studií také nedovoluje vyvodit definitivní závěry ohledně schopnosti predikovat prognózu nemocných na základě přítomnosti/vymizení MRN. Podrobný přehled dosud publikovaných studií zahrnujících stanovení MRN podává nedávno publikovaný článek Nabhana et al. (31).
Význam pro běžnou praxi
Doporučený postup pro diagnostiku a terapii CLL prodělal v nedávné době revizi na základě projektu (2005 až 2007) Mezinárodní pracovní skupiny pro CLL (International Workshop on CLL, IWCLL) podporované NCI (32). Byla upravena kritéria léčebné odpovědi publikovaná v roce 1996 Chesonem et al. (33). Kritéria pro dosažení kompletní a parciální remise (CR, resp. PR) zůstávají v podstatě nezměněna, podrobněji byla definována maximální přípustná velikost lymfatických uzlin. Pro hodnocení odpovědi na léčbu zůstává standardem vyšetření klinické a základní laboratorní. Mimo klinické studie není bezpodmínečně nutné vyšetření zobrazovacími metodami, ani stanovení MRN. Podmínkou pro dosažení CR je i nadále přítomnost < 30 % lymfocytů v biopsii kostní dřeně (bez nálezu lymfoidních uzlíků). Tato hranice je relativně vysoká, u pacientů s CR může přetrvávat relativně vysoké procento leukemických buněk. V práci Rawstrona et al. byla u 25 ze 104 sledovaných pacientů, kteří po léčbě dosáhli CR dle NCI-WG kritérií pomocí čtyřbarevné průtokové cytometrie detekována MRN (12). Hallek et al. (32) doporučují zařadit sledování MRN do klinických studií, jejichž cílem je dosáhnout co nejhlubší a nejdéle trvající CR. Na základě dosud publikovaných studií naznačujících, že vymizení MRN po léčbě má silný pozitivní prognostický význam, je vhodné zvážit monitorování MRN (pokud je toto vyšetření dostupné) u všech pacientů léčených útočnými režimy (chemoimunoterapie, alotransplantace, konsolidace monoklonálními protilátkami apod.).
Vstupní vyšetření před zahájením terapie je nezbytné pro plánované sledování MRN pomocí RT-Q-PCR a vhodné pro sledování průtokovou cytometrií. Vzhledem k tomu, že data umožňující předpovědět další průběh CLL na základě schopnosti dosáhnout vymizení MRN nejsou dostatečná, je třeba podporovat vznik dalších klinických studií zahrnujících co nejčastější kvantitativní sledování MRN (k postižení dynamiky leukemického klonu). Pouze na základě intenzivního monitorování leukemického klonu lze usuzovat na možné riziko relapsu.
Ke sledování MRN postačuje ve většině případů periferní krev. Výjimku představují pacienti léčení alemtuzumabem, u kterých dochází v prvních měsících po léčbě k lymfopenii, a případné reziduální CLL buňky jsou detekovatelné pouze v kostní dřeni (12).
Jako nevýhoda sledování MRN bývá často zmiňována finanční náročnost týkající se zejména molekulárního vyšetření. Tuto nevýhodu mohou ale vyvážit benefity, které poskytuje ASO-PCR: i) prvním krokem ke konstrukci klon-specifické unikátní eseje je stanovení mutačního stavu IgVH jako jednoho z nejsilnějších prognostických parametrů u CLL; ii) molekulární monitoring pomocí genetických markerů není ovlivněn fenotypickými změnami CLL buněk, které mohou doprovázet léčbu, anebo být per se charakteristikou maligního klonu; iii) vyšetření pomocí RT-Q-PCR za použití RNA jako templátu a LNA detekčního systému předčí senzitivitou všechny ostatní metody, které jsou v současné době k dispozici pro monitoring MRN.
Vyšetření průtokovou cytometrií lze s výhodou zařadit do diagnostického panelu pro CLL a v indikovaných případech pak existuje předpoklad pro další monitorování MRN touto metodou. Oproti dříve využívané flow-cytometrické technice sledování MRN (dvou-, resp. tříbarevná analýza s využitím značení CD19, CD5, CD20, event. CD79b) nepřináší výše zmíněná vysoce citlivá čtyřbarevná technika výrazně větší finanční náklady. Představuje tedy univerzální metodu sledování MRN, kterou je možno relativně snadno zavést a standardizovat i na pracovištích bez možnosti využití molekulárních metod. U většiny pacientů s CLL senzitivita průtokové cytometrie plně dostačuje klinickým požadavkům.
Závěr
Vzhledem k zavádění stále efektivnějších léčebných protokolů CLL, může již v současnosti sledování MRN představovat výhodný nástroj ke stanovení úrovně/hloubky kompletní remise. Ačkoli se kvůli malému počtu dosud publikovaných klinických dat dle nových kritérií IWCLL doporučuje vyšetřovat MRN pouze v rámci klinických studií, ukazuje se, že vymizení MRN po léčbě má silný pozitivní vliv na prognózu nemocných. Ke komplexnímu zhodnocení tohoto významu a ověření, zda průkaz MRN při předchozí MRN negativitě signalizuje riziko relapsu (eventuálně v jakém časovém horizontu jej lze očekávat) je třeba podporovat výzkumné projekty zahrnující sledování MRN u agresivně léčených pacientů. Do budoucna by se mohlo sledování MRN u agresivně léčených pacientů stát přínosem i pro běžnou klinickou praxi.
Vysoce citlivou čtyřbarevnou průtokovou cytometrii lze doporučit jako standardní metodu sledování MRN; k podrobné a ještě citlivější analýze (zejména v rámci výzkumných projektů a u alogenně transplantovaných) je vhodné doplnit RT-Q-PCR.
MUDr. Ludmila Bezdíčková
Oddělení klinické hematologie FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
Došlo do redakce: 8. 4. 2008
Přijato: 27. 5. 2008
Sources
1. Damle RN, Wasil T, Fais F, et al. IgVN gene station status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94 : 1840–7.
2. Hamblin TJ, Davis Z, Gardiner A, et al. Unmutated IgV(H) genes are associated witha more aggressive formo f chronic lymphocytic leukemia. Blood 1999; 94 : 1848–54.
3. Döhner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343 : 1910–16.
4. Wiestner A, Rosenwald A, Barry TS, et al. ZAP-70 expression identifies a chronic lymphocytic leukemia subtype with unmutated imunoglobulin genes, inferior clinical outcome, and distinctive gene expression profile. Blood 2003; 101 : 4944–51.
5. Peková S, Bezdíčková L, Smolej L, et al. Quantitation of minimal residual disease in patients with chronic lymphocytic leukemia using locked nucleic acid-modified, fluorescently labeled hybridization probes and real-time PCR technology. Mol Diagn Ther 2007; 11(5): 325–35.
6. Gallagher RE, Yeap BY, Bi W, et al. Quantitative real-time RT-PCR analysis of PML-RAR alpha mRNA in acute promyelocytic leukemia: assessment of prognostic significance in adult patients from intergroup protocol 0129. Blood 2003; 101(7): 2521–8.
7. Diverio D, Rossi V, Avvisati G, et al. Early detection of relapse by prospective reverse transcriptase-polymerase chain reaction analysis of the PML/RARalpha fusion gene in patients with acute promyelocytic leukemia enrolled in the GIMEMA-AIEOP multicenter “AIDA” trial. GIMEMA-AIEOP Multicenter “AIDA” Trial. Blood 1998; 92(3): 784–9.
8. Coustan-Smith E, Sancho J, Hancock ML, et al. Clinical importance of minimal residual disease in childhood acute lymphoblastic leukemia. Blood 2000; 96(8): 2691–6.
9. Zhou J, Goldwasser MA, Li A, et al.-Farber Cancer Institute ALL Consortium. Quantitative analysis of minimal residual disease predicts relapse in children with B-lineage acute lymphoblastic leukemia in DFCI ALL Consortium Protocol 95–01. Blood. 2007; 110(5): 1607–11.
10. Hochhaus A, Reiter A, Saussele S, et al. Molecular heterogeneity in complete cytogenetic responders after interferon-alpha therapy for chronic myelogenous leukemia: low levels of minimal residual disease are associated with continuing remission. German CML Study Group and the UK MRC CML Study Group. Blood 2000; 95(1): 62–6.
11. Bosch F, Ferrer A, López-Guillermo A, et al.; For the GELCAB (Grup per l’Estudi dels Limfomes a Catalunya i Balears). Fludarabine, cyclophosphamide and mitoxantrone in the treatment of resistant or relapsed chronic lymphocytic leukaemia. Br J Haematol 2002;119(4): 976–84.
12. Rawstron AC, Kennedy B, Evans PA, et al. Quantitation of minimal disease levels in chronic lymphocytic leukemia using a sensitive flow cytometric assay improves the prediction of outcome and can be used to optimize therapy. Blood 2001; 98(1): 29–35.
13. Moreton P, Kennedy B, Lucas G, et al. Eradication of minimal residual disease in B-cell chronic lymphocytic leukemia after alemtuzumab therapy is associated with prolonged survival. J Clin Oncol 2005; 23(13): 2971–9.
14. Wierda W, O’Brien S, Wen S, et al. Chemoimmunotherapy with fludarabine, cyclophosphamide, and rituximab for relapsed and refractory chronic lymphocytic leukemia. J Clin Oncol 2005; 23(18): 4070–8.
15. National Cancer Institute. Cancer stat fact sheets: chronic lymphocytic leukemia. 2007;
http://seer.cancer.gov/statfacts/html/clyl.html.
16. Böttcher S, Ritgen M, Pott C, et al. Comparative analysis of minimal residual disease detection using four-color flow cytometry, consensus IgH-PCR, and quantitative IgH PCR in CLL after allogeneic and autologous stem cell transplantation. Leukemia 2004; 18(10): 1637–45.
17. Vuillier F, Claisse JF, Vandenvelde C, et al. Evaluation of residual disease in B-cell chronic lymphocytic leukemia patients in clinical and bone-marrow remission using CD5-CD19 markers and PCR study of gene rearrangements. Leuk Lymphoma 1992; 7(3): 195–204.
18. Rawstron AC, Villamor N, Ritgen M, et al. International standardized approach for flow cytometric residual disease monitoring in chronic lymphocytic leukaemia. Leukemia 2007; 21(5): 956–64.
19. Karkare S, Bhatnagar D. Promising nucleic acid analogs and mimics: characteristic features and applications of PNA, LNA, and morpholino. Appl Microbiol Biotechnol. 2006 Aug;71(5):575–86. Epub 2006 May 9. Review
20. Bosch F, Ferrer A, Villamor N, et al. Fludarabine, cyclophosphamide, and mitoxantrone as initial therapy of chronic lymphocytic leukemia: high response rate and disease eradication. Clin Cancer Res 2008; 14(1): 155–61.
21. Keating MJ, O’Brien S, Albitar M, et al. Early results of a chemoimmunotherapy regimen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005; 23(18): 4079–88.
22. Keating MJ, O’Brien S, Albitar M, Lerner S, Wierda W, Kantarjian H. Extended follow-up of chemo-immunotherapy regimen FCR (fludarabiune, F; cyclophosphamide C and rituximab R) as initial therapy for chronic lymphocytic leukemia (CLL). Blood 2005; 106 : 599a [abstrakt 2118].
23. O’Brien SM, Kantarjian HM, Thomas DA, et al. Alemtuzumab as treatment for residual disease after chemotherapy in patients with chronic lymphocytic leukemia. Cancer 2003; 98(12): 2657–63.
24. Wendtner CM, Ritgen M, Schweighofer CD, et al. German CLL Study Group (GCLLSG). Consolidation with alemtuzumab in patients with chronic lymphocytic leukemia (CLL) in first remission—experience on safety and efficacy within a randomized multicenter phase III trial of the German CLL Study Group (GCLLSG). Leukemia 2004; 18(6): 1093–101.
25. Del Poeta G, Del Principe MI, Consalvo MA, et al. The addition of rituximab to fludarabine improves clinical outcome in untreated patients with ZAP-70-negative chronic lymphocytic leukemia. Cancer 2005; 104(12): 2743–52.
26. Montillo M, Tedeschi A, Miqueleiz S, et al. Alemtuzumab as consolidation after a response to fludarabine is effective in purging residual disease in patients with chronic lymphocytic leukemia. J Clin Oncol 2006; 24(15): 2337–42.
27. Esteve J, Villamor N, Colomer D, et al. Stem cell transplantation for chronic lymphocytic leukemia: different outcome after autologous and allogeneic transplantation and correlation with minimal residual disease status. Leukemia 2001; 15(3): 445–51.
28. Ritgen M, Stilgenbauer S, von Neuhoff N, et al. Graft-versus-leukemia activity may overcome therapeutic resistance of chronic lymphocytic leukemia with unmutated immunoglobulin variable heavy-chain gene status: implications of minimal residual disease measurement with quantitative PCR. Blood 2004; 104(8): 2600–2.
29. Moreno C, Villamor N, Colomer D, et al. Clinical significance of minimal residual disease, as assessed by different techniques, after stem cell transplantation for chronic lymphocytic leukemia. Blood 2006; 107(11): 4563–9.
30. Del Poeta G, Del Principe MI, Buccisano F, et al. Consolidation and maintenance immunotherapy with rituximab improve clinical outcome in patients with B-cell chronic lymphocytic leukemia. Cancer 2008; 112(1): 119–28.
31. Nabhan C, Coutré S, Hillmen P. Minimal residual disease in chronic lymphocytic leukaemia: is it ready for primetime? Br J Haematol 2007; 136(3): 379–92.
32. Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia (IWCLL) updating the National Cancer Institute-Working Group (NCI-WG) 1996 guidelines. Blood 2008; [Epub ahead of print].
33. Cheson BD, Bennett JM, Grever M, et al. National Cancer Institute-sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood 1996; 87(12): 4990–7.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2008 Issue 3-
All articles in this issue
- Third consecutive national study ALL-BFM 95 improved the outcome of acute lymphoblastic leukemia in children in the Czech Republic
- The role of positron emission tomography and combined positron emission tomography with computed tomography in staging and response assessment in patients with non-Hodgkin’s lymphoma
- Revision of criteria for the diagnosis and evaluation of response to therapy in multiple myeloma
- Minimal residual disease in chronic lymphocytic leukemia: methods of assessment and clinical significance
- Burkitt’s lymphoma: pathophysiology, diagnostics and treatment
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Burkitt’s lymphoma: pathophysiology, diagnostics and treatment
- Third consecutive national study ALL-BFM 95 improved the outcome of acute lymphoblastic leukemia in children in the Czech Republic
- The role of positron emission tomography and combined positron emission tomography with computed tomography in staging and response assessment in patients with non-Hodgkin’s lymphoma
- Minimal residual disease in chronic lymphocytic leukemia: methods of assessment and clinical significance
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

