-
Medical journals
- Career
Indikace k operační léčbě popálenin při využití metody laserdoppler imaging
Authors: Jiří Štětinský 1; Hana Klosová 1; Zdenka Němečková Crkvenjaš 1; Hana Kolářová 2; Iveta Bryjová 3; Stanislav Hledík 4; Dana Šalounová 5
Authors‘ workplace: Popáleninové centrum, Fakultní nemocnice Ostrava, Česká republika 1; Ústav lékařské biofyziky, Lékařská fakulta University Palackého, Olomouc, Česká republika 2; Katedra kybernetiky a biomedicínského inženýrství, FEI, VŠB-TU, Ostrava, Česká republika 3; Ústav biofyziky, Slezská Universita v Opavě, Česká republika 4; Katedra matematických metod v ekonomice, FEI, VŠB-TU, Ostrava, Česká republika 5
Published in: Lékař a technika - Clinician and Technology No. 2, 2013, 43, 23-27
Category: Original research
Overview
Klinické hodnocení hloubky popálení je chybné až ve 35 % případů, zejména v časných fázích termického traumatu. Správné stanovení hloubky popálení je klíčové pro naplánování adekvátního terapeutického postupu, tj. konzervativní nebo chirurgické léčby popáleninových ran. Klinicky lze rozlišit 4 základní stupně hloubky popálení. Popálení I. st a popáleniny IIa, IIb lze léčit konzervativně. Popálení III. st a IV. st, ale také některá hlubší popálení IIb je nutné operovat. Popálení IIb působí nejvíce diagnostických obtíží a jeho indikace k operační léčbě je určena hloubkou postižení dermis, což koreluje s prokrvením škáry a také délkou hojení. Klinicky je velmi obtížné odhadnout hloubku postižení škáry. Jedna z možností, jak objektivně a neinvazivně zhodnotit hloubku popálení, je LDI (laserdoppler imaging).
LDI je zobrazovací metoda využívající laserového záření a Dopplerova jevu k detekci průtoku krve kožními kapilárami. Při termickém traumatu dochází k přímému poškození stěny zásobujících kapilár s následnou nekrotizací tkání. Specificita i senzitivita LDI při určení hloubky popálení se uvádí 95 % [1].
V naší práci jsme navrhli diagnostický algoritmus hodnocení kapilární perfúze naměřené LDI. Vyšetření lze provádět až do 9. poúrazového dne, s přihlédnutím k aktuálnímu dni po úrazu.
LDI je vhodná pomůcka pro indikaci operační léčby. Níže uvedené postupy by měly tento proces usnadnit.Klíčová slova:
Laser Doppler Imaging (LDI), kapilární perfúze, perfúzní jednotka (PU), poúrazový denÚvod
Při klinickém hodnocení hloubky popálení stanoví klinik nepřesnou diagnózu až ve 35-40 % případů [4], zejména v prvních pěti poúrazových dnech, ale také později. Nepřesnost v diagnostice vede k neadekvátní lokální léčbě. V případě nesprávné volby konzervativní terapie je důsledkem prolongované hojení, což zvyšuje riziko vzniku hypertrofických jizev, sekundárního rozpadu již zhojených ploch a prodlužení doby hospitalizace [16]. Na druhou stranu, zbytečná operace přináší potřebu dalších vyšetření, operační zátěž, riziko souvi-sející s celkovou anestezií, event. krevním převodem, s nezanedbatelnými ekonomickými dopady [7]. Pro dosažení dobrých estetických a funkčních výsledků a rychlejšího návratu k plnohodnotnému životu je nezbytné také správné časné naplánování operační léčby. [1, 6, 18].
Laserdoppler imager (LDI) je bezkontaktní skener, umožňující diagnostiku hloubky popálení založenou na vyšetření průchodnosti kapilár ve škáře. Přesnost LDI při diagnostice hloubky popálení se uvádí 95 % [2, 8]. LDI využívá dobře známého dopplerova jevu při analýze zpětně odražených paprsků. Velikost fázového posunu a počet těchto zpětně odražených paprsků koresponduje s rychlostí proudění a počtem krevních elementů [3]. Syntézu těchto dvou kvalit vyjadřuje počet tzv. perfúzních jednotek, perfusion units, PU, barevně kódovaných do dvourozměrné barevné mapy. LDI barevný scan obsahuje 6 základních barev, s možností rozdělení na 254 odstínů. Tato barevná škála kóduje předem zvolený rozsah perfúzních jednotek. V naší praxi pracujeme s rozsahem 480 perfúzních jednotek. Tmavě modrá barva representuje nejnižší perfúzi. Zde je zastoupena zdravá, zánětlivě nezměněná kůže, ale také popálení v celém rozsahu kůže, tj. III. stupeň (do 80 PU), korelace s klinickým nálezem je velmi důležitá. Nárůst perfúze koreluje s dalšími barvami v tomto pořadí: světle modrá, žlutá, oranžová a červená, která representuje nejvyšší perfúzi.
Cílem této práce bylo určit hraniční hodnotu rané perfúze, na základě které lze pacienty indikovat ke konzervativní, či operační léčbu. Konzervativně léčeny mohou být rány s dobou hojení do 3 týdnů (IIa a IIb. stupeň). Operační léčba je vhodná při prolognovaném spontánním hojení, nad 3 týdny (IIb. stupeň), nebo při neschopnosti spontánního zhojení (III. stupeň), z výše uvedených důvodů. V anglosaské literatuře je dále IIb. stupeň rozdělen na tzv. mid dermal burn a deep dermal burn, což lépe koreluje s našimi výsledky. Mnoho prací ověřilo prediktivní schopnost LDI při hodnocení hloubky popálení během prvních 5 poúrazových dnů. Výsledné klinické výstupy a podmínky vyšetření se navzájem liší [10, 15]. V naší práci jsme sledovali ranou perfúzi po termickém traumatu až do 9. poúra-zového dne.
Metoda
Pro zařazení pacientů do studie byla splněna tato kritéria: klinicky ne zcela zřejmá hloubka popálení, hospitalizace pacienta, spolupráce při vyšetření, podepsaný informovaný souhlas, adekvátní ošetření rány před přijetím do nemocnice, normotermie před vyšetřením LDI a histologické vyšetření vzorků excidované tkáně v případě operace. Vylučujícími kritérii byly naopak jakékoliv makroskopické známky rané infekce, kožní onemocnění, febrilie, nespolupráce pacienta při vyšetření, kortikoidní terapie.
Pacienti
Celkem bylo laserdopplerometricky vyšetřeno 117 ran u 86 pacientů s termickým poraněním. Mezi vyšetřenými bylo 56 mužů, 19 žen a 11 dětí. Průměrný věk celé skupiny pacientů byl 41,5 let (2-88), průměrný věk mužů 45,5 let, žen 48,4 roky, dětí 9,1 rok. Mezi mechanismy úrazu dominovalo popálení plamenem: 49 pacientů, následované opařením: 32 pacientů, 5 pacien-tů utrpělo popálení kontaktem s horkým předmětem. Průměrný rozsah popálení činil 8 % tělesného povrchu (0,5-45 %). 53 ran bylo vyšetřeno opakovaně v různých poúrazových dnech od 1. do 9. dne, s celkovým počtem 221 vyšetření. Den úrazu jsme považovali za den 0. 9denní poúrazové období jsme rozdělili na 4 intervaly, dle zjištěného průběhu rané perfúze v tomto období. 47 ran bylo vyšetřeno do 2. poúrazového dne, 86 ran mezi 3. a 5. dnem, 47 ran bylo vyšetřeno 6. a 7. den a 30 ran bylo vyšetřeno 8. a 9. poúrazový den.
Rány byly vyšetřeny LDI skenerem co nejčasněji po přijetí do nemocnice, ne však v den úrazu, z důvodu bolestivosti a psychického traumatu spojeného s termickým poraněním. Dva popáleninoví chirurgové se zkušeností při hodnocení LDI skenů prováděli vyšetření. Další chirurg s dlouholetou praxí v oboru indikoval terapeutický postup, bez znalosti výsledků perfúzního skenu, pouze na základě klinického vyšetření. V případě konzervativní terapie byl stav hojení klinicky hodnocen 14. poúrazový den (u zhoje-ných pacientů hodnoceno jako IIa st.) a 21. poúrazový den (u zhojených pacientů hodnoceno jako IIb st.), včetně pořízení fotodokumentace.
Pacienti byli rozděleni na základě stavu epitelizace 21. den do 2 skupin: 1. zhojeni (IIa, IIb. stupeň - mid dermal burn) či 2. nezhojeni ( IIb stupeň - deep dermal, III. stupeň). Do skupiny nezhojených patří také pacienti operovaní, s histologickým nálezem popálení III. stup-ně.
Laserdopplerovské zobrazování
Pro vyšetření rané perfúze byl použit Laserdoppler imager PIM III (Perimed AB company) s integrovaným fotoaparátem. LDI PIM III využívá diodového laseru o vlnové délce 640 nm, výkonu 1 mW, průměru laserového paprsku 1 mm. Hloubka penetrace laserového paprsku je 0,5-1 mm, dle optických vlastností tkáně. PIM III umožnuje skenování oblasti o velikosti až 2500 cm2, se vzdáleností jednotlivých bodů 1-3 mm, dle vzdálenosti Hlavice skeneru. Během vyšetření byla poloha hlavice téměř kolmo na vyšetřovanou oblast. Menší úhel má vliv na úbytek intenzity signálu [12]. Vzdálenost mezi hlavicí skeneru a ranou se pohybovala v rozmezí 15-20 cm. Vzhledem k výkonu laseru není potřeba speciálních ochranných pomůcek. Nekontaktní skenování také eliminuje riziko kontaminace rány.
Vyšetření bylo provedeno vždy během převazu, po řádném očištění rány od zbytků lokálních antibakteriálních prostředků, v místnosti s konstantní teplotou 22 st. C a relativní vlhkostí 30-50 %, běžného denního světla. Délka vyšetření byla průměrně 2 minuty (1-3 min), během které pacient setrval v klidu.
Hodnota perfúze rány je obrazem průměrné hodnoty prokrvení všech měřených bodů, jak je automaticky vygeneroval ovládací software LDPwin 3, po označení oblasti zájmu s průměrným počtem 400 měřených bodů. Z oblasti zájmu bylo exkludováno tzv. zánětlivé hallo, které je patrné na hranici popálené a intaktní kůže.
Statistická analýza
Data byla analyzována pomocí softwaru IBM SPSS, verze 18. Pro všechny analýzy byla stanovena hladina významnosti p=0.05. Pro ověření diference mezi oběma skupinami, zhojeni a nezhojeni, byla vytvořena nová proměnná, tzv. krevní perfúze.
Výsledky
V 1. skupině pacientů, zhojených do 3 týdnů, bylo 77 ran, z toho 21 se zhojilo během 2 týdnů a 56 ran ve 3. týdnu po úrazu. Ve 2. skupině se 40 ranami, se 13 zhojilo po 21. dnu, průměrně za 28,2 dny (23-34), 27 ran bylo léčeno invazivně, chirurgicky, kdy výsle-dek histologie prokázal popálení III. stupně.
Statisticky významný rozdíl rané perfúze mezi oběma skupinami popálenin je patrný ve 3 sledovaných obdobích (p<0.0005), 3.–5. den, 6.–7. den, 8.–9. den. Použit byl medián test, viz tab. 1 a obr. 1.
Table 1. Kapilární raná perfúze, vyjádřena množstvím perfúzních jednotek (PU), analýza ve 3 obdobích, Blood perfusion 1 (3.–5. den), Blood perfuison 2 (6.–7. den), Blood perfusion 3 (8.–9. poúrazový den). 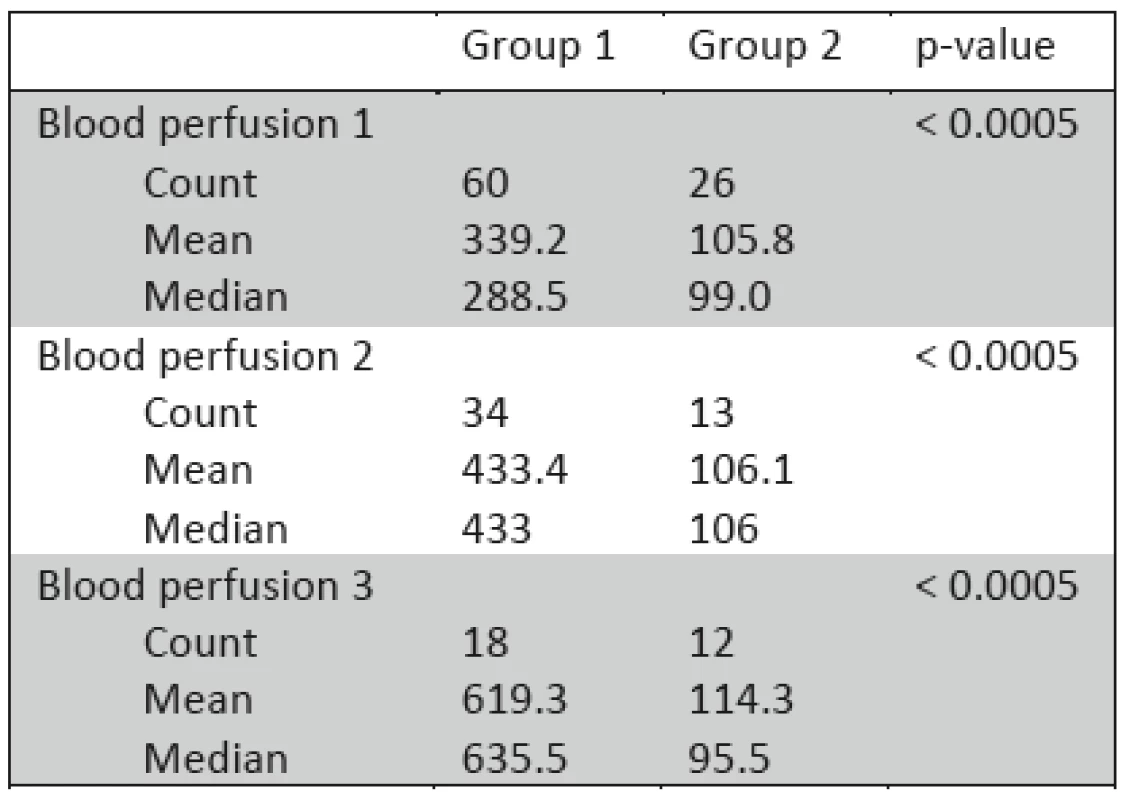
Image 1. Box plot krevní perfúze 3 období: 3.–5., 6.–7., 8.– 9. den u skupiny zhojených (levý sloupec) a nezhojených či operovaných (pravý sloupec). 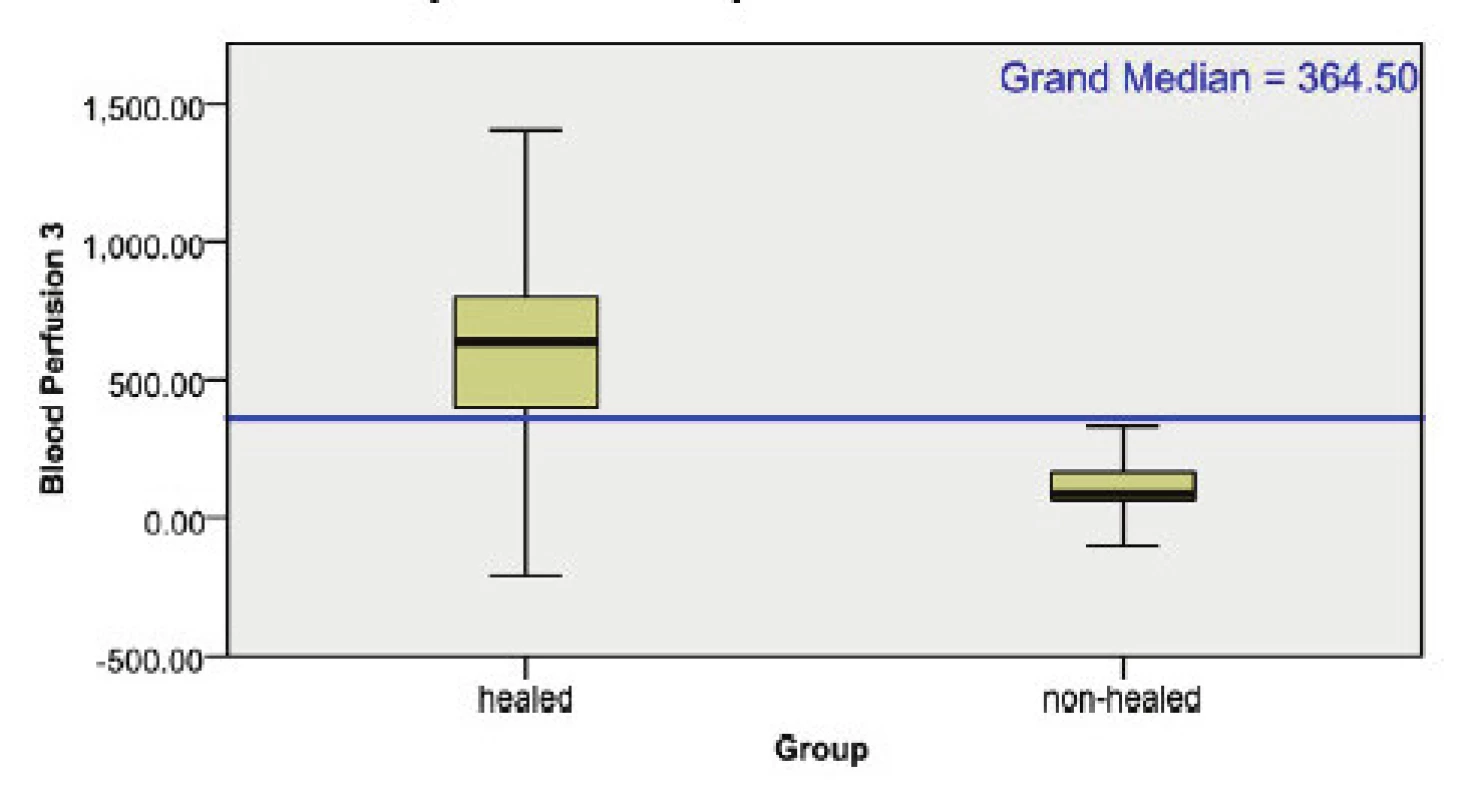
Pacienti v 1. skupině vykazovali signifikantní nárůst prokrvení v období mezi 6.–7. dnem a mezi 8.–9. dnem, ve srovnání s obdobím mezi 3.-5. dnem (p = 0.018 a p < 0.0005, použit Friedmanův a párový test). Hladinu perfúze, indikující provedení operační léčby, jsme odečetli z ROC křivky (viz. Tab. 2, Obr. 2).
Table 2. ROC analýza (Area-plocha pod křivkou; p-value - signifikance pro nulovou hypotézu: Area = 0.5; Cutoff Val-hodnota perfúze, uváděná v perfúzních jednotkách indikující provedení operace; Posit. N-počet pozitivních indikací, Negat. N-počet negativních indikací; Sens %- sensitivita (%); Spec %- specificita (%). 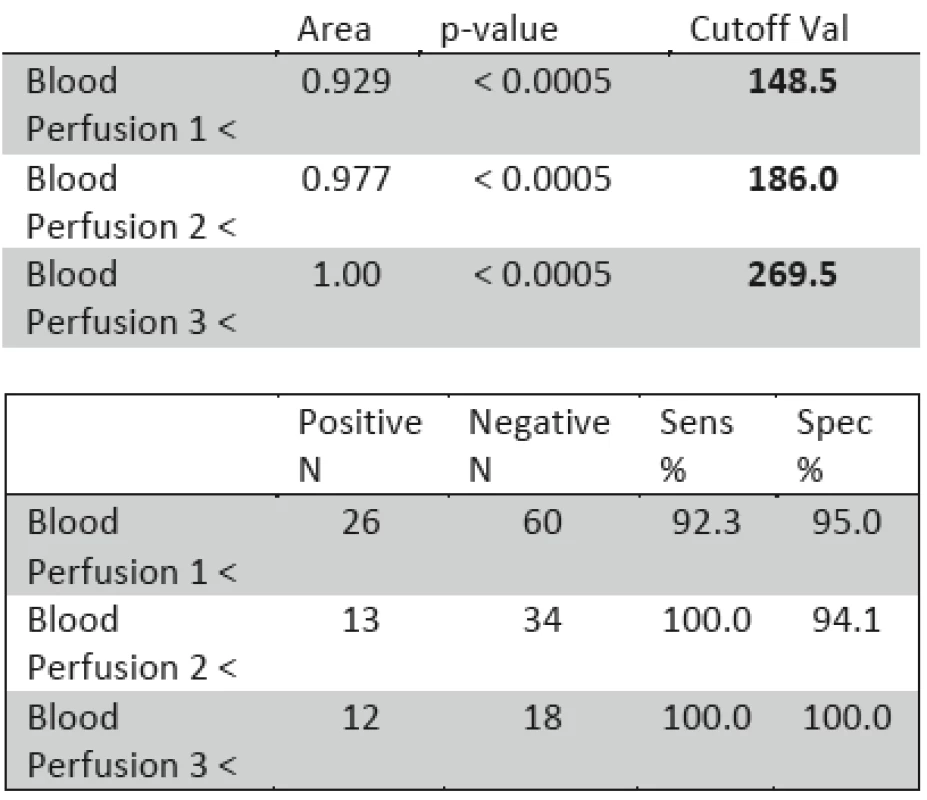
Image 2. ROC křivka krevní perfúze indikující operaci v období mezi 3. a 5. poúrazovým dnem. 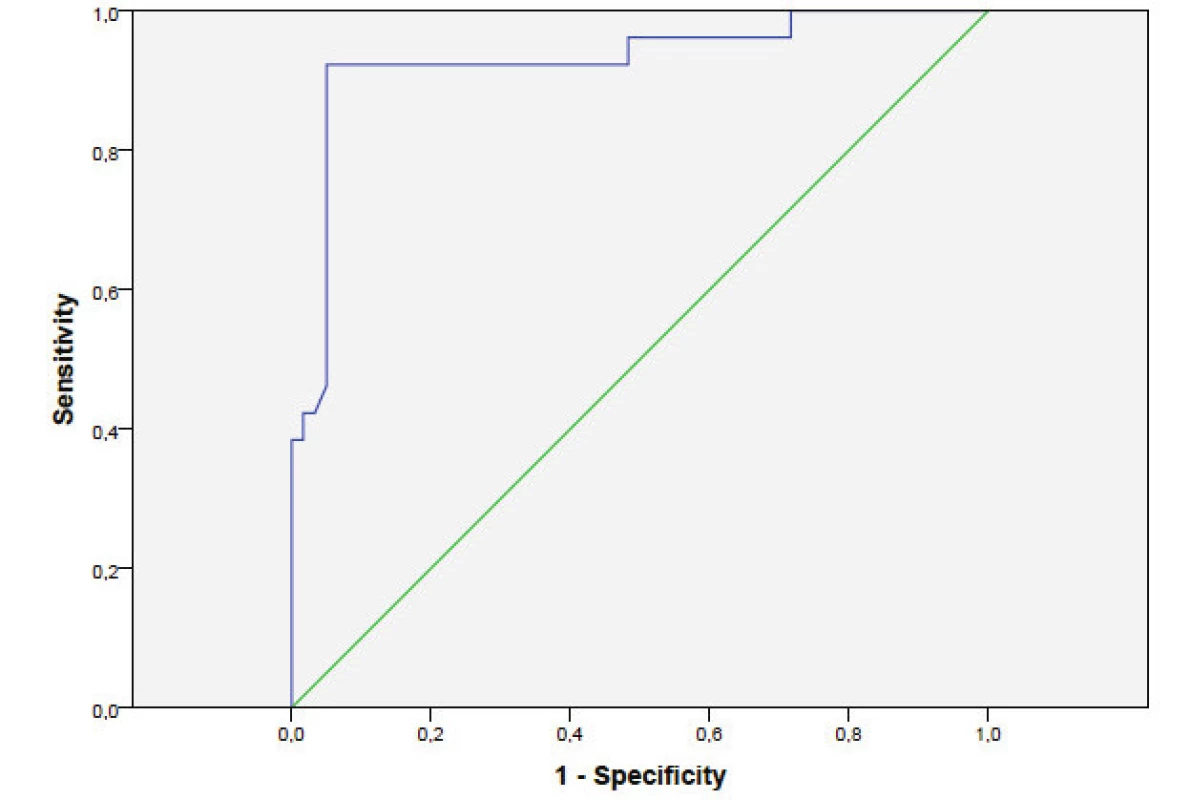
Hraniční perfúze indikující chirurgickou resp. konzervativní léčbu byla stanovena na 148.5 PU (perfúzních jednotek) v intervalu 3.–5. poúrazový den. Hraniční perfúze, indikující způsob léčby 6.–7. poúrazový den, byla stanovena na 186 PU. Perfúze indikující invazivní či konzervativní léčebný postup 8.–9. den byla stanovena na 269.5 PU. V období do 2. poúrazového dne nebyl statisticky signifikantní rozdíl mezi ranou perfúzí ve skupině obou skupin pacientů zhojených či nezhojených do 3 týdnů.
Diskuse
V naší práci jsme ověřili schopnost LDI objektivně hodnotit hloubku popálení související úzce s délkou hojení a prokrvením rány, a to během období prvních 9. poúrazových dnů.
Perfúze měřená do 2. poúrazového dne může nesprávně indikovat operační léčbu. V tomto období jsou perfúze ve skupině zhojených i nezhojených podobné. Nízkou perfúzi vykazovaly jak popáleniny III. st., tak některé povrchní popáleniny, pokud byl mechanismem úrazu ožeh plamenem, nebo bezprostředně po sejmutí bull. Tuto skutečnost si vysvětlujeme reflexním vazospasmem. V následujícím období, od 3. do 9. poúrazového dne, lze při indikaci operační či konzervativní léčby přihlížet k výše stanoveným hodnotám, tzv. cut off values.
Nárůst perfúze ve skupině zhojených kontrastuje se stagnací ve 2. skupině, tj. nezhojených. Tento fakt napomáhá při predikci průběhu hojení.
Nárůst perfúze ve skupině zhojených je odrazem rozvoje zánětlivé fáze hojení s dilatací kapilárních plexů. Na druhé straně, ve skupině nezhojených, jsou kapilární plexy ve škáře poškozeny, takže vazodilatace, která má zajistiti přísun živin během hojení, není možná. Během prvních 48 hodin po úrazu nastává komprese kapilární sítě díky lokálnímu edému, což může také falešné imitovat poškození kapilár. Proto bychom v tomto období měli zohlednit pouze perfúze vyšší než 148,5 PU, což je stanovená hraniční perfúze pro následující interval, mezi 3. a 5. dnem. V naší práci se shodujeme s výsledky Clopebergovy studie [19], kde u termických poranění zhojených do 3 týdnů je nárůst prokrvení patrný až do 10. poúrazovém dni.
Nárůst perfúze v prvních 48 hodinách, ukazující na možnou nepřesnost měření v tomto období, byl popsán v pracích několika autorů [5,11,13,21]. Tuto skutečnost jsme pozorovali také při našich měřeních. Na druhé straně jsou autoři, kteří prokázali přesnost LDI při skenování také v tomto intervalu [9]. Podobné determinující prokrvení uvádí ve své práci Jeng [8], který prováděl měření do 5. poúrazového dne.
Na základě určených hodnot perfúze můžeme hodnotit hloubku popálení v různých dnech až do 9. poúrazového dne. Přestože je vhodné provést měření a naplánovat léčebný postup co nejdříve, optimálně do 5. dne, některé okolnosti vyžadují objektivní zhodno-cení prokrvení rány také později. Důvodem může být opožděné přijetí pacienta, nebo nepřítomnost lékaře s praxí při hodnocení LDI.
Naše klinická zkušenost ukazuje, že diagnostická nejistota při hodnocení hloubky popálení se objevuje nejen do 5. dne, ale také v následujících dnech poúrazového období. Z výsledků rovněž vyplývá, že je výhodné provést měření ve dvou různých poúrazových dnech, trend vývoje perfúze je také významným prediktorem průběhu hojení. V období 6.–7. dne a 8.–9. poúrazový den bylo vyšetřeno méně pacientů, než v období mezi 3.-5. dnem. Tato skutečnost je dána operací části pacientů v pozdějším období, či propuštěním do ambulantní péče.
Závěr
Navrhujeme následující algoritmus při stanovení způsobu léčby na základě LDI měření. Pokud je hodnota rané perfúze ve kterémkoliv období vyšší něž stanovená pro jednotlivé období, postačí jednotlivé měření pro indikaci ke konzervativní léčbě. V případě nižší perfúze opakujeme měření během následujícího převazu, abychom eliminovali chybnou indikaci k operaci. Vzestupný trend vývoje perfúze je důležitou charakteristikou ran se schopností spontánního zhojení do 3 týdnů. V případě opakované nízké perfúze můžeme připravovat pacienta k operaci.
Poděkování
Práce byla podpořena výzkumným grantem FNO-99-OVZ-09-024-Do a projektem CZ.1.05/1.1.00/02.0070.
Popáleninové centrum
Fakultní nemocnice Ostrava
17. listopadu 1790, CZ-708 52 Ostrava
E-mail: jiri.stetinsky@cetrum.cz
tel.: +420 721 490 779
Sources
[1] Scott, John R., Stuart, B. 7 Surgical management of burns. Baillire's Clinical Anaesthesiology, 1997, vol. 11, no. 3, p. 473-495.
[2] Hemington-Gorse, S.J. A comparison of laser Doppler imaging with other measurement techniques to assess burn depth. Journal of wound care, 2005, vol.14, no. 4, p. 151-153.
[3] Watkins, D., Holloway Ga. An instrument to measure cutaneous blood flow using the Doppler shift of laser light. IEEE transactions on biomedical engineering. Bio-medical Engineering Group, 1978, vol. 25, p. 28-33.
[4] Watt, A.M.I., Tyler, M.P.H. Burn depth and its histological measurement. Burns, 2001, vol.27, no. 2.
[5] Atiles, L., Mileski, W. Early assesment of pediatric burn wounds by laser Doppler flowmetry. J Burn Care Rehabil, 1995, vol.16, no. 16, p.596-601.
[6] Cubison, Tania, C.S. Evidence for the link between healing time and the development of hypertrophic scars (HTS) in paediatric burns due to scald injury. Burns. 2006, vol.32, no.8, p.992-999.
[7] Klein, Matthew,B. Hospital Costs Associated With Pediatric Burn Injury. Journal of Burn Care,2008,vol.29,no.4,p.632-637.
[8] Jeng, J.C., Bridgeman, A. Laser Doppler imaging determines need for excision and grafting in advance of clinical judgment: a prospective blinded trial, Burns, 2003, vol.29, no.7, p.665-670.
[9] Mill, J., Cuttle L. Laser Doppler imaging in a paediatric burns population. Burns, 2009, vol.35, no.6, p.824-831.
[10] La Hei, E.R., Holland A.J.. Laser Doppler Imaging of paediatric burns: Burn wound outcome can be predicted independent of clinical examination. Burns. 2006, vol.32, no.5, p.550-553.
[11] Holland, A.J., Martin H.C. Laser Doppler imaging prediction of burn wound outcome in children. Burns, 2002, vol.28, no.1, p.11-17.
[12] Droog, E.J, Steenbergen W. Measurement of depth of burns by laser Doppler perfusion imaging. Burns, 2002, vol.28, no.1, p.561-568.
[13] Niazi, ZBM., Essex, TJH. New laser Doppler scanner, a valuable adjunct in burn depth assessment. Burns, 1993, vol. 19, p. 485-9.
[14] Riordan, Colin L.Noncontact Laser Doppler Imaging in Burn Depth Analysis of the Extremities. Journal of Burn Care, 2003, vol.24, no.4, p.177-186.
[15] Cho, J.K., Moon D.J. Relationship between healing time and mean perfusion units of laser Doppler imaging (LDI) in pediatric burns. Burns, 2009, vol.35, no.6, p.818-823.
[16] Lawrence, H.C., Ward, D.The Impact of Laser Doppler Imaging on Time to Grafting Decisions in Pediatric Burns. Journal of Burn Care, 2010, vol.31, no.2, p.328-332.
[17] Brown, RFR., Rice, P. RICE. The use of laser Doppler imaging as an aid in clinical management decision making in the treatment of vesicant burns. Burns, 1998, vol.24, no.8, p.692-698.
[18] Sjoberg, F., Danielsson, P. Utility of an intervention scoring system in documenting effects of changes in burn treatment. Burns, 2000, vol.26, no.6, p.553-9.
[19] Kloppenberg W.H., Beerthuizen, G.I.J.M. Perfusion of burn wounds assessed by Laser Doppler Imaging is related to burn depth and healing time. Burns, 2001, vol. 27, p. 359–363.
[20] Monstrey, S.M., Hoeksema, H. Reprint of: Burn wound healing time assessed by laser Doppler imaging. Part 2. Burns, 2012, vol.38, no.2, p.195-202.
[21] Hoeksema, H., Van De Skipe, K. Accuracy of early burn depth assessment by laser Doppler imaging on different days post burn. Burns, 2009, vol. 1, no.35, p. 36-45.
Labels
Biomedicine
Article was published inThe Clinician and Technology Journal

2013 Issue 2-
All articles in this issue
- WEARABLE ARTIFICIAL KIDNEY – EVOLUTION OF ITS CONCEPTS AND CURRENT STATE-OF-THE-ART
- On mixed statistical moments of texture in ultrasound B-mode images
- Artefakty spôsobené pacientom pri zobrazovaní magnetickou rezonanciou
- Indikace k operační léčbě popálenin při využití metody laserdoppler imaging
- Aj všeobecní lekári si budú môcť aktualizovať profesné kompetencie pomocou medicínskych simulátorov (výhody a úskalia)
- Hodnocení revaskularizace dolních končetin pomocí termografických měření a metodika
- The Clinician and Technology Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Artefakty spôsobené pacientom pri zobrazovaní magnetickou rezonanciou
- Hodnocení revaskularizace dolních končetin pomocí termografických měření a metodika
- Indikace k operační léčbě popálenin při využití metody laserdoppler imaging
- WEARABLE ARTIFICIAL KIDNEY – EVOLUTION OF ITS CONCEPTS AND CURRENT STATE-OF-THE-ART
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



