-
Medical journals
- Career
Detekce mírné kognitivní poruchy během lokomoce po cévní mozkové příhodě
Authors: Hereitová I. 1,2; Krobot A. 1,3
Authors‘ workplace: Neurologická klinika, Lékařská fakulta, Univerzita Palackého a Fakultní nemocnice Olomouc 1; Fakulta zdravotnických studií, Západočeská univerzita v Plzni 2; Oddělení rehabilitace, Fakultní nemocnice Olomouc 3
Published in: Rehabil. fyz. Lék., 28, 2021, No. 4, pp. 172-176.
Category: Review Article
doi: https://doi.org/10.48095/ccrhfl2021172Overview
Mírná kognitivní porucha s sebou nese vysoké riziko vzniku demence. Existuje stále více důkazů, že kognitivní pokles má za následek zhoršení lokomočních parametrů. Ačkoli jsou obvykle spojeny s pozdějšími stadii demence, pokles výkonnosti chůze může být detekován mnohem dříve. Možným směrem v odhalení mírné kognitivní poruchy u osob po cévní mozkové příhodě je sledování lokomočních parametrů za podmínek dvojího úkolu.
Klíčová slova:
cévní mozková příhoda – mírná kognitivní porucha – chůze – dvojí úkol
Úvod
Díky prevenci, efektivní péči na iktových jednotkách a včasné reperfuzní terapii se v posledních letech výrazně snížily následky cévní mozkové příhody (CMP). Přesto jsou však kognitivní poruchy po CMP běžnou záležitostí nezávisle na věku a velikosti léze [1,2].
Mnoho pacientů s minimálním nebo žádným zjevným neurologickým deficitem po CMP může mít kognitivní a psychické obtíže, které jsou často jinak klinicky němé. U části pacientů pokles kognitivních funkcí přetrvává a vede ke vzniku mírné kognitivní poruchy nebo demence [3]. Počet kognitivních a psychických poruch zjištěných po CMP se však liší v důsledku heterogenity kognitivních nástrojů, použitých diagnostických kritérií a demografických faktorů, jako je úroveň vzdělání, vaskulární rizikové faktory a komorbidita [4].
Osoby s minimálním neurologickým deficitem po CMP jsou často propuštěny krátce po přijetí s pozorováním, že „vše se zdá být v pořádku“. Po ukončení hospitalizace si však mohou uvědomit, že se změnila kvalita jejich života a funkční samostatnost. Mohou čelit skrytým poruchám, které zahrnují dysfunkci exekutivních funkcí, zhoršení paměti, poruchy řeči, sníženou psychomotorickou rychlost a únavu. Mohou se také objevit psychické poruchy jako je patologický smích a pláč, úzkost, deprese a apatie [5–7].
Skryté poruchy nemusí být vždy odhaleny neurologickým vyšetřením nebo nástroji kognitivního a psychologického screeningu používanými v klinické praxi [8,9]. Už jen klasifikace kognitivních funkcí není jednoduchá, jelikož jednotlivé domény jsou na sobě závislé. Například zapamatování seznamu slov a jeho následná reprodukce nezávisí jen na paměti, ale také na pozornosti a jazykových schopnostech [10].
Možným směrem v odhalení mírné kognitivní poruchy u osob po CMP s minimálním neurologickým deficitem může být sledování lokomočních parametrů za podmínek dvojího úkolu (dual tasking). Exekutivní funkce jsou s chůzí a její kvalitou úzce provázány. Vykonání náročného komplexního lokomotorického úkolu vyžaduje integritu a funkčnost jednotlivých nervových struktur, které podléhají exekutivně kontrolním procesům [11].
Paradigma testování pomocí dvojího úkolu
Paradigma testování pomocí dvojího úkolu, tj. chůze za současného plnění kognitivního úkolu, se nyní běžně používají ke zkoumání asociací mezi chůzí a kognitivními funkcemi. Dvojí úkol lze chápat jako model odolnosti vůči kognitivnímu stresu a posouzení účinků rozdělené pozornosti [12,13]. Podmínky dvojího úkolu tak umožňují potvrdit přítomnost mírného kognitivního deficitu pomocí odhalení změn v časoprostorových parametrech chůze, které mohou jinak zůstat nezjištěny. Tyto změny se za podmínek dvojího úkolu označují jako kognitivně-motorická interference a indikují přítomnost mírného kognitivního deficitu, který je spojen se zvýšeným rizikem pádu [14,15].
Pacienti po CMP se řadí mezi rizikovou skupinu projevu – tzv. motor-cognitive risk syndromu – spojeného s větší mírou rušivých faktorů interference během duální zátěže. Mírný kognitivní deficit se po CMP projevuje neefektivním provedením pohybu doprovázeným nadbytečným úsilím či nedostatečnou motivací. Během lokomoce se mírná kognitivní porucha projevuje změnou prioritizace posturální kontroly, zpomalením rytmu a rychlosti chůze, snížením délky kroku, kadence a prodloužením fáze dvojí opory [16].
Vzory kognitivně-motorické interference po cévní mozkové příhodě
Plummer et al. [17] popsali devět potenciálních vzorů interference lokomočního chování během duální situace, které se objevují u pacientů po CMP (tab. 1). Vzhledem k tomu, že ke zhoršení časoprostorových parametrů chůze může dojít jako zjevný kompromis zdrojů pozornosti nebo jako nedostatečný zdroj pozornosti pro kombinované úkoly, je nutné hodnotit parametry chůze samostatně a pak následné v kombinaci s kognitivní zátěží [18]. Vzor interference pravděpodobně závisí na několika faktorech, vč. typů kognitivního úkolu, úrovně obtížnosti a pokynech týkající se toho, které úkoly mají být upřednostněny. Pro validní testování se obecně doporučuje kombinovat více modalit kognitivního úkolu [19,20]. V tab. 2. poukazujeme na možnost testovacího protokolu během duální zátěže.
Table 1. Vzory kognitivně-motorické interference po cévní mozkové příhodě (upraveno dle Plummer et al. [17]).
Tab. 1. Patterns of cognitive-motor interference after stroke (adapted according to Plummer et al. [17]).![Vzory kognitivně-motorické interference po cévní mozkové příhodě
(upraveno dle Plummer et al. [17]).<br>
Tab. 1. Patterns of cognitive-motor interference after stroke (adapted according to
Plummer et al. [17]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c46fe1089a6a24cc336f4d34211170c5.jpg)
Table 2. Testovací protokol během duální zátěže.
Tab. 2. Test protocol during dual load.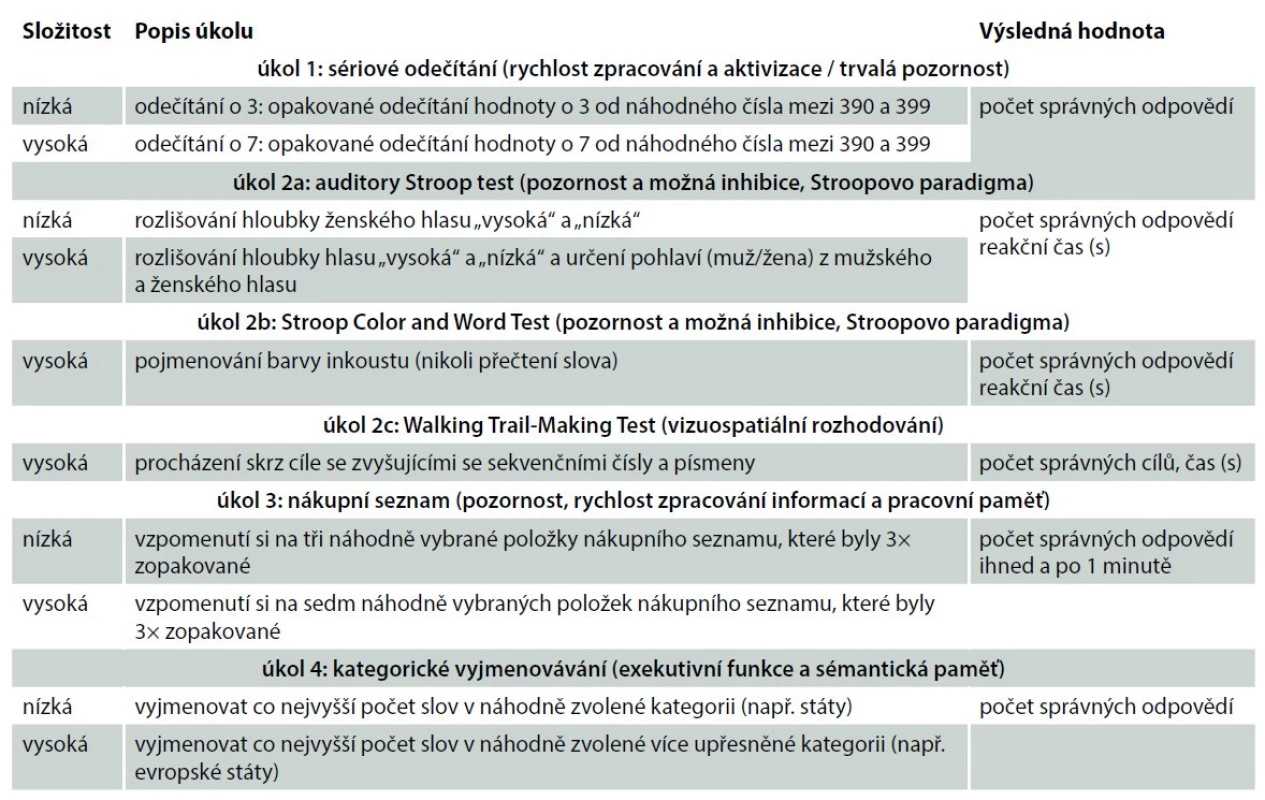
Díky představení motor-cognitive risk syndromu poukazujícího na projev prodromálního stadia mírné kognitivní poruchy během lokomoce po CMP byla zdůrazněna potřeba přesných konceptů pro identifikaci modifikovatelných rizikových faktorů [21]. V následující části popisujeme možné screeningové hodnocení chůze za podmínek dvojího úkolu pro detekci mírné kognitivní poruchy po CMP, které je snadno proveditelné i hodnotitelné, je pacienty dobře tolerováno a je vhodné pro různá prostředí. Je prokázáno, že chůze za podmínek dvojího úkolu je citlivější na kognitivní pokles než měření výkonnosti chůze samotné [22,23]. Pokud se během testování vyskytnou abnormální výsledky, mělo by být zváženo doporučení k hloubkovému neuropsychologickému posouzení [14].
Test Stops Walking When Talking
Lundin-Olsson et al. [24] zahájili současnou výzkumnou oblast kognitivně-motorické interference s cílem hodnotit souvislost mezi chůzí a kognitivními funkcemi. Popsali, že někteří geriatričtí pacienti se během chůze zastavili, aby odpověděli na jednoduchou otázku. Jejich práce ukázala, že 80 % z těch, kteří nebyli schopni provést dvojí úkol (současně chodit a mluvit), alespoň jednou v následujících 6 měsících zaznamenali pád. Potvrdili tak, že mírná kognitivní porucha hraje významnou roli během rizika pádů. Nejsnažší způsob, jak jej aplikovat, je položit pacientovi jednoduchou otázku, když je doprovázen do vyšetřovací místnosti.
Timed Up and Go Cognitive Test
Test Timed Up and Go (TUG) je jednoduchý a široce používaný klinický test pro hodnocení funkce dolních končetin, rovnováhy, pohyblivosti a rizika pádu v různých populacích. Ke zvýšení přesnosti lze do tradičního testu TUG přidat kognitivní úkoly (TUG test – Cognitive) dle jednotlivých kognitivních domén a úrovně složitosti [25].
Již Lundin-Olsson et al. [26] ukázali, že TUG test – Cognitive byl citlivější verzí v predikci rizika pádů u starších lidí. Studie dle Çekok et al. [27] prokázala nižší výkonnostní úrovně TUG test – Cognitive ve srovnání s tradičním TUG testem ve spojitosti s poruchou kognitivních funkcí. Zároveň potvrdili silnou senzitivitu testu v predikci neuropsychologických komplikací. TUG test – Cognitive statisticky významně koreluje s diagnostickou charakteristikou Montrealského kognitivního testu [19,20].
Imagine Timed Up and Go Test
Imagine Timed Up and Go Test (TUGi) byl přestaven jako nový nástroj k prozkoumání nejvyšší úrovně kontroly chůze za pomoci pohybové imaginace. Jedná se o mentální simulaci TUG testu bez skutečného provedení. V praxi se uskutečňuje tak, že po vykonání TUG testu zůstávají pacienti sedět a jsou poučeni, aby si představili jeho samotné provedení. Hodnotí se časová shoda mezi provedeným testem a testem v představě, tj. mentální chronometrie [28]. Beauchet et al. [29] potvrdili, že kognitivní pokles souvisí s časovým rozdílem mezi časy dokončení TUG testu a TUGi testu. Prodloužené delta časy mezi testy TUG a TUGi mohou pomoci při včasné diagnostice prodromálního stadia mírné kognitivní poruchy a souvisí se snížením rychlosti chůze, zvýšenou variabilitou chůze a zvýšeným rizikem pádů [21].
Trail-Walking-Test
Alexander et al. [30], Yamada et al. [31] a Schott et al. [32] přeměnili standardní neuropsychologický test (Trail-Making Test) na kognitivně-motorickou variantu Trail-Walking Test (TWT) pro predikci pádů u starších jedinců. Studie dle Klotzbier et al. [33] prokázala, že TWT je proveditelný, spolehlivý a platný nástroj k rozlišení porozumět vztahu mezi kognitivními funkcemi a lokomocí u lidí s mírnou kognitivní poruchou a zároveň jej vyhodnocuje jako potenciální detekční nástroj pro mírnou kognitivní poruchu. TWT se provádí tak, že kužely s vlajkami jsou umístěny náhodně na každé z 15 pozic v oblasti 16 m2 (4 × 4 m). Kolem každého kužele je nakreslen kruh o průměru 30 cm. Účastníci jsou instruováni, aby sledovali nastavenou cestu (TWT-1; obr. 1a), stoupali na cíle se zvyšujícími se sekvenčními čísly (tj. 1-2-3; TWT-2; obr. 1b) a zvyšovali sekvenční čísla a písmena (tj. 1-A-2-B-3-C; TWT-3; obr. 1c). Účastníci byli instruováni, aby přešli od jedné vlajky ke druhé ve vzestupném pořadí co nejrychleji, ale co nejpřesněji.
Image 1. Modifikace Trail walking testu dle Schott et al. [32].
Fig. 1. Trail walking test modification according to Schott et al. [32].![Modifikace Trail walking testu dle Schott et al. [32].<br>
Fig. 1. Trail walking test modification according to Schott et al. [32].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b1076efd938025c3e59726bc96ffac32.jpg)
Kvantitativní analýza chůze
Pokud jedno z těchto hodnocení poskytuje abnormální výsledky, lze k identifikaci možných kognitivních deficitů použít kvantitativní analýzu chůze. Pro objektivní měření chůze jsou využívány optoelektronické systémy, tenzometrické plošiny, bezdrátové systémy senzorů integrované do obuvi, akcelerometry, systémy snímání úhlové rychlosti a chodicí pásy se zabudovanou silovou a tlakovou plošinou. Který systém je nejlepší, závisí na řešených výzkumných a/nebo klinických otázkách [14].
V posledních letech bylo jako prediktory mírného kognitivního deficitu představeno několik časoprostorových parametrů chůze. Variabilita kroku (stride variability) je v současné době považována za jeden z parametrů, které jsou nejcitlivější na detekci mírné kognitivní poruchy. Představuje rozdíl v čase nebo délce od jednoho kroku k druhému. O variabilitě kroku lze uvažovat jako o ukazateli automatiky chůze, přičemž nízká variabilita představuje rytmickou a stabilní chůzi [14,34]. V retrospektivní studii [21] uvedli, že zvýšená variabilita chůze předpovídá budoucí riziko vzniku mírné kognitivní poruchy a demence.
Závěr
Paradigma dvojího úkolu za pomoci analýzy chůze je slibný nástroj k diagnostice nejranějších stadií kognitivních poruch. Vzhledem k tomu, že existuje prokazatelná asociace mezi kognitivními funkcemi a časoprostorovými parametry chůze, mělo by být využití kognitivně-motorické interference součástí citlivějšího screeningového hodnocení detekce mírné kognitivní poruchy po CMP. Včasná detekce umožňuje včasnou implementaci cílených intervencí ke zlepšení chůze a/nebo k udržení kognitivních funkcí.
Doručeno/Submitted: 1. 8. 2021
Přijato/Accepted: 27. 10. 2021
Korespondenční autor:
Mgr. Iva Hereitová
Fakulta zdravotnických studií,
Západočeská univerzita v Plzni,
Husova 664/11,
301 00 Plzeň
e-mail: ivlckova@kfe.zcu.cz
Sources
- Langhorne P, Ramachandra S, Stroke Unit Trialists’ Collaboration. Organised inpatient (stroke unit) care for stroke: network meta-analysis. Cochrane Database Syst Rev 2020; 4(4): CD000197. doi: 10.1002/14651858.CD000197.pub4.
- Ihle-Hansen H, Thommessen B, Fagerland MW et al. Impact of white matter lesions on cognition in stroke patients free from pre-stroke cognitive impairment: a one-year follow-up study. Dement Geriatr Cogn Dis Extra 2012; 2(1): 38–47. doi: 10.1159/000336817.
- Tadic M, Cuspidi C, Hering D. Hypertension and cognitive dysfunction in elderly: blood pressure management for this global burden. BMC Cardiovasc Disord 2016; 16(1): 208. doi: 10.1186/s12872-016-0386-0.
- Makin SDJ, Turpin S, Dennis MS et al. Cognitive impairment after lacunar stroke: systematic review and meta-analysis of incidence, prevalence and comparison with other stroke subtypes. J Neurol Neurosurg Psychiatry 2013; 84(8): 893–900. doi: 10.1136/jnnp-2012-303645.
- Campbell Burton CA, Murray J, Holmes J et al. Frequency of anxiety after stroke: a systematic review and meta-analysis of observational studies. Int J Stroke 2013; 8(7): 545–559. doi: 10.1111/j.1747-4949.2012.00906.x.
- Douven E, Köhler S, Schievink SHJ et al. Temporal associations between fatigue, depression, and apathy after stroke: results of the cognition and affect after stroke – a prospective evaluation of risks study. Cerebrovasc Dis 2017; 44(5–6): 330–337. doi: 10.1159/000481577.
- Belghali M, Chastan N, Davenne D et al. Improving dual-task walking paradigms to detect prodromal Parkinson’s and Alzheimer’s diseases. Front Neurol 2017; 8 : 207. doi: 10.3389/fneur.2017.00207.
- Jaillard A, Naegele B, Trabucco-Miguel S et al. Hidden dysfunctioning in subacute stroke. Stroke 2009; 40(7): 2473–2479. doi: 10.1161/STROKEAHA.108.541144.
- Hu MTM, Szewczyk-Królikowski K, Tomlinson P et al. Predictors of cognitive impairment in an early stage Parkinson’s disease cohort. Mov Disord 2014; 29(3): 351–359. doi: 10.1002/mds.25748.
- Cumming TB, Marshall RS, Lazar RM. Stroke, cognitive deficits, and rehabilitation: still an incomplete picture. Int J Stroke 2012; 8(1): 38–45. doi: 10.1111/j.1747-4949.2012.00972.x.
- Yogev-Seligmann G, Hausdorff JM, Giladi N. The role of executive function and attention in gait. Mov Disord 2008; 23(3): 329–342. doi: 10.1002/mds.21720.
- Bridenbaugh SA, Kressig RW. Laboratory review: the role of gait analysis in seniors’ mobility and fall prevention. Gerontology 2011; 57(3): 256–264. doi: 10.1159/000322194.
- Theill N, Martin M, Schumacher V et al. Simultaneously measuring gait and cognitive performance in cognitively healthy and cognitively impaired older adults: the Basel motor-cognition dual-task paradigm. J Am Geriatr Soc 2011; 59(6): 1012–1018. doi: 10.1111/j.1532-5415.2011.03429.x.
- Bridenbaugh SA, Kressig RW. Quantitative gait disturbances in older adults with cognitive impairments. Curr Pharm Des 2014; 20(19): 3165–3172. doi: 10.2174/13816128113196660688.
- Veldkamp R, Romberg A, Hämäläinen P et al. Test-retest reliability of cognitive-motor interference assessments in walking with various task complexities in persons with multiple sclerosis. Neurorehabil Neural Repair 2019; 33(8): 623–634. doi: 10.1177/1545968319856897.
- Wang XQ, Pi YL, Chen BL et al. Cognitive motor interference for gait and balance in stroke: a systematic review and meta-analysis. Eur J Neurol 2015; 22(3): 555–e37. doi: 10.1111/ene.12616.
- Plummer P, Eskes G, Wallace S et al. Cognitive-motor interference during functional mobility after stroke: state of the science and implications for future research. Arch Phys Med Rehabil 2013; 94(12): 2565–2574. doi: 10.1016/j.apmr.2013.08.002.
- Pashler H. Dual-task interference in simple tasks: data and theory. Psychol Bull 1994; 116(2): 220–244. doi: 10.1037/0033-2909.116.2.220.
- Tombu M, Jolicoeur P. Testing the predictions of the central capacity sharing model. J Exp Psychol Hum Percept Perform 2005; 31(4): 790–802. doi: 10.1037/0096-1523.31.4.790.
- Lehle C, Hübner R. Strategic capacity sharing between two tasks: evidence from tasks with the same and with different task sets. Psychol Res 2009; 73(5): 707–726. doi: 10.1007/s00426-008-0162-6.
- Verghese J, Annweiler C, Ayers E et al. Motoric cognitive risk syndrome: multicountry prevalence and dementia risk. Neurology 2014; 83(8): 718–726. doi: 10.1212/WNL.0000000000000717.
- MacAulay RK, Wagner MT, Szeles D et al. Improving sensitivity to detect mild cognitive impairment: cognitive load dual-task gait speed assessment. J Int Neuropsychol Soc 2017; 23(6): 493–501. doi: 10.1017/S1355617717000261.
- Muir SW, Speechley M, Wells J et al. Gait assessment in mild cognitive impairment and Alzheimer’s disease: the effect of dual-task challenges across the cognitive spectrum. Gait Posture 2012; 35(1): 96–100. doi: 10.1016/j.gaitpost.2011.08.014.
- Lundin-Olsson L, Nyberg L, Gustafson Y. “Stops walking when talking” as a predictor of falls in elderly people. Lancet 1997; 349(9052): 617. doi: 10.1016/S0140-6736(97)24009-2.
- Chen TY, Peronto CL, Edwards JD. Cognitive function as a prospective predictor of falls. J Gerontol B Psychol Sci Soc Sci 2012; 67(6): 720–728. doi: 10.1093/geronb/gbs052.
- Lundin-Olsson L, Nyberg L, Gustafson Y. Attention, frailty, and falls: the effect of a manual task on basic mobility. J Am Geriatr Soc 1998; 46(6): 758–761. doi: 10.1111/j.1532-5415.1998.tb03813.x.
- Çekok K, Kahraman T, Duran G et al. Timed Up and Go test with a Cognitive task: correlations with neuropsychological measures in people with Parkinson’s disease. Cureus 2020; 12(9): e10604. doi: 10.7759/cureus.10604.
- Bridenbaugh SA, Beauchet O, Annweiler C et al. Association between dual task-related decrease in walking speed and real versus imagined Timed Up and Go test performance. Aging Clin Exp Res 2013; 25(3): 283–289. doi: 10.1007/s40520-013-0046-5.
- Beauchet O, Launay CP, Sejdić E et al. Motor imagery of gait: a new way to detect mild cognitive impairment? J Neuroeng Rehabil 2014; 11 : 66. doi: 10.1186/1743-0003-11-66.
- Alexander NB, Ashton-Miller JA, Giordani B et al. Age differences in timed accurate stepping with increasing cognitive and visual demand: a walking trail making test. J Gerontol A Biol Sci Med Sci 2005; 60(12): 1558–1562. doi: 10.1093/gerona/60.12.1558.
- Yamada M, Ichihashi N. Predicting the probability of falls in community-dwelling elderly individuals using the trail-walking test. Environ Health Prev Med 2010; 15(6): 386–391. doi: 10.1007/s12199-010-0154-1.
- Schott N, El-Rajab I, Klotzbier T. Cognitive-motor interference during fine and gross motor tasks in children with Developmental Coordination Disorder (DCD). Res Dev Disabil 2016; 57 : 136–148. doi: 10.1016/j.ridd.2016.07.003.
- Klotzbier TJ, Schott N. Cognitive-motor interference during walking in older adults with probable mild cognitive impairment. Front Aging Neurosci 2017; 9 : 350. doi: 10.3389/fnagi.2017.00350.
- Verghese J, Wang C, Lipton RB et al. Quantitative gait dysfunction and risk of cognitive decline and dementia. J Neurol Neurosurg Psychiatry 2007; 78(9): 929–935. doi: 10.1136/jnnp.2006.106914.
Labels
Physiotherapist, university degree Rehabilitation Sports medicine
Article was published inRehabilitation & Physical Medicine

2021 Issue 4-
All articles in this issue
- Rehabilitace chůze u pacientů s Parkinsonovou nemocí – cueingová terapie
- Efekt dynamickej neuromuskulárnej stabilizácie u pacientov po artroskopii plecového kĺbu
- Ovlivnění rozsahu pohybu v kloubu s využitím terapie spoušťových bodů – literární rešerše
- Detekce mírné kognitivní poruchy během lokomoce po cévní mozkové příhodě
- Inerciálne senzory a ich využitie v klinickej praxi
- Aktualizace českého překladu Mezinárodní klasifikace funkčních schopností, disability a zdraví
- K 100. výročí narození doc. MUDr. Františka Véleho, CSc. (1921–2016)
- Rehabilitation & Physical Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rehabilitace chůze u pacientů s Parkinsonovou nemocí – cueingová terapie
- Efekt dynamickej neuromuskulárnej stabilizácie u pacientov po artroskopii plecového kĺbu
- Ovlivnění rozsahu pohybu v kloubu s využitím terapie spoušťových bodů – literární rešerše
- Aktualizace českého překladu Mezinárodní klasifikace funkčních schopností, disability a zdraví
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

