-
Medical journals
- Career
Metody screeningu nejčastějších morfologických a chromozomálních vrozených vývojových vad plodu
: Veronika Frisová
: Porodnicko-gynekologická klinika LF UP a FN Olomouc ; Profema – centrum fetální medicíny s. r. o., Praha
: Prakt Gyn 2015; 19(2): 116-122
: Fetomaternal Medicine: Review Article
Vrozené vývojové vady postihují dle údajů WHO přibližně 3 % novorozenců a jsou každoročně příčinou úmrtí přibližně 270 000 novorozenců na světě.
Dle aktuálního doporučení ČGPS pro péči o fyziologické těhotenství by každé těhotné ženě měl být v 1. trimestru nabídnut screening nejčastějších morfologických a chromozomálních vrozených vývojových vad plodu a poskytnuta informace o metodách screeningu, poskytovatelích i formě úhrady. Preferován by měl být kombinovaný screening v 1. trimestru těhotenství, zatím však není hrazen z prostředků veřejného zdravotního pojištění. Cílem článku je poskytnout lékařům přehlednou informaci o současných možnostech screeningu vrozených vývojových vad plodu, která jim může usnadnit vysvětlení a doporučení screeningových testů těhotné ženě.Klíčová slova:
genetické syndromy – chromozomální vady – metody – morfologické vady – screening – vrozené vývojové vadyÚvod
Vrozené vývojové vady postihují dle údajů WHO přibližně 3 % novorozenců a jsou každoročně příčinou úmrtí přibližně 270 000 novorozenců na světě. Díky rozvoji prenatální diagnostiky je možno screeningovými programy v těhotenství zachytit až 99 % chromozomálních a okolo 90 % vrozených morfologických vad.
Dle aktuálního doporučení České gynekologické a porodnické společnosti pro Zásady dispenzární péče ve fyziologickém těhotenství by měl být každé těhotné ženě v 1. trimestru nabídnut screening nejčastějších morfologických a chromozomálních vrozených vývojových vad plodu a poskytnuta informace o metodách screeningu, poskytovatelích i formě úhrady. Preferován by měl být kombinovaný screening v 1. trimestru těhotenství, ten však zatím není hrazen z prostředků veřejného zdravotního pojištění [1].
Každé těhotné ženě by mělo být vysvětleno následující:
- Jaké existují vrozené vady plodu
- Co je to screening vrozených vad
- Jaký je význam screeningu vrozených vad
- Jaké jsou metody screeningu chromozomálních vad a čím se liší
- Jaké jsou metody screeningu vrozených morfologických vad plodu
Informace by měly být podány jasným a snadno srozumitelným způsobem, protože těhotná žena by se podle nich měla svobodně rozhodnout, jaká vyšetření si přeje absolvovat.
Tento přehledový článek obsahuje všechny potřebné údaje pro vysvětlení významu a možností screeningu vrozených vývojových vad plodu těhotné ženě, a může proto být praktickou pomůckou při konzultaci těhotné ženy v 1. trimestru těhotenství.
Typy vrozených vad plodu
Existují 3 hlavní typy vrozených vývojových vad plodu a sice vady chromozomální, morfologické (strukturální) a genetické syndromy.
Chromozomální vady reprezentují poruchy počtu a struktury chromozómů. Při absenci prenatálního screeningu by těmito vadami bylo postiženo přibližně 0,6 % novorozenců[2]. K nejčastějším typům chromozomálních vad patří trizomie 21, 18, 13, triploidie a Turnerův syndrom [3]. Incidence většiny chromozomálních vad narůstá s věkem matky a klesá s gestačním stářím plodu [4].
Morfologické (strukturální) vady jsou vadami orgánů a systémů plodu a vyskytují se přibližně u 2 % novorozenců [5]. Incidence tohoto typu vrozených vad záleží také na věku matky, nejvyšší je u těhotných žen mladších 20 let (2,6 %) a nejnižší u žen ve věku mezi 30 a 35 lety (2,15 %)[6].
Genetické syndromy jsou způsobeny poruchou na úrovni malých částí chromozomů, respektive jejich alel. Jsou zpravidla spojeny se stigmatizací jedince a často i s mentální retardací. Jedná se o vzácná onemocnění, jejich souhrnná incidence se dle EUROCAT studie pohybuje okolo 0,08 % [5].
Co je to screening vrozených vad
Screening je testování určité, předem definované, části populace se snahou vyhledat onemocnění v jeho časných „skrytých“ stadiích před jeho klinickou manifestací [6]. Podmínkou zavedení screeningu určitého onemocnění je, že dané onemocnění je závažné, není vzácné, existuje pro něj diagnostická metoda a lze mu zabránit či jej léčit. Daný test musí vždy zahrnovat celou předem definovanou část populace, při screeningu vrozených vad plodu to znamená vyšetření všech těhotných žen. Test musí být bezpečný, specifický (vysoká senzitivita a nízká falešná pozitivita) a ne příliš drahý (jeho cena je mnohem nižší než náklady na léčbu při manifestaci onemocnění) [7].
Těhotná žena by tedy měla vědět, že
- screeningový test se týká všech těhotných žen
- test je bezpečný
- neznamená diagnózu, tzn. 100% jistotu o výskytu onemocnění, pouze znamená zvýšené riziko jeho výskytu
- test může být falešně pozitivní, tzn. abnormální výsledek u jinak zdravého těhotenství
- při pozitivním výsledku je vhodné zpřesnit diagnostiku přidáním dalšího, diagnostického testu. Teprve diagnostický test rozhodne, zda je onemocnění přítomno, či ne. Nevýhodou diagnostického testu však je, že není tak bezpečný a levný jako screeningový test. Proto se diagnostické testy neprovádějí u všech těhotných žen.
Význam screeningu vrozených vad plodu
Screening umožní vyhledat těhotenství se zvýšeným rizikem výskytu vrozených vad plodu. U těchto těhotenství je těhotné ženě doporučen diagnostický test, který umožní vyloučení, či potvrzení výskytu onemocnění u plodu.
Při potvrzení vrozené vady plodu bude těhotná žena seznámena s možnostmi léčby a prognózou. Na základě těchto informací se rozhodne u ukončení těhotenství, či jeho pokračování. U řady vrozených vad je prognóza těhotenství dobrá a postačí sledování či léčba dítěte po propuštění z porodnice. Někdy je však k zajištění dobré prognózy vhodné vést porod ve specializovaném centru s možností zahájení léčby novorozence časně po porodu (především u vad srdce a vad s okluzí dýchacích cest – brániční kýla apod) nebo provést léčbu plodu ještě v těhotenství (léčba „in utero“ např. při anémii plodu, u jednovaječných dvojčat při feto-fetální transfúzi, při brániční kýle apod).
Metody screeningu chromozomálních vad
Všechny metody screeningu chromozomálních vad vycházejí z věku těhotné ženy a ze stáří plodu, které určují tzv. populační riziko postižení plodu vrozenou chromozomální vadou. Toto riziko lze dále upřesnit připojením rodinné anamnézy, krevních testů a ultrasonografického (USG) vyšetření. Při zvýšeném riziku chromozomální vady plodu (zpravidla riziko okolo 1 : 300 = 0,3 %) je těhotné ženě doporučeno podstoupit diagnostický test, kterým je invazivním výkonem s cytogenetickou analýzou získaného vzorku placenty, plodové vody nebo pupečníkové krve. Teprve tento test určí, zda plod je, či není postižen. Nevýhodou invazivních metod prenatální diagnostiky je 0,5–1% zvýšení rizika potratu [8], a proto se tyto testy neprovádějí u všech těhotných žen.
V současnosti existuje mnoho metod screeningu chromozomálních vad. Ne všechny jsou však všude dostupné a rozdílná je i jejich lokální kvalita. Obecně se screeningové testy chromozomálních vad liší především cenou, efektivitou a dobou provádění screeningu.
Starší tradiční metody screeningu chromozomálních vad a metody obsahující pouze krevní testy mohou být hrazeny z prostředků veřejného zdravotnictví, a těhotná žena je proto může podstoupit zdarma.
Patří k nim:
- určení populačního rizika chromozomálních vad dle věku matky a stáří plodu
- upřesnění populačního rizika dle rodinné anamnézy
- biochemický screening ve 2. trimestru (triple test)
- biochemický screening v 1. trimestru
- sérum-integrovaný test
- genetická ultrasonografie (včetně fetální echokardiologie)
K testům hrazeným pacientkou patří:
- ultrasonografické (USG) vyšetření nuchální translucence, šíjového projasnění (NT)
- základní kombinovaný test (NT-koncentrace PAPP-A a free-beta-HCG)
- rozšířený USG-multimarkerový kombinovaný test
- integrovaný test
- upřesnění populačního rizika chromozomálních vad prostřednictvím neinvazivního prenatálního testu (cell-free-DNA testy: Panorama, Harmony, MaterniT21, MaterniT21 Plus, Prenascan atd)
Výše uvedené testy se liší nejen tím, zda je těhotná žena musí, či nemusí hradit, ale především efektivitou a dobou provádění. Platí, že testy hrazené pacientkou jsou přesnější (vyšší efektivita) a provádějí se dříve. (tab. 1) [2,4,9–14]. Výhodou časného provádění screeningového testu je možnost časného ukončení těhotenství při zjištění postižení plodu chromozomální vadou. Potrat plodu prováděný v 1. trimestru je spojen s nižším rizikem úmrtí těhotné ženy pro zdravotní komplikace [14], a navíc je pro ni i psychicky méně náročný.
1. Přehled efektivity screeningových testů chromozomálních vad [2,4, 9-14] ![Přehled efektivity screeningových testů chromozomálních vad [2,4, 9-14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4fc7b38fb7423df30988e2fd8880eba4.png)
Downův syndrom
Neinvazivní prenatální cell-free-DNA-testy
Nejefektivnější metodou screeningu Downova syndromu jsou v současné době neinvazivní prenatální cell-free-DNA-testy. Přestože laboratoře v ČR tyto testy neprovádějí, je možné je absolvovat. Některá specializovaná česká centra totiž spolupracují se zahraničními laboratořemi a krevní vzorky matky jim zasílají kurýrem k analýze. Tyto testy jsou nejefektivnější metodou screeningu Downova syndromu a poruch pohlavních chromozómů, přesné jsou i na vyšetření postižení plodu trizomií 18 a 13 a triploidií [12,13,16,17]. Lze je provádět již od 9. týdne těhotenství [12]. Jejich nevýhodou je vysoká cena (14 000–29 500 Kč) a delší doba čekání na výsledek (10–14 dní). Nutné je mít na paměti, že tyto testy odhalí pouze nejčastější typy chromozomálních vad [12,17]. Neumožní detekci všech chromozomálních ani strukturálních vad plodu. Jsou proto vhodné především u těhotných žen s normálním výsledkem USG-vyšetření, které si přejí maximálně přesné určení rizika postižení plodu Downovým syndromem (v podstatě jeho vyloučení) a preferují vyhnout se provedení invazivního výkonu [13,18]. Ideální metodou volby jsou u žen s hraničním nebo pozitivním výsledkem základního screeningu chromozomálních vad vzhledem k abnormálnímu výsledku biochemického testu nebo vyššímu věku matky. Nikdy by neměly nahrazovat USG-vyšetření plodu [13]. Podmínkou relevantního výsledku cell-free-DNA-testu je získání dostatečného množství DNA plodu z krve matky, tzv. fetální frakce, které musí být minimálně 4% [17,19]. Vyjádření množství získané fetální frakce na výsledku testu garantuje přesnost testu, při nízké fetální frakci může být popsán normální ženský karyotyp plodu i v krvi netěhotné ženy [19]. Množství fetální frakce závisí především na body mass indexu (BMI) těhotné ženy a gestačním stáří plodu. Při vyšším BMI je při nízkém gestačním stáří plodu zvýšeno riziko selhání analýzy pro nízkou fetální frakci [12,17], vhodné je proto plánovat odběr krve nejdříve v období okolo 14. týdne.
Prvotrimestrální screening kombinovaným testem
Prvotrimestrální screening Downova syndromu kombinovaným testem je celosvětově nejvíce rozšířenou metodou screeningu. Při správně provedeném USG-vyšetření sonografistou certifikovaným FMF (Fetal-Medicine-Foundation-London) s kalkulací rizika Downova syndromu v FMF rizikovém modulu se při 5% falešné pozitivitě (false positive rate – FPR) senzitivita kombinovaného testu pohybuje v rozmezí 90–98 % [3,9]. Výši senzitivity určuje počet vyšetřených USG - markerů Downova syndromu, za zvýšené riziko je považováno při 5% FPR riziko 1 : 300 (0,33 %). Při základním kombinovaném testu se populační riziko upřesňuje pouze dle výsledků biochemického testu (koncentrace PAPP-A a free-beta-HCG) a dle velikosti NT (obr. 1). Při rozšířeném USG-multimarkerovém kombinovaném testu se populační riziko upřesňuje podle výsledků biochemie (PAPP-A, free-beta-HCG), hodnoty NT, a navíc dle výskytu nosní kůstky, trikuspidální regurgitace a výše indexu pulzatility (PI) v ductus venosus (obr. 2). Význam FMF-certifikace spočívá ve zpětné kontrole kvality (povinný každoroční audit a obnova licence a certifikátu), a navíc v získání licence ke kalkulaci rizika v FMF rizikovém modulu. Pod výpočtem rizika chromozomálních vad je ve zprávě z FMF modulu vždy uvedeno, jaké markery byly využity k upřesnění populačního rizika (obr. 3). Pokud není riziko kalkulováno v FMF modulu, je populační riziko upřesněno zpravidla pouze podle výsledku biochemie a velikosti NT, a navíc výše senzitivity a falešné pozitivity se může od FMF údajů lišit.
1. Ultrasonografické vyšetření nuchální translucence dle FMF protokolu (normální nález) 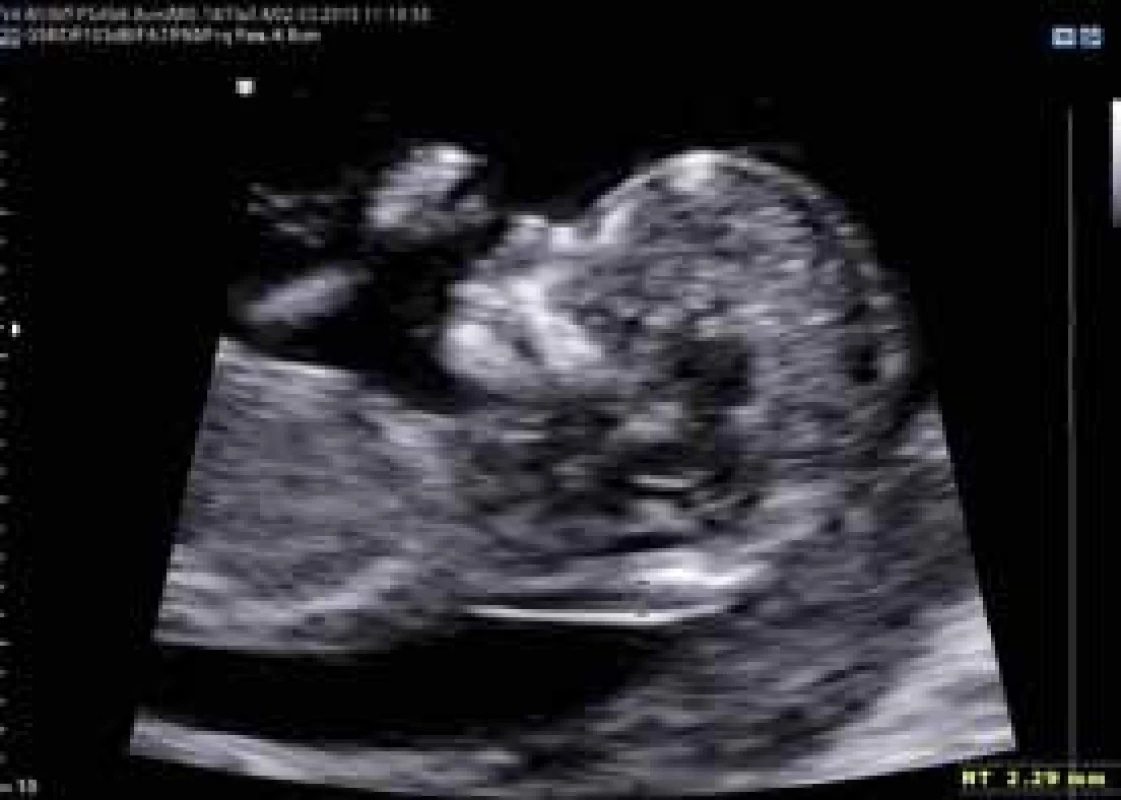
2. Ultrazvukové vyšetření novějších prvotrimestrálních markerů Downova syndromu dle FMF protokolu (normální nálezy): (a) nosní kůstky (b) dopplerovské vyšetření trojcípé chlopně (c) dopplerovské vyšetření PI v ductus venosus 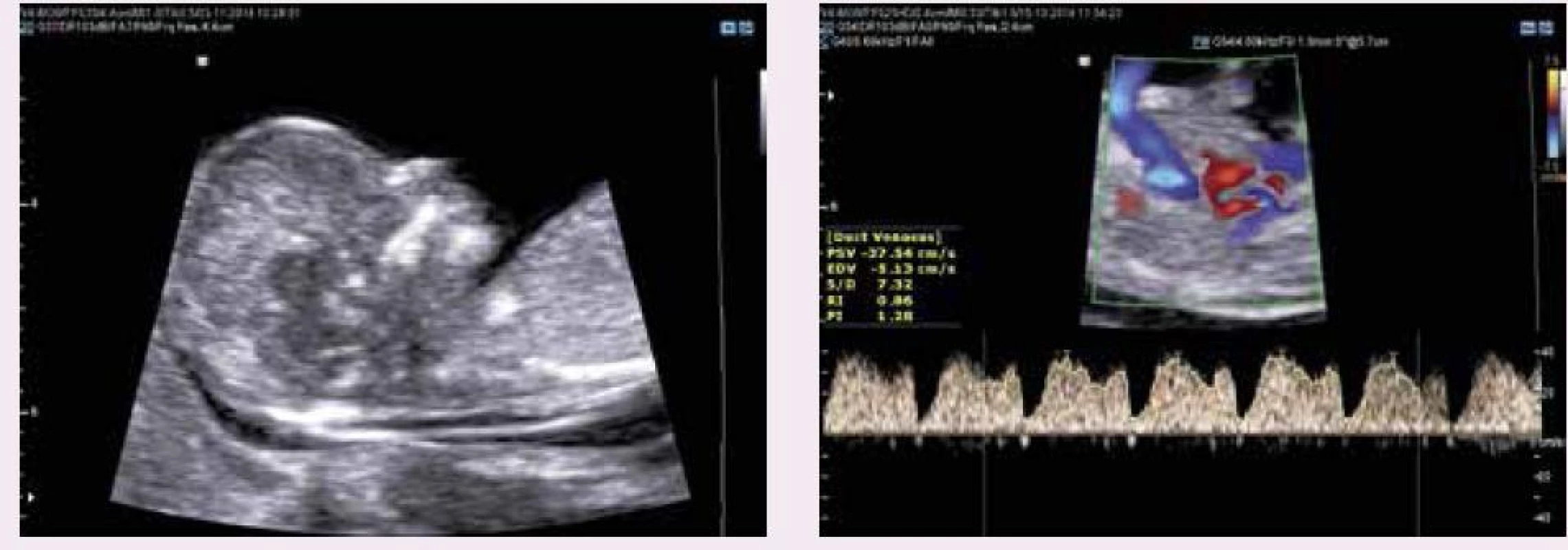
3. Ukázka zprávy z FMF rizikového modulu či softwaru ASTRAIA týkající se výpočtu rizika chromozomálních vad (a komplikací těhotenství). Vždy je nad výčtem rizik postižení plodu uvedeno FMF ID vyšetřujícího lékaře a pod výčtem rizik vyjmenováno, z čeho bylo riziko chromozomálních vad kalkulováno. Navíc je ve spodní části textu zmíněno, že byl využit FMF software. 
Aktuální seznamy FMF sonografistů certifikovaných na vyšetření markerů Downova syndromu je možno najít na odkazech:
- vyšetření NT: <https://courses.fetalmedicine.com/lists?course=1>
- vyšetření nosní kůstky: <https://courses.fetalmedicine.com/lists?marker=NB>
- vyšetření trojcípé chlopně: <https://courses.fetalmedicine.com/lists?marker=TR>
- vyšetření PI ductus venosus: <https://courses.fetalmedicine.com/lists?marker=DV>
K výhodám prvotrimestrálního screeningu kombinovaným testem patří:
- Vysoká efektivita screeningu nejčastějších chromozomálních vad
- Časné určení rizika chromozomálních vad s možností časné diagnostiky a časného ukončení těhotenství
- Individuální určení rizika chromozomálních vad u vícečetných vícechoriálních těhotenství
- Záchyt okolo 50 % strukturálních vad
- Identifikace těhotenství se zvýšeným rizikem výskytu srdečních vad a defektů neurální trubice plodu [19,20]
- Možnost screeningu preeklampsie matky a růstové retardace plodu s možností zahájení profylaktické medikace 100 mg kyselinou acetylsalicylovou [22].
K nevýhodám prvotrimestrálního screeningu patří nutnost hrazení testu pacientkou, a nadto závislost efektivity a kvality screeningu na technickém vybavení a zkušenostech vyšetřujícího.
Integrovaný test
Integrovaný test je velmi efektivní metodou screeningu Downova syndromu. Pokud zahrnuje vyšetření NT a plně integruje (spojuje) výsledky v 1. a 2. trimestru, jeho senzitivita dosahuje při 5% FPR až 95 % [9,23]. Pokud by při něm byly výsledky v 1. a 2. trimestru hodnoceny individuálně, dosahuje neúměrně vysoké falešné pozitivity (11–17 %) [9]. Výhodou integrovaného testu je vysoká efektivita, nevýhodou je získání výsledků až ve 2. trimestru a nutnost hrazení USG-vyšetření NT pacientkou. Sérum-integrovaný test bez vyšetření NT dosahuje nadto při 5% FPR senzitivity pouze 86 % [9].
Genetická ultrasonografie
Genetická ultrasonografie je ideální metodou screeningu při pozdním záchytu těhotenství a absenci screeningových testů chromozomálních vad. Může být využit i k upřesnění rizika Downova syndromu vypočítaného při předchozím screeningovém testu, zvláště při jeho hraničním výsledku. Lze jej provést od 16. týdne těhotenství a riziko Downova syndromu se při něm upravuje podle výskytu tzv. soft markerů Downova syndromu a z toho odvozených koeficientů pravděpodobnosti (LR – likelihood ratio) [3,8]. USG-vyšetření musí vždy zahrnovat detailní vyšetření morfologie plodu a vyšetření všech soft markerů Downova syndromu s přepočtem rizika Downova syndromu pomocí LR. Není vhodné doporučovat invazivní výkon pouze pro výskyt pouze jediného soft markeru. Při absenci typických vrozených vad a tradičních soft markerů Downova syndromu (velikost nuchální nad 6 mm, echogenní fokus, echogenní střevní kličky, mírná pelviektázie, krátký femur a krátký humerus) lze riziko trizomie 21 snížit 2–3krát [24]. Při absenci nověji popsaných soft markerů (tradiční soft markery a k tomu navíc ventrikulomegalie, absence nosní kůstky a aberantní průběh pravostranné arteria subclavia) lze riziko Downova syndromu snížit dokonce 7,7krát [25]. Genetická ultrasonografie umožňuje nejen upřesnit riziko Downova syndromu, ale navíc i identifikovat plody se zvýšeným rizikem jiných chromozomálních vad plodu [26]. Při normální morfologii a růstu plodu je totiž výskyt dalších chromozomálních vad málo pravděpodobný.
Triple test
Biochemický screening ve 2. trimestru (triple test) byl ve většině zemí nejhojněji využívanou metodou screeningu Downova syndromu. V posledních letech není považován za optimální metodu screeningu, a to kvůli nízké efektivitě (senzitivita okolo 65 % při 5%FPR) [8], absenci USG-vyšetření morfologie plodu a pozdnímu obdržení výsledku. Je metodou volby u žen, které odmítly nebo nestihly absolvovat prvotrimestrální screening. Vhodné je v těchto případech upřesnění rizika chromozomálních vad genetickou ultrasonografií ve 2. trimestru. Ani využití koncentrace AFP ke screeningu defektů neurální trubice není v poslední době opodstatněné (senzitivita pouze 80% oproti 90% při USG-vyšetření mozku plodu, navíc vykazuje vysokou falešnou pozitivitu) [27].
Metody screeningu strukturálních vad
USG-vyšetřením lze rozpoznat přibližně 50 % vrozených morfologických vad již v období okolo 12. týdne těhotenství, ve 21.–22. týdnu 80–90 % [5,28,29]. K dosažení takto vysokého záchytu vrozených vývojových vad musí vyšetření morfologie plodu splňovat kritéria doporučovaná společností ISUOG (International International Society of Ultrasound in Obstetrics and Gynecology) [30,31], která jsou téměř shodná s doporučením FMF. Existuje i FMF-certifikace pro USG-vyšetření ve 2. trimestru těhotenství, jejíž podmínkou je ovšem absolvování teoretického a praktického kurzu se zasláním logbooku snímků z povinně vyšetřovaných struktur plodu (obr. 4 a obr. 5). V 1. trimestru lze kromě přímého vyšetření morfologie plodu identifikovat i těhotenství se zvýšeným rizikem výskytu srdeční vady a defektu neurální trubice plodu [20,21]. Diagnostickým testem je u strukturálních vad konsiliární USG-vyšetření a vyšetření zobrazením magnetickou rezonance. U některých strukturálních vad není diagnostický test dostupný.
4. Ultrasonografické vyšetření morfologie plodu v 1. trimestru dle ISUOG a FMF doporučení (normální nálezy) 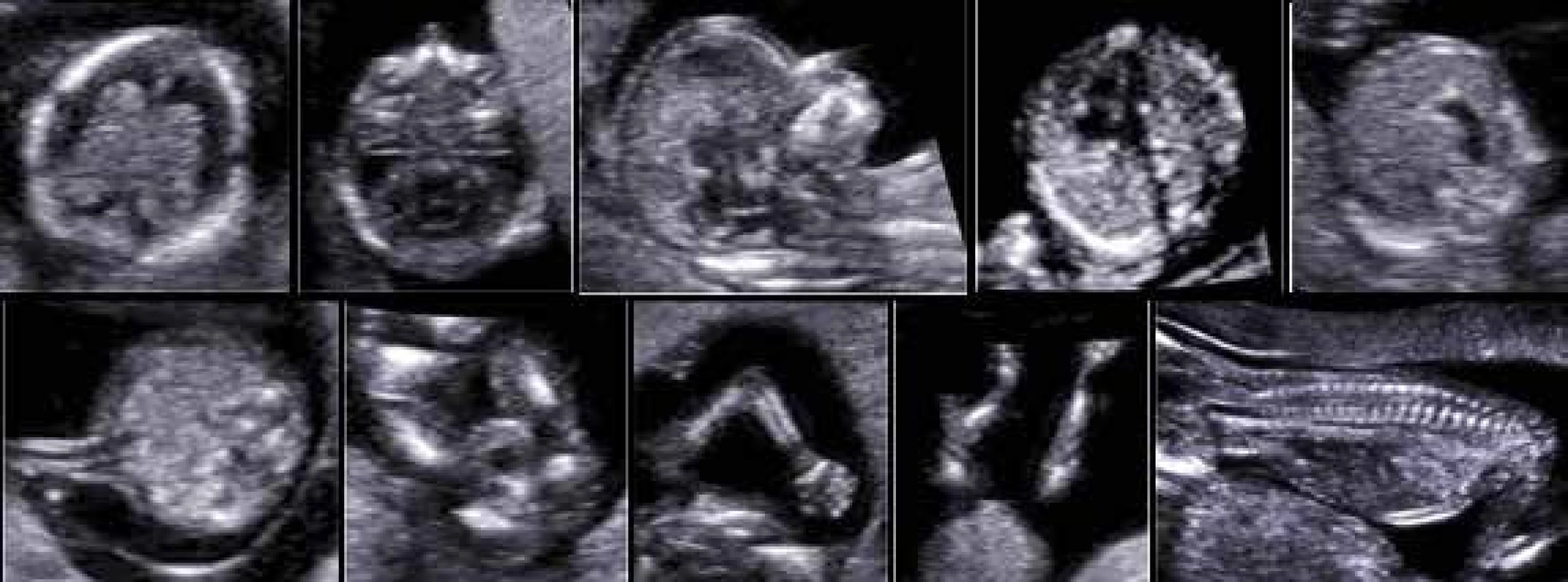
5. Ultrasonografické vyšetření morfologie plodu ve 2. trimestru dle FMF protokolu (normální nálezy) 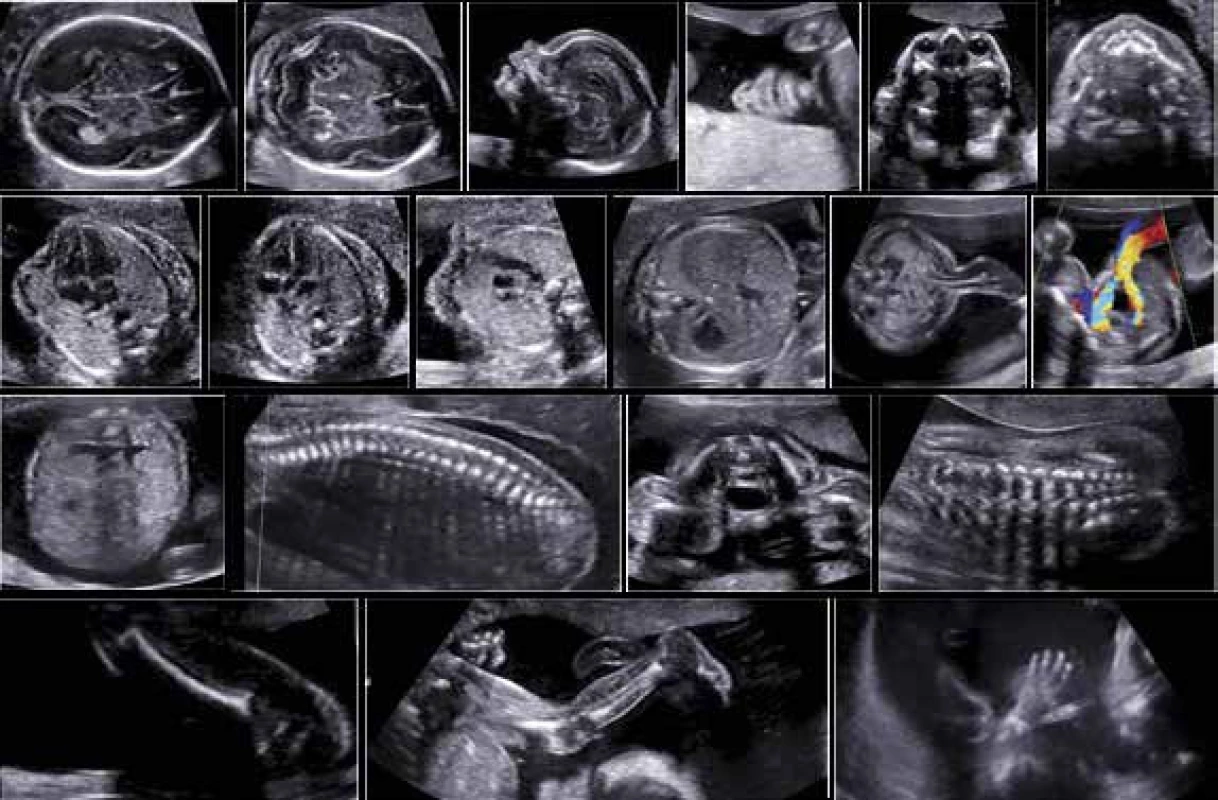
Závěr
V současné době je možno v těhotenství provádět efektivní screening chromozomálních a strukturálních vrozených vad. Screening znamená pouze zjištění zvýšeného rizika výskytu vady, neznamená přímo výskyt vady. Při pozitivním výsledku screeningu je vhodné těhotné ženě doporučit diagnostický test, případně před ním s upřesnění rizika výskytu vady dalším screeningovým testem. Zásadní je u každé těhotné ženy ultrasonografické vyšetření morfologie plodu. Nejpřesnější metodou screeningu chromozomálních vad jsou prenatální cell-free-DNA testy (při normálním výsledku USG-vyšetření) a prvotrimestrální USG-multimarkerový kombinovaný test. Screening strukturálních vrozených vad se provádí pomocí USG-vyšetření.
Doručeno do redakce 11. 3. 2015
Přijato po recenzi 21. 4. 2015
MUDr. Veronika Frisová, Ph.D.
veronika.frisova@email.cz
Profema – centrum fetální medicíny s.r.o.
Porodnicko-gynekologická klinika LF UP a FN Olomouc
Sources
1. Unzeitig V, Měchurová A, Ľubušký M. Zásady dispenzární péče ve fyziologickém těhotenství. Čes Gynek 2012; 77(3): 265–266.
2. Spencer K. Aneuploidy screening in the first trimester. Am J Med Genet C Semin Med Genet, 2007; 145C(1): 18–32.
3. Hills A, Donaghue C, Waters Jet al. QF-PCR as a stand-alone test for prenatal samples: the first 2 years' experience in the London region. Prenat Diagn 2010; 30(6): 509–517.
4. Nicolaides KH. Screening for fetal aneuploidies at 11 to 13 weeks. Prenat Diagn 2011; 31(1): 7–15.
5. Garne E, Loane M, Dolk H et al., Prenatal diagnosis of severe structural congenital malformations in Europe. Ultrasound Obstet Gynecol 2005; 25(1): 6–11.
6. Loane M, Dolk H, Morris JK. EUROCAT Working Group. Maternal age-specific risk of non-chromosomal anomalies. BJOG 2009; 116(8): 1111–1119.
7. Katz DL. Clinical epidemiology & evidence-based medicine: Fundamental principles of clinical reasoning & research. SAGE Publications: Thousand Oaks (California) 2001. ISBN 978–0761919384.
8. Tabor A, Vestergaard CH, O. Lidegaard O. Fetal loss rate after chorionic villus sampling and amniocentesis: an 11-year national registry study. Ultrasound Obstet Gynecol 2009; 34(1): 19–24.
9. Breathnach FM, Malone FD. Screening for aneuploidy in first and second trimesters: is there an optimal paradigm? Curr Opin Obstet Gynecol 2007; 19(2): 176–182.
10. Kagan KO, Staboulidou I, Cruz J et al. Two-stage first-trimester screening for trisomy 21 by ultrasound assessment and biochemical testing. Ultrasound Obstet Gynecol 2010; 36(5): 542–547.
11. Aagaard-Tillery KM, Malone FD, Nyberg DA et al. Role of second-trimester genetic sonography after Down syndrome screening. Obstet Gynecol 2009; 114(6): 1189–1196.
12. Dar P, Curnow KJ, Gross SJ et al. Clinical experience and follow-up with large scale single-nucleotide polymorphism-based noninvasive prenatal aneuploidy testing. Am J Obstet Gynecol 2014; 211(5): 527. e1–527. e17. Dostupné z DOI: <http://doi: 10.1016/j.ajog.2014.08.006>.
13. Nicolaides KH, Syngelaki A, Ashoor G et al. Noninvasive prenatal testing for fetal trisomies in a routinely screened first-trimester population. Am J Obstet Gynecol 2012; 207(5): 374, e1-e6. Dostupné z DOI: <http://doi: 10.1016/j.ajog.2012.08.033>.
14. Malone FD, Canick JA, Ball RH et al. First-trimester or second-trimester screening, or both, for Down's syndrome. N Engl J Med 2005; 353(19): 2001–2011.
15. Bartlett LA, Berg CJ, Shulman HB et al. Risk factors for legal induced abortion-related mortality in the United States. Obstet Gynecol 2004; 103(4): 729–737.
16. Pergament E, Cuckle H, Zimmermann B et al. Single-nucleotide polymorphism-based noninvasive prenatal screening in a high-risk and low-risk cohort. Obstet Gynecol 2014; 124(2 Pt 1): 210–218.
17. Ashoor G, Syngelaki A, Poon LC et al. Fetal fraction in maternal plasma cell-free DNA at 11–13 weeks' gestation: relation to maternal and fetal characteristics. Ultrasound Obstet Gynecol 2013; 41(1): 26–32.
18. Sonek JD, Cuckle HS. What will be the role of first-trimester ultrasound if cell-free DNA screening for aneuploidy becomes routine? Ultrasound Obstet Gynecol 2014; 44(6): 621–630.
19. Takoudes T, Hamar B. Performance of non-invasive prenatal testing when fetal cell-free DNA is absent. Ultrasound Obstet Gynecol 2015; 45(1): 112. Dostupné z DOI: <http://doi: 10.1002/uog.14715>.
20. Pereira, S., et al. Contribution of fetal tricuspid regurgitation in first-trimester screening for major cardiac defects. Obstet Gynecol 2011; 117(6): 1384–1391.
21. Chaoui R, Benoit B, Heling KS et al. Prospective detection of open spina bifida at 11–13 weeks by assessing intracranial translucency and posterior brain. Ultrasound Obstet Gynecol 2011; 38(6): 722–726.
22. Poon LC, Syngelaki A, Akolekar R et al. Combined screening for preeclampsia and small for gestational age at 11–13 weeks. Fetal Diagn Ther 2013; 33(1): 16–27.
23. Ball RH, Caughey AB, Malone FD et al. First - and second-trimester evaluation of risk for Down syndrome. Obstet Gynecol 2007; 110(1): 10–17.
24. Nyberg DA, Souter VL, El-Bastawissi A et al. Isolated sonographic markers for detection of fetal Down syndrome in the second trimester of pregnancy. J Ultrasound Med 2001; 20(10): 1053–1063.
25. Agathokleous M, Chaveeva P, Poon LC et al. Meta-analysis of second-trimester markers for trisomy 21. Ultrasound Obstet Gynecol 2013; 41(3): 247–261.
26. Nyberg DA, Souter VL. Sonographic markers of fetal trisomies: second trimester. J Ultrasound Med 2001; 20(6): 655–674.
27. Nyberg D. Ultrasound as a screening test for neural tube defects (and other important anomalies). Ultrasound Obstet Gynecol 1994; 4(4): 265–268.
28. Grande M, Arigita M, Borobio V et al. First-trimester detection of structural abnormalities and the role of aneuploidy markers. Ultrasound Obstet Gynecol 2012; 39(2): 157–163.
29. Syngelaki A, Chelemen T, Dagklis T et al. Challenges in the diagnosis of fetal non-chromosomal abnormalities at 11–13 weeks. Prenat Diagn 2011; 31(1): 90–102.
30. Salomon LJ, Alfirevic Z, Bilardo CM et al. ISUOG practice guidelines: performance of first-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol 2013; 41(1): 102–113.
31. Salomon LJ, Alfirevic Z, Berghella V et al. Practice guidelines for performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol 2011; 37(1): 116–126.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2015 Issue 2-
All articles in this issue
- Editorial
-
Where is assisted reproductive technology heading?
Interview with professor P. Ventruba - Talks with Laura. This time with O. Šottner, MD
- Analysis of the set of primiparous women with induced labor
- The importance of calcium intake during pregnancy and lactation and the possibilities of its supplementation
- Possible treatment of anogenital warts with the immunomodulation agent Isoprinosine
- Perforated appendicitis in pregnancy: case report
- Has the pregnancy outcome of women with pregestational diabetes mellitus improved in ten years?
- Methods of screening for the most common congenital structural and chromosomal fetal defects
- Non-hormonal therapy of climacteric syndrome
- Post menopausal osteoporosis – „dysmobility syndrome“
- Behaviour and psychosocial needs of newborn
- Spontaneous birth after Caesarean section – importance of sonographic evaluation of the lower uterine segment
- Midwife in London
- Kateřina Štechová a kol. Dítě diabetické matky. Komplexní pohled na diabetes a těhotenství
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Possible treatment of anogenital warts with the immunomodulation agent Isoprinosine
- Spontaneous birth after Caesarean section – importance of sonographic evaluation of the lower uterine segment
- Behaviour and psychosocial needs of newborn
- Methods of screening for the most common congenital structural and chromosomal fetal defects
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

