-
Medical journals
- Career
Riziko trombózy při užívání hormonální antikoncepce z pohledu hematologa
: Petr Dulíček 1; Eva Ivanová 1; Petr Sadílek 1; Martin Beránek 2
: IV. interní hematologická klinika, LF UK a FN, Hradec Králové 1; Ústav klinické biochemie a diagnostiky, LF UK a FN, Hradec Králové 2
: Prakt Gyn 2013; 17(4): 277-282
: Gynecology and Obstetrics: Review Article
Trombotické komplikace jsou více než 50 let dobře známou komplikací užívání hormonální antikoncepce. Riziko je jak pro trombózu žilní, tak arteriální. Příčiny trombóz jsou velmi často multifaktoriální a závisí na celé řadě dalších rizikových faktorů. V článku se zabýváme zejména rizikovostí vrozených trombofilních stavů, a to především mutací FV Leiden a mutací FII 20210a. Hormonální antikoncepce patří mezi časté příčiny trombózy u žen v produktivním věku, nicméně správným zhodnocením všech dalších rizikových faktorů a zajištěním všech rizikových situací je možné toto riziko snížit.
Trombotické komplikace jsou více než 50 let dobře známou komplikací užívání hormonální antikoncepce. Riziko je jak pro trombózu žilní, tak arteriální. Příčiny trombóz jsou velmi často multifaktoriální a závisí na celé řadě dalších rizikových faktorů. V článku se zabýváme zejména rizikovostí vrozených trombofilních stavů, a to především mutací FV Leiden a mutací FII 20210a. Hormonální antikoncepce patří mezi časté příčiny trombózy u žen v produktivním věku, nicméně správným zhodnocením všech dalších rizikových faktorů a zajištěním všech rizikových situací je možné toto riziko snížit.
Klíčová slova:
hormonální antikoncepce – trombofilie – venózní tromboembolizmusÚvod
Venózní tromboembolizmus (VTE) je stále závažným medicínským a sociálně ekonomickým problémem. Přes stále rostoucí počet znalostí o etiologii VTE zůstává incidence v populaci stejná – 1/1 000 a závisí na věku. Ve věkové kategorii do 45 let je o řád nižší, a to 1/10 000 [1]. V těchto věkových kategoriích incidence nezávisí na pohlaví. VTE je typickým představitelem onemocnění, které se manifestuje po vzájemné interakci genotypu a zevního prostředí, a je tedy onemocněním multifaktoriálním. V naší populaci je 5–8 % jedinců s vrozeným trombofilním stavem, z toho polovinu tvoří ženy. Jedním z nejčastějších získaných rizikových faktorů pro VTE je ve věkové kategorii žen do 45 let užívání kombinované hormonální antikoncepce (combined oral contraceptive – COC), kterou u nás užívá více než 30 % žen.
Hemostáza a hormonální antikoncepce
Nasazení COC vede k následujícím komplexním změnám hemostázy [2]:
- zvýšení aktivity koagulačních faktorů – fibrinogenů: FII, FVII, FVIII, FX
- snížení hladiny inhibitoru krevního srážení – proteinu S (celkového i volného), může dojít i k mírnému snížení antitrombinu a navození získané APC-rezistence
- změnám fibrinolýzy:
- ↑ TAFI (trombinem aktivovaný inhibitor fibrinolýzy)
- ↑ plazminogénu
- ↑ tPa (tkáňový aktivátor plazminogenu)
- ↓ PAI – I (inhibitor tkáňového aktivátoru plazminogenu)
Výsledkem těchto změn je vychýlení hemostázy směrem k trombóze a větší riziko VTE. Nutno však zdůraznit, že tyto změny jsou:
- individuální, proto jsou ženy rozdělovány do 2 skupin dle odezvy hemostázy:
- ženy s nízkou odezvou (low responders)
- ženy s výraznější odezvou (high responders)
- nezachytitelné běžně dostupnými a prováděnými koagulačními testy, jako např. aPTT, D-dimer apod.
Riziko VTE při užívání hormonální antikoncepce bylo popsáno již Jordanem v r. 1961 [3]. První přípravky obsahovaly více než 100 µg estrogenu. Snížení obsahu estrogenu na 50 µg etinylestradiolu (EE) skutečně vedlo k signifikantnímu snížení rizika VTE [4,5,6], ale další snížení EE na 30–35 µg vedlo ke snížení rizika už jen 2krát. V současnosti nejsou jednoznačné důkazy, že by COC s 20 µg EE byla méně riziková než COC s obsahem EE 30–35 µg [7], i když některé práce tvrdí opak. Riziko VTE nezáleží jen na obsahu EE, ale také na typu gestagenu. Monofázické přípravky jsou spojené se stejným rizikem jako bifázické a trifázické.
1. Přehled rozdílného RR 1. VTE příhody u různých přípravků hormonální antikoncepce 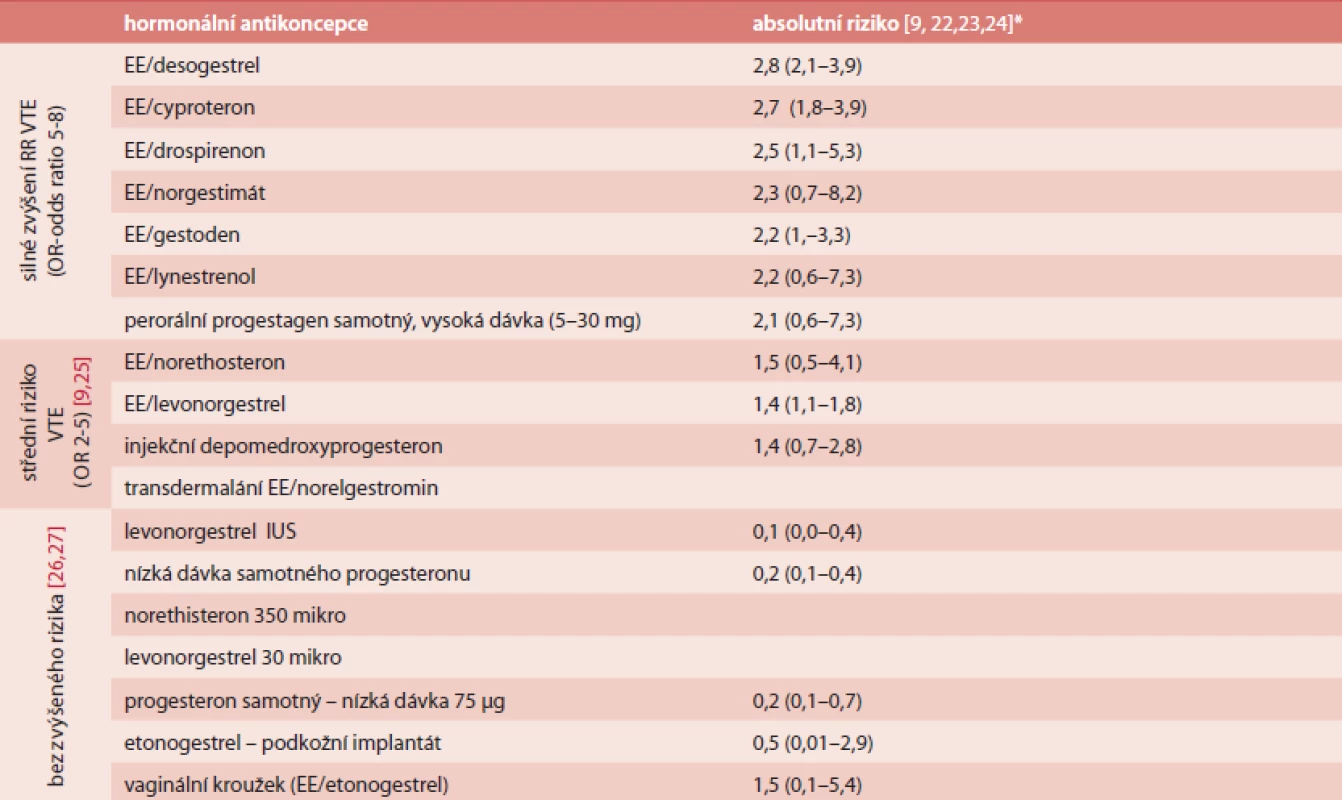
* absolutní riziko na 1 000 pacientských let: absolutní riziko: vynásobení RR bazální incidencí VTE 0,39/1000 p./let u žen 20-44 let užívajících hormonální antikoncepci Na čem závisí riziko VTE?
Relativní riziko (RR) VTE při užívání COC se udává 2 - až 4krát větší ve srovnání se stejnou věkovou kategorií žen, které ji neužívají. Absolutní riziko je 1–3/10 000 [8].
Riziko VTE ovlivňuje:
- délka užívání
- body mass index (BMI)
- typ antikoncepce
- věk uživatelky (výchozí riziko VTE)
- přítomnost vrozeného nebo získaného trombofilního stavu
- expozice dalšímu rizikovému faktoru (RF).
K VTE také často dochází v souvislosti s operací, imobilizací dolní končetiny a dalšími rizikovými situacemi pro vznik VTE (pokud není žena zajištěna profylakticky nízkomolekulárním heparinem (low molecular weight heparin - LMWH).
Délka užívání
Relativní riziko VTE je nejvyšší během prvních 3 měsíců užívání – riziko je až 13krát vyšší [9]. Stále zvýšené je v prvním roce užívání (zejména v prvních 6 měsících), poté riziko VTE klesá [10,11]. Nicméně přes tento „startovací efekt“ riziko VTE zůstává i v dalším čase vyšší.
Tělesná hmotnost
Zvýšená tělesná hmotnost je rizikovým faktorem pro VTE. RR VTE je při BMI > 25 kg/m2 5krát vyšší, při BMI > 30 kg/m dokonce 10krát vyšší [12].
Typ antikoncepce
Metaanalýza studií porovnávající riziko VTE u COC II. a III. generace prokázala 1,7krát vyšší riziko COC III. generace (3krát vyšší u žen užívající COC poprvé v životě) [13,14]. Pokud porovnáme vliv COC II. a III. generace na hemostázu (při stejném množství etinylestradiolu – EE), tak při užívání COC III. generace dochází k většímu zvýšení aktivity FVII, FII, FX [2], zvýšení TAFI [15], většímu poklesu proteinu S (jak volného, tak celkového) [15], rezistenci na aktivovaný proteinu C [16] (stanoveno trombin generačním testem). Také gestagen v COC III. generace méně „chrání” před účinky EE než gestagen II. generace. Přípravky obsahující cyproteron-acetát mají udávané riziko VTE, které je jako u COC III. generace [17]. Přípravky obsahující drospirenon mají riziko VTE, které není jednoznačně vyčísleno. Dle některých autorů [17] je riziko stejné jako u II. generace, u jiných jako III. generace [18]. Ženy užívající transdermálně aplikovanou antikoncepci mají 7,9krát (95% CI 3,5 resp 17,7) větší riziko VTE. Ženy, které užívají vaginální kroužek, mají pak toto riziko 6,5krát (95% CI 4,7 resp 8,9) větší. Riziko VTE je mírně zvýšeno u subkutánních implantátů (1,4krát; CI 0,6 resp 3,4), ale není zvýšeno u intrauterinního systému (IUS) s levonorgestrelem (0,6; 0,4–0,8) [19]. IUS – Mirena či Jaydess jsou z hlediska rizika VTE považovány za bezpečné [9,20,21].
Věk uživatelky
Většina vyčíslení míry rizika VTE při užívání hormonální antikoncepce vychází z vyčíslení relativního rizika VTE, nikoliv absolutního [28]. To vychází z kalkulace jak RR VTE, tak bazálního rizika VTE vzhledem k věku uživatelky. Nicméně to může vést k mírnému přecenění rizika, protože věk-pohlaví specifické bazální riziko VTE jsou odvozeny ze skupin, kde většina žen užívala hormonální antikoncepci. Absolutní riziko VTE stoupá signifikantně s věkem, zejména nad 45 let věku [1,29,30]. Např. ve věkové kategorii žen 20–44 je incidence VTE 0,4/1000, zatímco ve věkové kategorii 45–54 je 1/1000 [29].
Vrozený či získaný trombofilní stav
Vzhledem k velkému množství poznatků o trombofilních stavech dnes víme, že toto riziko není u všech stejné.
Vrozené trombofilní stavy lze dělit do 2 základních skupin:
- trombofilní stavy způsobené deficitem vrozených inhibitorů koagulace – deficit antitrombinu, proteinu C či proteinu S; jejich četnost v populaci je nižší, ale riziko VTE vyšší než ve 2. skupině
- mutace FV Leiden, mutace protrombinu G20210A: ty jsou v populaci naopak velmi četné (závislost na geografické distribuci). Frekvence výskytu FV Leiden je u nás 2–5 %, mutace protrombinu 1–2 %. Vedou k tzv. získání funkce – větší generaci trombinu a patří mezi mírné rizikové faktory VTE (rizikovost však značně stoupá v homozygotní konstituci, která vzhledem k četnosti výskytu není vzácná). Homozygotní forma Leidenské mutace má stejný výskyt jako deficit antitrombinu. Také kombinace obou mutací je poměrně častá.
V populaci se vyskytují také získané trombofilní stavy – vysoká aktivita některého z koagulačních faktorů, nejčastěji FVIII, antifosfolipidový syndrom (APS). Hyperhomocysteinemie může být jak vrozená, tak získaná. Vlastní mutace MTHFR C677T bez zvýšené hladiny homocysteinu není trombofilní stav [31–33], přesto je u nás vyšetřována. Vysoké riziko VTE je při deficitu antitrombinu [34]. Po nasazení COC ženě s deficitem antitrombinu (samozřejmě dosud nediagnostikovaným) je riziko 70–80%, že dojde k trombotické příhodě v prvních 6. měsících po nasazení. Tyto trombózy jsou většinou rozsáhlé – proximální, pánevní trombózy, často komplikované plicní embolií. Méně dat je o riziku VTE u deficitu proteinu C a S. Zde se většinou udává, že riziko je 6 - až 10krát větší, ale záleží také na typu deficitu [35]. Vzhledem k velké prevalenci mutace FV Leiden a protrombinové mutace (FII G20210A) je o riziku VTE nejvíce informací. Riziko VTE při užívání COC u ženy s Leidenskou mutací lze vyčíslit dle tab. 2 [36].
2. Riziko VTE u žen s mutací F V Leiden v heterozygotní f. a OC 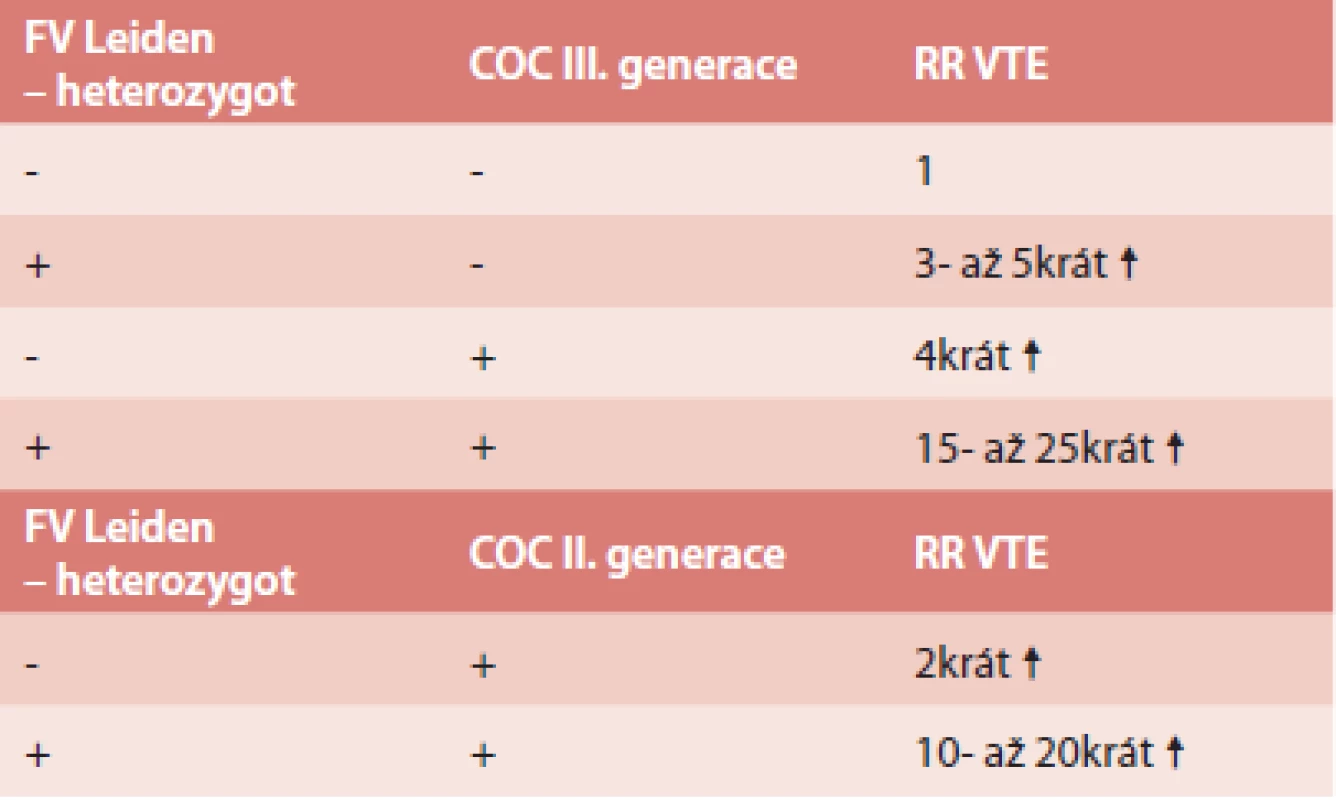
Při homozygotní formě Leidenské mutace je riziko ještě 10krát vyšší [37,38]. Nicméně v dalších letech se na základě dalších prací riziko vyčíslilo jako nižší, a to jako 10,3krát ↑ (5,7–18,5) [39]. Riziko VTE je u FII G20210A velmi podobné jako u Leidenské mutace, a to 7,1krát ↑ (3,4–15,04) [39]. Nicméně je zde větší riziko trombóz nitrolebních splavů. Podstatně méně dat je o riziku VTE v přítomnosti vrozeného trombofilního stavu a užívání čistě gestagenní OC. Riziko je považováno za podstatně nižší.
Expozice RF: operace, přiložení sádry či dlahy
K žilní trombóze velmi často dochází při expozici dalším rizikovým situacím, mezi které patří imobilizace dolní končetiny, celková imobilizace, operace, dlouhé cesty (autobusem přes noc či letecky více než 6, resp. 8 hodin). Zejména imobilizace dolní končetiny (výron apod.), kdy dojde k poranění tkáně, popř. zánětu, a následné aktivaci koagulace, patří mezi velmi časté vyvolávající momenty pro trombózy [40,41], o to bez ohledu na délku užívání antikoncepce. Přestože se jedná zejména o trombózy distální, ženy jsou pak následně eliminovány z dalšího užívání COC. Co se týče operací, riziko závisí zejména na typu operace (délce), věku uživatelky a délce užívání. Pouze u elektivních výkonů, operací patřících do skupiny s vysokým rizikem trombózy, je vhodné COC vysadit, a to nejméně alespoň 1 měsíc před zákrokem. Ostatní zákroky je vhodné zajistit LMWH, který není nutný u krátkých operací s nízkým rizikem VTE.
Na čem záleží riziko arteriální trombózy?
Absolutní riziko ischemické CMP je 21,4/100 000 a IM 10/100 000 [42]. Frekvence úmrtnosti během hospitalizace byla na tyto příhody 1% [42]. Riziko u jednotlivých typů COC je shrnuto v tab. 3 a tab. 4.
3. RR arteriální trombózy u COC s EE 30, resp. 40 μg 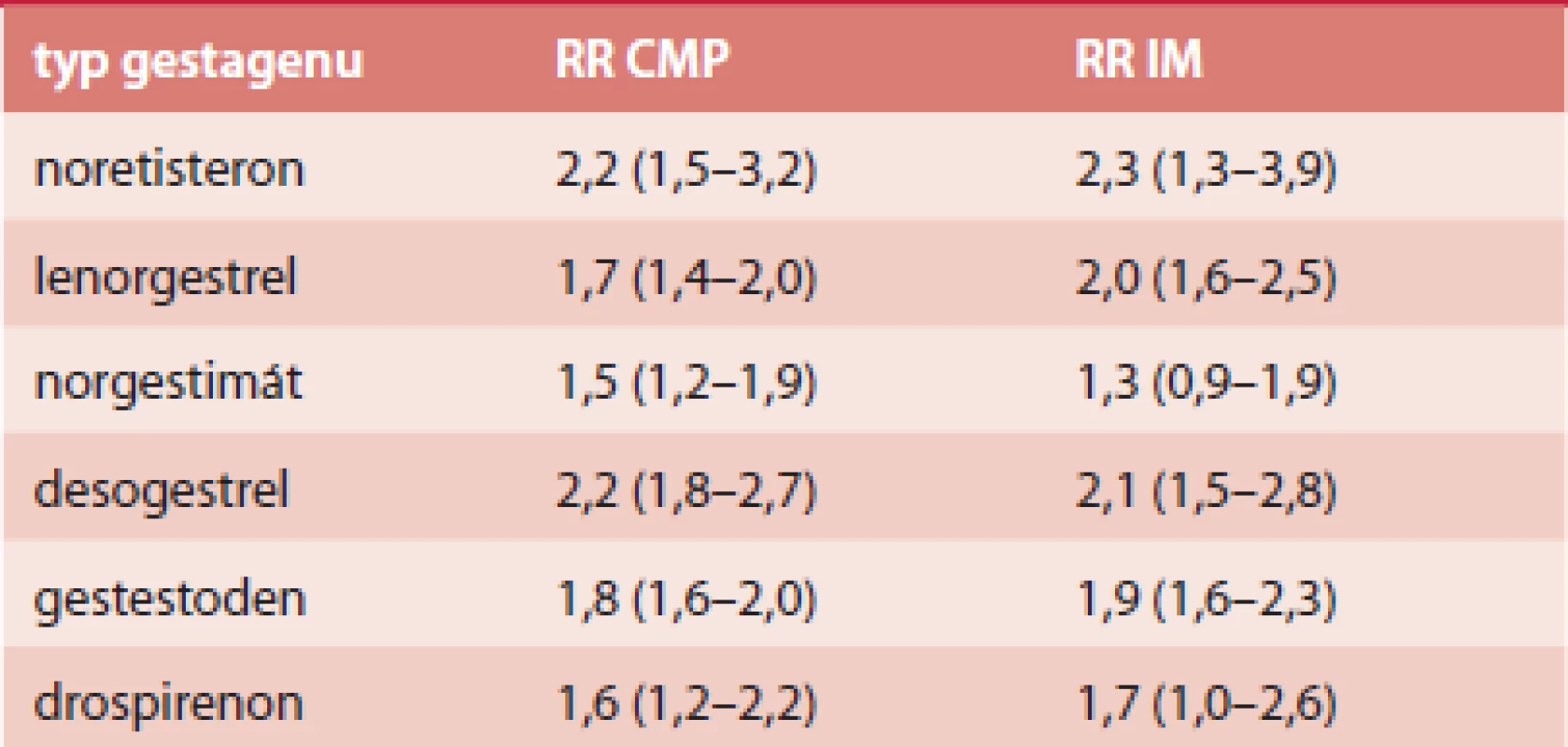
4. RR arteriální trombózy u COC s EE 20 μg 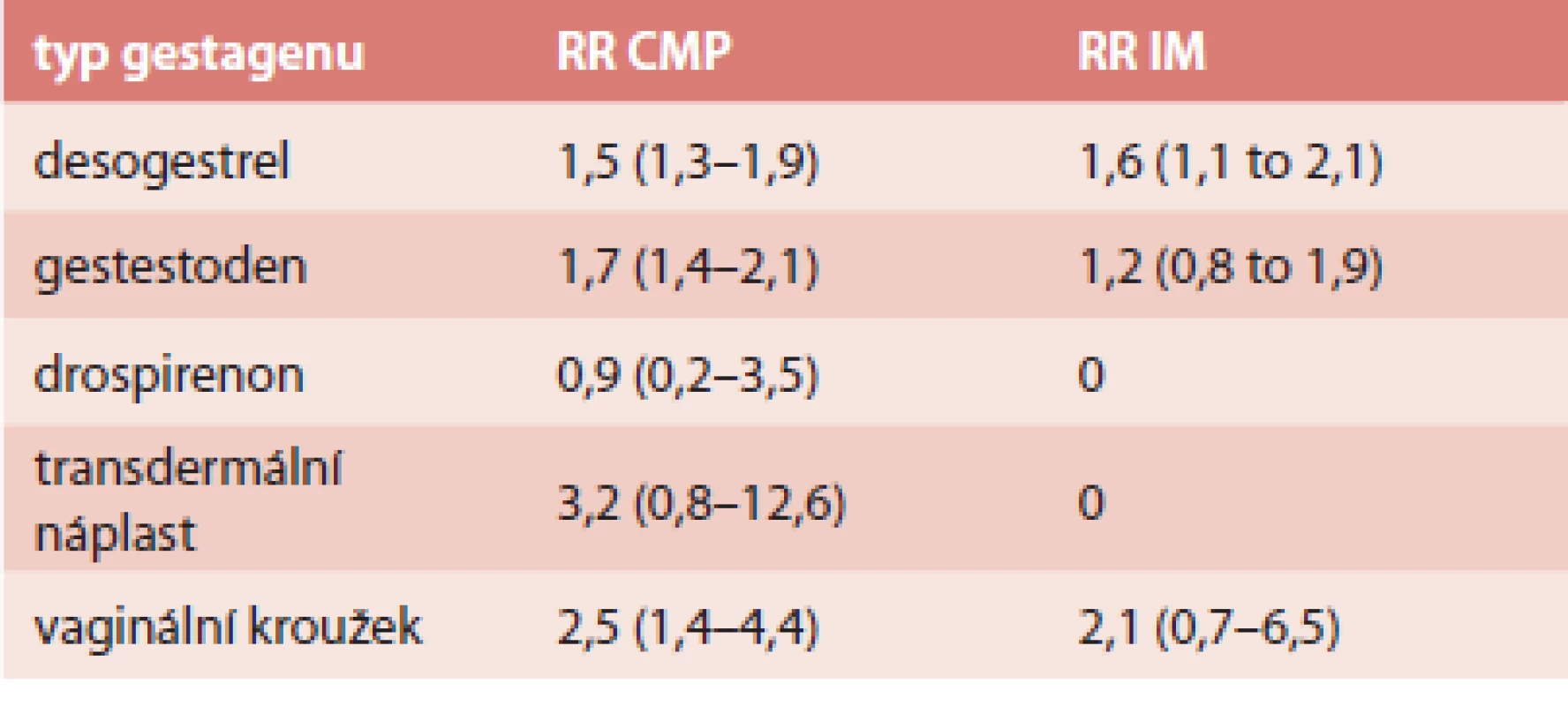
Riziko arteriální trombózy dále stoupá v přítomnosti dalších rizikových faktorů, mezi které patří diabetes mellitus, arteriální hypertenze (8krát), poruchy metabolizmu lipidů (11krát), kouření (4krát), získané trombofilní stavy, jako je např. APS (antifosfolipidový syndrom) či MPD (myeloproliferativní onemocnění).
Postup před nasazením hormonální antikoncepce je gynekologickou společností jasně a dobře formulován. Z hlediska hematologického se zmíním o interpretaci jednotlivých situací v klinické praxi.
Rodinná namnéza VTE
Schéma Rodinná anamnéza VTE
Osobní anamnéza VTE
- pozitivní
- 100% kontraindikace COC (v mnoha případech je to pro ženu škoda, např. když po mnoho let užívala COC, a pak došlo k distální DVT, např. při přiložení sádry apod)
- čistý gestagen? spíše ano, ale přihlédnout k závažnosti trombózy, ostatním RF
- lze IUS – MIRENA, Jaydess
- negativní
- antikoncepce dle standardního postupu
Postup před nasazením OC u asymptomatických žen (VTE) s prokázaným vrozeným trombofilním stavem
K průkazu by mělo dojít pouze v rámci vyšetření pokrevních příbuzných při splnění indikačních kritérií.
Kombinovanou OC považujeme za:
- kontraindikovanou při nálezu: deficit antitrombinu, proteinu C, proteinu S, mutace FV Leiden v homozygotní formě, mutace FII20210A v homozygotní formě, kombinace mutace FV Leiden + FII G20210A v heterozygotní formě
- rizikovou při nálezu mutace FV Leiden či mutace FII G20210A v heterozygotní formě + přítomnosti dalšího, jasně definovaného RF VTE, např. větším BMI aj. V této situaci ženě užívání COC nedoporučujeme do eventuální eliminace RF. V těchto 2 situacích lze užít pouze IUS – MIRENA či Jaydess
- za možnou při nálezu FV Leiden či FII G20210A v heterozygotní formě bez dalšího RF VTE ale je nutné:
- vyčíslit míru rizika VTE (viz výše)
- zhodnotit přítomnost dalších RF. Pokud nejsou přítomny další RF, pak je vlastní rozhodnutí na ženě. V případě, že chce COC užívat, je nutno ženu poučit o příznacích VTE, nutnosti návštěvy lékaře při příznacích VTE a nutnosti hlásit užívání COC v případě další rizikové situace (imobilizace DK apod)
Samozřejmě, výběr typu antikoncepce může snížit riziko VTE (čistý gestagen, II. generace). Vzhledem k prevalenci trombofilních stavů a rozšířenosti COC se nabízí otázka plošného vyšetřování trombofilních stavů před nasazením COC. To není v současnosti v rozvinutých zemích doporučováno. Např. při plošném vyšetřování Leidenské mutace by muselo být vyšetřeno 0,5 milionu žen, aby došlo k prevenci jedné fatální VTE.
Nejčastější nedostatky v klinické praxi z pohledu hematologa jsou následující:
- neindikované vyšetřování vrozených trombofilních stavů, a dokonce mutací, které nejsou vůbec trombofilní. To má důsledky nejen ekonomické, ale etické.
- špatná interpretace výsledků – falešné ujištění ženy o „neriziku“
- nevyčíslení absolutního rizika VTE
- neznalost skutečného rizika VTE, např. riziko VTE je v rodinách s mutací FV Leiden a pozitivní anamnézou VTE 2 - až 4krát větší než u jedinců náhodně zachycených.
Závěr
Hormonální antikoncepci užívá na světě více než 100 miliónů žen. Je velmi efektivní a oblíbenou formou antikoncepce. VTE je nejčastější a nejvýznamnější komplikací. Také podíl na celkové frekvenci výskytu VTE v populaci je malý, ale ve věkové skupině žen užívajících OC je signifikantním rizikovým faktorem venózního tromboembolizmu.
Nicméně při dodržování jednoduchých pravidel před jejím nasazením lze riziko VTE snížit, další rizika snížíme zajištěním všech dalších rizikových situací a používáním forem, které toto riziko vůbec nezvyšují, např. IUS.
Doručeno do redakce dne 8. října 2013
Přijato po recenzi dne 10. listopadu 2013
doc. MUDr. Petr Dulíček, Ph.D.
PetrDulicek@seznam.cz
IV. interní hematologická klinika, LF UK a FN, Hradec Králové
www.fnhk.cz
Sources
1. Nordström M, Lindblad B, Bergqvist D et al. A prospective study of the incidence of deep – vein thrombosis within a defined urban population. J Intern Med 1992; 232(2): 155–160.
2. Middeldorp S, Meijers JCM, van den Ende AE et al. Effects on coagulation of levonorgestrel and desogestrel containing low dose oral contraceptives: a cross over study. Thromb Haemost 2000; 84(1): 4–8.
3. Jordan WM, Anand JK. Pulmonary embolism. Lancet 1961; 278(7212): 1146–1147.
4. Meade TW, Greenberg G, Thompson SG.et al. Progestagens and cardiovascular reactions associated with oral contraceptives and comparison of the safety of 50 - and 30-microgram oestrogen preparations. Br Med J 1980; 280(6224): 1157–1160.
5. Böttiger LE, Boman G, Eklund G et al. Oral contraceptives and thromboembolic disease: effects of lowering estrogen content. Lancet 1980; 1(8178): 1097–1101.
6. Gerstman BB, Piper JM, Tomita DK et al. Oral contraceptive estrogen dose and the risk of deep venous thromboembolic disease. Am J Epidemiol 1991; 133(1): 32–37.
7. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contarception. Venous thromboembolic disease and combined oral contraceptives: results of international multicentre case-control study. Lancet 1995; 346(8990): 1575–1582.
8. Rosendaal FR. Thrombosis in the young: epidemiology and risk factors. A focus on venous thrombosis. Tromb Haemost 1997; 78(1): 1–6.
9. van Hylckama Vlieg A, Helmerhorst FM, Vandenbroucke JP et al. The venous thrombotic risk of oral contraceptives, effects of oestrogen dose and prgestogen type: results of the MEGA case-control study. BMJ 2009; 339: b2921. Dostupné z DOI: <http://doi: 10.1136/bmj.b2921>.
10. Bloemenkamp KW, Rosendaal FR, Helmerhorst FM et al. Higher risk of venous thrombosis during early use of oral contraceptives in women with inherited clotting defects. Arch Intern Med 2000; 160(1): 49–52.
11. Herings RM, Urquhart J, Leufkens HG. Venous thromboembolism among new users of different oral contraceptives. Lancet 1999; 354(9173): 127–128.
12. Abdollahi M, Cushman M, Rosendaal FR. Obesity: risk of venous thrombosis and the interaction with coagulation factor levels and oral contraceptive use. Thromb Haemost 2003; 89(3): 493–498.
13. Kemmeren JM, Algra A, Grobbee DE. Third generation oral contraceptives and risk of venous thrombosis: meta-analysis. BMJ 2001; 323(7305): 131–134.
14. Battaglioni T, Martinelli I. Hormone therapy and thromboembolic disease. Curr Opion Hematol 2007; 14(5): 488–493.
15. Meijers JC, Middeldorp S, Tekelenburg W et al. Increased fibrinolytic activity during use of oral contraceptives is counteracted by an enhanced factor XI – independent down regulation of fibrinolysis: a randomized cross-over study of two low-dose oral contraceptives. Tromb Haemost 2000; 84(1): 9–14.
16. Tans G, Curvers J, Middeldorp S et al. A randomised a cross over study on the effects of levonorgestrel - and desogestrel-containing oral contraceptives on the anticoagulant pathways. Thromb Haemost 2000; 84(1): 15–21.
17. Dinger JC, Heinemann LA, Kühl-Habich D et al. The safety of a drospirenone-containing oral contraceptive: final results from the European Active Surveillance Study on oral contraceptions based on 142,475 women-years of observation. Contraception 2007; 75(5): 344–354.
18. Plu-Bureau G, Maitrot-Mantelet L, Hugon-Rodin J et al. Hormonal contraceptives and venous thromboembolism: an epidemiological update. Best Pract Res Clin Endocrinol Metab. 2013; 27(1): 25–34.
19. Lidegaard Ø, Nielsen LH, Skovlund CW et al. Venous thrombosis in users of non-oral hormonal contraception: follow-up study. Denmark 2001–10. BMJ 2012; 344: e2990. Dostupné z DOI: <http://doi: http://dx.doi.org/10.1136/bmj.e2990>.
20. Lidegaard Ø, Løkkegaard E, Svendsen AL et al. Hormonal contraception and risk of venous thromboembolism: national follow-up study. BMJ 2009; 339: b2890. Dostupné z DOI: <http://doi: 10.1136/bmj.b2890>.
21. Lidegaard Ø, Nielsen LH, Skovlund CW et al. Risk of venous thromboembolism from use of oral contraceptives containing different progestogens and oestrogen doses: Danish cohort study, 2001–9. BMJ 2011; 343: d6423. Dostupné z DOI: <http://doi: 10.1136/bmj.d6423>.
22. Vasilakis C, Jick H, del Mar Melero-Montes M.. Risk of idiopathic venous thromboembolism in users of progestagens alone. Lancet 1999; 354(9190): 1610–1611.
23. Jick S, Kaye JA, Li L et al. Further results on the risk of nonfatal venous thromboembolism in users of zhe contraceptive transdermal patch compared to users of oral contraceptives containing norgestimate and 35 microg of ethinyl estradiol. Contraception 2007; 76(1): 4–7.
24. Cole JA, Norman H, Doherty M et al. Venous thromboembolism, myocardial infarction, and stroke among transdermal contraceptive system users. Obstet Gynecol 2007; 109(2 Pt 1): 339–346.
25. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception. Cardiovascular disease and use of oral and injectable progestagen-only contraceptives and combined injectable contraceptives. Results of an international, multicenter, case-control study. Contraception 1998; 57(5): 315–324.
26. van Hylckama Vlieg A, Hellmerhorst FM, Rosendaal FR. The risk of deep venous thrombosis associated with injectable depot-medroxyprogesterone acetate contraceptives or a levonorgestrel intrauterine device. Arterioscler Thromb Vasc Biol 2010; 30(11): 2297–2300.
27. Gemzell-Danielsson K, Inki P, Heikinheimo O. Safety and Efficacy of the Levonorgestrel-releasing Intrauterine System. Expert Rev Obstet Gynecol 2013; 8(3): 235–247.
28. van Hylckama Vlieg A., Middeldorp S. Hormone therapies and venous thromboembolism: where are we now? J Thrombo Haemost 2011; 9(2): 257–266.
29. Naess IA, Christiansen SC, Romundstad P et al. Incidence and mortality of venous thrombosis: a population – based study. J Thromb Haemost 2007; 5(4): 692–699.
30. Anderson FA Jr, Wheeler HB, Goldberg RJ et al. A population-based perspektive of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT Study. Arch Intern Med 1991; 151(5): 933–938.
31. Salden A, Keeney S, Hay CR et al. The C677T MTHFR variant and the risk of venous thrombosis. Br J Haematol 1997; 99(2): 472.
32. Tosetto A, Missiaglia E, Frezzato M et al. The VITA project: C677T mutation in the methylene-tetrahydrofolate reductase gene and risk of venous thromboembolism. Br J Haematol 1997; 97(4): 804–806.
33. Brown K, Luddington R, Baglin T. Effect of the MTHFR C677T variant on the risk of venous thromboembolism: interaction with factor V Leiden and prothrombin (F2G20210A) mutations. Br J Haematol 1998; 103(1): 42–44.
34. Simioni P, Sanson BJ, Prandoni P et al. Incidence of venous thromboembolism in families with inherited thrombophilia. Thromb Haemost 1999; 81(2): 198–202.
35. Martinelli I, Mannucci PM, De Stefano V et al. Different risk of thrombosis in four coagulation defects associated with inherited thrombophilia: a study of 150 families. Blood 1998; 92(7): 2353–2358.
36. Vandenbroucke JP, Koster T, Briët E et al. Increased risk of venous thrombosis in oral-contraceptive users who are carriers of factor V Leiden mutation. Lancet 1994; 344(8935): 1453–1457.
37. Rosendaal FR, Koster T, Vandenbroucke JP et al. High risk of thrombosis in patients homozygous for factor V Leiden (activated protein C resistance). Blood 1995; 85(6): 1504–1508.
38. Rintelen C, Mannhalter C, Ireland H et al. Oral contraceptives enhance the risk of clinical manifestation of venous thrombosis at a young age in females homozygous for factor V Leiden. Br J Haematol 1996; 93(2): 487–490.
39. Emmerich J, Rosendaal FR, Cattaneo M et al. Combined effect of factor F V Leiden and prothrombin 20210A on the risk of venous thromboembolism-pooled analysis of 8 case-control studies including 2310 cases and 3204 controls. Study Group for Pooled-Analysis in Venous Thromboembolism. Thromb Haemost 2001; 86(3): 809–816.
40. Dulíček P, Malý J, Pecka et al. Venous thromboembolism in young female while on oral contraceptives: high frequency of inherited thrombophilia and analysis of thrombotic events in 400 czech women. Clin Appl Thromb Hemost 2009; 15(5): 567–573.
41. Dulíček P, Sadílek P, Beránek M et al. Výskyt venózního tromboembolizmu u žen v časové souvislosti s užíváním hormonální antikoncepce. Transfuze hematol. dnes, 2013; 19(1): 33–38.
42. Lidegaard Ø, Løkkegaard E, Jensen A et al. Thrombotic stroke and myocardial infarction with hormonal contraception. N Engl J Med 2012; 366(24): 2257–2266.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2013 Issue 4-
All articles in this issue
- Risk of thrombosis in association with oral contraceptive use from hematologist΄s point of view
- Can contraception to impact demographics dates?
- Obstetrical anesthesia – Czech Republic versus world
- Stillbirth – persistent problem of perinatal care
- Pharmacological options to reduce blood loss in laparoscopic myectomy
- Pelvic exenteration and female sexuality
- Traffic injuries of the pregnant women
- Principles and results of National register of assisted reproduction
- Avastin in first-line treatment of metastatic breast cancer – our experiences: case report
- Expectations of expectant mothers versus the hospital reality in case the planned caesarean section
- Screening of sporadic colorectal cancer in Czech Republic
- Authors´index
- Reviewers´ index
- Key words index
- Organization of Medical Care in the Field of Assisted Reproduction in Ukraine (Myth and Reality)
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Risk of thrombosis in association with oral contraceptive use from hematologist΄s point of view
- Stillbirth – persistent problem of perinatal care
- Principles and results of National register of assisted reproduction
- Obstetrical anesthesia – Czech Republic versus world
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


