-
Medical journals
- Career
Screening poruch štítné žlázy v graviditě a po porodu
: A. Kořenek
: Jesenická nemocnice, spol. s r. o. ; Gynekologicko-porodnické oddělení
: Prakt Gyn 2009; 13(3): 137-141
Cíl studie:
Zhodnotit funkci štítné žlázy u pacientek v graviditě a po porodu v závislosti na jodurii, hladinách tyreostimulačního hormonu (TSH), volného tyroxinu (fT4), protilátkách proti peroxidáze (anti TPO) a proti tyreoglobulinu (anti TG).Typ studie:
Prospektivní longitudinální studie.Název a sídlo pracoviště:
Gynekologicko‑porodnické oddělení, Jesenická nemocnice.Metodika:
Do studie bylo v období od června 2005 do prosince 2006 zařazeno náhodným výběrem 174 pacientek s potvrzenou vitální graviditou (do 10. týdne gravidity). Jódový status byl určen pomocí množství jódu v moči za 24 hod, hladina TSH, fT4, anti TPO a anti TG byla stanovena chemiluminiscenční analýzou z krevního séra. Odběry krve byly provedeny po potvrzení gravidity (I), ve 20. týdnu gravidity (II), čtyři dny po porodu (III) a šest měsíců po porodu (IV).Výsledky:
165 pacientek dokončilo studii, sedm pacientek užívalo tyroxin před graviditou. U pacientek byla zjištěna jodurie o průměrné hodnotě 3,04 μmol/24 hod, žádná pacientka neměla méně než 0,6 μmol/24 hod. U 15 (9, l %) pacientek byly zjištěny hladiny TSH (I) nad 3 mIU/l (14 pacientek nad 5 mIU/l), ve skupině IV byly u osmi (4,8 %) pacientek detekovány hladiny TSH nad 5 mIU/l. Všechny pacientky měly hladiny fT4 v normě: 10,3–25 pmol/l. Pět gravidit skončilo spontánním abortem do 22. týdne, ostatní sledované pacientky porodily v rozmezí 38.–41. týdne gravidity.Závěr:
Výsledky naší studie neprokázaly u žádné z pacientek nedostatek jódu, přesto u 15 z nich byly detekovány zvýšené hladiny TSH, které by mohly signalizovat subklinickou či počínající klinickou hypotyreózu. Alarmující je elevace TSH u čtyř ze sedmi pacientek, které užívaly substituci euthyroxem před graviditou. U osmi pacientek bylo půl roku po porodu TSH vyšší než 5 mIU/l, což potvrzuje rozvoj subklinické postpartální hypotyreózy.Klíčová slova:
jód – tyreostimulační hormon (TSH) – gravidita – hypotyreózaÚvod
Poruchy funkce štítné žlázy patří mezi nejčastější endokrinopatie, ženy bývají postiženy až 6krát častěji než muži, s maximem výskytu v pubertě, během těhotenství, po porodu a v postmenopauzálním období [1].
Choroby štítné žlázy lze zhruba rozdělit na vrozené poruchy štítnice, nemoci z nedostatku jódu, eufunkční benigní struma, infekční a autoimunitní záněty, stavy hypertyreózy a hypotyreózy a konečně nádory.
Štítná žláza produkuje trijódtyronin (T3) a tyroxin (T4), sama je řízena na principu negativní zpětné vazby. V hypotalamu v nucleus supraopticus a paraventricularis je produkován tripeptid tyreoliberin (TRH), stimulující produkci tyreostimulačního hormonu (TSH) z adenohypofýzy. TSH ovlivňuje vychytávání jodidu z krve, jeho oxidaci peroxidázou (TPO) na elementární jód a posléze jeho organifikaci navázáním na tyreoglobulin (TG) v koloidu acinu tyreoidey.
Hormony štítnice působí jak genomickými mechanizmy na receptory v jádru (ovlivnění genomové transkripce), tak i nongenomickými mechanizmy s rychlým nástupem pomocí membránových signálních cest.
Štítná žláza v graviditě
V řízení a funkci štítné žlázy v graviditě se uplatňuje tříkompartmentový model osy hypotalamo-hypofýzo-tyroidální u matky, plodu a také placenty.
V graviditě je štítnice stimulována třemi mechanizmy, ke kterým patří snížená dostupnost jódu a zpětnovazebné mechanizmy při nižší hladině free T4 pro elevaci tyroxin binding globulinu (TBG), a konečně direktně elevací humánního choriogonadotropinu (hCG).
Vlivem větší glomerulární filtrace roste celkový obrat jódu a clearance jódu ledvinami, z čehož rezultuje pokles hladiny cirkulujícího jódu v plazmě, zejména v lokalitách s deficiencí jódu. Během gravidity zvýšené hladiny estrogenů podněcují tvorbu TBG v játrech, a proto je více T4 vázáno na vazebný protein. Díky podobné stavbě s TSH je v počátku gravidity hCG schopno aktivovat štítnou žlázu navázáním na TSH receptor, tento jev se nazývá spillover syndrom [2].
Periferní metabolizmus hormonů matkou je modifikován, roste obrat T4, zejména v druhé polovině gravidity. Placenta obsahuje velké množství monodejodázy typu III, konvertující T4 na metabolicky inaktivní reverzní rT3, proto je v plodu více rT3. Tyto změny není schopna udržet štítnice poškozená buď autoimunitními procesy, nebo nedostatkem jódu. Roste riziko výskytu dysfunkce štítnice a v séru se objevují zvýšené hladiny autoprotilátek proti štítnici. K antigenním strukturám štítné žlázy patří zejména proti peroxidáza (TPO), tyreoglobulin (TG) a receptory TSH, raritně lze najít protilátky proti receptorům T4 a proti samotným hormonům T3 a T4 [3].
Anti TPO hrají roli jak v aktivaci komplementu po navázání na TPO, exprimovanou na povrch tyreocytů, tak aktivací monocytů a následně alterací buněčné cytotoxicity, jež se v konečném důsledku podílí na destrukci tyreocytů. Hladiny protilátek ale nekorelují se závažností autoimunitního postižení štítné žlázy. Další imunogenní strukturou štítnice jsou receptory TSH, proti kterým mohou být tvořeny autoprotilátky (TSHrAb). Aktivující TSHrAb vyvolávají hypertyreózu Graves-Basedowova typu s následnou excesivní produkcí T3 a T4, způsobující hypertrofii a hyperplazii tyroidálních folikulů. Na C terminální části TSH receptoru se mohou vázat blokující protilátky (TSH binding inhibitory antibody – TBIAb), které blokují funkci receptoru, nacházíme je i u primárního hypotyreoidismu a myxedému u Hashimotovy tyreoiditidy a v graviditě mohou alterovat projevy hypertyreoidismu [4,9].
Vlastní práce
V naší studii jsme se zaměřili na dynamické biochemické monitorování stavu štítné žlázy v graviditě a půl roku po porodu. Klinický dotazník nám měl pomoci definovat skupinu těhotných s vyšším rizikem onemocnění štítné žlázy a zároveň definovat skupinu těhotných, které již jsou pro dysfunkci štítnice léčeny. Výzkum měl za úkol obhájit, či naopak vyvrátit oprávněnost zařazení základního biochemického vyšetření funkce štítnice v rámci vyšetřovacího algoritmu těhotných v prenatálních poradnách [5].
Do klinického dotazníku byly zařazeny otázky pátrající po předchozím či probíhajícím onemocnění štítné žlázy pacientky, lécích užívaných v případě onemocnění štítnice, operacích štítné žlázy a léčbě štítné žlázy radiojódem. Dále bylo formou otázek ověřováno onemocnění štítné žlázy v rodině, léčba autoimunitních nemocí (diabetes mellitus, perniciózní anemie, m. Crohn, Sjögrenův syndrom, revmatoidní arthritis, vitiligo apod.), užívání léků pro jiné nemoci (amiodaron, lithium, interferon a, tamoxifen, metoclopramid, phenothiazin, tricyklická antidepresiva, fluoxetin, sertralin, preparáty se železem, rifampicin, fenytoin, multivitaminové preparáty s jódem). Ke zjišťovaným skutečnostem taktéž patřily informace o eventuální léčbě deprese a léčbě pro zvýšenou hladinu cholesterolu v krvi.
U gynekologické anamnézy nás zajímal počet předchozích těhotenství, přítomnost preeklampsie, gestačního diabetu, mrtvorozené plody po 28. týdnu gravidity, předčasně odloučená placenta, léčba neplodnosti, spontánní potraty, těhotenství po IVF. Pacientky svůj souhlas se zařazením do studie potvrdily podepsáním informovaného souhlasu.
Vlastní monitorování funkce štítné žlázy probíhalo formou odběrů krve na určení hladin TSH, fT4, anti TPO, anti TG, vyšetření jodurie a taktéž formou kompletního orálního glukózového tolerančního testu (oGTT).
O jódové bilanci v organizmu nás informuje množství jódu v moči neboli jodurie. Vyšetření se provádělo ze vzorku moči nashromážděné za 24 hod metodou in house na fotometrickém přístroji MAX 002 (Diagnostic Products Corporation, Los Angeles, USA), kde fyziologická hranice byla 0,6–2,4 μmol/24 hod (80–100 mg/24 hod). Pacientky byly podrobně poučeny o způsobu sběru, uchování a transportu vzorku.
Hladina TSH v krvi byla měřena na přístroji Immulite 2000 imunochemicky (LEIA) DPC testem na III. generaci TSH (Diagnostic Products Corporation, Los Angeles, USA), kde fyziologické hodnoty byly 0,32–5,0 mIU/l pro netěhotné, u těhotných byla hranice stanovena na 0,3–3,0 mIU/l. Hladiny fT4 v séru byly určeny imunochemicky (LEIA – Diagnostic Products Corporation, Los Angeles, USA), fyziologické rozmezí pro gravidní bylo 10,0–25,0 pmol/l. Kvantitativní stanovení koncentrace protilátek anti TPO i anti TG v séru je založeno na sekvenční imunochemické koncentraci, kde laboratoř uvádí fyziologické hladiny pro anti TG do 100 mIU/l a pro anti TPO do 35 mIU/l. Odběry krve byly provedeny po potvrzení gravidity (I), ve 20. týdnu gravidity (II), čtyři dny po porodu (III) a šest měsíců po porodu (IV) [6,14,15].
Výsledky práce
Do prospektivní longitudinální studie bylo od června 2005 do prosince 2006 náhodným výběrem zařazeno 174 pacientek s potvrzenou vitální graviditou (do 10. týdne gravidity). Pět gravidit skončilo spontánním abortem do 22. týdne, čtyři pacientky se odstěhovaly mimo region a technicky nebylo možné dokončit odběry, ostatní pacientky porodily v rozmezí 38.–41. týdne gravidity.
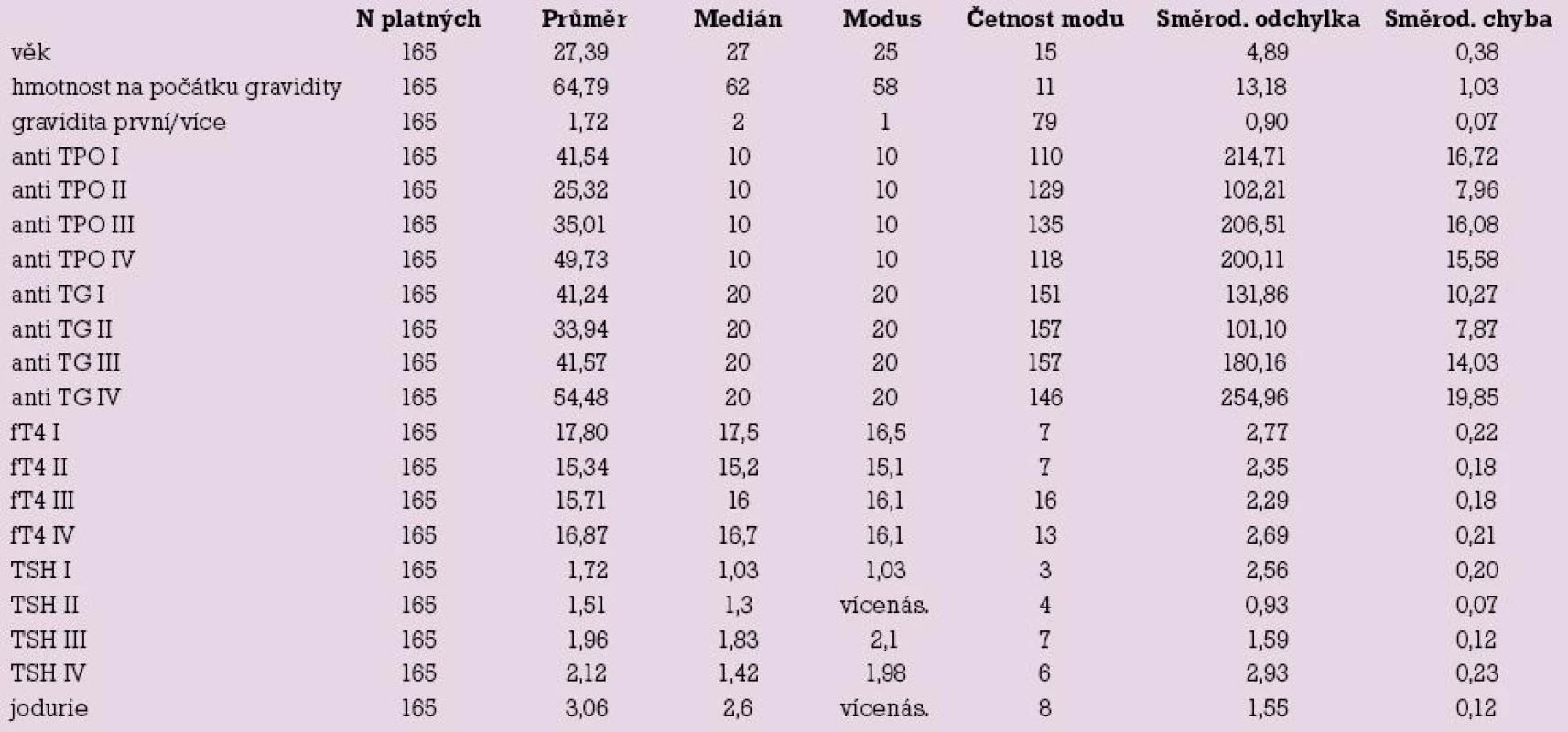
Studii dokončilo 165 (94,8 %) pacientek, průměrný věk byl 27,39 let (17–39 let). Hmotnost pacientek na začátku gravidity byla v průměru 64,79 kg (43–120 kg). 34 (19,5 %) pacientek na počátku gravidity kouřilo cigarety. Sedm pacientek užívalo tyroxin před graviditou.
U pacientek byla zjištěna jodurie o průměrné hodnotě 3,06 μmol/24 hod. Norma je 0,6–2,4 μmol/24 hod. Žádná pacientka neměla méně než 0,6 μmol/24 hod.
Hladiny TSH (I–IV) a fT4 (I–IV) jsou uvedeny v tab. 1.
U 15 (9, l %) pacientek byly zjištěny hladiny TSH (I) nad 3 mIU/l (u 14 pacientek nad 5 mIU/l), ve skupině IV byly u osmi (4,8 %) pacientek nalezeny hladiny TSH nad 5 mIU/l. Tyto pacientky byly referovány k endokrinologovi s diagnózou subklinické či incipientní klinické hypotyreózy, včetně postpartální formy v případě skupiny IV. Alarmující je elevace TSH (nad 5 mIU/l) u čtyř ze sedmi pacientek na substituci euthyroxem před graviditou, což svědčí o nutnosti promptní úpravy dávkování substituce po verifikaci těhotenství.
10,3 % pacientek v rané graviditě mělo hladinu anti TPO vyšší než normu, to přetrvalo u 9,75 % pacientek po porodu. Hladiny anti TG byly zvýšeny na počátku gravidity u 3,03 % pacientek, po porodu počet vzrostl na 3,65 %, viz tab. 2.
2. Počet pacientek (%) se zvýšenými hodnotami TSH, anti TPO a anti TG. 
Diskuze
V graviditě bývá výskyt hypotyreózy až u 5–10 % pacientek a pacientek u 0,5 % hypertyreózy.
Subklinická hypotyreóza, charakterizovaná elevací TSH při fyziologických hodnotách T3 a T4, vychází jednak z karence jódu ve výživě, jednak z probíhající chronické autoimunitní tyroiditidy (hlavně v regionech s dostatečnou jódovou saturací). Autoimunitní záněty při absenci klinických obtíží jsou verifikovány elevací autoprotilátek, nejčastěji proti peroxidáze a tyreoglobulinu. Dalším znakem chronického autoimunitního zánětu je ultrazvukový obraz štítnice s četnými hypoechogenními ložisky ve žláze. Diagnostikovaná neléčená subklinická hypotyreóza je rizikovým faktorem vzniku dyslipoproteinemie s akcelerací aterosklerózy a následnou kardiální dysfunkcí, přechodem do manifestní hypotyreózy a dekompenzací případného diabetu mellitu [7,8].
Hypotyreóza u matky vede v těhotenství častěji k spontánním abortům, anemii, postpartální hemoragii, kardiální dysfunkci, placentární abrupci, maternální hypertenzi a preeklampsii a roste pravděpodobnost ukončení gravidity per sectionem caesaream. Plod hypotyreotické matky je kromě potratu ohrožen předčasným porodem, nízkou porodní hmotností, mrtvorozeností, opožděním neurologického vývoje, encefalopatií a zvýšeným výskytem vrozených vývojových vad [10,11].
Pro neuropsychologický rozvoj plodu je důležitější normální hladina T4 matky v prvním trimestru než hladiny TSH. T4 je potřebné pro ontogeneticky regulovanou generaci T3 v množství důležitém pro optimální rozvoj a diferenciaci mozkových struktur. Architektonický vývoj mozku (neuronální multiplikace, migrace a organizace) v prvém a druhém trimestru koresponduje s hladinami hormonů štítné žlázy matky; další fáze fetálního rozvoje (multiplikace gliálních buněk, migrace a myelinizace) ve třetím trimestru závisí na T4 vytvořených plodem. Z toho vyplývá, že maternální hypotyroidismus i ve II. trimestru může vést ke změnám CNS plodu. Je jednoznačně prokázána souvislost mezi hypotyreózou a komplexem deficitu pozornosti a hyperaktivitou (ADHD), autismem, behaviorálními poruchami, poruchami kognitivních a emocionálních funkcí, poruchami učení a řeči. Také předčasně narozené plody jsou kvůli nezralosti štítnice ohroženy nedostatkem jí produkovaných hormonů; prenatální nedostatek jódu výsledek ještě zhoršuje. Hůře jsou na tom plody, u jejichž matek došlo v prvním trimestru k poklesu T4, než plody s kongenitální hypotyroxinemií, ale adekvátně postnatálně léčené [12].
Hypotyreóza po porodu se nejčastěji objevuje v rámci autoimunitní postpartální tyreoiditidy, která bývá diagnostikována zhruba 3–6 měsíců po porodu. U 90 % pacientek se stav upraví spontánně do jednoho roku. Hypotyreóza nastupuje po krátkém tranzitorním období hypertyreózy, při kterém nacházíme v séru matky elevované hladiny T3 a T4 spolu s poklesem vychytávání jódu štítnou žlázou.
K léčbě hypotyreózy v graviditě využíváme jednak adekvátní substituce jódem ve formě jodidu v dávce 100–200 μg/den, jednak hlavně levothyroxin, což je monosodiová sůl levotočivého izomeru thyroxinu v dávce 2,25 μg/kg tělesné hmotnosti pacientky/den za pečlivého monitorování hladin tyreoidálních hormonů. l–4 % těhotných v období koncepce již užívá T4 medikaci pro poruchu funkce štítné žlázy. U těchto pacientek během gravidity nároky na substituci vzrostou o 20–30 %.
U tyreotoxikózy jsou tkáně vystaveny vyšším hladinám tyroidálních hormonů unikajících buď z poškozené štítnice (tyroiditis), nebo ve zvýšené míře sekretované štítnicí (morbus Graves-Basedow – m. GB), anebo exogenního původu (thyreotoxicosis factitia). Subklinická tyreotoxikóza je rizikovým faktorem pro srdeční arytmie, zvyšují se hladiny markerů kostního obratu s rozvojem osteopenie až osteoporózy, roste riziko rozvoje degenerativních onemocnění CNS (Alzheimerova choroba) a samozřejmě stoupá riziko přechodu do manifestní formy hypertyreózy.
Společným jmenovatelem klinických projevů hyperfunkce štítnice je vystupňovaný metabolizmus a sympatoadrenální reakce, např. termofobie, pocení, nervozita, třes, nespavost, palpitace a nepravidelnosti srdečního rytmu.
Hypertyroidismus v graviditě je nejčastěji způsoben m. GB, pak multinodulárními a solitárními hyperfunkčními uzly štítnice, přechodně autoimunitními a subakutními tyroiditidami a konečně zvýšenými hladinami hCG.
M. GB je definován jako nesupresibilní produkce T4 a T3 v důsledku autoimunitní stimulace tyreocytů, respektive TSH receptorů na tyreocytech. Do skupiny obecně nazývané tyreoideu stimulující imunoglobuliny (TSI) patří zejména TSHrAb, které stimulují TSH receptor. M. GB býval determinován klasickou merseburskou triádou, kam patří exophtalmus, struma a tachykardie. M. GB nejčastěji propukne u těhotné v prvním trimestru a v šestinedělí, ve II. a III. trimestru nastává remise. V graviditě je možné méně závažné formy hypertyreózy jen sledovat bez léčby, protože se upravují samy v těhotenství vlivem alterace imunity. Těžká hypertyreóza se léčí farmaky, vzácně chirurgickým zákrokem [13].
U hypertyreózy plodu se obyčejně objevuje struma, která může být porodní překážkou nebo může vytvářet kompresi trachey. Přes placentu prostupují imunoglobuliny stimulující štítnou žlázu. Ke klinickým známkám hypertyreózy plodu a novorozence patří tachykardie nad 160/min, selhávání srdce, nonimunní hydrops plodu, zvýšená motilita plodu, intrauterinní růstová retardace (IUGR), akcelerovaná kostní maturace, kraniální synostózy, hepatosplenomegalie, prematurita, hyperexcitabilita, periorbitální edém, neprospívání a hypertermie.
Závěr
Sledování funkce štítné žlázy, zejména na počátku gravidity, by se mělo stát obligatorním vyšetřením. Zda toto vyšetření bude vedle standardních fT4 a TSH hladin obsahovat i určení hladiny antityreoidálních protilátek, zejména anti TPO, ukážou až výsledky dlouhodobých studií a jednání mezi gynekologickou a endokrinologickou společností. Zvýšené hladiny TSH již na počátku gravidity mělo 9,1 % pacientek. Štítná žláza matky i plodu je negativně ovlivněna aktivním i pasivním kouřením tabáku. Téměř 20 % kouřících žen v počátku gravidity představuje alarmující číslo a dává prostor pro včasnou osvětu [16,17].
prim. MUDr. Antonín Kořenek
Gynekologicko-porodnické oddělení
Jesenická nemocnice, spol. s r. o.
Sources
1. Maruna P. Gynekologické aspekty poruch štítné žlázy. Přehled. Čes Gynek 2006; 71(4): 332–338.
2. Pop VJ, Vulsma T. Maternal hypothyroxinaemia during (early) gestation. Lancet 2005; 365(9471): 1604–1606.
3. Rebuffat SA, Nguyen B, Robert B et al. Antithyroperoxidase antibody-dependent cytotoxicity in autoimmune thyroid disease. J Clin Endocrinol Metab 2008; 93(3): 929–934.
4. Dosiou C, Sanders GD, Araki SS et al. Screening pregnant women for autoimmune thyroid disease: a cost‑effectiveness analysis. Eur J Endocrinol 2008; 158(6): 841–851.
5. Límanová Z, Potluková E. Význam preventivního vyšetření funkce štítné žlázy v graviditě. Prakt Gyn 2007; 11(3): 120–124.
6. Soldin OP. Thyroid Function Testing in Pregnancy and Thyroid Disease: trimester-specific reference intervals. The Drug Monit 2006; 28(1): 8–11.
7. Casey BM. Subclinical Hypothyroidism and Pregnancy. Obstet Gynecol Surv 2006; 61(6): 415–420.
8. Nanda N, Bobby Z, Hamide A. Association of thyroid stimulating hormone and coronary lipid risk factors with lipid peroxidation in hypothyroidism. Clin Chem Lab Med 2008; 46(5): 674–679.
9. Kohn L, Hari N. Thyrotropin Receptor Autoantibodies (TSHRAbs): Epitopes, Origin and Clinical Significance. Autoimmunity 2003; 36 : 331–337.
10. Glinoer D, Delange F. The potential repercussions of maternal, fetal and neonatal hypothyroxinemia on the progeny. Thyroid 2000; 10(10): 871–887.
11. Matalon S, Sheiner E, Levy A. Relationship of treated maternal hypothyroidism and perinatal outcome. J Reprod Med 2006; 51(1): 56–63.
12. Morreale de Escobar G. Maternal hypothyroxinemia versus hypothyroidism and potential neurodevelopment. Alterations of her offspring. Ann Endocrinol (Paris) 2003; 64(1): 51–52.
13. Glinoer D. Management of hypo ‑ and hyperthyroidism during pregnancy. Growth Horm IGF Res 2003; 13(Suppl A): S45–S54.
14. Ayala A, Wartofsky L. The case for more aggressive screening and treatment of mild thyroid failure. Cleve Clin J Med 2002; 69(6): 313–320.
15. Soldin OP, Tractenberg RE, Hollowell JG et al. Trimester-specific changes in maternal thyroid hormone, thyrotropin, and thyroglobulin concentrations during gestation: trends and associations across trimesters in iodine sufficiency. Thyroid 2004; 14(12): 1084–1090.
16. Wier FA, Farley CL. Clinical Controversies in Screening Women for Thyroid Disorders During Pregnancy. J Midwifery Womens Health 2006; 51(3): 152–158.
17. Bjørn O, Åsvold M, Trine B et al. Tobacco Smoking and Thyroid Function. Arch Intern Med 2007; 167 : 1428–1432.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2009 Issue 3-
All articles in this issue
- Are the caesarian section and birthweight associated with alergies?
- Screening of disturbances of thyroid gland during pregnancy and postpartum
- Malignant tumors of vulva
- Lichen sclerosus.
- Lymfoedema of the upper extremity after breast cancer therapy.
- Antichlamydial antibodies occurrence in men and women.
- Forensic aspects of assisted reproduction within the legislation context of the Czech and Slovak Republics.
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lichen sclerosus.
- Malignant tumors of vulva
- Screening of disturbances of thyroid gland during pregnancy and postpartum
- Forensic aspects of assisted reproduction within the legislation context of the Czech and Slovak Republics.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career