-
Medical journals
- Career
Význam glykokalyxu v chirurgii
Authors: L. Hána 1,3; J. Kočí 2,3; Radek Pohnán 1; D. Řehák 5; D. Astapenko 4,5,6
Authors‘ workplace: Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy a Ústřední vojenské nemocnice – Vojenské fakultní nemocnice Praha, Česká republika 1; Klinika urgentní medicíny, Fakultní nemocnice Hradec Králové, Česká republika 2; Katedra vojenské chirurgie, Vojenská lékařská fakulta Hradec Králové, Univerzita obrany v Brně, Česká republika 3; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové, Česká republika 4; Lékařská fakulta v Hradci Králové, Univerzita Karlova, Česká republika 5; Fakulta zdravotnických studií, Technická univerzita v Liberci, Česká republika 6
Published in: Rozhl. Chir., 2023, roč. 102, č. 12, s. 453-458.
Category: Review
doi: https://doi.org/10.33699/PIS.2023.102.12.453–458Overview
Úvod: Chirurgická léčba je spojena s nežádoucí reakcí organismu na tzv. chirurgické trauma, která je označována jako chirurgický stres. Jednou z jeho základních příčin je ischemicko-reperfuzní poškození tkání, které zahrnuje funkční a strukturální změny v tkáních. Ty vznikají po obnovení průtoku krve po epizodě ischemie. Dochází k nekróze ireverzibilně změněných buněk či otoku tkání vznikajícímu na podkladě endoteliální a mitochondriální dysfunkce.
Metody: Fyziologie, patofyziologie endoteliálního glykokalyxu: Endoteliální glykokalyx je 0,2 až 5 mikrometrů vysoká heteropolysacharidová vrstva pokrývající endotel na jeho intraluminální straně. Páteřními molekulami glykokalyxu jsou proteoglykany, na které se vážou glykoproteiny a glykosaminoglykany. Poškození endoteliálního glykokalyxu bylo dokumentováno u traumatu, u pacientů se septickým šokem, při ischemicko-reperfuzním poškození či při rozsáhlých chirurgických výkonech. Postupy prevence poškození endoteliálního glykokalyxu: Jako prevence ischemicko-reperfuzního poškození tkání byla zkoumána metoda vzdálené prekondice ischemie. Provedené metaanalýzy přínos tohoto postupu v chirurgii ale nepotvrdily. Farmakologicky může být bráněno poškození glykokalyxu látkami, jako jsou antitrombin III, doxycyklin, hydrokortizon, etanercept či dárci oxidu dusnatého. Protektivně na glykokalyx působí také albumin a inhalace vodíku. Protektivní a reparační účinek na glykokalyx vykazuje také sulodexid. Jedná se o proteoglykan působící antitromboticky, fibrinolyticky, hypofibrinogenemicky a lipolyticky. Současná indikace sulodexidu je v léčbě žilních onemocnění, ischemické choroby srdeční a ischemické choroby dolních končetin. Byl prokázán pozitivní efekt sulodexidu na renální poškození při modelování ischemie a reperfuze a na reparaci endotelu po jeho mechanickém poškození.
Závěr: Prostor pro další zkoumání se otevírá směrem k prokázání účinku endotelprotektiv prostřednictvím reparace endoteliálního glykokalyxu při ischemicko-reperfuzním poškození na modelu velkého laboratorního zvířete a také při klinické studii u pacientů podstupujících cévně rekonstrukční výkon.
ÚVOD
Celosvětově je prováděno více než 300 milionů operačních výkonů ročně. Časná pooperační mortalita je 1 až 4 %, morbidita je udávána v rozmezí 14 až 50 % [1]. Chirurgická léčba je spojena s riziky vyplývajícími z reakce organismu na tzv. chirurgické trauma [2]. Odpovědí na chirurgické trauma (incize, manipulace s orgány, mechanické poškození tkání při preparaci, lokální krvácení, ischemie a s ní související reperfuzní poškození) je chirurgický stres [1]. Významně vyšší úrovní stresové reakce organismu jsou zatíženy rozsáhlé (otevřené) operace v břišní chirurgii, v chirurgii cévní, implantace totálních endoprotéz velkých kloubů a kardiochirurgické výkony s použitím mimotělního oběhu [3]. Nižší úroveň stresové reakce naopak vykazují operace miniinvazivní (robotické, laparoskopické) [2]. Stresová reakce organismu se dá rozdělit na odpověď neuroendokrinní, metabolickou, inflamatorní a imunitní [3].
Jednou ze základních příčin chirurgického traumatu je ischemicko-reperfuzní poškození tkání. Ischemicko-reperfuzní poškození zahrnuje funkční a strukturální změny v tkáních, které nastávají po obnovení průtoku krve tkání po epizodě kyslíkové deprivace – ischemie. Toto obnovení průtoku krve, které je často nestejnoměrné, může mít negativní důsledky, jako je nekróza ireverzibilně změněných buněk či otok tkání vznikající na podkladě endoteliální a mitochondriální dysfunkce, která je dále zhoršována nedokonalou perfuzí tkání [4]. Ischemie vede v tkáních k anaerobnímu metabolismu, při kterém je produkováno menší množství ATP, a k selhávání iontových kanálů, které má za důsledek otok buněk a zhoršení enzymatické aktivity v cytoplazmě. Poškození mitochondrií a dysbalance elektrolytů při reperfuzi vedou k oxidativnímu stresu ze 3 systémů: NADPH oxidázový systém, systém syntázy oxidu dusnatého (nitric oxide synthase, NOS) a systém xantinoxidázy. Retence reaktivních forem kyslíku (reactive oxygen species, ROS) vede ke smrti buňky prostřednictvím autofagie, mitoptózy, nekrózy a apoptózy. NOS je hlavním faktorem oxidativního stresu při poškození jater, srdečního svalu či endoteliálních buněk [5]. Endoteliální NOS (eNOS) hraje hlavní úlohu při regulování a udržování funkčního kardiovaskulárního systému [6], ale při hypoxii se podílí na produkci ROS a prohloubení ischemicko-reperfuzního poškození [5].
Struktura a fyziologie endoteliálního glykokalyxu
Všechny buňky lidského těla jsou pokryty denzní vrstvou glykoproteinů a proteoglykanů nazývanou glykokalyx [7]. Struktura glykokalyxu byla objevena a publikována v roce 1966 díky vývoji technologie elektronové mikroskopie [8].
Endoteliální glykokalyx (EG) je heteropolysacharidová vrstva pokrývající endotel na jeho intraluminální straně. Páteřními molekulami glykokalyxu jsou proteoglykany (PG: syndekany, glypikany, perlekan, versikan, dekorin, biglykan, mimekan), které jsou ukotveny k cytoplazmatické membráně endotelu. Na proteoglykany se pak vážou glykosaminoglykany, mezi které patří heparan sulfát (HS), chondroitin sulfát (CS), dermatan sulfát a keratan sulfát. Dalším glykosamoniglykanem je kyselina hyaluronová (HA), která se neváže na proteoglykany, ale přes receptory CD 44 přímo na povrch buňky [9]. Glykoproteinová komponenta je představována molekulami, jako jsou E-selektiny (ES), P-selektiny (PS) či integriny (I) nebo proteinové komplexy se vztahem k dějům hemostázy (glykoprotein Ib-IX-V komplex, který se váže k von Willebrandovu faktoru a P-selektinu a umožňuje interakci trombocytů a aktivovaných endoteliálních buněk. EG má také komponentu solubilní, která je v dynamické rovnováze s plazmou. Solubilní část glykokalyxu je tvořena širokým spektrem molekul produkovaným endotelem nebo přinášených krevním proudem. Tyto molekuly (PM) jsou vázány endoteliálními buňkami nebo jsou včleněny do páteřní sítě glykokalyxu [10]. Výška glykokalyxu je uváděna v rozmezí 0,2 až 5 mikrometrů [11]. Jeho struktura ve vztahu k intracelulárnímu (IC) a extracelulárnímu prostoru (EC) je schematicky zobrazena na Obr. 1.
Endoteliální glykokalyx není prostou součástí bariéry mezi intracelulárním a extracelulárním prostorem, ale má řadu důležitých funkcí v mikrocirkulaci: mechanotransdukce (fyzikální působení krevních elementů, které glykokalyx přenáší na endotel), koagulace (váže antitrombin III či proteinové komplexy se vztahem k hemostáze), imunitní dohled (imunoglobuliny, integriny, selektiny), antioxidace (superoxiddismutáza) a interakce se sérovými proteiny (albumin – struktura glykokalyxu získává onkotický gradient) a s natriem (ovlivňuje hydrataci, náboj a tuhost glykokalyxu) [12].
Image 1. Struktura endoteliálního glykokalyxu Fig. 1: Endothelial glycocalyx structure 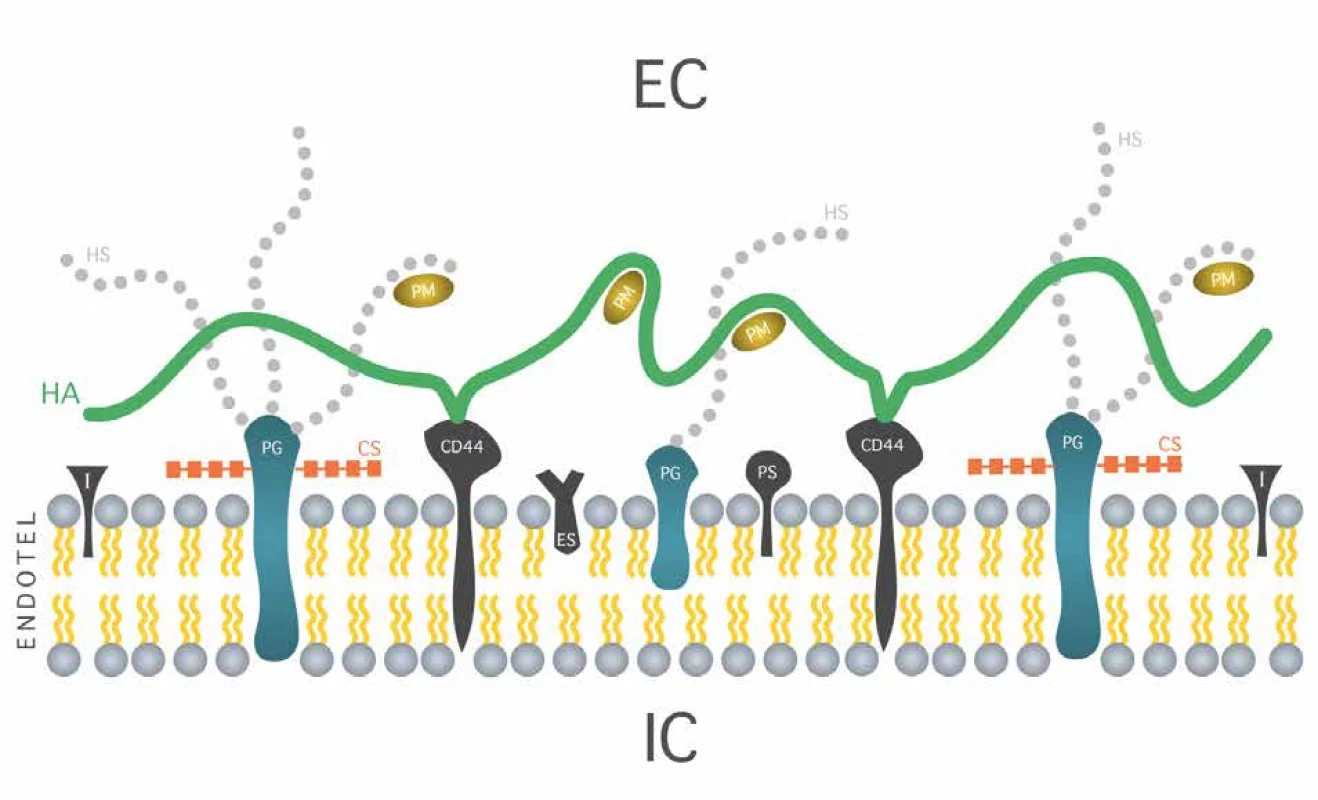
EC – extracelulární prostor, IC – intracelulární prostor, HS – heparansulfát, CS – chondroitinsulfát, HA – hyaluronová kyselina, ES – E-selektin, PS – P-selektin, I – integrin, PM – plazmatické molekuly.
EC – extracellular space; IC – intracellular space; HS – heparan sulfate; CS – chondroitin sulfate; HA – hyaluronic acid; ES – E-selectin; PS – P-selectin; I – integrin; PM – plasma molecules.Patofyziologie endoteliálního glykokalyxu
V patofyziologii EG byl prokázán vztah poškození glykokalyxu a traumatu. U závažně poraněných pacientů s hemoragickým šokem se rozvíjí tzv.„endotheliopathy of trauma“ (endoteliální dysfunkce, systémová zánětlivá reakce a koagulopatie). K poškození EG dochází časně po poranění a toto poškození se uplatňuje v patogenezi multiorgánového selhávání, které vede ke špatným výsledkům přežití polytraumatizovaných pacientů [13]. Byl také prokázán vztah mezi poškozením EG a septickým šokem, kdy je EG poškozován přímým působením heparanázy, matrix metaloproteináz (MMPs), tzv. a disintegrin and metalloproteinase (ADAMs) a také působením TNF-α [14]. Poškození EG bylo dokumentováno rovněž při ischemicko-reperfuzním poškození, a to jak při celotělové ischemii (např. při kardiogenním šoku), tak i při orgánově izolované ischemii a následné reperfuzi (renální, kardiální, jaterní, plicní či při transplantacích orgánů). U všech těchto stavů byly dokumentovány zvýšené plazmatické hladiny syndekanu-1 a heparan sulfátu – produktů degradace glykokalyxu. K poškození EG vedou i chronické stavy, jako je ateroskleróza, hypertenze a diabetes mellitus [15]. Při zkoumání vztahu poškození glykokalyxu a chirurgických výkonů byl tento vztah prokázán u výkonů hepato-pankreato-biliární chirurgie, naopak u výkonů gynekologických či obecně laparoskopických tento vztah prokázán nebyl [16]. Poškození glykokalyxu bylo dokumentováno při kardiochirurgických výkonech [17] a na malém souboru pacientů i v cévní chirurgii (operace pro infrarenálně uložené aneurysma abdominální aorty) [18].
Při in vitro experimentech s endoteliálními buňkami lidské umbilikální žíly (human umbilical vein entothelial cell, HUVEC) bylo prokázáno uspořádání první funkční vrstvy EG již po 24 hodinách [19]. Spontánní reparace EG do plné výšky je zřejmě pomalejší. Studie provedené na animálních modelech prokazují obnovení glykokalyxu do původního rozsahu až po 7 dnech. V literatuře není k dispozici dostatečná evidence pro časový průběh degradace a obnovení glykokalyxu v perioperačním období. U kardiochirurgických výkonů klesá plazmatická hladina produktů degradace glykokalyxu k normálu 24 hodin po operaci; hladina syndekanu 1 či heparan sulfátu se nedá považovat na spolehlivý marker regenerace glykokalyxu. Signifikantní je pouze vzestup sérových koncentrací uvedených molekul při jeho degradaci [20]. Uvedený stav dává příležitost zkoumání možností protekce či zrychlení obnovování glykokalyxu.
Postupy prevence poškození endoteliálního glykokalyxu
Prekondice ischemicko-reperfuzního poškození
Prekondice ischemicko-reperfuzního poškození je postup, při kterém krátké epizody ischemie a reperfuze navodí ochranné a adaptační mechanismy v tkáni, která je následně vystavena další (a často delší) ischemii a reperfuzi [21]. Tento princip byl poprvé publikován v polovině 80. let 20. století [22]. Následně byly prezentovány studie prováděné na animálních modelech popisující prekondici ischemie různých tkání (myokard, kosterní svalstvo, ledviny, játra) [21]. V roce 1993 byl poprvé publikován princip tzv. vzdálené prekondice ischemie (remote ischaemic preconditioning, RIPC), při kterém vzniká ochrana před ischemicko-reperfuzním poškozením tkání i ve vzdálených tkáních, které byly vystaveny iniciální krátké ischemii a reperfuzi [23]. V transplantační medicíně byl prokázán pozitivní efekt RIPC na prodloužení funkce štěpu u transplantovaných ledvin od žijícího dárce [24]. Provedené metaanalýzy však přínos principu RIPC v chirurgii obecně nepotvrzují. U pacientů, kteří podstoupili kardiochirurgický zákrok s použitím mimotělního oběhu, se neprokázalo snížení morbidity či mortality při použití principu RIPC [25]. Podobně metaanalýza prací zabývajících se použitím RIPC při rozsáhlých výkonech v cévní chirurgii či při endovaskulární léčbě neprokázala významný rozdíl proti skupině bez použití RIPC v perioperační mortalitě, ve výskytu infarktu myokardu, renální insuficience a cévních mozkových příhod. Neprokázala ani rozdíl v délce hospitalizace, v délce operačního času či v riziku ztráty končetiny [26]. Metaanalýza prací zabývajících se porovnáním operačních výkonů při vyloučení kardiochirurgických a cévních výkonů, při kterých byla použita RIPC, proti výkonům, u kterých RIPC použita nebyla, rovněž neprokázala významný rozdíl v morbiditě, v délce hospitalizace či v parametrech dokumentujících kardiální, respirační, renální či jaterní dysfunkci [27].
Farmakologické ovlivnění degradace endoteliálního glykokalyxu
V odborné literatuře byly publikovány práce dokumentující pozitivní účinek různých látek, které se uplatňují v prevenci poškození glykokalyxu. Mezi tyto látky jsou řazeny antioxidanty, antitrombin III, doxycyklin, hydrokortizon, etanercept (analog TNF-α) či dárci oxidu dusnatého. U antitrombinu III a hydrokortizonu bylo na modelu malého laboratorního zvířete popsáno snížení postischemické degradace EG a snížení intersticiálního edému v porovnání s kontrolní skupinou [28,29]. U doxycyklinu bylo u pacientů, kterým byl proveden kardiopulmonální bypass, dokumentováno snížení degradace EG způsobené snížením metaloproteináz [30]. Etanercept podaný před podáním endotoxinu dobrovolníkům způsobil snížení degradace EG cestou inhibice TNF-α [31]. Na modelu ischemie a reperfuze izolovaného srdce malého laboratorního zvířete byl prokázán protektivní vliv oxidu dusnatého na EG, bylo dokumentováno snížení intersticiálního edému a porušení cévní stěny koronárních arterií [32]. U uvedených molekul nebyl účinek dokumentovaný in vitro či in vivo na animálním modelu převeden do reálné praxe. Podobně také in vitro prokázaný pozitivní účinek doplňování stavebních kamenů glykokalyxu (heparan sulfát a hyaluronová kyselina) nebyl prokázán in vivo na modelu sepse [20].
Zkoumána byla také role plazmatických proteinů (např. albuminu) v ochraně glykokalyxu. Albumin se váže na glykokalyx a zajišťuje tím stabilitu konstrukce endoteliální vrstvy. Dále přenáší sfingozin-1-fosfát, který má protektivní účinek na endotel, působí jako vychytávač volných radikálů a má imunomodulační a protizánětlivý efekt. Albumin má své uplatnění při léčbě septických pacientů, u pacientů léčených pro závažné popáleniny či v určitých případech jaterní nedostatečnosti. Předpokládá se souvislost pozitivního účinku použití albuminu a obnovení funkce poškozeného glykokalyxu [33].
Na animálním modelu hemoragického šoku a resuscitace byl prokázán pozitivní účinek inhalace vodíku. Bylo dokumentováno menší poškození glykokalyxu, časnější stabilizace hemodynamických ukazatelů a vyšší krátkodobé přežití. Mechanismus účinku molekuly vodíku je zřejmě dán její antioxidační ochranou, není závislý na aktivitě xantinoxidoreduktázy, potlačuje ale uvolňování TNF-α a tím omezuje degradaci glykokalyxu a působí jako prevence endoteliální dysfunkce [34].
Další látkou, u které jsou zkoumány její účinky na EG, je sulodexid. Sulodexid je proteoglykan skládající se ze středněmolekulárního heparinu a dermatansulfátu v poměru 4 : 1. Sulodexid, resp. zejména jeho heparinová složka, působí antitromboticky (inhibicí faktoru Xa prostřednictvím aktivace antitrombinu III) a fibrinolyticky (stimulací uvolňování tkáňového aktivátoru plazminogenu a snížením hladiny inverzně působícího inhibitoru aktivátoru plazminogenu). Dermatan ovlivňuje uvolňování prostacyklinu a ovlivňuje heparinový kofaktor II, který zprostředkovává antikoagulační účinek. Dermatansulfát také stimuluje fibrinolýzu podobným mechanismem jako heparinová složka (stimulace uvolňování tkáňového aktivátoru plazminogenu a inhibice inhibitoru aktivátoru plazminogenu). Sulodexid vykazuje také účinek hypofibrinogenemický a lipolytický (aktivace lipoproteinové lipázy). Oba tyto účinky se podílejí na snížení viskozity plazmy [35, 36]. V současné době je indikováno použití sulodexidu v léčbě chorob žilního systému, jako jsou žilní trombóza a posttrombotický syndrom. Byl prokázán také jeho pozitivní efekt při léčbě chronické žilní insuficience [37]. Další indikací sulodexidu jsou onemocnění tepenného systému (ischemická choroba srdeční a ischemická choroba dolních končetin). Při léčbě ischemické choroby dolních končetin sulodexidem bylo prokázáno zlepšení hodnot ankle-brachial indexu a prodloužení klaudikačního intervalu [38]. Dalšími indikacemi pro použití sulodexidu je také léčba diabetické mikroangiopatie i makroangiopatie, neurologické cévní poruchy či prevence makulární degenerace.
Recentní výzkumné úsilí směřuje k prokázání protektivního a reparačního účinku sulodexidu na endotel. Na animálním modelu byl prokázán pozitivní efekt sulodexidu na renální poškození při modelování ischemicko-reperfuzního poškození. Zlepšení renální dysfunkce bylo doprovázeno snížením oxidativního stresu, zánětlivé reakce, buněčné apoptózy a aktivací antitrombinu III [39]. V dalším experimentu (poranění krkavice balonem u malého laboratorního zvířete) byl prokázán pozitivní efekt sulodexidu na reparaci endotelu prostřednictvím rekonstrukce glykokalyxu. Elektronmikroskopicky bylo prokázáno, že podávání sulodexidu 7 dní po poranění karotidy může rekonstruovat EG. Sulodexid také zvýšil množství NOS, snížil endoteliální hyperplazii a inhiboval agregaci trombocytů. Při použití sulodexidu byly také dokumentovány nižší hodnoty markerů zánětu a byl prokázán pozitivní vliv na dyslipidemii [40]. Přehledně jsou farmaka působící protektivně na EG uvedena v Tab. 1.
Tab. 1: Látky působící protektivně na endoteliální glykokalyx
Tab. 1: Agents with a protective effect on the endothelial glycocalyx
Léčivo/molekula
Model/Pacient
Efekt
Citace č.
Antitrombin III
malé laboratorní zvíře
udržení cévní bariéry, snížení intersticiálního edému
28
Doxycyklin
randomizovaná studie
snížení degradace EG inhibicí metaloproteináz
30
Hydrokortison
malé laboratorní zvíře
udržení cévní bariéry, snížení intersticiálního edému
29
Etanercept
pacienti, resp. dobrovolníci
snížení degradace EG cestou inhibice TNF alfa
31
Dárci oxidu dusnatého
srdce malého laboratorního zvířete
udržení cévní bariéry, snížení intersticiálního edému
32
Heparan sulfát
a hyaluronová kyselina
malé laboratorní zvíře
rekonstrukce struktury EG
20
Albumin
malé laboratorní zvíře
stabilita endotelu, vychytávač volných radikálů
33
Vodík
malé laboratorní zvíře
antioxidační ochrana, inhibice uvolňování TNF alfa
34
Sulodexid
malé laboratorní zvíře
rekonstrukce EG, snížení oxidativního stresu, zvýšení NOS
39, 40
ZÁVĚR
Recentní výzkumy přinášejí příslib pozitivního efektu endotelprotektiv na prevenci ischemicko-reperfuzního poškození. Prostor pro další zkoumání se otevírá směrem k zavedení uvedených léčiv do běžné praxe prokázáním jejich účinku na endotel prostřednictvím reparace EG při ischemicko-reperfuzním poškození na modelu velkého laboratorního zvířete a také při klinické studii u pacientů podstupujících cévně rekonstrukční výkon.
Podpořeno MO 1012. Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vzni-
kem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Luděk Hána, MBA
Chirurgická klinika 2. LF UK a ÚVN
e-mail: ludek.hana@uvn.cz
ORCID: 0000-0003-0348-2298
Sources
- Dobson GP. Trauma of major surgery: A global problem that is not going away. International Journal of Surgery 2020;81 : 47–54. doi:10.1016/j.ijsu.2020.07.017.
- Máca J, Peteja M, Reimer P, et al. Surgical injury: comparing open surgery and laparoscopy by markers of tissue damage. Ther Clin Risk Manag. 2018;14 : 999–1006. doi:10.2147/TCRM.S153359.
- Cusack B, Buggy DJ. Anaesthesia, analgesia, and the surgical stress response. BJA Educ. 2020;20(9):321–328. doi:10.1016/j. bjae.2020.04.006.
- Soares ROS, Losada DM, Jordani MC, et al. Ischemia/reperfusion injury revisited: An overview of the latest pharmacological strategies. Int J Mol Sci. 2019;20(20):5034. doi:10.3390/ijms20205034.
- Wu MY, Yiang GT, Liao WT, et al. Current mechanistic concepts in ischemia and reperfusion injury. Cellular Physiology and Biochemistry 2018;46(4):1650–1667. doi:10.1159/000489241.
- Garcia V, Sessa WC. Endothelial NOS: perspective and recent developments. Br J Pharmacol. 2019;176(2):189–196. doi:10.1111/bph.14522.
- Möckl L. The emerging role of the mammalian glycocalyx in functional membrane organization and immune system regulation. Front Cell Dev Biol. 2020;8. doi:10.3389/fcell.2020.00253.
- Luft JH. Fine structures of capillary and endocapillary layer as revealed by ruthenium red. Fed Proc. 1966;25(6):1773 – 1783.
- Reitsma S, Slaaf DW, Vink H, et al. The endothelial glycocalyx: composition, functions, and visualization. Pflugers Arch. 2007;454(3):345–359. doi:10.1007/ s00424-007-0212-8.
- Fernández-Sarmiento J, Salazar-Peláez LM, Carcillo JA. The endothelial glycocalyx. Pediatric Critical Care Medicine 2020;21(5):e291–e300. doi:10.1097/PCC.0000000000002266.
- Hahn RG, Patel V, Dull RO. Human glycocalyx shedding: Systematic review and critical appraisal. Acta Anaesthesiol Scand. 2021;65(5):590–606. doi:10.1111/ aas.13797.
- Astapenko D, Benes J, Pouska J, et al. Endothelial glycocalyx in acute care surgery – what anaesthesiologists need to know for clinical practice. BMC Anesthesiol. 2019;19(1):238. doi:10.1186/s12871-019-0896-2.
- Barry M, Pati S. Targeting repair of the vascular endothelium and glycocalyx after traumatic injury with plasma and platelet resuscitation. Matrix Biol Plus 2022;14 : 100107. doi:10.1016/j.mbplus.2022.100107.
- Sullivan RC, Rockstrom MD, Schmidt EP, et al. Endothelial glycocalyx degradation during sepsis: Causes and consequences. Matrix Biol Plus 2021;12 : 100094. doi:10.1016/j.mbplus.2021.100094.
- Abassi Z, Armaly Z, Heyman SN, et al. Glycocalyx degradation in ischemia-reperfusion injury. Am J Pathol. 2020;190(4): 752–767. doi:10.1016/j.ajpath.2019.08.019.
- Yanase F, Naorungroj T, Bellomo R. Glycocalyx damage biomarkers in healthy controls, abdominal surgery, and sepsis: a scoping review. Biomarkers 2020; 25(6):425–435. doi:10.1080/1354750X.2020.1787518.
- Passov A, Schramko A, Salminen US, et al. Endothelial glycocalyx during early reperfusion in patients undergoing cardiac surgery. PLoS One 2021; 16(5):e0251747. doi:10.1371/journal.pone. 0251747.
- Rehm M, Bruegger D, Christ F, et al. Shedding of the endothelial glycocalyx in patients undergoing major vascular surgery with global and regional ischemia. Circulation 2007;116(17): 1896–1906. doi:10.1161/CIRCULATIONA-HA. 106.684852.
- Lindner M, Laporte A, Elomaa L, et al. Flow-induced glycocalyx formation and cell alignment of HUVECs compared to iPSC-derived ECs for tissue engineering applications. Front Cell Dev Biol. 2022;10. doi:10.3389/fcell.2022.953062.
- Song JW, Goligorsky MS. Perioperative implication of the endothelial glycocalyx. Korean J Anesthesiol. 2018;71(2):92–102. doi:10.4097/kjae.2018.71.2.92.
- Wang WZ. Investigation of reperfusion injury and ischemic preconditioning in microsurgery. Microsurgery 2009;29(1):72–79. doi:10.1002/micr.20587.
- Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation 1986;74(5):1124–1136. doi:10.1161/01.CIR.74.5.1124.
- Przyklenk K, Bauer B, Ovize M, et al. Regional ischemic “preconditioning” protects remote virgin myocardium from subsequent sustained coronary occlusion. Circulation 1993;87(3):893–899. doi:10.1161/01.CIR.87.3.893.
- Veighey K V, Nicholas JM, Clayton T, et al. Early remote ischaemic preconditioning leads to sustained improvement in allograft function after live donor kidney transplantation: long-term outcomes in the REnal protection against ischaemia – reperfusion in transplantation (REPAIR) randomised trial. Br J Anaesth. 2019;123(5):584–591. doi:10.1016/j.bja.2019.07.019.
- Pierce B, Bole I, Patel V, et al. Clinical outcomes of remote ischemic preconditioning prior to cardiac surgery: A meta ‐ analysis of randomized controlled trials. J Am Heart Assoc. 2017;6(2). doi:10.1161/ JAHA.116.004666.
- Liang F, Liu S, Liu G, et al. Remote ischaemic preconditioning versus no remote ischaemic preconditioning for vascular and endovascular surgical procedures. Cochrane Database of Systematic Reviews 2023;2023(1). doi:10.1002/ 14651858.CD008472.pub3.
- Papadopoulou A, Dickinson M, Samuels TL, et al. Efficacy of remote ischaemic preconditioning on outcomes following non-cardiac non-vascular surgery: a systematic review and meta-analysis. Perioperative Medicine 2023;12(1):9. doi:10.1186/s13741-023-00297-0.
- Chappell D, Jacob M, Hofmann-Kiefer K, et al. Antithrombin reduces shedding of the endothelial glycocalyx following ischaemia/reperfusion. Cardiovasc Res. 2009;83(2):388–396. doi:10.1093/cvr/cvp097.
- Chappell D, Jacob M, Hofmann-Kiefer K, et al. Hydrocortisone preserves the vascular barrier by protecting the endothelial glycocalyx. Anesthesiology. 2007;107(5):776–784. doi:10.1097/01.anes.0000286984.39328.96.
- Gao W, Fang F, Xia TJ, et al. Doxycycline can reduce glycocalyx shedding by inhibiting matrix metalloproteinases in patients undergoing cardiopulmonary bypass: A randomized controlled trial. Microvasc Res. 2022;142 : 104381. doi:10.1016/j.mvr.2022.104381.
- Nieuwdorp M, Meuwese MC, Mooij HL, et al. Tumor necrosis factor-alpha inhibition protects against endotoxin-induced endothelial glycocalyx perturbation. Atherosclerosis 2009;202(1): 296–303. doi:10.1016/j.atherosclerosis.2008.03.024.
- Bruegger D, Rehm M, Jacob M, et al. Exogenous nitric oxide requires an endothelial glycocalyx to prevent postischemic coronary vascular leak in guinea pig hearts. Crit Care 2008;12(3):R73. doi:10.1186/ cc6913.
- Aldecoa C, Llau JV, Nuvials X, et al. Role of albumin in the preservation of endothelial glycocalyx integrity and the microcirculation: a review. Ann Intensive Care 2020;10(1):85. doi:10.1186/s13613-020-00697-1.
- Tamura T, Sano M, Matsuoka T, et al. Hydrogen gas inhalation attenuates endothelial glycocalyx damage and stabilizes hemodynamics in a rat hemorrhagic shock model. Shock 2020;54(3):377–385. doi:10.1097/SHK.0000000000001459.
- Harenberg J. Review of pharmacodynamics, pharmacokinetics, and therapeutic properites of sulodexide. Med Res Rev. 1998;18(1):1–20. doi:10.1002/(SICI)1098-1128(199801)18 : 1<1:AID-MED1>3.0. CO;2-4.
- Hoppensteadt DA, Fareed J. Pharmacological profile of sulodexide. Int Angiol. 2014;33(3):229–235.
- Bignamini AA, Matuška J. Sulodexide for the symptoms and signs of chronic venous disease: A systematic review and meta-analysis. Adv Ther. 2020;37 (3):1013–1033. doi:10.1007/s12325-020-01232-1.
- Lasierra-Cirujeda J. Use of sulodexide in patients with peripheral vascular disease. J Blood Med. Online 2010 June;105. doi:10.2147/JBM.S10558.
- Yin J, Chen W, Ma F, et al. Sulodexide pretreatment attenuates renal ischemia-reperfusion injury in rats. Oncotarget 2017;8(6):9986–9995. doi:10.18632/oncotarget.14309.
- Li T, Liu X, Zhao Z, et al. Sulodexide recovers endothelial function through reconstructing glycocalyx in the balloon-injury rat carotid artery model. Oncotarget 2017;8(53):91350–91361. doi:10.18632/oncotarget.20518.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2023 Issue 12
Most read in this issue- Bosworthova zlomenina hlezna − současný stav
- Robotická resekce rekta – v čem spočívají její výhody?
- Gastrinom duodena − kazuistika
- Význam glykokalyxu v chirurgii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

