-
Medical journals
- Career
Vlastný operačný postup v konštrukcii posuvného endorektálneho laloku v chirurgickej terapii komplexných análnych fistúl (osemnásťročné skúsenosti)
Authors: J. Korček; A. Lazorišák; T. Jankovič
Published in: Rozhl. Chir., 2023, roč. 102, č. 10, s. 387-394.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2023.102.10.387–394Overview
Úvod: Análna fistula je častým ochorením s incidenciou 5,6 na 100 000 žien a 12,3 mužov. Najčastejšie je kryptoglandulárneho pôvodu. Cieľom tejto štúdie je zhodnotiť naše skúseností s pacientmi liečenými pre komplexné análne fistuly vlastným komplexným operačným výkonom s posuvným endorektálnym lalokom.
Metódy: Do štúdie sme zaradili 524 pacientov s komplexými análnymi fistulami, ktorí boli odoslaní na našu chirurgickú kliniku od januára 2005 do konca decembra 2022. Diagnózu sme stanovili detekciou traktu fistuly fyzikálnym vyšetrením, anoskopiou, sondážou traktu fistuly a endorektálnou ultrasonografiou. Komplexný operačný výkon spolu s konštrukciou Posuvného endorektálneho laloku vo vlastnej modifkácii sme realizovali u všetkých pacientov.
Výsledky: Primárna operačná intervencia v súbore 326 pacientov s komplexnými análnymi fistulami (bez pacientov s morbus Crohn) bola úspešná u 283 (87 %) pacientov. Defekt posuvného endorektálneho laloku v pooperačnom období sme identifikovali u 17 (5,2 %) pacientov, soiling u 16 (4,9 %) a inkontinenciu pre flatus u 9 (2,7 %) pacientov. V súbore 120 pacientov po viacerých operačných výkonoch (bez pacientov s morbus Crohn) bol náš operačný postup úspešný u 92 (76,6 %) pacientov. Defekt posuvného endorektálneho laloku sme v pooperačnom období identifikovali u 6 (5 %) pacientov, soiling u 8 (6,6 %) a inkontinenciu pre flatus u 3 (2,5 %) pacientov.
Záver: Konštrukcia posuvného endorektálneho laloku bola kuratívna a bez ovplyvnenia úrovne análnej kontinencie u 87 % pacientov po primárnej operačnej intervencii a u 76,6 % po viacerých operačných výkonoch. Komplexný operačný výkon s konštrukciou posuvného endorektálneho laloku podľa nášho postupu zachováva funkciu sfinkterov a má relatívne nízke percento recidív. Počet predchádzajúcich operačných intervencií nemal žiadny vplyv na úroveň análnej kontinencie.
Klíčová slova:
posuvný endorektálny lalok – komplexná análna fistula – rekonštrukcia mm. sphincteris ani externi
ÚVOD
Análna fistula (AF) je bežné ochorenie s incidenciou 5,6 na 100 000 obyvateľov ženského pohlavia a 12,3 na 100 000 obyvateľov mužského pohlavia a vyskytuje sa prevažne v tretej a v štvrtej dekáde života. Väčšina prípadov je kryptoglandulárneho pôvodu [1,2]. Radikálna excízia traktu fistuly s následnou konštrukciou posuvnéhoendorektálneho laloku (PEL) je osvedčenou chirurgickou terapiou pre komplexné análne fistuly (KAF). Výsledok opakovanej operačnej intervencie pri nezhojení a/alebo recidíve primárneho ochorenia je stále predmetom viacerých klinických štúdií [3,4,5]. Hoci hlavným cieľom liečby KAF je eradikácia fistuly, veľmi dôležité je zachovanie análnej kontinencie, minimalizovanie peroperačných a pooperačných komplikácií a minimalizovanie rizika vzniku recidívy. KAF sú vysoké transsfinkterické, suprasfinkterické a extrasfinkterické AF. Trakt KAF prechádza vyššie ako je 30−50 % hmoty svalovej vrstvy mm. sphincteris ani externi. Medzi KAF zaraďujeme aj análne fistuly (AF) u žien na prednom obvode perinea s viacerými traktami a s jedným, alebo s viacerými vonkajšími ústiami a súčasne i pacientov s KAF po iradiácii a s morbus Crohn [2]. V súčasnosti má chirurg k dispozícii niekoľko chirurgických možností v chirurgickej terapii KAF vrátane fistulektómie [4,5], konštrukcie PEL, aplikácie fibrínového lepidla [6,7], anal fistula plug [8], aplikácie setonu [9,10,11,12,13], laser deštrukcie, prerušenia traktu fistuly v jej intersfinkterickom priebehu (LIFT) [14,15] a i videom asistovaný operačný postup (VAAFT). Cieľom našej retrospektívnej štúdie bolo preskúmať výsledky nášho operačného postupu u pacientov s KAF kryptoglandulárneho pôvodu, u ktorých sme vykonali radikálnu excíziu traktu AF s excíziou vonkajšieho ústia v kombinácii s resekciou steny canalis analis (v rozsahu mukózy a submukózy) spolu s vnútorným ústim AF, s resekciou mm. sphincteris ani externi po oboch stranách excidovaného traktu fistuly s konštrukciou a fixáciou PEL a so súčasnou rekonštrukciou mm. sphincteris ani externi.
METÓDY
Do našej retrospektívnej štúdie sme zaradili 524 pacientov s KAF, ktorí sa podrobili kombinovanej operačnej intervencii s konštrukciou PEL na našej klinike v období od januára 2005 do decembra 2022. V našom súbore bolo 412 mužov a 112 žien s priemerným vekom 37,5 roka, s krajnými hodnotami 24−65 rokov. Všetci pacienti boli v predoperačnom období fyzikálne vyšetrený chirurgom s dlhoročnými skúsenosťami v proktológii. Mali realizovanú anoskopiu a sondáž traktu fistuly kovovou sondou v špecializovanej ambulancii pre chirurgické ochorenia hrubého čreva a konečníka na našej chirurgickej klinike. Každý pacient mal realizované kolonoskopické vyšetrenie a následne endoanálnu ultrasonografiu (EUS). Prostredníctvom EUS sme lokalizovali trakt AF, jeho priebeh a vzťah traktu fistuly ku mm. sphincteris ani externi a m. puborectalis. EUS vyšetrenie nám predoperačne umožnilo zhodnotiť rozsah aj lokalizáciu pozápalových zmien perianálnych a perirektálnych tkanív. Fistulografiu a magnetickú rezonanciu panvového dna sme realizovali len v prípade pochybností o správnom diagnostickom závere po realizovaných štandardných vyšetreniach. V súbore 524 pacientov s KAF sme identifikovali 446 pacientov s kryptogolandulárnou etiológiou vzniku KAF a 78 pacientov s m.Crohn (Graf 1). Pri rozdelení podľa druhu KAF sme zaznamenali 392 pacientov s vysokou transsfinkterickou fistulou, 84 pacientov so suprasfinkterickou a 48 s extrasfinkterickou AF (Graf 2).
Graf 1: Súbor 524 pacientov s komplex análnymi fistulami Rozdelenie podľa etiológie: december 2005−január 2023
− zelená farba − morbus Crohn, modrá farba – kryptoglandulárna.
Graph 1: Set of 524 patients with complex fistula-in-ano Division according to aetiology: December 2005−January 2023
– green colour − Crohn dissease, blue colour – cryptoglandular.
Graf 2 : Súbor 524 pacientov s komplex análnymi fistulami Rozdelenie podľa druhu fistúl: december 2005−január 2023, zelená farba − suprasfinkterická, modrá farba − extrasphinkterická, oranžová farba − vysoká transsfinkterická.
Graph 2 : Set of 524 patients with complex fistula-in-anoAllocation by types of fistulas: December 2005−January 2023, green colour − suprasphincteric, blue colour − extrasphincteric,orange colour − high transsphincteric.Operačný postup
Príprava pred operačnou intervenciou:
Dva dni pred operačnou intervenciou pacienti prijímali perorálne tekutú stravu. 24 hodín pred operačnou intervenciou absolvovali všetci pacienti ortográdnu laváž kolonu a rekta. Ráno v deň operačnej intervencie sme pacientom podali vysoké klyzma. Hodinu pred operačným výkonom sme v rámci antibiotickej profylaxie aplikovali pacientom Axetine 1,5 g (Medochemie Ltd. Cyprus) + Metronidazol 500 mg ( B.Braun medical s.r.o., SR) i.v. Pacienti boli operovaný v celkovej, alebo v regionálnej anestéze. Poloha pacienta počas operačnej intervencie závisela od lokalizácie vonkajšieho ústia KAF. Ak vonkajšie ústie bolo na prednom obvode perinea, pacient bol v Jackknife polohe, ak bolo na zadnom obvode, pacient bol v modifikovanej Litotomickej polohe.
Všetkým pacientom z nášho súboru s KAF sme vykonali na kovovej sonde zavedenej do traktu fistuly excíziu vonkajšieho ústia fistuly a kompletnú excíziu traktu fistuly prebiehajúceho transsfinktericky aj s excíziou mm. sphincteris ani externi po oboch stranách pôvodného traktu fistuly v rozsahu najmenej po 5 mm (Obr. 1) (Obr. 2). Na zavedenej paličkovej kovovej sonde sme identifikovali vnútorné ústie AF (Obr. 3) (Obr. 4). Ak sme neboli schopní identifikovať vnútorné ústie, aplikovali sme do traktu fistuly peroxid vodíka. Disekovali sme mukózu canalis analis spolu so submukózou v polovici obvodu canalis analis aj s vnútorným ústim fistuly. Následne sme vytvorili PEL v tvare oblého širokého romboidu (Obr. 5). Resekovali sme deliberovanú časť steny canalis analis spolu s vnútorným ústim AF. PEL sme fixovali jednotlivými stehmi, a to tak, že priečna časť sutury bola lokalizovaná intraanálne (Obr. 6). Po excízii mm. sphincteris ani externi z oboch strán pôvodného defektu po excízii traktu KAF sme jednotlivými matracovými stehmi, vstrebateľným šijacím materiálom vykonali rekonštrukciu mm. sphincteris ani externi (Obr. 7). Zrekonštruovali sme mäkké tkanivá perinea a zaviedli sme kapilárny drén do podkožia a drén do perinea, ktorý sme vyviedli mimo operačný prístup (Obr. 8). Prvý pooperačný deň sme vykonali preväz perinea. Perorálny príjem tekutín mal pacient povolený od druhého pooperačného dňa a od tretieho pooperačného dňa sa pacient stravoval. Po ukončení krátkodobej antibiotickej profylaxie sme pacientom aplikovali intravenózne cefalosporíny II. generácie v kombinácii s Metronidazolom (B.Braun medical s.r.o., SR). Nízkomolekulárny heparin sme pacientom aplikovali od prvého pooperačného dňa. Zavedený drén do perinea sme odstraňovali na tretí pooperačný deň. Na šiesty pooperačný deň sme pacientov prepustili do ambulantnej starostlivosti (Obr. 9) s následnými pravidelnými kontrolami v špecializovanej ambulancii na našej klinike.
Obr. 1: Sondáž traktu fistuly (pacient J.P.) − vlastný klinický materiál
Fig. 1: Detection of the fistula track (patient J.P.) – own clinical materialObr. 2: Kompletná excízia traktu fistuly (pacient J.P.) − vlastný klinický materiál
Fig. 2: Complete excision of the fistula track (patient J.P.) – own clinical materialObr. 3: Identifikácia vnútorného ústia fistuly (pacient J.P.) – vlastný klinický materiál
Fig. 3: Detection of the internal opening of the fistula (patient J.P.) – own clinical material
Obr. 4: Identifikácia vnútorného ústia fistuly (pacient J.P.) – vlastný klinický materiál
Fig. 4: Detection of the internal opening of the fistula (patient J.P.) – own clinical material
Obr. 5: Rekonštrukcia sfinkterov (pacient J.P.) − vlastný klinický materiál
Fig. 5: Sphincters recovery (patient J.P.) – own clinical material
Obr. 6: Konštrukcia posuvného endorektálneho laloku – široký oblý romboidný lalok u iného pacienta (pacient A.K.) −vlastný klinický materiál
Fig. 6: Design of the advancement endorectal flapwide round rhomboid flap in another patient (patient A.K.) – ownclinical material
Obr. 7: Posuvný endorektálny lalok je uložený a fixovaný u iného pacienta (pacient A.K.) − vlastný klinický materiál
Fig. 7: Advancement endorectal flap stowed and hold in another patient (patient A.K.) – own clinical material
Obr. 8: Stav po drenáži a suture mäkkých tkanív perinea (pacient J.P.) – vlastný klinický materiál
Fig. 8: Findings after drainage and suture of the soft perineal tissues (patient J.P.) – own clinical material
Obr. 9: Pacient šiesty deň po operačnej intervencii (pacient J.P.) - vlastný klinický materiál
Fig. 9: Patient sixth day after the surgery (patient J.P.) – own clinical materialVÝSLEDKY
Priemerná doba sledovania v našom súbore 524 pacientov s KAF(vrátane pacientov s IBD) po operačnej intervencii bola 5 rokov s krajnými hodnotami tri mesiace a 6 rokov. V súbore 326 pacientov (bez pacientov s IBD) po primárnej operačnej intervencii sme zaznamenali pooperačné infekčné a ranové komplikácie (PIRK) u 12 (5,2 %) pacientov, soiling u 16 (4,9 %) a inkontinenciu pre flatus u 9 (2,7 %) pacientov. Všetci pacienti s inkontinenciou pre flatus mali skóre podľa Wexnerovej škály do 5 bodov. Defekt v konštruovanom PEL sme zaznamenali u 17 (5,2 % ) pacientov (Tab. 1). V tejto skupine pacientov sme defekt PEL identifikovali u 90 % pacientov v priebehu prvého roku po operačnej intervencii. Úspešnosť operačného postupu ako primárnej operačnej intervencie, ktorý preferujeme a je kombináciou radikálnej excízie traktu KAF a následnej konštrukcie PEL s rekonštrukciou mm. sphincteris ani externi sme zaznamenali u 87,0 % pacientov. V súbore 446 pacientov (bez pacientov s IBD) po excízii traktu KAF a konštrukcii PEL sme identifikovali 120 pacientov po predchádzajúcich viac ako dvoch operačných intervenciách rôzneho druhu. PIRK sme zaznamenali u 4 (3,3 %) pacientov, soiling u 8 (6,6 %) a inkontinenciu pre flatus u 3 (2,5 %) pacientov. Všetci pacienti s inkontinenciou pre flatus mali skóre podľa Wexnerovej škály do 5 bodov. Defekt v konštruovanom PEL sme zaznamenali u 6 (5,0 % ) pacientov (Tab. 2). V tejto skupine pacientov sme zaznamenali úspešnosť nášho operačného postupu u 92 pacientov (76,6 %). Závažnosť pooperačných komplikácií sme vyhodnocovali podľa klasifikácie Clavien-Dindo (CD) [16]. V súbore 326 pacientov po primárnom operačnom výkone sme zaznamenali PIRK, inkontinenciu pre flatus a soiling podľa klasifikácie CD len na úrovni prvého a druhého stupňa. 15 (88,2 %) pacientov zo skupiny 17 pacientov s pooperačnými defektmi PEL spĺňalo kritéria prvého a druhého stupňa podľa klasifikácie CD. Dvoch (11,7 %) pacientov zo skupiny 17 pacientov s pooperačnými defektmi PEL, ktorí vyžadovali chirurgickú intervenciu sme zaradili do tretieho stupňa podľa klasifikácie CD (Tab. 3). V súbore 120 pacientov po predchádzajúcich viac ako dvoch operačných intervenciách rôzneho druhu, sme zaznamenali PIRK, inkontinenciu pre flatus a soiling podľa klasifikácie CD len na úrovni prvého a druhého stupňa. Štyria pacienti zo skupiny šiestich pacientov s pooperačnými defektmi PEL spĺňali kritéria druhého stupňa podľa klasifikácie CD. Dvoch pacientov zo skupiny šiestich pacientov s pooperačnými defektmi PEL, ktorí vyžadovali chirurgickú intervenciu sme zaradili do tretieho stupňa podľa klasifikácie CD (Tab. 4). Studentovým„t“ testom sme nezistili štatisticky významný rozdiel (p=0,17) medzi pooperačnými komplikáciami zaradenými do tretieho stupňa podľa klasifikácie CD u pacientov po prvej operačnej intervencii s konštrukciou PEL a u pacientov po viac ako dvoch operačných intervenciách v anamnéze pre KAF.
Table 1. Súbor 326 pacientov s komplex análnymi fistulami (prvá operačná intervencia) // Set of 326 patients with complex fistula-in-ano – (first surgery) 
Pooperačné komplikácie po realizácii posuvného endorektálneho laloku: december 2005− január 2023 − priemerný čas sledovania v pooperačnom období 5 rokov. // Postoperative complications after endorectal advacement flap: December 2005 − January 2023 − median postoperative follow up period of 5 years. Table 2. Súbor 120 pacientov s komplex análnymi fistulami (po viac ako 2. operačných výkonoch) // Set of 120 patients with complex fistula-in-ano (after more than 2 surgicaly procedure) 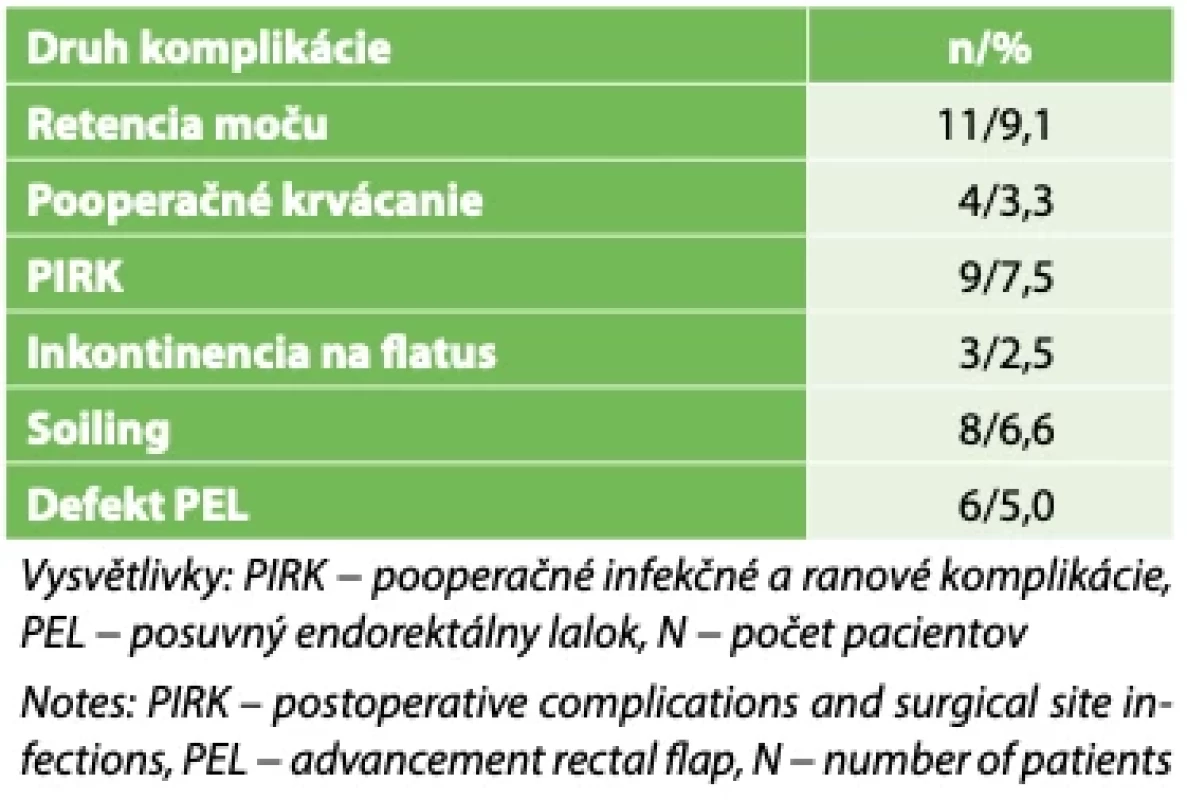
Pooperačné komplikácie po realizácii posuvného endorektálneho laloku: december 2005 − január 2023 − priemerný čas sledovania v pooperačnom období 5 rokov. // Postoperative complications after endorectal advacement flap: December 2005 – January 2023 – median postoperative follow up period of 5 years. Table 3. Súbor 326 pacientov s Komplex análnymi fistulami (prvá operačná intervencia) // Set of 326 patients with complex fistula-in-ano (first surgery) 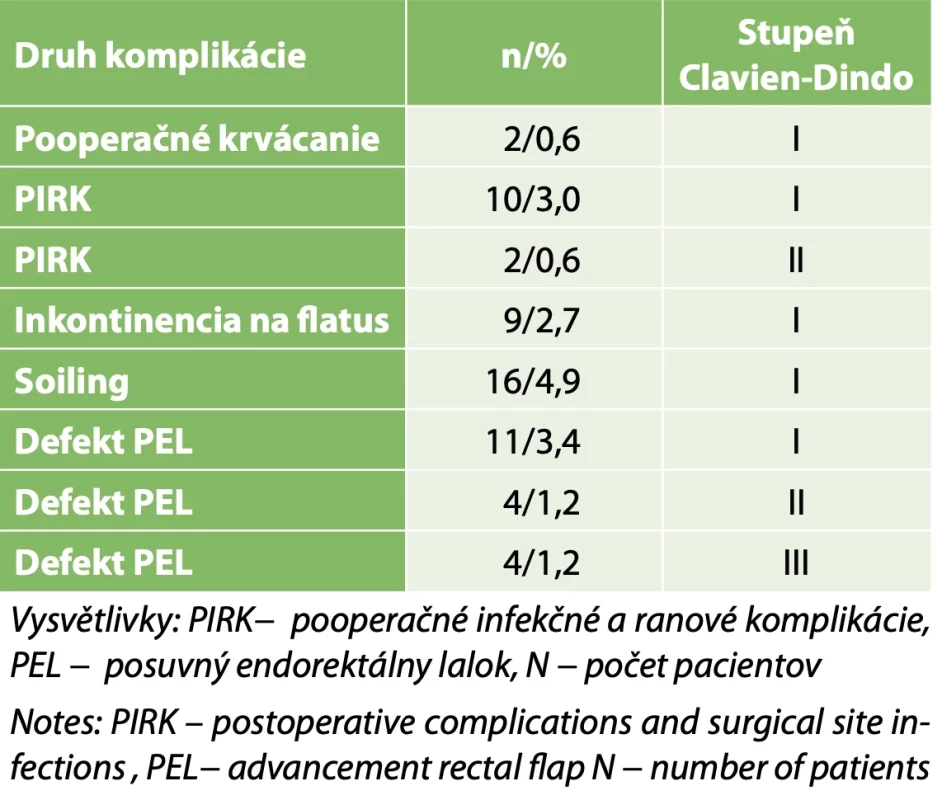
Pooperačné komplikácie po realizácii posuvného endorektálneho laloku − hodnotenie podľa Clavien Dindo klasifikácie: december 2005 − január 2023 - priemerný čas sledovania v pooperačnom období 5 rokov. // Postoperative complications after endorectal advacement flap – evaluation according to Clavien Dindo classification: December 2005 − January 2023 − median postoperative fol- low up period of 5 years. Table 4. Súbor 120 pacientov s komplex análnymi fistulami (po viac ako 2. operačných výkonoch) // Set of 446 patients with complex fistula-in-ano (after more than 2 surgical procedures) 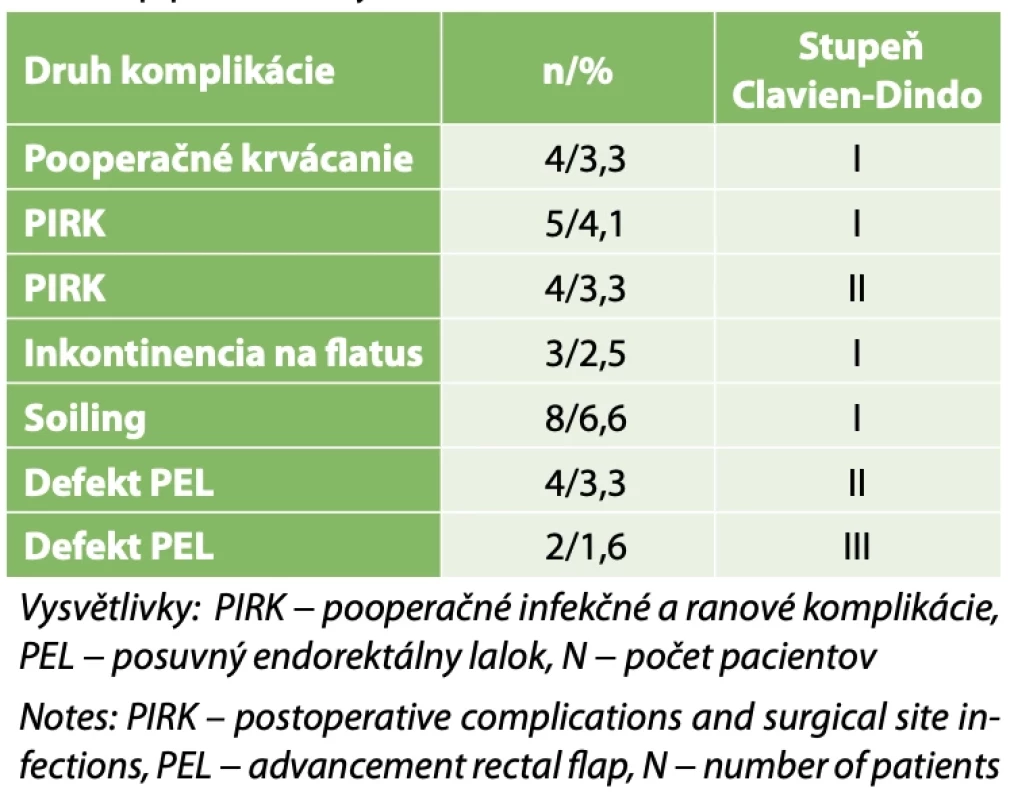
Pooperačné komplikácie po realizácii posuvného endorektálneho laloku: december 2005 − január 2023 − priemerný čas sledovania v pooperačnom období 5 rokov // Postoperative complications after endorectal advancement flap: December 2005 − January 2023 − median postoperative follow up period of 5 years. DISKUSIA
Chirurgická terapia análnej fistuly je stále veľkou výzvou pre chirurgov vzhľadom na anatomickú lokalizáciu ochorenia a potenciálne riziká vzniku pooperačnej análnej inkontinencie a septických komplikácií. Fistulotómia v chirurgickej terapii KAF, vzhľadom na nevyhnutnosť rôzneho stupňa iatrogénneho poškodenia sfinkterov je však absolútne nevhodná operačná modalita v terapii KAF [17,18]. Toto zistenie podnietilo chirurgov identifikovať podskupiny pacientov, u ktorých je zvýšené riziko vzniku post fistulotomickej inkontinencie a realizovať u tejto skupiny pacientov sfinkter zachovávajúce operačné výkony [3,17,18,19]. Niet pochýb o tom, že KAF tak ako ich klasifikujeme sú entitou, ktorá si vyžaduje zvláštnu pozornosť. Podľa mnohých štúdií cieľovou skupinou pre realizáciu PEL sú pacienti s KAF s mnohopočetnými AF a aj pacienti, ktorí už predtým podstúpili neúspešnú konštrukciu PEL [2,20]. PEL je nepochybne operačná modalita, ktorá spĺňa kritéria na základné požiadavky v chirurgickej terapii KAF. Hoci konštrukcia PEL je známa už od jej zavedenia do klinickej praxe A.W. Eltingom v roku 1912 [21,22], postupom času sa vyvíjala a naďalej sa vyvíja. Kombinácia zavedenia setonu s následnou odloženou konštrukciou PEL, je podľa viacerých autorov zaťažená vyšším percentom recidív a odlúčenia PEL [5,23,24]. Podľa našich skúsenosti z klinickej praxe nie je možné vytvoriť len posuvný mukózny lalok a ak sa tak autor rozhodne, v pooperačnom priebehu s vysokou pravdepodobnosťou príde ku jeho ischémii [25,26,27]. U pacientov s KAF kryptoglandulárnej etiológie bez IBD nikdy nezavádzame predoperačne seton žiadneho druhu. Operačnú intervenciu vždy realizujeme v kľudovom štádiu KAF bez akútnych zápalových zmien okolitých mäkkých tkanív perinea, nie skôr, ako za tri mesiace po incízii a drenáži periproktálneho abscesu. Na našom pracovisku konštruujeme PEL, ktorého súčasťou je aj submukóza a je vždy v tvare širokého oblého romboidu [2,25,26,27]. Vytvoreniu PEL vždy predchádza radikálna excízia celého traktu, alebo traktov KAF. Za veľmi dôležitú súčasť operačnej intervencie považujeme aj fixáciu PEL tak, aby transverzálna časť sutury bola uložená intraanálne. Náš operačný postup realizujeme vždy tak, že vykonávame nielen excíziu traktu fistuly, ale resekujeme fibroticky zmenené vlákna mm. sphincteris ani externi v rozsahu celého priebehu traktu fistuly, bilaterálne minimálne v rozsahu piatich milimetrov na rozdiel od iných autorov, ktorí sa obmedzujú len na rekonštrukciu defektu vzniknutého po excízii traktu fistuly [2,3,30]. Našim chirurgickým postupom nevykonávame excíziu orificium internum fistulae samostatne, ale vnútorné ústie fistuly odstraňujem „en bloc“ spolu so stenou canalis analis, ktorú resekujeme a následne konštruujeme PEL. Po takto vykonanej operačnej intervencii je nevyhnutná následná primárna rekonštrukcia prerušeného sfinkterového aparátu. Je zaujímavé, že v žiadnej mne dostupnej literatúre sa autori nezaoberajú danou skutočnosťou a uspokoja sa len s excíziou vnútorného ústia KAF a konštrukciou PEL, pričom ponechávajú in situ zápalovým procesom poškodené časti mm. sphincteris ani externi, čo následne môže viesť ku ich fibrotickej prestavbe a vzniku rôzneho stupňa análnej inkontinencie a/alebo stenózam canalis analis [30]. Vzhľadom ku rozsahu operačnej intervencie, ktorú realizujeme v chirurgickej terapii KAF po lege artis predoperačnej príprave aplikujeme pacientom nielen antimikrobiálnu profylaxiu, ale na rozdiel od ostatných operačných výkonov v kolorektálnej chirurgii aj následnú antibiotickú terapiu, inými antibiotikami aké používame v antibiotickej profylaxii. Na rozdiel od pooperačného postupu u iných druhov kolorektálnych operačných výkonov s perorálnym príjmom začíname až na druhý pooperačný deň. Hlavným dôvodom nášho pooperačného postupu je peroperačná kontaminácia mäkkých tkanív perinea a periproktálneho priestoru po rozsiahlej resekcii mm. sphincteris ani externi a ich následnej rekonštrukcii v kombinácii s resekčným intrarektálnym výkonom a s následnou konštrukciou intrarektálne uloženej anastomózy. Napriek ortográdnej laváži kolonu a rekta v kombinácii s aplikáciou klyziem je predoperačná príprava hrubého čreva a rekta v skupine pacientov s KAF problematická pre rozsiahle fibrotické zmeny nielen perianálne a perirektálne, ale aj intrarektálne. V operačnej terapii ostatných druhov AF realizujeme len ultrakrátku antimkrobiálnu profylaxiu a v pooperačnom priebehu pacientom antibiotiká nepodávame. V kontexte s inými autormi považujem trojročné pooperačné sledovanie pacientov po realizácii PEL za plne dostačujúce, pretože 90 % komplikácií sme identifikovali v prvom roku po operačnej intervencii [27,28,29]. V skupine 120 pacientov po viac ako dvoch operačných intervenciách pre KAF sme zaznamenali úspešnosť nášho operačného postupu u 76,6 % pacientov, čo koreluje aj s údajmi z literatúry [2,3,9,24]. Obezita a zápalové ochorenia hrubého čreva a konečníka majú vplyv na výsledky konštrukcie PEL. V prípade obezity je to predovšetkým technicky náročná preparácia intraanálne, predominantne u pacientov s extrasfinkterickými AF a problematická análna hygiena v pooperačnom období [2,27,28,29]. V skupine pacientov s defektom PEL v pooperačnom období sme realizovali opakovanú konštrukciu PEL a nepozorovali sme následne žiadne štatisticky významné rozdiely v komplikáciách v pooperačnom období vrátane možného zníženia úrovne análnej kontinencie. Skupina pacientov s nešpecifickými zápalovými ochoreniami rekta s KAF s realizáciou PEL nebola súčasťou našej retrospektívnej štúdie a vyžaduje si samostatné zhodnotenie výsledkov vzhľadom na významné rozdiely v taktike prípravy pacientov pred operačnou intervenciou a v jej vlastnej realizácii.
ZÁVER
Našou retrospektívnou štúdiou na súbore 326 pacientov (bez pacientov s IBD) s KAF kryptoglandulárneho pôvodu, u ktorých sme primárne vykonali radikálnu excíziu traktu AF s excíziou jej vonkajšieho ústia v kombinácii s resekciou steny canalis analis v rozsahu mukózy a submukózy spolu s vnútorným ústim AF, s konštrukciou a fixáciou PEL v tvare širokého oblého romboidu s primeranou hrúbkou a vždy so submukózou a s primárnou rekonštrukciou mm. sphincteris ani externi sme na základe výsledkov preukázali, že náš kombinovaný operačný postup je vhodnou operačnou modalitou v chirurgickej terapii KAF. Rekonštrukcia prerušených vlákien mm. sphincteris ani externi po ich širokej excízii je dôležitou súčasťou operačnej intervencie. Úspešnosť nami vykonávanej primárnej operačnej intervencie u pacientov s KAF bola 87 % a u 120 pacientov (bez pacientov s IBD) po viac ako dvoch operačných intervenciách v anamnéze bola 76,6 %. Operačná modalita, ktorú vykonávame je proktochirurgom technicky zvládnuteľná a je zaťažená nízkym percentom pooperačných komplikácii vrátane vzniku análnej inkontinencie.
Zoznam skratiek
AF – análna fistulaCD – Clavien-DindoEUS – endoanálna ultrasonografiai. v. – intravenózneKAF – komplex análna fistulam. – musculusmm. – musculiPEL – posuvný endorektálny lalokPIRK – pooperačné infekčné a ranové komplikácieKonflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.doc. MUDr. Jozef Korček Ph.D. mim. prof.
Višňová č. 22/A
949 01 Nitra
Slovenská republika
e-mail: jozef.korcek@pobox.sk
Sources
1. Willis S, Rau M, Schumpelick V. Surgical treatment of high anorectal and rectovaginal fistulas with the use of transanal endorectal advancement flaps. [Article in German], Chirurg 2000;71 : 836−840. doi: 10.1007/s 001040051145.
2. Zimmerman DE, Stijns J, Daria K, et al. Transanal advancement flap repair: The current gold standard for cryptoglandular transsphincteric perianal fistulas. Turk J Colorectal Dis. 2019;29 : 104−110. doi: 10.4274/tjcd.galenos.2019.06-2.
3. Balciscueta Z, Uribe N, Balciscueta I, et al. Rectal advancement flap for the treatment of complex cryptoglandular anal fistulas: a systematic review and meta-analysis. Int J Colorectal Dis. 2017;32 : 599−609. doi: 10.1007/s00384-017-2779-7.
4. Schouten WR, Zimmerman DD, Briel JW. Transanal advancement flap repair of transsphincteric fistulas. Dis Colon Rectum 1999;42 : 1419−1422. doi: 10.1007/ BF02235039
5. Pinedo GM, Caselli MG, Urrejola SG, et al. Modified loose-seton technique for the treatment of complex anal fistulas. Colorectal Dis. 2010;12(10 On-line): e310–e313. doi: 10.1111/j.1463-1318.2010.02195.x
6. Ellis CN, Clark S. Fibrin glue as an adjunct to flap repair of anal fistulas: a randomized, controlled study. Dis Colon Rectum 2006;49 : 1736−1740. doi: 10.1007/ s10350-006-0718-8.
7. Cintron JR, Park JJ, Orsay CP, et al. Abcarian H. Repair of fistulas-in-ano using autologous fibrin tissue adhesive. Dis Colon Rectum 1999;42 : 607−613. doi: 10.1007/ BF02234135.
8. van Koperen PJ, Bemelman WA, Bossuyt PM, et al. The anal fistula plug versus the mucosal advancement flap for the treatment of anorectal fistula (PLUG trial). BMC Surg 2008;8 : 11. doi: 10.1186/14712482-8-11.
9. Williams JG, MacLeod CA, Rothenberger DA, et al. Seton treatment of high anal fistulae. Br J Surg. 1991;78 : 1159–1161. doi: 10.1002/bjs.1800781004.
10. Mitalas LE, van Wijk JJ, Gosselink MP, et al. Seton drainage prior to transanal advancement flap repair: useful or not? Int J Colorectal Dis. 2010;25 : 1499–1502. doi: 10.1007/s00384-010-0993-7.
11. Eitan A, Koliada M, Bickel A. The use of the loose seton technique as a definitive treatment for recurrent and persistent high trans-sphincteric anal fistulas: a long-term outcome. J Gastrointest Surg. 2009 Jun;13(6):1116−1119. doi: 10.1007/s11605-009-0826-6.
12. Galis-Rozen E, Tulchinsky H, Rosen A, et al. Long-term outcome of loose seton for complex anal fistula: a two-centre study of patients with and without Crohn‘s disease. Colorectal Dis. 2010 Apr;12(4):358−362. doi: 10.1111/j.14631318.2009.01796.x. Epub 2009 Feb 7.
13. Subhas G, Gupta A, Balaraman S, et al. Non-cutting setons for progressive migration of complex fistula tracts: a new spin on an old technique. Int J Colorectal Dis. 2011 Jun;26(6):793−798. doi: 10.1007/s00384-011-1189-5.
14. Sirikurnpiboon S, Awapittaya B, Jivapaisarnpong P. Ligation of intersphincteric fistula tract and its modification: Results from treatment of complex fistula. World J Gastrointest Surg. 2013;5 : 123–128. doi: 10.4240/wjgs.v5.i4.123.
15. Mushaya C, Bartlett L, Schulze B, et al. Ligation of intersphincteric fistula tract compared with advancement flap for complex anorectal fistulas requiring initial seton drainage. Am J Surg. 2012 Sep;204(3):283−289. doi: 10.1016/j.amjsurg.2011.10.025.
16. Clavien PA, Barkun J, de Oliveira ML, et al. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009;250 : 187–196. Ann Surg. 2009 Aug;250(2):187−196. doi: 10.1097/ SLA.0b013e3181b13ca2.
17. Perez F, Arroyo A, Serrano P, et al. Randomized clinical and manometric study of advancement flap versus fistulotomy with sphincter reconstruction in the management of complex fistula-in-ano. Am J Surg. 2006 Jul;192(1):34-40. doi: 10.1016/j.amjsurg.2006.01.028.
18. Ortiz H, Marzo M, de Miguel M, et al. Length of follow-up after fistulotomy and fistulectomy associated with endorectal advancement flap repair for fistula in ano. Br J Surg. 2008 Apr;95(4):484−487. doi: 10.1002/bjs.602
19. Soltani A, Kaiser AM. Endorectal advancement flap for cryptoglandular or Crohn’s fistula-in-ano. Dis Colon Rectum 2010 Apr;53(4):486–495. doi: 10.1007/ DCR.0b013e3181ce8b01.
20. Mitalas LE, Gosselink MP, Zimmerman DD, et al. Repeat transanal advancement flap repair: impact on the overall healing rate of high transsphincteric fistulas and on fecal continence. Dis Colon Rectum 2007 Oct; 50(10): 1508–1511. doi: 10.1007/s10350-007-9015-4
21. Aguilar PS, Plasencia G, Hardy TG Jr, et al. Mucosal advancement in the treatment of anal fistula. Dis Colon Rectum 1985 Jul;28(7):496-8. doi: 10.1007/ BF02554093.
22. Elting AW. X. The treatment of fistula in ano: With especial reference to the whitehead operation. Ann Surg. 1912 Nov;56(5):744−752. doi: 10.1097/ 00000658-191211000-00010.
23. Hamalainen KP, Sainio AP. Cutting seton for anal fistulas: high risk of minor control defects. Dis Colon Rectum 1997 Dec;40(12):1443−1446; discussion 1447. doi: 10.1007/BF02070710.
24. Ozuner G, Hull TL, Cartmill J, et al. Longterm analysis of the use of transanal rectal advancement flaps for complicated anorectal/vaginal fistulas. Dis Colon Rectum 1996 Jan;39(1):10−14. doi: 10.1007/ BF02048261.
25. Tan KK, Alsuwaigh R, Tan AM, et al. To LIFT or to flap? Which surgery to perform following seton insertion for high anal fistula? Dis Colon Rectum 2012 Dec;55(12):1273-1277. doi: 10.1097/ DCR.0b013e31826dbff0.
26. Yellinek S, Krizzuk D, Moreno Djadou T, et al. Endorectal advancement flap for complex anal fistula: does flap configuration matter? Colorectal Dis. 2019 May;21(5):581−587. doi: 10.1111/ codi.14564.
27. Dubsky PC, Stift A, Friedl J, et al. Endorectal advancement flaps in the treatment of high anal fistula of cryptoglandular origin: full-thickness vs. mucosal-rectum flaps. Dis Colon Rectum 2008 Jun;51(6):852−857. doi: 10.1007/s10350008-9242-3.
28. Khafagy W, Omar W, El Nakeeb A, et al. Treatment of anal fistulas by partial rectal wall advancement flap or mucosal advancement flap: a prospective randomized study. Randomized Controlled Trial Int J Surg. 2010;8(4):321−325. doi: 10.1016/j.ijsu.2010.03.009.
29. Jarrar A, Church J. Advancement flap repair: a good option for complex anorectal fistulas. Dis Colon Rectum 2011 Dec;54(12):1537−15341. doi: 10.1097/ DCR.0b013e31822d7ddd.
30. Seyfried S, Bussen D, Joos A. et al. Fistulectomy with primary sphincter reconstruction. Int J Colorectal Dis. 2018 Jul;33(7):911−918. doi: 10.1007/s00384018-3042-6.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2023 Issue 10-
All articles in this issue
- Koloproktologie čtyřikrát jinak
- Detection and clinical significance of circulating tumour cells in patients with colorectal carcinoma
- Postoperative delirium
- Novel surgical procedure in design of advancement endorectal flap in the surgical treatment of complex anal fistulas
- Ileus conditions after rectal and Hartmann’s resections
- Effect of neoadjuvant therapy on early postoperative complications in rectal cancer
- Zápis z jednání Redakční rady časopisu Rozhledy v chirurgii, konané dne 29. 11. 2023
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postoperative delirium
- Novel surgical procedure in design of advancement endorectal flap in the surgical treatment of complex anal fistulas
- Ileus conditions after rectal and Hartmann’s resections
- Detection and clinical significance of circulating tumour cells in patients with colorectal carcinoma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

