-
Medical journals
- Career
Prognostické faktory v časné opakované transuretrální resekci uroteliálního karcinomu močového měchýře bez invaze detruzoru − 10leté zkušenosti referenčního pracoviště
Authors: B. Žemličková; A. Brisuda
Authors‘ workplace: Urologická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole, Praha
Published in: Rozhl. Chir., 2022, roč. 101, č. 3, s. 119-128.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2022.101.3.119–128Overview
Úvod: Uroteliální karcinom močového měchýře infiltrující submukózu (T1) představuje nádor s vysokým rizikem progrese do invazivního onemocnění. V případě histologického nálezu pT1 nebo absence detruzoru v histologii pacienty indikujeme k časné opakované resekci močového měchýře (reTUR). Dle retrospektivních hodnocení má histologický nález v reTUR prognostický význam. Cílem sdělení je prezentace výsledků léčby referenčního pracoviště.
Metody: Retrospektivně bylo zhodnoceno 146 pacientů s primozáchytem nádoru močového měchýře bez invaze detruzoru, kteří v období 3/2010 – 2/2021 podstoupili transuretrální resekci močového měchýře a časnou reTUR. Byly sestrojeny Kaplan-Meierovy křivky přežití bez recidivy, progrese a cystektomie a analyzována korelace 7 klinicko-patologických faktorů (věk, pohlaví, svalovina v histologickém vzorku, přítomnost reziduálního nádoru v reTUR, přítomnost carcinoma in situ v reTUR, intravezikální chemoterapie a bacillus Calmette-Guérin terapie, BCG) pomocí univariační a multivarační analýzy.
Výsledky: Medián přežití bez recidivy byl 2,15 roku, přežití bez recidivy bylo v 1 roce 66,9 % a ve 3 letech 43,4 %. Jednoleté přežití bez progrese bylo 93,5 %, 3leté pak 88,4 %. Přežití bez cystektomie bylo 91,0 % v 1 roce, respektive 82,4 % ve 3 letech. V multivariační analýze byl negativním prognostickým faktorem přežití bez recidivy jakýkoliv reziduální nádor v reTUR, pozitivním faktorem pak podání intravezikální chemoterapie a BCG. Jediným negativním prognostickým faktorem přežití bez progrese a bez cystektomie byl reziduální nádor v reTUR.
Závěr: Kvalita primoresekce nádoru močového měchýře, která je dána úplností resekce a přítomností detruzoru v histologii, je základním kamenem adekvátní diagnózy a správné léčby. Pokud je časná reTUR indikována, pak je dle našich dat přítomnost reziduálního nádoru významným prognostickým ukazatelem.
Klíčová slova:
uroteliální karcinom – prognóza – Nádor močového měchýře – Časná opakovaná resekce (reTUR)
ÚVOD
Nádory močového měchýře jsou nejčastějšími nádory močového traktu a v celkovém souhrnu jsou 5. nejčastějšími nádory u mužů a 12. nejčastějšími nádory u žen v České republice [1]. Histologicky se jedná přibližně v 90 % o uroteliální karcinomy, z čehož 75 % tvoří neinvazivní nádory močového měchýře (non-muscle invasive bladder cancer, NMIBC) ohraničené na sliznici (Ta, carcinoma in situ − CIS) a infiltrující submukózu (T1). Zbytek tvoří invazivní formy onemocnění zasahující minimálně do svaloviny m. detrusor (≥T2), které vyžadují agresivní chirurgický (radikální cystektomie), eventuálně multimodální přístup. Základní léčebnou a diagnostickou metodou sloužící k přesnému stanovení stadia je transuretrální resekce močového měchýře (TUR). Na základě klinicko-patologických faktorů následně pacienty stratifikujeme do rizikových skupin s ohledem na riziko recidivy a progrese onemocnění [2,3]. Nádory T1 high grade (HG), tedy nádory infiltrující submukózu s nízkým stupněm diferenciace buněk, představují nádory s nejvyšším rizikem progrese do invazivní formy onemocnění (19,8 % v průběhu 5 let) [4]. V případě nálezu pT1 stadia, absence detruzoru v histologii či podezření nekompletního provedení TUR je indikována časná reTUR v odstupu 2−6 týdnů od první operace [4]. Dle retrospektivních hodnocení má přítomnost reziduálního nádoru při reTUR nepříznivý prognostický význam. Dále se zdá, že v predikci pT0 (histologicky potvrzená absence nádoru) v reTUR hraje roli přítomnost detruzoru v primoresekci a absence CIS [5]. Cílem článku je zhodnocení prognostických faktorů recidivy a progrese na základě výsledků léčby pacientů s primozáchytem NMIBC, kteří podstoupili TUR a reTUR v průběhu 10 let na našem pracovišti.
METODY
Retrospektivně bylo zhodnoceno 146 pacientů z prospektivně vedeného registru, 57 žen a 89 mužů, s primozáchytem nádoru močového měchýře, kteří v období od března 2010 do února 2021 podstoupili transuretrální resekci močového měchýře a časnou reTUR na našem pracovišti (Tab. 1).
Table 1. Klinicko-patologická charakteristika souboru pacientů
Tab. 1: Clinical and pathologic characteristics of the patients
Histologické vzorky byly zpracovány patologem erudovaným v uropatologii s určením stadia dle TNM klasifikace z roku 2002 a buněčné diferenciace podle World Health Organization (WHO) klasifikace z roku 1973 a 2004/2016.
Na základě stratifikace do rizikových skupin dle Evropské urologické společnosti (European Association of Urology, EAU) byla pacientům po výkonu podávána intravezikální chemoterapie či BCG terapie dle aktuálně platných doporučení. Za adekvátní intravezikální léčbu bylo považováno alespoň 10 instilací 40 ml Mitomycinu C, respektive alespoň 5 instilací BCG v rámci iniciace a 2 dávky BCG v rámci udržovací léčby [4]. Nemocní s neadekvátní instilační léčbou byli hodnoceni jako bez instilační léčby.
Medián sledování pacientů byl 2,6 roku. U pacientů jsme sledovali 7 klinicko-patologických faktorů: věk, pohlaví, přítomnost detruzoru v histologii při TUR/re - TUR, histologický nález v reTUR, nález carcinoma in situ v reTUR, podávání chemoterapie a BCG terapie. V rámci statistické analýzy byly sestrojeny Kaplan-Meierovy křivky přežití bez recidivy, progrese a cystektomie a byla vyhodnocena korelace výše zmíněných 7 klinicko-patologických faktorů pomocí univariační a multivariační analýzy.
Univariační analýza byla počítána pomocí Mann-Whitneyova testu pro spojité veličiny a Friedmanova exaktního testu pro kategoriální data. Analýza hodnocení času do výskytu sledované události (time to event analysis) byla provedena pomocí Kaplan-Meierovy analýzy přežití a Coxova modelu proporcionálních rizik. Jako statisticky významná je brána hodnota p<0,05.
Recidiva onemocnění byla definována jako nově detekovaný histologicky potvrzený tumor při cystoskopii nebo radikální cystektomii (RCYE) po reTUR. Definice progrese onemocnění byla stanovena jako nález invazivního nádoru močového měchýře (minimálně T2) v průběhu sledování po reTUR nebo progrese nádoru do uzlinového nebo metastatického onemocnění. Nádory Ta (zcela bez invaze) mají výrazně lepší prognózu než nádory T1. Proto byly prováděny vždy 2 analýzy histologických nálezů v reTUR, a to T0 versus Ta+T1+T2+CIS a T0+Ta versus T1+T2+CIS.
VÝSLEDKY
V průběhu sledování jsme zaznamenali recidivu u 72 pacientů (49,3 %) a progresi u 12 pacientů (8,2 %). Cystektomii podstoupilo celkem 21 (14,4 %) pacientů, z toho 9 (42,8 %) z důvodu progrese do invazivního onemocnění, 1 (4,8 %) pro nález invazivního tumoru v reTUR a 11 (52,4 %) pro recidivující NMIBC přes intravezikální terapii. Univariační analýzy jsou uvedeny v Tab. 2–4.
Table 2. Univariační analýza recidivy NMIBC
Tab. 2: Univariate analysis of NMIBC recurrence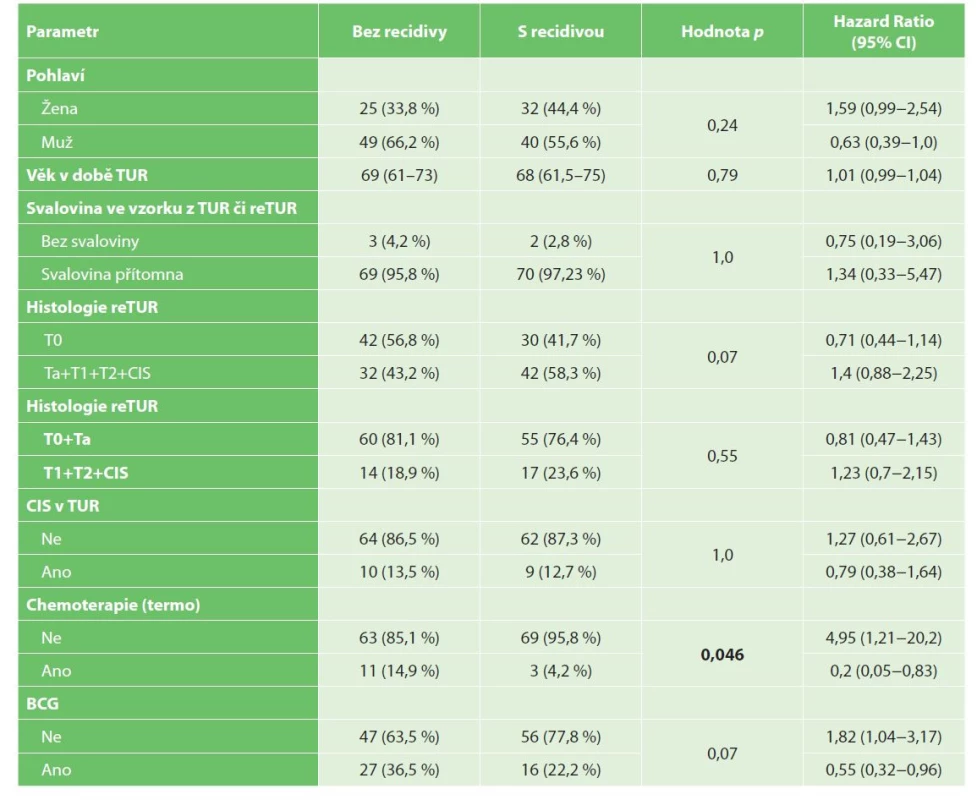
Table 3. Univariační analýza progrese NMIBC
Tab. 3: Univariate analysis of NMIBC progression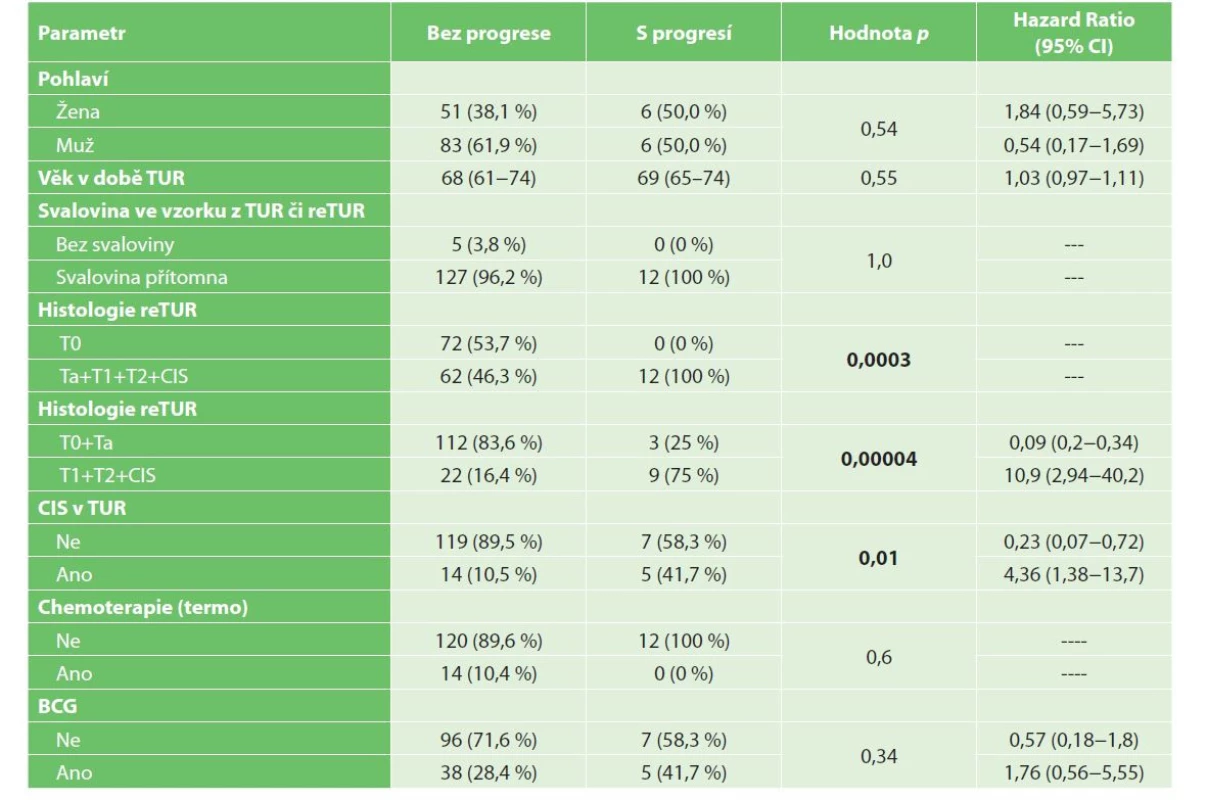
Table 4. Univariační analýza radikálních cystektomií
Tab. 4: Univariate analysis of radical cystectomy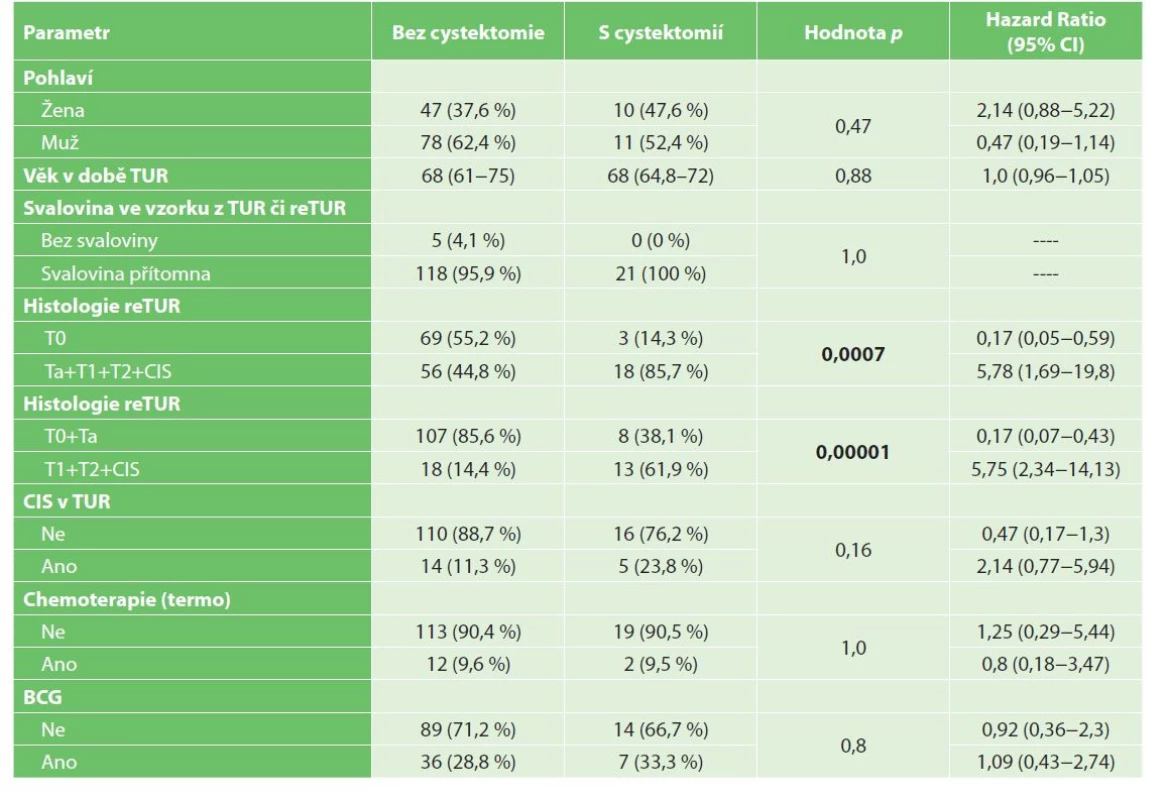
Medián přežití bez recidivy (Recurrence free survival, RFS) byl 2,15 roku, 1 rok po primoresekci přežívalo bez recidivy 66,9 % pacientů a 3 roky po TUR 43,4 % pacientů. Mužské pohlaví (p=0,053), podání intravezikální chemoterapie (p=0,013) a BCG terapie (p=0,033) korelovalo s delším přežitím bez recidivy, viz Graf 1−2.
Graph 1. Vliv podávání chemoterapie na RFS
Graph 1: Impact of chemotherapy on RFS
Graph 2. Vliv podávání BCG na RFS
Graph 2: Impact of BCG therapy on RFS
V multivariační analýze byly jedinými významnými prognostickými faktory pro přežití bez recidivy reziduální nádor v reTUR, podání chemoterapie a podání BCG, viz Tab. 5a, 5b.
Table 5. Multivariační analýza recidivy NMIBC
Tab. 5: Multivariate analysis of NMIBC recurrence
Tab. 5a: Histologie v reTUR T0 vs Ta+T1+T2+CIS
Tab. 5a: ReTUR histology T0 vs Ta+T1+T2+CIS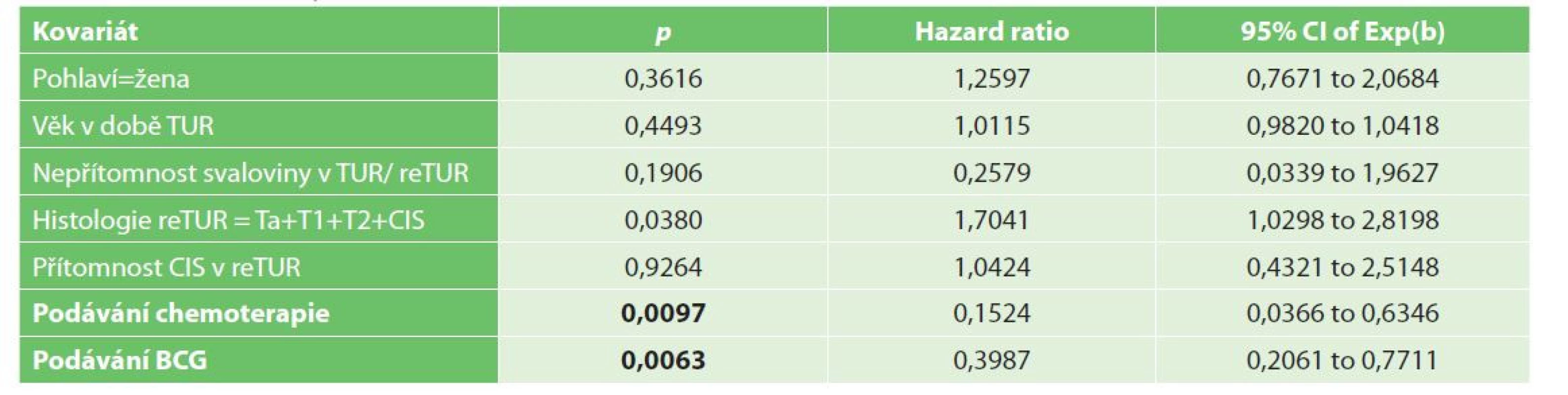
Tab. 5b: Histologie v reTUR T0+Ta vs T1+T2+CIS
Tab. 5b: ReTUR histology T0+Ta vs T1+T2+CIS
Přežití bez progrese (progression free survival, PFS) bylo v našem souboru v 1 roce 93,5 % a ve 3 letech 88,4 %. Dle univariační analýzy je negativním prognostickým faktorem přežití bez progrese reziduální nádor v reTUR, dále přítomnost CIS v reTUR (p=0,007), viz Graf 3−4. Z multivariační analýzy vyplývá jako statisticky významný negativní prediktivní faktor přežití bez progrese nález nádoru pT1, pT2 či CIS v reTUR (p<0,0008, HR=11,8943) (Tab. 6).
Graph 3. Vliv nálezu reziduálního tumoru (Ta, T1, T2, CIS) v reTUR na PFS
Graph 3: Impact of residual tumor (Ta, T1, T2, CIS) in reTUR on PFS
Graph 4. Vliv nálezu reziduálního tumoru (T1, T2, CIS) v reTUR na PFS
Graph 4: Impact of residual tumor (T1, T2, CIS) in reTUR on PFS
Table 6. Multivariační analýza progrese NMIBC
Tab. 6: Multivariate analysis of NMIBC progression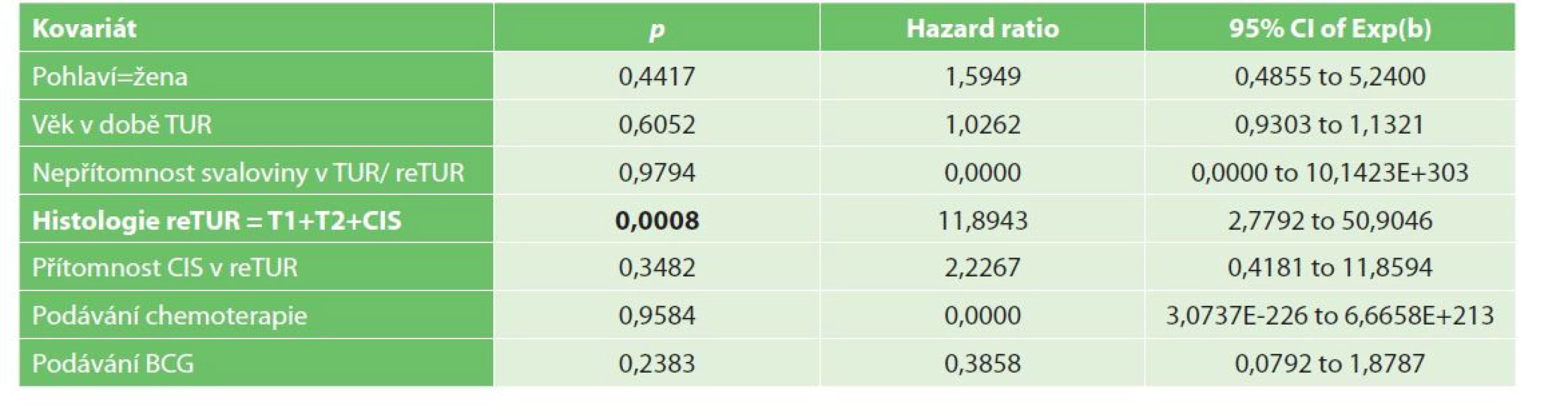
Bez radikální cystektomie přežívalo v 1 a ve 3 letech po TUR 91 %, respektive 82,4 % pacientů. Nález reziduálního nádoru v reTUR je negativním prognostickým faktorem přežití bez radikální cystektomie dle univariační, viz Graf 5−6, i multivariační analýzy (Tab. 7a, 7b).
Graph 5. Vliv nálezu reziduálního tumoru (Ta, T1, T2, CIS) v reTUR na přežití bez radikální cystektomie
Graph 5: Impact of residual tumor (Ta, T1, T2, CIS) in reTUR on radical cystectomy free survival
Graph 6. Vliv nálezu reziduálního tumoru (T1, T2, CIS) v reTUR na přežití bez radikální cystektomie
Graph 6: Impact of residual tumor (T1, T2, CIS) in reTUR on radical cystectomy free survival
Table 7. Multivariační analýza radikální cystektomie
Tab. 7: Multivariate analysis of radical cystectomy
Tab. 7a: Histologie reTUR = Ta+T1+T2+CIS
Tab. 7a: ReTUR histology = Ta+T1+T2+CIS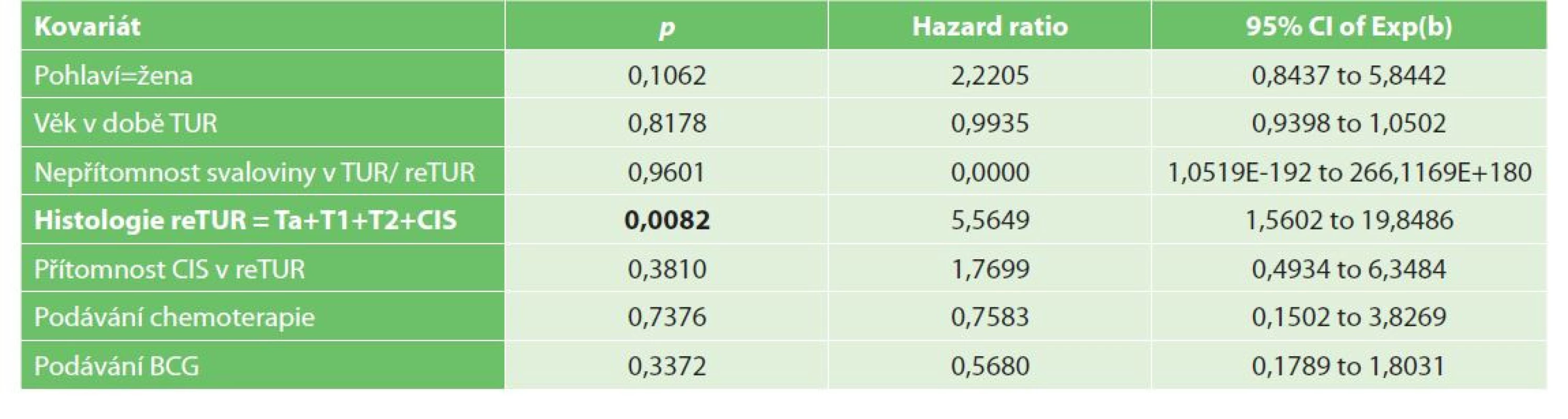
Tab. 7b: Histologie reTUR = T1+T2+CIS
Tab. 7b: ReTUR histology = T1+T2+CIS
DISKUZE
Transuretrální resekce močového měchýře představuje základní diagnostickou a léčebnou metodu u pacientů s nádory močového měchýře, následovanou instilační lokální léčbou dle rizika recidivy a progrese. V indikaci časné reTUR jsou zásadní 3 faktory: riziko neúplné resekce (multifokální tumor, nedostatečný přehled, krvácení − záleží na rozvaze operatéra), nádor T1 a absence detruzoru. Jedná se o opakovaný endoskopický výkon v celkové nebo spinální anestezii prováděný časně po primoresekci (2–6 týdnů dle doporučení EAU), který s sebou nese nezanedbatelná rizika komplikací, jako jsou extenzivní hematurie, perforace stěny měchýře, infekce nebo poranění močové trubice se vznikem striktury. Navíc je třeba zmínit psychologický, organizační a ekonomický aspekt výkonu ze strany pacienta a zdravotnického systému. V neposlední řadě může u části pacientů dojít k oddálení efektivní adjuvantní léčby, pokud je indikována.
Doporučení časné reTUR u všech nádorů pT1 vychází ze starších souborů, ve kterých byl invazivní tumor nalezen u 30–60 % nemocných, kteří podstoupili cystektomii [6]. Je však jasné, že k radikální cystektomii jsou indikováni pacienti s nádory s nejvyšším rizikem (HG multifokální, plošně rozsáhlé nádory, recidivy po BCG apod.), kde se šance k podhodnocení stadia výrazně zvyšují. Reziduální nádor v reTUR byl dle dostupných dat diagnostikován až v 50 % případů [7]. V našem souboru byl reziduální tumor v reTUR nalezen u 60 ze 116 (51,7 %) pacientů se stadiem T1 v primoresekci, ze kterých 5 % tvořilo invazivní nádor (≥T2). Cystektomii podstoupilo 19 pacientů.
V retrospektivním hodnocení 2451 nemocných s T1G3 nádory léčených pomocí BCG, z nichž 935 podstoupilo časnou reTUR, bylo pozorováno prodloužení intervalu bez recidivy, bez progrese a celkového přežívání pouze u skupiny bez detruzoru v primoresekci [8]. Otázkou tedy zůstává, zda je opravdu nutné rutinně provádět časné reTUR i u pacientů s jasně popsaným detruzorem v primoresekci, když je léčba BCG tak či tak indikována a kvůli reTUR je tato účinná léčba oddálena nebo dokonce znemožněna. Na druhou stranu rozsáhlá analýza kohort pacientů s reTUR z období 1980–2016 demonstrovala významné procento podhodnocení stadia (v 11 %) i ve skupině s přítomným detruzorem v histologii [9]. Podle dostupných dat tedy nelze vyvodit jednoznačný závěr a ve většině případů se tak klinická praxe opírá o doporučení EAU.
Kvalita resekce je dána zejména přítomností detruzoru ve vzorku z primoresekce, což snižuje riziko podhodnocení stadia onemocnění. Přítomnost detruzoru v první, zjevně kompletní resekci a zkušenost operátora jsou významnými prediktory časné recidivy [10]. Tato data byla prospektivně validována stejnými autory [11]. V původní studii byla absence detruzoru přítomna v 90 ze 144 (62,5 %) případů primoresekce [10]. V našem souboru pacientů s vysoce rizikovým NMIBC byla časná reTUR indikována z důvodu absence detruzoru pouze u 14,4 % případů, což jsou velmi dobré výsledky, uvážíme-li, že skladba zkušených operatérů a rezidentů byla na našem pracovišti vyrovnaná. Nepochybně hraje svou roli období, ve kterém byly výkony prováděny (roky 2005−2006, respektive 2010−2021), a svůj vliv tedy může mít technologický a technický pokrok při provádění těchto výkonů.
Nejzásadnější otázkou zůstává prognostický význam nálezů při reTUR a dalších klinických parametrů. V naší studii jsme hodnotili korelaci těchto faktorů s přežíváním bez recidivy, bez progrese a bez radikální cystektomie. Palou, et al. retrospektivně hodnotili soubor 2451 T1G3 pacientů s mediánem sledování 5,2 roku, ze kterých 38 % podstoupilo časnou reTUR [12]. Reziduální nádor byl nalezen u 71,4 % pacientů, což je více než v našem souboru (50,7 %). V souladu s našimi výsledky koreloval čas do recidivy a progrese s patologickým stadiem nálezu při časné reTUR. Nádorově specifická mortalita u nádorů T1G3 v reTUR byla 13,1 %. V jiné studii byla retrospektivně analyzována kohorta 94 pacientů [13]. Celkem 23,4 % mělo v reTUR invazivní onemocnění (v našem souboru pouhá 2 %). Zbývajících 72 pacientů analyzované kohorty mělo v reTUR reziduální nádor ve 41 případech (43,6 %). V multivariační analýze byly stadium tumoru časné reTUR a podání BCG nezávislými prediktory přežívání bez progrese a recidivy (HR 2,11, respektive 1,77 = obě hodnoty platí pro stadia v reTUR). V jiné studii byl opět nález T0 v re - TUR signifikantním prediktorem přežívání bez recidivy [14]. Výsledky naší statistiky podporují publikované studie. Otázkou nadále zůstává úloha techniky resekce, en-bloc vs. konvenční resekce. Studie porovnávající potenciální výhody en-bloc resekce nadále probíhají, výsledky pilotní studie toto zatím spolehlivě nepotvrdily [15]. V našem souboru byli pacienti operováni oběma technikami, podstatná pro hodnocení však byla přítomnost detruzoru v preparátu.
Studie má samozřejmě své limitace. Nejdůležitější z nich je retrospektivní hodnocení dat. Relativní nevýhodou je menší počet probandů, krátká doba sledování a s tím související menší četnost sledovaných událostí (pouze 8 % progresí a 14 % cystektomií za uvedené období sledování). Silnou stránkou studie je revize histologických nálezů erudovaným patologem zkušeným v uro(cyto)patologii, spolehlivý registr a dispenzarizace i komplexní vyhodnocení základních onkologických ukazatelů NMIBC (recidiva, progrese, cystektomie).
ZÁVĚR
Na základě retrospektivní analýzy souboru nemocných s NMIBC vysokého a velmi vysokého rizika lze konstatovat, že nález T0 v časné reTUR významně koreluje s prognózou pacienta. Jakýkoliv reziduální nádor v časné reTUR je nezávislým prediktorem prežívání bez recidivy a bez cystektomie. Jakýkoliv reziduální nádor v reTUR mimo nádory Ta koreluje s délkou přežívání bez progrese. Dle našich zkušeností má tedy časná re-TUR u těchto forem nádoru močového měchýře stále svoji roli. Největší potenciál do budoucna má přesný předoperační staging, technika resekce a manipulace s preparáty a nové neinvazivní markery.
Seznam zkratek:
BCG − bacillus Calmette-Guérin
CIS − carcinoma in situ
EAU − European Association of Urology, Evropská urologická společnost
HG − high grade, nízký stupeň diferenciace buněk
NMIBC − non-muscle invasive bladder cancer, neinvazivní nádor močového měchýře
PFS − progression free survival, přežití bez progrese
RCYE − radikální cystektomie
reTUR − časná opakovaná transuretrální resekce močového měchýře
RFS − recurrence free survival, přežití bez recidivy
TUR − transuretrální resekce močového měchýře
WHO − World Health Organisation, Světová zdravotnická organizace
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Barbora Žemličková
Urologická klinika 2. LF UK a FN v Motole
V Úvalu 84
150 56 Praha 5
e-mail: barbora.zemlickova@fnmotol.cz
ORCID 0000-0002-3639-596X
Sources
1. Mužík J, Dušek L, Babjuk M, et al. Uroweb – webový portál pro analýzu a vizualizaci epidemiologie, diagnostiky a léčby urologických malignit [online]. Masarykova univerzita, Brno 2022. [cit. 2021-06-02]. Available at: www: http://www.uroweb. cz. ISSN 1804-6371. Verze 1.6d.
2. Sylvester RJ, van der Meijden AP, Oosterlinck W, et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol. 2006 Mar;49(3):466−465; discussion 475−477. doi:10.1016/j.eururo. 2005.12.031. Epub 2006 Jan 17. PMID: 16442208.
3. Sylvester RJ, Rodríguez O, Hernández V, et al. European Association of Urology (EAU) prognostic factor risk groups for non-muscle-invasive bladder cancer (NMIBC) incorporating the WHO 2004/2016 and WHO 1973 classification systems for grade: An update from the EAU NMIBC guidelines panel. Eur Urol. 2021 Apr;79(4):480−488. doi: 10.1016/j. eururo.2020.12.033. Epub 2021 Jan 6. PMID: 33419683.
4. Babjuk M, Burger M, Compérat E, et al. European Association of Urology Guidelines on Non-muscle-invasive Bladder Cancer (TaT1 and Carcinoma In Situ) Edn. Presented at the EAU Annual Congress Milan 2021. ISBN 978-94-92671-13-4. Publisher: EAU Guidelines Office. Place published: Arnhem, The Netherlands.
5. Soria F, D’Andrea D, Moschini M, et al. Predictive factors of the absence of residual disease at repeated transurethral resection of the bladder. Is there a possibility to avoid it in well-selected patients? Urol Oncol. 2020 Mar;38(3):77.e1−77.e7. doi:10.1016/j.urolonc.2019.08.010. Epub 2019 Sep 14. PMID: 31526650.
6. Fritsche HM, Burger M, Svatek RS, et al. Characteristics and outcomes of patients with clinical T1 grade 3 urothelial carcinoma treated with radical cystectomy: results from an international cohort. Eur Urol. 2010 Feb;57(2):300−309. doi:10.1016/j.eururo.2009.09.024. Epub 2009 Sep 12. Erratum in: Eur Urol. 2015 Jul;68(1):171. PMID: 19766384.
7. Dutta SC, Smith JA Jr, Shappell SB, et al. Clinical under staging of high risk nonmuscle invasive urothelial carcinoma treated with radical cystectomy. J Urol. 2001 Aug;166(2):490−493. PMID: 11458053.
8. Gontero P, Sylvester R, Pisano F, et al. The impact of re-transurethral resection on clinical outcomes in a large multicentre cohort of patients with T1 high-grade/ grade 3 bladder cancer treated with bacille Calmette-Guérin. BJU Int. 2016 Jul;118(1):44−52. doi:10.1111/bju.13354. Epub 2015 Nov 6. PMID: 26469362
9. Naselli A, Hurle R, Paparella S, et al. Role of restaging transurethral resection for T1 non-muscle invasive bladder cancer: A systematic review and meta-analysis. Eur Urol Focus. 2018 Jul;4(4):558−567. doi:10.1016/j.euf.2016.12.011. Epub 2017 Jan 13. PMID: 28753839.10.
10. Mariappan P, Zachou A, Grigor KM. Edinburgh Uro-Oncology Group. Detrusor muscle in the first, apparently complete transurethral resection of bladder tumour specimen is a surrogate marker of resection quality, predicts risk of early recurrence, and is dependent on operator experience. Eur Urol. 2010 May;57(5):843−849. doi:10.1016/j.eururo. 2009.05.047. Epub 2009 Jun 6. PMID: 19524354.
11. Mariappan P, Finney SM, Head E, et al. Edinburgh Urological Cancer Group. Good quality white-light transurethral resection of bladder tumours (GQ-WLTURBT) with experienced surgeons performing complete resections and obtaining detrusor muscle reduces early recurrence in new non-muscle-invasive bladder cancer: validation across time and place and recommendation for benchmarking. BJU Int. 2012 Jun;109(11):1666−1673. doi:10.1111/j.1464-410X.2011.10571.x. Epub 2011 Nov 1. PMID: 22044434.
12. Palou J, Pisano F, Sylvester R, et al. Recurrence, progression and cancer-specific mortality according to stage at re-TUR in T1G3 bladder cancer patients treated with BCG: not as bad as previously thought. World J Urol. 2018 Oct;36(10):1621−1627. doi:10.1007/ s00345-018-2299-2. Epub 2018 May 2. PMID: 29721611; PMCID: PMC8177015.
13. Bishr M, Lattouf JB, Latour M, et al. Tumour stage on re-staging transurethral resection predicts recurrence and progression-free survival of patients with high-risk non-muscle invasive bladder cancer. Can Urol Assoc J. 2014 May;8(5−6):E306-10. doi:10.5489/ cuaj.1514. PMID: 24940455; PMCID: PMC4039592.
14. Hashine K, Ide T, Nakashima T, et al. Results of second transurethral resection for high-grade T1 bladder cancer. Urol Ann. 2016 Jan-Mar;8(1):10−15. doi:10.4103/0974-7796.163798. PMID: 26834394; PMCID: PMC4719498.
15. Kramer MW, Rassweiler JJ, Klein J, et al. En bloc resection of urothelium carcinoma of the bladder (EBRUC): a European multicenter study to compare safety, efficacy, and outcome of laser and electrical en bloc transurethral resection of bladder tumor. World J Urol. 2015 Dec;33(12):1937−1943. doi:10.1007/ s00345-015-1568-6. Epub 2015 Apr 25. PMID: 25910478.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 3-
All articles in this issue
- Vybrané aspekty současné onkourologie
- Nové trendy v diagnostice karcinomu prostaty
- Selhání intravezikální BCG imunoterapie v terapii svalovinu neinvadujících nádorů močového měchýře – současnost a budoucnost léčby
- Zastoupení nekrózy v histologickém preparátu jako prediktor relapsu po chirurgické léčbě lokalizovaného světlobuněčného renálního karcinomu
- Prognostické faktory v časné opakované transuretrální resekci uroteliálního karcinomu močového měchýře bez invaze detruzoru − 10leté zkušenosti referenčního pracoviště
- Riziko biochemické recidivy u pacientů s pozitivním okrajem po radikální prostatektomii
- Amputace penisu pro sarkom
- Okultní karcinom prsu: kazuistika a současné léčebné postupy
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Riziko biochemické recidivy u pacientů s pozitivním okrajem po radikální prostatektomii
- Nové trendy v diagnostice karcinomu prostaty
- Okultní karcinom prsu: kazuistika a současné léčebné postupy
- Amputace penisu pro sarkom
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

