-
Medical journals
- Career
Perioperační výživa ve světle doporučení
(a ve stínu praxe)
Authors: I.satinský 1,2
Authors‘ workplace: Mezioborová jednotka intenzivní péče − pro chirurgické obory, Nemocnice Havířov 1; Ústav ošetřovatelství, Fakulta veřejných politik, Slezská univerzita v Opavě 2
Published in: Rozhl. Chir., 2021, roč. 100, č. 2, s. 49-59.
Category: Review
Overview
U pacientů malnutričních nebo v kritickém stavu se stává nutriční péče jednou ze základních podmínek úspěšného zotavení. Malnutrice je u chirurgického pacienta významným negativním faktorem, který má vliv na pooperační morbiditu i letalitu. Je jevem poměrně častým zvláště u onkochirurgických pacientů, u seniorů a u pacientů s chronickým onemocněním zažívacího traktu. Problematika špatného nutričního stavu by měla být lékařem řešena od chvíle, kdy se nemocný stává pacientem. Snaha o ovlivnění malnutrice by měla pokrývat celé perioperační období – od zahájení diagnostického procesu přes hospitalizaci s případným operačním výkonem a pooperačním zajištěním nutrice až po monitoraci nutričního stavu po dimisi při dalším ambulantním sledování. Pro celou tuto širokou problematiku existuje recentní evropské i české doporučení přijaté Českou chirurgickou společností a dalšími odbornými společnostmi. V praxi však realizace těchto doporučených postupů mnohdy naráží na překážky, které vedou k nízké implementaci těchto guidelines. Péče o výživu je povinnou součástí léčby chirurgického pacienta jak v ambulantní, tak v nemocniční fázi celého procesu.
Článek je komentovaným výběrem doporučení nutriční péče o chirurgického pacienta Evropské společnosti pro parenterální a enterální výživu (ESPEN) z roku 2017 a konsenzuálního hlasování pracovní skupiny Společnosti klinické výživy a intenzivní metabolické péče (SKVIMP) z roku 2018.
Klíčová slova:
perioperační výživa – chirurgický pacient – doporučení
ÚVOD
Malnutrice je u chirurgického pacienta významným negativním faktorem, který má vliv na pooperační morbiditu i letalitu. Je jevem poměrně častým zvláště u onkochirurgických pacientů, u seniorů a u pacientů s chronickým onemocněním trávicího traktu. Souvislost mezi nutričním stavem a pooperačními výsledky poprvé zdůraznil Studley v roce 1936, kdy referoval o výsledcích po gastrektomiích u pacientů s chronickým peptickým vředem [1]. Tehdy byl tento výkon zatížen 3,5% letalitou u pacientů, u kterých byla předoperačně zaznamenána ztráta hmotnosti menší než 20 %. U pacientů, kteří zhubli o více než 20 %, byla letalita téměř 10krát vyšší – 33 %. Tento negativní vztah mezi malnutricí a pooperačními výsledky byl opakovaně demonstrován v dalších mnohdy legendárních studiích [2−5].
V osmdesátých letech minulého století byly kromě diagnostiky malnutrice a průkazu jejího negativního vlivu položeny základy sofistikovaného přístupu k ovlivnění nepříznivého nutričního stavu. Především snaha ovlivnit zhoršené hojení ran, rozpad střevních anastomóz a infekční komplikace vedly ke vzniku prvních perioperačních doporučení pro chirurgického pacienta [6].
Je zřejmé, že právě aktuální nutriční stav hraje důležitou roli pro nekomplikovaný průběh hojení, ale i pro dlouhodobou rekonvalescenci po větším chirurgickém výkonu. Jak u pacientů malnutričních, tak u pacientů v dobré nutriční kondici, ale v kritickém stavu se stává nutriční péče jednou ze základních podmínek úspěšného zotavení. Aktuální problematice výživy u kriticky nemocných jsou věnována poslední dvě mezinárodní doporučení [7,8].
Problematika špatného nutričního stavu by měla být lékařem řešena od chvíle, kdy se nemocný stává pacientem − to znamená, že se dostává v ambulantní péči do stadia diagnostiky a léčby. Snaha o ovlivnění malnutrice by tak měla pokrývat celé perioperační období – od zahájení vyšetřování přes hospitalizaci s případným operačním výkonem a pooperačním zajištěním nutrice až po monitoraci nutričního stavu po dimisi při dalším ambulantním sledování.
Zásadním a recentním nutričním doporučením pro chirurgického pacienta je doporučení Evropské společnosti pro parenterální a enterální výživu (ESPEN), které bylo zveřejněno v roce 2017 [9]. Většinu autorů tvořili chirurgové, významný vliv při tvorbě dokumentu měla i společnost ERAS (Enhanced Recovery After Surgery). V roce 2018 z podnětu Společnosti klinické výživy a intenzivní metabolické péče (SKVIMP) vznikla česká mutace evropského doporučení. Znění všech jednotlivých 37 doporučení ESPEN bylo beze zbytku převzato, byl ale formulován komentář k některým těmto tezím [10]. Text české mutace byl přijat Českou chirurgickou společností (ČCHS) jako doporučený klinický postup v roce 2019. Stejně jej akceptovaly další odbornosti podílející se na přípravě chirurgického pacienta před operací nebo na pooperační péči – Česká společnost intenzivní medicíny (ČSIM), Česká společnost anesteziologie, resuscitace a intenzivní medicíny (ČSARIM) a Společnosti klinické výživy a intenzivní metabolické péče (SKVIMP). Proto bylo doporučení prezentováno i v časopisech uvedených odborných společností [11,12]. Práce je komentovaným výběrem z doporučení nutriční péče o chirurgického pacienta ESPEN z roku 2017 a konsenzuálního hlasování pracovní skupiny SKVIMP z roku 2018.
Žádné doporučení nemůže pokrýt každého jednotlivého pacienta v každé konkrétní situaci. Doporučení vycházejí ze zjištěných statistických dat klinických studií. Při biologické variabilitě je vždy nutno v řešení individuální situace zhodnotit sílu doporučení a konkrétní patofyziologickou situaci pacienta. Doporučení jsou zakotvena v čase, ve kterém vznikla. Je proto přirozené, že některé teze, zvláště ty, které už v době svého vzniku jsou spojeny s kontroverzemi a s menší silou důkazů, jsou po určitém čase zásadně změněny, někdy i negovány.
Implementovat doporučení odborných společností do praxe je mnohdy obtížné, v případě zajištění perioperační nutriční terapie to platí snad dvojnásobně. Mezi hlavní překážky patří tradiční pojetí chirurgické péče, přetrvávající dogmata, bagatelizace vlivu nutrice na výsledek operační léčby a zajištění organizace nutriční péče v daném zdravotnickém zařízení. Prosazení nových postupů a komplexního pojetí celého perioperačního období brání i nedostatečná erudice v oblasti výživy u chirurgů a nelékařského zdravotnického personálu (NLZP), ale i prostý nedostatek těchto profesí na daném pracovišti. Důsledkem tak mnohdy bývá skutečnost, že tato problematika je předávána do gesce jiným oborům nebo se neřeší vůbec.
Předkládaná doporučení jsou potřebná brát jako jisté východisko pro léčebný plán a cíl. Vždy bude nezbytné k těmto obecným tezím přiřadit určitého pacienta, a tak případně individualizovat zvolený postup.
Předoperační nutriční terapie v ambulanci
Již při zahájení vyšetřovacího procesu u chirurgického pacienta, nezávisle na tom, jestli bude důvod nebo možnost operačně léčit podstatu potíží, je nutné zjistit aspoň základní fakta o aktuálním nutričním stavu. Patří sem údaje o současné hmotnosti a hodnota body mass indexu (BMI), pacientova dřívější (obvyklá) hmotnost před vznikem potíží a časový údaj, za jak dlouho (v měsících) nastal případný hmotnostní úbytek. Dále je žádoucí zjistit toleranci stravy (nejlépe odhadem v % dřívější tolerance) a příčiny, které k nižší toleranci stravy vedou (nechutenství, porucha polykání, pocit plného žaludku, porucha pasáže, bolesti, celková slabost...). Výše uvedené údaje může kvalitně získat od pacienta i ambulantní sestra. Pomocníkem je existence předdefinovaných otázek a automatický výpočet BMI v nemocničním informačním systému (NIS), který dokáže tyto údaje uchovat pro další sledování.
Doporučení ESPEN jasně deklaruje, že pokud pacient není schopen pokrýt své energetické potřeby běžnou stravou, je v předoperačním období doporučeno podávat těmto pacientům orální nutriční suplementa (ONS) nezávisle na jejich nutričním stavu [9]. Důvod je jasný – je potřeba zabránit dalšímu sníženému příjmu stravy, který by jinak vedl k další ztrátě svalové hmoty a k nežádoucí progresi celkového oslabování organismu před plánovanou operací, obzvláště v případě, kdy předoperační příprava je delší a operační výkon bude větší. Cílem je normalizace metabolické reaktivity a zrušení adaptačního hypometabolismu, který zhoršuje hojení i celkovou odpověď organismu na stres. Některé studie zkoumající vliv podávání ONS u pacientů nezávisle na jejich nutričním stavu neukázaly signifikantní vliv na pooperační průběh, Smedleyho studie ale ukázala významný pokles menších komplikací [13−15]. Je však potřeba zmínit skutečnost, že většina pacientů s kolorektálním karcinomem nebývá v nutričním riziku. To pak vysvětluje, proč metaanalýzy těchto studií neprokazují signifikantní benefit pro pacienta [16].
Větší důraz na přednemocniční zahájení nutriční terapie je u rizikových skupin. U všech malnutričních onkologických pacientů a vysoce rizikových pacientů je před větším chirurgickým výkonem doporučeno předoperační podávání ONS. Obzvláště rizikovou skupinou jsou starší lidé se sarkopenií [9]. Důležitou roli při předoperačním podávání sippingu hraje informovanost pacienta a jeho motivace [17].
Nadále nejasný zůstává postoj k podávání imunomodulačních přípravků. Doporučení ESPEN pro chirurgického pacienta sice podporuje jejich podávání, ale zároveň konstatuje, že neexistují jasné důkazy pro výhradní podávání imunomodulačních diet před podáváním standardních ONS. Proto doporučující tvrzení, že imunomodulační ONS obsahující arginin, omega-3 mastné kyseliny a nukleotidy jsou preferovány a mají být podávány 5 až 7 dní před operací, je založeno jen na dobré klinické zkušenosti (good practice points). Při hlasování v evropské pracovní skupině získalo toto doporučení jen většinový souhlas (64 %), v české pracovní skupině SKVIMP byla shoda (88% souhlas) [9,10].
Nedílnou součástí zahájení případné nutriční terapie u rizikových pacientů je nutriční screening. Měl by být proveden na začátku vyšetřovacího procesu před každou větší operací. Všeobecně jsou doporučeny screeningové dotazníky Nutritional Risk Screening 2002 (NRS 2002), Malnutrition Universal Screening Tool (MUST), Mini Nutritional Assessment – short form (MNA-SF) [18-20]. Z českých skórovacích systémů je pro onkochirurgické pacienty vhodný dotazník pracovní skupiny nutriční péče v onkologii při České onkologické společnosti (PSNPO) [21]. Všechny dotazníky lze implementovat do nemocničního informačního systému tak, že jejich vyplnění je otázkou několika minut a výsledek je k dispozici okamžitě. Není potřeba laboratorních testů. Přehled všech zmíněných testů je obsahem sdělení Skoblej, et al v tomto čísle Rozhledů v chirurgii [22]. Lze je také nalézt na webových stránkách ČCHS a SKVIMP [23,24].
I když v mnoha českých nemocnicích se stal nutriční screening nedílnou součástí předoperační přípravy, nadále naráží jeho implementace na četné problémy. Někde je to nedostatek zdravotnického personálu, přetížení celého systému ambulantní péče, někde se stále ještě jedná o nepochopení významu nutrice pro chirurgického pacienta nebo posouvání této problematiky jiným odbornostem. Častou chybou je, že nutriční screening je prováděn jen bezprostředně před plánovanou hospitalizací (nebo dokonce až v den přijetí), kdy možnosti pozitivně ovlivnit aktuální nutriční stav jsou pak výrazně limitovány časem.
Pro většinu malnutričních pacientů před operací jsou to právě orální nutriční suplementa – sipping, která mají potenciál zastavit progresivní ztrátu svalové hmoty, dodat organismu větší nálož proteinů, ale i vitaminů a stopových prvků. Donedávna mohl ONS ambulantně předepisovat pouze nutricionista (lékař s atestací z umělé výživy a intenzivní metabolické péče, nebo lékař − nositel funkční licence F 016 – umělá výživa a metabolická péče), a to na neomezenou dobu. Od roku 2013 může tyto přípravky předepisovat i onkolog, ale jen na omezenou dobu 4 týdnů. Od 1. 5. 2020 je i chirurgovi dána možnost preskribovat sipping za určitých podmínek na omezenou dobu 4 týdnů [25]. To výrazně usnadňuje cíleně ovlivnit alterovaný nutriční stav jak předoperačně, tak pooperačně. Je vždy možné (a pro chirurga snadnější) poslat rizikového pacienta k preskripci sippingu nutricionistovi do místní fungující nutriční ambulance. Ale pokud je objednací doba u tohoto specialisty delší než 1 týden, pak je splněna podmínka pro možnost preskripce sippingu přímo chirurgem na 1 měsíc. Právě jeden měsíc se považován za dostatečnou dobu, aby ambulantní pacient přešel do pravidelné péče nutricionisty.
Závěr panelu expertů ESPEN pak doporučuje, aby předoperační enterální výživa nebo orální nutriční doplňky (ONS) byly přednostně podávány ještě před přijetím do nemocnice, aby se předešlo zbytečné hospitalizaci a snížilo se tak riziko nozokomiálních nákaz [9].
Existuje skupina pacientů, u kterých je trávicí trakt funkční do té míry, že jej lze využít k aplikaci výživy, ale klasický sipping není možný. Jsou to nemocní s výrazným nechutenstvím, poruchou polykání nebo porušenou motilitou žaludku. Zde je indikována enterální sondová výživa, nejčastěji formou nazogastrické nebo nazojejunální výživy. Domácí předoperační enterální výživu lze realizovat za pomoci agentury domácí péče nebo aplikaci zvládne sám pacient s rodinnými příslušníky po zevrubné edukaci. Samozřejmostí je použití mobilních enterálních pump, které neomezují pacienta v pohybu, případně ani v pracovních povinnostech. Tento způsob výživy zajišťuje nutricionista.
V případech, kdy u malnutričního pacienta nelze sipping podávat, je nutné zvážit jinou cestu aplikace nutričních přípravků. Zejména jsou to pacienti se stenózou jícnu, výraznou funkční poruchou motility zažívacího traktu nebo pacienti s již dříve založenou derivační jejunostomií nebo ileostomií, kdy perorální příjem není vůbec možný nebo je nedostatečný při klinicky přítomném syndromu krátkého střeva z důvodů malabsorpce nebo maldigesce. Zde je možná domácí parenterální výživa jako prostředek k ovlivnění nepříznivého nutričního stavu. Předoperační parenterální výživa má být podávána pouze pacientům s malnutricí nebo s vysokým nutričním rizikem, u kterých energetické požadavky nemohou být pokryty enterálně. Je doporučeno podávání 7–14 dnů [9]. Toto časové doporučení se týká pacientů s maligním onemocněním, kdy si nemůžeme dovolit delší odklad operace. V případě odložitelných operací u malnutričních pacientů a při současně zlepšujícím se nutričním stavu nutriční péčí je předoperační příprava prodlužována na dobu podstatně delší. Zlepšování nutričního stavu tak má význam aspoň po dobu 4 týdnů.
Pozitivní vliv předoperačního podávání parenterální výživy je patrný pouze u pacientů s těžkou malnutricí (hmotnostní úbytek >15 %) před velkým výkonem na trávicím traktu. Analýza databáze Cochrane potvrdila významné snížení komplikací z 45 % na 28 % právě u pacientů podstupujících gastrointestinální operaci a zajištěných předoperační parenterální výživou [16,26]. Neexistují studie srovnávající předoperační podávání parenterální výživy 7 dnů a podávání 10–14 dnů. Podmínkou pro parenterální nutriční přípravu v domácím prostředí je existence erudovaných lokálních agentur domácí péče, zkušený nutricionista, fungující logistika dodávky nutričních přípravků a spotřebního materiálu a v neposlední řadě nasmlouvání kódu pro podávání parenterální výživy v domácím prostředí praktikujícím zdravotnickým zařízením. U soběstačných pacientů je vhodné použít mobilní pumpu k aplikaci parenterální výživy. Nejčastější cestou podávání je z periferie zavedený centrální žilní katétr (peripherally-inserted central catheter − PICC).
Předoperační nutriční terapie při hospitalizaci
U nutričně bezproblémových pacientů přijatých do nemocnice před velkým operačním výkonem je žádoucí udržení optimálního příjmu pestré stravy do operačního dne. Při delší předoperační hospitalizaci může docházet iatrogenně k navození proteinového deficitu především v důsledku ztráty chuti k jídlu v nemocničním prostředí a při nevyhovující dietě, častěji pak vlivem vyšetřovacích metod vyžadujících lačnění před jejich provedením. Svůj negativní vliv má i současné snižování fyzické aktivity.
U pacientů v nutričním riziku nebo vyloženě malnutričních je potřeba pokračovat v dříve nastavené ambulantní nutriční terapii, nejčastěji formou sippingu, v těžších případech parenterální výživou. Pokud nebyla malnutrice řešena ambulantně nebo nebyla dokonce před přijetím diagnostikována, jsou možnosti její korekce výrazně limitovány.
U pacientů před velkým chirurgickým výkonem s vysokým nutričním rizikem je doporučeno předoperačně podávat nutriční léčbu dokonce i v případě, že operace, včetně operace pro nádor, bude odložena. Přiměřené období aplikace je 7–14 dní [9]. Toto doporučení v praxi naráží především na organizační problémy. Při nedostatku volných lůžek v nemocnici je mnohdy obtížné zajistit dvoutýdenní hospitalizaci s primárním cílem podávání nutriční terapie. Pro implementaci tohoto doporučení je tak vhodné, aby chirurgické pracoviště dokázalo zajistit aplikaci domácí enterální nebo parenterální výživy předáním pacienta do péče místního nutricionisty. Řešením, které nezatíží lůžkový fond, je výše zmíněná možnost podávat parenterální výživu v domácím prostředí. Je kdykoliv možné kombinovat perorální výživu s parenterální výživou v situacích, kdy je potřeba dosáhnout energetické cíle a příjem orální cestou je limitován (např. stenózou horního trávicího traktu). Parenterální výživa by měla být navyšována postupně při laboratorním a kardiálním monitorování s přiměřenou náhradou draslíku, hořčíku, fosfátu a thiaminu ve snaze vyhnout se refeeding syndromu u těžce malnutričních pacientů [10].
S postupným zaváděním protokolu ERAS (Enhanced Recovery After Surgery) do běžné praxe chirurgických oddělení je jen pozvolna vytěsňováno tradiční pojetí předoperačního lačnění a žíznění. Nejsou důkazy o tom, že by pacient popíjející do 2 hodin před plánovanou operací byl více ohrožen rizikem aspirace. Proto je doporučeno, aby pacienti před plánovaným chirurgickým výkonem, u kterého není zvýšené riziko aspirace, popíjeli čiré tekutiny do 2 hodin před anestezií. Jíst tuhou stravu je povoleno do 6 hodin před anestezií [9]. Čirými tekutinami jsou např.: kohoutková voda, minerální vody, čaj, ovocné šťávy bez dužiny. Výjimkou jsou pacienti s již známým zpomaleným vyprazdňováním žaludku v anamnéze nebo s ezofagogastrickým refluxem. U většiny pacientů je hladovění od půlnoci před plánovaným výkonem zbytečné. Stejného znění je recentní doporučení společnosti ERAS pro perioperační péči v kolorektální chirurgii z roku 2019 [27].
Západoevropské a severoamerické anesteziologické společnosti zařadily toto doporučení do svých guidelines již v letech 2002–2006. Dokument ČSARIM – Doporučení pro omezování příjmu tekutin a stravy před anesteziologickou péčí platí od roku 2011.
Místo nočního žíznění před operací je doporučeno popíjet sacharidové roztoky ke snížení perioperačního dyskomfortu. U větších chirurgických operací je vhodné zvážit předoperační podávání cukerných roztoků ke snížení pooperační inzulinové rezistence a pro zkrácení doby hospitalizace [9]. Obvykle podávaný objem tekutin (800 ml během noci a 400 ml do 2 hodin před operací) nezvyšuje riziko aspirace. Nejčastěji je používán 12,5% roztok maltodextrinu, mohou ale být použity i ovocné šťávy nebo sladký čaj. Pití slazených tekutin může mít pozitivní vliv na pooperační nauzeu a zvracení. Slazené tekutiny by neměly být podávány u těžkých diabetiků, zvláště s poruchou vyprazdňování žaludku.
Kromě obtížného překonávání dogmat z minulosti brání plné implementaci tohoto doporučení i samotný provoz na chirurgických pracovištích. Akutní změny v plánovaném operačním programu mohou vést k časové kolizi začátku operace s ukončením perorálního příjmu. V praxi se proto osvědčuje povolení příjmu tekutin do 6 : 00 u všech plánovaných výkonů s tím, že po ranní pracovní schůzce je aktualizován operační program. Tak mohou pacienti jdoucí na operaci později popíjet případně i během dopoledne s dodržením nezbytného dvouhodinového žíznění před anestezií.
Další častou chybou v předoperačním žíznění je restrikce povoleného objemu tekutin v noci a ráno před výkonem ze strany ošetřujícího chirurga nebo anesteziologa. Pro dosažení účinku na obvyklou pooperační inzulinovou rezistenci je rozhodující právě množství sacharidů přijatých formou sladkých roztoků popíjených v noci a ráno.
Pooperační nutriční terapie při hospitalizaci
Zatímco u zdravého člověka úmyslné nebo neúmyslné krátkodobé vynechání stravy nemá prakticky žádné negativní důsledky, u nemocného člověka je situace poněkud jiná. Přerušení dodávky nutrietů zvláště u malnutričního onkochirurgického pacienta může mít své závažné konsekvence. Proto je obecným doporučením pokračovat v perorálním příjmu po operaci prakticky bez přerušení. Je vhodné přizpůsobit perorální příjem individuální toleranci pacienta a typu chirurgického výkonu se zvláštní pozorností na starší pacienty. U většiny pacientů je vhodné zahájit perorální příjem čirými tekutinami během několika hodin po operaci [9].
Časné pooperační zahájení perorálního příjmu je možné po většině chirurgických zákroků a není spojeno s větším rizikem střevních dehiscencí. Významně snižuje počet komplikací ve srovnání s tradičním postupem, který oddaloval zahájení perorálního příjmu. Časné zahájení perorální výživy vede k výraznému pozitivnímu vlivu na pooperační letalitu, četnost dehiscencí anastomóz a na délku hospitalizace [28]. Včasné zahájení perorálního příjmu patří ke klíčovým kapitolám koncepce Enhanced Recovery After Surgery (ERAS). Po kolorektálních operacích je provádění snadné a bezpečné, ale je možné i po gastrektomiích při vynechání nazojejunální sondy, navíc s důsledkem kratší doby hospitalizace [29].
Konkrétní množství a druh diety musí být přizpůsoben gastrointestinálním funkcím a individuální toleranci pacientem. I po stejném typu chirurgického výkonu může být tolerance pooperační diety různá v závislosti na postižení organismu základní i přidruženými chorobami, dále na věku, přítomnosti vegetativních příznaků, břišního dyskomfortu a na funkčním stavu trávicího traktu.
V zahájení pooperačního perorálního příjmu však v praxi stále převažuje často zdrženlivost, až obavy z možných důsledků časného zatížení trávicího traktu. Tradiční pojetí obnovení dietního systému přetrvává v praxi jak u sester, které z opatrnosti a z obav z aspirace samy oddalují zahájení perorálního příjmu, tak ze strany lékařů, kteří ordinují pouze tekutiny i několik dní po operaci v domnění, že dřívější koncepce „bowell rest“ povede ke snížení komplikací. Rezervovanost v časném obnovení perorálního příjmu je tak podobná tradicionalismu v zahajování vertikalizace a rehabilitace po operacích. Jak vzdálena je každodenní praxe na chirurgických pracovištích od doporučení ERAS v těchto kapitolách, prokázala studie Rysky (2013) [30]. Lze však optimisticky předpokládat, že s postupující mírou implementace koncepce ERAS na chirurgických pracovištích je současná praxe již odlišná.
Zatímco běžný chirurgický pacient při nekomplikovaném pooperačním průběhu nevyžaduje nutriční podporu díky rychle se obnovujícímu perorálnímu příjmu a adekvátnímu dietnímu režimu, existuje velká skupina pacientů, u kterých je nutriční terapie indikována. Opět je nutné zdůraznit časnou diagnostiku malnutrice nebo stanovení výše nutričního rizika. V detekci malnutrice, v monitorování stavu výživy a pro případnou indikaci a korekci nutriční péče hrají nezastupitelnou úlohu nutriční terapeuti. Jsou kvalifikováni k přesnému zhodnocení nutričního rizika s následným doporučením adekvátní nutriční intervence [10]. Jejich úloha je ale většinou omezena na standardní chirurgická lůžka. Diagnostika malnutrice a nutričního rizika u pacienta v intenzivní péči patří k povinnostem ošetřujícího lékaře.
Perioperační nutriční terapie je indikována u pacientů s malnutricí a u těch, kteří jsou v nutričním riziku. Perioperační nutriční terapie by měla být zahájena také v případě, kdy se předpokládá u pacienta nemožnost jíst po dobu více než 5 dnů po operaci. Je také indikována u pacientů, u kterých se předpokládá nedostatečný perorální příjem a kteří nejsou schopni přijmout více než 50 % doporučeného příjmu po dobu delší než 7 dní. V těchto případech je doporučeno bez prodlení zahájit nutriční terapii (s preferencí enterálního příjmu použitím orálních nutričních suplementů nebo použitím sondové výživy) [9]. V tomto doporučení ESPEN byla i u české mutace doporučení dosažena silná shoda (100% souhlas) [10].
Nedostatečný perorální příjem delší než dva týdny je spojen s vyšší letalitou. Při nemoci jsou obvyklé požadavky na pokrytí energetických potřeb 25–30 kcal/kg a na dodávku proteinů 1,2–1,5 g/kg ideální hmotnosti. Ideální hmotnost je vztažena k BMI 25.
Enterální způsob nutriční terapie by měl být vždy preferován, kromě těchto kontraindikací:
- střevní neprůchodnost nebo ileus,
- těžký šokový stav,
- střevní ischemie,
- střevní píštěl s velkou produkcí,
- výrazné krvácení v gastrointestinálním traktu.
Je doporučeno zahájit enterální výživu časně – do 24 hodin.
Časná sondová enterální výživa (během 24 hodin) má být podávána pacientům, u kterých nelze zahájit časný perorální příjem a u kterých se předpokládá, že perorální příjem bude nedostatečný (méně než 50 %) více než 7 dnů [9]. Zvlášť rizikoví jsou pacienti:
- podstupující větší výkon na hlavě a krku nebo na zažívacím traktu pro nádor,
- s těžkým úrazem zahrnujícím poranění mozku,
- se zřejmou malnutricí v době výkonu.
Výsledky studií ukazují, že je bezpečné podávat výživu perorálně i po resekčních výkonech na žaludku (včetně gastrektomie) nebo po totálních laryngektomiích [31−34]. Pacienti po velkých výkonech na hlavě a krku nebo pacienti po onkochirurgických výkonech na horním zažívacím traktu (včetně pankreatu) jsou obvykle již před operací malnutriční a mají vyšší riziko rozvoje septických komplikací. Pooperační perorální příjem ale často vázne díky otoku, obstrukci nebo poruše vyprazdňování žaludku. V takové situaci je pak problémem naplnit nutriční požadavky, a právě sondová výživa aplikovaná až do jejuna je prostředkem k dosažení adekvátního příjmu živin.
U většiny pacientů je plně dostačující standardní polymerní výživa. Kuchyňská mixovaná strava pro sondovou výživu není všeobecně doporučena pro technické problémy se srážením v sondě a pro riziko infekce [9]. Většina pacientů tak může být živena standardními přípravky. Dokonce ani v případech nazojejunální sondové výživy není nutná oligomerní výživa. Kuchyňské mixované výživy jsou nutričně nevyvážené, mají krátkou dobu trvanlivosti a nesou s sebou infekční riziko z možné kontaminace různými mikroorganismy. Mají také vysoké riziko srážení se v sondě. Toto riziko dané vysokou viskozitou může být sníženo, pokud bude obsah energie kolem 1 kcal/ml a pokud standardní enterální složení bude na mléčném základě. Doma připravované výživy mohou být zvažovány v individuálních případech, kdy jsou připravovány pro jednotlivce a kdy je riziko kontaminace menší než při přípravě v institucích, které připravují dietu pro více klientů. Nevýhodou kuchyňsky mixované výživy je neplnohodnotné složení.
Pokud nelze dosáhnout energetické a nutriční cíle perorálním nebo enterálním příjmem (méně než 50 % kalorického cíle) po dobu delší než 7 dní, je doporučeno kombinovat enterální výživu s parenterální výživou. Parenterální výživa by měla být zahájena co nejdříve, pokud je indikována a pokud je enterální výživa kontraindikována jako u střevní obstrukce [9].
U chirurgických pacientů je parenterální výživa vhodná v případech, kdy pacient je malnutriční a enterální výživa u něj není možná nebo není tolerovaná. Stejně vhodná je u pacientů, u kterých pooperační komplikace zhoršují gastrointestinální funkce, a pacienti tak nejsou schopni tolerovat a absorbovat adekvátní množství perorální nebo sondové výživy přinejmenším 7 dní. Efekt parenterální výživy ve srovnání s enterální výživou zůstává kontroverzní. Není patrný rozdíl ve smrtnosti, počtu infekčních komplikací a v délce hospitalizace v obou skupinách. Není jasné, zda případné nasazení parenterální výživy má být co nejdříve nebo 4. den nebo až 7. den po nasazení enterální výživy. Tento transatlantický nesoulad je patrný i z recentního doporučení ESPEN na jedné straně a posledních doporučení A.S.P.E.N. (American Society for Parenteral and Enteral Nutrition) a americké SCCM (Society of Critical Care Medicine) na straně druhé [7,35].
V praxi je běžnou chybou, že u malnutričního pacienta po oběhové stabilizaci nenavazuje nutriční terapie bezprostředně po operaci. U pacientů v dobré nutriční kondici lze několik dnů vystačit s podáváním sacharidových roztoků (jako zdroje energie) a krystaloidních roztoků (k zajištění optimální hydratace) při postupně se obnovujícím perorálním příjmu. U těchto operantů je vhodné podávat minimálně 150–200 g glukózy denně na pokrytí základních energetických požadavků. U nutričně kompromitovaných pacientů je ale nutné zahájit/pokračovat v nutriční podpoře co nejdříve po operaci, neboť jejich nutriční rezervy jsou předcházejícím průběhem choroby vyčerpány. Při preferenci enterálního způsobu výživy je výhodné u některých typů výkonů (např. operace na jícnu, gastroduodenu nebo pankreatu) již peroperačně zavést nazoenterální sondu nebo založit nutritivní jejunostomii.
Je doporučeno začít aplikovat sondovou výživu pomalou rychlostí (např. 10 ml/hod., maximálně 20 ml/hod.) a navyšovat rychlost opatrně a individuálně vzhledem k omezené střevní toleranci. Doba potřebná k dosažení cílového příjmu může být velmi rozdílná a bývá 5 až 7 dnů [9]. Navyšování rychlosti aplikace se ale děje při dobré toleranci pacientem i několikrát denně, takže je možné během 48−96 hodin dosáhnout dostatečného objemu aplikované výživy. Standardním způsobem je kontinuální podávání (celých 24 hodin) nebo podávání cyklické s obvyklým nočním přerušením na dobu 8–10 hodin [29,36]. Některými autory je rutinní založení nutritivní jejunostomie považováno za léčbu nadbytečnou a navrhují ji pouze u vysoce rizikových pacientů [37−39]. Některé metaanalýzy nepřinesly jasný klinický rozdíl mezi použitím nutritivní jejunostomie a parenterálního přístupu [40]. Protože nazojejunální nebo nazoduodenální sondy bývají spojeny s časnou dislokací, pracovní skupina ESPEN (2017) preferuje založení nutritivní jejunostomie před nazojejunální nebo nazoduodenální sondou [9]. Vazopresorická podpora není kontraindikací k podávání enterální výživy.
U malnutričních pacientů, kde není možné použít enterální aplikaci výživy, je nutné pokrýt energetické a proteinové požadavky adekvátním složením parenterální výživy bez zbytečné prodlevy. V současnosti jsou již na trhu enterální a parenterální přípravky s vysokým obsahem proteinů. U kriticky nemocných pacientů je v časné fázi preferována vyšší dávka proteinů před vyšší kalorickou náloží. V rozsáhlé prospektivní studii (1137 mechanicky ventilovaných pacientů) byla zjišťována spojitost mezi letalitou a množstvím dodávané energie a množstvím dodávaných proteinů [41]. Zatímco byla zjištěna lineární závislost mezi smrtností a dodávkou bílkovin (čím více dodaných proteinů, tím byla letalita menší), tak závislost na dodání energie je charakterizována U křivkou, kdy nejnižší smrtnost byla spojena s dodávkou 70% energetického cíle vypočítaného pomocí nepřímé kalorimetrie (Graf 1).
Graph 1. Souvislost mezi letalitou a dodávkou energie (vlevo) a letalitou a dodávkou bílkovin (vpravo) Upraveno dle Zusmana [41].
Graph 1: Association between lethality and energy supply (left) and between lethality and protein supply (right) Adapted to Zusman [41].![Souvislost mezi letalitou a dodávkou energie (vlevo) a letalitou a dodávkou bílkovin (vpravo)
Upraveno dle Zusmana [41].<br>
Graph 1: Association between lethality and energy supply (left) and between lethality and protein
supply (right) Adapted to Zusman [41].](https://pl-master.mdcdn.cz/media/image_pdf/fff063e42b184d0e4563ec41f0a3e554.png?version=1616623168)
Trojkomorové vaky parenterální výživy (all-in-one) nebo vaky připravované v lékárně by měly být preferovány před systémem mnoha láhví (multibottle system). Pro zajištění účinné nutriční péče je doporučena existence standardního protokolu pro nutriční podporu [9]. U dlouhodobé úplné parenterální výživy je nezbytné zvážit adekvátní náhradu mikronutrientů a vitaminů.
Imunonutrice
Změna pohledu i přetrvávající kontroverze jsou typické pro problematiku podávání glutaminu, omega-3 mastných kyselin a imunonutrientů.
Obecně se dá konstatovat, že v současné době neexistují jasné důkazy pro doporučení podávat glutamin parenterálně [42]. Na základě kontroverzních výsledků studií nebylo pro chirurgické pacienty v roce 2009 vydáno žádné doporučení ze strany ESPEN [43]. Většina nekomplikovaných chirurgických pacientů (zvláště po plánovaných kolorektálních operacích) není kandidáty výlučného podávání parenterální výživy, a proto žádné silné doporučení pro parenterálně živené chirurgické pacienty není v současnosti oprávněné. Nyní nejsou dostupná ani data, která by dokazovala pozitivní vliv parenterálně podávaného glutaminu v kombinaci s orální/enterální výživou. Nedostatek silných důkazů se tak odrazil i v mírně rezervovaném názoru české pracovní skupiny SKVIMP na podávání glutaminu (88% souhlas) [10]. Existuje omezený počet dat o perorálním podávání glutaminu jako jediném suplementu.
Parenterální suplementace glutaminu může být zvážena u pacientů, kteří nemohou být adekvátně živeni enterálně, a proto vyžadují pouze parenterální výživu [9].
Průkaznější data existují o benefitu omega-3 mastných kyselin. Parenterální podávání těchto kyselin u chirurgických pacientů vedlo k významnému zlepšení, co se týká pooperačního výskytu infekčních komplikací a délky hospitalizace [43−45]. Existují ale metodologické nesrovnalosti v pojetí a definici infekčních komplikací a délky hospitalizace. Proto pracovní skupina ESPEN v roce 2017 zvolila omezený stupeň doporučení B, zato český konsenzus byl nad zněním textu jednoznačný (100% souhlas) [10].
Pooperační parenterální výživa včetně omega-3 mastných kyselin by měla být zvážena pouze u pacientů, kteří nemohou být adekvátně živeni enterálně, a proto vyžadují parenterální výživu [9].
Perioperační nebo alespoň pooperační podávání speciálních formulí obohacených imunonutrienty (arginin, omega-3 mastné kyseliny, ribonukleotidy) by mělo být aplikováno u malnutričních pacientů podstupujících velký onkochirurgický výkon.
Existuje velký počet studií s použitím imunomodulačních ONS nebo sondové výživy obsahující arginin, omega-3 mastné kyseliny a ribonukleotidy s nebo bez glutaminu a jejich metaanalýz. Tyto studie vykazují při perioperačním podávání těchto formulí snížení počtu pooperačních komplikací a zkrácení doby hospitalizace. Guidelines ASPEN z roku 2009 silně doporučují tyto přípravky pro malnutriční onkochirurgické pacienty [35]. Francouzské doporučení je určeno pro pacienty s plánovaným výkonem na zažívacím traktu aplikací předoperační „farmakoterapie“ po dobu 5–7 dnů bez ohledu na to, zda jsou malnutriční nebo nikoli [47]. Guidelines ESPEN z roku 2016 dávají silné doporučení pro onkologické pacienty podstupující resekční výkon na horním zažívacím traktu [48].
Avšak metodologické rozbory těchto studií a jejich metaanalýz vedou k rezervovanému přístupu pro silné doporučení na obecné používání imunomodulačních formulí. Je to díky heterogenitě jednotlivých studií včetně rozdílných údobí aplikace a nedostatku homogenních kritérií pro definici komplikací a propuštění z nemocnice [49].
Velká část studií kolem roku 2000 prokazovala, že pre a perioperační podávání ONS s imunonutrienty po dobu 5–7 dnů snížila pooperační morbiditu a délku hospitalizace po velkých břišních onkochirurgických operacích, zvláště u malnutričních pacientů. Podávání imunonutrientů bylo zařazeno i do doporučení ERAS. Existují studie, které zaznamenaly benefit pro pacienty s karcinomem hlavy a krku nebo pro pacienty po traumatech a popáleninách. V současnosti neexistuje žádné jasné doporučení pro parenterální nebo enterální suplementaci argininu jako jednotlivé substance.
Pooperační nutriční terapie po propuštění
Navzdory předoperační nutriční terapii dochází u řady pacientů v důsledku pooperačních komplikací k dalšímu zhoršování stavu výživy. Někdy je příčinou dlouhodobý neadekvátní perorální příjem. Často může komplikovaný pooperační průběh i pacienta v původně dobrém nutričním stavu posunout do stavu malnutričního, zvláště pokud mu není podávána adekvátní výživa. V posuzování nutričního stavu před propuštěním z nemocnice (stejně jako během celého perioperačního období) hraje důležitou roli nutriční terapeut. Je kvalifikován k přesnému zhodnocení nutričního rizika s následným doporučením adekvátní nutriční intervence [10]. Právě zkušenosti nutričního terapeuta je možné využít ke zhodnocení aktuálního nutričního rizika před dimisí.
Table 1. Stručný souhrn doporučení ESPEN s konsenzuálním hlasováním pracovní skupiny SKVIMP
Tab. 1: Brief summary of ESPEN guidelines with consensual voting of the working group of the Czech Society for Clinical Nutrition and Intensive Metabolic Care (SKVIMP)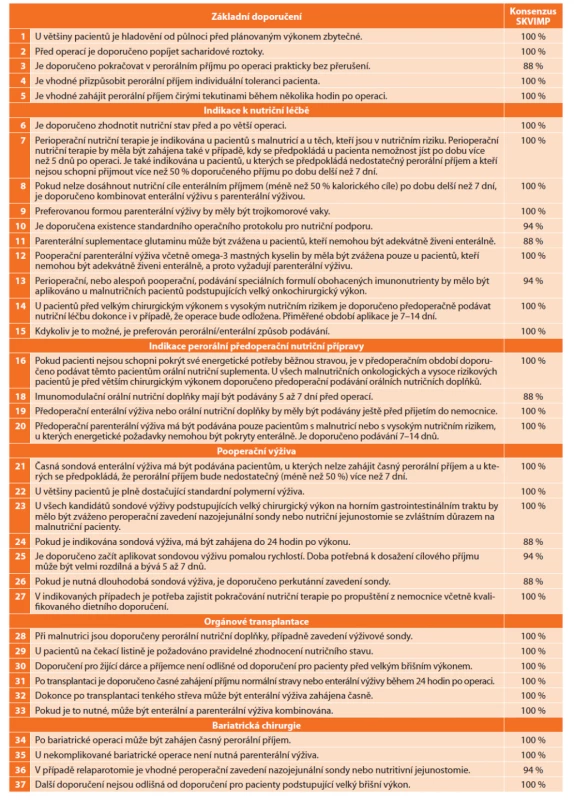
Častou chybou v praxi je přerušení nutriční terapie při překladu z lůžka JIP na standardní lůžko nebo při propuštění ze standardního oddělení domů. Bývá to vlivem mnohdy neopodstatněného názoru, že pacientův stav je natolik dobrý, že již nutriční podporu nepotřebuje. Paradoxně u pacienta v rekonvalescenční anabolické fázi je potřeba vyrovnat výrazně negativní jak proteinovou, tak především kalorickou bilanci z předcházejících dnů či týdnů. Ta v období bezprostředně po operaci zaznamenává kumulativní propad právě v oblasti těchto dvou položek. Ztráta svalové hmoty zásadně mění dobu rekonvalescence i po propuštění z nemocnice. Často pak ještě trvá 6–12 měsíců, než se pacient, který prošel komplikovaným pooperačním průběhem, dostane na optimální úroveň svých fyziologických funkcí. Je proto potřeba dřívější ztráty hradit zvýšeným příjmem proteinů a kalorií. Pro tyto účely je vhodný sipping, v nutných případech i prodloužení aplikace enterální nebo suplementární parenterální výživy.
Jednoduchým nástrojem pro sledování nutričního stavu je sledování hmotnosti a BMI. Hodnota BMI ale není schopna zachytit změny v tělesném složení u neměnných hodnot BMI. Důležité je monitorovat změnu hmotnosti v časové ose, míru tolerance pacienta ke stravě i případným ONS. Právě sipping doporučený i po propuštění z nemocnice je účinným nástrojem ke korekci přetrvávající malnutrice nebo jako prevence možného nutričního rizika při neschopnosti pacienta tolerovat adekvátní množství energie a proteinů. Takovýto pacient by měl být zajištěn pro domov preskripcí sippingu cestou nutričního konziliáře již před propuštěním. V případě, že nelze nutričně kompromitovaného chirurgického nemocného takto zajistit, má chirurg i bez funkční licence F 016 (umělá výživa a metabolická péče) možnost pacienta vybavit receptem zajišťujícím ONS na dobu 4 týdnů [22]. Měsíční pokrytí nutričních potřeb pacienta zajistí, že v dalším období může nutriční péče kontinuálně pokračovat v lokální nutriční ambulanci s dlouhodobým sledováním a zajištěním preskripce dalších nutričních přípravků nutricionistou.
U pacientů, kteří perioperačně měli nutriční terapii a nadále nejsou schopni pokrýt své energetické požadavky perorálním příjmem, je doporučeno pravidelné hodnocení nutričního stavu během hospitalizace. V indikovaných případech je potřeba zajistit pokračování nutriční terapie po propuštění z nemocnice včetně kvalifikovaného dietního doporučení [9].
Adekvátní dietní režim je silně doporučován a má svůj význam u většiny pacientů. Nutritivní jejunostomie nemusí být odstraňována při propuštění, ale zůstává tak výhodnou možností aplikace suplementární enterální výživy (např. s noční dávkou 500–1000 kcal/den). Domácí používání nutritivní jejunostomie se ukazuje jako bezpečné a snadné.
Dostupná data jasně neprokazují, že rutinní podávání ONS zlepšuje celkové výsledky, ale ukazují benefit pro nutriční stav, snížení rizika výskytu menších komplikací. Jejich konzumace vede ke zlepšení subjektivního pocitu a kvality života pacientů, kteří nedokážou své nutriční požadavky pokrýt běžnou stravou doma. To platí především pro nemocné po velkých výkonech na trávicím traktu a pro geriatrické pacienty.
Stručný souhrn základních doporučení a tezí pro perioperační výživu je uveden v tabulkovém přehledu [9,12].
Závěr
Malnutrice je u chirurgického pacienta významným negativním faktorem, který má vliv na pooperační morbiditu i letalitu. Je jevem poměrně častým zvláště u onkochirurgických pacientů, u seniorů a u pacientů s chronickým onemocněním trávicího traktu. Problematika špatného nutričního stavu by měla být lékařem řešena od chvíle, kdy se nemocný stává pacientem, tzn. přechází do odborné péče. Snaha o ovlivnění malnutrice by měla pokrývat celé perioperační období – od zahájení diagnostického procesu přes hospitalizaci s případným operačním výkonem a pooperačním zajištěním nutrice až po monitoraci nutričního stavu po dimisi při dalším ambulantním sledování. Pro celou tuto problematiku existuje recentní evropské i české doporučení přijaté Českou chirurgickou společností a dalšími odbornými společnostmi. Současná doporučení odborných společností zdůrazňují péči o výživu jako povinnou součást chirurgické léčby jak v ambulantní, tak nemocniční fázi celého procesu. Implementace doporučení naráží na tradiční stereotypy, bagatelizaci problému i organizační nedostatky. Praxe tak často zaostává za doporučenými klinickými postupy.
Konflikt zájmů
Autor článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Igor Satinský, Ph.D.
Mezioborová jednotka intenzivní péče
Nemocnice Havířov
Dělnická 1132/24
736 01 Havířov
e-mail: igor.satinsky@nsphav.cz
Sources
- Studley HO. Percentage of weight loss: a basic indicator of surgical risk in patients with chronic peptic ulcer. JAMA 1936 : 458−460.
- Buzby GP, Mullen JL, Matthews DC, et al. Prognostic nutritional index in gastrointestinal surgery. Am J Surg. 1980;139 : 160−167. doi:10.1016/0002-9610(80)90246-9.
- Detsky AS, Baker JP, O´Rourke K, et al. Predicting nutrition-associated complications for patients undergoing gastrointestinal surgery. J Parent Enteral Nutr. 1987;11(5):440−446. doi:10.1177/0148607187011005440.
- Dempsey DT, Mullen JL, Buzby GP. The link between nutritional status and clinical outcome: can nutritional intervention modify it? Am J Clin Nutr. 1988;47 : 352−356. doi:10.1093/ajcn/47.2.352.
- Daley J, Khuri SF, Henderson W, et al. Risk adjustment of the postoperative mortality rate for the comparative assessment of the quality of surgical care: results of the National Veterans Affairs Surgical Risk Study. Am Coll Surg. 1997;185(4):328−340.
- Howard L, Ashley C. Nutrition in the perioperative patient. Annu Rev Nutr. 2003;23 : 263−282. doi:10.1146/annurev.nutr.23.011702.073353.PMID: 14527336.
- Singer P, Blase AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr. 2019;38(1):48−79. doi:10.1016/j.clnu.2018.08.037.
- Taylor BE, McClave SA, Martindale RG, et al. Guidelines for the provision and assesment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutriton (A.S.P.E.N.). Crit Care Med. 2016;44(2):390−438. doi:10.1186/s13054-020-2739-4.
- Weimann A, Braga M, Carli F, et al. ESPEN guidelines: Clinical nutrition in surgery. Clin Nutr. 2017;36(3):623V650. doi:10.1016/j.clnu.2017.02.013.
- Satinský I, Havel E, Bezděk K, et al. Klinická výživa v chirurgii – doporučení ESPEN s konsenzuálním hlasováním pracovní skupiny SKVIMP. Rozhl Chir. 2018;97(10):P1−P9.
- Satinský I, Havel E, Bezděk K, et al. Klinická výživa v chirurgii – doporučení ESPEN s konsenzuálním hlasováním pracovní skupiny SKVIMP. Anest Intenziv Med. 2019;30(2):104−110.
- Satinský I, Havel E, Bezděk K, et al. Klinická výživa v chirurgii – doporučení ESPEN s konsenzuálním hlasováním pracovní skupiny SKVIMP. Nutrition News 2020;7(1):7–19.
- MacFie J, Woodcock NP, Palmer MD, et al. Oral dietary supplements in pre - and postoperative surgical patients: a prospective and randomized clinical trial. Nutrition 2000;16(9):723−728. doi:10.1016/s0899-9007(00)00377-4.
- Burden ST, Hill J, Shaffer JL, et al. An unblinded randomised controlled trial of preoperative oral supplements in colorectal cancer patients. J Hum Nutr Diet 2011;24(5):441−448. doi:10.1111/j.1365-277X.2011.01188.x.
- Smedley F, Browling T, James M, et al. Randomized clinical trial of the effects of preoperative and postoperative oral nutritional supplements on clinical course and cost of care. Br J Surg. 2004;91(8):983−990. doi:10.1002/bjs.4578.
- Burden S, Todd C, Hill J, et al. Pre-operative nutrition support in patients undergoing gastrointestinal surgery. Cochrane Database Syst Rev. 2012;11:CD008879. doi:10.1002/14651858.CD008879.pub2.
- Grass F, Bertrand PC, Schaffer JL, et al. Compliance with preoperative oral nutritional supplements in patients at nutritional risk--only a question of will? Eur J Clin Nut. 2015;69(4):525−529. doi:10.1038/ejcn.2014.285.
- Kondrup J, Rasmussen HH, Hamberg O, et al. Nutritional Risk Screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr. 2003;22(3):321−336. doi:10.1016/s0261-5614(02)00214-5.
- Stratton RJ, Hackstone A, Longmore D, et al. Malnutrition in hospital outpatients and inpatients: prevalence, concurrent validity and ease of use of the “malnutrition universal screening tool“ (“MUST“) for adults. Br J Nutr. 2004;92 : 799−808. doi:10.1079/BJN20041258.
- Guigos Y, Vellas B, Garry PJ. Assessing the nutritional status of the elderly. The Mini Nutritional Assessment as part of the geriatric evaluation. Nutr Rev. 1996;54(1):S59−S65. doi:10.1111/j.1753-4887.1996.tb03793.
- Česká onkologická společnost [online]. Praha: ČOS, 2013 [cit. 24.6.2020]. Available from: https://www.linkos.cz/ceska-onkologicka-spolecnost-cls-jep/organizace-cos/pracovni-skupiny-cos/pracovni-skupina-nutricni-pece-v-onkologii-pri-cos/materialy-pro-praxi-ke-stazeni/.
- Skoblej T, Schwarz P, Satinský I. Nové ambulantní možnosti ovlivnění malnutrice chirurgem. Rozhl Chir 2021;100(XX): in press.
- Česká chirurgická společnost [online]. Praha: ČCHS, 2020 [cit. 24.6.2020]. Available from: https://www.chirurgie.cz/sekce-spolecnosti/sekce-intenzivni-pece-pro-chirurgii/dokumenty/dokumenty-ke-stazeni/.
- Česká společnost klinické výživy a intenzivní metabolické péče [online]. Praha: SKVIMP 2020 [cit. 28.6.2020]. Available from://www.chirurgie.cz/sekce-spolecnosti/sekce-intenzivni-pece-pro-chirurgii/dokumenty/dokumenty-ke-stazeni/.
- Státní ústav pro kontrolu léčiv [online]. Praha: SÚKL, 2020 [cit. 24.6.2020]. Available from: https://verso.sukl.cz/fcgi/verso.fpl?fname=vp_pisemnost&_idspis=176815371&_idpis=424072261.
- Burden S, Todd C. Hill J, Lal S. Pre-operative nutrition support in patients undergoing gastrointestinal surgery. Cochrane Database Sys Rev. 2012;11. CD008879.
- Gustafsson UO, Scott MJ, Hubner M, et al. Guidelines for perioperative care in elective colorectal surgery: Enhanced Recovery After Surgery (ERAS©) Society recommendations: 2018. World J Surg. 2019;43(3):659−695. doi:10.1007/s00268-018-4844-y.
- Andersen HK, Lewis HK, Thomas S. Early enteral nutrition within 24h of colorectal surgery versus later commencement of feeding for postoperative complications Cochrane Database Syst Rev. 2006;(4):CD004080. doi:10.1002/14651858.CD004080.pub2.
- Carrere N, Seulin P, Julio CH, et al. Is nasogastric or nasojejunal decompression necessary after gastrectomy? A prospective randomized trial. World J Surg. 2007;31(1):122−127. doi:10.1007/s00268-006-0430-9.
- Ryska O, Šerclová Z, Antoš F, et al. Jak jsou dodržovány postupy moderní perioperační péče (Enhanced Recovery After Surgery) na chirurgických pracovištích v ČR – výsledky národní ankety. Rozhl Chir. 2013;92(8):435−442.
- Lassen K, Soop M, Nygren J, et al. Consensus review of optimal perioperative care in colorectal surgery: Enhanced Recovery After Surgery (ERAS) Group recommendations. Arch Surg. 2009;144(10):961−969. doi:10.1001/archsurg.2009.170.
- Willcutts KF, Chung MC, Erenberg CL, et al. Early oral feeding as compared with traditional timing of oral feeding after upper gastrointestinal surgery: A systematic review and meta-analysis. Ann Surg. 2016;264(1):54−63. doi:10.1097/SLA.0000000000001644.
- Hur H, Kim SG, Shim HJ, et al. Effect of early oral feeding after gastric cancer surgery: a result of randomized clinical trial. Surgery 2011;149(4):561−568. doi:10.1016/j.surg.2010.10.003.
- Seven H, Calis AB, Turgut S. A randomized controlled trial of early oral feeding in laryngectomized patients. Laryngoscope 2003 Jun;113(6):1076−1079. doi:10.1097/00005537-200306000-00030.
- McClave SA, Martindale RG, Vanek VW, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) J Parenter Enteral Nutr. 2009;33(3):277−316. doi:10.1177/0148607109335234.
- Ichimaru S. Methods of enteral nutrition administration in critically ill patients: continuous, cyclic, intermittent, and bolus feeding. Nutr Clin Pract. 2018;33(6):790−795. doi:10.1002/ncp.10105.
- Yermilov I, Jain S, Sekeris E, et al. Utilization of parenteral nutrition following pancreaticoduodenectomy: is routine jejunostomy tube placement warranted? Dig Dis Sci. 2009;54(7):1582−1588. doi:10.1007/s10620-008-0526-1.
- Gerritsen A, Besseling MG, Cieslak KP, et al. Efficacy and complications of nasojejunal, jejunostomy and parenteral feeding after pancreaticoduodenectomy. J Gastrointest Surg. 2012;16(6):1144−1151. doi:10.1007/s11605-012-1887-5.
- Dann CC, Squires HM, Postlewait LM, et al. An assessment of feeding jejunostomy tube placement at the time of resection for gastric adenocarcinoma: A seven-institution analysis of 837 patients from the U.S. gastric cancer collaborative. J Surg Oncol. 2015;112(2):195−202. doi:10.1002/jso.23983.
- Markides GA, Alkhaffaf B, Vickers J. Nutritional access routes following oesophagectomy--a systematic review. Eur J Clin Nutr. 2011;65(5):565−573. doi:10.1038/ejcn.2010.292.
- Zusman O, Theilla M, Cohen J, et al. Resting energy expenditure, calorie and protein consumption in critically ill patients: a retrospective cohort study. Crit Care 2016;20(1):367. doi:10.1186/s13054-016-1538-4.
- Gianotti L, Braga M, Biffi R, et al. Perioperative intravenous glutamine supplemetation in major abdominal surgery for cancer: a randomized multicenter trial. Ann Surg. 2009;250(5):684−690. doi:10.1097/SLA.0b013e3181bcb28d.
- Braga M, Ljungqvist O, Soeters P, et al. ESPEN Guidelines on Parenteral Nutrition: surgery. Clin Nutr. 2009;28(4):378−386. doi:10.1016/j.clnu.2009.04.002.
- Chen B, Zhou Y, Yang P, et al. Safety and efficacy of fish oil-enriched parenteral nutrition regimen on postoperative patients undergoing major abdominal surgery: a meta-analysis of randomized controlled trials. J Parenter Enteral Nutr. 2010;34(4):387−394. doi:10.1177/0148607110362532.
- Pradelli L, Mayer K, Muscaritoli M, et al. n-3 fatty acid-enriched parenteral nutrition regimens in elective surgical and ICU patients: a meta-analysis. Crit Care 2012;16(5):R184. doi:10.1186/cc11668.
- Li NN, Zhou Y, Qin XP, et al. Does intravenous fish oil benefit patients post-surgery? A meta-analysis of randomised controlled trials. Clin Nutr. 2014;33(2):226−239. doi:10.1016/j.clnu.2013.08.013.
- Chambrier C, Sztark F. French clinical guidelines on perioperative nutrition – update of the 1994 consensus conference on perioperative artificial nutrition for elective surgery in adults. J Visc Surg. 2012;149(5):e325−336. doi:10.1016/j.jviscsurg.2012.06.006.
- Arends J, Bachmann P, Baracos V, Barthelemy N, Berthz H, Fearon K, et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr. 2017;36(1):11−48. doi:10.1016/j.clnu.2016.07.015.
- Nothacker M, Rutters D. Evidenzbericht. Analysen von Metaanalysen zur perioperativen klinischen Ernahrung. Berlin. Arzliches Zentrum fur Qualitat in der Medizin 2012.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 2-
All articles in this issue
-
Perioperative nutrition in the light of guidelines
(and in the shadow of practice) - New options for surgeons to improve malnutrition in the outpatient setting
- Intermittent feeding in intensive care – the theory and practice
- Rectal cancer – current treatment strategy and the tumor regression grade evaluation after neoadjuvant therapy in patients who underwent surgery at the I. Department of Surgery, General University Hospital in Prague between 2012 and 2016
- Nutrition in open abdomen
- Multidisciplinary surgical approach to renal cancer with vena cava invasion and pulmonary embolism
- Výživa v chirurgii: jak dostat koně do Tróje?
-
Perforace divertiklu tlustého střeva králičí kostí –
kazuistika
-
Perioperative nutrition in the light of guidelines
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Perioperative nutrition in the light of guidelines
(and in the shadow of practice) - Intermittent feeding in intensive care – the theory and practice
- Rectal cancer – current treatment strategy and the tumor regression grade evaluation after neoadjuvant therapy in patients who underwent surgery at the I. Department of Surgery, General University Hospital in Prague between 2012 and 2016
- Nutrition in open abdomen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

