-
Medical journals
- Career
Karcinom rekta – současná léčebná strategie a hodnocení stupně regrese tumoru po neoadjuvantní onkologické léčbě u pacientů operovaných na I. chirurgické klinice 1. LF UK a VFN v Praze v období 2012−2016
Authors: P. Koželský 1; V. Frýba 1; M. Bártů 2; V. Černý 3; J. Ulrych 1; Z. Krška 1
Authors‘ workplace: I. chirurgická klinika − hrudní, břišní a úrazové chirurgie 1. lékařské fakulty Univerzity Karlovy a Všeobecná fakultní, nemocnice v Praze 1; Ústav patologie 1. lékařské fakulty Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze 2; Radiodiagnostická klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze 3
Published in: Rozhl. Chir., 2021, roč. 100, č. 2, s. 74-82.
Category: Original articles
Overview
Úvod: Naše sdělení obsahuje shrnutí problematiky stagingu a terapie s důrazem na léčbu neoadjuvantní a s ní spojenou regresi tumoru s analýzou vlastního souboru pacientů.
Metody: Retrospektivní analýza pacientů s karcinomem rekta operovaných na I. chirurgické klinice VFN v Praze se zaměřením na ty, kteří podstoupili neoadjuvantní chemoradioterapii a u nichž byl patologem hodnocen stupeň regrese tumoru v definitivním resekátu.
Výsledky: Soubor tvoří 161 pacientů operovaných v období 2012−2016. 47 nemocných prodělalo neoadjuvantní onkologickou léčbu a hodnocení stupně regrese tumoru patologem, použit byl skórovací systém dle Ryana. U 10,4 % pacientů byla navozena kompletní patologická odpověď, u 35,4 % pacientů nedošlo k žádné odpovědi, u 54,2 % došlo k částečné regresi nádoru.
Závěr: I když je patrna určitá rozdílnost našich výsledků při porovnání se zahraničními publikacemi, poměr pacientů zůstává zachován. Jistě budou následovat další studie hodnotící výhody versus nevýhody neoadjuvantní terapie, částečně je nastolena otázka vhodnosti chirurgické léčby jako jediného kurativního řešení.
Klíčová slova:
karcinom rekta – neoadjuvantní chemoradioterapie – stupeň regrese tumoru – Ryan
Úvod
Kolorektální karcinom představuje závažný zdravotnický problém v České republice i v dalších zemích západního světa. I když představuje třetí nejčastější malignitu diagnostikovanou u obou pohlaví, přičemž karcinom rekta a rektosigmoideálního přechodu tvoří třetinu všech diagnostikovaných kolorektálních karcinomů, management pacientů a následná léčebná strategie i nadále vzbuzují určité kontroverze a nejasnosti. Karcinom rekta (RC) je definován jako tumor do 15 centimetrů od anu. Nejběžnějším histologickým typem je pak adenokarcinom [1]. Incidence RC v České republice činila v roce 2017 19,8/100 000 obyvatel, letalita 10,6/100 000 obyvatel [2]. Přestože se histologicky RC neliší od karcinomů ostatních částí tračníku, díky svojí poloze a topografii je často považován za zcela samostatnou entitu. To vyžaduje komplexní multioborový přístup jak v diagnostice, tak v terapii, kde jsou v součinnosti gastroenterolog, radiolog, onkolog a samozřejmě chirurg, neboť základem potenciálně radikální léčby je adekvátní chirurgický výkon s dosažením R0 resekce.
Předkládané sdělení shrnuje i aktuální obecné poznatky a trendy v terapii RC se zaměřením na karcinomy klinického stadia II a III aborálních 2/3 rekta, které podle aktuálních doporučení vyžadují neoadjuvantní onkologickou léčbu. Předkládáme retrospektivní analýzu pacientů operovaných na I. chirurgické klinice VFN v období 1/2012–12/2016 se základní diagnózou RC (MKN C20). U skupiny pacientů, kteří podstoupili neoadjuvantní onkologickou léčbu, je hodnocen stupeň patologické regrese tumoru.
Metody
V našem článku prezentujeme retrospektivní analýzu vlastního souboru pacientů se základní diagnózou RC (MKN C20), tedy aborálních 2/3 rekta, operovaných na I. chirurgické klinice VFN v období 1/2012−12/2016. Z těchto pacientů jsou vybráni ti, kteří podstoupili neoadjuvantní onkologickou léčbu, tedy frakcionovanou radioterapii pánve, ve většině případů doplněnou o konkomitantní chemoterapii kapecitabinem. V definitivním resekátu byl patologem hodnocen stupeň regrese tumoru, použit byl skórovací systém TRG AJCC/CAP (modif. Ryan).
Výsledky
V uvedeném období bylo na naší klinice operováno 161 nemocných s diagnózou MKN C20. Z toho 47 nemocných prodělalo neoadjuvantní onkologickou léčbu (29,2 %). V daném souboru bylo celkem 29 mužů (61,7 %), 18 žen (38,3 %). Medián věku byl 62 let, medián vzdálenosti tumoru od análního okraje byl 5 cm. V předoperačním stagingu byla většina pacientů stadia cT3 (40 pacientů – 85,1 %), pacientů s klinicky diagnostikovaným uzlinovým postižením bylo 41–87,2 %. Sfinktery šetřící výkon byl proveden u 35 pacientů (74,5 %), u 12 pacientů byla provedena abdominoperineální resekce (25,5 %). U pacientů, kteří podstoupili abdominoperineální resekci, bylo v hodnocení resekátu patologem (yp stadium) rozložení pacientů následující: 0 − 1 pacient (8,3 %), I – 2 pacienti (16,7 %), II – 4 pacienti (33,3 %), III – 5 pacientů (41,7 %). Z 35 pacientů, u kterých byl proveden sfinktery šetřící výkon, byla u 25 pacientů založena protektivní ileostomie (71,4 %). Operační technika byla volena dle habitu pacienta, pokročilosti nádoru a zkušeností operatéra. Z 35 pacientů, u kterých byla zvolena nízká přední resekce (LAR), bylo operováno 20 pacientů laparoskopicky (57,1 %), zbylých 15 pacientů podstoupilo klasický otevřený výkon. Z 12 pacientů, u nichž bylo přistoupeno k abdominoperineální resekci, byla u 4 pacientů (33,3 %) abdominální fáze operace provedena laparoskopicky (Tab. 1). U všech pacientů, kteří podstoupili neoadjuvantní radioterapii, byla léčba vedena dle standardního protokolu s aplikací 44−45 Gy v 28 frakcích s boostem na nádor dávkou 5−6 Gy, stejně tak je na našem onkologickém pracovišti standardně podávána chemoterapie 5-fluorouracilem či kapecitabinem. V hodnocení regrese bylo pak jako TRG 0 hodnoceno 5 pacientů (10,4 %), TRG 1 9 pacientů (18,8 %), TRG 2 17 pacientů (35,4 %) a TRG 3 17 pacientů (35,4 %) – Tab. 2. Lze tedy říci, že u 10,4 % pacientů byla navozena kompletní patologická odpověď, u 35,4 % pacientů nedošlo k žádné odpovědi či dokonce k progresi nádoru, u více než poloviny pacientů (54,2 %) došlo k částečné regresi nádoru.
Table 1. Shrnutí epidemiologických parametrů souboru našich pacientů
Tab. 1: The summary of epidemiological parameters of our patients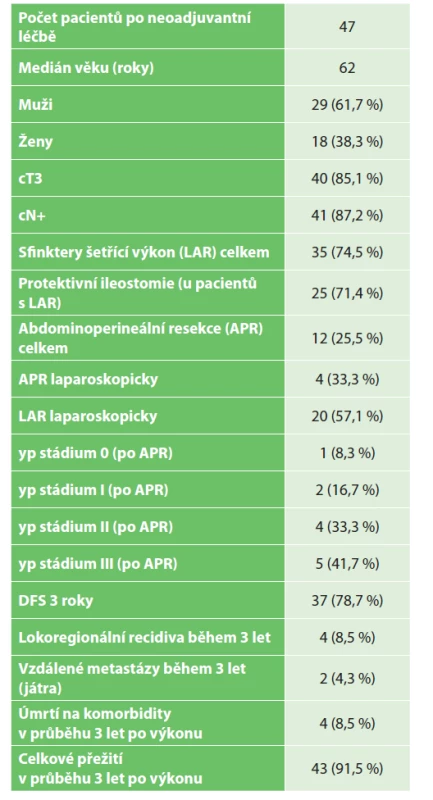
Table 2. Přehledné shrnutí souboru pacientů s karcinomem rekta, kteří prodělali neoadjuvantní onkologickou léčbu
Tab. 2: The summary of our patients with rectal cancer who underwent neoadjuvant oncological treatment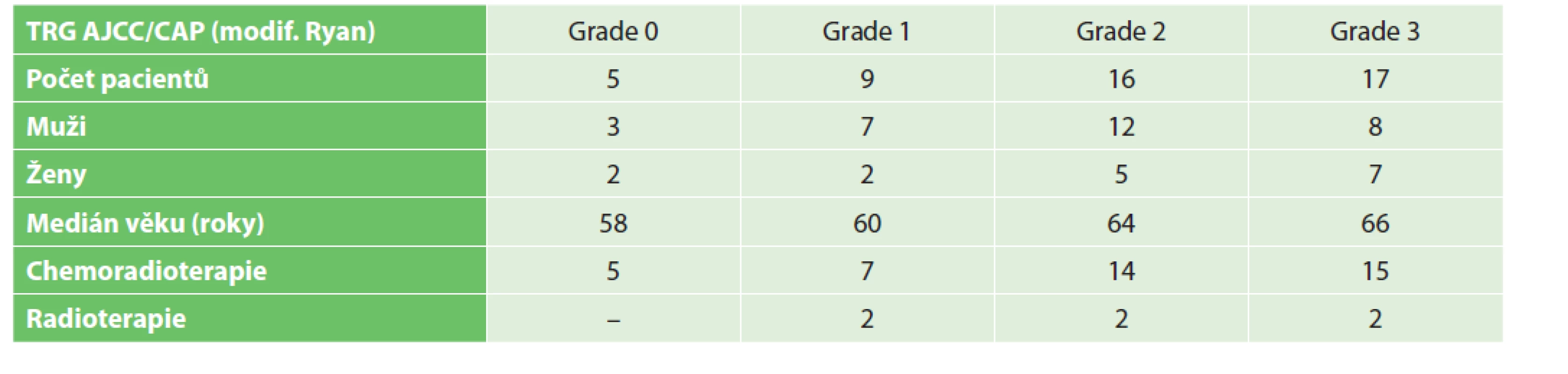
Z toho ve skupině pacientů TRG 0 prodělali všichni neoadjuvantní chemoradioterapii, v TRG 1 prodělalo 7 pacientů CHRT, pouze 2 pacienti RT, v TRG 2 prodělalo 14 pacientů CHRT, 2 pacienti RT, v TRG 3 prodělalo 15 pacientů CHRT a 2 pacienti RT (Tab. 2). Onkologické parametry jako přežití bez choroby (DFS) a celkové přežití (OS) jsou v našem souboru limitované na 3 roky vzhledem k neúplnému sledování všech pacientů. Tři roky DFS jsou prokázány u 37 pacientů (78,7 %), v histologickém hodnocení resekátu byla pozorována kompletní patologická odpověď či dobrá odpověď na neoadjuvantní léčbu (modif. Ryan 0/1). 4 pacienti (8,5 %) zemřeli v průběhu tří let po výkonu na přidružené interní komorbidity, u 4 pacientů (8,5 %) byla v rámci onkologického sledování zachycena lokoregionální recidiva, u 2 pacientů (4,3 %) byly zachyceny vzdálené metastázy (játra). U všech těchto 6 pacientů byla v resekátu pozorována minimální či žádná regrese (modif. Ryan 2/3). Hodnocení celkového přežití (OS) v daném časovém období nemá přílišnou výpovědní hodnotu, uvádíme ho pouze pro úplnost nezávisle na klinickém stadiu – 43 pacientů (91,5 %).
Diskuze
Úloha zobrazovacích metod v léčbě RC
Předpokladem každé protinádorové léčby je precizní staging. Ten se opírá o zobrazovací metody, základem je CT hrudníku, břicha a pánve k posouzení celkového rozsahu onemocnění, dále magnetická rezonance (MR) pánve či endosonografie (EUS) k posouzení lokálního rozsahu postižení.
Ke stagingu RC je MR ideální zobrazovací metodou. Hodnotit lze jak lokální nález – T stadium v rámci TNM klasifikace, tak další klinicky důležité parametry.
Hodnocení T stadia pomocí magnetické rezonance je velmi přesné. Ve starší literatuře se uvádí, že přesnější je endosonografie, zejména u nižších T [3]. Nicméně novější data jednoznačně prokazují, že MR je schopna rozlišit nejenom stadia T3 a T4, ale i stadia T1 (dokonce lze hodnotit stupeň infiltrace submukózy – sm1, sm2, sm3) a T2 (lze rozlišit, zda tumor prorůstá pouze částí muscularis propria, nebo prorůstá celou její šíří, tedy rozlišit stadium T2a a T2b). Toto je reflektováno i v guidelines ESMO z r. 2017, kde je i pro nízká T stadia MR uváděna jako rovnocenná metoda s endosonografií [4].
Hloubka prorůstání tumoru do mezorektálního tuku měřená pomocí MR přesně koreluje s hloubkou prorůstání detekovanou patologem v resekátu [5]. Pro klinické rozhodování je dále klíčový vztah tumoru k mezorektální fascii (circuferential resection margin, CRM). Jako CRM negativní hodnotíme nález, kdy nejmenší vzdálenost mezi tumorózní tkání a CRM je 1 mm a více. Hodnocení uzlin pomocí MR je rovněž možné, nicméně přesnost detekce metastatického postižení uzlin je nízká. Brouwer et al. uvádějí, že pozitivní prediktivní hodnota (PPV) je pouze 59 %. Mnohem přesnější a přínosnější je hodnocení tzv. extramurální venózní invaze (EMVI) a perivenózních depozit tumoru. MR je jedinou metodou, která je schopna tato depozita detekovat. V TNM klasifikaci se označují jako stadium N1c, i když s lymfatickými uzlinami nemají nic společného. Data z velkých studií jednoznačně prokazují, že nález těchto tumorózních depozit je negativním prognostickým faktorem a MR má vysokou přesnost v jejich detekci [6].
Pomocí MR lze hodnotit i odpověď na neoadjuvantní terapii – tedy jak odpověď samotného tumoru (zmenšení, fibróza), tak i odpověď uzlin a perivenózních depozit tumoru. Regrese tumoru je patrna na MR snímku (Obr. 1).
Image 1. Magnetická rezonance rekta, T2 vážené obrazy v šikmé axiální rovině
a) stagingové vyšetření − známky prorůstání tumorózní tkáně (střední intenzita signálu) přes muscularis propria (šipka), obraz T3b;
b) restaging po chemoradioterapii.
Došlo k poklesu signálu tumorózní tkáně (známka fibrotizace), bez známek prorůstání přes muscularis propria.
Fig. 1: Magnetic resonance imaging of the rectum, T2-weighted images in inclined axial plane
a) staging examination − signs of tumor growth (medium signal stength) through muscularis propria (arrow), figure T3;
b) restaging imaging after chemoradiotherapy.
Decrease in tumor tissue signal (sign of fibrotization), without signs of tumor growth through muscularis propria.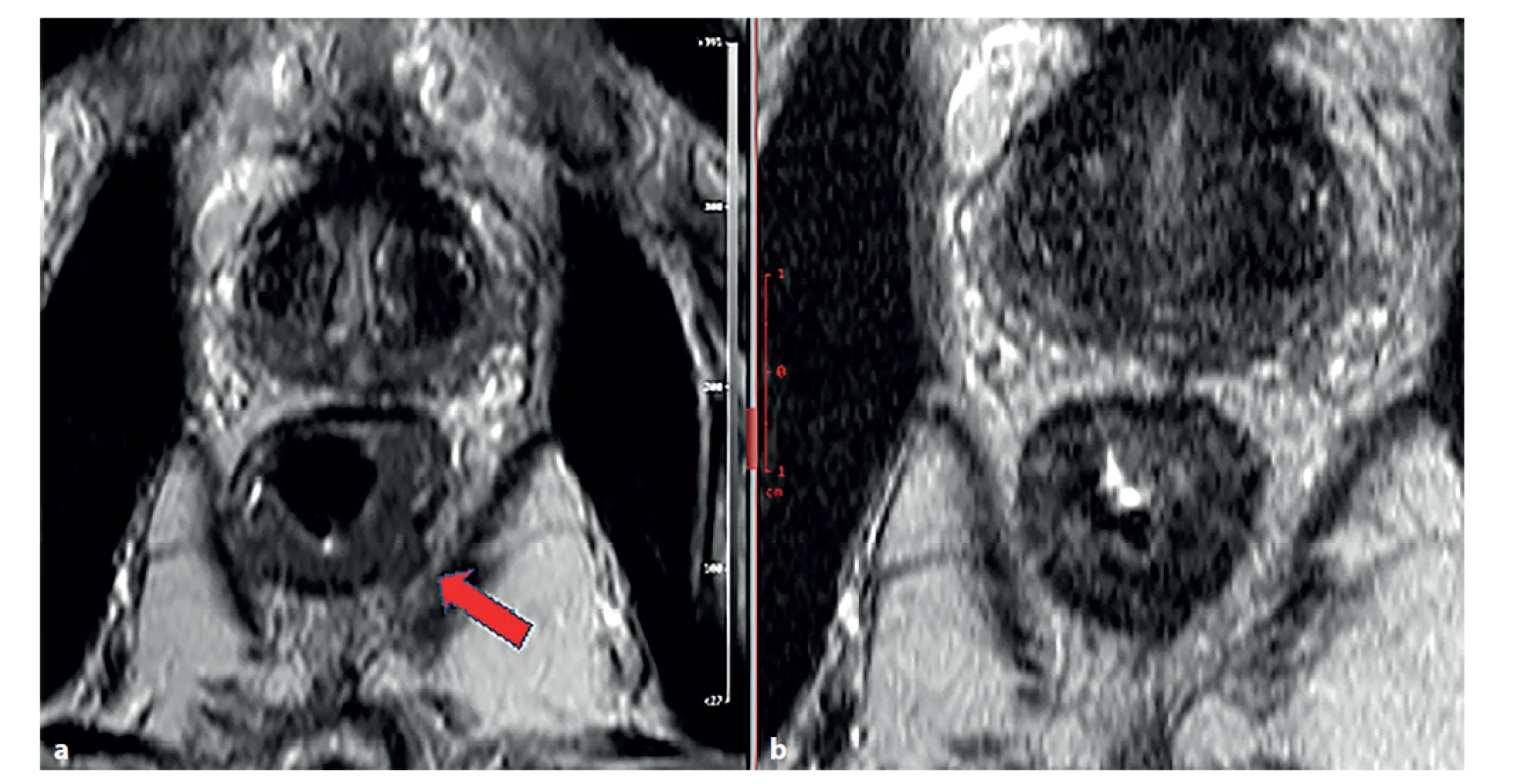
Léčba RC
Léčba RC je multimodální, nicméně základem potenciálně radikální léčby je adekvátní chirurgický výkon s dosažením R0 resekce. Dalšími léčebnými modalitami jsou kromě chirurgie i chemoterapie a radioterapie. Tady, stejně jako u ostatních nádorových onemocnění, je základem protinádorové léčby precizní staging, který je, jak už bylo zmíněno v předchozí kapitole, založen na výsledcích zobrazovacích vyšetření. Chirurgie si pak klade za cíl radikálně odstranit nádor, předejít systémovému šíření a lokoregionální recidivě, zachovat přirozenou anální kontinenci šetřením svěračů, zachovat močovou kontinenci a sexuální funkce. Prioritou ovšem stále zůstává radikální odstranění tumoru a má zcela jistě přednost před zachováním funkcí. K primárně chirurgickému řešení jsou určeny nádory klinického stadia 0 a I, tedy Tis, T1−2 bez uzlinového či metastatického postižení. Lokální excize (transanální či endoskopická mikrochirurgická) je při tom indikována pouze u Tis a T1 low risk tumorů (sm1 či sm2, G1−2, bez angioinvaze apod.). Dále je lokální excize přípustná pouze u pacientů s pokročilejším stadiem onemocnění, kteří ovšem nejsou únosní radikálního výkonu, vhodná je kombinace s následnou radioterapií [1].
U tumorů s klinickým stadiem II a III je iniciální léčebnou modalitou neoadjuvantní onkologická léčba, tedy radioterapie či v konkomitanci s chemoterapií (CHRT). Výhody radioterapie byly poprvé popsány švédskou skupinou pro studium RC v roce 1997. Cílem je jednak downstaging a downsizing nádoru, dále potom snížení rizika lokální recidivy. Ve stadiu II činí totiž riziko lokální recidivy 20−30 %, ve stadiu III až 50 %. Pětileté přežití po samotné operaci je 33 %, naproti tomu s neoadjuvantní léčbou až 70 %. [7]. V případě, že jsou tumorem postiženy anální svěrače, můžeme úspěšnou neoadjuvantní CHRT docílit zmenšení tumoru do té míry, že lze dosáhnout bezpečného resekčního okraje i se zachováním análních sfinkterů, a tím kontinence stolice. Standardní předoperační radioterapie tedy zlepšuje bezpříznakové a celkové přežití, konkomitantní chemoterapie snižuje riziko systémového šíření nádoru.
Základními preparáty pro chemoterapii jsou v České republice kapecitabin nebo 5-fluoroura-cil. Standardem neoadjuvantní radioterapie je aplikace 44–45 Gy v 28 frakcích s boostem na nádor dávkou 5–6 Gy. Zkrácený režim představuje akcelerovaná hypofrakcionační radioterapie – dávka 25 Gy v 5 frakcích, což ale neumožňuje adekvátní systémovou konkomitantní chemoterapii [1].
Chirurgická léčba RC byla výrazně ovlivněna konceptem totální mezorektální excize (TME), který významně zlepšil prognózu pacientů. TME byla poprvé popsána prof. Healdem a dnes tvoří zlatý standard v chirurgické léčbě karcinomů rekta [8]. Určitou výjimku pak tvoří akutní stavy, které jsou způsobené RC, a to obstrukce či krvácení. U obstrukce je indikováno, s přihlédnutím k další terapii, založení stomie. Ta má být co nejdistálnější, ileostomie je řešením nevhodným. Alternativou je pak zavedení stentu (bridge to surgery). Masivní krvácení pak bývá přítomno spíše u pokročilých neresekabilních tumorů. Metodou volby je pak selektivní embolizace arteria rectalis superior, případně a. iliaca interna. Operační řešení je pak výkonem krajním.
Komplikace radioterapie
Zavedení neoadjuvantní radioterapie do managementu karcinomu rekta zlepšilo léčebné výsledky a prognózu pacientů. Potenciální benefit plynoucí z neoadjuvantní léčby však musí být hodnocen v souvislosti s možnými závažnými vedlejšími účinky radioterapie. Jsou dokumentovány vícečetné vedlejší účinky, komplikace a toxicita plynoucí z této léčby, zahrnující časné komplikace, jako jsou dehiscence operační rány, ranné infekce (SSI) a leaky anastomóz i pozdní funkční následky jako LARS (low anterior resection syndrome) a urogenitální dysfunkce.
Toxicita radioterapie
Toxicita radioterapie je známá od zavedení radioterapie jako modality léčby na počátku 20. století. Symptomy toxicity jsou vícečetné a různé závažnosti. Pro potřeby přesného hodnocení těchto vedlejších účinků radioterapie je používána klasifikace RTOG (Radiation Therapy Oncology Group)/EORTC (European Organisation fot the Research and Treatment of Cancer) specifická pro každý orgán nebo systém exponovaný radioterapií. Jedním z nejčastějších a nejvíce stresujících nežádoucích účinků radioterapie pro pacienty jsou průjmy [9,10].
Anorektální dysfunkce
Pacienti, kteří podstoupí neoadjuvantní léčbu a následně nízkou resekci pro karcinom distálního rekta, jsou ve velkém riziku vzniku LARS (low anterior resection syndrome). LARS se projevuje četnými symptomy včetně inkontinence stolice, urgence k defekaci, flatulence, vyšší frekvence stolic nebo naopak obstipace. Prevalence dosahuje 42 % [11]. Patofyziologickým podkladem LARS je zhoršení funkce análních sfinkterů, porucha motility střeva a dysfunkce neorektálního rezervoáru. Jako příčiny tohoto syndromu jsou uváděny fyzikální a neurální faktory. Je známo, že zmenšený objem rekta po resekci přispívá ke zkrácenému tranzitnímu času střevem, čímž vede ke zvýšené frekvenci stolic. Metaanalýza z roku 2008 zkoumala funkční výsledky po alternativních způsobech rekonstrukce. Pouze dvě studie zahrnuté v této práci zkoumaly dlouhodobé funkční výsledky po resekci. Autoři zhodnotili, že kolonický J-pouch má lepší funkční výsledky oproti přímé koloanální anastomóze (p<0,05, p<0,001). Autoři ale zároveň podotýkají, že tento pozitivní efekt je patrný pouze v prvních 18 měsících po resekci [12]. Neurální faktory hrají rovněž významnou roli v rozvoji LARS. Neurální dysfunkce může po léčbě vzniknout následkem denervace po chirurgickém výkonu nebo jako následek radioterapie. V průřezové studii publikované v roce 2013 mělo 41 % pacientů z celkového počtu 938 LARS. Pacienti, kteří podstoupili neoadjuvantní terapii (krátký i dlouhý režim) a totální excizi mezorekta, byli ve vyšším riziku LARS [13]. V Dutch Rectal Cancer Trial byla pozorována incidence LARS dokonce 46 % u pacientů, kteří zodpověděli na dotazník. Rizikové faktory zahrnovaly neoadjuvantní radioterapii a věk >75 let [14].
Urogenitální dysfunkce
Tato dysfunkce je způsobena poškozením autonomních nervů během chirurgického výkonu a má velký vliv na kvalitu života. Základní struktury, které mohou být poškozeny, jsou horní a dolní hypogastrický plexus, nervi erigentes a pudendální nerv. Poškození nervů je způsobeno několika faktory včetně předoperační radioterapie, která rezultuje v zánětlivou reakci v okolních tkáních. To vede k obtížné identifikaci anatomických vrstev během preparace. Hendren et al. zjistili pomocí dotazníkové studie u žijících pacientů léčených pro karcinom rekta mezi lety 1980 a 2003 u 29 % žen a 45 % mužů urogenitální dysfunkce různého stupně. Radioterapie byla faktorem významně asociovaným (p<0,0001) se vznikem dysfunkce. Stejně tak typ chirurgického výkonu. Amputace rekta vede k častější dysfunkci (p<0,05). Močová dysfunkce zahrnuje symptomy, jako jsou inkontinence, obtížná iniciace mikce, močová retence. Podobně jako sexuální dysfunkce i močová dysfunkce se častěji vyskytuje po neoadjuvantní terapii a chirurgii pro distálně uložené tumory [15]. Retrospektivní švédská observační studie shledala, že 36 % mužů a 57 % žen trpí inkontinencí moči 3 roky po amputaci rekta [16].
Fraktury pánve
Dalším závažným, ale nedostatečně dokumentovaným nežádoucím účinkem radioterapie jsou patologické zlomeniny pánve. Tyto zlomeniny jsou způsobeny ztrátou mineralizace kosti, přičemž tento proces je radioterapií výrazně urychlován. Příčinou je ischemie drobných cév v kosti způsobená zářením [17]. Prospektivní kohortová studie zahrnující 403 pacientů s karcinomem rekta byla publikována v roce 2018. Pacientům byla 3 roky po resekci rekta provedena MRI pánve ke zhodnocení lokální recidivy a patologických zlomenin pánve. Fraktura byla nalezena u 49 pacientů, přičemž 39 z nich podstoupilo neoadjuvantní léčbu (p<0,001). Multivariantní analýzou byly zjištěny předoperační chemoradioterapie (OR: 14.2, 6.-33.1), ženské pohlaví (OR: 3.52, 1.7-7.5) a věk nad 65 let (OR: 3.2, 1.5-6.9) jako faktory signifikantně asociované s rizikem fraktury pánve [18].
Zpracování resekátů a jejich hodnocení z hledu patologa
Správné zpracování a hodnocení preparátů rekta s TME patologem je naprosto zásadní, protože má nejen prognostický význam, ale také poskytuje důležitou zpětnou vazbu pro chirurga s ohledem na technickou kvalitu provedené excize. Doporučené postupy pro zpracování TME se liší nejen mezi evropskými a západními státy jako takovými, ale i v rámci jednotlivých zemí Evropy. Mezi nejrozšířenější jednotnou metodiku patří přístup dle Quirkeho a Nagtegaala, kteří byli zodpovědní za zpracování základního přístupu k hodnocení TME v rámci studie CLASSIC (organizované Medical Research Council ve Velké Británii) a holandské TME studie [19].
Naprosto zásadním předpokladem pro zpracování TME je správné doručení resekátu, který musí být k patologickému vyšetření dodán nativně, nefixovaný a nerozstřižený. Patolog poté nativní resekát správně zorientuje, pořídí detailní makroskopickou fotodokumentaci (celého resekátu se zaměřením na ventrální a dorzální plochu, detailní fotografie mezorektálního povrchu a případně největších zastižených defektů) (Obr. 2). Poté následuje tušování nativního preparátu, kdy se zásadně tušuje pouze celý neperitonealizovaný úsek mezorektálního tuku (ne serózního povrchu). Otušovaná část resekátu poté vede šikmo vzhůru jako úpon peritonea – ventrálně je nejníže, zatímco dorzálně vybíhá trojúhelníkovitě vzhůru (Obr. 3). Po natušování je resekát rozstřižený distálně na ventrálním povrchu (napříč těsně nad staplerovou linií), přičemž u delších resekátů je možné rozstřihnout střevo i od proximálního okraje přes neperitonealizovanou část. Úsek se samotným nádorovým ložiskem se vždy nechává intaktní, stříháme do maximální vzdálenosti 2 cm od palpačně identifikovaného nádoru. Po tomto zpracování se do nerozstřiženého lumen vloží gáza nasáklá formalinem a celkový resekát se fixuje ve formalinu po dobu nejméně 48 hodin. Po fixaci následuje detailní makropopis (změření a popis mezorektálního povrchu, defektů…) a resekát se prokrajuje na příčné lamely tloušťky 3–5 mm. Lamely se přikrajují přes celou délku nerozstřiženého střeva s nádorem, doplněné o 1–2 lamely do zdravé tkáně nad i pod nádorem. Každá lamela je ihned rovnána, orientována a následně je pořízena makrofotodokumentace všech lamel a detailů (Obr. 4). Všechny lamely jsou také důsledně revidovány s ohledem na určení vzdálenosti nádoru od cirkumferenčního resekčního okraje (circumferential resection margin, CRM), přítomnosti nádorově infiltrovaných lymfatických uzlin (a jejich vzdálenost od CRM), hloubky invaze, minimální výšky mezorektálního tuku nad nádorem atd. Samotné přikrojení nádoru se skládá z minimálně 3 bloků zastihujících nádor a mezorektální tuk v místě nejbližšího CRM, 2 bloků s luminální částí nádoru, dále se přikrajují resekční okraje, všechny zastižené lymfatické uzliny a ostatní vedlejší nálezy (např. polypy). Preparace lymfatických uzlin se zpravidla provádí po předchozím projasnění lamel v Carnoyově roztoku, přičemž při blokování uzlin v blízkosti CRM je nutné přikrojit zároveň i otušovaný CRM, neboť u perinodálního šíření nádoru a satelitů je vzdálenost k CRM velmi důležitá.
Image 2. Fotodokumentace resekátu rekta pořízená patologem
Fig. 2: Photodocumentation of the resected rectal specimen by pathologist
Image 3. Preparát rekta obarvený tuší
Fig. 3: Specimen of rectum coloured with ink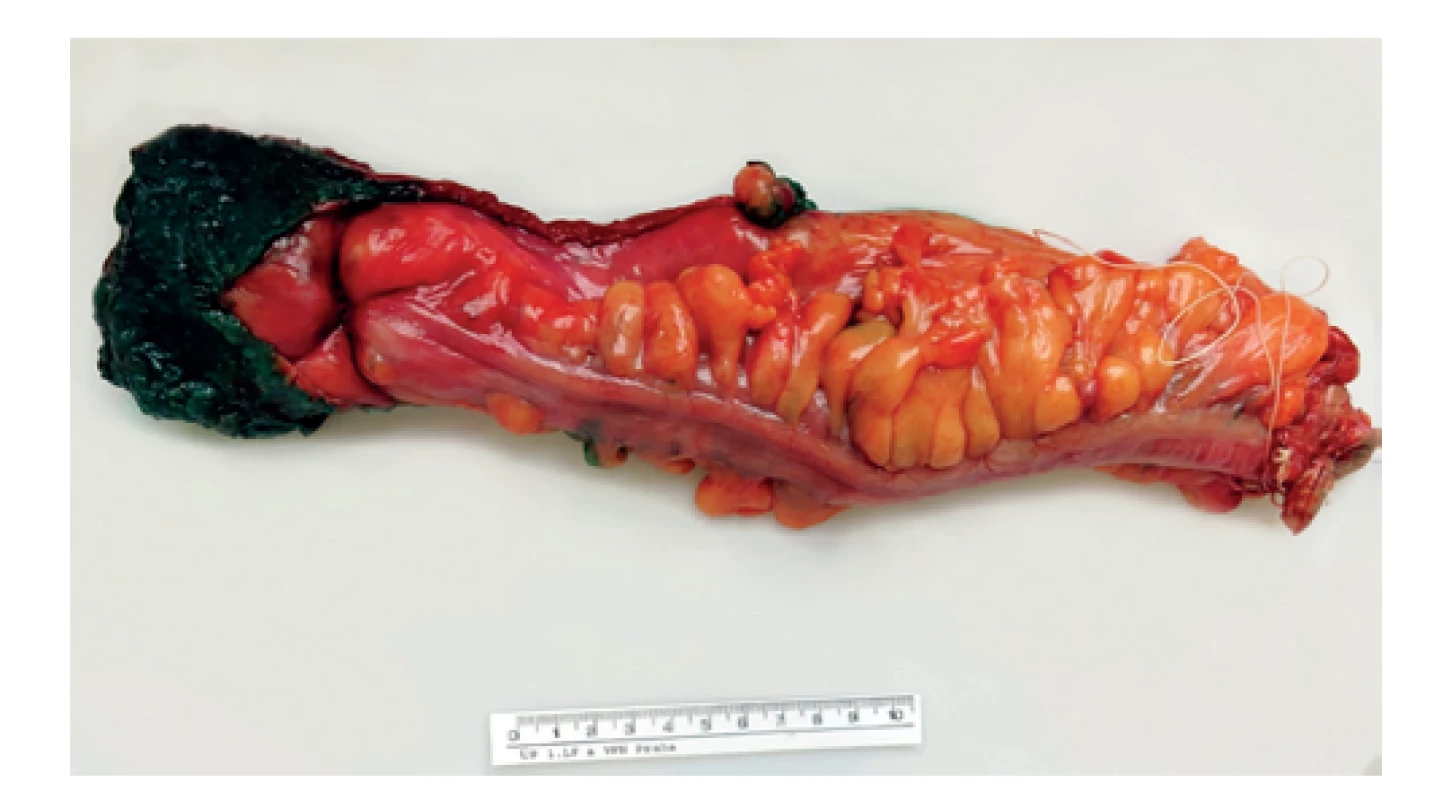
Image 4. Preparát rekta s karcinomem prokrájený patologem
Fig. 4: Specimen of rectum with tumor sliced by pathologist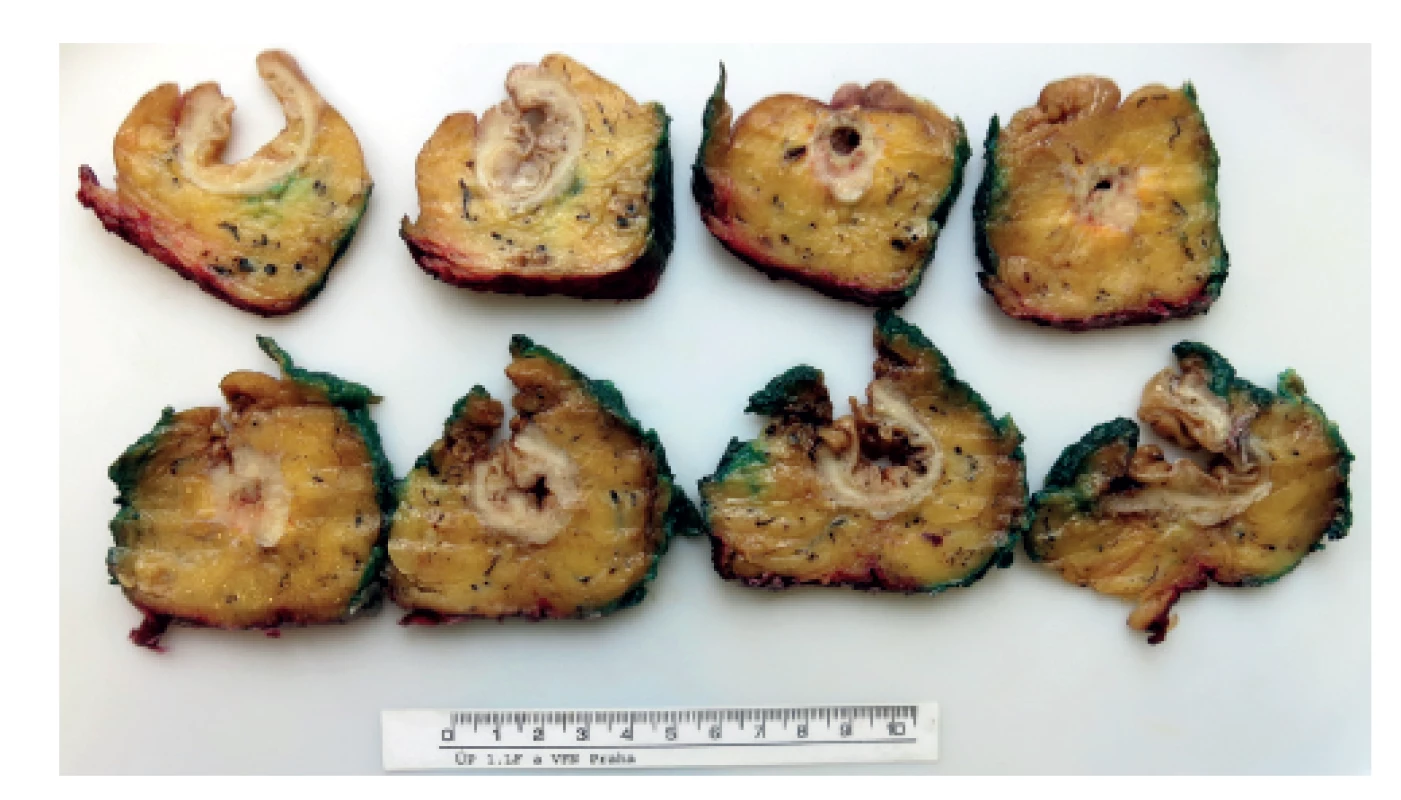
Výsledné histologické hodnocení a výsledkový protokol tedy kromě „tradičních“ hodnocených parametrů zahrnuje v případě TME i posouzení kvality mezorektální excize (klasifikována jako I – kompletní, II – téměř kompletní a III – inkompletní) a vzdálenost nádoru od CRM (kdy se vzdálenost ≤1 mm považuje za pozitivní okraj). Hodnocení CRM je nejdůležitějším prediktorem lokální rekurence, přičemž kvalita excidovaného mezorekta je klíčovým faktorem, který ovlivňuje riziko lokální rekurence u pacientů s negativním CRM [20].
Pro hodnocení stupně regrese nádoru (tumor regression grade, TRG) po neoadjuvantní léčbě se u RC používá několik skórovacích systémů, které hodnotí histologické změny způsobené chemoradioterapií v ložisku primárního tumoru. TRG představuje významný nezávislý prognostický faktor, neboť méně výrazná či zcela chybějící regrese nádoru odráží agresivní maligní fenotyp, který je méně citlivý k chemoradioterapii a vykazuje větší metastatický potenciál [21].
Skórovací systémy hodnotící TRG se dají rozdělit do dvou hlavních skupin v závislosti na základních využívaných principech hodnocení [22]. První skupina využívá hodnocení semikvantitativní, založené na hodnocení poměru fibrózy a reziduálních nádorových buněk v ložisku primárního tumoru. Mezi hlavní TRG systémy využívající toto hodnocení patří systém dle Mandarda [23], dle Dworaka [24], dle Ryana [25] a AJCC/CAP (American Joint Committee on Cancer / College of American Pathologists´) systém z roku 2010 [26]. Druhá skupina využívá k hodnocení odhad procenta reziduálních nádorových buněk v původním nádorovém ložisku, kdy hlavní zástupce představuje zejména TRG systém dle Rödela [27], Beckera [28] a RCRG systém (Rectal Cancer Regression Grading System of the Royal Association of Pathologists) [29]. Základní charakteristiky nejčastěji využívaných TRG systémů jsou shrnuty v Tab. 3. TRG systémy dle Mandarda a Dworaka jsou oba 5stupňové systémy s obdobnými hodnotícími kritérii, s jediným rozdílem v opačném pořadí TRG kategorií (TRG 1 dle Mandarda = kompletní regrese vs. TRG 0 dle Dworaka = zcela bez regrese). TRG systém dle Ryana je 3stupňový a představuje modifikaci systému Mandardova. Na TRG systému dle Ryana je dále založené hodnocení dle AJCC/CAP. AJCC/CAP je TRG systém o 4 stupních, který je v současné době doporučovaný pro hodnocení regrese i v AJCC TNM staging systému, a proto byl použit i v naší práci.
Table 3. Přehled nejčastěji využívaných TRG systémů pro hodnocení stupně regrese po neoadjuvantní chemoradioterapii u karcinomu rekta
Tab. 3: An overview of the most frequently used TRG scoring systems for evaluation of the tumor regression after neoadjuvant chemoradiotherapy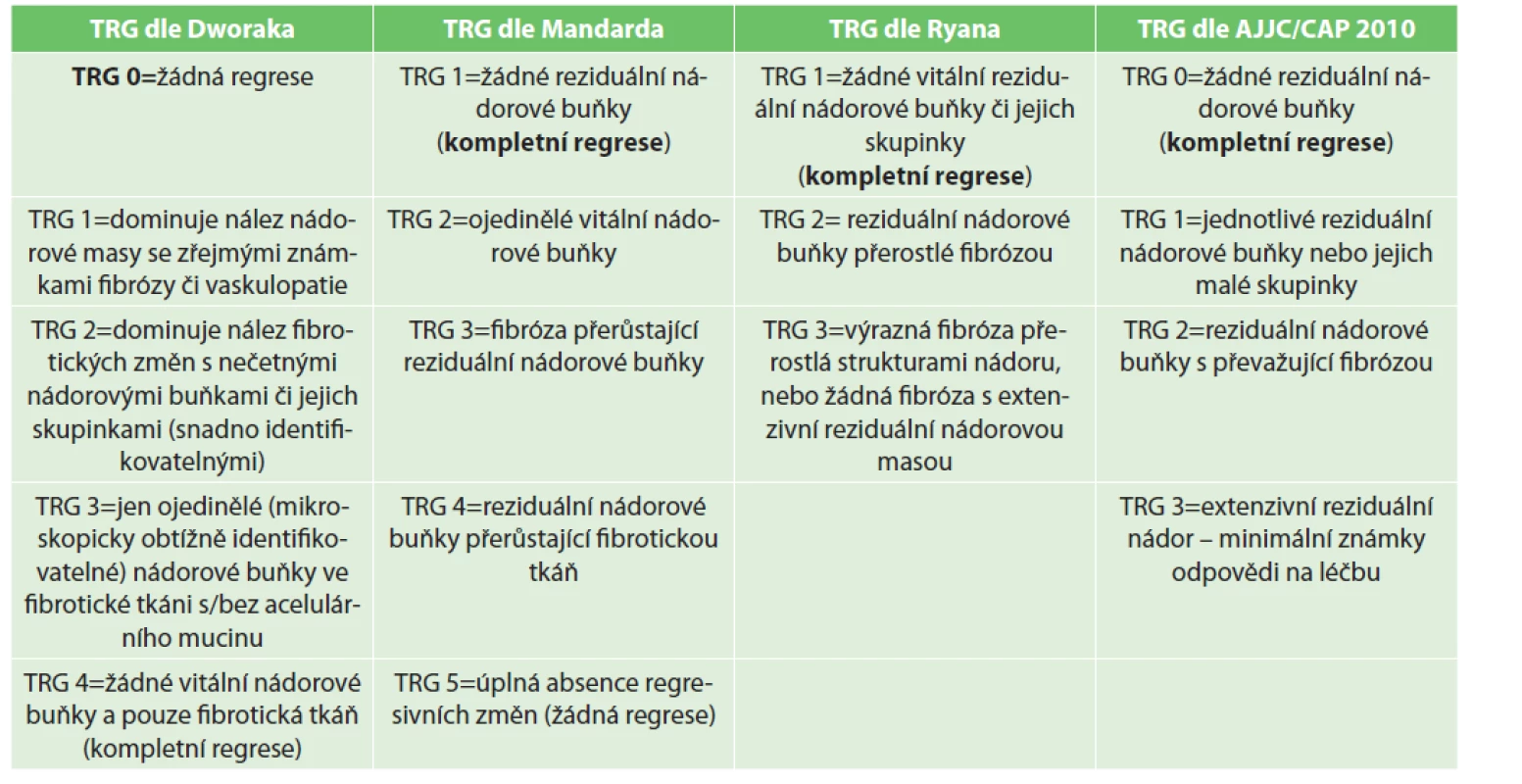
Bez ohledu na rozdíly mezi jednotlivými výše uvedenými TRG systémy všechny z nich sdílejí jistou nevýhodu ve vysokém stupni inter - i intraobservační variability a vykazují nízký stupeň konkordance, což snižuje jejich reproducibilitu. Recentně bylo také poukazováno na to, že současné TRG systémy hodnotí pouze primární tumor bez ohledu na stav regionálních lymfatických uzlin, a proto byla navržena i modifikovaná verze Dworakova TRG systému (modif. Dworak), která hodnotí jak primární tumor, tak regionální lymfatické uzliny [30].
Jak vyplývá z uvedených výsledků vlastního souboru pacientů, kompletní patologické odpovědi bylo dosaženo u 10,4 % pacientů. Zde je patrna určitá diskrepance se zahraničními studiemi, které průměrně uvádějí hodnotu 13 %. Na tom se ovšem může podílet fakt, že v rozdílných publikacích se stále setkáváme s různými TRG systémy. Soubor našich pacientů navíc nebyl rozčleněn do podskupin dle jednotlivých klinických stadií, což jistě může výsledek také ovlivnit. Nicméně i z našich výsledků jasně vyplývá, že neoadjuvantní onkologická léčba je pro pacienty s lokálně pokročilým RC jednoznačným benefitem. Z dostupné literatury je patrný neoddiskutovatelný fakt, že patologická odpověď ve smyslu regrese karcinomu je spojena se zlepšeným celkovým přežitím [31]. Stále ovšem nemáme jasný konsenzus o odstupu chirurgického výkonu od ukončení chemoradioterapie, zejména ve vztahu k toxickým účinkům radioterapie. V současné době je obecně uznávaný fakt, že po aplikaci standardní frakcionované radioterapie (či v konkomitanci s chemoterapií), má operační výkon následovat 6–8 týdnů od ukončení léčby. To je dostatečně dlouhá doba k odeznění akutní postradiační reakce, která ale zároveň dává možnost uplatnění protinádorového efektu léčby. Naopak u akcelerované radioterapie má operační výkon následovat do 72 hodin od ukončení léčby, před rozvojem akutních toxických účinků. Dle některých autorů se ale zdá, že resekční výkon do 6 týdnů od ukončení neoadjuvance je spojen s vyšším rizikem pooperačních komplikací. Naopak resekční výkon po 8 týdnech od ukončení neodjuvantní léčby je zatížen nižším rizikem pooperačních komplikací a zároveň je pozorována lepší odpověď protinádorové léčby ve smyslu downsizingu [32]. Studie Lyon R90-01 srovnávala celkem u 201 pacientů interval 2 týdny oproti 6 až 8 týdnům mezi dokončením neoadjuvantní radioterapie a chirurgickým výkonem. Delší interval vedl k signifikantně vyššímu procentu léčebných odpovědí (53,1 % versus 71,7 %, p=0,007) i lepšímu downstagingu (10,3 % versus 26 %, p=0,005). Nebyl rozdíl v morbiditě, množství lokálních rekurencí a krátkodobém přežití u obou skupin pacientů [33]. Studie Stockholm III uveřejněná v roce 2017 hodnotila optimální interval mezi neoadjuvantní léčbou a chirurgickým výkonem. Jednalo se o multicentrickou randomizovanou studii fáze 3, zahrnuto bylo 840 pacientů celkem do tří ramen. První skupina dostala 5×5 Gy radioterapie, poté následoval chirurgický výkon do 1 týdne (short-course RT) nebo s odstupem 4 až 8 týdnů (delayed short-course RT). Třetí skupina byla léčena radioterapií v 25 frakcích à 2 Gy a chirurgický výkon byl proveden s odstupem 4–8 týdnů (long course RT). Studie neshledala signifikantní rozdíl v počtu lokálních recidiv u všech tří skupin. Zajímavá byla subanalýza srovnávající krátký režim s okamžitým chirurgickým výkonem oproti krátkému režimu s odloženou chirurgií, kdy množství pooperačních komplikací bylo vyšší u krátkého režimu s okamžitým chirurgickým výkonem (53 % vs. 41 %, p=0,001). Celkové množství komplikací bylo u první skupiny 50 %, u druhé 38 % a u třetí 39 %. Chirurgické komplikace (ranné infekce, pooperační krvácení, leak anastomózy, dehiscence rány) se vyskytly u 31 % pacientů s krátkým režimem, u 26 % pacientů s krátkým režimem a odloženým chirurgickým výkonem a u 23 % pacientů s dlouhým režimem [34].
Recentně bylo provedeno i několik metaanalýz hodnotících odstup chirurgického výkonu od neoadjuvantní léčby. Např. Petrelli et al. zkoumali korelaci mezi intervalem chirurgického výkonu a patologickou kompletní odpovědí. Kontrolní skupinou byli pacienti operovaní 6–8 týdnů po dokončení neoadjuvance. Ve skupině operované po delší, než 8týdenní pauze bylo vyšší procento pCR (13,7 % vs. 19,5 %, p=0,0001). Další sledované parametry jako přežití, lokální rekurence, pooperační komplikace byly srovnatelné [35].
Poněkud komplexnější je ale problematika pacientů se stadiem cT3N0, u nichž ani při precizním stagingu nebylo prokázáno uzlinové postižení. Je třeba mít na paměti nejen benefity, ale i možné komplikace neoadjuvantní chemoradioterapie, které byly uvedeny výše. V německé studii CAO/ARO/AIO-94 podstoupilo 18 % pacientů se stadiem cT3N0 primární chirurgický výkon bez neoadjuvantní onkologické léčby. V definitivním histologickém hodnocení byl potom tumor hodnocen jako pT1-2N0. U těchto pacientů by se pak jednalo o over-treatement se všemi potenciálními riziky plynoucími z neoadjuvantní léčby. Guillem et al. publikovali výsledky u pacientů, kteří podstoupili neoadjuvantní léčbu. U 22 % bylo po výkonu zachyceno uzlinové postižení. U pacientů, kteří podstoupili primárně chirurgický výkon, mělo uzlinové postižení až 40 % pacientů. Tito pacienti poté vyžadovali pooperační chemoradioterapii, která je ale zatížena vyšším počtem lokálních recidiv, vyšší tkáňovou toxicitou a alterovaným vyprazdňováním. I přesto je ale dle aktuálních doporučení neoadjuvantní onkologická léčba preferována.
Dalším aktuálně stále velmi diskutovaným přístupem je „watch and wait“ strategie u pacientů s klinickou kompletní odpovědí nádoru na neoadjuvantní chemoradioterapii. Habr-Gama et al. v roce 2004 publikovali výsledky dlouhodobého sledování těchto pacientů. 265 pacientů s resekabilním nízko uloženým RC absolvovalo standardní neoadjuvantní chemoradioterapii. Po 8 týdnech pacienti absolvovali restagingové vyšetření za užití klinického, zobrazovacího i endoskopického vyšetření. U 71 pacientů byla pozorována klinická kompletní odpověď na neoadjuvantní léčbu. Tito pacienti ovšem neprodělali primárně chirurgický výkon, ale byli zařazeni do přísného dispenzarizačního programu s mediánem sledování 57,3 měsíce. Z Habr-Gamou prezentovaných výsledků vyplývá, že pouze 2 pacienti vyvinuli lokální recidivu a u 3 pacientů byla pozorována recidiva systémová. I přes prezentované výsledky zůstává „watch and wait“ strategie stále tématem poněkud kontroverzním a vzhledem k rozdílným metodikám ve zpracování dat je srovnání dalších studií také poměrně obtížné, přičemž stále ne zcela jasný zůstává nejdůležitější aspekt, a to výběr vhodných pacientů [36].
Závěr
Léčba karcinomu rekta prošla v posledních desetiletích značným vývojem. Díky zlepšení chirurgické techniky, novým instrumentáriím a zejména díky zavedení konceptu TME do rutinní praxe se zásadním způsobem snížilo riziko lokální recidivy a zlepšilo celkové přežití nemocných. Radioterapie se u karcinomů aborálních 2/3 rekta stala nedílnou součástí léčby karcinomu rekta, její indikace však musí být pečlivě zvažována multidisciplinárním týmem odborníků vzhledem k závažným vedlejším účinkům, jako jsou anorektální a urogenitální dysfunkce. V současné době probíhají studie, které by měly dále upřesnit roli radioterapie v léčebném managementu karcinomu rekta. Zdá se, že i v případě RC, tak jako u celé řady dalších malignit, se léčba bude ubírat cestou personalizace a optimalizace, tedy léčby šité na míru pacientovi, respektive tumoru, tak aby nedocházelo k under-treatment nebo naopak over-treatment.
Seznam zkratek:
APR – abdominoperineal resection
CRM – circumferencial resection margin
CHRT – chemoradioterapie
DFS – desease free survival
LAR – low anterior resection
LARS – low anterior resection syndrom
OS – overall survival
RC – karcinom rekta
SSI – surgical site infections, ranné infekce
TRG – tumor regression grade
Podpořeno z projektu SVV 260367 – Ústav patologie 1. LF UK a VFN v Praze.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Pavel Koželský
I. chirurgická klinika 1. LF UK a VFN v Praze
U Nemocnice 499/2
128 00 Praha 2
e-mail: pavel.kozelsky@vfn.cz
Sources
- Hoch J, Dytrych P, Prausová J. Nádory konečníku. In: Krška Z, Hoskovec D, et al. Chirurgická onkologie. Praha, Grada publishing 2014 : 553−562.
- WWW.SVOD.CZ, 2017.
- Siddiqui AA, Fayiga Y, Huerta S. The role of endoscopic ultrasound in the evaluation of rectal cancer. Int Semin Surg Oncol. 2006;3 : 36. doi:10.1186/1477-7800-3-36.
- Glynne-Jones R, Wyrwicz L, Tiret E, et al. Rectal cancer: ESMO Clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;(01)28(suppl 4):iv22–40. doi:10.1093/annonc/mdx224.
- Brown G, Richards CJ, Newcombe RG, et al. Rectal carcinoma: thin-section MR imaging for staging in 28 patients. Radiology 1999;211(1):215–22. doi: 10.1148/radiology.211.1.r99ap35215.
- Brouwer NPM, Stijns RCH, Lemmens VEPP, et al. Clinical lymph node staging in colorectal cancer; J Surg Oncol. 2018;44(8):1241–6. doi:10.1016/j.ejso.2018.04.008.
- Feeney G, Sehgal R, Sheehan M, et al. Neoadjuvant radiotherapy for rectal cancer management. World J Gastroenterol. 2019;25 : 4850–69 doi: 10.3748/wjg.v25.i33.4850.
- Heald RJ. A new approach to rectal cancer. Br J Hosp Med. 1979;22 : 277–281.
- Sauer R, Becker H, Hohenberger W, et al. German Rectal Cancer Study Group. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351 : 1731–1740. doi: 10.1056/NEJMoa040694.
- Ansari N, Solomon MJ, Fisher RJ, et al. Acute adverse events and postoperative complications in a randomized trial of preoperative short-course radiotherapy versus long-course chemoradiotherapy for T3 adenocarcinoma of the rectum: Trans-Tasman Radiation Oncology Group trial (TROG 01.04). Ann Surg. 2017;265 : 882–888. doi: 10.1097/SLA.0000000000001987.
- Croese AD, Lonie JM, Trollope, et al. A meta-analysis of the prevalence of Low Anterior Resection Syndrome and systematic review of risk factors. Int J Surg. 2018;56 : 234–241. doi: 10.1016/j.ijsu.2018.06.031.
- Brown CJ, Fenech DS, McLeod RS. Reconstructive techniques after rectal resection for rectal cancer. Cochrane Database Syst Rev. 2008:CD006040 doi: 10.1002/14651858.CD006040.pub2.
- Bregendahl S, Emmertsen KJ, Lous J, et al. Bowel dysfunction after low anterior resection with and without neoadjuvant therapy for rectal cancer: a population-based cross-sectional study. Colorectal Dis. 2013;15 : 1130–1139. doi: 10.1111/codi.12244.
- Chen TY, Wiltink LM, Nout RA, et al. Bowel function 14 years after preoperative short-course radiotherapy and total mesorectal excision for rectal cancer: report of a multicenter randomized trial. Clin Colorectal Cancer 2015;14 : 106–114. doi: 10.1016/j.clcc.2014.12.007.
- Hendren SK, O‘Connor BI, Liu M, et al. Prevalence of male and female sexual dysfunction is high following surgery for rectal cancer. Ann Surg. 2005;242 : 212–223. doi: 10.1097/01.sla.0000171299.43954.ce.
- Ledebo A, Bock D, Prytz M, et al. Urogenital function 3 years after abdominoperineal excision for rectal cancer. Colorectal Dis. 2018;20:O123–O134 doi: 10.1111/codi.14229.
- Hopewell JW. Radiation-therapy effects on bone density. Med Pediatr Oncol. 2003;41 : 208–211. doi: 10.1002/mpo.10338.
- Jørgensen JB, Bondeven P, Iversen LH, et al. Pelvic insufficiency fractures frequently occur following preoperative chemo-radiotherapy for rectal cancer − a nationwide MRI study. Colorectal Dis. 2018;20 : 873–880. doi: 10.1111/codi.14224.
- Parfitt JR, Driman DK. The total mesorectal excision specimen for rectal cancer: a review of its pathological assessment. J Clin Pathol. 2007;60(8):849−855. doi: 10.1136/jcp.2006.043802.
- Campa-Thompson M, Weir R, Calcetera N, et al. Pathologic processing of the total mesorectal excision. Clin Colon Rectal Surg. 2015;28(1):43−52. doi: 10.1055/s-0035-1545069.
- Ghadimi M, Liersch T, Grabenbauer GG, et al. Tumor regression grading after preoperative chemoradiotherapy as a prognostic factor and individual-level surrogate for disease-free survival in rectal cancer. J Natl Cancer Inst. 2017;109(12). doi: 10.1093/jnci/djx095.
- Langer R, Becker K. Tumor regression grading of gastrointestinal cancers after neoadjuvant therapy. Virchows Arch. 2018;472(2):175−186. doi: 10.1007/s00428-017-2232-x.
- Mandard AM, Dalibard F, Mandard JC, et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer 1994;73(11):2680−2686. doi: 10.1002/1097-0142(19940601)73 : 11 <2680::aid-cncr2820731105>3.0.co;2-c.
- Dworak O, Keilholz L, Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorectal Dis. 1997;12(1):19−23. doi: 10.1007/s003840050072.
- Ryan R, Gibbons D, Hyland JM, et al. Pathological response following long-course neoadjuvant chemoradiotherapy for locally advanced rectal cancer. Histopathology 2005;47(2):141−146. doi: 10.1111/j.1365-2559.2005.02176.x.
- Edge SB, Byrd DR, Compton CC, et al. A 3rd. AJCC cancer staging manual. 7th ed. New York, Springer-Verlag 2010. doi: 10.3322/caac.21388.
- Rödel C, Martus P, Papadoupolos T, et al. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Ocol. 2005;23(34):8688−8696. doi: 10.1200/JCO.2005.02.1329.
- Becker K, Mueller JD, Schulmacher C, et al. Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy. Cancer 2003;98(7):1521−1530. doi: 10.1002/cncr.11660.
- Bateman AC, Jaynes E, Bateman AR. Rectal cancer staging post neoadjuvant therapy − how should the changes be assessed? Histopathology 2009;54(6):713−721. doi: 10.1111/j.1365-2559.2009.03292.x.
- Kim SH, Chang HJ, Kim DY, et al. What is the ideal tumor regression grading system in rectal cancer patients after preoperative chemoradiotherapy? Cancer Res Treat. 2016;48(3):998−1009. doi: 10.4143/crt.2015.254.
- Cotte E, Passot G, Decullier E, et al. Pathologic response, when increased by longer interval, is a marker but not the cause of good prognosis in rectal cancer: 17-year follow-up of the Lyon R90-01 randomized trial. Int J Radiat Oncol Biol Phys. 2016;94(3):544−553. doi: 10.1016/j.ijrobp.2015.10.061.
- Sauer R, Becker H, Hohenberger Wet, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351(17):1731–1740. doi: 10.1056/NEJMoa040694.
- Francois Y, Nemoz CJ, Baulieux J, et al. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: The Lyon R90-01 randomized trial. J Clin Oncol. 1999;17 : 2396. doi: 10.1200/JCO.1999.17.8.2396.
- Erlandsson J, Holm T, Pettersson D, et al. Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer (Stockholm III): a multicentre, randomised, non-blinded, phase 3, non-inferiority trial. Lancet Oncol. 2017;18 : 336–346. doi: 10.1016/S1470-2045(17)30086-4.
- Petrelli F, Sgroi G, Sarti E, et al. Increasing the interval between neoadjuvant chemoradiotherapy and surgery in rectal cancer: a meta-analysis of published studies. Ann Surg. 2013;00 : 1–8. doi: 10.1097/SLA.0000000000000368.
- Laurence B, Balyasnikova S, Tait D, et al. Watch-and wait as a therapeutic strategy in rectal cancer. Current Colorectal Cancer Reports 2018;14 : 37–55. doi: 10.1007/s11888-018-0398-5.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 2-
All articles in this issue
-
Perioperative nutrition in the light of guidelines
(and in the shadow of practice) - New options for surgeons to improve malnutrition in the outpatient setting
- Intermittent feeding in intensive care – the theory and practice
- Rectal cancer – current treatment strategy and the tumor regression grade evaluation after neoadjuvant therapy in patients who underwent surgery at the I. Department of Surgery, General University Hospital in Prague between 2012 and 2016
- Nutrition in open abdomen
- Multidisciplinary surgical approach to renal cancer with vena cava invasion and pulmonary embolism
- Výživa v chirurgii: jak dostat koně do Tróje?
-
Perforace divertiklu tlustého střeva králičí kostí –
kazuistika
-
Perioperative nutrition in the light of guidelines
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Perioperative nutrition in the light of guidelines
(and in the shadow of practice) - Intermittent feeding in intensive care – the theory and practice
- Rectal cancer – current treatment strategy and the tumor regression grade evaluation after neoadjuvant therapy in patients who underwent surgery at the I. Department of Surgery, General University Hospital in Prague between 2012 and 2016
- Nutrition in open abdomen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

