-
Medical journals
- Career
Intermitentní výživa v intenzivní péči – teorie a praxe
Authors: I. Satinský 1,2; J. Richtarová 1,3
Authors‘ workplace: av ošetřovatelství, Fakulta veřejných politik, Slezská univerzita v Opavě ; Ústav epidemiologie a ochrany veřejného zdraví, Lékařská fakulta, Ostravská univerzita 3
Published in: Rozhl. Chir., 2021, roč. 100, č. 2, s. 66-73.
Category: Original articles
Overview
Úvod: U pacientů malnutričních nebo v kritickém stavu se stává nutriční péče jednou ze základních podmínek úspěšného zotavení. Aplikace enterální výživy u kriticky nemocných pacientů je většinou realizována formou kontinuálního nebo cyklického podávání. Naopak mezi potenciální výhody intermitentního podávání patří zvýšení proteosyntézy svalových bílkovin. Sdělení se zabývá teorií možného anabolického účinku intermitentního způsobu podávání výživy. Jsou popsány zkušenosti s implementací tohoto způsobu aplikace na lůžku intenzivní péče se sledováním možných komplikací a nežádoucích příhod.
Metody: Ve sledovaném období bylo retrospektivně zaznamenáno 6 pacientů, kteří byli živeni intermitentním způsobem. Kromě demografických dat byly sledovány možné komplikace spojené s intermitentním podáváním enterální výživy (aspirační pneumonie, navýšení gastrického reziduálního objemu − GRV, břišní dyskomfort, osmotický průjem).
Výsledky: Průměrná délka intermitentního podávání výživy byla 8 dnů. Souhrn dnů, ve kterých byla podávána výživa intermitentním způsobem, činil 63 dnů. Během této doby nebyla zaznamenána žádná aspirační příhoda s následnou pneumonií. Nedošlo ani k navýšení GRV. U žádného pacienta nebyl pozorován břišní dyskomfort a osmotický průjem.
Závěr: I když je kontinuální a cyklické podávání enterální výživy u kriticky nemocných označováno za standard a je široce v praxi užíváno, je považováno za nefyziologický způsob s možnými negativními důsledky pro samotného pacienta. Naproti tomu intermitentní podávání je teoreticky spojeno s respektováním cirkadiálního rytmu a s aktivací autofagie. Přerušované podávání výživy zvyšuje proteosyntézu svalových bílkovin a podporuje uvolňování mastných kyselin. Naše observační studie ukázala, že intermitentní aplikace enterální výživy na lůžkách intenzivní péče je realizovatelná bez nežádoucích účinků, je ale časově náročnější pro nelékařské zdravotnické pracovníky.
Klíčová slova:
intermitentní výživa – intenzivní péče – enterální výživa – svalová slabost − proteosyntéza
ÚVOD
V posledních letech narůstá odborný zájem o vliv výživy na chirurgického nemocného v celém perioperačním období. Je zřejmé, že právě aktuální nutriční stav hraje důležitou roli pro nekomplikovaný průběh hojení, ale i pro dlouhodobou rekonvalescenci po větším chirurgickém výkonu. U pacientů malnutričních nebo v kritickém stavu se stává nutriční péče jednou ze základních podmínek úspěšného zotavení. Právě této aktuální problematice výživy u kriticky nemocných jsou věnovány poslední dvě mezinárodní doporučení [1,2].
Adekvátní nutriční podpora v pooperační fázi je podmínkou zmírnění důsledků proteolýzy. S převažujícím katabolickým stavem a s případnou imobilitou je spojena získaná slabost na jednotce intenzivní péče (acquired weakness in intensive care unit, AW-ICU). Ta vede především k oslabení svalové síly končetin a bránice a tím k další progresi omezení pohyblivosti, snížené schopnosti expektorace a k prodloužení případné závislosti na umělé plicní ventilaci. Výsledkem je pak zvýšený počet komplikací (ztráta soběstačnosti, pneumonie, dekubity) a prodloužení doby hospitalizace na jednotkách intenzivní péče (JIP) a v nemocnici celkově. Ztráta svalové hmoty zásadně mění dobu rekonvalescence i po propuštění z nemocnice. Často pak ještě trvá 6–12 měsíců než se pacient, který prošel komplikovaným pooperačním průběhem, dostane na optimální úroveň svých fyziologických funkcí.
Syntéza svalových bílkovin je u zdravého jedince výrazně stimulována příjmem stravy. Dochází k nárůstu až na 300 % původní úrovně proteosyntézy se současným poklesem proteolýzy na 50 %. Po orálním podání bolusu esenciálních aminokyselin mladým jedincům následuje po prodlevě trvající 45 až 90 min. zvýšení syntézy svalových proteinů, které přetrvává asi 90 min. Tato výrazná anabolická reakce se pak poměrně rychle vrací na původní úroveň [3−5]. Trvání a stupeň vyvolaného anabolického navýšení po požití proteinů je ovlivněno cvičením, věkem, dávkou a druhem podaných proteinů a samozřejmě aktuálním anabolicko-katabolickým stavem daného jedince [3]. Je ale také potřeba zmínit, že další makronutrienty nemají žádný aditivní anabolický účinek. Přidání sacharidů k proteinům nezvyšuje syntézu svalových bílkovin a ani nesnižuje rozpad svalových proteinů [3,6].
U pacientů kriticky nemocných je ztráta svalové hmoty výsledkem nerovnováhy mezi svalovou proteolýzou a proteosyntézou bílkovin. Proteolýza je zprostředkována několika buněčnými signálními sítěmi, ale převládající proteolytickou cestou je ubiquitin-proteázomový systém [7]. Důsledkem vystupňované proteolýzy svalových bílkovin je pak výrazná ztráta svalové hmoty a svalové síly. U pacientů po 10 dnech na umělé plicní ventilaci byla zaznamenána 17% redukce objemu přímého stehenního svalu [8]. Toto zjištění má své zásadní klinické konsekvence.
Optimální úroveň syntézy proteinů vyžaduje pulzní navýšení větvených aminokyselin (zvláště leucinu) s nebo bez současných výkyvů hladiny inzulinu. Studie ukázaly, že inzulin a větvené aminokyseliny nezávisle zvyšují syntézu svalů s potencovaným účinkem při jejich současném podávání [9]. Data z animálních studií potvrzují, že tvorba svalových proteinů po požití potravy nastupuje rychle (během 30 min.) a přetrvává asi kolem 2 hodin. Pak proteosyntéza klesá do původního stavu souběžně s postprandiálními změnami hladin inzulinu a aminokyselin [10,11].
Úroveň svalové syntézy a efekt „muscle full“ jsou ovlivněny cvičením, věkem, typem přijatého proteinu a anabolicko-katabolickým stavem jedince [3]. Klesající úroveň svalové syntézy po příjmu stravy označovaná jako anabolická rezistence je spojená se stárnutím a může částečně vysvětlovat sarkopenii ve stáří [3,12].
Metody podávání enterální výživy
Enterální výživa může být podávána z časového hlediska různými způsoby. Mluvíme tak o podávání kontinuálním, cyklickém, intermitentním a bolusovém (Obr. 1).
Image 1. Způsoby podávání sondové enterální výživy − upraveno dle Ichimaru [14]
Fig. 1: Methods of delivering enteral tube feeding – adapted according to Ichimaru [14]![Způsoby podávání sondové enterální výživy − upraveno dle Ichimaru [14]<br>
Fig. 1: Methods of delivering enteral tube feeding – adapted according to Ichimaru [14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d9f65255fd8d54283cbe519ffd697885.png)
Kontinuální podávání je realizováno pomocí enterální pumpy během celých 24 hodin. Tento způsob se uplatňuje při zahájení podávání enterální výživy. Iniciální rychlost je obvykle kolem 20–40 ml/hod. a postupně se zvyšuje o 10–20 ml/hod. každých 2–24 hodin. Tento způsob podávání je obvyklý u kriticky nemocných, u intubovaných pacientů nebo u těch, kteří nejsou schopni tolerovat intermitentní nebo bolusové podávání. Kontinuální podávání je celosvětově preferováno na většině jednotek intenzivní péče pro svou jednoduchost a relativní bezpečnost. Stále není jasné, zdali nepřerušované podávání vede k lepší glykemické kontrole než podávání intermitentní či bolusové. Nevýhodou kontinuálního podávání je skutečnost, že dochází k častému přerušování podávání. Důvodem jsou nezbytné léčebné a diagnostické intervence, mechanické problémy se sondou nebo podávání léků enterálně. Taková přerušení podávání mohou vést k výrazné redukci původně předepsaného denního objemu výživy [13].
Cyklické podávání znamená aplikaci výživy méně než 24 hodin. Většinou je přerušení cíleno na noční hodiny s respektem k cirkadiálnímu rytmu. Přestávka může být délky od 1 do 23 hodin, obvykle bývá kolem 6–8 hodin. Tento časový interval umožňuje u pacienta možné zvýšení chuti k jídlu a obnovení žaludeční acidity při lačnění. Delší přerušení výživy umožňuje zvýšení mobility pacienta odpojeného od enterální pumpy [14].
Intermitentní podávání trvá obvykle 20–60 minut pomocí enterální pumpy (méně často jen gravitačním způsobem s kolečkovým regulátorem). Většinou se podává objem 240–720 ml, a to 4 až 6× denně podle nutričních potřeb pacienta. Tento způsob podávání je více fyziologický oproti podávání kontinuálnímu nebo cyklickému. Navíc umožňuje větší mobilitu pacienta mezi samotným podáváním. Podle tolerance pacienta může být objem jednotlivých dávek postupně zvyšován a počet podání redukován [15]. Starší studie upozorňovaly na některé možné nevýhody intermitentního podávání, zejména na zvýšené riziko aspirace a průjmů. Následné studie srovnávající intermitentní a kontinuální aplikaci neukázaly žádný rozdíl ve výsledcích – včetně letality, počtu aspirací a pneumonií a výskytu průjmů [16−19].
Bolusové podávání je aplikováno obvykle 4–10 minut většinou velkoobjemovou stříkačkou s dávkami kolem 100–250 ml. Bolus je podáván nejčastěji 3 až 7× denně [15]. Protože rychlá aplikace výživy může vyvolávat průjem nebo aspiraci, je tento způsob aplikace enterální výživy určen spíše pro stabilní pacienty krmenými do žaludku [20]. Bolusová aplikace umožňuje separátní podávání medikace. Svou četností se přibližuje normálním stravovacím zvyklostem a zvyšuje nezávislost na podávání s větší možností pohybu a normálního způsobu života [14].
Potenciální výhody intermitentního a bolusového podávání výživy
U pacientů v intenzivní péči často převažuje rozpad svalové hmoty nad její syntézou a výsledná ztráta skeletálního svalstva vede k těžkému funkčnímu postižení kriticky nemocných pacientů [8]. Inzulin a leucin zvyšují syntézu svalových bílkovin aktivací AKT/protein kinázy B a savčího cílového receptoru pro rapamycin (mTOR) [21−23]. Kontinuální infuze aminokyselin podaná během 30–60 min. vede ke stimulaci syntézy svalových bílkovin. Syntéza však po 120 minutách klesá do základní úrovně, přestože infuze aminokyselin kontinuálně pokračuje [24]. Obdobně při perorálním podání bolusu syrovátky je vyvoláno pulzní vyplavení inzulinu, pulzní zvýšení intramuskulární koncentrace leucinu a zvýšení syntézy svalových bílkovin. Toto navýšení má svůj vrchol po 90 minutách od podání, poté proteosyntéza začne klesat, aby po 180 minutách dosáhla své bazální úrovně [4].
Po přijetí stravy začnou enterokrinní buňky vnitřního epitelu zažívacího traktu uvolňovat některé hormony jako glukagon-like peptid-1 (GLP-1), gastric inhibitory polypeptid (glucose-dependent insulinotropic polypeptide, GIP), cholecystokinin, ghrelin a peptid YY. Tyto hormony regulují motilitu trávicí soustavy, kontrakci žlučníku, pankreatickou funkci pro vstřebávání živin. Většina z nich je uvolňována již v průběhu přijímání stravy. Přechodně stoupá jejich hladina, kdy po dokončení jídla opět klesá na základní úroveň [25]. Při kontinuálním podávání živin tato enterohormonální odpověď většinou úplně chybí [26]. Ačkoliv dřívější studie nebyly zaměřeny na pacienty v intenzivní péči, lze předpokládat, že stejný mechanismus probíhá i u těchto nemocných. Právě díky sekreci hormonů zažívacího traktu a díky změnám v syntéze svalových proteinů může být intermitentní nebo bolusové podávání výživy přínosnější pro kriticky nemocné, než je podávání kontinuální (Obr. 2) [14].
Image 2. Grafické znázornění „muscle full“ efektu při kontinuálním a intermitentním podávání výživy
Fig. 2: Graphic visualization of the “muscle full“ effect with continuous and intermittent feeding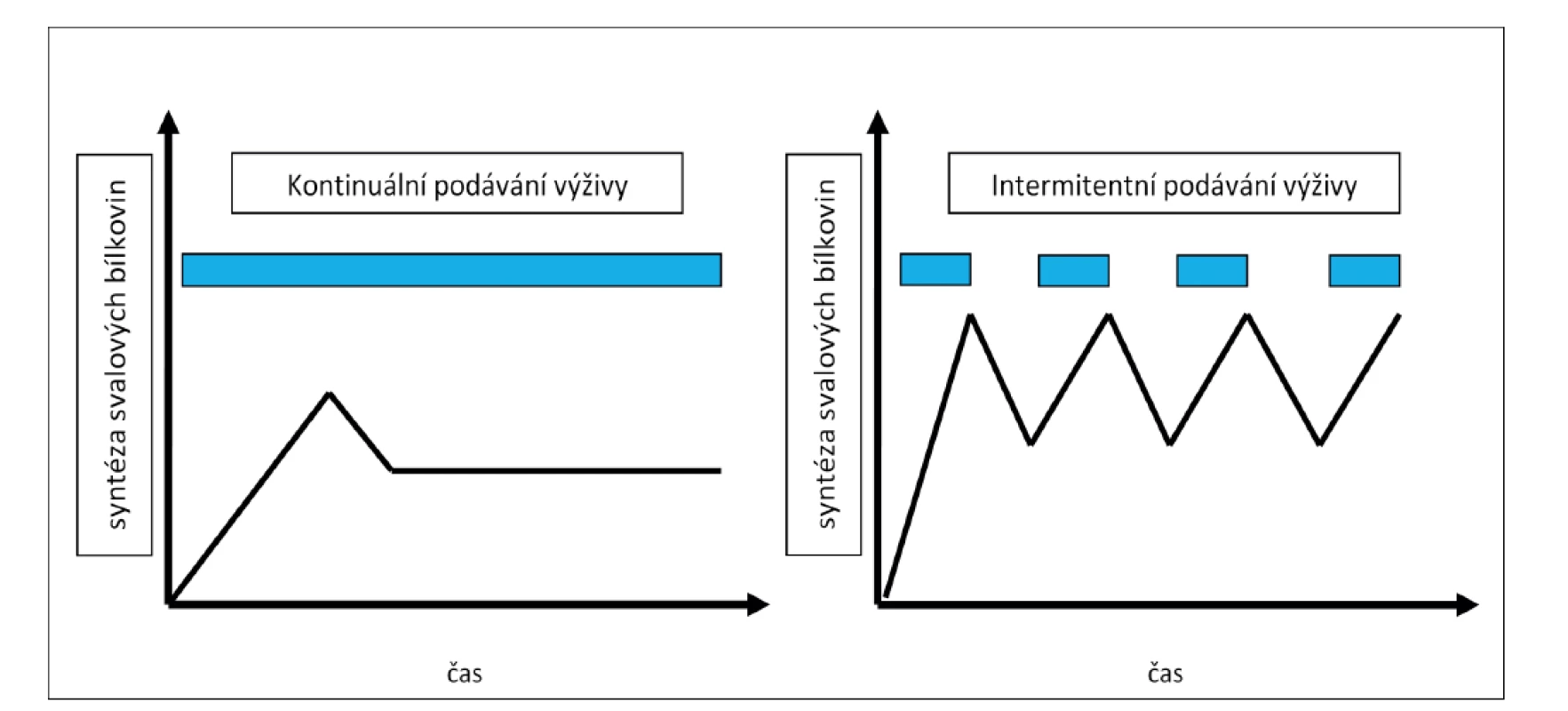
Přehledné srovnání výhod a nevýhod jednotlivých způsobů aplikace sondové výživy je souhrnně uvedeno v tabulce (Tab. 1).
Table 1. Potenciální výhody a nevýhody jednotlivých metod podávání výživy
Tab. 1: Potential advantages and disadvantages of individual feeding methods
Upraveno podle Ichimaru [28]. Metody
V roce 2018 jsme se na našem pracovišti − Mezioborová jednotka intenzivní péče pro chirurgické obory (MOJIP), Nemocnice Havířov – rozhodli zavést v indikovaných případech intermitentní podávání výživy. Prvním pacientem byl v červenci 2018 muž po kraniotraumatu s výrazným neurologickým deficitem, s tracheotomií. Intermitentní výživa byla podávána u tohoto pacienta nazogastrickou sondou. Do souboru byli zařazeni všichni pacienti, kterým byla v období od 1. 7. 2018 do 30. 6. 2020 podávána enterální výživa intermitentním způsobem na lůžkách MOJIP.
Tito pacienti během své hospitalizace na MOJIP byli zprvu živeni kontinuálně nebo cyklicky podávanou časnou enterální výživou v kombinaci se suplementární parenterální výživou. Poté, co objem tolerované enterální výživy dosáhl 60–80 % denních energetických a proteinových cílů, byl způsob aplikace enterální výživy převeden na intermitentní výživu dle daného schématu (Tab. 2). Toto schéma bylo modifikací aplikačního schématu podle Paula Marika [28]. V době, kdy neprobíhala enterální výživa, byly sondou podávány tekutiny rychlostí 50–100 ml /hod.
Table 2. Rozpis intermitentního podávání enterální výživy
Tab. 2: Schedule of intermittent enteral feeding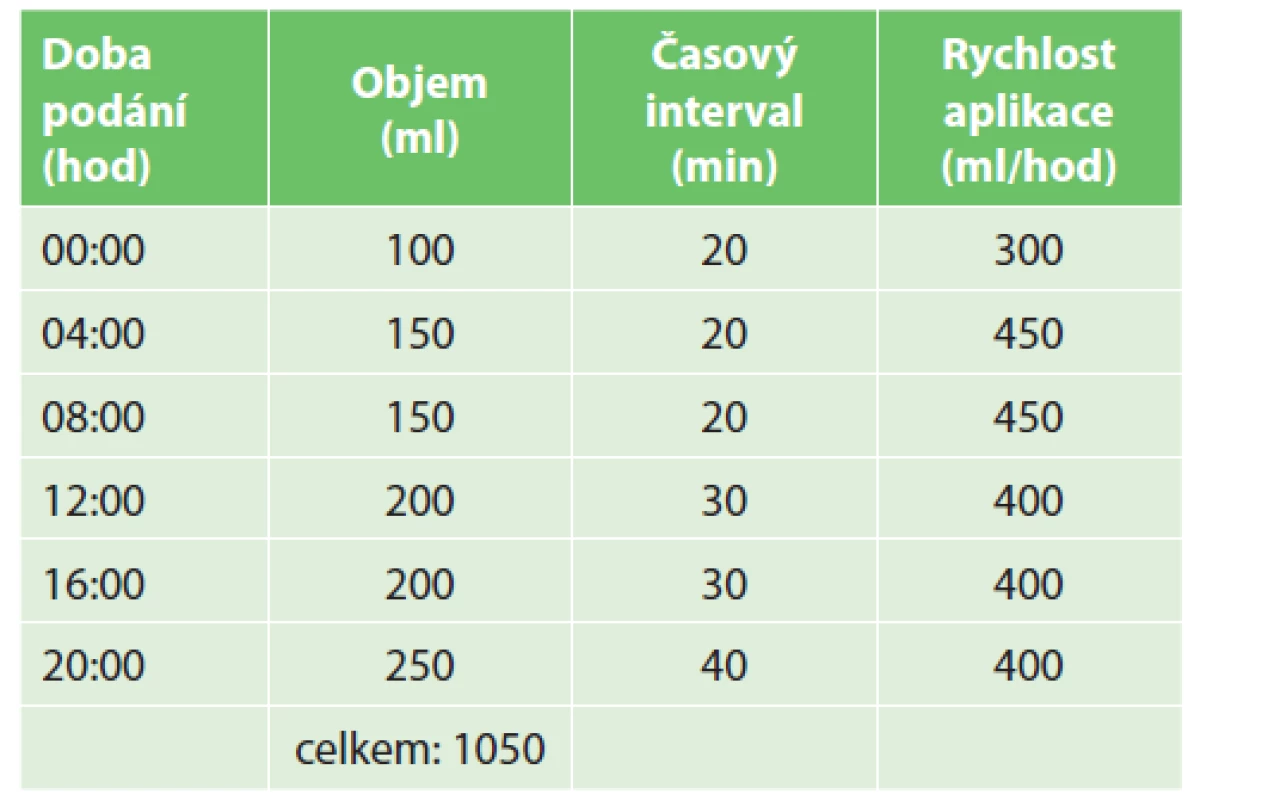
Upraveno podle Marika [28]. Technickým problémem bylo nastavení rychlosti větší než 400 ml/hod. Při aplikaci objemu např. 200 ml během 30 minut je nutné nastavit na pumpě rychlost 400 ml/hod. Námi používané enterální pumpy jsou však v důsledku zabezpečení proti neadekvátní rychlosti aplikace limitovány hodnotou 399 ml/hod. Vyzkoušeli jsme enterální pumpy od 3 výrobců a všechny byly takto výrobcem nastaveny. Není nám znám výrobce enterální pumpy, u které by bylo možné nastavit hodnotu maximální rychlosti na 400–450 ml/hod. Proto jsme podávání enterální výživy intermitentním způsobem realizovali pomocí infuzních pump určených primárně k aplikaci parenterální výživy, které mají omezení rychlosti až na hodnotě 999 ml/hod. K vyloučení případné záměny jsou použité pumpy vždy označeny, ke které aplikaci která pumpa slouží – k aplikaci enterální výživy, k aplikaci tekutin, případně k aplikaci suplementární parenterální výživy (Obr. 3).
Image 3. Praktické označení obou pump k enterální aplikaci
Fig. 3: Practical description of both enteral feeding pumps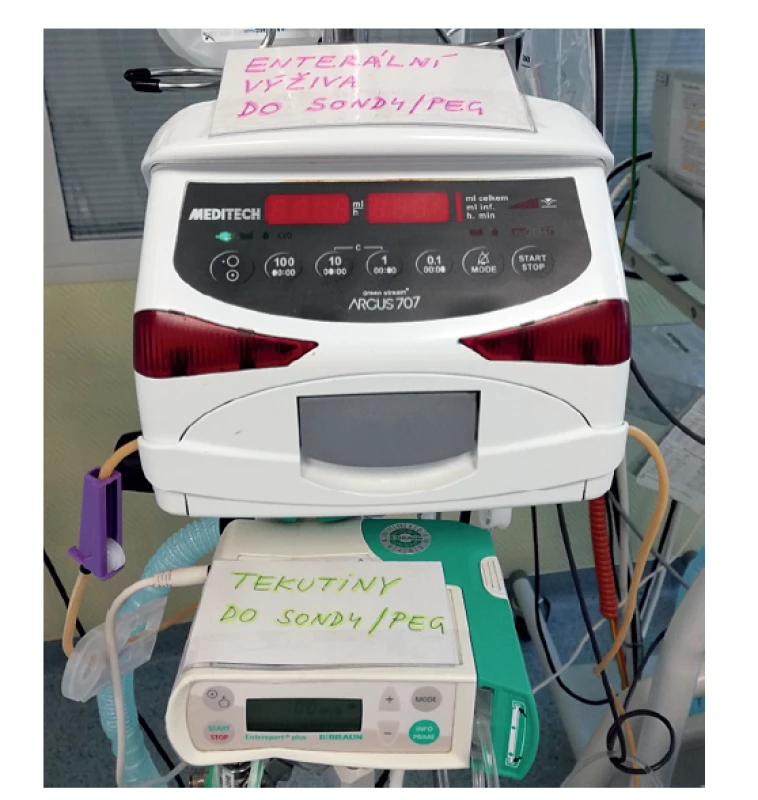
Ve sledovaném souboru byly kromě demografických dat sledovány možné komplikace spojené s intermitentním podáváním enterální výživy (aspirační pneumonie, navýšení gastrického reziduálního objemu − GRV, břišní dyskomfort, osmotický průjem).
Protože se jedná o malý vzorek pacientů, podrobili jsme získaná data jen statistické deskripci.
Výsledky
Ve sledovaném období od 1. 7. 2018 do 30. 6. 2020 jsme intermitentním způsobem podávali výživu 6 pacientům na lůžkách MOJIP. Vždy se jednalo pacienty po kraniotraumatu s výrazným neurologickým postižením, kteří stravu nebyli schopni dostatečně nebo vůbec přijímat ústy a jejichž výživa byla zajišťována převážně enterálním způsobem.
Všech 6 pacientů byli muži, průměrný věk byl 56,5 roku (věkové rozmezí 48–72 let). Průměrná délka hospitalizace na MOJIP byla 28,7 dne (rozmezí 23–41 dnů). Průměrná délka intermitentního podávání výživy byla 8 dnů (6–15 dnů). Čtyři pacienti byli v době intermitentního podávání na umělé plicní ventilaci, jeden pacient byl na vazopresorické podpoře oběhu.
Souhrn dnů, ve kterých byla sledovaným pacientům podávána výživa intermitentním způsobem, činil 63 dnů. Během této doby nebyla zaznamenána žádná aspirační příhoda s následnou pneumonií. Nedošlo ani k navýšení GRV a schéma intermitentního podávání nemuselo být přerušeno. U žádného pacienta nebyl pozorován břišní dyskomfort, ale údaj byl ovlivněn také sníženým stavem vědomí většiny pacientů. U jednoho pacienta se vyskytly vodnaté stolice s četností 3−5× za den po dobu 5 dnů. U tohoto pacienta byla prokázána klostridiová kolitida (toxin A a B a průkaz glutamátdehydrogenázy), a tak lze předpokládat, že osmotický průjem se v souboru nevyskytl.
Diskuze
Aplikace enterální výživy u kriticky nemocných pacientů je většinou realizována formou kontinuálního nebo cyklického podávání a oba typy aplikace jsou považovány za zlatý standard [27]. Nicméně žádný živočišný druh nepřijímá potravu kontinuálně 24 hodin denně a takový evoluční posun se zdá být absurdní. Je zřejmé, že zažívací trakt a metabolické pochody u člověka jsou vývojově určeny k intermitentnímu přijímání stravy několikrát denně. Kontinuální přívod nutrietů se tak jeví jako jasně nefyziologický a pravděpodobně spojený s významnými komplikacemi [28]. Střevo je důležitým endokrinním orgánem s množstvím regulačních peptidů produkovaných speciálními endokrinními buňkami ve sliznici zažívacího traktu. Tyto hormony plní komplexní úlohy v regulaci gastrointestinální motility, při kontrakci žlučníku, v pankreatických funkcích a při vstřebávání nutrientů [29]. Většina těchto hormonů je produkována během několika minut při požití stravy, jejich hladina přechodně stoupá, aby se po ukončení stravy následně vrátila na základní úroveň. Tato entero-hormonální odpověď na příjem živin je kontinuálním podáváním výživy téměř kompletně narušena. Z tohoto pohledu se pak jeví kontinuální podávání enterální výživy jako nelogické a stejně tak se jeví i kontinuální podávání parenterální výživy [28].
Studie Gazzaneové a spolupracovníků na selatech ukázala, že jedinci krmení intermitentně orogastrickou sondou měli zvýšenou syntézu svalových bílkovin ve srovnání se skupinou, kterým potrava byla podávána kontinuálně. Tento významný vzestup proteosyntézy v kosterních svalech je spojen s rychlým a výrazným navýšením cirkulujících aminokyselin a inzulinu. To pak vede k aktivaci nitrobuněčných signálních proteinů, kteréregulují na mTOR dependentní zahájení translace [30].Studie tak poprvé ukázala, že intermitentní podávání výživy má potenciál posílit svalovou hmotu a zlepšit klinické výsledky.
Interpolovat výsledky z animálních studií do humánní medicíny je potřeba s vysokou obezřetností. Navíc u kriticky nemocných pacientů bývá častá anabolická rezistence důsledkem imobility, sepse a probíhajícího zánětu. Podstatnou roli hraje také věk. Zatímco dávka 20 g proteinů vede u mladých trénovaných mužů k maximálně vystupňované myofibrilární syntéze, pak u starších jedinců je nutná dávka 40 g proteinů ke stejnému efektu [31,32].
I když u pacientů kriticky nemocných narůstá kumulativní deficit proteinů a energie, je v současné době preferována méně agresivní dodávka nutrientů. Důvodem je především možná suprese autofagie nadměrným přívodem výživy v kritickém stavu. Právě autofagie jako homeostatický proces reparace nitrobuněčného poškození je mnohými považována za významný aspekt pro zotavení ze sepsí indukovaného poškození orgánů [33,34]. Současná doporučení propagují spíše kontinuální podávání enterální výživy před intermitentním kvůli zvýšenému riziku průjmů právě při intermitentním podávání [1].
Mezi potenciální výhody intermitentního podávání u kriticky nemocných patří zvýšení proteosyntézy svalových bílkovin [35]. Intermitentní podávání výživy u zdravých dobrovolníků vedlo ke zvýšenému uvolňování esenciálních mastných kyselin z tukové tkáně [36]. Pokud by podobný účinek platil i u kriticky nemocných, bylo by to výhodné, neboť zvýšená dostupnost endogenních mastných kyselin je spojena se zlepšeným přežíváním kriticky nemocných [37].
V současné době stále přetrvávají kontroverzní názory na vliv nutrice jako negativního faktoru na autofagický proces. Je diskutabilní, zda omezený přívod výživy (ať už enterální, nebo parenterální) má skutečně tak zásadní supresorický vliv na autofagii. Jistou nevýhodou kontinuálního podávání výživy je narušení cirkadiálního rytmu, který hraje důležitou roli v homeostáze sacharidů a lipidů, v sekreci hormonů, imunitní odpovědi a funkci zažívacího traktu. Skutečnost, že přerušované podávání stravy do žaludku umožňuje obnovení jeho fyziologické acidity, vede k potlačení bakteriální kolonizace žaludku. Studie Bontena však ukázala, že pokles žaludečního pH žaludku při přerušení dodávky výživy nezabrání kolonizaci žaludku u mechanicky ventilovaných pacientů [38].
Nejednoznačně vyznívá i vliv intermitentní výživy na prokrvení horní mezentrickou tepnou. Zatímco u zdravých jedinců vede intermitentní podávání výživy ke zvýšení průtoku mezenteriální oblastí, zůstává nejasné, zda tento efekt u hemodynamicky nestabilních pacientů (steal fenomén) není spíše nežádoucí než přínosný [26]. Obavy, že intermitentní podávání výživy vede ke komplikované kontrole glykemie, se ukázaly jako neopodstatněné [39].
Někteří autoři konstatují, že přes teoretické výhody současná úroveň důkazů nepodporuje časné používání intermitentního podávání výživy u kriticky nemocných. Jedná se o první týden pobytu na lůžku intenzivní péče [40]. Na druhé straně se nepotvrdily obavy, že přerušované podávání výživy povede k rozkolísání glykemického profilu nebo gastrointestinální intoleranci. Stále existuje málo studií, které by potvrzovaly benefit intermitentního podávání ve srovnání se stále standardní kontinuální aplikací [41].
Problematická může být ošetřovatelská a organizační stránka podávání intermitentní výživy. Na rozdíl od kontinuální nebo cyklické aplikace, kdy podávání stejnou nebo jen postupně mírně navyšovanou rychlostí pomocí enterální pumpy není náročné na ošetřovatelskou péči, je intermitentní podávání časově náročnější. Nelékařský zdravotnický personál (NLZP) zde musí postupovat přesně podle ordinací − výrazně mění rychlost i dávku v poměrně krátkém čase a několikrát denně. Podávání výživy nazogastrickou sondou se střídá s aplikací tekutin identickou cestou. Protože je rychlost podávání přes enterální pumpu limitována samotným přístrojem do 400 ml/hod., je nutné intermitentní enterální výživu aplikovat přes pumpu původně určenou pro administraci parenterální výživy. Ta totiž umožňuje požadovanou rychlost aplikace až kolem 450 ml/hod. Je tak vhodné použít k aplikaci výživy do žaludku pumpy dvě: parenterální k aplikaci intermitentní enterální výživy a enterální k aplikaci tekutin v době, kdy samotná výživa je přerušena. Vyžaduje to jasné označení obou pump, aby se předešlo případné záměně. V případě současně probíhající suplementární parenterální výživy je nebezpečí záměny pump a především aplikovaných nutričních přípravků ještě vyšší.
V malém souboru našich pacientů, u kterých jsme podávali enterální výživu intermitentním způsobem, jsme nezaznamenali ani aspiraci, ani aspirační pneumonii. Gastrický reziduální objem nebyl navýšen nad tolerovanou hranici 300 ml/6 hod. U pacientů nebyl zaznamenán ani dyskomfort, ani průjem, který by byl v souvislosti s podáváním výživy. Praxe na našem pracovišti ukázala, že intermitentní podávání je bezpečné a není spojeno s nežádoucími účinky. Je vždy potřeba individualizovat indikaci k tomuto druhu aplikace.
Závěr
I když je kontinuální a cyklické podávání enterální výživy u kriticky nemocných označováno za standard a je široce v praxi užíváno, je považováno za nefyziologický způsob s možnými negativními důsledky pro samotného pacienta. Naproti tomu intermitentní podávání je teoreticky spojeno s respektováním cirkadiálního rytmu a s aktivací autofagie. Především pak přerušované podávání výživy zvyšuje proteosyntézu svalových bílkovin a podporuje uvolňování mastných kyselin. Srovnávací studie nedokázaly zvýšení glukózové variability a gastrointestinální nesnášenlivosti intermitentní aplikací.
Naše observační studie ukázala, že intermitentní aplikace enterální výživy na lůžkách intenzivní péče je realizovatelná bez nežádoucích účinků, je ale časově náročnější pro nelékařské zdravotnické pracovníky.
Je potřeba dalších studií, které potvrdí nebo vyvrátí přínos intermitentního podávání výživy u kriticky nemocných pacientů.
Poděkování
Poděkování patří celému kolektivu nelékařských zdravotnických pracovníků Mezioborové jednotky intenzivní péče, který se na zavádění intermitentního podávání enterální výživy do praktického použití zásadním způsobem podílel.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Igor Satinský, Ph.D.
Nemocnice Havířov
Mezioborová jednotka intenzivní péče
e-mail: igor.satinsky@nsphav.cz
Sources
- Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr. 2019;38(1):48-79. doi: 10.1016/j.clnu.2018.08.037.
- Taylor BE, McClave SA, Martindale RG, et al. Guidelines for the provision and assesment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutriton (A.S.P.E.N.). Crit Care Med. 2016;44(2):390-438. doi: 10.1186/s13054-020-2739-4.
- Phillips BE, Hill DS, Atherton PJ. Regulation of muscle protein synthesis in humans. Curr Opin Clin Nutr Metab Care 2012;15 : 58-64. doi: 10.1097/MCO.0b013e32834d19bc.
- Atherton PJ, Etheridge T, Watt PW, et al. Muscle full effect after oral protein: time-dependent mechanism concordance and discordance between human muscle protein synthesis and mTORC1 signaling. Am J Clin Nutr. 2010;92 : 1080−1088. doi: 10.3945/ajcn.2010.29819.
- Mitchell WK, Phillips BE, Williams JP, et al. A dose - rather than delivery profile-dependent mechanism regulates the „muscle-full“ effect in response to oral essential amino acid intake in young men. J Nutr. 2015;145(2):207−214. doi: 10.3945/jn.114.199604.
- Staples AW, Burd NA, West DW, et al. Carbohydrate does not augment exercise-induced protein accretion versus protein alone. Med Sci Sports Exerc. 2011;43(7):1154−1161. doi: 10.1249/MSS.0b013e31820751cb.
- Bodine SC, Latres E, Baumhueter S, et al. Identification of ubiquitin ligases required for skeletal muscle atrophy. Science 2001;23;294(5547):1704−1708. doi: 10.1126/science.1065874.
- Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness. JAMA 2013;310(15):1591−1600. doi: 10.1001/jama.2013.278481.
- Suryawan A, O´Connor PM, Bush JA, et al. Differential regulation of protein synthesis by amino acids and insulin in peripheral and visceral tissues of neonatal pigs. Amino Acids 2009;37(1):97−104. doi: 10.1007/s00726-008-0149-z.
- Norton LE, Layman DK, Bunpo P, et al. The leucine content of a complete meal directs peak activation but not duration of skeletal muscle protein synthesis and mammalian target of rapamycin signaling in rats. J Nutr. 2009;139(6):1103−1109. doi: 10.3945/jn.108.103853.
- Wilson FA, Suryawan A, Orellana RA, et al. Feeding rapidly stimulates protein synthesis in skeletal muscle of neonatal pigs by enhancing translation initiation. J Nutr. 2009;139(10):1873−1880. doi: 10.3945/jn.109.106781.
- Kumar V, Selby A, Rankin D, et al. Age-related differences in the dose-response relationship of muscle protein synthesis to resistance exercise in young and old men. J Physiol. 2009;15;587(1):211−217. doi: 10.1113/jphysiol.2008.164483.
- Heyland DK, Dhaliwal R, Wang M, et al. The prevalence of iatrogenic underfeeding in the nutritionally ‚at-risk‘ critically ill patient: Results of an international, multicenter, prospective study. Clin Nutr. 2015;34(4):659−666. doi: 10.1016/j.clnu.2014.07.008.
- Ichimaru S. Methods of enteral nutrition administration in critically ill patients: continuous, cyclic, intermittent, and bolus feeding. Nutr Clin Pract. 2018;33(6):790−795. doi: 10.1002/ncp.10105.
- Brantley SL, Mills ME. Overview of enteral nutrition. In: Mueller CM, ed. The A.S.P.E.N. Nutrition support care curriculum. 2nd ed. Silver Spring. American Society of Parenteral and Enteral Nutrition 2012 : 170−184.
- Serpa LF, Kimura M, Faintuch J, et al. Effects of continuous versus bolus infusion of enteral nutrition in critical patients. Rev Hosp Clin Fac Med Sao Paulo 2003;58(1):9−14. doi: 10.1590/s0041-87812003000100003.
- MacLeod JB, Lefton J, Houghton D, et al. Prospective randomized control trial of intermittent versus continuous gastric feeds for critically ill trauma patients. J Trauma 2007;63(1):57−61. doi: 10.1097/01.ta.0000249294.58703.11.
- Lee JS, Auyeung TW. A comparison of two feeding methods in the alleviation of diarrhoea in older tube-fed patients: A randomised controlled trial. Age Ageing 2003;32(4):388−393. doi: 10.1093/ageing/32.4.388.
- Lee JS, Kwok T, Chui PY, et al. Can continuous pump feeding reduce the incidence of pneumonia in nasogastric tube-fed patients? A randomized controlled trial. Clin Nutr. 2010;29(4):453−458. doi: 10.1016/j.clnu.2009.10.003.
- Bankhead R, Boullata J, Brantley S, et al. Enteral nutrition practice recommendations. JPEN 2009;33(2):122−167. doi: 10.1177/0148607108330314.
- Bolster DR, Jefferson LS, Kimball SR. Regulation of protein synthesis associated with skeletal muscle hypertrophy by insulin-, amino acid - and exercise-induced signalling. Proc Nutr Soc. 2004;63(2):351−356. doi: 10.1079/PNS2004355.
- Katsanos CS, Kobayashi H, Sheffield-Moore M, et al. A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly. Am J Physiol Endocrinol Metab. 2006;291(2):E381−7. doi: 10.1152/ajpendo.00488.2005.
- Anthony JC, Yoshizawa F, Anthony TG, et al. Leucine stimulates translation initiation in skeletal muscle of postabsorptive rats via a rapamycin-sensitive pathway. J Nutr. 2000;130(10):2413−2419. doi: 10.1093/jn/130.10.2413.
- Bohé J, Low JF, Wolfe RR, et al. Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol. 2001;15;532(Pt 2):575−579. doi: 10.1111/j.1469-7793.2001.0575f.x.
- Gutierrez-Aguilar R, Woods SC. Nutrition and L and K-enteroendocrine cells. Curr Opin Endocrinol Diabetes Obes. 2011;18(1):35−41. doi: 10.1097/MED.0b013e32834190b5.
- Chowdhury AH, Murray K, Hoad CL, et al. Effects of bolus and continuous nasogastric feeding on gastric emptying, small bowel water content, superior mesenteric artery blood flow, and plasma hormone concentrations in healthy adults: A randomized crossover study. Ann Surg. 2016;263(3):450−457. doi: 10.1097/SLA.0000000000001110.
- McClave SA, Martindale RG, Vanek VW, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) JPEN 2009;33(3):277−316. doi: 10.1177/0148607109335234.
- Marik PE. Feeding critically ill patients the right ‚whey‘: Thinking outside of the box. A personal view. Ann Intensive Care 2015;5(1):51. doi: 10.1186/s13613-015-0051-2.
- Drucker DJ. Enhancing the action of incretin hormones: A new whey forward? 2006;147(7):3171−3172. doi: 10.1210/en.2006-0494.
- Gazzaneo MC, Suryawan A, Orellana RA, et al. Intermittent bolus feeding has a greater stimulatory effect on protein synthesis in skeletal muscle than continuous feeding in neonatal pigs. J Nutr. 2011;141(12):2152−2158. doi: 10.3945/jn.111.147520.
- Witard OC, Jackman SR, Breen L, et al. Myofibrillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise. Am J Clin Nutr. 2014;99(1):86−95. doi: 10.3945/ajcn.112.055517.
- Yang Y, Breen L, Burd NA, et al. Resistance exercise enhances myofibrillar protein synthesis with graded intakes of whey protein in older men. Br J Nutr. 2012;108(10):1780−1788. doi: 10.1017/S0007114511007422.
- Hermans G, Casaer MP, Clerckx B, et al. Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med. 2013;1(8):621−629. doi: 10.1016/S2213-2600(13)70183-8.
- Gunst J. Recovery from critical illness-induced organ failure: the role of autophagy. 2017;21(1):209. doi: 10.1186/s13054-017-1786-y.
- Patel JJ, Rosenthal MD, Heyland DK, et al. Intermittent versus continuous feeding in critically ill adults. Curr Opin Clin Nutr Metab Care 2018;21(2):116−120. doi: 10.1097/MCO.0000000000000447.
- Wene JD, Connor WE, DenBesten L. The development of essential fatty acid deficiency in healthy men fed fat-free diets intravenously and orally. J Clin Invest. 1975;56(1):127−134. doi: 10.1172/JCI108061.
- Goossens C, Vander Perre S, Van den Berghe G, et al. Proliferation and differentiation of adipose tissue in prolonged lean and obese critically ill patients. Intensive Cre Med. 2017;5(1):16. doi: 10.1186/s40635-017-0128-3.
- Bonten MJ, Gaillard CA, van der Hulst R, et al. Intermittent enteral feeding: the influence on respiratory and digestive tract colonization in mechanically ventilated intensive-care-unit patients. Am J Respir Crit Care Med. 1996;154(2 Pt 1):394−399. doi: 10.1164/ajrccm.154.2.8756812.
- Evans DC, Forbes R, Jones C, et al. Continuous versus bolus tube feeds: Does the modality affect glycemic variability, tube feeding volume, caloric intake, or insulin utilization? Int J Crit Illn Inj Sci. 2016;6(1):9−15. doi: 10.4103/2229-5151.177357.
- Dyck LV, Casaer MP. Intermittent or continuous feeding: any difference during the first week? Curr Opin Crit Care 2019;25(4):356−362. doi: 10.1097/MCC.0000000000000617.
- Bear DE, Hart N, Puthucheary Z. Continuous or intermittent feeding: pros and cons. Curr Opin Crit Care 2018;24(4):256−261. doi: 10.1097/MCC.0000000000000513.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 2-
All articles in this issue
-
Perioperative nutrition in the light of guidelines
(and in the shadow of practice) - New options for surgeons to improve malnutrition in the outpatient setting
- Intermittent feeding in intensive care – the theory and practice
- Rectal cancer – current treatment strategy and the tumor regression grade evaluation after neoadjuvant therapy in patients who underwent surgery at the I. Department of Surgery, General University Hospital in Prague between 2012 and 2016
- Nutrition in open abdomen
- Multidisciplinary surgical approach to renal cancer with vena cava invasion and pulmonary embolism
- Výživa v chirurgii: jak dostat koně do Tróje?
-
Perforace divertiklu tlustého střeva králičí kostí –
kazuistika
-
Perioperative nutrition in the light of guidelines
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Perioperative nutrition in the light of guidelines
(and in the shadow of practice) - Intermittent feeding in intensive care – the theory and practice
- Rectal cancer – current treatment strategy and the tumor regression grade evaluation after neoadjuvant therapy in patients who underwent surgery at the I. Department of Surgery, General University Hospital in Prague between 2012 and 2016
- Nutrition in open abdomen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

