-
Medical journals
- Career
Videoasistované a roboticky asistované torakoskopické plicní lobektomie, naše zkušenosti
Authors: J. Kolařík; A. Stolz; J. Vachtenheim; M. Švorcová; J. Pozniak; J. Šimonek; J. Schützner; R. Lischke
Authors‘ workplace: 3. chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha − Národní program transplantace plic
Published in: Rozhl. Chir., 2021, roč. 100, č. 12, s. 576-583.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2021.100.12.576–583Overview
Úvod: Využívání videoasistované (VATS) a roboticky asistované (RATS) torakoskopické chirurgie při anatomických plicních resekcích výrazně narůstá. Cílem této studie je analýza vlastních výsledků miniinvazivních lobektomií a bezpečné zavedení těchto technik do naší praxe.
Metody: Při zahájení těchto nových programů jsme dodrželi doporučené kroky včetně návštěvy zahraničních pracovišť a proktoringu. Retrospektivně jsme analyzovali data souboru z naší 7leté zkušenosti s VATS lobektomiemi a jednoleté s RATS lobektomiemi.
Výsledky: Na našem pracovišti jsme mezi 4/2015 a 4/2021 provedli 128 miniinvazivních lobektomií. Průměrný věk pacientů 64,7±10,5 roku, 61 (47,7 %) žen a 67 (52,3 %) mužů. Hlavní indikací byly plicní malignity 116 (90,6 %) včetně 2 pacientů s lokalizovaným malobuněčným karcinomem plic (SCLC). Ve 12 (9,4 %) případech jsme operovali pro bronchiektázie a benigní léze plic. Karcinom plic byl ve stadiu I u 57 (66,3 %), stadiu II u 22 (25,6 %) a stadiu III u 7 (8,1 %) pacientů. Provedli jsme 110 VATS a 18 RATS lobektomií s jasným trendem přechodu od triportal VATS k uniportal VATS a RATS v posledních letech. Průměrný operační čas byl 166 ± 55,5 minuty, konvertovali jsme v 8 (6,2 %) případech (4 krvácení se ztrátou <300 ml, 3 onkologické, 1 technický důvod). Medián pooperační hospitalizace byl 4 dny.
Závěr: VATS a RATS lobektomie se staly standardním přístupem u časných stadií plicního karcinomu. Zavádění technik miniinvazivní hrudní chirurgie je za dodržení doporučených postupů včetně proktoringu bezpečné a nemá negativní vliv na přežívání pacientů ani onkologickou radikalitu.
Klíčová slova:
videoasistovaná torakoskopická chirurgie (VATS) − roboticky asistovaná torakoskopická chirurgie (RATS) − uniportal VATS − učicí křivka − trénink
ÚVOD
Hrudní chirurgie zaznamenává výrazný nárůst miniinvazivních technik se stále se zvyšujícím počtem prováděných videoasistovaných torakoskopických (VATS) lobektomií, které jsou definovány maximální délkou kožní incize 8 cm, bez použití rozvěrače žeber [1]. Roboticky asistované torakoskopické (RATS) lobektomie jsou prováděny pomocí robotického systému da Vinci, Intuitive Surgical, Sunnyvale, CA, USA.
Uplatnění těchto miniinvazivních technik umožnil značný technický rozvoj. Od prvního Bozziniho endoskopu osvětleného 1806 ještě svíčkou [2] rozvinul techniku Desormeaux, který zavedl v roce 1853 pojem endoskopista. Edisonův vynález žárovky 1879 výrazně posunul endoskopii. Za otce torakoskopie je považován švédský internita Jacobaeus, který roku 1910 provedl první torakoskopii cystoskopem, prováděl kolapsoterapii a torakokaustiku při tuberkulóze. Zavedení antituberkulotik vedlo téměř k zapomnění torakoskopie, která byla prováděna jen na některých pneumologických pracovištích, hlavně v rámci diagnostiky. Rozvoj hrudní chirurgie jako oboru, Carlensova biluminální intubace z roku 1949, vývoj optických vláken, videotechniky, miniaturizace optiky a nástup laparoskopie postupně umožnil v 90. letech 20. století rozvoj torakoskopie již jako VATS, plně v rukou chirurgů. Od menších výkonů pro plicní buly, pneumothorax a empyém až k roku 1992, kdy Roviaro [3] a Landreneau [4] publikovali soubory VATS pacientů včetně VATS lobektomií. Přestože Lewis publikoval roku 1998 soubor 200 VATS lobektomií [5], byla tato technika na okraji zájmu hrudních chirurgů hlavně z obavy o onkologickou radikalitu a management krvácivých komplikací. Až publikace 1100 VATS anatomických resekcí hlavního průkopníka McKenny [6] vedla postupně k popularizaci metody. V roce 2013 byl stanoven konsenzus největších center u příležitosti 20 let provádění metody [1]. Analýza dat European Society of Thoracic Surgeons (ESTS) potvrdila VATS lobektomie jako bezpečnou metodu s menším výskytem komplikací a nižší mortalitou v porovnání s otevřenými lobektomiemi [7]. Longova randomizovaná studie z 5 velkých čínských terciálních center ověřila bezpečnost VATS lobektomií na souboru 425 pacientů s nemalobuněčným karcinomem plic (NSCLC) s kratším operačním časem a menší krevní ztrátou ve skupině VATS oproti axilární torakotomii bez rozdílu v pooperační bolesti a délce hospitalizace [8]. Dánská randomizovaná studie skupiny P. Lichta publikovala menší pooperační bolesti a vyšší kvalitu života ve skupině VATS oproti anterolaterální torakotomii v prvním roce po operaci [9]. Sugi ve své práci potvrzuje stejné onkologické výsledky ve skupině VATS u stadia IA plicního karcinomu včetně 5letého přežívání [10]. Postupně narůstá počet prováděných VATS lobektomií. Ještě v roce 2016 byl publikován francouzský starší národní soubor, kde podíl VATS lobektomií byl 4,9 % [11], ale již roku 2018 evropská data ze 100 center z 31 zemí uvádějí podíl VATS lobektomií 55 % [12].
Vývoj v současnosti směřuje k redukci počtu incizí od původní tzv. multiportální techniky McKenny přes triportal a biportal VATS až k jediné 3–4 cm incizi uniportal VATS Diega Gonzalese Rivase za současného zachování radikality výkonu a rozvoje techniky až k provádění komplexních resekcí včetně angio a bronchoplastik [13]. Od původní práce Melfi z roku 2002 [14] se souběžně stále více prosazují RATS lobektomie. V ČR publikovala v roce 2008 skupina pana profesora I. Čapova soubor 5 dolních plicních lobektomií [15]. Výsledkem Liangovy metaanalýzy byly srovnatelné výsledky VATS i RATS, kde ve skupině RATS bylo menší procento konverzí k torakotomii, ale delší operační čas [16]. O´Sullivanova metaanalýza zaznamenala menší 30denní mortalitu u RATS oproti otevřeným a VATS lobektomiím [17].
Cíl našeho sdělení je analýza vlastních výsledků a popsání procesu bezpečného zavedení operační metody do klinické praxe.
METODY
Podobně jako u velké většiny hrudních chirurgů ve světě i v našem týmu převládaly nejprve obavy o onkologickou radikalitu, a ne zcela jasný profit pacientů z VATS techniky při anatomických plicních resekcích, které jsme byli zvyklí provádět z malé anterolaterální torakotomie s co největší redukcí poranění hrudní stěny. Stále narůstající podíl VATS lobektomií celosvětově s velmi nadějnými výsledky nás přiměl k rozhodnutí o zavedení této metody do naší běžné klinické praxe, ovšem za dodržení kvality výkonu, maximální bezpečnosti a ESTS doporučeného rozsahu lymfadenektomie [18]. Měli jsme možnost osobně sledovat triportal VATS lobektomie v Innsbrucku prováděné týmem profesora T. Schmidta, který po nezbytném rozšíření našeho instrumentária přijel na naše pracoviště v rámci doporučeného proktoringu [1] a asistoval u 5 úvodních VATS lobektomií. V rámci zavádění techniky uniportal jsme se zúčastnili tréninku v Shanghai pulmonary hospital pod vedením D. G. Rivase, tedy v high volume centru plicní chirurgie, které provádí denně 30–40 anatomických plicních resekcí na 12 operačních sálech v naprosté většině technikou uniportal VATS. Objem anatomických plicních resekcí v tomto centru odpovídá desetinásobku objemu resekcí v celé České republice. Pro uniportal VATS lobektomie preferujeme přístup 5. mezižebřím mezi přední a střední axilární čarou, 3−4 cm incizí (Obr. 1). Páté mezižebří preferujeme i pro pravou horní lobektomii pro výhodnější úhel zavedení stapleru při přerušování větve horní plicní žíly pro horní lalok. Používáme fissure last techniku s cílem minimalizace pooperačního air leaku. U levé horní lobektomie při zašlé štěrbině může být úskalím operace zavádění stapleru kolem horního lobárního bronchu. Za bronchem probíhá plicnice a její lingulární větve. Z důvodů bezpečnosti proto preferujeme kombinovaný či fissure first přístup s tzv. tunelizační technikou. Mezi horní a dolní plicní žilou vyhledáme dolní lobární bronchus, na jeho ventrální ploše se po odstranění častého uzlinového bloku dostaneme k větvím plicnice pro dolní lalok. Vypreparujeme jejich ventrální plochu a vytvoříme tunel podél ventrální plochy plicnice centrálněji. Do tunelu vsuneme tenkou branži čelistí stapleru a druhou širší branži přiložíme zevně na plíci, a tak přerušíme mezilalokový parenchymový můstek. Všechny důležité struktury zůstávají bezpečně dorzálně od stapleru. Potom vypreparujeme a přerušíme lingulární tepnu a bezpečně staplerem přerušíme horní lobární bronchus.
Image 1. Pacient po uniportal VATS dolní lobektomii pravé plíce
Fig. 1: Patient who has had uniportal VATS right lower lobectomy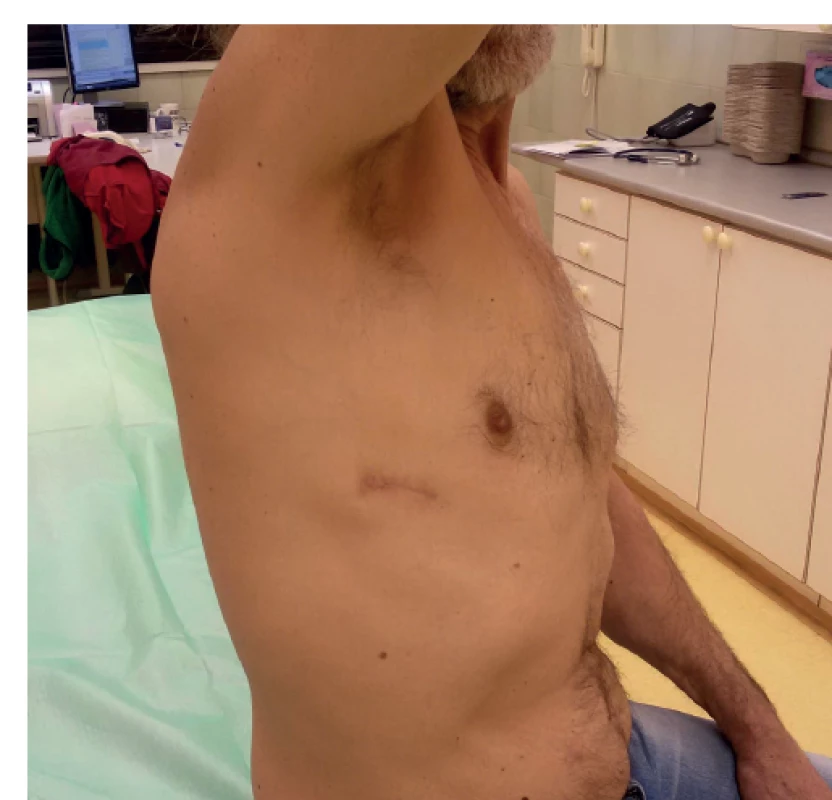
Tak jako celosvětově narůstá počet prováděných RATS lobektomií, narůstá i zájem o tuto metodu na hrudně chirurgických kongresech a jsou publikovány velmi dobré výsledky, rozhodli jsme se rozšířit fungující program robotického centra ve FN Motol o plicní program RATS lobektomií. Souběžně s vyjednáváním úhrady s pojišťovnami jsme absolvovali několikastupňový trénink dle předepsaného postupu společnosti Intuitive, měli jsme možnost vidět dvě RATS operace v Londýně v Guy‘s Hospital u Toma Routledge. V srpnu 2020 jsme na našem pracovišti zahájili program robotických anatomických plicních resekcí, první tři lobektomie s proktoringem S. Stamenkoviche z Londýna, který na další výkon již kvůli omezením při pandemii SARS CoV-2 nemohl přijet. Další lobektomii jsme tedy provedli s proktoringem G. Shahin z holandského Zwolle. Kvůli pandemickým opatřením jsme již další robotické lobektomie provedli bez dalšího proktoringu. RATS lobektomie provádíme pomocí robotického systému da Vinci Xi, Intuitive Surgical, Sunnyvale, CA, USA, +tedy robotu nejnovější generace. Využíváme všechna čtyři robotická ramena a jeden asistentský port. Kvalitní kolaps plíce podporujeme kapnopleurálním přetlakem 6−7 mmHg. Operační taktiku nám usnadnila zkušenost získaná VATS lobektomiemi. Ve shodě se světovými trendy preferujeme fissure last techniku.
Ke statistice jsme použili Kaplan-Meierovy metody analýzy přežívání a aritmetického průměru se směrodatnou odchylkou.
VÝSLEDKY
Na 3. chirurgické klinice 1. LFUK a FN Motol jsme od 4/2015 do 4/2021 provedli 128 miniinvazivních anatomických plicních resekcí, průměrný věk pacientů 64,7±10,5 roku, žen bylo 61 (47,7 %) a mužů 67 (52,3 %). Nejčastěji jsme operovali pro nádory, plicní karcinom 86 (67,2 %), karcinoidy 15 (11,7 %), plicní metastázy 14 (10,9 %), myxoidní sarkom 1 (0,8 %), hamartom středního laloku 1 (0,8 %). S narůstající zkušeností jsme mohli zařadit i miniinvazivní lobektomie pro záněty plic, bronchiektazie 9 (7,0 %), tuberkulom středního laloku 2 (1,6 %) (Graf 1). Typy plicního karcinomu znázorňuje (Tab. 1). Většina pacientů byla ve stadiu I 57 (66,3 %), ve stadiu II 22 (25,6 %) a ve stadiu III 7 (8,1 %) pacientů (Graf 2), jednalo se i o pacienty se single stage N2 disease (Obr. 3). Pravou horní lobektomii jsme dělali ve 30 (23 %), střední 27 (21 %), pravou dolní 20 (16 %), levá horní 35 (27 %) a levá dolní 16 (13 %) případech. Podle typu výkonů bylo 110 (86 %) VATS lobektomií a po zahájení robotického programu v 8/2020 i 18 (14 %) RATS lobektomií (Graf 3). Podle počtu incizí triportal VATS 58 (45 %), biportal VATS 13 (10 %) a uniportal VATS 39 (31 %) s trendem v nárůstu zastoupení uniportal (Graf 4). V roce 2020 jsme provedli miniinvazivně 37 % anatomických plicních resekcí. V letošním roce 2021 jsme zatím procento miniinvazivních výkonů navýšili na 48 %, rovným dílem pouze technikou uniportal a RATS (Graf 5).
Graph 1. Diagnózy operovaných pacientů
Graph 1: Diagnoses of operated patients
Table 1. Diagnózy operovaných pacientů
Tab. 1: Diagnoses of operated patients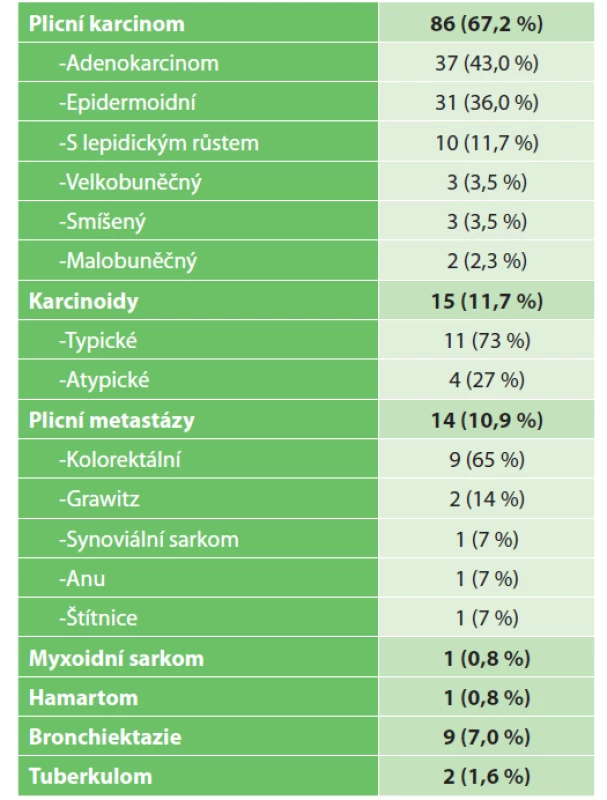
Graph 2. Stadia plicního karcinomu
Graph 2: Lung cancer stages
Graph 3. Počty miniinvazivních výkonů
Graph 3: Number of minimal invasive procedures
Graph 4. Typy miniinvazivních výkonů
Graph 4: Types of minimal invasive procedures
Graph 5. Procento miniinvazivních výkonů
Graph 5: Percentage of minimal invasive procedures
Ve 2 případech jsme řešili extrapleurální resekcí invazi tumoru do hrudní stěny v rozsahu parietální pleury (Obr. 2). Odstranili jsme i tumory velikosti 7 cm, kdy jsme pro usnadnění extrakce preparátu v endobag plánovaně přerušili kaudální žebro, bez signifikantního nárůstu pooperační bolesti. Délka operace průměrně 166±55,5 minuty. Během výkonu jsme v rozsahu doporučeném ESTS odstranili průměrně 11,3±7,0 uzliny s maximem 36 uzlin. Konverzi k torakotomii jsme provedli v 8 (6,2 %) případech, pro krvácení ve 4 (3,1 %), kdy krevní ztráta nepřevýšila 300 ml, bez nutnosti transfuze. Z důvodů zachování onkologické radikality jsme konvertovali u 3 (2,3 %) pacientů, pro vrůst do v. cava superior, centrální šíření tumoru podél plicní tepny a pevný vrůst metastázy N1 uzliny do větve plicnice. V jednom případě jsme konvertovali z technického důvodu pro neoddělitelnou plicnici od bronchu při stavu po neoadjuvantní chemoterapii (Tab. 2). Podle našeho protokolu zavádíme jeden hrudní drén s preferencí tloušťky do 24 F včetně, bez aplikace aktivního sání. Většině pacientů extrahujeme hrudní drén 1. pooperační den, od druhého dne podáváme analgetika p.o. a týden po operaci toleruje většina pacientů spánek na operovaném boku. Z komplikací (Tab. 2) jsme řešili v pooperačním průběhu legionelovou lobární pneumonii reziduálního laloku operované plíce s jeho kompletní destrukcí infekcí a nezbytným odstraněním. Jednoho pacienta jsme reoperovali s provedením VATS ligatury ductus thoracicus pro na konzervativní léčbu nereagující chylotorax z lymfatik po radikální lymfadenektomii. Progredující fluidothorax u pacienta po VATS lobektomii pro bronchiektázie a plicní absces si vyžádal VATS revizi a toiletu pleurální dutiny. Pro fluidothorax jsme provedli 3 (2,3 %) redrenáže. Průměrný pooperační den propuštění byl 5,2±3,7 s mediánem 4. pooperační den. 82 (70,1 %) pacientů jsme propustili do 4. pooperačního dne včetně (Graf 6). Dva pacienti byli starší než 80 let, pro dobrý průběh byla možná jejich dimise 3., resp. 4. pooperační den po lobektomii. Pacienty kontrolujeme v naší plicní ambulanci. Přežívání zachycuje Graf 7, 30denní činilo 100 %, nekompletní roční 95 % a 5leté 79 %.
Image 2. Uniportal VATS, resekovaný horní lalok levé plíce se 7cm tumorem s en block resekcí terče parietální pleury
Fig. 2: Uniportal VATS, resected upper lobe of the left lung with a 7cm tumor with en bloc resection of parietal pleura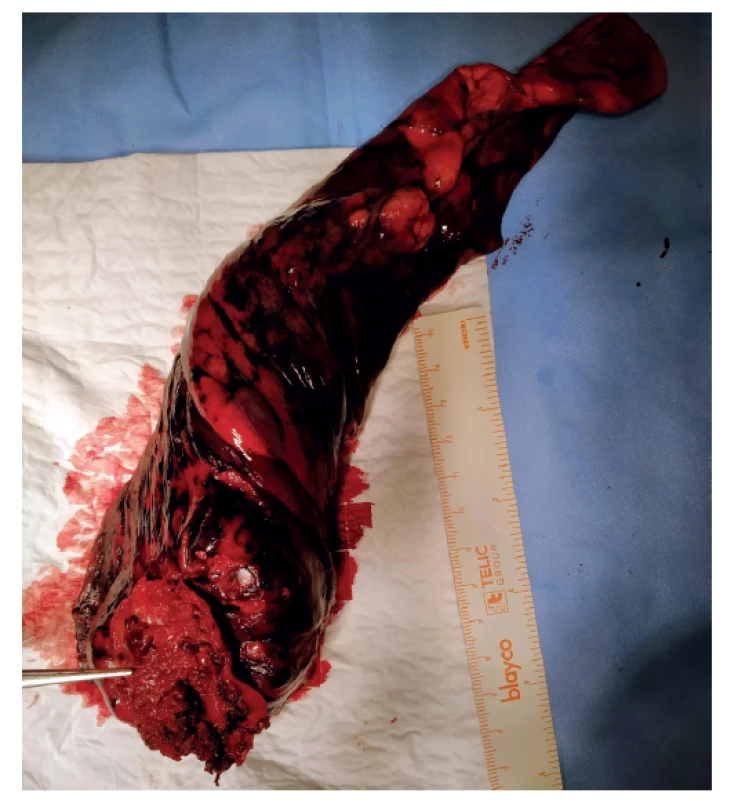
Table 2. Komplikace
Tab. 2: Complications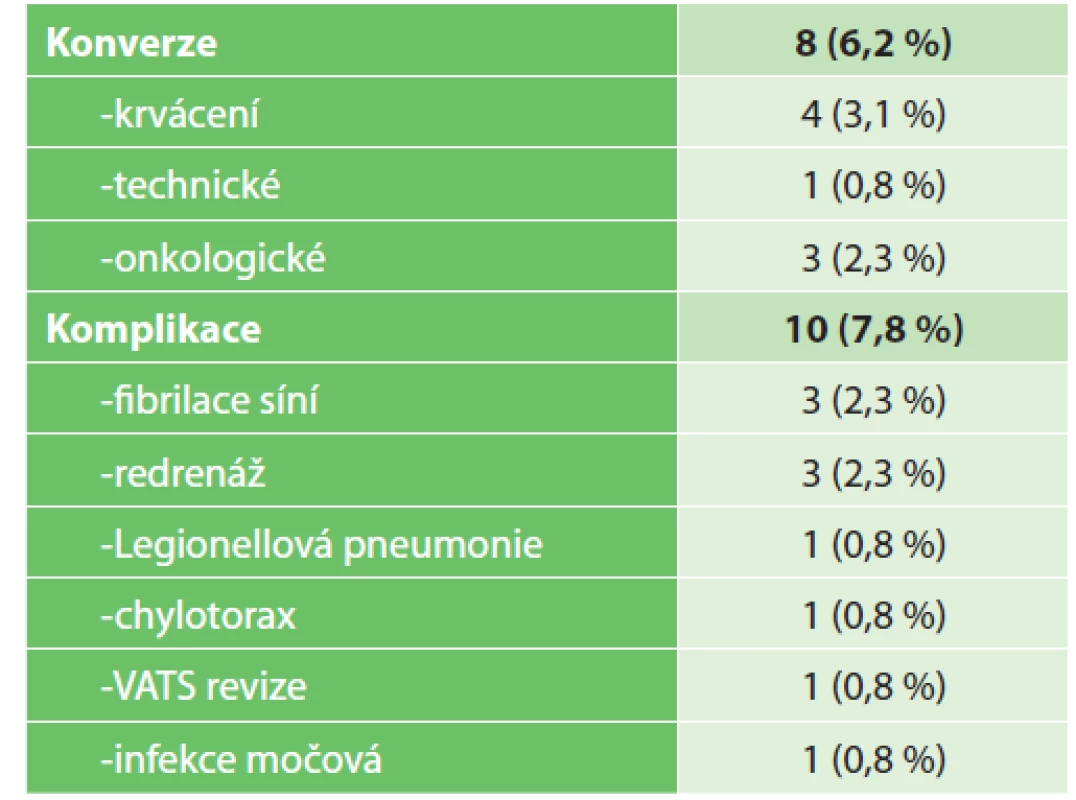
Image 3. Uniportal VATS horní lobektomie pravé plíce, mediastinální lymfadenektomie sk. 2R, 4R en block. Prostor mezi venou azygos (AV), tracheou (T), horní dutou žilou (SVC) a aortou. Plicní tepna (AP)
Fig. 3: Uniportal VATS right upper lobectomy, mediastinal lymphadenectomy 2R+4R en bloc. Space defined by the azygos vein (AV), trachea (T), superior vena cava (SVC) and aorta. Pulmonary artery (AP)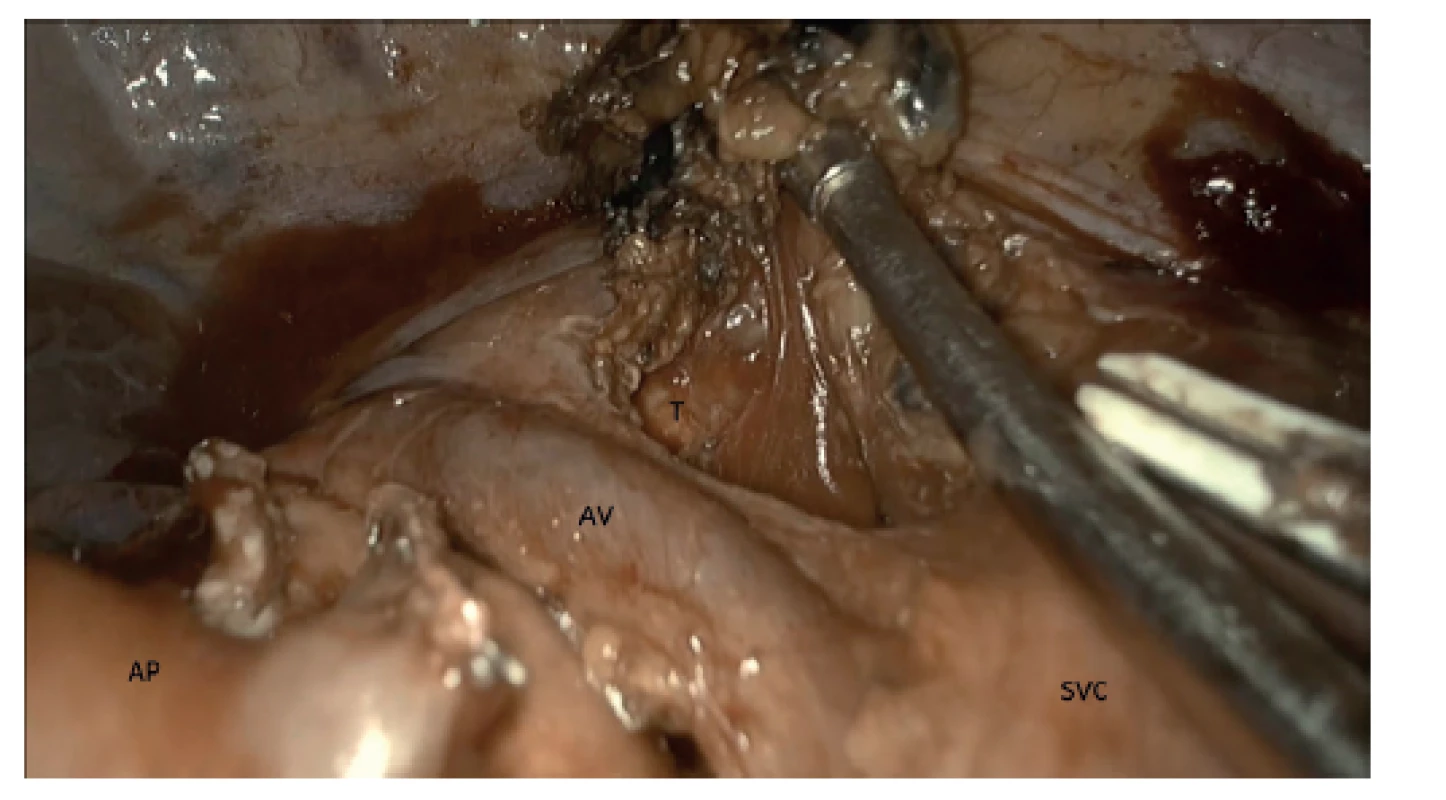
Graph 6. Pooperační hospitalizace
Graph 6: Postoperative length of stay
Graph 7. Pooperační přežívání
Graph 7: Postoperative survival
DISKUZE
Minimalizace traumatizace a morbidity zavedením miniinvazivních výkonů i v rámci programu Enhanced recovery after surgery (ERAS), jehož principy také zavádíme, umožnily rozšíření indikačních kritérií. Dobrá tolerance pooperačního průběhu a krátká hospitalizace pomohly přesvědčit řadu pneumologů ke společné indikaci hraničních pacientů. Nejvíce z miniinvazivního přístupu profitují právě pacienti s hraniční únosností. Máme velmi dobrou zkušenost s VATS lobektomiemi u pacientů nad 80 let věku a pacienty s hraniční spirometrií. Podobně bude do budoucna možné rozšířit indikační kritéria chirurgické léčby plicního karcinomu a agresivněji přistupovat k indikacím u pacientů po downstagingu. Původní obavy z pooperační morbidity a následně kratšího přežívání operovaných pacientů s limitovaným N2 postižením ve stadiu IIIa by minimalizace operační morbidity mohla rozptýlit a nabídnout těmto pacientům kurativní intenci, jejíž součástí by byla operace v rámci multimodální léčby. Naše iniciální zkušenosti tomu nasvědčují, ale pro jasné doporučení bude třeba analýza větších souborů. Miniinvazivními výkony lze dle našich zkušeností provádět radikální systematickou lymfadenektomii i v případě metastatického postižení uzlin. Stejně tak se nám podařilo indikovat a úspěšně odoperovat 2 pacienty s malobuněčným karcinomem plic (SCLC) bez uzlinového postižení, oba byli propuštěni 3. pooperační den bez komplikací a jsou doposud krátce, ale zatím bez známek rekurence onemocnění. Indikace těchto pacientů byla kontroverzní, ale současné publikace vybízejí k odvážnější indikaci operační léčby lokalizovaného SCLC za dodržení multimodálního přístupu léčby [19,20]. Bude jistě nutný delší časový úsek sledování pacientů ke zhodnocení vlivu rozvolnění indikačních kritérií na přežívání pacientů. Stejně tak bude třeba většího souboru a delšího sledování, abychom mohli porovnat výsledky pacientů operovaných cestou VATS, uniportal VATS a RATS. S narůstající zkušeností také klesá potřeba konverze, např. selhání stapleru při uniportal VATS dolní lobektomii vpravo jsme vyřešili založením 3 pomocných stehů za stěnu přerušeného, ale neprošitého bronchu. Za pomocné stehy jsme otevřený bronchiální pahýl vtáhli do nového stapleru, který o něco centrálněji pahýl uzavřel a pacient se zhojil bez komplikací.
ZÁVĚR
VATS a RATS lobektomie se stávají standardem léčby časných stadií karcinomu plic. Tyto metody byly ověřeny jako bezpečné a onkologicky radikální. Dodržením doporučených postupů zavádění těchto technik je implementace miniinvazivní hrudní chirurgie bezpečná. Narůstající zkušeností se posouvají technické limity a indikační kritéria. Minimalizace morbidity umožňuje operace pacientů s hraniční únosností a navýšení operability plicního karcinomu.
Seznam zkratek:
VATS − videoasistovaná torakoskopická chirurgie
RATS − roboticky asistovaná torakoskopická chirurgie
ESTS − Evropská společnost hrudních chirurgů
NSCLC − nemalobuněčný karcinom plic
SCLC − malobuněčný karcinom plic
ERAS − enhanced recovery after surgery, vylepšené zotavení po operaci
AP − plicní tepna
SVC − horní dutá žíla
T − trachea
AV − vena azygos
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Jan Kolařík
3. chirurgická klinika 1. LFUK a FNM
Národní program transplantace plic
e-mail: jan.kolarik@fnmotol.cz
Sources
1. Yan TD, Cao C, D‘Amico TA, et al. International VATS Lobectomy Consensus Group. Video-assisted thoracoscopic surgery lobectomy at 20 years: a consensus statement. Eur J Cardiothorac Surg. 2014 Apr;45(4):633−639. doi:10.1093/ ejcts/ezt463. Epub 2013 Oct 14. PMID: 24130372.
2. Philipp Bozzini Lichtleiter, eine Erfindung zur Anschauung innerer Theile und Krankheiten“, in Journal der praktischen Heilkunde, Berlin 1806.
3. Roviaro G, Rebuffat C, Varoli F, et al. Videoendoscopic pulmonary lobectomy for cancer. Surg Laparosc Endosc. 1992 Sep;2(3):244−247. PMID: 1341539.
4. Landreneau RJ, Mack MJ, Hazelrigg SR, et al. Video-assisted thoracic surgery: basic technical concepts and intercostal approach strategies. Ann Thorac Surg. 1992 Oct;54(4):800−807. doi:10.1016/0003 - 4975(92)91040-g. PMID: 1417251.
5. Lewis RJ, Caccavale RJ. Video-assisted thoracic surgical non-rib spreading simultaneously stapled lobectomy (VATS(n) SSL). Semin Thorac Cardiovasc Surg. 1998 Oct;10(4):332−339. doi:10.1016/s1043 - 0679(98)70036-x. PMID: 9801256.
6. McKenna RJ Jr, Houck WV. New approaches to the minimally invasive treatment of lung cancer. Curr Opin Pulm Med. 2005 Jul;11(4):282−286. doi:10.1097/01. mcp.0000166589.08880.44. PMID: 15928492.
7. Falcoz PE, Puyraveau M, Thomas PA, et al. ESTS Database Committee and ESTS Minimally Invasive Interest Group. Video-assisted thoracoscopic surgery versus open lobectomy for primary non-small-cell lung cancer: a propensity-matched analysis of outcome from the European Society of Thoracic Surgeons database. Eur J Cardiothorac Surg. 2016 Feb;49(2):602−609. doi:10.1093/ejcts/ezv154. Epub 2015 Apr 26. PMID: 25913824.
8. Long H, Tan Q, Luo Q, et al. Thoracoscopic surgery versus thoracotomy for lung cancer: Short-term outcomes of a randomized trial. Ann Thorac Surg. 2018 Feb;105(2):386−392. doi:10.1016/j.athoracsur. 2017.08.045. Epub 2017 Dec 2. PMID: 29198623.
9. Bendixen M, Jørgensen OD, Kronborg C, et al. Postoperative pain and quality of life after lobectomy via video-assisted thoracoscopic surgery or anterolateral thoracotomy for early stage lung cancer: a randomised controlled trial. Lancet Oncol. 2016 Jun;17(6):836−844. doi:10.1016/ S1470-2045(16)00173-X. Epub 2016 May 6. PMID: 27160473.
10. Sugi K, Kaneda Y, Esato K. Video-assisted thoracoscopic lobectomy achieves a satisfactory long-term prognosis in patients with clinical stage IA lung cancer. World J Surg. 2000 Jan;24(1):27−30; discussion 30−1. doi:10.1007/s002689910006. PMID: 10594199.
11. Pagès PB, Delpy JP, Orsini B, et al. Epithor project French Society of Thoracic and Cardiovascular Surgery. Propensity score analysis comparing videothoracoscopic lobectomy with thoracotomy: A French nationwide study. Ann Thorac Surg. 2016 Apr;101(4):1370−1378. doi:10.1016/j. athoracsur.2015.10.105. Epub 2016 Feb 10. PMID: 26872732.
12. Cao C, Frick AE, Ilonen I, et al. European questionnaire on the clinical use of video-assisted thoracoscopic surgery. Interact Cardiovasc Thorac Surg. 2018 Sep 1;27(3):379−383. doi:10.1093/icvts/ ivy062. PMID: 30165553.
13. Gonzalez-Rivas D, Yang Y, Stupnik T, et al. Uniportal video-assisted thoracoscopic bronchovascular, tracheal and carinal sleeve resections. Eur J Cardiothorac Surg. 2016 Jan;49 Suppl 1:i6−16. doi:10.1093/ejcts/ezv410. Epub 2015 Nov 25. PMID: 26609055.
14. Melfi FM, Menconi GF, Mariani AM, Angeletti CA. Early experience with robotic technology for thoracoscopic surgery. Eur J Cardiothorac Surg. 2002 May;21(5):864−868. doi:10.1016/s1010 - 7940(02)00102-1. PMID: 12062276.
15. Doležel J, Jedlička V, Čapov I. Robotická plicní lobektomie – naše první zkušenosti. Rozhl Chir. 2008;87 : 121−123. PMID: 18459437.
16. Liang H, Liang W, Zhao L, et al. Robotic versus video-assisted lobectomy/segmentectomy for lung cancer: A meta-analysis. Ann Surg. 2018 Aug;268(2):254−259. doi: 10.1097/SLA.0000000000002346. PMID: 28628562.
17. O‘Sullivan KE, Kreaden US, Hebert AE, et al. A systematic review and meta-analysis of robotic versus open and video-assisted thoracoscopic surgery approaches for lobectomy. Interact Cardiovasc Thorac Surg. 2019 Apr 1;28(4):526−534. doi: 10.1093/icvts/ivy315. PMID: 30496420.
18. Lardinois D, De Leyn P, Van Schil P, et al. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur J Cardiothorac Surg. 2006 Nov;30(5):787−792. doi:10.1016/j. ejcts.2006.08.008. Epub 2006 Sep 12. PMID: 16971134.
19. Rucker AJ, Raman V, Jawitz OK, et al. Effect of lymph node assessment on outcomes in surgery for limited stage small cell lung cancer. Ann Thorac Surg. 2020 Dec;110(6):1854−1860. doi: 10.1016/j.athoracsur.2020.04.117. Epub 2020 Jun 13. PMID: 32544452; PMCID: PMC7958968.
20. Xu L, Zhang G, Song S, et al. Surgery for small cell lung cancer: A surveillance, epidemiology, and end results (SEER) survey from 2010 to 2015. Medicine (Baltimore) 2019 Oct;98(40): e17214. doi:10.1097/MD.0000000000017214. PMID: 31577711.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 12-
All articles in this issue
- Střípky současnosti
- Retroperitoneal hematoma: diagnosis and treatment
- Video-assisted and robotic-assisted thoracoscopic pulmonary lobectomies, our experience
- Laparoscopic versus open elective right hemicolectomy with curative intent for colon adenocarcinoma
- Transhepatic perforation of the gallbladder with massive intraperitoneal hemorrhage as a rare complication of acute cholecystitis
- Spontaneous retroperitoneal bleeding in COVID-19 patients – two case reports
- Tumor mimicking gastric ulcer penetrating asymptomatically into the pancreas
- Blank spaces in the management of venous thromboembolism prophylaxis at surgical departments and the impact of a clinical pharmacist
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Retroperitoneal hematoma: diagnosis and treatment
- Laparoscopic versus open elective right hemicolectomy with curative intent for colon adenocarcinoma
- Video-assisted and robotic-assisted thoracoscopic pulmonary lobectomies, our experience
- Tumor mimicking gastric ulcer penetrating asymptomatically into the pancreas
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

