-
Medical journals
- Career
Gigantické nitrobřišní tumory – zkušenosti jednoho centra
Authors: J. Moláček 1; V. Opatrný 1; J. Baxa 2; V. Třeška 1
Authors‘ workplace: Chirurgická klinika Fakultní nemocnice Plzeň a Lékařská fakulta, Univerzita Karlova, Plzeň 1; Klinika zobrazovacích metod Fakultní nemocnice Plzeň a Lékařská fakulta, Univerzita Karlova, Plzeň 2
Published in: Rozhl. Chir., 2021, roč. 100, č. 1, s. 10-16.
Category: Review
doi: https://doi.org/10.33699/PIS.2021.100.1.10–16Overview
Komplexní sdělení o možnostech chirurgické léčby neobvykle velkých nádorů dutiny břišní a retroperitonea nezávisle na jejich původu a histologickém nálezu. Léčba těchto novotvarů vyžaduje komplexní multioborový přístup, bez kterého nelze zodpovědně a racionálně rozhodnout nejen o indikaci k výkonu, ale i o jeho rozsahu. Autoři popisují 5 dokumentovaných kazuistik, kde upozorňují na specifika, úskalí diagnostiky a operativy těchto vzácných případů.
Klíčová slova:
gigantický nitrobřišní tumor – tumor retroperitonea
Úvod
Název článku gigantické nitrobřišní tumory předestírá, že souhrnné sdělení se bude zabývat zcela heterogenní skupinou nádorů, jejichž jediným společným jmenovatelem je enormní velikost a lokalizace v dutině břišní, ať již přímo v peritoneální dutině, nebo v retroperitoneu. Termín „gigantický“ je velmi vágní a pro každého může znamenat něco jiného, cílem je vyjádřit skutečně extrémní velikost těchto novotvarů.
Předmětem této publikace není prezentace co největších, resp. nejtěžších tumorů. Odstraněný velký tumor nikdy nesmí být trofej a je všeobecně známo, že největší nádor neznamená největší a nejobtížnější chirurgický výkon. Mnohdy je tomu přesně naopak − náročnost výkonu často není úměrná velikosti nádoru. Typickým příkladem je malý tumor hlavy pankreatu infiltrující confluens portální žíly v kontrastu se sice gigantickým, ale dobře ohraničeným liposarkomem retroperitonea. Cílem této práce je tedy pouze a jen upozornění na určitá specifika operativy extrémně rozsáhlých nádorů v dutině břišní, ať již jsou jakékoliv biologické povahy či jakéhokoli origa. V odborné literatuře nenalezneme rozsáhlé sestavy těchto výkonů, téměř vždy se jedná pouze o kazuistická sdělení, resp. review dostupných dat [1–7]. Jedním z důvodů je právě zmiňovaná heterogenita těchto neoplazmat, která patří často do působnosti odlišných specializací. Dalším důvodem je relativní vzácnost těchto výkonů, hovoříme-li skutečně o gigantických tumorech. Problémem je skutečnost, že tyto excesivní výkony často přesahují možnosti daného specialisty (všeobecného chirurga, gynekologa, urologa) a je nutné je řešit v týmu a na pracovišti, které je schopno zajistit komplexní management od precizní diagnostiky přes chirurgický výkon a v neposlední řadě vysoce specializovanou anesteziologickou a intenzivní pooperační péči. Autoři se snaží upozornit na diagnostická, indikační a rovněž technická úskalí, která jsou typická pro operační řešení gigantických nitrobřišních tumorů a ilustrují je na několika konkrétních případech. Je zřejmé, že v této publikaci nelze popsat veškeré potenciální příklady chirurgických výkonů prováděných u takto nesourodé skupiny pacientů.
Patogeneze
Nádory v dutině břišní, které mohou dosahovat extrémních rozměrů, mají svůj původ jak v peritoneální dutině, tak v tkáních a orgánech retroperitonea. U takto objemných expanzí nelze někdy primárně odlišit, kde je původní origo tumoru, ten často vyplňuje celý retroperitoneální prostor a prorůstá do peritoneální dutiny.
Z vlastní peritoneální dutiny dosahují enormních rozměrů nejčastěji nádory ovaria, jater, sleziny, lymfatických uzlin a tumory mezenteria. Častěji vede ke gigantickým expanzím jejich původ v retroperitoneu, jedná se o měkkotkáňové nádory vycházející z pojivové tkáně retroperitonea, z tukového pouzdra ledviny, ale často i z vlastního parenchymu ledviny či nadledviny, z lymfatické tkáně, vzácněji z prostaty [8−14]. Co se týče biologické aktivity, může se jednat jak o maligní, tak i o benigní expanze, resp. nízce maligní. Typicky u mezenchymálních tumorů pozorujeme různý stupeň diferenciace, který bezpochyby ovlivňuje prognózu onemocnění. Z logiky věci vyplývá, že vysoce maligní tumory málokdy dosáhnou extrémních rozměrů. V naprosté většině případů se jedná o primární tumory vzniklé v dané lokalitě, jen vzácně se setkáváme s metastázou, která dosáhne takovýchto rozměrů. Histologicky jsou to nejčastěji lipomy, liposarkomy, leyomyosarkomy, rabdomyosarkomy, desmoidní tumory, nádory z extragonadálních zárodečných buněk, maligní fibrozní hystiocytomy, adenomy, cystadenomy, adenokarcinomy, lymfomy a gastrointestinální stromální tumory.
Symptomatologie
Symptomy objemných expanzí mohou být překvapivě nezřídka minimální, velmi častý je údaj nemocného, že se domníval, že „pouze tloustne“. Bolest nebývá častým příznakem, alespoň do doby, než začne tumor utlačovat okolní struktury. V té chvíli se pak objevují typické symptomy, jako jsou zvracení při kompresi duodena, obecně ileózní stavy při kompresi trávicí trubice, bolesti a městnání ledvin při útlaku močovodů, dechové obtíže při elevaci bránice a často i hluboká žilní trombóza dolních končetin při útlaku dolní duté žíly či pánevních žil. S výše uvedeným souvisí často i paradoxní ztráta na váze při zvětšování břicha. Další vzácnější symptomy mohou vyplývat z potenciální hormonální aktivity některých tumorů [15].
Diagnostika a indikace k výkonu
Po fyzikálním vyšetření probíhá prvotní diagnostika často na primárním pracovišti, kde je nemocný vyšetřován (sonografie, výpočetní tomografie). Dále by měla být diagnostika dokončena ideálně v centru, kde bude probíhat léčba. Zde je doplněno nejčastěji CT angiografické vyšetření (CTA) k posouzení potenciální infiltrace tumoru do velkých cév a jiných klíčových struktur, resp. magnetická rezonance, která je vhodná na zobrazení měkkotkáňových tumorů. V našem centru vždy individuálně zvažujeme i provedení hybridních metod, jako je pozitronová emisní tomografie v kombinaci s výpočetní tomografií (PET/CT) či magnetickou rezonancí (PET/MR). Hlavním významem těchto vyšetření je získání kompletní informace včetně celotělového stagingu onemocnění. Digitální subtrakční angiografie (DSA) s možnou předoperační okluzí dárcovských cév tumoru je využívána spíše výjimečně. Ani takto komplexní diagnostika pomocí nejmodernějších zobrazovacích metod nemusí ve všech případech jasně stanovit původ tumoru, a ten je poté odhalen až pooperačně histopatologickou analýzou [16]. V případě objemných tumorů je velmi obtížné určit orgán či oblast, ze které původně vyrůstá. Ještě problematičtější bývá případné vyjádření k resekabilitě, tedy možnému radikálnímu odstranění. Na druhou stranu zobrazovací metody umožní předem určit kritické struktury, jejichž infiltrace může být zásadní při pokusu o odstranění. Nejčastěji jde o dolní dutou žílu, aortu, duodenum, pankreas nebo radix mezenteria. Přes zpřesnění zobrazovacích metod naše zkušenosti nadále potvrzují, že striktní kontraindikace výkonu pouze na jejich podkladě není správná.
Důležitým faktorem při rozhodování je výsledek histologického hodnocení. Předoperační znalost histologie tumoru je podle většiny autorů velmi vhodná, ne-li nutná [17]. Napomůže jak v terapeutické rozvaze a v indikaci k výkonu jako takovému, tak zejména k jeho rozsahu. Někdy však správné stanovení histologie není tak jednoduché, jak by se na první pohled zdálo. Roli hraje objemná masa tumoru a zejména jeho možná nehomogenita (viz níže).
Finální rozhodnutí o případném zákroku by mělo být učiněno v rámci tzv. multioborového týmu (chirurg, onkolog, radiolog, anesteziolog, internista), který musí pečlivě zvážit veškerá rizika excesivního výkonu a na druhé straně jeho potenciální přínos. Argument, že takto objemný tumor je radikálně neodstranitelný, může být často lichý. Onkolog při znalosti histologického nálezu dokáže posoudit, je-li i potenciální neradikální (R1, R2) resekce přínosem pro pacienta, je-li tedy onemocnění třeba jen i po cytoredukční operaci nadále ovlivnitelné. Z klinického pohledu je odstranění objemné masy tumoru (proběhne-li nekomplikovaně) téměř vždy přínosné pro pacienta. Nádor jej zatěžuje již pouhou svou přítomností a útlakem okolních struktur (viz symptomatologie), a proto i pouhý „debulking“ může být někdy zcela na místě. Dalšími faktory, které bezpochyby ovlivňují vlastní indikaci k resekčnímu řešení, jsou věk nemocného, jeho celkový stav, životní expektace apod. Jistě není cílem vystavit nemocného neúměrnému riziku při špatné prognóze u rozsáhlých invazivně se šířících maligních tumorů a snížit tak kvalitu zbytku života pacienta, na druhou stranu je-li konsenzus v klinickém týmu, že se jedná o ovlivnitelné onemocnění (chirurgický výkon v kombinaci s adjuvantní onkologickou léčbou) nebo je-li život pacienta výrazně omezen i při benigním nálezu, je na místě navrhnout nemocnému možnost chirurgického řešení, byť se signifikantními riziky a potenciálně vyšší morbiditou.
Chirurgický výkon
Vlastní chirurgický výkon je v naprosté většině případů prováděn ze střední laparotomie, pouze ojediněle u tumorů striktně lokalizovaných v retroperitoneu lze zvolit extraperitoneální přístup s odtlačením peritoneální dutiny mediálně. Chirurg by měl vždy pomýšlet na to, jaký rozsah výkonu je ještě přínosem pro pacienta (viz indikační rozvaha). Jistě nelze příliš ospravedlnit provedení nefrektomie spolu s odstraněním tumoru vycházejícího z tukového pouzdra ledviny, ukáže-li se po výkonu, že novotvar je benigní. Jiná situace je u objemných sarkomů nebo jiných např. hormonálně aktivních tumorů, které nejsou v naprosté většině chemo ani radiosenzitivní a chirurgický výkon je prakticky jediný způsob, který může nemocnému přinést benefit. Pak lze uvažovat i o multiviscerálních blokových resekcích včetně resekcí a náhrady velkých cév, jako jsou aorta nebo dolní dutá žíla [18−20]. Dalším důvodem parciální resekce dolní duté žíly (DDŽ) může být intrakavální trombus, nejčastěji způsobený tumorem ledviny, event. nadledviny, ale mohou jej útlakem zapříčinit i jiné objemné tumory. Problematika rozsáhlých karcinomů ledvin s intrakaválním trombem je často diskutována a jistě by si zasloužila vlastní separátní pohled, to však není předmětem této publikace a v literatuře je řada recentních dat [21]. V našem výčtu však nelze vynechat ani tyto tumory. Velmi záleží, zdali je trombus tuhé konzistence („sausage“), jedná se o častější případ a lze snadno odstranit, nebo drolivé konzistence infiltrující stěnu DDŽ („porridge“), a pak je nutno část stěny nebo celou DDŽ resekovat. Podle rozsahu resekce zvážíme přímou suturu, event. náhradu protézou (Obr. 1). Tuto eventualitu uvádíme, abychom zdůraznili, že ani infiltrace stěny DDŽ nemusí být kontraindikací výkonu.
Image 1. Parciální resekce DDŽ pro infiltraci nádorovým trombem, náhrada ePTFE protézou
Fig. 1: Partial VCI resection due to malignant thrombus infiltration, ePTFE graft replacement
Specifikem operativy těchto objemných tumorů je fakt, že není v průběhu operace dlouho zřejmé, bude-li nález kompletně resekabilní. Vzhledem k velikosti nádoru nelze dlouho posoudit, jaký vztah má jeho spodina ke slinivce, velkým cévám, duodenu apod. Fatální chybou by bylo poranění velkých cév (zejména DDŽ, pánevních žil, aorty) ve chvíli, kdy nejsou ještě bezpečně vypreparované a zajištěné. Je zajímavé, že objemné nádory při svém růstu mají schopnost výrazně dislokovat aortu a DDŽ, málokdy kompletně infiltrují celou stěnu, často však jejich prorůstání do tunica adventicia způsobí nemožnost bezpečného odpreparování cévy a snazší je poté její resekce a náhrada. Resekční výkony na duodenu či pankreatu jsou v této oblasti vzácné, lze o nich uvažovat u prokázaných malignit, které budou nadále ovlivnitelné adjuvantní onkologickou léčbou, u benigních lézí volíme méně radikální řešení. Resekční výkony na tenkém střevě a tračníku jsou vynucené nejčastěji infiltrací samotného střeva nebo mezenteria, resp. mezokolon tumorem, nečiní většinou větší problémy v rámci výkonu a nebývají překážkou radikálnímu odstranění nálezu. Výjimkou bývá infiltrace radixu mezenteria, která by si vynutila resekci velkého rozsahu tenkého střeva a způsobila tak následky s tím související. V retroperitoneu může být častým problémem infiltrace ledviny, resp. močovodu tumorem. V takových případech musíme postupovat individuálně dle charakteru a biologické aktivity nádoru (viz předoperační rozvaha). Velmi nápomocné pro diferenciaci a uvolnění ureteru od tumoru je předoperační cystoskopické zavedení stentu. V řadě případů se dá močovod bezpečně „svléknout“ z nádoru, musíme však dbát na to, abychom jej nezbavili výživy. Infiltrace nádorů do kostní tkáně (obratel, lopata kosti kyčelní, kost křížová) je typická pro agresivní sarkomy (např. rabdomyosarkomy), radikální odstranění je prakticky nemožné a po exstirpaci nádor často velmi rychle recidivuje.
Histologické zpracování
U obrovských nádorových lézí se musí více než kdy jindy dbát na kompletní histologickou analýzu, je běžné, že se jedná o nehomogenní tkáň, kdy po obvodu tumoru může být nádor benigního charakteru, ale v centru již jsou jasné známky maligního zvratu. Typicky takovýto obraz vídáme např. u liposarkomů, kde v centru objemné léze je jiný stupeň dediferenciace než po obvodu.
Adjuvantní terapie
Onkolog na základě znalostí rozsahu operačního výkonu, peroperačního nálezu, histologie tumoru a celkového stavu nemocného rozhodne o eventuální další adjuvantní léčbě, případně pouze o dispenzarizaci tak, jak je to běžné u jakékoliv malignity.
Kazuistika 1
66letá žena s rozsáhlým tumorem retroperitonea, s asymptomatickým průběhem, pouze pocit zvětšujícího se břicha. Byla provedena kompletní exstirpace tumoru z laparotomie, nekomplikovaný průběh, dimise 10. pooperační den. Histologický nález: dobře diferencovaný liposarkom, grade 1. Bez indikace adjuvantní onkologické terapie. Rok po operaci bez známek recidivy.
Image 2. CTA vyšetření
Fig. 2: CTA examination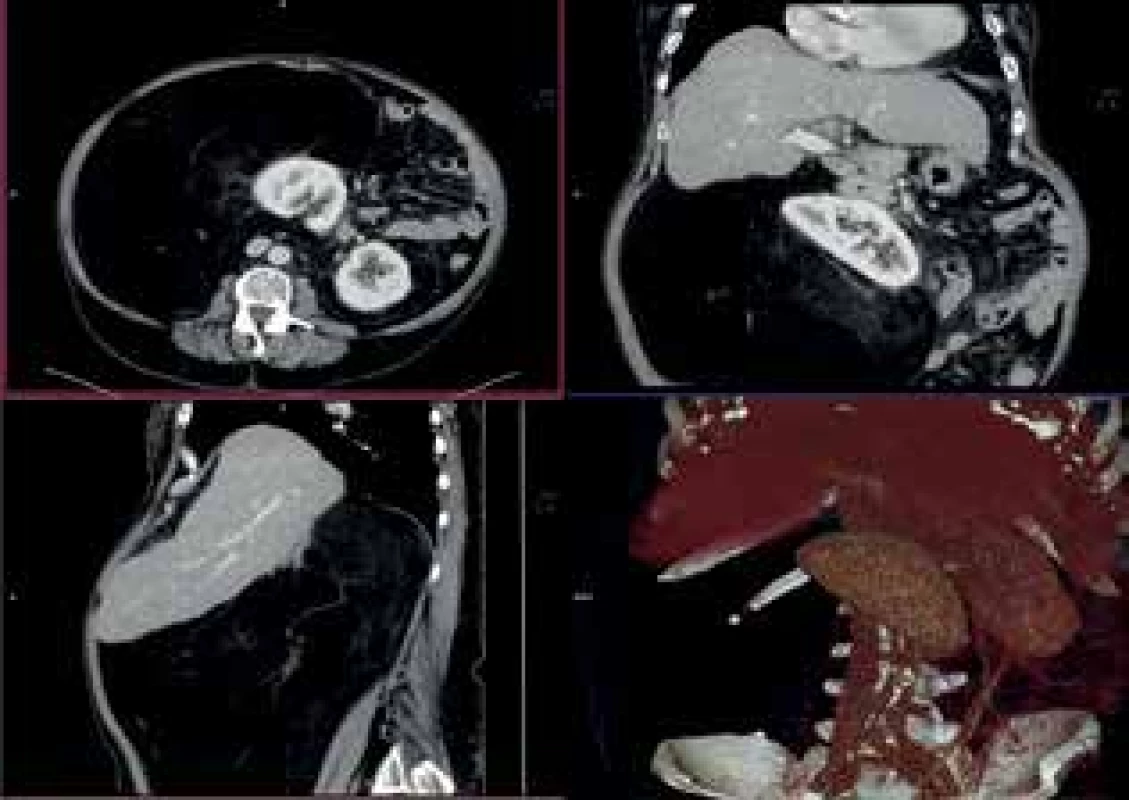
Image 3. Peroperační nález liposarkomu
Fig. 3: Peroperative finding of liposarcoma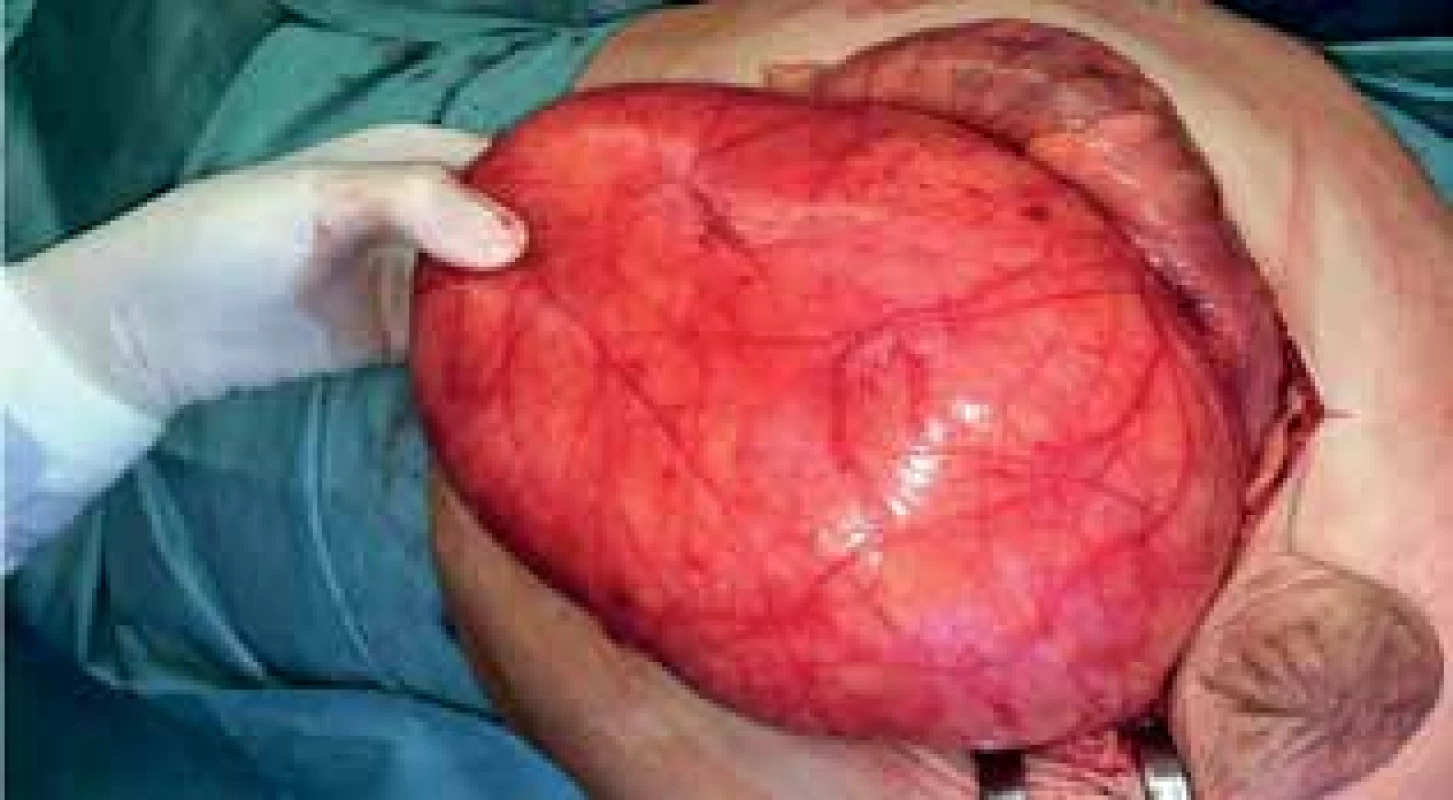
Kazuistika 2
67letý muž s rozsáhlým tumorem v dutině břišní, nemocný udával dyskomfort a bolesti břicha. Byla provedena exstirpace tumoru vycházejícího z prostaty, ponecháno nevelké reziduum v oblasti prostaty, dimise 11. pooperační den. Histologický nález: uterinní Müllerianský typ leiomyomu. Bez indikace adjuvantní onkologické terapie. 8 měsíců po operaci diagnostikována recidiva s infiltrací sigmatu, ileózní stav, založena axiální kolostomie. Nyní 2 roky po operaci, dobrá kvalita života.
Image 4. CTA vyšetření
Fig. 4: CTA examination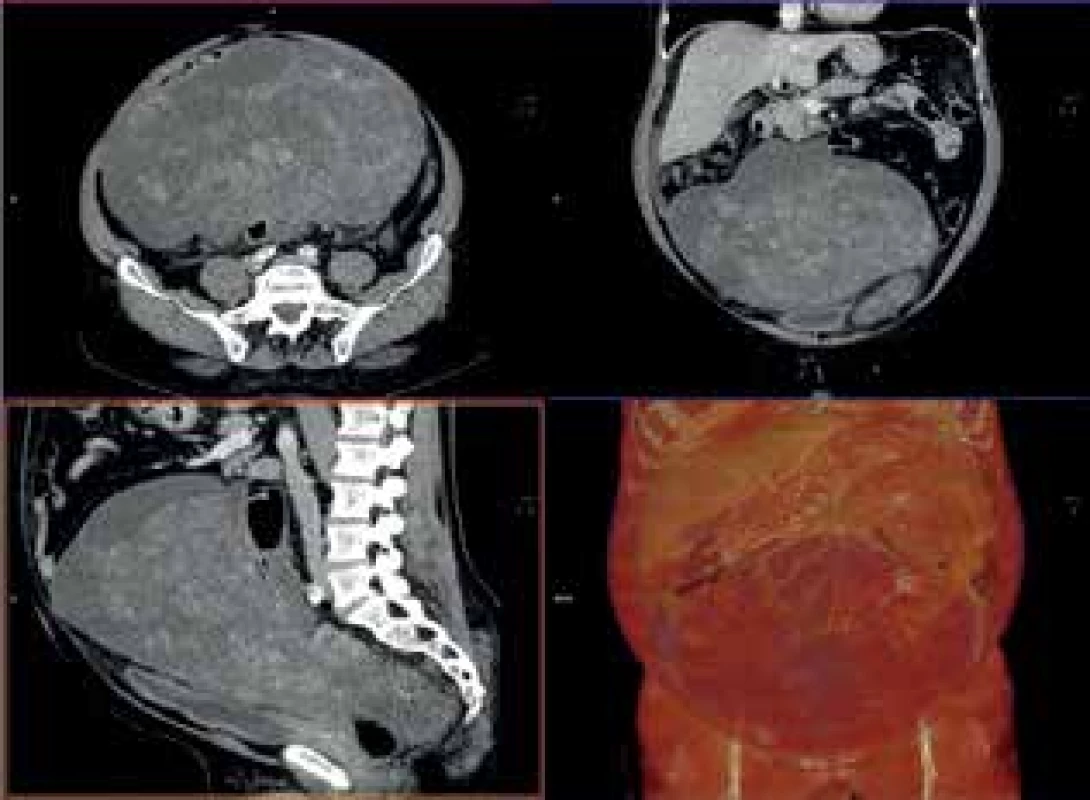
Image 5. Peroperační nález I (uterinní Müllerianský leiomyom)
Fig. 5: Peroperative finding I (uterine Müllerian leiomyoma)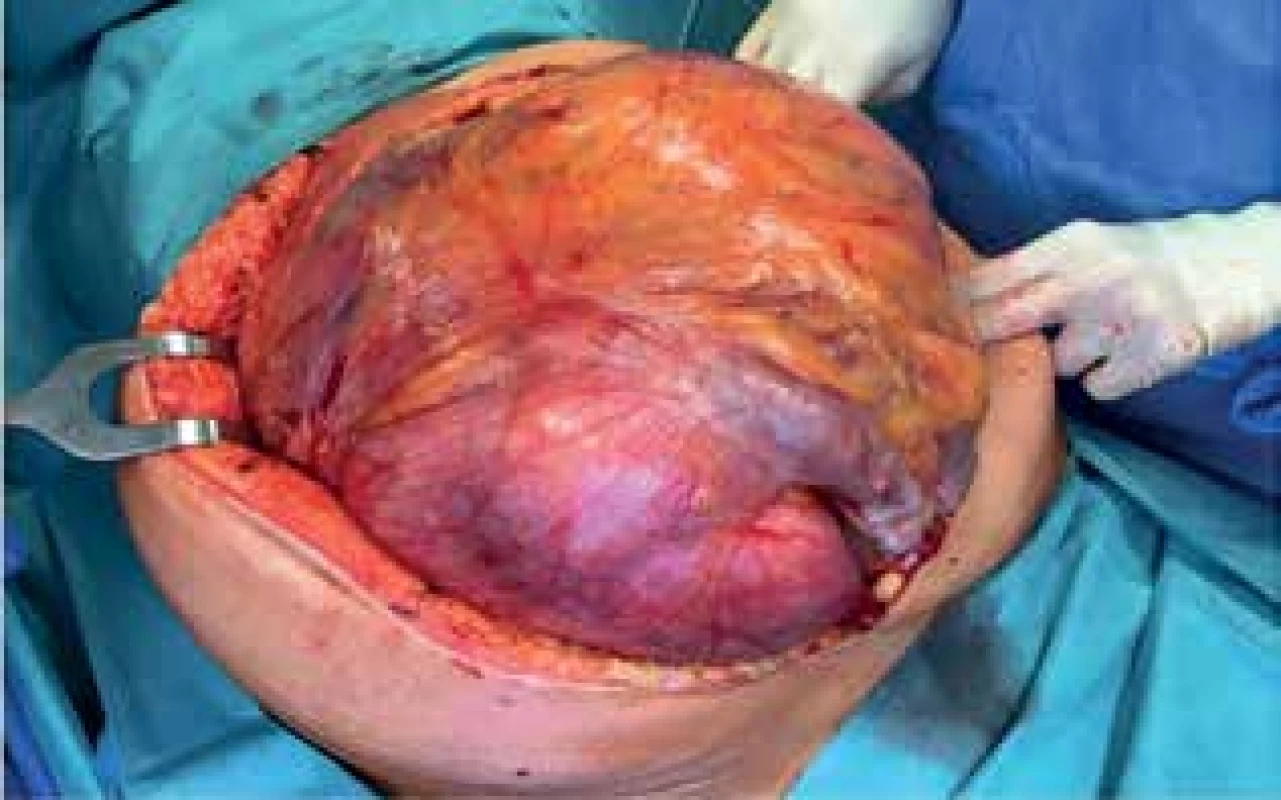
Kazuistika 3
69letá žena s objemným tumorem v dutině břišní, subjektivně pouze pocit plnosti, narůstání břicha. Byla provedena kompletní exstirpace tumoru, nutná levostranná nefrektomie, klidný pooperační průběh, dimise 14. pooperační den. Histologický nález: dobře diferencovaný liposarkom. Nebyla indikována adjuvantní onkologická léčba. Nyní 17 měsíců po operaci odhalena nevelká recidiva u levého psoatu, byl zvolen konzervativní postup.
Image 6. CTA obraz tumoru
Fig. 6: CTA scan of the tumor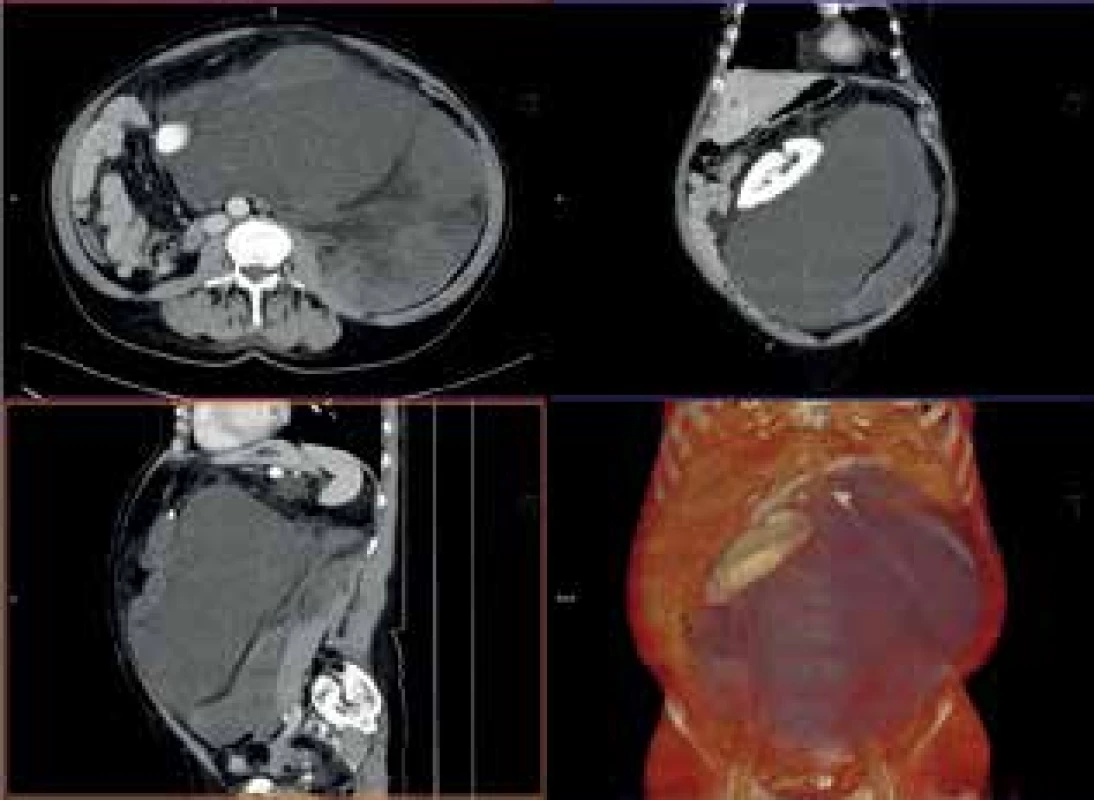
Image 7. Peroperační nález I (liposarkom)
Fig. 7: Peroperative finding I (liposarcoma)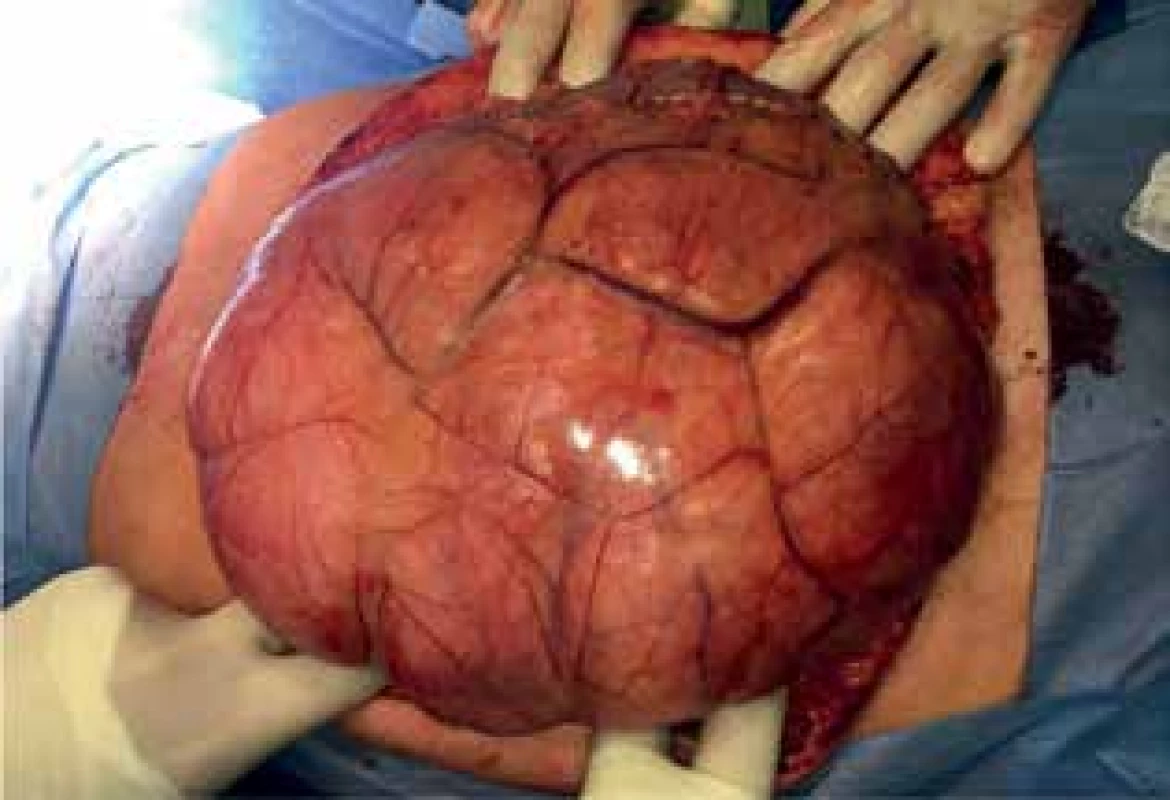
Kazuistika 4
44letá žena s gigantickým tumorem v dutině břišní, v minulosti po resekci rekta pro adenokarcinom a po cholecystektomii, nyní drobné metastázy v plicích. Subjektivní výrazné obtíže související s rezistencí v dutině břišní, téměř nemožnost chůze. Podezření na tumor ovaria. Nemocná je Svědek Jehovův, odmítající striktně krevní deriváty. Po pečlivém zvážení a na výslovné přání nemocné bylo přistoupeno k pokusu o exstirpaci. Podařilo se odstranit celý tumor, histologický nález: metastáza kolorektálního karcinomu. Pooperační průběh byl bez komplikací, dimise 14. pooperační den. 3 měsíce po operaci nemocná při kontrole zcela v pořádku, velmi dobrá kvalita života, v péči onkologa, adjuvantní onkologická léčba. Úmrtí 1 rok po operaci na generalizaci základního onemocnění.
Image 8. CTA obraz tumoru
Fig. 8: CTA scan of the tumor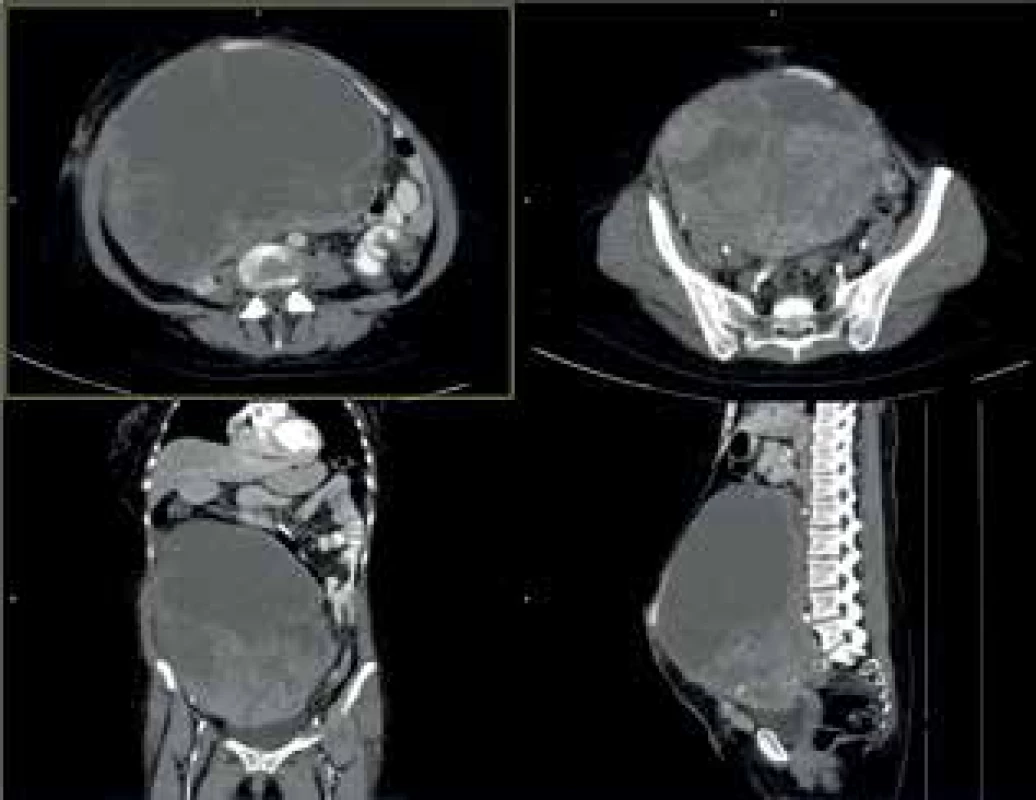
Image 9. Peroperační nález
Fig. 9: Peroperative finding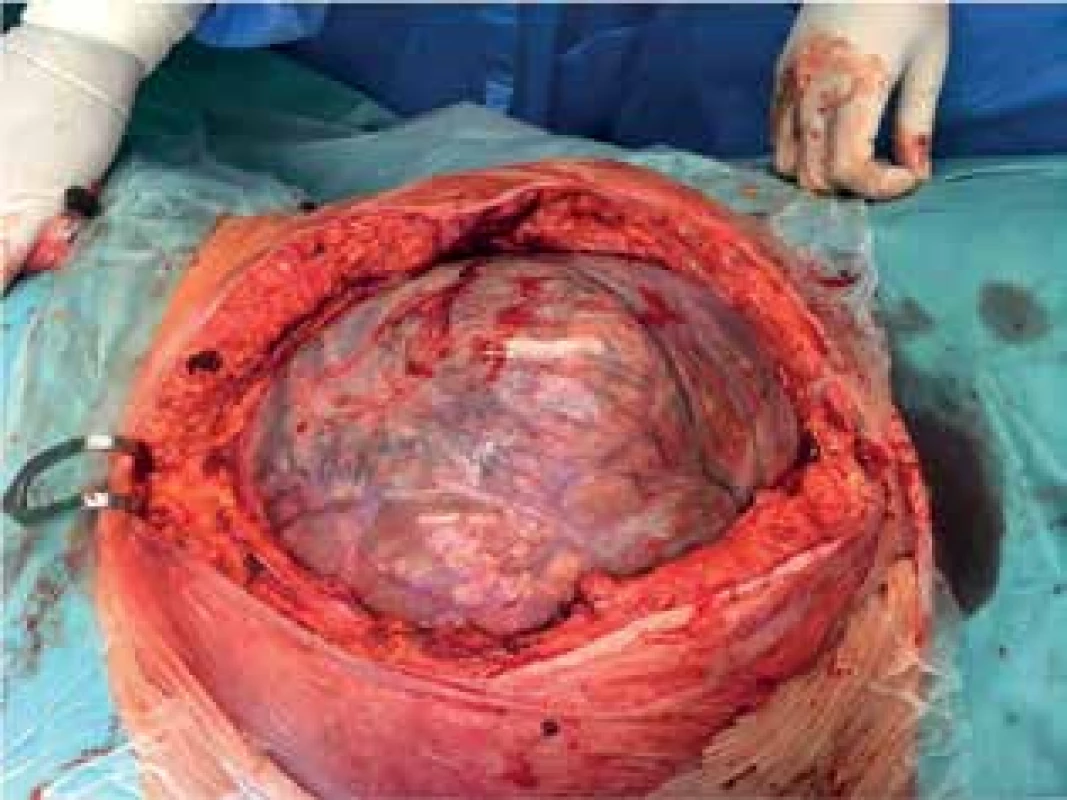
Kazuistika 5
62letá nemocná s bolestmi břicha a poruchami pasáže, příčinou objemná rezistence v dutině břišní, byla provedena kompletní exstirpace tumoru. Histologie: dobře diferencovaný liposarkom s místy dediferenciace grade 2. Klidný pooperační průběh, dimise 9. pooperační den. Bez adjuvantní onkologické léčby, nyní rok po operaci je bez známek recidivy onemocnění.
Image 10. CTA obraz tumoru
Fig. 10: CTA scan of the tumor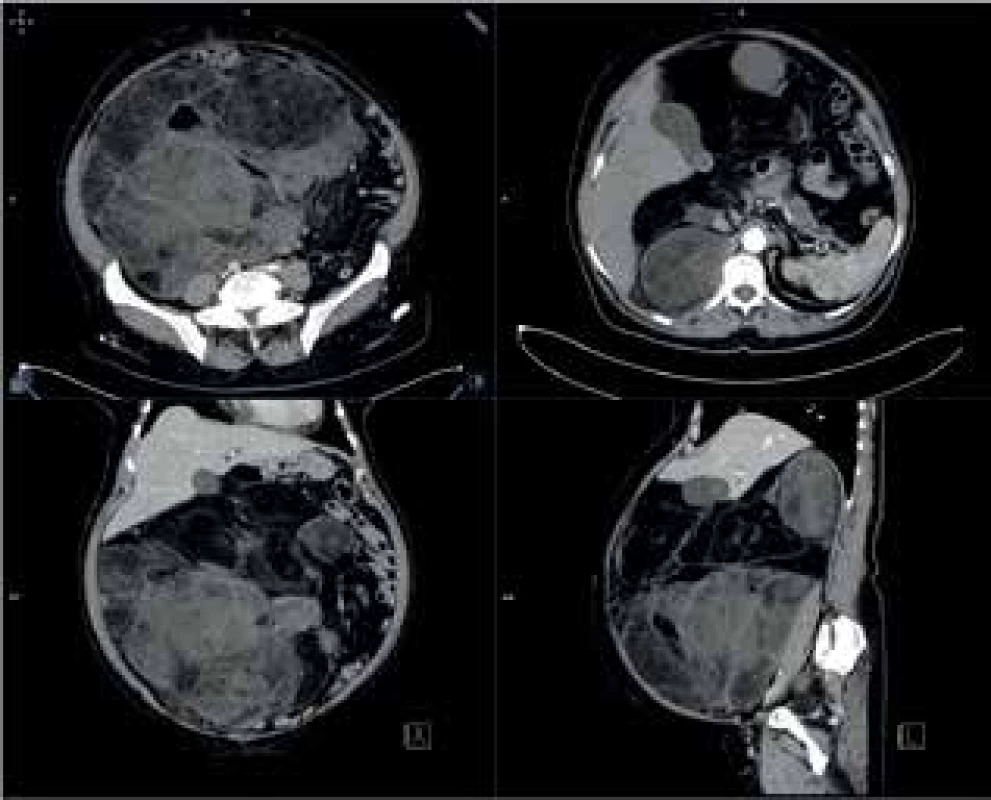
Image 11. Peroperační nález I (liposarkom)
Fig. 11: Peroperative finding I (liposarcoma)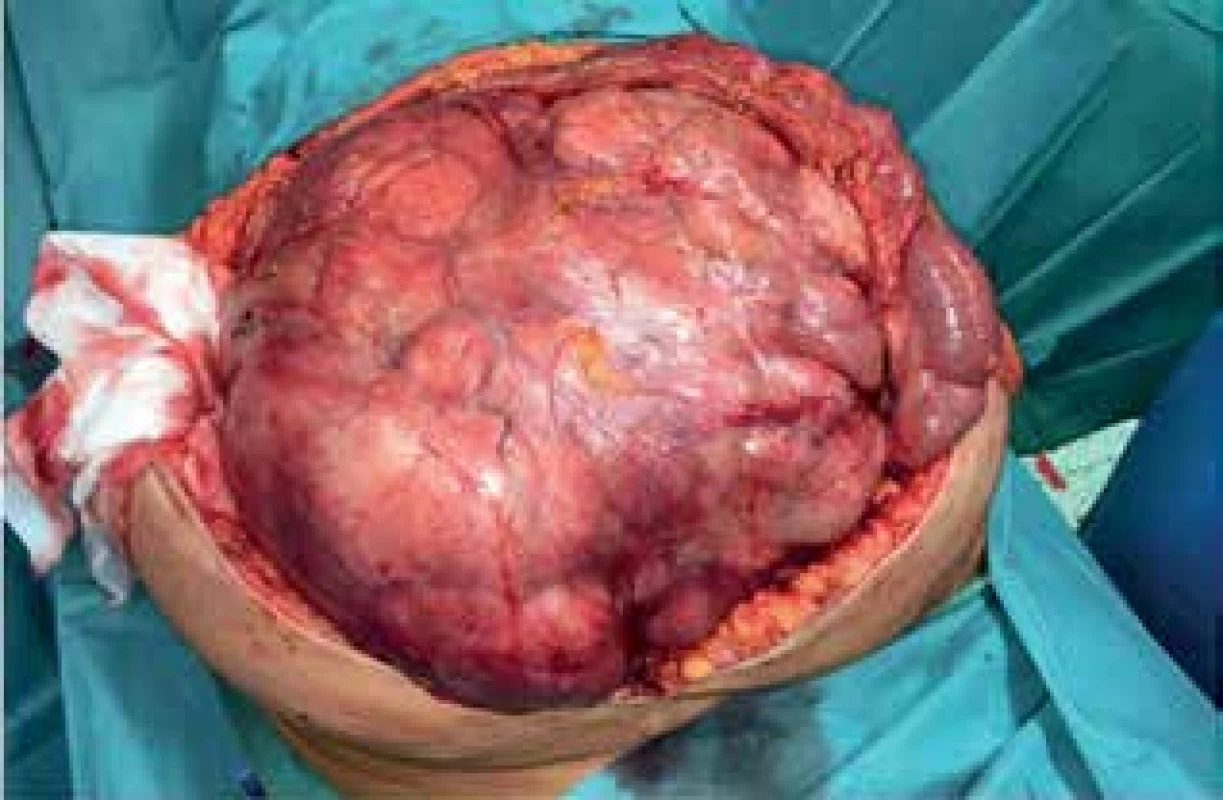
Image 12. Peroperační nález II (liposarkom)
Fig. 12: Peroperative finding II (liposarcoma)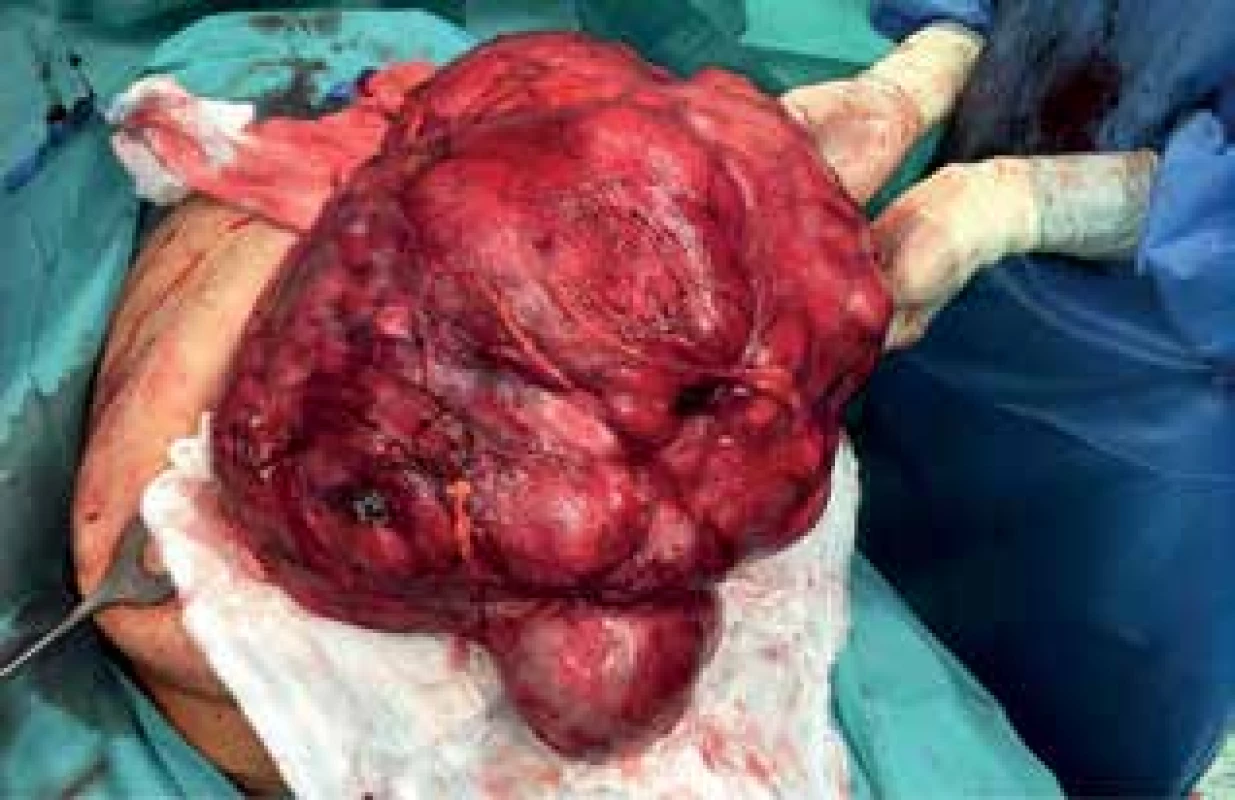
Závěr
Neobvykle velké nádory dutiny břišní mohou být diagnostikovány řadou specialistů, od praktického lékaře přes chirurga, gynekologa, urologa atp. Je beze všech pochyb, že jejich léčba patří do center, která mají s touto operativou zkušenosti. Motivací k výkonu by nikdy nemělo být odoperovat největší nádor na svém pracovišti, ale pouze a jedině pokusit se vyléčit nemocného. Naprosto kruciální je precizní předoperační diagnostika, která je klíčem ke správnému rozhodnutí o vlastní indikaci a rozsahu výkonu. Je třeba využít veškerých nejmodernějších zobrazovacích metod k získání co nejpřesnějších informací, ať již o topograficko-anatomických souvislostech, tak o biologické aktivitě tumoru. Jen tak může být operatér připraven na veškeré eventuality během výkonu a učinit tak optimální rozhodnutí ve prospěch pacienta. Riziko výkonu by nikdy nemělo být neúměrné, musí být vždy vyváženo potenciálním benefitem úspěšné operace. Jedním z rizikových momentů je manipulace s tumorem adherujícím k velkým cévám retroperitonea. I bez jakéhokoliv poranění může dojít k oběhové nestabilitě díky změně tlakových poměrů v retroperitoneu. V těchto chvílích je klíčová úloha zkušeného anesteziologa, který se dokáže s danou situací vyrovnat. V rizikových momentech je třeba počítat i s nutným náhlým uzavřením aorty, resp. dolní duté žíly, ať již při její nutné resekci a náhradě, nebo při jejím peroperačním poranění. Naprostá většina extrémně objemných nádorů retroperitonea a dutiny břišní nevykazuje známky významné dediferenciace a nejedná se tedy většinou o vysoce maligní tumory. Jsou pomalu rostoucí a nezahubí nemocného kvůli svému vysokému gradingu, ale spíše kvůli komplikacím souvisejícím s jejich velikostí [22]. Z toho vyplývá, že i potenciální recidiva tohoto onemocnění po rozsáhlé exstirpaci nádoru neznamená automaticky fatální konec. Jak z vlastní zkušenosti, tak z literárních dat jsou známé případy opakovaných exstirpací nízce maligních liposarkomů, a to i během celé řady let [23,24]. Nemocný s neobvykle objemnými tumory v dutině břišní, resp. v retroperitoneu bude vždy profitovat z multidisciplinárního přístupu na pracovišti, které má zkušenosti s těmito případy.
Tato práce byla podpořena Výzkumným záměrem UK Progres Q 39.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
prof. MUDr. Jiří Moláček, Ph.D.
Chirurgická klinika LF a FN Plzeň
Husova 3
301 00 Plzeň
e-mail: molacek@fnplzen.cz
Sources
1. Ji H, Zhu W, Zhao B, et al. A giant mesenteric fibromatosis involving the muscular layer of the colon wall: A case report. Medicine (Baltimore) 2019;98(1):e14015. doi:10.1097/MD.0000000000014015.
2. Hida M, Azahouani A, Elazzouzi D, et al. Giant mesenteric lipoma in children: A case-report. Arch Pediatr Organe Off Soc Francaise Pediatr. 2017;24(5):457–459. doi:10.1016/j.arcped.2017.02.022.
3. Nakamura Y, Shida D, Shibayama T, et al. Giant multilocular prostatic cystadenoma. World J Surg Oncol. 2019;17(1):42. doi:10.1186/s12957-019-1579-7.
4. Herzberg J, Niehaus K, Holl-Ulrich K, et al. Giant retroperitoneal liposarcoma: A case report and literature review. J Taibah Univ Med Sci. 2019;14(5):466–471. doi:10.1016/j.jtumed.2019.08.005.
5. Guzel T, Dąbrowski B, Mazurkiewicz M, et al. Gigantic solitary fibrous tumour of extra-peritoneal space. A case report and review of the literature. Pol Przegl Chir. 2014;86(7):337–340. doi:10.2478/pjs-2014-0059.
6. Karray O, Boulma R, Abdi A, et al. Management of a giant retroperitoneal leiomyoma: a case report. J Med Case Reports 2018;12(1):81. doi:10.1186/s13256-018-1617-z.
7. Wu YS, Xu SY, Jin J, et al. Successful treatment of a giant ossified benign mesenteric schwannoma. World J Gastroenterol. 2018;24(2):303–309. doi:10.3748/wjg.v24.i2.303.
8. Nishida K, Ubukata H, Konishi S, et al. A giant solitary fibrous tumor of the mesentery: a case report and literature review. World J Surg Oncol. 2015;13 : 17. doi:10.1186/s12957-014-0422-4.
9. Okamura M, Akabori T, Takeuchi S, et al. A case of young woman with giant ovarian tumor as the manifestation of leukemic recurrence. Nihon Gan Chiryo Gakkai Shi. 1990;25(5):1032–1037.
10. Pastrián LG, Ruz-Caracuel I, Gonzalez RS: Giant primary neuroendocrine neoplasms of the liver: Report of 2 cases with molecular characterization. Int J Surg Pathol. 2019;27(8):893–899. doi: 10.1177/1066896919855764.
11. Pascual Samaniego M, González Fajardo JA, Fernández de la Gándara F, et al. Giant retroperitoneal liposarcoma. Actas Urol Esp. 2003;27(8):640–644. doi:10.1016/s0210-4806(03)72988-x.
12. Misawa S, Takeda M, Sakamoto H, et al. Spontaneous rupture of a giant gastrointestinal stromal tumor of the jejunum: a case report and literature review. World J Surg Oncol. 2014;12 : 153. doi:10.1186/1477-7819-12-153.
13. Federici S, Mordenti M, Domenichelli V, et al. Successful combined treatment for giant mesenteric desmoid tumor: case report and review of the literature. J Pediatr Surg. 2012;47(6):e25−30. doi:10.1016/j.jpedsurg.2012.01.081.
14. Pedullà G, Sapienza P, Paliotta A. Surgical considerations for removal of giant tumor of the right adrenal. Anticancer Res. 2014;34(9):5087–90.
15. Ioannidis O, Papaemmanouil S, Chatzopoulos S, et al. Giant bilateral symptomatic adrenal myelolipomas associated with congenital adrenal hyperplasia. Pathol Oncol Res. 2011;17(3):775–778. doi:10.1007/s12253-010-9330-2.
16. Ruggiero S, Ripetti V, Bianchi A, et al. A singular observation of a giant benign Brenner tumor of the ovary. Arch Gynecol Obstet. 2011;284(2):513–516. doi:10.1007/s00404-011-1930-x.
17. Almond LM, Tirotta F, Tattersall H, et al. Diagnostic accuracy of percutaneous biopsy in retroperitoneal sarcoma. Br J Surg. 2019;106(4):395–403. doi:10.1002/bjs.11064.
18. Wang J, Yuan D, Lu Y, et al. A large pheochromocytoma requiring aortic and inferior vena caval reconstruction: A case report. Medicine (Baltimore) 2019;98(29):e16494. doi:10.1097/MD.0000000000016494.
19. Grimaldi C, Bertocchini A, Crocoli A, et al. Caval replacement strategy in pediatric retroperitoneal tumors encasing the vena cava: a single-center experience and review of literature. J Pediatr Surg. 2019;54(3):557–561. doi:10.1016/j.jpedsurg.2018.06.008.
20. Dossett LA, Rudzinski ER, Blevins LS, et al. Malignant pheochromocytoma of the organ of Zuckerkandl requiring aortic and vena caval reconstruction. Endocr Pract Off J Am Coll Endocrinol Am Assoc Clin Endocrinol. 2007;13(5):493–497. doi:10.4158/EP.13.5.493.
21. Serag H, Featherstone JM, Griffiths DF, et al. Radical nephrectomy and intracaval thrombectomy for advanced renal cancer with extensive inferior vena cava involvement utilising cardiopulmonary bypass and hypothermic circulatory arrest: Is it worthwhile? Arab J Urol. 2018;16(4):378–385. doi:10.1016/j.aju.2018.06.005.
22. Herzberg J, Niehaus K, Holl-Ulrich K, et al. Giant retroperitoneal liposarcoma: A case report and literature review. J Taibah Univ Med Sci. 2019;14(5):466–471. doi:10.1016/j.jtumed.2019.08.005.
23. Waters R, Horvai A, Greipp P, et al. Atypical lipomatous tumour/well‐differentiated liposarcoma and de‐differentiated liposarcoma in patients aged ≤40 years: a study of 116 patients. Histopathology 2019;75(6):833–842. doi:10.1111/his.13957.
24. Niemetz I, Faß J, Wolf M. Multipel rezidivierendes retroperitoneales Liposarkom bei einem 66-jährigen Patienten. Internist 2020;61(2):217–222. doi:10.1007/s00108-019-00701-2.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 1-
All articles in this issue
- Nebezpečí bakteriální translokace pro chirurgického pacienta
- Gigantické nitrobřišní tumory – zkušenosti jednoho centra
- Souběžné onemocnění štítné žlázy u pacientů operovaných pro primární hyperparatyreózu
- Chirurgia štítnej žľazy u detí: naše skúsenosti
- Endometrióza v jazve po cisárskom reze: naše recentné skúsenosti
- Ruptura aneuryzmatu dolní pankreatikoduodenální tepny jako příčina hemoperitonea – kazuistika a review literatury
- Plynová embolie po výplachu incize periproktálního abscesu peroxidem vodíku − kazuistika Měl by být peroxid vodíku v chirurgii nadále využíván?
- 100. výročí založení odborného časopisu Rozhledy v chirurgii
- 140. výročí zahájení výuky chirurgie v českém jazyce na I. chirurgické klinice v Praze
- Zápis z jednání Redakční rady časopisu Rozhledy v chirurgii, konané dne 15. 12. 2020
- Poznámka k recenzím příspěvků zaslaných redakci Rozhledů v chirurgii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza v jazve po cisárskom reze: naše recentné skúsenosti
- Plynová embolie po výplachu incize periproktálního abscesu peroxidem vodíku − kazuistika Měl by být peroxid vodíku v chirurgii nadále využíván?
- Nebezpečí bakteriální translokace pro chirurgického pacienta
- Chirurgia štítnej žľazy u detí: naše skúsenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

