-
Medical journals
- Career
Lymfomy a náhlé příhody břišní – soubor kazuistik
Authors: V. Čan 1; P. Moravčík 1; A. Janíková 2; Z. Kala 1; J. Pánek 3; I. Penka 1
Authors‘ workplace: Chirurgická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 1; Interní hematologická a onkologická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 2; Klinika radiologie a nukleární medicíny Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 3
Published in: Rozhl. Chir., 2019, roč. 98, č. 8, s. 328-334.
Category: Case Report
doi: https://doi.org/10.33699/PIS.2019.98.8.328–334Overview
V léčbě lymfomů je základní léčebnou modalitou systémová onkologická terapie – chemoterapie, imunoterapie, radioterapie, transplantace krvetvorných buněk či jejich kombinace. Hlavní úloha chirurgie u lymfoproliferativních onemocnění spočívá v diagnostickém procesu v podobě biopsie a v brzkém umožnění přesné histologické verifikace.
Jiná situace je ovšem u lymfomů, které se projeví jako náhlá příhoda břišní (NPB). Zde chirurgie již hraje zásadní roli v terapii podobně jako u NPB z jiných příčin. Náhlé příhody břišní spojené s lymfomy mají i shodné projevy: krvácení, obstrukce a perforace. Všechny tyto akutní stavy mohou být způsobeny jak primárně gastrointestinálními (extranodálními) lymfomy, tak pokročilými lymfomy uzlinovými – nodálními, které infiltrují nebo svojí velikostí či lokalizací utlačují gastrointestinální trakt (GIT). Perforace bývá také často spojena s efektem probíhající systémové onkologické léčby. Při léčbě NPB způsobených lymfomy je nutná multidisciplinární spolupráce všech zúčastněných oborů. Z chirurgického hlediska je nutno především minimalizovat riziko pooperačních komplikací pro umožnění brzké systémové onkologické léčby.
Klíčová slova:
lymfom – náhlá příhoda břišní – krvácení – obstrukce – perforace
Úvod
Náhlé příhody břišní (NBP) jsou závažná onemocnění břicha s náhlým vznikem z plného zdraví a rychlým průběhem, která bez včasné léčby ohrožují člověka na životě. Jednou z příčin NPB bývají také lymfomová onemocnění.
Lymfomy jsou nádory vycházející z mízních uzlin či lymfatické tkáně jednotlivých orgánů. Nepatří mezi častá onemocnění, dle údajů z Ústavu zdravotnických informací a statistiky ČR z roku 2015 tvoří 1,8 % ze všech nově diagnostikovaných nádorů u mužů i u žen. Dlouhodobé trendy však ukazují na pomalý nárůst incidence tohoto onemocnění – v roce 2015 na 18/100 000 u mužů a 16,3/100 000 u žen [1]. Velký počet různých typů a podtypů lymfomů a teoretická možnost jejich vzniku v kterékoliv části gastrointestinálního traktu tak vytvářejí širokou škálu onemocnění, se kterými je možné se v praxi setkat. Nejčastější dělení lymfomů z hlediska histologického je do dvou základních skupin, a to na Hodgkinovy (HL) a Non-Hodgkinovy lymfomy (NHL), kde v rámci NHL rozlišujeme B - a T-lymfomy. Z praktického hlediska je taktéž důležité rozdělení na lymfomy agresivní a indolentní (nízce maligní). Hodgkinův lymfom se v oblasti GIT vyskytuje velmi vzácně [2]. S náhlými příhodami břišními jsou tedy mnohem častěji spojovány NHL a z nich převážně primární gastrointestinální lymfomy (PGIL). Nutné je myslet i na variantu pokročilého nodálního onemocnění, které sekundárně ovlivňuje GIT přímou infiltrací nebo nepřímo útlakem a projevuje se klinickými známkami NPB. Primárně extranodální lymfomy (lymfomy vyrůstající z mimouzlinových orgánů) tvoří cca 30 % všech Non-Hodgkinových lymfomů – a z nich cca 40 % jsou lymfomy GIT. Celkem tedy primární gastrointestinální lymfomy (PGIL) tvoří 5–10 % všech NHL. Z celkového počtu malignit GIT však vzhledem ke své incidenci představují PGIL pouze 1−4 % [3]. Pro úplnost je nutno konstatovat, že z hlediska poměrného zastoupení jsou v rámci PGIL mnohem častější B-lymfomy (až 90 %) než T-lymfomy [4].
Rizikovými faktory pro vznik lymfomů mohou být i bakteriální onemocnění (Helicobacter pylori, Campylobacter jejuni) a některé viry (Epstein-Barrové virus, virus humánní imunitní nedostatečnosti – HIV, virus lidské T-buněčné leukemie HTLV-1 a HTLV-2, humánní herpes virus 8 = virus Kaposiho sarkomu KSHV, virus hepatitidy C). Dalšími rizikovými faktory vzniku lymfomu jsou autoimunitní choroby (revmatoidní artritis, celiakie...), či imunosuprese navozená předchozí chemoterapií nebo radioterapií jiného nádorového onemocnění. I imunosuprese navozená dlouhodobě užívanými léky při léčbě chronických onemocnění (např. revmatoidní artritidy) či po orgánových transplantacích může zvyšovat riziko vzniku lymfomů [5].
Diagnostika primárních gastrointestinálních lymfomů vychází, mimo histologickou verifikaci, z Dowsonových kritérií stanovených již v roce 1961 : 1) absence periferní lymfadenopatie v době diagnostiky lymfomu, 2) nepřítomnost mediastinální lymfadenopatie, 3) normální počet leukocytů v krevním obraze a normální diferenciální krevní obraz, 4) dominantní postižení GIT zjištěné během operace se zvětšením pouze přilehlých lymfatických uzlin, 5) bez současného postižení jater a sleziny [6]. Pro staging Non-Hodgkinových lymfomů je využívána Musshoffova modifikace Ann Arbor klasifikace [7], nicméně pro rozsah nemoci u PGIL Non-Hodgkinova typu je užívána klasifikace Lugano (Tab. 1) [7] a klasifikace Pařížská (Tab. 2) [8].
Table 1. Modifikovaná klasifikace z r. 1994 pro gastrointestinální NHL [7]
Tab. 1. Modified classification of gastrointestinal NHL from 1994 [7]![Modifikovaná klasifikace z r. 1994 pro gastrointestinální NHL [7]<br>
Tab. 1. Modified classification of gastrointestinal NHL from 1994 [7]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e82714104c5caf122f7f6e6a35cd1222.png)
Table 2. Pařížská klasifikace pro gastrointestinální NHL z roku 2003 [8]
Tab. 2. Paris classification for gastrointestinal NHL from 2003 [8]![Pařížská klasifikace pro gastrointestinální NHL z roku 2003 [8]<br>
Tab. 2. Paris classification for gastrointestinal NHL from 2003 [8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c08ab42fa73a6fc44e85a5a4970f6be5.png)
Ač se údaje z různých publikací zcela neshodují, za nejčastější lokalizaci PGIL bývá považován žaludek, následován tenkým střevem, ileo-cekálním přechodem a rektem [9].
Na následujících kazuistikách z našeho pracoviště bychom rádi prezentovali typický průběh a léčbu komplikovaných PGIL.
Kazuistika 1
V dalším textu prezentujeme případ 72letého muže, který byl do FN Brno přeložen z okresní nemocnice pro krvácení z konečníku. Pacient byl dlouhodobě sledován gastroenterologem pro ulcerózní kolitidu na systémové terapii kortikoidy (Medrol), imunosupresivy (Imuran) a 5-aminosalyciláty (Salofalk). Maximum zánětlivých změn měl pacient na přechodu esovitého tračníku v rektum a opakované biopsie potvrzovaly chronickou aktivní kolitidu v 35 cm od anu. Na sigmoideoskopii na konci roku 2017 byla popsána infiltrace anu cca 4 cm od svěrače, opakované biopsie vyloučily malignitu. Po zavedené terapii z okresní nemocnice nedošlo ke zklidnění krvácení z konečníku, proto byl pacient odeslán na pracoviště vyššího typu.
Sigmoideoskopie na Endoskopickém centru FN Brno popsala stenotizující infiltraci rekta mezi vnitřním svěračem až cca 12 cm orálně s miskovitou ulcerací. Ve vyšetřeném rozsahu nebyly nalezeny známky IBD.
Na CT břicha byla popsána infiltrace rekta s prosakem perirektálního tuku a trombózou pánevních žil (Obr. 1). Dopplerovské vyšetření žil potvrdilo flebotrombózu od vena femoralis až do periferie končetin. Vedlejším, ale závažným nálezem na CT byl malý 24mm tumor na pravé ledvině. Celotělová scintigrafie skeletu nepopsala patologické ložisko zvýšené aktivity charakteru metastázy. Po konzervativní léčbě došlo k zastavení krvácení, proto byl pacient propuštěn do domácího sledování do definitivního výsledku histologie.
Image 1. Koronární řez CT pánve s infiltrací rekta lymfomem
Fig. 1. Coronal pelvic CT scan with tumorous infiltration of rectum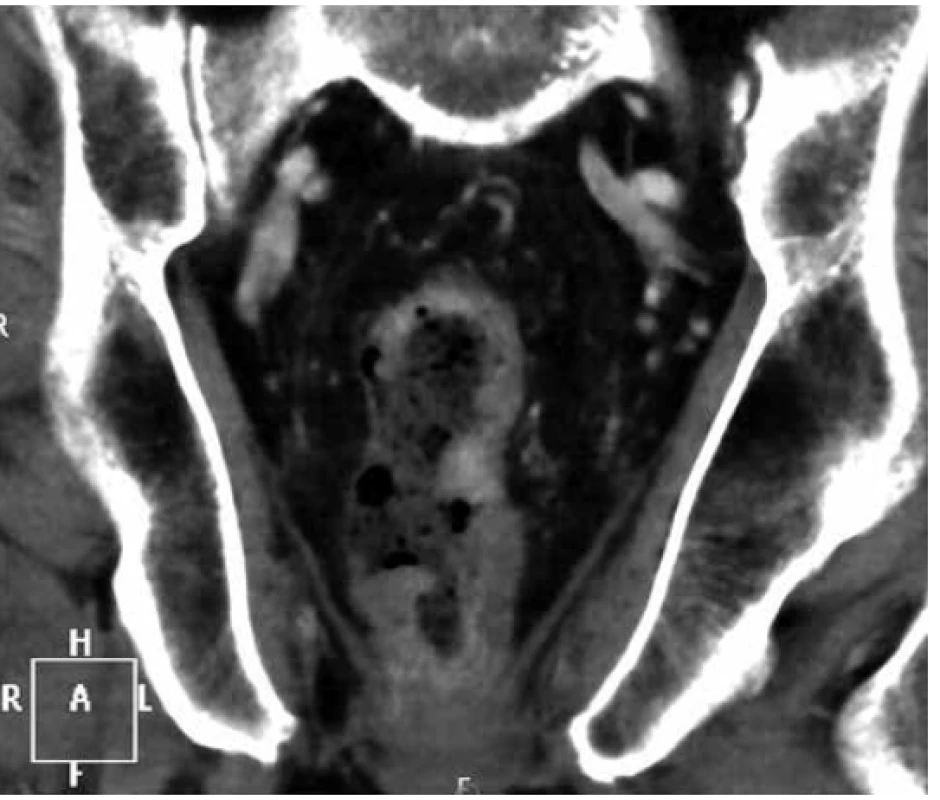
Definitivní histologie z biopsie rekta popsala lymfoblastický lymfom (CD20-138+, EBER+MUM1+kappa negat., lambda pozit., Ki67 až 90 %).
Vzhledem ke krvácivým projevům lymfomu byl pacient indikován k resekci postiženého úseku rekta. Jelikož tumor byl velmi nízko s těsným vztahem ke svěračům, byla indikována abdominoperineální amputace rekta. Tento výkon musel být uspíšen, protože po dimisi došlo doma k recidivě krvácení. Peroperačně byly tkáně rekta velmi křehké, trhající se a krvácivé. Histologie resekátu rekta potvrzuje ve shodě s předoperační biopsií agresivní B lymfom s plazmablastickou diferenciací. V esovitém tračníku byl potvrzen střevní zánět typu ulcerózní kolitidy. Ani pooperační období nebylo u tohoto pacienta bez komplikací. Opakovaně byla nutná chirurgická drenáž presakrálního abscesu (Obr. 2).
Image 2. Sagitální řez CT pánve s presakrální abscesovou formací po amputaci rekta
Fig. 2. Sagittal pelvic CT scan with presacral abscess after abdominoperineal resection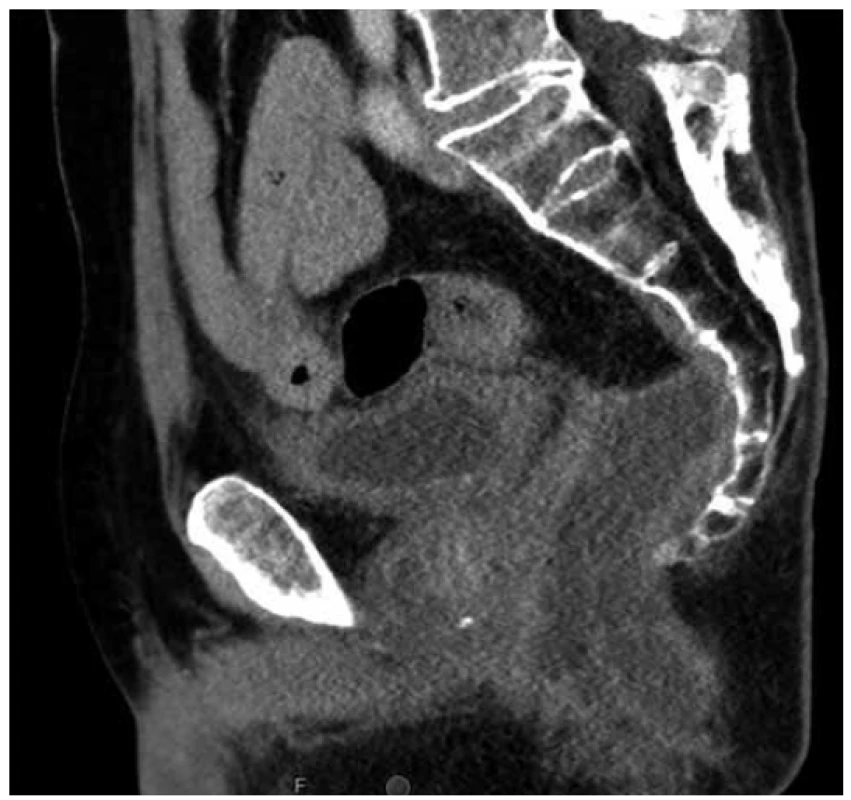
Kazuistika 2
Poměrně složitou kazuistikou, se kterou jsme se setkali, bylo onemocnění 69letého muže, který k nám byl přeložen z okresní nemocnice pro nově dg. krvácející Non-Hodkinův lymfom (Obr. 3). Pro anemizaci a anamnézu melény byl došetřován gastroskopicky s viditelným koagulem v terénu infiltrace duodena, avšak bez nálezu aktivního krvácení. Za pár dní se u pacienta objevila čerstvá meléna, dle akutní gastroskopie byla zdrojem recidiva krvácení z exulcerované infiltrace duodena. Byl proveden opich adrenalinem se snahou o zastavení krvácení. I přes zavedenou hemostyptickou a substituční léčbu pokračovala meléna, bylo nutno opakovaně endoskopicky léze opichovat adrenalinem a ošetřovat hemosprejem. Vzhledem k rozsahu infiltrace ale nebylo možné operačně situaci řešit, proto byla indikována selektivní embolizace dolních pankreatikoduodenálních arkád horní mezenterické arterie (Obr. 4). V dalším průběhu hospitalizace se však opakovaně rozvinulo krvácení do gastrointestinálního traktu s progresí do hemoragického šoku s plnou intenzivní léčbou. Gastroskopie neprokázala krvácení do horní části GIT. Proto byla doplněna CT angiografie, která prokázala krvácení do GIT ze střeva na rozhraní jejuna a ilea (Obr. 5). Dle konzultace radiologů stav nebyl řešitelný embolizací, proto byla z vitální indikace provedena chirurgická revize dutiny břišní. Peroperačně bylo tenké i tlusté střevo vyplněno krví, tenké střevo bylo poseto cirkulárními lymfomovými infiltráty bez stenotizace lumen. Asi 60 cm před bauhinskou chlopní byl nalezen silně prokrvácený infiltrát, který byl zdrojem krvácení do GIT. V jeho těsné blízkosti byly nalezeny dva podobné infiltráty, proto byl tento úsek ilea resekován. Vzhledem k hemoragickému šoku a nestabilitě pacienta a předpokládané nutnosti chemoterapie byl orální konec střeva vyveden jako terminální ileostomie. V dalším průběhu již nedošlo ke krvácení a pacient podstoupil další onkologickou léčbu chemoterapií.
Image 3. Rozsah postižení dutiny břišní lymfomem
Fig. 3. Extent of tumorous infiltration of patient’s abdomen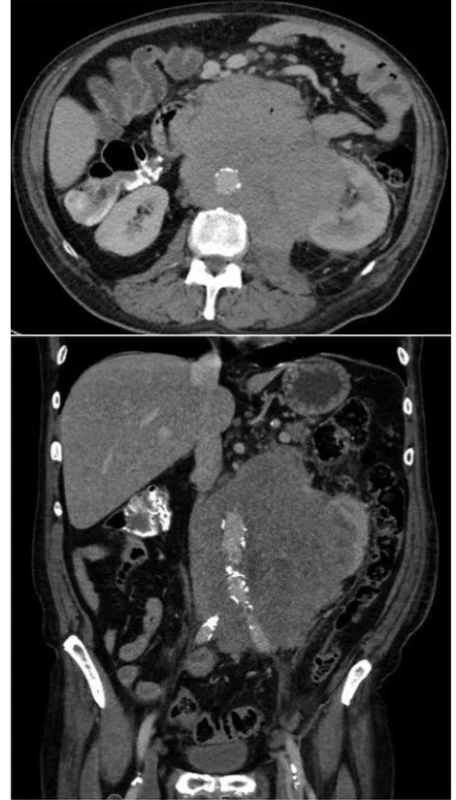
Image 4. Stav před embolizací tepen zásobujících tumorózní infiltrát
Fig. 4. Pre-embolisation visualisation of tumour arteries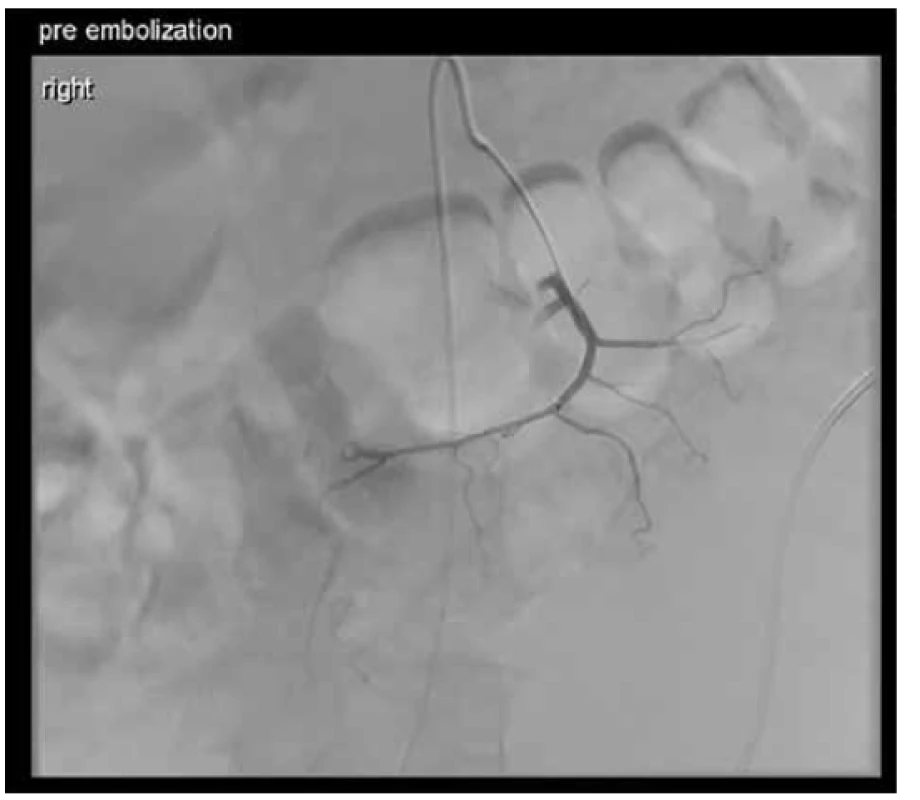
Image 5. Aktivní zdroj krvácení v tenkém střevě v levém hypogastriu
Fig. 5. Active bleeding from small intestinal wall in left hypogastrium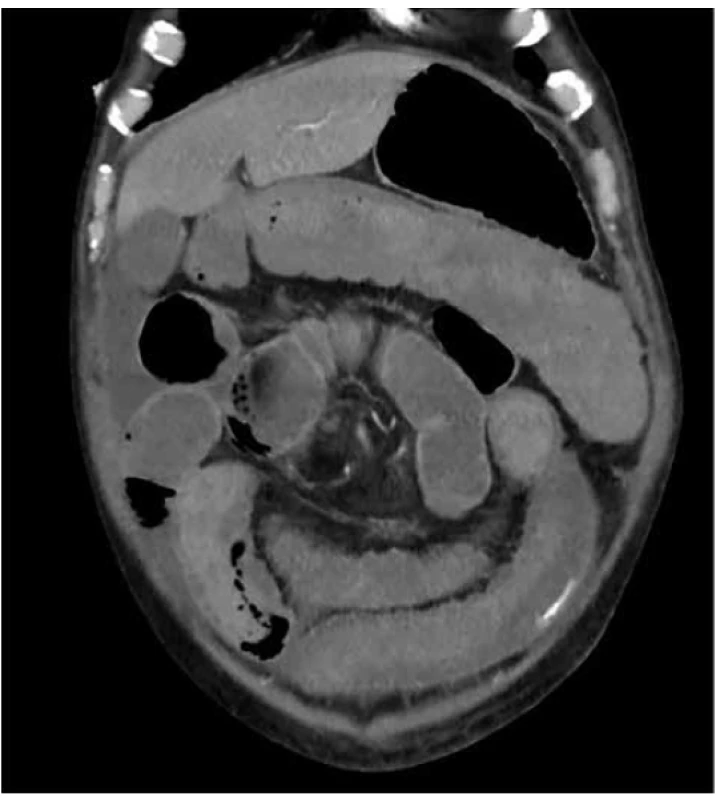
Kazuistika 3
Poslední kazuistika je případ akutní cholecystitidy u 61letého pacienta po allogenní transplantaci krvetvorných buněk pro subkutánní kožní T-lymfom. Pacient byl přijat 5 týdnů po transplantaci krvetvorby pro rozvinutý septický stav s podezřením na Graft vs. Host Disease. Tato patologie byla hematoonkology vyloučena a kultivačně byla prokázána klostridiová kolitida, zaléčená fidaxomycinem. Pro další zhoršování stavu s MODS a elevací CRP na 320 bylo pátráno po infekčním fokusu. Dle ultrazvuku byl fokusem žlučník se zesílenou stěnou až na 14 mm a se známkami těžké cholecystitidy (Obr. 6). Chirurgem byla indikována akutní cholecystektomie, která byla možná až po rozsáhlé hematologické přípravě pacienta v těžkém dřeňovém útlumu s koagulopatií a těžkou trombocytopenií. Makroskopicky, peroperačně, byl žlučník postižen cholesterolózou s obsahem sludge. I přes hematologickou přípravu byla peroperační ztráta při klasické cholecystektomii u imunokompromitovaného pacienta přes 700 ml krve. Po operaci byl pacient předán v těžkém septickém šoku na ARO. V dalších 2 dnech i přes intenzivní léčbu docházelo k multiorgánovému selhání a pacient zemřel. Histologicky, překvapivě, byl žlučník infiltrován buňkami základního onemocnění (T-buněčný lymfom kůže) na pozadí mírné aktivní chronické cholecystitidy.
Image 6. Zesílená stěna žlučníku na 14 mm v rámci akutní cholecystitidy
Fig. 6. Gallbladder wall thickened to 14 mm in acute cholecystitis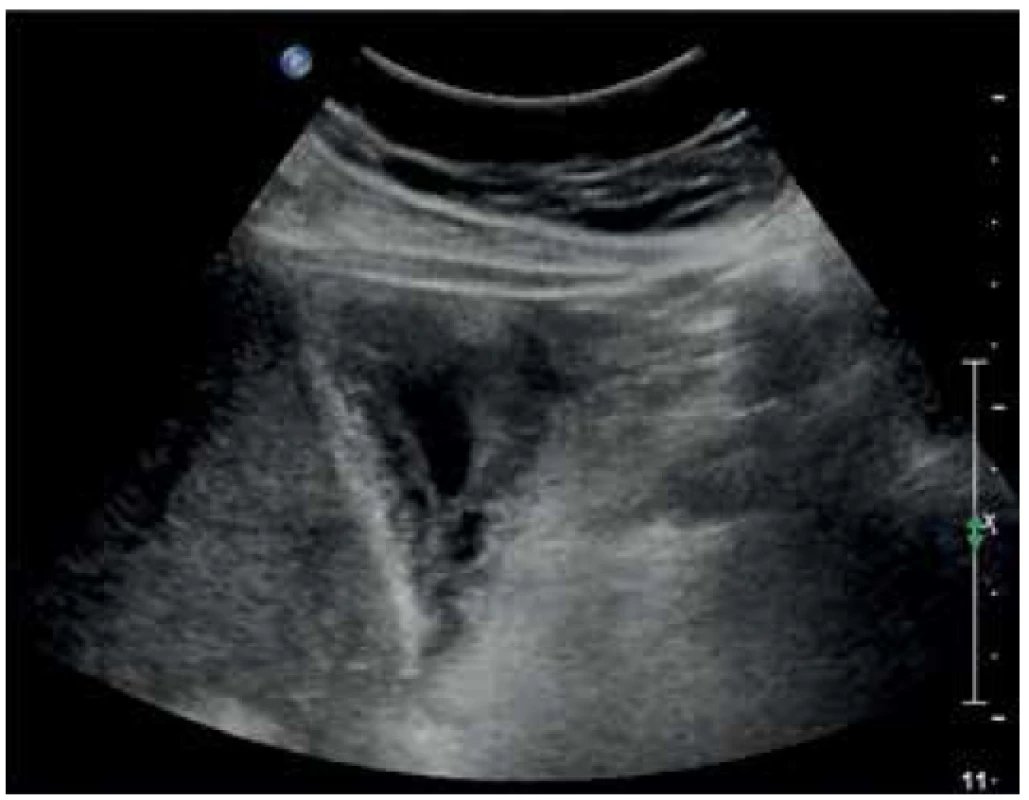
Diskuze
Léčba nekomplikovaných lymfomů je dnes v rukou hematoonkologů. Terapeutické možnosti zahrnují chemoterapii, imunoterapii, radioterapii, transplantaci krvetvorných buněk či jejich kombinace [10,11]. V případě MALT žaludku asociovaného s H. pylori je dokonce často dostatečnou léčbou jen jeho eradikace pomocí antibiotické léčby v kombinaci s inhibitory protonové pumpy, která navodí celkovou remisi lymfomu u 60−100 % pacientů [12,13]. Taktéž léčba imunoproliferativního onemocnění tenkého střeva (immunoproliferative small intestine disease – IPSID) asociovaného s infekcí Campylobacter jejuni je řešitelná prostou antibiotickou léčbou, kdy navozuje remisi asi v 30−70 % případů [15,16]. Chirurgie je dnes především využívána v diagnostice lymfomových onemocnění – odběr patologicky změněné lymfatické uzliny či vzorku nádorové tkáně, nicméně nadále je rezervována pro případy komplikovaných lymfomů, kde má nezastupitelnou roli [17,18,26].
V chirurgické praxi se pak můžeme setkat s pacienty, kteří jeví známky NPB bez předchozí anamnézy lymfomového onemocnění, nebo s pacienty s lymfomem v anamnéze. Další skupinu tvoří pacienti s anamnézou lymfomu v různém stadiu onkologické léčby a konečně pacienti s diagnostikovaným lymfomem, kde je NPB asociována s recentně proběhlou nebo právě probíhající systémovou onkologickou léčbou. Dle příznaků můžeme případy NPB u těchto pacientů rozdělit na následující:
Krvácivé NPB: v dostupné české a anglosaské literatuře jsou popsány četné jednotlivé kazuistiky o krvácejícím PGIL v podstatě ve všech etážích GIT [19,20,21]. Je k dispozici taktéž několik malých souborů pacientů s touto patologií. Nejčastěji je popisováno krvácení z lymfomů žaludku, méně často pak z etáží ostatních. V případě krvácení z PGIL bez oběhové nestability se autoři většinou přiklánějí k volbě konzervativního postupu – došetření zdroje krvácení, endoskopické či endovaskulární ošetření. V případě klinicky významného, endoskopicky či endovaskulárně neošetřitelného krvácení s protrahovanou krevní ztrátou nebo nástupem příznaků oběhové nestability je pak indikováno chirurgické řešení, při kterém je zpravidla výhodnější provedení resekčního výkonu než pouhé prošití zdroje.
Ileózní NPB: ve spojitosti s PGIL se jedná o poměrně častou NPB. Ileus může být způsoben i nodálním typem lymfomu – útlakem GIT zvenčí. Velmi často je popisován ileus na podkladě intususcepce [22]. V případě stenotizace GIT bez plně vyjádřeného ileózního stavu, byť s poruchami pasáže u pacientů s již histologicky prokázaným lymfomem, je na místě konzervativní postup – intenzivní onkologická léčba, která může být i definitivním řešením. Při pokročilém ileózním stavu je indikováno chirurgické řešení s výkonem dle peroperačního nálezu a se zohledněním celkového stavu pacienta – vyvedení stomie, event. resekce s vyvedením stomie či resekcí postiženého úseku GIT s primární anastomózou. Cílem musí být především bezpečné ošetření, s minimem pooperačních rizik, jelikož naléhavým požadavkem u takového pacienta s NPB je umožnění brzké systémové onkologické léčby lymfomu.
Perforační NPB jsou často přítomny u lymfomů žaludku. Zpravidla bývají asociovány s krvácením do GIT. Jednotlivé kazuistiky popisují taktéž perforaci v terénu lymfomu v oblasti dvanáctníku a perforaci v terénu primárního lymfomu žlučníku s následnou peritonitidou [23].
Mezi raritní NPB patří například ischemie střeva na podkladě obliterace mezenteriálních či mezokolických cév buňkami intravaskulárního B-lymfomu [24].
Významnou kapitolou jsou NPB asociované s podanou systémovou onkologickou terapií. Perforace a krvácení z oblasti PGIL jsou možnými riziky provázejícími chemoterapii, resp. imunochemoterapii. Jsou relativně málo časté a jejich incidence se pohybuje kolem 5 %. Výskyt je pozorován většinou po 5. dni od zahájení systémové léčby. Další následky onkologické léčby, které mohou potenciálně vést k NPB, jsou stenózy a striktury GIT po absolvované radioterapii.
Jedna z nejzávažnějších komplikací v souvislosti se systémovou onkologickou léčbou, která se projevuje jako náhlá příhoda břišní, bývá febrilní neutropenie [25]. Zvláště ve formě neutropenické enterokolitidy může být příčinou vysoké morbidity a mortality u nemocných s léčeným lymfomem. I když drtivá většina pacientů reaguje na konzervativní terapii, nejtěžší formy mohou vyžadovat akutní a extenzivní chirurgické řešení. Neutropenická enterokolitida může být následkem samotného průběhu základního maligního onemocnění, spíše se však jedná o následek imunosupresivní myelotoxické terapie. K jejím charakteristickým známkám patří především pokles neutrofilů v krevním obrazu, teplotní špičky nad 38 °C s minimálním odstupem 1 hodiny. Charakteristickým symptomem jsou bolesti břicha.
Vlastní příčinou stavu je rozvoj infekce imunokompromitovaného organismu postihující GIT. V diagnostice hraje důležitou roli velmi úzká spolupráce s onkologem. Především pak pečlivá anamnéza a klinické vyšetření, které při postižení tračníku vykazuje různý stupeň břišní distenze nebo přítomnost příznaků peritoneálního dráždění. Situaci komplikuje i eventuální koexistence apendicitidy, cholecystitidy, jejichž paralelní výskyt se základním onemocněním je pochopitelně možný a i relativně častý.
Diferenciálně diagnostickým problémem je také pseudomembranózní kolitida. Zásadní význam má v těchto případech provedení CT vyšetření s intravenózně podanou kontrastní látkou, které může odhalit nejtěžší formy neutropenické enterokolitidy – přítomnost vzduchu ve střevní stěně. Koloskopické vyšetření je extrémně rizikové pro možnost perforace, a proto indikace koloskopie v akutním stadiu kolitidy musí být velmi pečlivě zvažována. U stabilních pacientů je plně indikována a vhodná konzervativní léčba zánětu, zahrnující pobyt na lůžku intenzivní péče, omezený perorální příjem se zavedením dekompresní nazogastrické sondy, parenterální výživa, důsledné korekce minerálového hospodářství a vnitřního prostředí organismu. Velmi důležitá je korekce pancytopenie a koagulopatie. Zásadní postavení v léčbě enterokolitidy mají empiricky podávaná širokospektrá antibiotika a antimykotika. Důležitý je přísný interdisciplinární přístup a spolupráce onkologa, chirurga, radiologa, hematologa a lékaře antibiotického centra.
U nestabilních pacientů a případů bez příznivého efektu konzervativní terapie a rovněž v případech krvácení je vhodné zvážit chirurgickou léčbu samozřejmě s konzultací využití miniinvazivních radiologických technik. V případech prokázaného pneumoperitonea či peritonitidy je chirurgická léčba nevyhnutelná.
Z chirurgických výkonů u NPB spojených s lymfomy volíme spíše limitované resekce s odstraněním destruovaných či devitalizovaných úseků střeva bez nutnosti onkologické radikality solidních tumorů gastrointestinálního traktu. Cílem operačního výkonu musí být co nejbezpečnější řešení, které zajistí co nejrychlejší možnost komplexní onkologické léčby základního onemocnění. Z tohoto důvodu nedoporučujeme zakládat rizikovější střevní spojení a dáváme přednost dočasným stomiím. I když těžiště léčby neutropenické enterokolitidy spočívá v konzervativní léčbě, ty nejtěžší formy si zpravidla vyžádají chirurgické řešení.
Závěr
Diagnostika a léčba lymfomů v posledních desetiletích významně pokročila. S rozvojem radiodiagnostických metod, pokrokem v onkologické terapii a centralizací péče o pacienty s lymfomovým onemocněním se postupně změnila i pozice chirurgie v jejich terapii. V neakutních situacích dnes hraje roli převážně diagnostickou. V případě komplikací ve smyslu NPB však nadále chirurgie zůstává nezastupitelnou součástí komplexní péče. Nutná je multidisciplinární spolupráce všech zúčastněných oborů. Z chirurgického hlediska je potřebné brát zřetel na minimalizaci rizik v pooperačním období s vědomím brzké nutnosti systémové onkologické léčby.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Petr Moravčík
Chirurgická klinika, FN Brno, LF MU v Brně,
Jihlavská 20
Brno 625 00
e-mail: Moravcik.petr@fnbrno.cz
Sources
- Ústav zdravotních informací a statistiky: Novotvary 2015 ČR, Cancer incidence in the Czech Republic. ISSN 1210-857X, (0862-576X, 0862-5778), available from: http://www.uzis.cz/katalog/zdravotnicka-statistika/novotvary.
- Libson E, Mapp E, Dachman AH. Hodgkin’s disease of the gastrointestinal tract. Clin Radiol. 1994;49 : 166−9.
- Janíková A, Zambo I, Baumeisterová A, et al. Lymfomy gastrointestinálního traktu – klinicko-patologický přehled. Transfuze Hematol 2013;3 : 140−51.
- Howell JM, Auer-Grzesiak I, Zhang J, et al. Increasing incidence rates, distribution and histological characteristics of primary gastrointestinal non-Hodgkin lymphoma in a North American population. Can J Gastroenterol. 2012;26 : 452−6.
- Song LN, Cen XN, Ou JP, et al. Clinical and prognostic analysis of 101 cases of primary gastrointestinal Non-Hodgkin´s lymphoma. Zhongguo Shi Yan Xue Ye Xue Za Zhi 2013;21 : 387−91.
- Lecuit M, Abachin E, Martin A, et al. Immunoproliferative small intestinal disease associated with Campylobacter jejuni. N Engl J Med. 2004;350 : 239−48. doi:10.1056/NEJMoa031887
- Al-Saleem T, Al-Mondhiry H. Immunoproliferative small intestinal disease (IPSID): a model for mature B-cell neoplasms. Blood 2005;105 : 2274−80. doi:10.1182/blood-2004-07-2755
- Schechter NR, Yahalom J. Low-grade MAL T lymphoma of the stomach: A review of treatment options. Int J Rad Oncol Biol Phys. 2000;46 : 1093−1103.
- Dreyling M, Thieblemont C, Gallamini A, et al. ESMO consensus conference: guidelines on malignant lymphoma. part 2: marginal zone lymphoma, mantle cell lymphoma, peripheral T-cell lymphoma. Ann Oncol. 2013;24 : 857−77.
- Zucca E, Conconi A, Laszlo D, et al. Addition of rituximab to chlorambucil produces superior event-free survival in the treatment of patients with extranodal marginal-zone B-cell lymphoma: 5-year analysis of the IELSG-19 Randomized Study J Clin Oncol. 2013;10 : 31 : 565−72. doi: 10.1200/JCO.2011.40.6272.
- Zucca E, Gregorini A, Cavalli F. Management of non-Hodgkin lymphomas arising at extranodal sites. Therapeutische Umschau. 2010;67. doi: 10.1024/0040-5930/a000088.
- Gobbi PG, Ghirardelli ML, Cavalli C, et al. The role of surgery in the treatment of gastrointestinal lymphomas other than low-grade MALT lymphomas. Haematologica 2000;85 : 372−80.
- Matyasik-Budnik T, Fabiani B, Hennequin C, et al. Gastrointestinal lymphomas: French intergroup clinical practice recommendations for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SFH). Dig Liver Dis. 2018;50 : 124−31. doi: 10.1016/j.dld.2017.12.006.
- Hussell T, Isaacson PG, Crabtree JE, et al. Helicobacter pylori-specific tumour infiltrating cells provide contact dependent help for growth of malignant B cells in low-grade gastric lymphoma of mucosa-associated lymphoid tissue. J Pathol. 1996;178 : 122−7. doi:10.1002/(SICI)1096-9896(199602)178 : 2<122:AID-PATH486>3.0.CO;2-D
- Kuo SH, Yeh KH, Wu MS, et al. Helicobacter pylori eradication therapy is effective in the treatment of early-stage H.pylori-positive gastric diffuse large B-cell lymphomas. Blood 2012;119 : 4838−44. doi: 10.1182/blood-2012-01-404194.
- Stolte M, Bayerdörffer E, Morgner A, et al. Helicobacter and gastric MALT lymphoma. Gut 2002;50 : 19−24. doi: 10.1136/gut.50.suppl_3.iii19.
- Spectre G, Libster D, Grisariu S, et al. Bleeding, obstruction, and perforation in a series of patients with aggressive gastric lymphoma treated with primary chemotherapy. Ann Surg Oncol. 2006;13 : 1372−8. doi:10.1245/s10434-006-9069-x
- Ghielmini M, Vitolo U, Kimby E, et al. ESMO Guidelines consensus conference on malignant lymphoma 2011 part 1: diffuse large B-cell lymphoma (DLBCL), follicular lymphoma (FL) and chronic lymphocytic leukemia (CLL). Ann Oncol. 2013;24 : 561−76. doi: 10.1093/annonc/mds517.
- Ghimire P, Wu GY, Zhu L. Primary gastrointestinal lymphoma. World J Gastroenterol. 2011;17 : 697−707. doi: 10.3748/wjg.v17.i6.697.
- Sojka L, Makajevova V, Simka J, et al. Primární lymfomy zažívacího traktu z pohledu chirurga. Rozhl Chir. 2017;96 : 276−83.
- Hlaváčová L, Vrba R, Gregořík M, et al. Multiorgánová chirurgická resekce pro rozsáhlý lymfom dutiny břišní. Rozhl Chir. 2017;96 : 37−40.
- Shakya VC, Agrawal CS, Koirala R, et al. Intussusception due to non Hodgkin’s lymphoma; different experiences in two children: two case reports. Cases J. 2009;2 : 6304. doi: 10.4076/1757-1626-2-6304.
- Vaidya R1, Habermann TM, Donohue JH, et al. Bowel perforation in intestinal lymphoma: incidence and clinical features, Ann Onc. 2013;24 : 2439–43. doi: 10.1093/annonc/mdt188.
- Hsiao CH, Lee WI, Chang SL, et al. Angiocentric T-cell lymphoma of the intestine: A distinct etiology of ischemic bowel disease. Gastroenterol. 1996;110 : 985−90.
- Lyman GH, Kuderer N, Greene J, et al. The economics of febrile neutropenia: implications for the use of colony-stimulating factors. Eur J Cancer 1998;34 : 1857–64.
- Hoch J, Kubáčková K. Lymfom rekta – diagnóza k operaci? Rozhl Chir. 2009;88 : 317−9.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 8-
All articles in this issue
- Krátká úvaha o jednodenní chirurgii
- Psychologické aspekty v onkochirurgii
- Vliv psychiky na hojení ran
- Traumata tenkého a tlustého střeva
- Dlouhodobé sledování nemocných po léčbě symptomatické lymfokély po transplantaci ledviny
- Lymfomy a náhlé příhody břišní – soubor kazuistik
- Poranění dolní duté žíly jako komplikace při zavedení ureterálního splintu – kazuistika
- Komentář a diskuze
- Neobvyklý případ bolesti v epigastriu kvůli tromboflebitidě rekanalizované umbilikální žíly – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Traumata tenkého a tlustého střeva
- Vliv psychiky na hojení ran
- Dlouhodobé sledování nemocných po léčbě symptomatické lymfokély po transplantaci ledviny
- Lymfomy a náhlé příhody břišní – soubor kazuistik
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

