-
Medical journals
- Career
Nový pohled na exenteraci axily při metastáze v sentinelové uzlině
: I. Zedníková 1; A. Ňaršanská 1; O. Hes 2; A. Metelková 3; O. Fiala 3; T. Svoboda 3
: Chirurgická klinika FN Plzeň-Lochotín přednosta: prof. MUDr. V. Třeška, DrSc. 1; Šiklův patologicko-anatomický ústav FN Plzeň přednosta: prof. MUDr. M. Michal 2; Onkologická a radioterapeutická klinika FN Plzeň přednosta: prof. MUDr. J. Fínek, Ph. D. 3
: Rozhl. Chir., 2017, roč. 96, č. 8, s. 346-352.
: Original articles
Úvod:
Karcinom prsu je nejčastější nádorové onemocnění žen a představuje celosvětový problém. Díky moderním diagnostickým metodám, mamografickému screeningu a komplexní léčbě se v posledních letech podařilo výrazně snížit mortalitu, avšak incidence onemocnění trvale mírně narůstá. Boj s touto nemocí se odehrává na několika liniích, jako jsou prevence, léčba primárního nádoru, ale také řešení recidiv a generalizace onemocnění. Proto je velmi důležitý odhad prognózy na základě biologických vlastností nádoru a správné stanovení individuální léčby u každé konkrétní pacientky. Naším cílem bylo na základě biologických vlastností nádoru stanovit skupinu pacientek s maligním onemocněním prsu, u které bude možné vynechat exenteraci axily při metastáze v sentinelové uzlině a tím snížit morbiditu spojenou s tímto výkonem bez zhoršení prognózy.Metoda:
Výzkumný projekt probíhal od června 2012 do června 2015. Jednalo se o prospektivní randomizovanou studii, kde hlavní zkoumanou skupinou byly pacientky s primárně chirurgicky léčeným karcinomem prsní žlázy, které v rámci operace podstoupily biopsii sentinelové uzliny (SNB). Ty jsme rozdělili do 3 skupin: 1. skupina – SNB pozitivní bez dokončené exenterace axily (axillary dissection – AD), 2. skupina – SNB pozitivní s dokončením AD, 3. skupina – SNB negativní. 4. skupinu tvořily pacientky s primárně provedenou AD. Zkoumali jsme statisticky významné prognostické faktory metastatického postižení uzlin a zároveň časné progrese onemocnění. Výsledky byly statisticky zpracovány a hodnoceny rozdíly mezi jednotlivými skupinami, stanoveny prognosticky využitelné biologické vlastnosti nádoru ve vztahu k metastatickému postižení uzlin a přežití bez progrese onemocnění.Výsledky:
Do studie bylo zařazeno 214 pacientek s karcinomem prsu. 136 pacientek (64 %) nemělo metastatické postižení axilárních uzlin, naopak 78 pacientek (36 %) mělo pozitivní axilární uzliny, z nichž 28 (13 %) mělo mikrometastázu v sentinelové uzlině, 38 (17 %) mělo 1–3 pozitivní uzliny, 8 (4 %) mělo 4–9 pozitivních uzlin a 4 pacientky (2 %) měly více než 10 metastatických uzlin. Statisticky významný rozdíl metastatického postižení uzlin byl zjištěn u velikosti tumoru, exprese estrogenových receptorů, proliferační aktivity a gradingu.Závěr:
Jako statisticky významné prognostické faktory metastatického postižení uzlin a zároveň časné progrese onemocnění se nám podařilo prokázat: velikost tumoru nad 2 cm, negativní expresi estrogenových receptorů, nádory se střední a vysokou proliferační aktivitou a grade nádoru G2 a G3. Za tři roky této studie nedošlo ani v jednom případě k regionální recidivě v axilárních uzlinách. Proto je evidentní, že při tumorech menších než 2 cm, s expresí estrogenových receptorů, s nízkou proliferační aktivitou a grade 1 je možné vynechat dokončení exenterace axily při 1−2 pozitivních sentinelových uzlinách, pokud je možné adjuvantní ozáření. Exenteraci axily také není třeba doplňovat při mikrometastáze či izolovaných nádorových buňkách v sentinelové uzlině.Klíčová slova:
karcinom prsu – biopsie sentinelové uzliny – exenterace axily – prognostické faktoryÚVOD
S neustále stárnoucí populací, s narůstajícím využíváním moderní diagnostické techniky, díky osvětě a erudici zdravotnických pracovníků napříč všemi odbornostmi a za přispění screeningového programu stále roste incidence zhoubných nádorů prsu. A přestože je léčba karcinomu prsu zvláště v raných stadiích velmi úspěšná, zůstává karcinom prsu i nadále nejčastější onkologickou příčinou smrti u žen [1]. Bohužel zatím neznáme ve většině případů etiologii tohoto onemocnění. Neznáme ani účinnou prevenci této nemoci. Současným trendem je logicky snaha detailněji poznat biologické vlastnosti nádorů prsu, pomocí nich stanovit již před léčbou prognózu onemocnění a terapii každé konkrétní pacientce tzv. ušít na míru [2].
Hlavním cílem naší práce bylo pokusit se stanovit skupinu pacientek, u kterých by bylo možné na základě dostupných informací o biologické aktivitě karcinomu prsu upustit od exenterace axily při metastatickém postižení sentinelové uzliny a tím snížit pooperační morbiditu spojenou s tímto operačním výkonem.
METODA
Do studie byly zařazeny pacientky s primárně chirurgicky léčeným karcinomem prsu v období červen 2012 až červen 2015. Všechny nemocné byly podrobně seznámeny s výzkumným projektem a svým podpisem stvrdily souhlas se zařazením do studie. Studie byla schválena etickou komisí Fakultní nemocnice v Plzni. Zařadili jsme všechny pacientky, které souhlasily se zařazením do studie a v daném období podstoupily biopsii sentinelové uzliny a rozdělili je do tří skupin:
1. skupina – metastatická sentinelová uzlina bez dokončené exenterace axily – 44 pacientek (21 %),
2. skupina – metastatická sentinelová uzlina s doplněnou exenterací axily – 17 pacientek (8 %),
3. skupina – negativní sentinelová uzlina – 133 pacientek (62 %).
Dále jsme analyzovali výsledky u kontrolní skupiny:
4. skupina – primární exenterace axily pro metastatické uzliny – 17 pacientek + 3 pacientky z důvodu nezobrazení sentinelové uzliny (uzliny benigní) = 20 pacientek (9 %).
Biopsie sentinelové uzliny (SNB) je indikovaná u nemocných s nádorem prsu do 5 cm a klinicky negativními axilárními uzlinami. Uzliny považujeme za benigní na základě sonografického vyšetření axil. Naopak, pokud jsou sonograficky popsané patologické uzliny, indikujeme primární exenteraci axily. Zcela výjimečně před operací toto ověřujeme punkční biopsií uzliny.
Při peroperačně zjištěné pozitivní SNB jsme u každé druhé pacientky dokončili exenteraci axily a svodnou lymfatickou oblast ozářili, polovina pacientek podstoupila pouze ozáření axily bez exenterace. U části pacientek byla zjištěna mikrometastáza či metastáza menších rozměrů v sentinelové uzlině až z definitivního histologického vyšetření, proto je skupina pacientek bez dokončené exenterace axily (AD) větší. Indikace k operaci respektovaly celosvětová doporučení pro léčbu karcinomu prsu a byly vždy navrženy dle rozhodnutí mamárního týmu Fakultní nemocnice v Plzni. Po chirurgické léčbě následovala adjuvantní systémová léčba a radioterapie. Na našem pracovišti indikujeme ozáření axily již při jedné metastatické axilární uzlině. Ve 2. skupině s klinicky negativními uzlinami v axile a peroperačně zjištěné metastáze v sentinelové uzlině byly v 6 případech všechny ostatní uzliny bez metastázy, 11x byly nonsentinelové uzliny metastatické. Ve 4. skupině s klinicky metastatickými uzlinami v axile (vždy na základě sonografického vyšetření, bez punkční biopsie) byly ve všech 17 případech metastázy histologicky prokázané.
VÝSLEDKY
Do studie bylo zařazeno 214 pacientek s primárně chirurgicky řešeným karcinomem prsu. Průměrný věk v době stanovení diagnózy byl 58 let bez statisticky významného rozdílu mezi jednotlivými skupinami. Z hlediska zastoupení histologického typu měla 1 pacientka DCIS, 181 pacientek (85 %) mělo invazivní duktální karcinom, 25 (12 %) invazivní lobulární karcinom a 7 (3 %) jiný typ karcinomu. V 184 případech (86 %) jsme provedli parciální resekci prsu, ve 30 případech (14 %) byla provedena mastektomie.
Z hlediska TNM klasifikace lze říci, že 172 nádorů (80 %) dosahovalo velikosti do 2 cm (pT1) a 42 nádorů (20 %) bylo v rozsahu 2−5 cm (pT2). 136 pacientek (64 %) nemělo metastatické postižení axilárních uzlin, z toho 133 mělo negativní sentinelovou uzlinu, u 3 byla provedena primárně exenterace axily, protože se sentinelová uzlina nezobrazila. Oproti tomu 78 pacientek (36 %) mělo metastatické postižení axilárních uzlin, z nichž 28 (13 %) mělo mikrometastázu v sentinelové uzlině, 38 (17 %) mělo 1−3 pozitivní uzliny, 8 (4 %) mělo 4−9 pozitivních uzlin a 4 pacientky (2 %) měly více než 10 metastatických uzlin. Všechny nemocné byly v době stanovení diagnózy dle stagingových vyšetření bez průkazu vzdálených metastáz (pM0). Podle TNM klasifikace byly nemocné rozděleny do klinických stadií nádorového onemocnění. Stadium I – 139 pacientek (65 %), stadium II – 63 pacientek (29 %) a stadium III – 12 pacientek (6 %). Celkově u 14 nemocných došlo k progresi nádorového onemocnění, u 1 pacientky byla zjištěna lokální recidiva současně s generalizací. Žádná pacientka zatím nezemřela. Z hlediska rozložení v jednotlivých skupinách došlo v 1. skupině k progresi nádorového onemocnění u 3 pacientek (7 %), u jedné z nich současně k lokální recidivě, ve 2. skupině také u 3 pacientek (18 %), ve 3. skupině u 6 pacientek (5 %) a ve 4. skupině u 2 pacientek (10 %). Medián sledování všech pacientek činil 19 měsíců.
1. Charakteristika souboru Tab. 1: Characteristics of enrolled patients 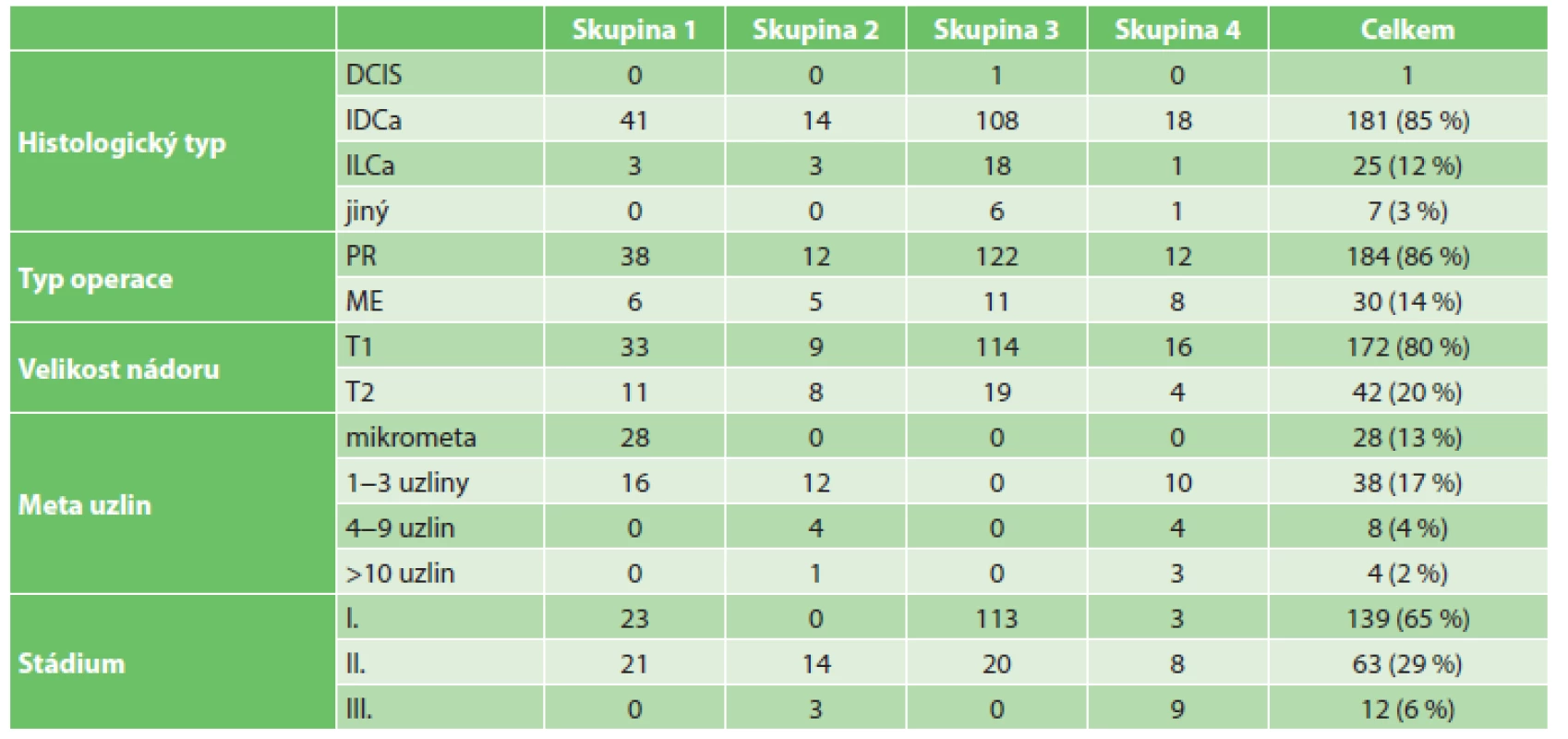
Mezi jednotlivými skupinami jsme testovali anamnestické údaje a dané parametry nádoru a snažili jsme se najít statisticky významné rozdíly. Při zvolené hladině významnosti 5 % byl statisticky významným rizikovým faktorem zjištěn pouze věk vzniku nádoru u pacientek s pozitivní rodinnou anamnézou (RA) karcinomu prsu, který se vyskytl u 40 pacientek (19 %). Průměrný věk, kdy byla zjištěna diagnóza karcinomu prsu u pacientek s pozitivní RA, byl 53 let. Oproti tomu u pacientek bez karcinomu prsu v RA byl průměrný věk diagnózy 59 let. Všechny ostatní testované parametry: věk, exprese estrogenových a progesteronových receptorů, amplifikace HER2 genu, proliferační aktivita, grading tumoru, předoperační hladina nádorových markerů CEA a CA15-3 jsou bez statistické významnosti mezi jednotlivými skupinami. Dále jsme se zaměřili na celkovou délku přežití = Overall Survival (OS), přežití bez lokální recidivy onemocnění = Disease-free Survival (DFS) a přežití bez progrese onemocnění = Progression-free Survival (PFS) ve všech čtyřech skupinách. Vzhledem k příliš krátké době sledování nemá smysl hodnotit OS ani DFS, protože všechny pacientky žijí a došlo pouze k jedné lokální recidivě. Jediné, co při takto krátkém follow-up hodnotit lze, je PFS (přežití bez progrese onemocnění), kdy 200 pacientek (93 %) je zatím bez progrese onemocnění, u 14 pacientek (7 %) došlo ke generalizaci. Rozdíly mezi skupinami jsou statisticky nevýznamné pro dlouhé období. Bez statistické významnosti mezi jednotlivými skupinami vzhledem k PFS jsou histologický typ nádoru, metastatické postižení uzlin, amplifikace HER2 genu a karcinom prsu v RA. Naopak statisticky významné faktory vzhledem k progresi onemocnění jsou: velikost tumoru, stadium onemocnění, grading, proliferační aktivita a exprese ER a PR. U tumorů větších než 2 cm je 4x vyšší pravděpodobnost progrese onemocnění. Onemocnění ve stadiu II a III má 4x vyšší pravděpodobnost progrese nemoci než stadium I. Karcinomy grade 3 mají 6x vyšší riziko progrese onemocnění než G1 a G2. Střední a vysoká proliferační aktivita nádorových buněk má 3x vyšší pravděpodobnost progrese onemocnění než nízká. Nádory s negativní expresí estrogenových, resp. progesteronových receptorů mají 4,4x, resp. 3,4x vyšší riziko progrese onemocnění oproti pozitivním ER a PR.
2. Statisticky významné faktory progrese onemocnění a metastatického postižení uzlin Tab. 2: Statistically significant disease progression factors and metastatic nodal involvement 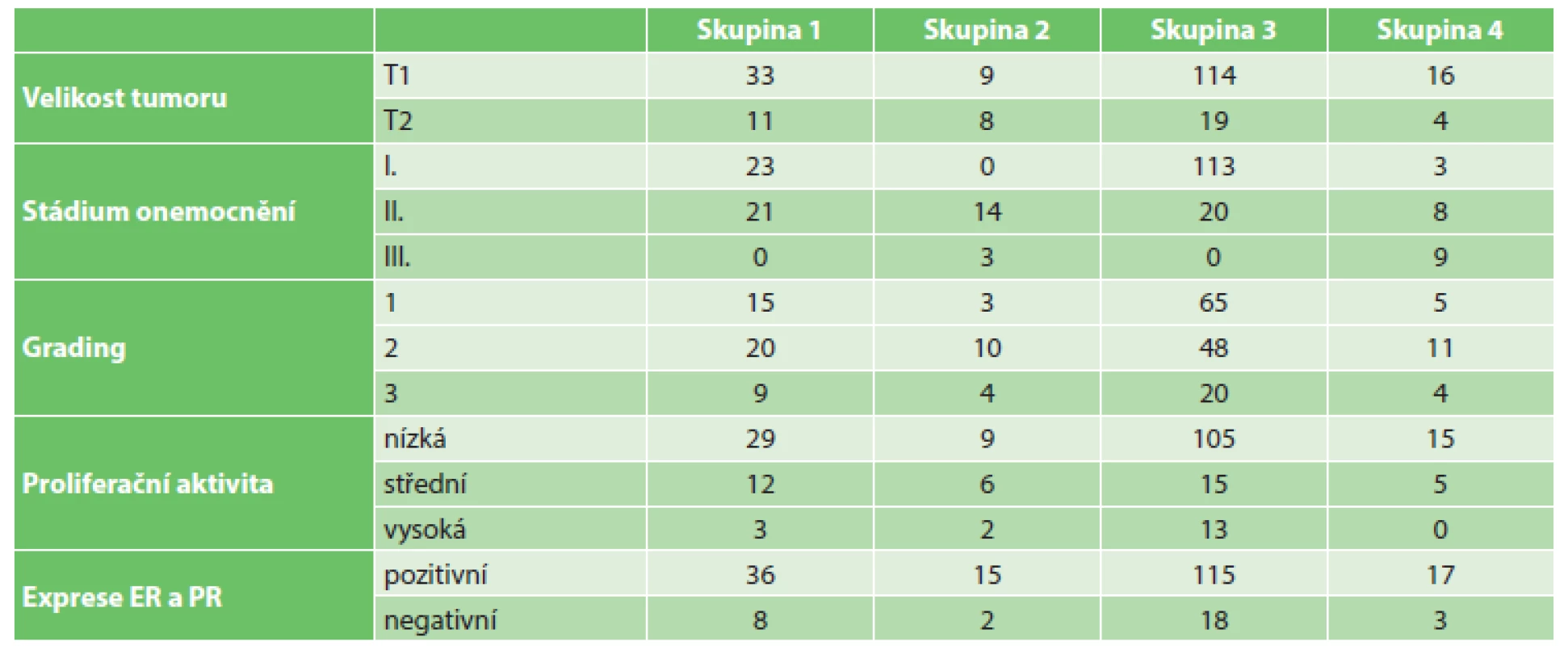
Naším hlavním cílem bylo zjistit, jaký vliv na prognózu onemocnění má vynechání exenterace axily při metastatickém postižení sentinelové uzliny.
Porovnali jsme tedy celkovou délku přežití = Overall Survival (OS), přežití bez lokální recidivy onemocnění = Disease-free Survival (DFS) a přežití bez progrese onenocnění = Progression-free Survival (PFS) v prvních dvou skupinách s metastatickou sentinelovou uzlinou:
1. skupina – metastatická sentinelová uzlina bez dokončené exenterace axily – 44 pacientek.
2. skupina – metastatická sentinelová uzlina s doplněnou exenterací axily – 17 pacientek.
Karcinom prsu je v současné době velmi dobře léčitelné onemocnění s dlouhodobým přežíváním, proto vzhledem ke krátké době sledování (medián 19 měsíců) všechny pacientky žijí a došlo pouze k jedné lokální recidivě. OS a DFS proto nelze hodnotit. PFS je v tomto krátkém období bez statisticky významného rozdílu mezi těmito skupinami. Vynechání exenterace axily při metastáze v sentinelové uzlině v našem souboru tedy nehrálo žádnou roli v časné recidivě či progresi nádoru. Proto jsme se dále zaměřili na zjištění rizikových faktorů metastatického postižení uzlin ve všech skupinách pacientek. V našem souboru 136 pacientek (64 %) nemělo metastatické postižení axilárních uzlin, z toho 133 mělo negativní sentinelovou uzlinu, u 3 byla provedena primárně exenterace axily, protože se sentinelová uzlina nezobrazila. Oproti tomu 78 pacientek (36 %) mělo metastatické postižení axilárních uzlin, z nichž 28 (13 %) mělo mikrometastázu v sentinelové uzlině, 38 (17 %) mělo 1−3 pozitivní uzliny, 8 (4 %) mělo 4−9 pozitivních uzlin a 4 pacientky (2 %) měly více než 10 metastatických uzlin. Bez statistické významnosti pro metastatické postižení uzlin jsou věk, exprese progesteronových receptorů, amplifikace HER2 genu, histologický typ nádoru a předoperační hladiny nádorových markerů CEA a CA15-3. Statisticky významný rozdíl byl naopak zjištěn u velikosti tumoru – tumory větší než 2 cm mají 2,6x vyšší šanci postižení uzlin, exprese estrogenových receptorů – nižší hodnoty jsou rizikovější z hlediska postižení uzlin, proliferační aktivita – nádory se střední a vysokou mají 2x vyšší šanci pozitivních uzlin, grade – nádory G2 a G3 mají 2,8x vyšší pravděpodobnost pozitivních uzlin.
DISKUZE
V zahraničí proběhlo již několik úspěšných studií ohledně vynechání exenterace axily (axillary dissection − AD) při pozitivní sentinelové uzlině (sentinel node – SN), což bylo také motivací pro naši práci. Nejprve jsme provedli retrospektivní analýzu na malém souboru pacientek operovaných na našem pracovišti v letech 2006–2008, s mediánem sledování 84 měsíců, a tím s dostatečně dlouhým follow-up pro hodnocení bezpříznakového i celkového přežití. Tím jsme si ověřili, že vynechání AD při metastatickém postižení SN se zajištěním ozářením a systémovou léčbou neovlivňuje DFS ani PFS.
Biopsie sentinelové uzliny je u časného karcinomu prsu v současné době standardem v léčbě a stanovení axilárního stagingu při klinicky negativních uzlinách. Řadou studií a metaanalýz bylo prokázáno, že pacientky s negativní SN mají velmi nízké riziko lokoregionální rekurence (0,3 %) a v porovnání s pacientkami, které podstoupily AD s negativními axilárními uzlinami, dosahují stejné délky bezpříznakového i celkového přežití při výrazně nižší morbiditě jako následek exenterace axily [3,4]. Z přirozeného vývoje a pozorování výsledků léčby karcinomu prsu vyplývá další otázka: Existuje skupina pacientek s pozitivní sentinelovou uzlinou, která bude mít pravděpodobně ostatní axilární uzliny bez metastatického postižení, tedy z následné axilární disekce nebude profitovat, a jak takové ženy již před zahájením léčby rozpoznat a neindikovat při pozitivní SN k dokončení exenterace axily? Udává se, že 40−70 % pacientek s časným karcinomem má nález axilární metastázy omezen pouze na SN, tedy že přibližně polovina pacientek podstupuje AD při pozitivní SN zbytečně [5,6,7]. Další logickou otázkou je, zda i při metastatickém postižení dalších neexstirpovaných nonsentinelových axilárních uzlin bude v dané skupině pacientek signifikantně horší prognóza, či zda při zajištění lokoregionální kontroly pooperačním ozářením a systémovou onkologickou léčbou bude bezpříznakové a celkové přežití srovnatelné. Tato úvaha vychází z teorie, že přítomnost metastázy v SN je dostatečným kritériem k podání systémové chemoterapie a předpokládá eradikaci potenciálních nádorových buněk v nonSN, tedy zajištění i lokoregionální kontroly [8,9,10].
Na přelomu tisíciletí probíhaly 2 studie zabývající se danou problematikou. Dle Bilimoria et al. (1998−2006) nebyl zjištěn žádný rozdíl v bezpříznakovém intervalu a 5letém přežití u pacientek s pozitivní SN při nálezu makro - i mikrometastázy bez, resp. s dokončením AD. Studie Yi et al. (1998−2004) přinesla podobné výsledky. Obě studie vnesly do léčby karcinomu prsu nový směr, tj. při nálezu mikrometastázy v SN lze vypustit AD bez alterace celkové prognózy [11,12,13].
Ve 21. století navázaly další 3 klíčové studie. Studie Z0011 vychází z teorie, že až 70 % pacientek s pozitivní SN nebude mít pozitivní další nonsentinelové uzliny, tzn. že u 70 % pacientek nebude mít disekce axily žádný léčebný benefit. Studie randomizovala pacientky s nádory do 5 cm, s klinicky negativními axilárními uzlinami, ženy po konzervativním chirurgickém výkonu na prsu (BCS) a mající 1−2 pozitivní SN do 2 větví – s, resp. bez doplnění AD při metastatickém postižení SN. Bylo zjištěno, že 27 % pacientek po AD mělo pozitivní další nonSN, ale za 6leté sledování nebyl prokázán statisticky významný rozdíl ve výskytu lokální recidivy (3,6 %, resp. 1,9 %), regionální recidivy (0,5 %, resp. 0,9 %) při doplnění, resp. bez AD. 5leté přežití bez projevů nemoci (82,2 %, resp. 83,9 %) i celkové přežití (91,8 %, resp. 92,5 %) jsou srovnatelné při disekci axily, resp. jejím vynechání [13]. Zřejmá nevýhoda celé studie spočívá ve výběru pacientek, které byly ve studii randomizovány. Jednalo se o výběr nemocných s velmi časným karcinomem s dobrými prognostickými vlastnostmi – až 70 % tumorů do 2 cm, 83 % hormonálně dependentní a ve skupině pacientek s vynecháním AD mělo 45 % mikrometastázu. Všechny pacientky podstoupily pooperační radioterapii. Důsledkem je její omezená extrapolace na širokou populaci žen s karcinomem prsu, přestože její výsledky poměrně jednoznačně prokazují srovnatelné výsledky obou skupin pacientek a dokazují, že při pooperačním ozáření nepřináší AD stran celkového i bezpříznakového přežití žádný benefit. V závěru studie Z0011 autoři připouštějí bezpečné vynechání disekce axily u prognosticky příznivých nádorů s pooperačním ozářením [14,15].
Studie AMAROS probíhající v letech 2001−2010 randomizovala 4806 pacientek s pozitivní SN do 2 větví – 1. s dokončením AD a 2. s pooperačním ozářením (RT) bez dalšího výkonu v axile. Otázkou bylo, zda pooperační radioterapie zajistí srovnatelnou lokální kontrolu jako standardní operační výkon, zda budou srovnatelné výsledky celkového i bezpříznakového intervalu a jaký vliv bude mít léčba na vznik lymfedému. Závěr studie dokladuje RT jako srovnatelnou alternativu AD pro zajištění lokální kontroly u pacientek s pozitivní SN, ovšem s polovičním podílem lymfedému [16].
Studie IBCSG 23-01 se zabývala problematikou mikrometastáz v SN. Randomizovala 931 pacientek do dvou větví a porovnávala DFS a OS pacientek s AD, resp. bez AD. Ve sledovaném intervalu 57 měsíců zaznamenala srovnatelný DFS – 87 %, resp. 88 % i srovnatelné OS − 97,6 %, resp. 98 % ve skupině s, resp. bez AD. Závěrem studie je možnost vynechat AD v případě mikrometastatického postižení SN [17].
Španělští autoři Pernas et al. a Langer et al. se zabývali ve své práci hodnocením lokální rekurence při vynechání AD při mikrometastatickém postižení SN. V obou studiích nedošlo v době sledování 60 měsíců, resp. 42 měsíců k žádné lokoregionální recidivě [18]. Dutch MIRROR study a Park et al. publikují ve svých studiích 5% podíl regionální rekurence při makrometastáze v SN bez další chirurgické intervence v axile [19], obdobně Gatzemeier et al. (studie Z0011) uvádějí 8% riziko regionální rekurence při vynechání AD [15]. Extrakapsulárním šířením metastázy v SN se zabývali ve své studii Ozmen et al. a Boler et al. Jejich výsledky podporují teorii, že extrakapsulární šíření metastázy v SN představuje silně nepříznivý prognostický faktor pro přítomnost metastáz v nonSN (65,4 % a 70 % vs. 33,3 % a 23,6 %, neproniká-li metastáza přes pouzdro uzliny) [16].
Shrnutím dosavadních poznatků vytvořila pracovní skupina venezuelských autorů práci, jejíž podstatou je vytvoření guidelines umožňujících vynechání AD při pozitivní SN, resp. upravila pravidla z roku 2010, která považovala AD při pozitivní SN za standardní léčebný postup. Současná doporučení dovolují vynechání AD při klinicky negativních uzlinách a splnění všech následujících kritérií: tumor menší než 2 cm (pT1), 1−2 pozitivní SN, nepřítomnost lymfangioinvaze, hormonální dependence, zajištění pooperační radio - a chemoterapie. Vynechání AD se obecně nedoporučuje u triple negativního karcinomu, při expresi HER2/neu bez možnosti podání trastuzumabu (Herceptin) a u pacientek podstupujících primárně mastektomii [20,21].
Práce Harlow et al. z roku 2014 shrnuje indikace SNB, která je absolutně indikována v léčbě karcinomu prsu při klinicky negativních axilárních uzlinách. Dovoluje ji zcela vynechat, pokud informace o axilárním stagingu nemá rozhodující význam pro adjuvantní léčbu (např. ženy nad 70 let s nádory do 2 cm, hormonálně dependentní). Nález ITC je považován za prognosticky srovnatelný s negativní SN a v současné době není indikace k AD, RT ani adjuvantní chemoterapii. Nález mikrometastázy nevyžaduje AD v případě pooperačního ozáření; bez RT vyžaduje AD pro statisticky významně vyšší riziko lokální rekurence proti negativní SN či ITC. AD je primárně indikována pro klinicky pozitivní axilární uzliny a nález mikro - i makrometastázy ve 3 a více SN. Diskutabilní a nedořešenou otázkou zůstává postižení 1−2 SN mikro - či makrometastázou. Vzhledem k tomu, že metastatické postižení axilárních uzlin je indikací k systémové léčbě postihující reziduální nádorovou nemoc včetně axilárních uzlin, není již pozitivní SN absolutní indikací k AD při vyhodnocení fenotypových vlastností primárního nádoru a charakteru metastáz v SN [22,23,24].
V současné době představuje biopsie sentinelové uzliny (SNB) u pacientek s karcinomem prsu preferovaný výkon ve svodné lymfatické oblasti. U 1/4 těchto pacientek je sentinelová uzlina pozitivní na přítomnost metastázy [5]. Dosud je standard při pozitivní sentinelové uzlině doplnit exenteraci axily (AD) [2]. Dle již provedených studií se zdá, že při podání systémové léčby a ozáření axily nemá doplnění AD žádný vliv na délku přežití [20]. Cílem naší práce bylo na základě známých prognostických faktorů stanovit skupinu pacientek, u kterých bude možné od AD ustoupit.
Analyzovali jsme soubor 214 pacientek s primárně chirurgicky řešeným karcinomem prsu. Jedním z cílů bylo detekovat negativní nebo pozitivní prognostické faktory z hlediska časné lokální recidivy či progrese onemocnění a zkrácení celkového přežití. Stimulem pro tuto studii byla otázka, zda exenterace axily při metastáze v SN má skutečně pro pacientky s karcinomem prsu v časném stadiu význam v prodloužení OS a DFS při současné úrovni systémové terapie tohoto onemocnění. Vlastní operace axilárních uzlin může být zatížena celou řadou komplikací, kam řadíme zejména lymfedém a omezení hybnosti ipsilaterální horní končetiny, které mohou výrazně snížit kvalitu života pacientek [2].
Pro jednotlivá stadia nemoci lze prognózu vyjádřit pomocí mediánů bezpříznakového i celkového přežití a pomocí procentuálního vyjádření pětiletého či desetiletého přežití. V rámci našeho výzkumu jsme vzhledem ke krátké době probíhajícího výzkumného projektu a prozatím krátkému follow-up nebyli schopni spočítat mediány DFS ani OS, stejně jako vyjádřit procentuální přežívání nemocných v pětiletém či desetiletém intervalu. Hodnotili jsme pouze přežití bez progrese onemocnění (PFS). Obecně se udává, že největší procento všech karcinomů progreduje do 2 let po operaci (až 10 %), poté má postupně klesající trend a 5 let po operaci dosahuje poloviční hodnoty (5 %) [1]. Průměrná doba vzniku generalizace v našem souboru byla 14 měsíců (2−30) a došlo k ní u 7 % pacientek. Jako statisticky významné faktory vzhledem k progresi onemocnění v našem souboru byly: grading, velikost tumoru, stadium onemocnění, proliferační aktivita a exprese estrogenových a progesteronových receptorů. Všechny testované parametry jsou bez statistické významnosti mezi jednotlivými skupinami.
Hlavním cílem této studie bylo zjistit, jaký vliv na prognózu onemocnění má metastatické postižení uzlin. Postižení lymfatického aparátu je považováno za silný negativní prognostický faktor karcinomu prsu. Nemocné v klinickém stadiu I, tedy s nádory do 2 cm a bez postižení regionálních mízních uzlin, mají výrazně lepší bezpříznakové přežití než nemocné v klinickém stadiu II, a tedy s karcinomy buď většími než 2 cm, nebo s metastaticky postiženými axilárními uzlinami. Porovnáme-li skupinu karcinomů bez postižení lymfatického aparátu a s jeho metastatickým postižením, lze říci, že ve tříletém období po operaci je riziko progrese pokročilejších nádorů o 30 % vyšší [25]. Specifickou problematikou je nález mikrometastázy (metastáza o velikosti ≤2 mm) v sentinelové uzlině. Vycházíme-li z patogeneze metastatického procesu, musíme i mikrometastázu považovat za postižení lymfatického aparátu vycestovanými nádorovými buňkami a pro její přítomnost je vymezeno označení pN1mi [26,27]. Zpočátku byl nález mikrometastázy považován za nepříznivý prognostický faktor rovnocenný s postižením makrometastázou a byl indikací k systémové léčbě s cílem prodloužení celkového přežití. Při současné úrovni poznání ale samotný nález mikrometastázy či izolovaných nádorových buněk v sentinelové uzlině není indikací k systémové léčbě a v prvních 5 letech od stanovení diagnózy neovlivňuje délku celkového přežití. Současné práce také uvádějí, že při jejich nálezu není třeba doplňovat exenteraci axily [28,29].
V našem souboru vzhledem ke krátké době sledování (medián 19 měsíců) všechny pacientky žijí a došlo pouze k jedné lokální recidivě. OS a DFS proto nelze hodnotit. PFS je v tomto krátkém období bez statisticky významného rozdílu mezi skupinou s, resp. bez dokončené exenterace axily při pozitivní SN. Vynechání exenterace axily při metastáze v sentinelové uzlině v našem souboru tedy nehrálo žádnou roli v časné recidivě či progresi nádoru.
Jako prognosticky významné faktory metastatického postižení uzlin vyšly velikost tumoru nad 2 cm, negativní exprese estrogenových receptorů, nádory se střední a vysokou proliferační aktivitou a grade nádoru G2 a G3.
ZÁVĚR
Jako statisticky významné prognostické faktory metastatického postižení uzlin a zároveň časné progrese onemocnění v našem souboru se nám podařilo prokázat: velikost tumoru nad 2 cm, negativní exprese estrogenových receptorů, nádory se střední a vysokou proliferační aktivitou a grade nádoru G2 a G3. To znamená, že v souladu se zahraničními studiemi je metastatické postižení uzlin málo pravděpodobné při tumorech menších než 2 cm, s expresí estrogenových receptorů, s nízkou proliferační aktivitou a grade 1. Za tři roky této studie došlo pouze k jedné lokální recidivě nádoru v prsu, a to v 1. skupině pacientek s metastatickou sentinelovou uzlinou, avšak ani v jednom případě nedošlo k regionální recidivě v axilárních uzlinách, dokonce tedy bez závislosti na prognostických faktorech tumoru a s nimi související agresivitou tumoru. Proto je evidentní, že v těchto případech je zcela určitě možné vynechat dokončení exenterace axily při 1−2 pozitivních sentinelových uzlinách, což v současné době již využíváme v klinické praxi po předchozí domluvě s pacientkou, a pokud je možné adjuvantní ozáření. Exenteraci axily také není třeba doplňovat při mikrometastáze či izolovaných nádorových buňkách v sentinelové uzlině, což neprovádíme již zcela rutinně.
Samozřejmě vzhledem ke krátké době sledování pacientek v této studii bude výzkum dále pokračovat, pacientky budeme dále sledovat a soubor opět statisticky zhodnotíme v pětiletém a desetiletém intervalu.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Ilona Zedníková
Chirurgická klinika FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: ilona.zednikova@seznam.cz
Sources
1. Becker HD, Hohenberger W, Junginger T, et al. Chirurgická onkologie. Praha, Grada Publishing 2005 : 21−7 : 115−65.
2. Coufal O, Fait V a kol. Chirurgická léčba karcinomu prsu. Praha, Grada Publishing 2011.
3. Galimberti V, Botteri E, Chifu C, et al. Can we avoid axillary dissection in the micrometastatic sentinel node in breast cancer? Breast Cancer Res Treat 2012;131 : 819−25.
4. Bolondi M, Farinetti A. Axillary lymph node dissection in patients with micrometastasis in sentinel lymph node: new predilections. Minerva Chir 2011;66 : 385−95.
5. Zoras O, Ziogas D, Roukos DH. Omitting axilla lymphadenectomy even by positive sentinel lymph node: a change in breast cancer treatment practice. Womens Health (Lond Engl) 2011;7 : 417−8.
6. Yi M, Giordano SH, Meric-Bernstam F, et al. Trends in and outcomes from sentinel lymph node biopsy (SLNB) alone vs. SLNB with axillary lymph node dissection for node-positive breast cancer patients: experience from the SEER database. Ann Surg Oncol 2010;17 Suppl 3 : 343−51.
7. Meretoja TJ, Vironen JH, Heikkilä PS, et al. Outcome of selected breast cancer patients with micrometastasis or isolated tumor cells in sentinel node biopsy and no completion axillary lymph node dissection. J Surg Oncol 2010;102 : 215−9.
8. Maaike de Boer MD, Carolien HM, van Deurzen MD, et al. Micrometastases or isolated tumor cells and the outcome of breast cancer. N Engl J Med 2009;361 : 653−63.
9. Maaskant-Braat AJ, van de Poll-Franse LV, Voogd AC, et al. Sentinel node micrometastases in breast cancer do not affect prognosis: a population-based study. Breast Cancer Res Treat 2011;127 : 195−203.
10. Gloyeske NC. Goreal W, O´Neil M, et al. Outcomes of breast cancer patients with micrometastases and isolated tumor cells in sentinel lymph nodes. In Vivo Nov-Dec 2011;25 : 997−1001.
11. Ozao-Choy J, Giuliano AE. Prognostic significance of micrometastasis and isolated tumor cells in the sentinel lymph node. Breast Cancer Res Treat 2011;127 : 205−6.
12. Vrána D, Gatěk J, Cwiertka K, et al. Další postupný ústup od axilární disekce u časného karcinomu prsu. Klin Onkol 2014;27 : 143.
13. Wang Z, Wu LC, Chen JQ. Sentinel lymph node biopsy compared with axillary lymph node dissection in early breast cancer: a meta-analysis. Breast Cancer Res Treat 2011;129 : 675−89.
14. Bilimoria KY, Bentrem DJ, Hansen NM, et al. Comparison of sentinel lymph node biopsy alone and completion axillary lymph node dissection for node-positive breast cancer. J Clin Oncol 2009;27 : 2946−53.
15. Gatzemeier W, Mann GB. Which sentinel lymph-node positive breast cancer patient needs an axillary lymph-node dissection ACOSOG Z0011 results and beyond. Breast 2013;22 : 211−6.
16. EORTC study shows radiotherapy and surgery provide excellent regional control for breast cancer patients. Available from: http://www.eortc.org/news/eortc-study-shows-radiotherapy-and-surgery-provide-excellent-regional-control-breast-cancer-pat.
17. Galimberti V, Cole BF, Zurrida S, et al. International Breast Cancer Study Group Trial 23-01 investigators. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol 2013;14 : 297−305.
18. Krsička P, Coufal O, Zapletal O. Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci? Rozhl Chir 2013;92 : 684−9.
19. Latosinsky S, Berrang TS, Cutter CS, et al. Axillary dissection versus no axillary dissection in women with invasive breast cancer and sentinel node metastasis. Can J Surg 2012;55 : 66−9.
20. Kotoč J, Kotočová K, Gatěk J, et al. Mikrometastáza v sentinelové uzlině – nutnost disekce axilárních uzlin? Prakt Lék 2009;89 : 587−90.
21. Abreu EB, Martinez P, Betancourt L, et al. Treatment plan for breast cancer with sentinel node metastasis. Ecancermedicalscience 2014;8 : 383.
22. Tjan-Heijnen V, Pepels M, Boer M, et al. Impact of omission of completion axillaries lymph node dissection or axillaries radiotherapy in breast cancer patients with micro metastasis or isolated tumor cells in the sentinel lymph node: results from the MIRROR study. J Clin Oncol 2009;27 : 18.
23. Rutledge H, Davis J, Chiu R, et al. Sentinel node micrometastasis in breast carcinoma may not be an indication for complete axillary dissection. Mod Pathol 2005;18 : 762−8.
24. van Deurzen CH, van Hillegersberg R, Hobbelink MG, et al. Predictive value of tumor load in breast cancer sentinel lymf nodes for second echelon lymph node metastases. Cell Oncol 2007;29 : 497−505.
25. Boler DE, Uras C, Ince U, et al. Factors predicting the non-sentinel lymph node involvement in breast cancer patients with sentinel lymph node metastases. Breast 2012;21 : 518−23.
26. Pernas S, Gil M, Benítez A, et al. Avoiding axillary treatment in sentinel lymph node micrometastases of breast cancer: a prospective analysis of axillary or distant recurrence. Ann Surg Oncol 2010;17 : 772–7.
27. Ozmen V, Karanlik H, Cabioglu N, et al. Factors predicting the sentinel and non-sentinel lymph node metastases in breast cancer. Breast Cancer Res Treat 2006;95 : 1−6.
28. Dengel LT, Van Zee KJ, King TA, et al. Axillary dissection can be avoided in the majority of clinically node-negative patients undergoing breast-conserving therapy. Ann Surg Oncol 2014;21 : 22−7.
29. Harlow SP, Weaver DL. Sentinel lymph node dissection for breast cancer: Indications and outcomes. Available from: http://www.uptodate.com/contents/sentinel-lymph-node-dissection-for-breast-cancer-indications-and-outcomes/.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 8-
All articles in this issue
- Is it possible to avoid axillary dissection?
- Internal mammary lymph nodes in early stage breast cancer
- Satisfaction and overall quality of life in BRCA positive women after prophylactic surgeries
- Microscopic tumor cells in re-excision tissue by conservative surgery in breast cancer
- Magnetic resonance imaging in preoperative diagnosis of invasive lobular carcinomas of the breast – analysis of 230 cases
- A new perspective on axillary dissection in situations of metastatic sentinel node
- Breast angiosarcoma induced by radiotherapy – surgical treatment options and review of literature
- XXIV. Pražské chirurgické dny 2017
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A new perspective on axillary dissection in situations of metastatic sentinel node
- Is it possible to avoid axillary dissection?
- Satisfaction and overall quality of life in BRCA positive women after prophylactic surgeries
- Magnetic resonance imaging in preoperative diagnosis of invasive lobular carcinomas of the breast – analysis of 230 cases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

