-
Medical journals
- Career
Hemangiomy jater – kdy indikovat invazivní léčbu?
: V. Třeška; T. Skalický; V. Liška; J. Fichtl; J. Brůha; M. Skála; J. Šebek; P. Duras
: Chirurgická klinika LF Univerzity Karlovy a FN v Plzni přednosta: prof. MUDr. V. Třeška, DrSc.
: Rozhl. Chir., 2017, roč. 96, č. 4, s. 151-155.
: Original articles
Úvod:
Hemangiomy jater jsou nejčastějšími benigními jaterními nádory. Většina z nich je asymptomatická a je diagnostikována většinou náhodně ultrasonografií, computerovou tomografií nebo magnetickou rezonancí břicha. Hemangiomy jater zpravidla nevyžadují žádnou léčbu. Nicméně symptomatické, gigantické hemangiomy mohou být indikací k chirurgické, embolizační nebo termoablační léčbě. Cílem práce bylo na základě vlastních a literárních zkušeností definovat, kdy a k jakému typu léčby je nemocný s jaterním hemangiomem indikován.Metoda:
V uplynulém pětiletém období bylo do studie zařazeno 37 nemocných léčených invazivními metodami pro gigantické hemangiomy o průměru 67 mm (45–221 mm). U 11 (29,7 %) nemocných se vyskytovaly vícečetné jaterní hemangiomy. U 15 (40,5 %) nemocných jsme provedli enukleaci, u 3 (8,1 %) neanatomickou jaterní resekci a u jednoho (2,7 %) levostrannou lobektomii, u 2 (5,4 %) jen explorativní laparotomii s původním podezřením na primární nádor jater, což vyloučila peroperační ultrasonografie s využitím kontrastní látky. U 16 (43,2 %) nemocných jsme provedli transarteriální embolizaci (TAE).Výsledky:
Mortalita celého souboru byla nulová. U dvou nemocných (10,5 %) po chirurgické operaci byl přítomný hematom v resekční ploše, který spontánně regredoval. U tří nemocných (16,7 %) po TAE byl výkon komplikován postembolizačním syndromem. V intervalu 1−4 let po TAE došlo u 2 (28,8 %) nemocných k dalšímu růstu hemangiomu, u 6 nemocných (37,5 %) došlo k regresi velikosti a u 7 (43,8 %) je nález stacionární.Závěr:
U většiny hemangiomů lze postupovat konzervativně, především tam, kde se jedná o hemangiomy malé, asymptomatické. U gigantických symptomatických nebo rostoucích hemangiomů s průměrem větším 10 cm, nebo tam kde není diagnostická jistota, že se jedná o hemangiom, je metodou první volby chirurgická léčba, kde doporučujeme enukleaci hemangiomu nebo neanatomickou resekci jater. U rizikových nemocných pro operační výkon je vhodná TAE, kterou je možné při růstu hemangiomu opakovat. Využití jiných metod, jako např. radiofrekvenční ablace, zatím čeká na širší klinické ověření.Klíčová slova:
hemangiomy jater – léčebné postupyÚVOD
Hemangiomy jater jsou nejčastější benigní nádory jater s incidencí od 0,4 do 20 %. Postihují všechny věkové skupiny s nejčastějším výskytem mezi 30.–50. rokem života. Ve výskytu dominuje ženské pohlaví v poměru 5 : 1 k mužům. Jejich etiologie není zcela objasněna, nicméně se jedná nejspíše o kongenitální cévní malformaci s vlivem ženských pohlavních hormonů. Asi třetina hemangiomů jater tvoří více jaterních ložisek. Většina hemangiomů jater je asymptomatická, nalezena náhodně při ultrasonografickém (USG), computerově tomografickém (CT) vyšetření nebo magnetické rezonanci (MR) břicha z jiných důvodů. Velké, tzv. gigantické hemangiomy (>4 cm) mohou zejména při velkých rozměrech (>10 cm) působit nemocnému různou formu potíží od břišního dyskomfortu, bolestí či tlaku v pravém horním kvadrantu břicha, zažívacích potíží při tlaku např. na žaludek nebo krvácení při jejich ruptuře. Cílem naší studie bylo na základě vlastních zkušeností a literárních údajů definovat kritéria, kdy jsou hemangiomy jater indikované k chirurgické léčbě.
METODA
V pětiletém období (2011−2016) jsme operační cestou nebo radiointervenčně řešili celkem 36 nemocných průměrného věku 55,3 roku (36,2–68,1). Poměr žen a mužů byl 3 : 1. 26,1 % žen užívalo hormonální antikoncepci. Indikací k intervenci byly u 34 (91,9 %) nemocných symptomatické gigantické hemangiomy s průměrem 6,7 cm (4,5–19,1 cm), u 3 (8,1 %) nemocných pak nejasný nález s podezřením na možný hepatocelulární karcinom (HCC). Symptomatologie byla podstatně častější, pokud průměr hemangiomu byl větší než 10 cm. 25 (69,4 %) nemocných mělo solitární lézi (Obr. 1), u 11 (29,7 %) nemocných se vyskytovaly vícečetné hemangiomy jater (Obr. 2). U vícečetných hemangiomů jsme řešili vždy jen hemangiomy největší s ohledem na bezpečný zbytkový objem jater (>40 %), malé hemangiomy jsme ponechali pro další sledování. U 15 nemocných (40,5 %) jsme provedli enukleaci hemangiomu (Obr. 3), u 3 (8,1 %) neanatomickou resekci (z toho u 1 pro nejasný diagnostický závěr s podezřením na HCC), u jednoho (2,7 %) levostrannou jaterní lobektomii a u 2 nemocných (5,4 %) jen explorativní laparotomii. Jednalo se o nemocné s podezřením na HCC, kde peroperační nález potvrzený ultrasonografií s využitím kontrastní látky potvrdil hemangiom o průměru 4,5 a 4,7 cm. U 16 (43,2 %) nemocných jsme provedli transarteriální embolizaci (TAE), kterou jsme indikovali z důvodů především centrální lokalizace hemangiomu s intimním vztahem k jaterním žilám a portálnímu řečišti (Obr. 4). Dalším důvodem byla i skutečnost, že někteří nemocní odmítli chirurgickou intervenci a zvolili TAE. Nemocní byli dále sledováni v jaterní poradně v intervalu 1, 3, 6 a 12 měsíců v prvním roce a poté při stacionárním nálezu 1x za rok s využitím USG (Tab. 1, 2).
1. Magnetická rezonance jater – gigantický solitární hemangiom jater s průměrem 19,1 cm řešený enukleací Fig. 1: Magnetic resonance imaging of the liver – solitary giant liver hemangioma (19.1 cm in diameter) managed using enucleation 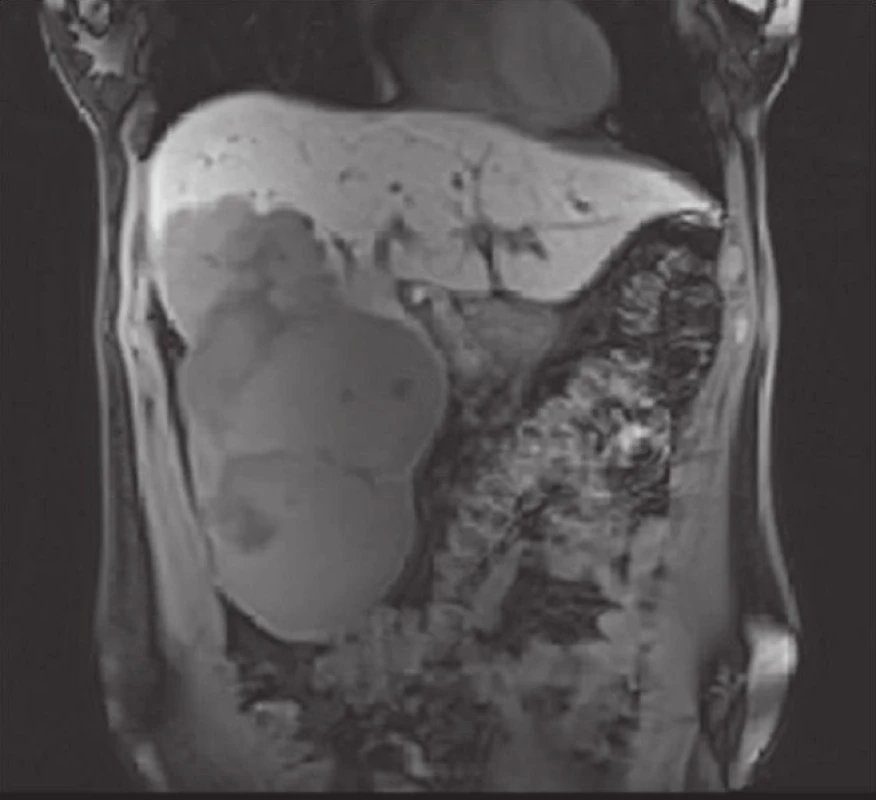
2. Magnetická rezonance jater – gigantické hemangiomy jater (14,9 a 9,2 cm) řešené enukleací Fig. 2: Magnetic resonance imaging of the liver – giant liver hemangiomas (14.9 and 9.2 cm) managed using enucleation 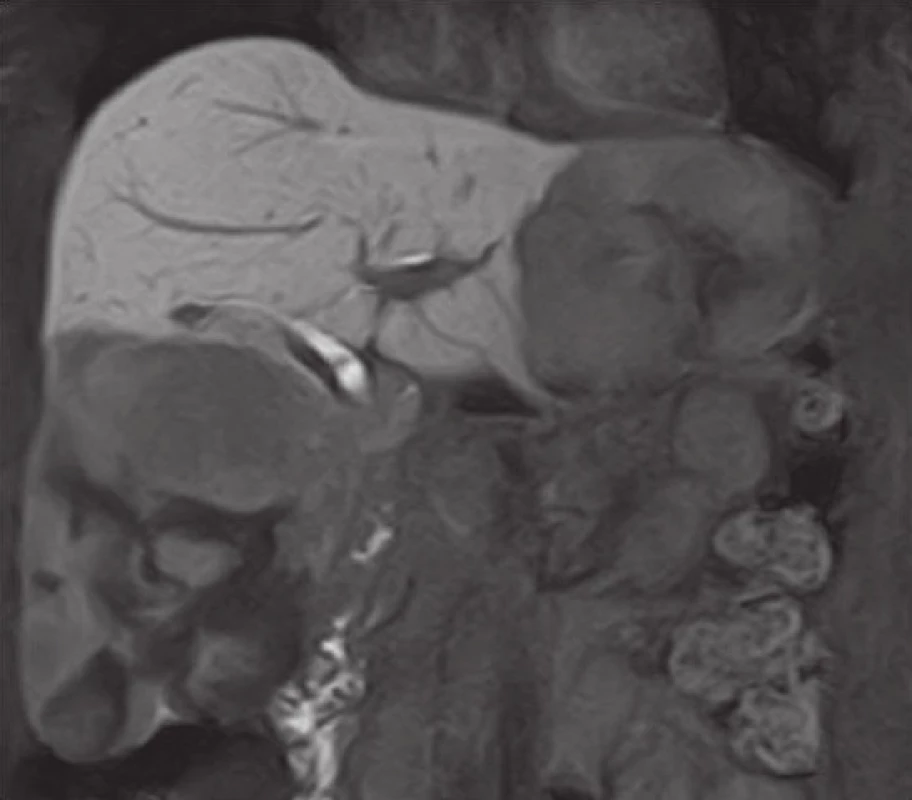
3. Gigantický kavernózní hemangiom jater – peroperační snímek Fig. 3: Giant cavernous liver hemangioma – peroperative photo 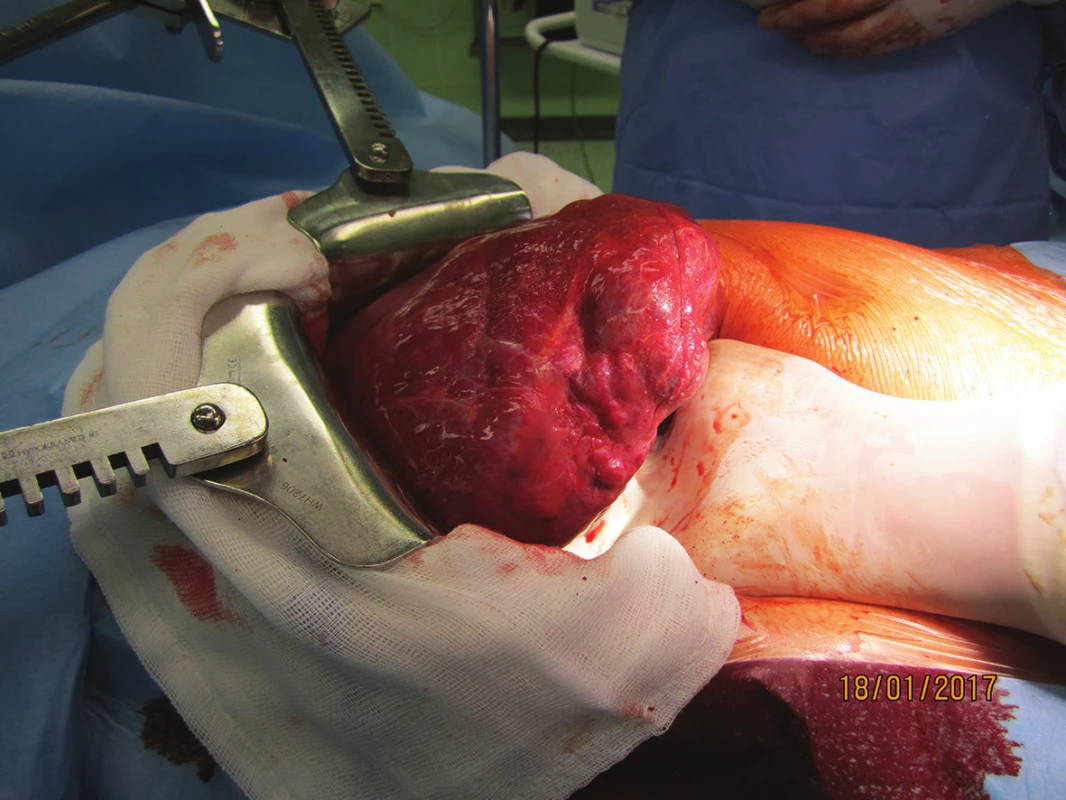
4. Transarteriální embolizace gigantického hemangiomu o průměru 13 cm pravého laloku jater směsí Histoacryl-Lipiodol (1:10) Fig. 4: Transarterial embolization of a giant hemangioma (13 cm in diameter) of the right liver lobe using the Histoacryl-Lipiodol mixture (1:10) 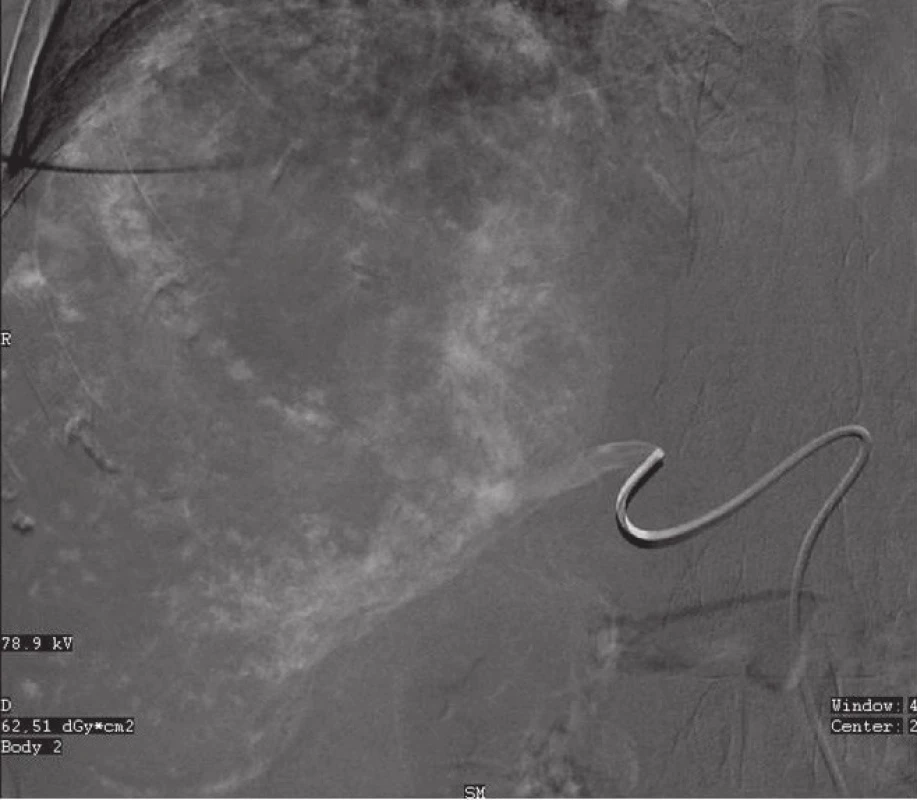
1. Soubor nemocných (2011–2016) Tab. 1: Group of patients (2011–2016) 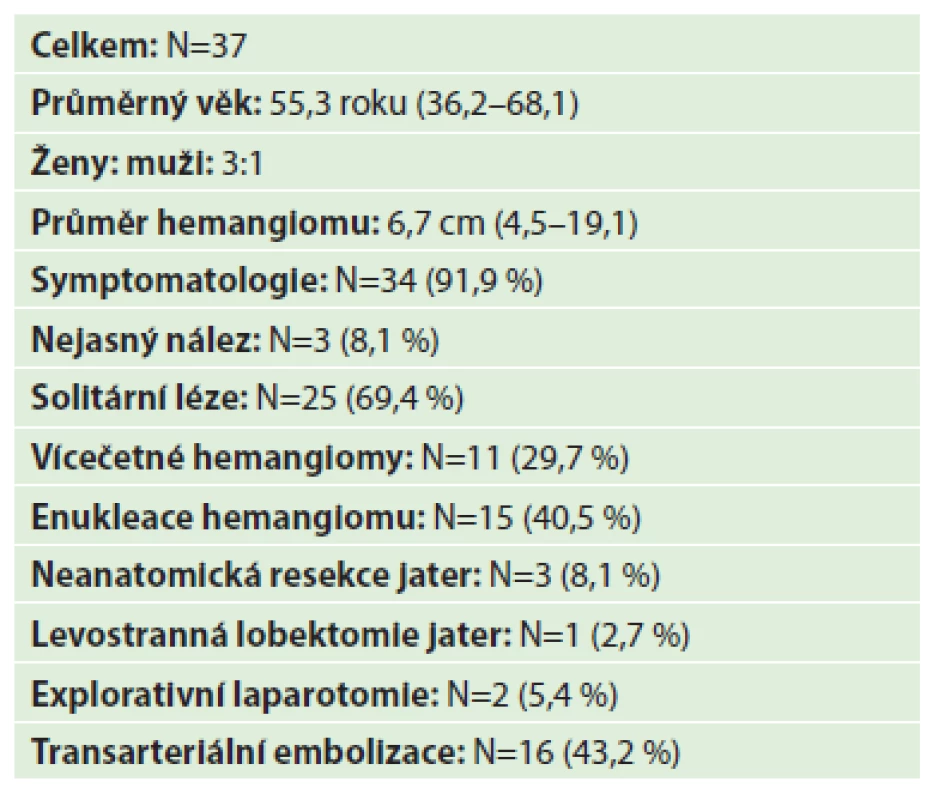
2. Výsledky (N=37) Tab. 2: Results (N=37) 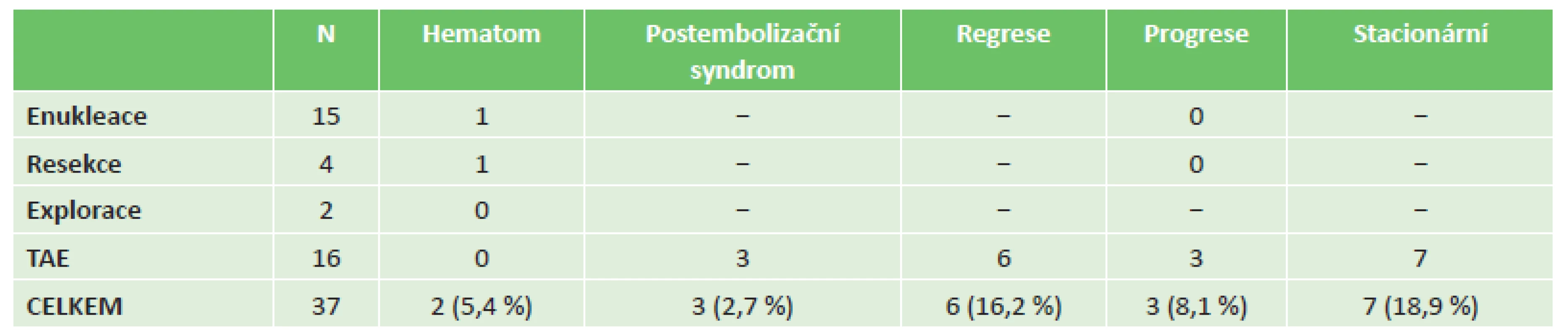
VÝSLEDKY
V souvislosti s výkonem nezemřel žádný nemocný. U dvou nemocných (11,1 %) po chirurgickém výkonu (1x enukleace, 1x resekce) byl přítomný hematom v místě operačního zásahu, který spontánně regredoval. U 3 nemocných po TAE (28,8 %) byl výkon komplikován postembolizačním syndromem, který po symptomatické léčbě odezněl během 4–5 dní. Při kontrolách v intervalu 1−4 let nedošlo k žádné recidivě u nemocných po enukleaci nebo resekci hemangiomu. Po TAE došlo u 3 nemocných (28,8 %) k další progresi hemangiomu, u 6 nemocných (37,5 %) došlo k regresi velikosti a u 7 (43,8 %) je nález stacionární co do velikosti hemangiomu v porovnání s velikostí před TAE. U nemocných, u kterých došlo po TAE k růstu hemangiomu, jsme provedli opakovanou TAE s následnou regresí u dvou a stabilizaci velikosti hemangiomu u jednoho nemocného. Operační výkon po předchozí TAE vzhledem k výše uvedené lokalizaci hemangiomu jsme neprováděli. Pokud šlo o nemocné, kde byl proveden operační výkon v terénu vícečetných lézí s odstraněním léze hlavní, nedošlo v dalších letech po operaci k progresi žádného ze zbývajících ložisek. Průměrná doba hospitalizace nemocných po chirurgickém výkonu byla 8 dní, po TAE 4 dny.
DISKUZE
Hemangiomy jater jsou velmi časté benigní nádory jater. Z histopatologického hlediska jsou kavernózní hemangiomy jater nejčastějším typem a jsou tvořené množstvím velkých, dilatovaných cévních kaveren vystlaných jednou vrstvou endoteliálních buněk a obklopených fibrózním stromatem. Hemangiomy jater nemají žádný maligní potenciál a nejsou žádnou potenciální lézí pro rozvoj malignity typu hemangiosarkomu, jehož výskyt nemá s hemangiomem nic společného.
Z hlediska diferenciální diagnostiky je nutné odlišit jiné hypervaskulární jaterní nádory, jakými jsou hepatocelulární adenom, hepatocelulární karcinom, metastázy neuroendokrinních nádorů nebo renálního karcinomu a hemangiosarkom. USG, CT a MR jsou tři základní diagnostické metody s vysokou specificitou a senzitivitou při využití kontrastní látky, které umožňují se značnou přesností diagnostikovat hemangiomy jater. Jen v ojedinělých případech je diagnostika obtížná a u těchto nemocných je lépe odstranit nejasnou jaterní lézi operačně než se pokoušet o jaterní biopsii, která může končit závažným krvácením [1].
Pro klinickou praxi mají význam tzv. gigantické hemangiomy, které poprvé definoval Adam [2] jako léze o průměru větším 4 cm. Definice gigantického hemangiomu vznikla na základě symptomatologie, kdy právě hemangiomy s tímto průměrem mohou působit svému nositeli potíže. Nicméně řada prací zejména z poslední doby [3,4,5] poukazuje na skutečnost, že za gigantické hemangiomy by měly být považovány léze s průměrem větším než 10 cm. S tímto stanoviskem rovněž souhlasíme, neboť u těchto hemangiomů je větší pravděpodobnost rozvoje břišní symptomatologie (v 23−57 %) z důvodu napětí Glissonova pouzdra, krvácení (v 1 až 4 %), zažívacích potíží z tlaku na okolní orgány, dalšího progresivního růstu, rozvoje Kasabach-Merrittova syndromu (trombocytopenie, nízká hladina fibrinogenu, vysoká hladina fibrin degradačních produktů a mikroangiopatické hemolýzy). Progresivní růst hemangiomů je možný především u ženského pohlaví, kde Glinkova a kol. [6] prokázali, že u žen s hormonální léčbou je nárůst hemangiomů častější v porovnání s běžnou ženskou populací (33,7 versus 9,7 %). Hormonální antikoncepce podporuje především růst gigantických hemangiomů [7,8]. V našem souboru užívala antikoncepci čtvrtina žen. Jasný vztah hormonální antikoncepce a růstu hemangiomů není zatím potvrzen ani vyvrácen. Nicméně u žen s gigantickými hemangiomy, které užívají dlouhodobě antikoncepci, bychom měli, zejména u rostoucích hemangiomů, zvážit jako první krok léčby její vysazení. U velkých hemangiomů mohou přicházet epizody teplot se vzestupem zánětlivých laboratorních parametrů z důvodů trombóz s následným infarktem a nekrózou části hemangiomu [9].
Většina hemangiomů, včetně gigantických hemangiomů, je asymptomatická a nevyžaduje jakoukoli metodu léčby. Vzhledem k větší pravděpodobnosti jejich růstu s následným rozvojem symptomatologie mají být nemocní s těmito hemangiomy dispenzarizováni, kdy dostatečná je USG kontrola zkušeným sonografistou v intervalu jednoho roku, nebo dříve při vzniku symptomatologie. Obecnou shodou u většiny autorů je aktivní léčba u symptomatických hemangiomů [10,11,12]. Metodami aktivního léčebného postupu jsou chirurgická léčba – enukleace, resekce, TAE, transarteriální chemoembolizace (TACE), kombinace embolizačních technik s chirurgickou léčbou a dále metoda radiofrekvenční ablace (RFA).
Chirurgická léčba zahrnuje enukleaci ložiska nebo jeho resekci v okolním zdravém jaterním parenchymu. Z našich zkušeností jednoznačně upřednostňujeme enukleaci hemangiomu jater na Pringlově manévru. Enukleace má nižší procento krvácivých komplikací v porovnání s resekcí, pokud odstraňujeme hemangiom přísně podél jeho fibrózního pouzdra. Její další výhodou je šetření zdravého jaterního parenchymu, kratší operační čas a obecně nižší procento pooperačních komplikací. Tyto naše zkušenosti potvrzují i další autoři [13,14]. Nicméně je zapotřebí velké opatrnosti v případech, že hemangiom je v těsné souvislosti s hlavními cévními strukturami jaterního parenchymu nebo intimně naléhá na dolní dutou žílu. U těchto nemocných někteří autoři doporučují předoperační TAE a vlastní operační výkon pak provést s odstupem přibližně jednoho měsíce [15,16]. Důvodem tohoto etapového postupu je skutečnost, že hemangiom jater je živen arteriální krví s drenáží do portálního řečiště. Laparoskopické výkony jsou možné u hemangiomů lokalizovaných v oblasti 2. a 3. jaterního segmentu či v předních segmentech jater, v ostatních oblastech laparoskopickou enukleaci či resekci z hlediska krvácivých komplikací nedoporučujeme. Samozřejmostí je dostatečná erudice jaterního chirurga v laparoskopických operacích jater.
Samostatná TAE je výkonem, který nemá radikální potenciál. U řady nemocných dojde ke zmenšení hemangiomu na základě trombózy hlavních přívodných tepen, nicméně v dalším časovém období dochází u většiny nemocných k rozvoji nových zásobujících cév hemangiomu. TAE se provádí Seldingerovou technikou v místní anestezii přístupem z femorální tepny. Cílovou tepnou je tepna/ny zásobující hemangiom. Používají se různé typy embolizačních materiálů (gelatinová pěna, kovové spirálky, polyvinyl alkohol, etanol). Naše pracoviště má dobré zkušenosti s aplikací směsi Histoacryl (BBraun, Germany, Tuttlingen)-Lipiodol (Cedex, France, Rennes) v poměru 1 : 10. Někteří nemocní trpí po TAE tzv. postembolizačním syndromem, který vzniká na podkladě nekrózy v embolizovaném hemangiomu. Projevuje se bolestí v jaterní krajině, teplotou, nauzeou. Postembolizační syndrom zpravidla odezní do jednoho týdne [17,18]. Pokud v dalším sledování dochází k opětnému růstu hemangiomu, můžeme TAE opakovat.
Další metodou, která je uváděna v literatuře v léčbě gigantických symptomatických hemangiomů, je transarteriální chemoembolizace (TACE), která využívá pingyangmycin-lipiodolovou emulzi. Pingyangmycin je antimitotická a antimikrobiální látka, která se užívá v onkologické léčbě pro blokování syntézy DNA a štěpení DNA řetězce. U hemangiomů vede k porušení endotelové výstelky, zánětu a trombóze s následnou fibrotizací cévních kaveren. TACE tedy využívá jak ischemizace, tak výše uvedeného efektu v oblasti hemangiomu. Vedlejším účinkem jako u TAE může být postembolizační syndrom. Pokud jde o dlouhodobé výsledky, pak tyto jsou obdobné jako u TAE, neboť metoda nemá radikální efekt [19]. Naše pracoviště má bohaté zkušenosti s TACE u maligních nádorů jater, nicméně v léčbě symptomatických gigantických hemangiomů TACE nepoužíváme. Důvodem je, že hemangiom je benigní nádor nevyžadující onkologickou léčbu.
Radiofrekvenční ablace (RFA) je popisována především čínskými autory jako metoda volby. Gao a kol. takto řešili 124 hemangiomů o průměru 9,1±3,2 cm [20]. Kompletní ablaci dosáhli u 95,2 % nemocných. Výkon prováděli laparoskopicky z důvodů dokonalé vizualizace především naléhajících orgánů a v řadě případů nutnosti současné cholecystektomie, pokud hemangiom souvisel s oblastí lůžka žlučníku. Navíc kapnoperitoneum významně snižuje tok krve v portálním řečišti, čímž se zvyšuje i efekt RFA. Nicméně problémem může být delší doba nutná k RFA gigantického hemangiomu jednak z hlediska velikosti a jednak z hlediska ochlazování RFA sondy proudem krve („heat sink“ efekt) v hemangiomu s možnou celkovou odezvou organismu (hypertermie), což autoři řešili přerušením výkonu a v odstupu několika dní pak dokončením ablace hemangiomu perkutánní cestou. Z tohoto důvodu Ji a kol. využili TAE před RFA ke snížení průtoku krve hemangiomem [21]. Tato metoda je stále diskutabilní především z hlediska perioperačních komplikací a na konečné zhodnocení budeme muset ještě počkat.
ZÁVĚR
Závěrem můžeme konstatovat, že u většiny hemangiomů lze postupovat konzervativně, především tam, kde se jedná o hemangiomy malé, asymptomatické. U gigantických symptomatických nebo rostoucích hemangiomů s průměrem větším 10 cm nebo tam, kde není diagnostická jistota, že se jedná o hemangiom, je metodou první volby chirurgická léčba, kde doporučujeme enukleaci hemangiomu nebo neanatomickou resekci ložiska. U nemocných z různých důvodů rizikových pro chirurgickou léčbu (např. celkový stav, lokalizace hemangiomu) nebo u těch, kteří si chirurgickou léčbu nepřejí, doporučujeme provést TAE, kterou je možné při dalším růstu hemangiomu opakovat. Tuto metodu je možné také s výhodou využít v první době před enukleací nebo resekcí hemangiomu. Metoda TACE s použitím látky zasahující do struktury DNA nemá z našeho pohledu opodstatnění v léčbě benigních jaterních lézí. RFA je v této oblasti možnou léčebnou metodou, nicméně bude ještě zapotřebí přesně definovat kritéria jejího použití především z hlediska možných komplikací.
Práce vznikla v rámci projektu PROGRES LF v Plzni, UK v Praze.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
prof. MUDr. Vladislav Třeška, DrSc.
U Českého dvora 11
326 00 Plzeň
e-mail: treska@fnplzen.cz
Sources
1. Bajenaru N, Balaban V, Savulescu F, et al. Hepatic hemangioma – review. Journal of Medicine and Life 2015;8 : 4−11.
2. Adam YG, Huvos AG, Fortner JG. Giant hemangiomas of the liver. Ann Surg 1970;172 : 239−45.
3. Di Carlo I, Koshy R, Al Mudares S, et al. Giant cavernous liver hemangiomas: is it the time to change the size categories? Hepatobiliary Pancreat Dis Int 2016;15 : 21−9.
4. Fu XH, Lai EC, Yao XP, et al. Enucleation of liver hemangiomas: is there a difference in surgical outcomes for centrally or peripherally located lesions? Am J Surge 2009;198 : 184−7.
5. Zhang W, Huang ZY, Ke ChS, et al. Surgical treatment of giant liver hemangioma larger than 10cm: A single center´s experience with 86 patients. Medicine 2015;94 : 1−8.
6. Glinkova V, Shevah O, Boaz M, et al. Hepatic haemangiomas: possible association with female sex hormones. Gut 2004;53 : 1352−5.
7. Moctezuma-Velázquez C, López-Arce G, Martínez-Rodríguez LA, et al. Giant hepatic hemangioma versus conventional hepatic hemangioma: clinical findings, risk factors, and management. Rev Gastroenterol Mex 2014;79 : 229−37.
8. La Vecchia C, Tavani A. Female hormones and benign liver tumours. Dig Liver Dis 2006;38 : 535−6.
9. Schnelldorfer T, Wave AL, Smoot R, et al. Management of giant hemangioma of the liver: resection versus observation J Am Coll Surg 2010;211 : 724−30.
10. Skalicky T, Treska V, Sutnar A, et al. Surgical treatment of benign liver tumours--indications and results. Zentralbl Chir 2009;134 : 141−4.
11. Třeška V, Ferda J, Skalický T, et al. Hemangiomy jater – diagnostika a léčba. Rozhl Chir 2007;86 : 28−31.
12. Hoekstra LT, Bieze M, Erdogan D, et al. Management of giant liver hemangiomas: an update. Expert Rev Gastroenterol Hepatol 2013;7 : 263−8.
13. Singh RK, Kapoor S, Sahni P, et al. Giant haemangioma of the liver: is enucleation better than resection? Ann R Coll Surg Engl 2007;89 : 490−3.
14. Choi J, Lee YJ, Hwang DW, et al. Surgical treatment of giant hemangiomas: technical point of view. Am Surg 2011;77 : 48−54.
15. Vassiou K, Rountas H, Liakou P, et al. Embolization of a giant hepatic heamangioma prior to urgent liver resection. Case report and review of the literature. Cardiovasc Intervent Radiol 2007;30 : 800−2.
16. Firouznia K, Ghanaati H, Alavian SM, et al. Management of liver hemangioma using trans-catheter arterial embolization. Hepat Mon 2014; 14:e 25788.
17. Kayaalp C, Sabuncuoglu MZ. Embolization of liver hemangiomas. Hepat Mon 2015;15:e30334.
18. Malagari K, Alexopoulou E, Dourakis S, et al. Transarterial embolization of giant liver hemangiomas associated with Kasabach-Merritt syndrome: a case report. Acta Radiol 2007;48 : 608−12.
19. Li Y, Jia Y, Li S, et al. Transarterial chemoembolization of giant liver hemangioma: A multi-center study with 836 cases. Cell Biochem Biophys 2015;73 : 469−72.
20. Gao J, Ji JS, Ding XM, et al. Laparoscopic radiofrequency ablation for large subcapsular hepatic hemangiomas: Technical and clinical outcomes. PLOS one 2016. Available from: http://dx.doi.org/10.1371/journal.pone.0149755.
21. Ji J, Gao J. Zhao L, et al Computed tomography-guided radiofrequency ablation following transcatheter arterial embolization in treatment of large hepatic hemangiomas. Medicine 2016;15 : 1−5.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 4-
All articles in this issue
- Ureterointestinal anastomosis in urinary diversion – current opinion
- Liver hemangiomas – when is invasive treatment indicated?
- Treatment of pelvic avulsion fractures in children and adolescents
- Solid pseudopapillary neoplasms of the pancreas
- Polymastia in unusual localization during pregnancy
- Two-stage surgical treatment of inferior vena cava traumatic rupture including urgent transport to a specialized unit
- Liver resection for recurrent sarcoma with allogenic aortic patch as partial inferior vena cava replacement – case report and review of literature
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Liver hemangiomas – when is invasive treatment indicated?
- Treatment of pelvic avulsion fractures in children and adolescents
- Solid pseudopapillary neoplasms of the pancreas
- Polymastia in unusual localization during pregnancy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

