-
Medical journals
- Career
Léčba lokoregionálně pokročilého karcinomu rekta − je čas na změnu?
: R. Soumarová 1,2,3; M. Škrovina 4
: Oddělení radioterapie a onkologie, Komplexní onkologické centrum Nový Jičín, Nemocnice Nový Jičín, a. s. vedoucí centra: doc. MUDr. R. Soumarová, Ph. D., MBA 1; Katedra interních oborů LF Ostravské univerzity vedoucí katedry: MUDr. I. Valkovský, Ph. D. 2; Onkologické oddělení, Vzdělávací a výzkumný institut Agel, o. p. s. – pobočka Nový Jičín, Nemocnice Nový Jičín, a. s. primář: doc. MUDr. R. Soumarová, Ph. D., MBA 3; Oddělení chirurgie, Komplexní onkologické centrum Nový Jičín, Nemocnice Nový Jičín, a. s. primář: MUDr. M. Škrovina, Ph. D. 4
: Rozhl. Chir., 2017, roč. 96, č. 10, s. 415-420.
: Review
Léčba lokálně pokročilého karcinomu rekta je stále velmi aktuální téma. Metodou volby je chirurgický výkon doplněný před nebo pooperační chemoradioterapií. Přínos předoperační chemoradioterapie byl prokázán v řadě randomizovaných studií, stejně tak jako její výhody ve srovnání s pooperační léčbou. V současné době se však objevují práce, ve kterých je neoadjuvantní chemoradioterapie nahrazována pouze chemoterapií bez radioterapie. Velmi kontroverzním tématem je vynechání operace u pacientů po neoadjuvantní chemoradioterapii, kteří dosáhli kompletní remise. Diskuze se vedou i ohledně nutnosti použití adjuvantní chemoterapie po radikální operaci a neoadjuvantní chemoradioterapii. Všechny tyto okruhy budou v naší práci probrány, i když jsme si vědomi, že ne zcela vyčerpávajícím způsobem. Pokusíme se tak odpovědět na otázku, zda je již čas na některé změny v léčebné strategii pokročilého kolorektálního karcinomu.
Klíčová slova:
lokálně pokročilý karcinom rekta − neoadjuvantní chemoradioterapie − indukční chemoterapieÚvod
Rizikové a epidemiologické faktory vzniku karcinomu rekta jsou relativně známé a v literatuře hojně popisované [1]. I přes existující screeningové programy se stále v současné době často setkáváme s již lokálně pokročilými či generalizovanými nádory. Základní léčbou lokalizovaných nádorů rekta je radikální chirurgický výkon, který má kurativní charakter. Lokálně pokročilé nádory, které můžeme definovat dle TNM klasifikace jako nádory v rozsahu T3, T4 nebo N+, je vhodné léčit již kombinací chirurgického výkonu s radioterapií (RT), což vede k lepší lokální kontrole onemocnění i zlepšenému přežití ve srovnání se samotným chirurgickým výkonem [2,3]. Pro stanovení optimální strategie léčby je velmi důležité zjištění přesného rozsahu onemocnění, ke kterému se využívají transrektální sonografie, magnetická rezonance (MRI) a CT, event. pozitronová emisní tomografie v kombinaci s CT (PET/CT). Do popředí se dostávají i nové zobrazovací metody, jako např. multiparametrická dynamická MRI. Každá z uvedených stagingových metod má svou specificitu a senzitivitu a je vhodná buď pro určení rozsahu postižení střevní stěny (T klasifikace), nebo určení postižení lymfatických uzlin (N klasifikace) či vyloučení vzdálené diseminace (M klasifikace).
Neoadjuvantní léčba
V případě lokálně pokročilého karcinomu rekta bylo několika randomizovanými studiemi prokázáno, že výsledky konkomitantní, tedy současně podávané chemoradioterapie (CHT/RT), jsou ve srovnání se samostatnou radioterapií lepší [4]. K těm nejvýznamnějším patří EORTC studie fáze III, která srovnávala samostatnou radioterapii a radioterapii s podáním chemoterapie (CHT) v podobě bolusového 5-fluorouracilu s leukovorinem (FUFA) v 1. a 5. týdnu léčby zářením. V rameni s CHT bylo statisticky významně vyšší procento kompletních patologických odpovědí (pCR), což je pro další prognózu pacienta velmi důležité [5,6].
Cílem neoadjuvantní konkomitantní chemoradioterapie je dosažení zmenšení nádoru (downstagingu a downsizingu), zlepšení operability a zlepšení lokální kontroly onemocnění. Velmi diskutovaným přínosem této léčby je i zvýšení sfinkter šetřících operací u nízce sedících nádorů. Dle některých studií je tento přínos statisticky signifikantní, dle jiných tomu tak není. Velká německá studie (CAO/ARO/AIO–94) srovnávala použití konkomitantní CHT/RT před a po operaci [7]. Sfinkter šetřící operace se při předoperačním podání provedla v 39 % vs. 19 %, k pozdnímu zúžení anastomózy došlo ve 3 % vs. 9 %, lokální recidiva se objevila v 7 % vs. v 11 %. Akutní toxicita léčby stupně 3 a 4 byla též nižší u neoadjuvantní konkomitantní CHT/RT (27 % vs. 40 %), stejně jako toxicita pozdní (14 % vs. 24 %). Vzdálená diseminace ale byla v obou skupinách srovnatelná (34 % vs. 36 %), stejně jako celkové přežití (76 % vs. 74 %).
Neoadjuvantní léčbu je také možné potencovat intraoperační radioterapií (IORT), která umožní eskalaci dávky bez zvýšení ozáření okolních zdravých tkání, zejména kliček střevních, které jsou během aplikace záření mimo ozařované pole [8,9].
Nejběžněji používaným cytostatikem v neoadjuvantní indikaci u karcinomu rekta je 5-fluorouracil (5–FU), který se v kombinaci s leukovorinem podává již od poloviny devadesátých let [10,11]. Kontinuální podání 5-fluorouracilu je z hlediska toxicity výhodnější než podání bolusové, ale má nevýhodu v nutnosti hospitalizace či inzerci centrálního žilního přístupu, což má negativní vliv na kvalitu života onkologických pacientů [12,13]. Kontinuální aplikaci 5-fluorouracilu imituje denní perorální užití kapecitabinu (Xeloda; Hoffmann–LaRoche, Inc., Nutley, NJ). Ve studiích je prokázána stejná účinnost kapecitabinu jako 5-FU v počtu pCR (tedy nepřítomnosti nádorových buněk v definitivním histopatologickém preparátu) a dosažení chirurgického downstagingu [14,15].
Snahy o intenzifikaci chemoradioterapie s použitím kombinovaných režimů zatím nebyly příliš úspěšné. V randomizované studii fáze IIIACCORD 12 byla srovnávána RT s kapecitabinem s režimem RT/XELOX [16]. V rameni s oxaliplatinou byla zaznamenána signifikantně vyšší toxicita stupně 3 a 4 (25 v 1 %; P<0,001). Patologická kompletní odpověď (pCR) byla v rameni s kapecitabinem 13,9 %, s oxaliplatinou 19,2 % (P=0,09). Ani studie NSABP R-04 nepotvrdila zlepšení výsledků s přidáním oxaliplatiny, ale pouze zvýšení toxicity – zejména signifikantní zvýšení incidence průjmů stupně 3−4 [17]. Nicméně na základě výše uvedených dat je ke zvážení aplikace kapecitabinu s oxaliplatinou v konkomitanci s RT u velmi lokálně pokročilých nádorů T3, resp. T4, kde výstupem by mělo být usnadnění resekability [18].
Neoadjuvantní radioterapie je nejčastěji aplikována v pětitýdenním režimu. Tzv. krátký kurz radioterapie v délce jednoho týdne je u některých skupin pacientů alternativou tohoto postupu. Dlouhodobé výsledky dánské studie ukázaly, že desetileté přežití bylo signifikantně zlepšeno ve skupině s předoperační krátkou RT ve srovnání se samostatným chirurgickým výkonem [19].
Polská studie srovnávající krátkou RT s dlouhým kurzem nenalezla rozdíly v přežití ani v lokální kontrole [20]. Design studií se však měnil a ke krátkému režimu RT byla přidávána CHT. Další polská studie po RT zařadila konsolidační CHT v režimu FOLFOX4, do dlouhého režimu RT s CHT (FUFA) byla také přidána oxaliplatina týdně [21]. Tříleté přežití bylo signifikantně lepší v rameni s krátkou RT a CHT (73 % vs. 65 %), kde byla zaznamenána i nižší akutní toxicita.
Studií srovnávající tzv. krátký a dlouhý režim je v současnosti dokončena již celá řada. Kromě dříve uvedené polské studie je nutné zmínit švédskou studii Stockholm III, ve které bylo dosaženo největší regrese nádoru v rameni s odloženou operací ve srovnání s operací provedenou ihned po skončení RT.
Studie transtasmánské skupiny TROG randomizovala pacienty do dvou ramen: krátký kurz RT nebo konkomitantní CHT/RT ve standardním pětitýdenním režimu. Po operaci pacienti absolvovali adjuvantní CHT [22]. V rameni s konkomitantní CHT/RT byla dosaženo pCR v 15 %, v krátkém rameni pouze v 1 %! Downstagingu bylo dosaženo v dlouhém režimu v 45 %, v krátkém v 28 %, což bylo statisticky signifikantní. Celkové přežití i výskyt lokální recidivy po třech letech však byly stejné.
Na kongresu ASTRO v roce 2016 byly zveřejněny první výsledky studie STELLAR čínských autorů. Pacienti s lokálně pokročilým karcinomem rekta byli léčeni ve dvou skupinách – krátký kurz RT (5x5 Gy) s indukční CHT v režimu CAPOX a následnou operací a ve skupině s konkomitantní CHT/RT (s kapecitabinem). Po operaci byla dokončena CHT do celkového počtu 6 cyklů. Ve skupině s krátkou RT a CHT byla popsána pCR u 25,7 % pacientů, ve druhé skupině pouze u 7,9 %. Akutní toxicita stupně 3−4 byla signifikantně vyšší ve skupině s krátkou RT (28,4 % vs. 5,2 %). Perioperační komplikace byly v obou skupinách podobné [23]. Metaanalýza srovnávající krátký kurz RT s okamžitou operací s dlouhým režimem CHT/RT a odloženou operací (zařazeno bylo 12 studií) nepotvrdila signifikantní rozdíl v celkovém přežití, DFS, lokální kontrole, DMR, prezervaci sfinkteru, dosažení R0 resekce ani v pozdní toxicitě. Dlouhý režim však dosahoval vyššího procenta pCR, ale měl i vyšší akutní toxicitu [24].
Neoadjuvantní radioterapie je zatížena relativně vyšší toxicitou, zejména ve smyslu ovlivnění anorektální funkce [25], proto u některých pacientů právě na základě velmi kvalitního a přesného stagingu je možné indikovat primární chirurgický výkon s následnou chemoterapií. Jedná se o nádory rekta v rozsahu T3 lokalizované ve vzdálenosti 10 cm a více od anu, bez postižení lymfatických uzlin či pozitivity cirkumferenčního resekčního okraje (CRM) dle MRI. Avšak retrospektivní studie ukázala, že až 22 % pacientů s uzlinami hodnocenými předoperačně jako negativní mělo dle definitivního patologického vyšetření uzliny pozitivní [26]. Toxicita radioterapie je také důvodem pro použití samostatné chemoterapie. Na druhou stranu ke snížení nežádoucích účinků radioterapie může přispět přesná definice cílového objemu na základě moderních zobrazovacích metod či nové techniky radioterapie, jako např. technika intenzitně modulované RT (IMRT).
V doporučení NCCN (verze 2.2017) se objevuje aplikace indukční chemoterapie před neoadjuvantní chemoradioterapií [27]. V několika menších studiích byla použita indukční chemoterapie v režimu CapeOX nebo FOLFOX s následnou chemoradioterapií s poměrně dobrou tolerancí i výsledky [28,29]. Smyslem tohoto postupu je časná eradikace mikrometastáz, vyšší počet pCR, pravděpodobnost větší resekability tumoru. Řada studií též zkoušela v neoadjuvantním podání zařadit biologickou léčbu, ať s cetuximabem, panitumabem, nebo bevazicumabem. Zvýšení odpovědi na léčbu bylo většinou spojeno se zvýšením toxicity léčby [30,31].
V případě neoadjuvantní léčby je zcela zásadní na základě stagingových vyšetření dobře selektovat pacienty vhodné k neoadjuvantní konkomitantní chemoradioterapii. Alternativou je u určité skupiny pacientů použití krátkého kurzu radioterapie. Předmětem dalších studií je samostatná chemoterapie v neoadjuvantním či indukčním podání. Zcela zásadní je multidisciplinární zhodnocení a návrh optimální strategie léčby pro konkrétního pacienta.
Timing chirurgického výkonu
Optimální interval mezi dokončením neoadjuvantní léčby a provedením operace není přesně dán, přestože se tomuto tématu věnuje také celá řada nových studií. Studie GRECCAR 6 randomizovala pacienty po dokončení chemoradioterapie v délce 5,5 týdne do ramene s operací po 7 týdnech a s operací po 11 týdnech. Patologická kompletní odpověď byla v prvním rameni dosažena u 15 % pacientů, v druhém v 17 %. V obou skupinách byl podobný stupeň dehiscence anastomózy. Komplikovanější hojení perinea bylo u pacientů po abdominoperineální amputaci ve skupině po 11 týdnech (u 43 % pacientů versus u 17 %) [32].
Dle NCCN 2.2017 je udáván možný interval pro provedení operace mezi 5 a 12 týdny [27]. Delší interval je spojen s větší pravděpodobností patologické kompletní odpovědi. Není však jednoznačné, zda z toho vyplývá i větší klinický benefit; některé práce prokazují zlepšení přežití bez nemoci [33].
Švédská skupina ve studii Stockholm III sledovala tři ramena léčby: krátký kurz RT s operací po 4−8 týdnech, dlouhý režim s operací po 4−8 týdnech a krátký režim s okamžitou operací. Rozdíly v pooperačních komplikacích nebyly statisticky signifikantní. Avšak největší patologické regrese bylo dosaženo v rameni s odloženou operací [34,35].
Metaanalýza 15 retrospektivních studií s 4431 pacienty z roku 2015 ukázala, že největší šance na dosažení pCR je po provedení neoadjuvantní konkomitantní CHT/RT s operací po 7–8 týdnech [36]. Další metaanalýza (zařazeno bylo 13 studií s 3584 pacienty) se zabývá vlivem delšího intervalu než 6−8 týdnů mezi neoadjuvantní konkomitantní CHT/RT a operací [37]. Delší interval znamenal zvýšení pCR o 6 % procent s podobnými onkologickými výsledky a komplikacemi.
Pro rozlišení těch pacientů, kteří odpovídají dobře na neoadjuvantní léčbu, čili jsou dobrými respondéry, a těmi špatnými existuje několik v poslední době diskutovaných metod. Patří k nim např. použití dynamické magnetické rezonance [38]. Patří k nim také vyšetřování celé řady prediktivních biomolekulárních markerů, např. protein BCL2, mikroRNA 31 apod. [39,40]. Zda bude jejich detekce součástí rutinních postupů hodnotících dopad na načasování chirurgického výkonu či prognózu nemocných, bude předmětem dalších studií.
Pro správné načasování chirurgického výkonu je nutný individuální přístup. U pacientů, kde je potřeba dosažení downstagingu, zvláště u těch, kde by bylo nutné provedení abdominoperinální amputace, je vhodné zvolení neoadjuvantní CHT/RT s operací po 7 až 8 týdnech.
Adjuvantní léčba
Prognosticky důležitá se zdá odpověď na neoadjuvantní léčbu. Dobrá odpověď hodnocená pomocí tzv. regresního skóre (TRG) se jeví dlouhodobě prognosticky příznivější. To může souviset i s možným vytipováním skupiny pacientů, kteří budou mít přínos z adjuvantní léčby [41]. Analýza podskupiny pacientů (ve studii EORTC 22921) s nádory hodnocenými po neoadjuvantní léčbě jako ypT0-2 ypN0 ukázala, že právě tito pacienti dobře odpovídající na neoadjuvantní léčbu mají větší benefit z následné adjuvantní chemoterapie [42].
Také korejská studie publikovaná v roce 2015 zkoumala přínos adjuvantní chemoterapie u pacientů s nádory středního a dolního rekta po předoperační chemoradioterapii klasifikovanými jako ypT0-2 ypN0[43]. Ze zařazených cca 1000 pacientů 10 % nemělo adjuvantní CHT, ve druhé skupině chemoterapie aplikována byla. Na rozdíl od předchozí práce však nebyl nalezen rozdíl v pětileté lokální kontrole ani diseminaci onemocnění v obou skupinách. Přínos adjuvantní chemoterapie proto dle autorů není jasný a indikace by měla být velmi pečlivě zvažována.
Metaanalýza z roku 2015 hodnotila přínos adjuvantní chemoterapie na bázi 5-fluorouracilu po neoadjuvantní chemoradioterapii [44]. Zahrnovala 1196 pacientů stadia II a III. Nenalezla signifikantní rozdíl v celkovém přežití mezi těmi, kteří měli nebo neměli adjuvantní chemoterapii ve všech podskupinách. Adjuvantní CHT nezlepšila ani přežití bez nemoci.
Podobnou metaanalýzu publikoval v roce 2015 také Bujko [45]. Zde bylo zařazeno 5 randomizovaných studií s 2398 pacienty. Ani zde nebyl prokázán přínos adjuvantní chemoterapie s nebo bez oxaliplatiny na celkové přežití a přežití bez nemoci.
Adjuvantní chemoterapie po radikálním operačním výkonu je zvažována u všech pacientů původně s lokálně pokročilým karcinomem rekta. Její indikace však není podložena silnými daty.
Vynechání operace (watch and wait)
Dalším přístupem, který se snaží o snížení dopadů léčby na kvalitu života pacientů, je tzv. watch and watt přístup. Základem je velmi kvalitní diagnostika založená na moderních zobrazovacích metodách včetně již zmiňované multiparametrické dynamické rezonance. U pacientů, kteří dosáhli klinické kompletní odpovědi (cCR) po neoadjuvantní chemoradioterapii, je možné dle některých autorů vynechat chirurgický výkon. Tato strategie vychází ze studie profesorky Habr-Gamy z roku 2004, která vyvolala velký ohlas i velkou diskuzi [46]. Výsledky a úvaha o možnosti vynechání operace vycházejí mimo jiné i z nutnosti velmi pečlivého sledování pacienta, u kterého je v případě lokální recidivy indikován radikální chirurgický výkon. U 31 % takto sledovaných pacientů se objevila lokální recidiva, v polovině případů do 12 měsíců po úvodní léčbě, přičemž salvage terapie byla možná ve více než 90 % případů s 94% lokální kontrolou [47]. Závěry této skupiny potvrzují již i některé další analýzy, které sdílejí názor, že u pacientů s kompletní regresí po neoadjuvantní léčbě je možno vyhnout se chirurgické resekci bez zhoršení celkových výsledků léčby.
V lednu 2017 na konferenci o gastrointestinálních nádorech v San Franciscu byla dr. Van Der Valkem z Holandska prezentována data z velké mezinárodní observační databáze (International Watch and Wait Database Consortium). Ta ukázala, že u pacientů v klinické kompletní remisi není vynechání chirurgického výkonu horším postupem. Asi u 20 % nemocných s nádorem rekta stadia T2−4 po neoadjuvantní chemoradioterapii dochází ke kompletní remisi. Zatím není běžné, že po provedení neoadjuvantní léčby je provedeno přehodnocení, zda je chirurgický výkon potřeba. Z uvedené databáze lze zjistit, že 3leté přežití u pacientů, kteří podstoupili watch and wait, bylo 91 %, což je podobné jako u pacientů podstupujících chirurgii. Nežádoucí účinky a komplikace, jako jsou kolostomie, močové a sexuální problémy, jsou však nižší. Do databáze založené v roce 2014 přispívá 35 institucí v 11 zemích. Analýza zahrnovala 802 pacientů bez známek reziduálního tumoru po indukční léčbě. Pečlivé sledování v prvních dvou letech sestávalo každé tři měsíce z provedení endoskopie, MRI a klinického vyšetření. Strategie watch and wait je používána zatím u méně než 5 % pacientů. S mediánem sledování 2,6 roku asi u 25 % pacientů byl proveden odložený chirurgický výkon pro lokální recidivu. Vzdálené metastázy se objevily u 7 %. Dr. van der Valk současně uvedl, že navzdory excelentním výsledkům se jedná o osobní rozhodnutí každého pacienta. Některý se chce vyhnout kolostomii, jiný preferuje chirurgický výkon před rizikem recidivy [48].
Na otázku, u jakého procenta pacientů s přístupem watch and wait a opětovným růstem nádoru je možná záchranná (salvage) operace, se snažila odpovědět metaanalýza z roku 2017 [49]. Do analýzy bylo zahrnuto pět retrospektivních a čtyři observační prospektivní studie s 370 pacienty, kteří byli léčeni dle protokolu watch and wait. Přibližně u třetiny pacientů (31,8 %) došlo k opětovnému růstu nádoru. Z nich u 83,8 % bylo možné provést salvage operaci. Onkologickou bezpečnost tohoto přístupu v hodnocení tříletého celkového přežití potvrzují i data z analýzy ve Velké Británii [50]. Naopak pouze „sledovaní“ pacienti měli lepší tříleté přežití bez kolostomie.
Provedení radikálního chirurgického výkonu je stále standardním postupem po neoadjuvantní léčbě. U vybrané skupiny pacientů s klinickou kompletní remisí a s vážnějšími komorbiditami je možné zvolit postup pečlivého sledování.
Závěr
Debata nad managementem pacientů s karcinomem rekta stále pokračuje. Dle současných doporučení je stále léčba lokálně pokročilého karcinomu rekta převážně trimodalitní. Standardem na poli chirurgie je totální mezorektální resekce. Radioterapie i chemoterapie jsou součástí multimodální léčby, která má snížit pravděpodobnost výskytu lokální recidivy a zlepšit celkové přežití. Neoadjuvantní radioterapie je standardem, avšak pokračuje diskuze o indikacích a využití tzv. krátkého kurzu RT či úplného vynechání RT u určité skupiny pacientů. Chemoterapie je také standardní součástí léčby, avšak není zcela jasné, v jakém složení a kdy ji použít, zda před, či po operaci. Diskutuje se také o kombinaci s tzv. biologickou léčbou či imunoterapií. Důležité je, jak již bylo zmíněno, také hodnocení odpovědi na léčbu během neoadjuvantního podání a dle výsledků volba dalšího postupu [51].
Čas na některé změny v zažité strategii se na základě nových dat blíží (Tab. 1). Možné algoritmy léčby jsou uvedeny ve Schématech 1 a 2.
1. Současná doporučení a možné změny v léčbě lokálně pokročilého karcinomu rekta Tab. 1: The current recommendations and possible changes in the treatment of locally advanced rectal cancer 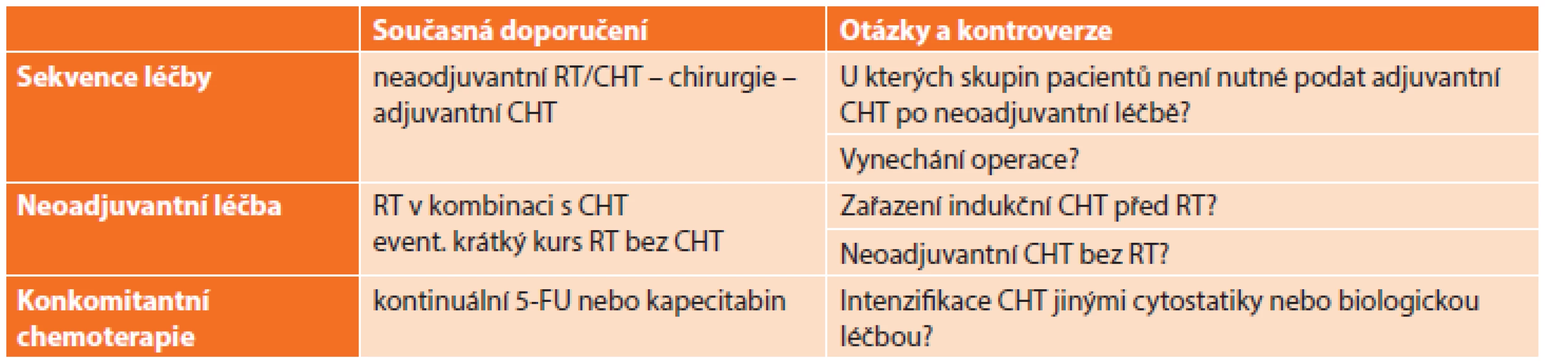
Schéma 1: Současný standard trimodalitní léčby lokálně pokročilého karcinomu rekta Schema 1: The current trimodality standard in the treatment of locally advanced rectal cancer 
Schéma 2: Alternativní strategie léčby lokálně pokročilého karcinomu rekta Schema 2: The alternative strategy in the treatment of locally advanced rectal cancer 
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
doc. MUDr. Renata Soumarová, Ph.D., MBA
vedoucí Komplexního onkologického centra Nový Jičín
Nemocnice Nový Jičín a.s.
Purkyňova 2138/16
741 01 Nový Jičín
e-mail: renata.soumarova@nnj.agel.cz
Sources
1. Janout V, Kollárová H. Epidemiology of colorectal cancer. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2001;145 : 5–10.
2. Camma C, Giunta M, Fiorica F, et al. Preoperative radiotherapy for resectable rectal cancer: A meta–analysis. JAMA 2000;284 : 1008–15.
3. Glimelius B, Isacsson U, Jung B, et al. Radiotherapy in addition to radical surgery in rectal cancer: Evidence for a dose–response effect favoring preoperative treatment. Int J Radiat Oncol Biol Phys 1997;37 : 281–7.
4. Rödel C, Grabenbauer GG, Schick C, et al. Preoperative radiation with concurrent 5–fluorouracil for locally advanced T4–primary rectal cancer. Strahlenther Onkol 2000;176 : 161–7.
5. Bosset JF, Calais G, Daban A, et al. Preoperative chemoradiotherapy versus preoperative radiotherapy in rectal cancer patients: assessment of acute toxicity and treatment compliance. Report of the 22921 randomised trial conducted by the EORTC Radiotherapy Group. Eur J Cancer 2004;40 : 219–24.
6. Bosset JF, Calais G, Mineur L, et al. Enhanced tumorocidal effect of chemotherapy with preoperative radiotherapy for rectal cancer: preliminary results–EORTC 22921. J Clin Oncol 2005;23 : 5620–7.
7. Sauer R, Becker H, Hohenberger W, et al. German Rectal Cancer Study Group. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004;351 : 1731–40.
8. Soumarova R, Skrovina M, Machala S, et al. Intraoperative radiotherapy in multimodality treatment of locally advanced rectal carcinoma. Rozhl Chir 2010;89 : 685−8.
9. Skrovina M, Soumarova R, Duda M, et al. Laparoscopic abdominoperineal resection with intraoperative radiotherapy for locally advanced low rectal cancer. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2014;158 : 447−50.
10. Bosset JF, Pavy JJ, Hamers HP, et al. Determination of the optimal dose of 5-fluorouracil when combined with low dose D, Lleucovorin and irradiation in rectal cancer: results of three consecutive phase II studies. EORTC Radiotherapy Group. Eur J Cancer 1993;29 : 1406–10.
11. Ng AK, Recht A, Busse PM. Sphincter preservation therapy for distal rectal carcinoma: a review. Cancer 1997;79 : 671–83.
12. Rich TA, Skibber JM, Ajani JA, et al. Preoperative infusional chemoradiation therapy for stage T3 rectal cancer. Int J Radiat Oncol Biol Phys 1995;32 : 1025–29.
13. Grann A, Minsky BD, Cohen AM, et al. Preliminary results of pre-operative 5-Fluorouracil (5–FU), low dose leucovorin, and concurrent radiation therapy for resectable T3 rectal cancer. Dis Colon Rectum 1997;40 : 515–22.
14. Hofheinz RD, Wenz F, Post S, et al. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol 2012;13 : 579–88.
15. O‘Connell MJ, Colangelo LH, Beart RW, et al. Capecitabine and oxaliplatin in the preoperative multimodality treatment of rectal cancer: surgical end points from National Surgical Adjuvant Breast and Bowel Project trial R-04. J Clin Oncol 2014;32 : 1927−34.
16. Gérard JP, Azria D, Gourgou-Bourgade S, et al. Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol 2010;28 : 1638–4.
17. Roh MS, Yothers GA, O’Connell MJ, et al. The impact of capecitabine and oxaliplatin in the preoperative multimodality treatment in patients with carcinoma of the rectum: NSABP R-04, abstract 3503, J Clin Oncol 2011, suppl. 29.
18. Rödel C, Liersch T, Becker H, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol 2012;13 : 679−87.
19. van Gijn W, Marijnen CA, Nagtegaal ID, et al. Dutch Colorectal Cancer Group. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011;12 : 575−82.
20. Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al. Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 2006;93 : 1215−23.
21. Bujko K, Wyrwicz L, Rutkowski A, et al. Polish Colorectal Study Group. Long-course oxaliplatin-based preoperative chemoradiation versus 5×5 Gy and consolidation chemotherapy for cT4 or fixed cT3 rectal cancer: results of a randomized phase III study. Ann Oncol 2016;27 : 834−42.
22. Ngan SY, Burmeister B, Fisher RJ, et al. Randomized trial of short course radiotherapy versus long course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04. J Clin Oncol2012;30 : 3827.
23. Tang Y, Jin J, Li S, et al. The initial results for a phase III study of short-term versus long-term chemoradiotherapy in locally advanced rectal cancer (STELLAR trial). ASTRO presentation 2016
24. Zhou ZR, Liu SX, Zhang TS, et al. Short-course preoperative radiotherapy with immediate surgery versus long-course chemoradiation with delayed surgery in the treatment of rectal cancer: a systematic review and meta-analysis. Surg Oncol 2014;23 : 211−21.
25. Loos M, Quentmeier P, Schuster T, et al. Effect of preoperative radio(chemo)therapy on long-term functional outcome in rectal cancer patients: a systematic review and meta-analysis. Ann Surg Oncol 2013;20 : 1816−28.
26. Guillem JG, Díaz-González JA, Minsky BD, et al. cT3N0 rectal cancer: potential overtreatment with preoperative chemoradiotherapy is warranted. J Clin Oncol 2008;26 : 368−73.
27. NCCN Clinical Practice Guidelines in Oncology, Rectal Cancer 2/2017. Available from: www.nccn.org.
28. Fernández-Martos C, Pericay C, Aparicio J, et al. Phase II, randomized study of concomitant chemoradiotherapy followed by surgery and adjuvant capecitabine plus oxaliplatin (CAPOX) compared with induction CAPOX followed by concomitant chemoradiotherapy and surgery in magnetic resonance imaging-defined, locally advanced rectal cancer: Grupo cancer de recto 3 study. J Clin Oncol 2010;28 : 859−65.
29. Maréchal R, Vos B, Polus M, et al. Short course chemotherapy followed by concomitant chemoradiotherapy and surgery in locally advanced rectal cancer: a randomized multicentric phase II study. Ann Oncol 2012;23 : 1525−30.
30. Helbling D, Bodoky G, Gautschi O, et al. Neoadjuvant chemoradiotherapy with or without panitumumab in patients with wild-type KRAS, locally advanced rectal cancer (LARC): a randomized, multicenter, phase II trial SAKK 41/07. Ann Oncol 2013;24 : 718−25.
31. Spigel DR, Bendell JC, McCleod M, et al. Phase II study of bevacizumab and chemoradiation in the preoperative or adjuvant treatment of patients with stage II/III rectal cancer. Clin Colorectal Cancer 2012;11 : 45−52.
32. Lefevre JH,Mineur L, Kotti S, et al. Effect of interval (7 or 11 weeks) between neoadjuvant radiochemotherapy and surgery on complete pathologic response in rectal cancer: A multicenter, randomized, controlled trial (GRECCAR-6). J Clin Oncol 2016. [Epub ahead of print]
33. Tulchinsky H, Shmueli E, Figer A, et al. An interval >7 weeks between neoadjuvant therapy and surgery improves pathologic complete response and disease-free survival in patients with locally advanced rectal cancer. Ann Surg Oncol 2008;15 : 2661−7.
34. Pettersson D, Cedermark B, Holm T, et al. Interim analysis of the Stockholm III trial of preoperative radiotherapy regimens for rectal cancer. Br J Surg 2010;97 : 580−7.
35. Pettersson D, Lörinc E, Holm T, et al. Tumour regression in the randomized Stockholm III Trial of radiotherapy regimens for rectal cancer. Br J Surg2015;102 : 972−8; discussion 978.
36. Wang XJ, Zheng ZR, Chi P, et al. Effect of interval between neoadjuvant chemoradiotherapy and surgery on oncological outcome for rectal cancer: A systematic review and meta-analysis. Gastroenterol Res Pract 2016. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4829714/.
37. Petrelli F, Sgroi G, Sarti E, et al. Increasing the interval between neoadjuvant chemoradiotherapy and surgery in rectal cancer: A meta-analysis of published studies. Ann Surg 2016;263 : 458−64.
38. Martens MH, Subhani S, Heijnen LA, et al. Can perfusion MRI predict response to preoperative treatment in rectal cancer? Radiother Oncol 2015;114 : 218−23.
39. Flanagan L, Lindner AU, de Chaumont C, et al. BCL2 protein signalling determines acute responses to neoadjuvant chemoradiotherapy in rectal cancer. J Mol Med (Berl) 2015;93 : 315−26.
40. Caramés C, Cristobal I, Moreno V, et al. MicroRNA-31 emerges as a predictive biomarker of pathological response and outcome in locally advanced rectal cancer. Int J Mol Sci2016;17 : 878.
41. Fokas E, Liersch T, Fietkau R, et al. Tumor regression grading after preoperative chemoradiotherapy for locally advanced rectal carcinoma revisited: updated results of the CAO/ARO/AIO-94 trial. J Clin Oncol 2014;32 : 1554−62.
42. Collette L, Bosset JF, den Dulk M, et al. European Organisation for Research and Treatment of Cancer Radiation Oncology Group. Patients with curative resection of cT3-4 rectal cancer after preoperative radiotherapy or radiochemotherapy: does anybody benefit from adjuvant fluorouracil-based chemotherapy? A trial of the European Organisation for Research and Treatment of Cancer Radiation Oncology Group. J Clin Oncol 2007;25 : 4379−86.
43. Park IJ, Kim DY, Kim HC, et al. Role of adjuvant chemotherapy in ypT0-2N0 patients treated with preoperative chemoradiation therapy and radical resection for rectal cancer. Int J Radiat Oncol Biol Phys 2015;92 : 540−7.
44. Breugom AJ, Swets M, Bosset JF, et al. Adjuvant chemotherapy after preoperative (chemo)radiotherapy and surgery for patients with rectal cancer: a systematic review and meta-analysis of individual patient data. Lancet Oncol 2015;16 : 200−7.
45. Bujko K, Glimelius B, Valentini V, et al. Postoperative chemotherapy in patients with rectal cancer receiving preoperative radio(chemo)therapy: A meta-analysis of randomized trials comparing surgery ± a fluoropyrimidine and surgery + a fluoropyrimidine ± oxaliplatin. Eur J Surg Oncol 2015;41 : 713−23.
46. Habr-Gama A, Perez RO, Nadalin W, et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg 2004;240 : 711−7; discussion 717−8.
47. Habr-Gama A, Gama-Rodrigues J, São Julião GP, et al. Local recurrence after complete clinical response and watch and wait in rectal cancer after neoadjuvant chemoradiation: impact of salvage therapy on local disease control. Int J Radiat Oncol Biol Phys 2014;88 : 822−8.
48. ASCO GI, presentation. More patients with rectal cancer are candidates for a watch-and-wait approach. Practice Update Editorial Team 2017.
49. Kong JC, Guerra GR, Warrier SK, et al. Outcome and salvage surgery following „watch and wait“ for rectal cancer after neoadjuvant therapy: A systematic review. Dis Colon Rectum 2017;60 : 335−45.
50. Renehan AG, Malcomson L, Emsley R, et al. Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (the OnCoRe project): a propensity-score matched cohort analysis. Lancet Oncol 2016;17 : 174−83.
51. Millard T, Kunk PR, Ramsdale E, et al. Current debate in the oncologic management of rectal cancer. World J Gastrointest Oncol 2016;8 : 715−24.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 10-
All articles in this issue
- Complicated intraabdominal infections in surgical patients–empiric antimicrobial therapy management
- Clostridium difficile remains a medical challenge
- Treatment of locally advanced rectal cancer – is it time for a change?
- Secondary peritonitis and volume therapy – single-site retrospective analysis
- Characterisation of Candida sp. isolated from patients after abdominal surgery
- Breast conservative surgery after neoadjuvant oncologic treatment for breast carcinoma at the 1st Department of Surgery, 1st Faculty of Medicine of Charles University and General Teaching Hospital in Prague over a ten-year period (2004−2013)
- Bleeding during anticoagulant and antiaggregation therapy as a cause of acute abdomen
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Complicated intraabdominal infections in surgical patients–empiric antimicrobial therapy management
- Clostridium difficile remains a medical challenge
- Bleeding during anticoagulant and antiaggregation therapy as a cause of acute abdomen
- Treatment of locally advanced rectal cancer – is it time for a change?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

