-
Medical journals
- Career
Myxofibrosarkom dutiny břišní
Authors: F. Janů
Authors‘ workplace: Chirurgické oddělení, Krajská zdravotní, a. s. − odštěpný závod Most, primář: MUDr. F. Janů
Published in: Rozhl. Chir., 2016, roč. 95, č. 10, s. 365-367.
Category: Case Report
Overview
V dutině břišní se může vyskytovat celá řada benigních a maligních tumorů. Mezi vzácnější nádory dutiny břišní řadíme sarkomy. Diagnostikovány jsou často až při pokročilé velikosti, kdy jsou schopny činit klinické potíže pacientům z jejich lokálního růstu. Autor uvádí kazuistiku myxofibrosarkomu dutiny břišní.
Klíčová slova:
myxofibrosarkomÚVOD
V dutině břišní se vyskytují sarkomy zřídka. Jejich incidence je menší než 1/100 000 obyvatel a představují asi 1 % všech zhoubných nádorů, jejich četnost je asi 15 % ze všech operovaných nádorů měkkých tkání [1]. U dětí je relativní incidence podstatně vyšší.
Autor ve svém sdělení prezentuje kazuistiku dospělého nemocného operovaného pro sarkom dutiny břišní.
Kazuistika
57letý nemocný vyšetřen na interním oddělení pro dlouhodobé bolesti břicha a hmatnou rezistenci v dutině břišní. Dle ultrasonografie (USG) a počítačové tomografie (CT)(Obr. 1, 2) byla diagnostikována objemná ohraničená tumorózní expanze zaujímající levou polovinu dutiny břišní, drobné cysty jater a malý ascites. Tumor nejspíše vychází ze zadní stěny žaludku.
Image 1. Předoperační CT břicha − axiální rovina Fig. 1: Preoperative CT scan of the abdomen – axial plane 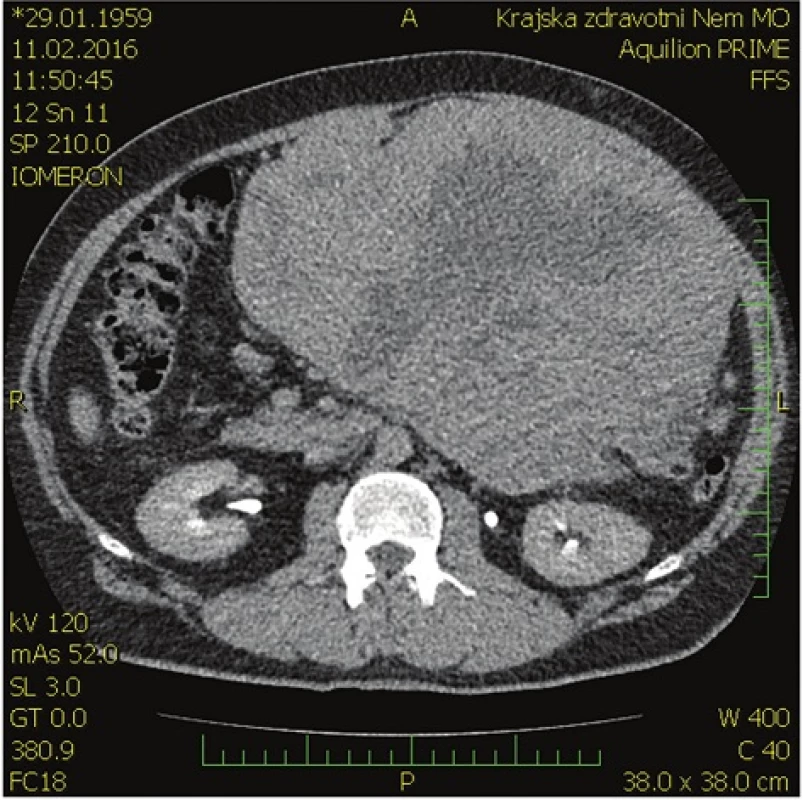
Image 2. Předoperační CT břicha − koronární rovina Fig. 2: Preoperative CT scan of the abdomen – coronal plane 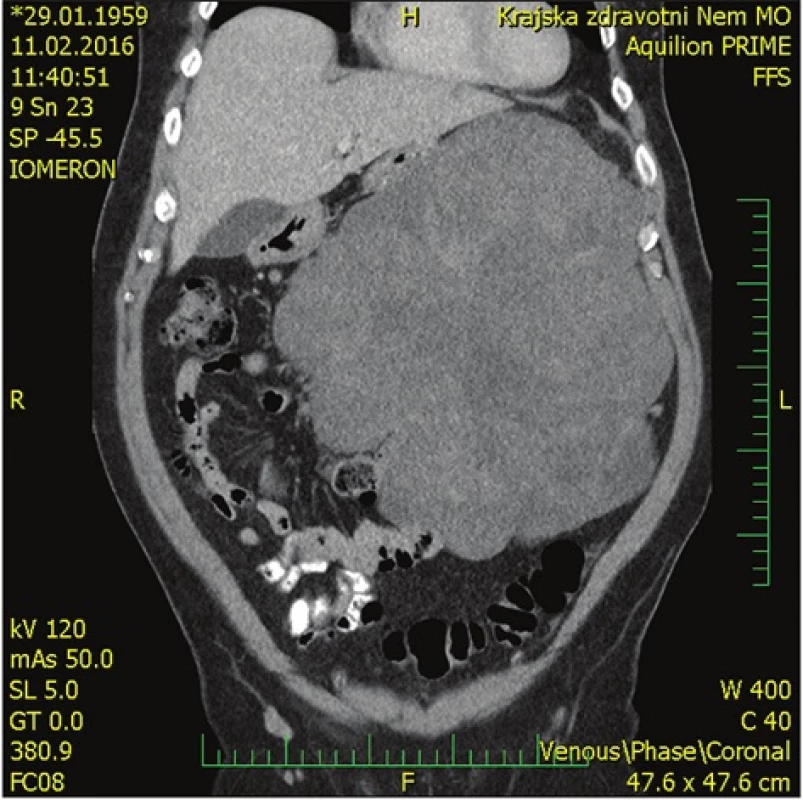
Nebyly prokázány zvětšené regionální uzliny. Na základě zobrazovacích metod nebylo možné jednoznačně určit přesnou etiologii rezistence, proto bylo rozhodnuto o plánované explorativní laparotomii s úvahou o radikálním odstranění tumoru. Rozšířenou příčnou laparotomií jsme pronikli do dutiny břišní. Při otevření dutiny břišní se do rány vyklenuje část tuhého laločnatého tumoru. Tumor je intimně nalepen na žaludek, kolon ascendens, transversum, kolon descendens a omentum s patrnými vinutými přemosťujícími žilami (Obr. 3). Po mobilizaci hepatální i lineální flexury a protnutí hepatokolického ligamenta zjištujeme, že tumor vychází z oblasti velké kurvatury žaludku (Obr. 4). Po otevření omentální bursy se daří žaludek uvolnit a postupně podvázat přemosťující žíly (Obr. 5). Za použití harmonického skalpelu pak celý tumor kompletně exstirpujeme i s celou velkou předstěrou (Obr. 6). Rozměry tumoru 20x30x30 cm, váha 5000 g. Operace trvala 2,5 hodiny, proběhla bez větších potíží a komplikací. Peroperační krevní ztrátu cca 600 ml považujeme za zcela přiměřenou ve vztahu k rozsahu a radikalitě chirurgického výkonu.
Image 3. Peroperační nález-postupná luxace tumoru do příčné laparotomie Fig. 3: Intraoperative finding – progressive dislocation of the tumor to transverse laparotomy 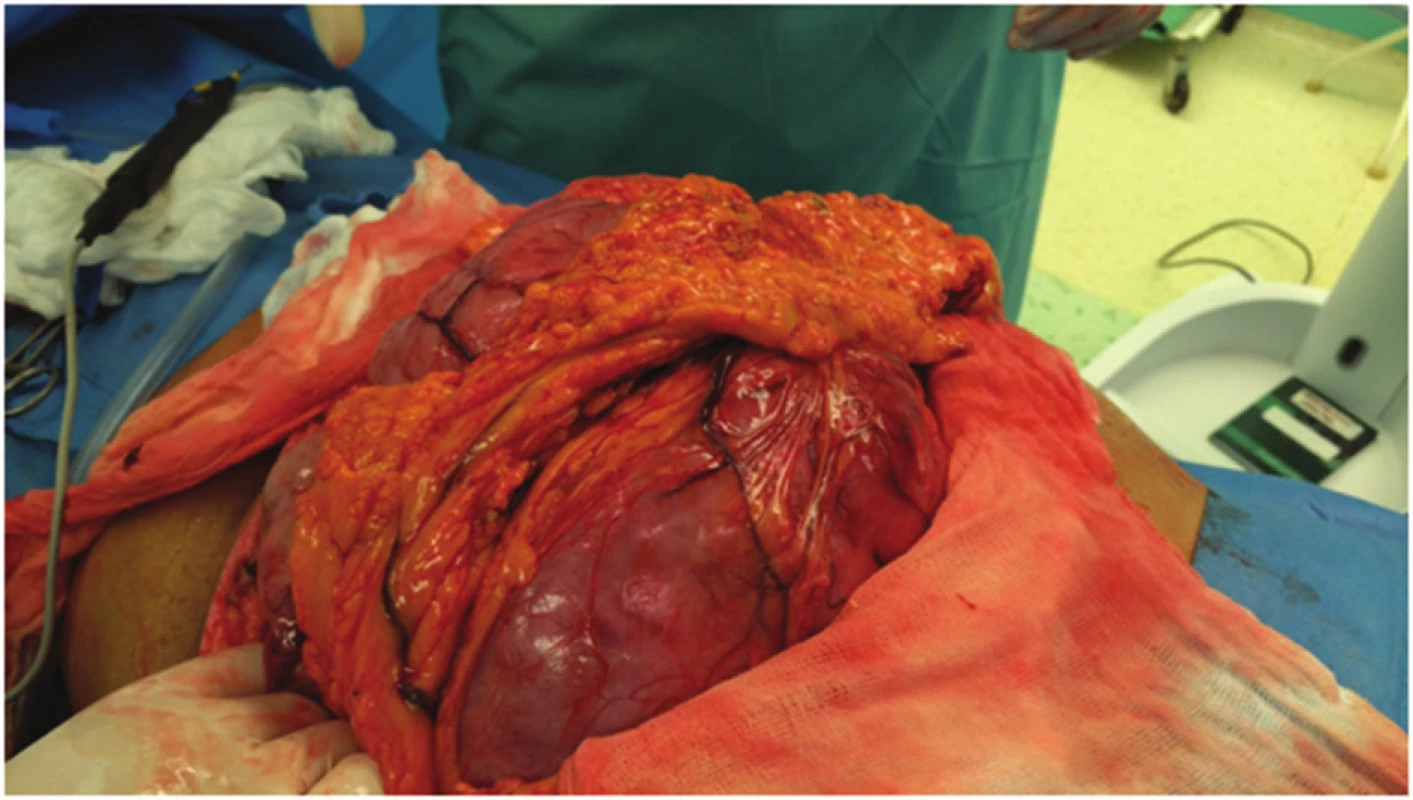
Image 4. Oddělování tumoru od velké kurvatury žaludku Fig. 4: Separation of the tumor from the greater curvature of the stomach 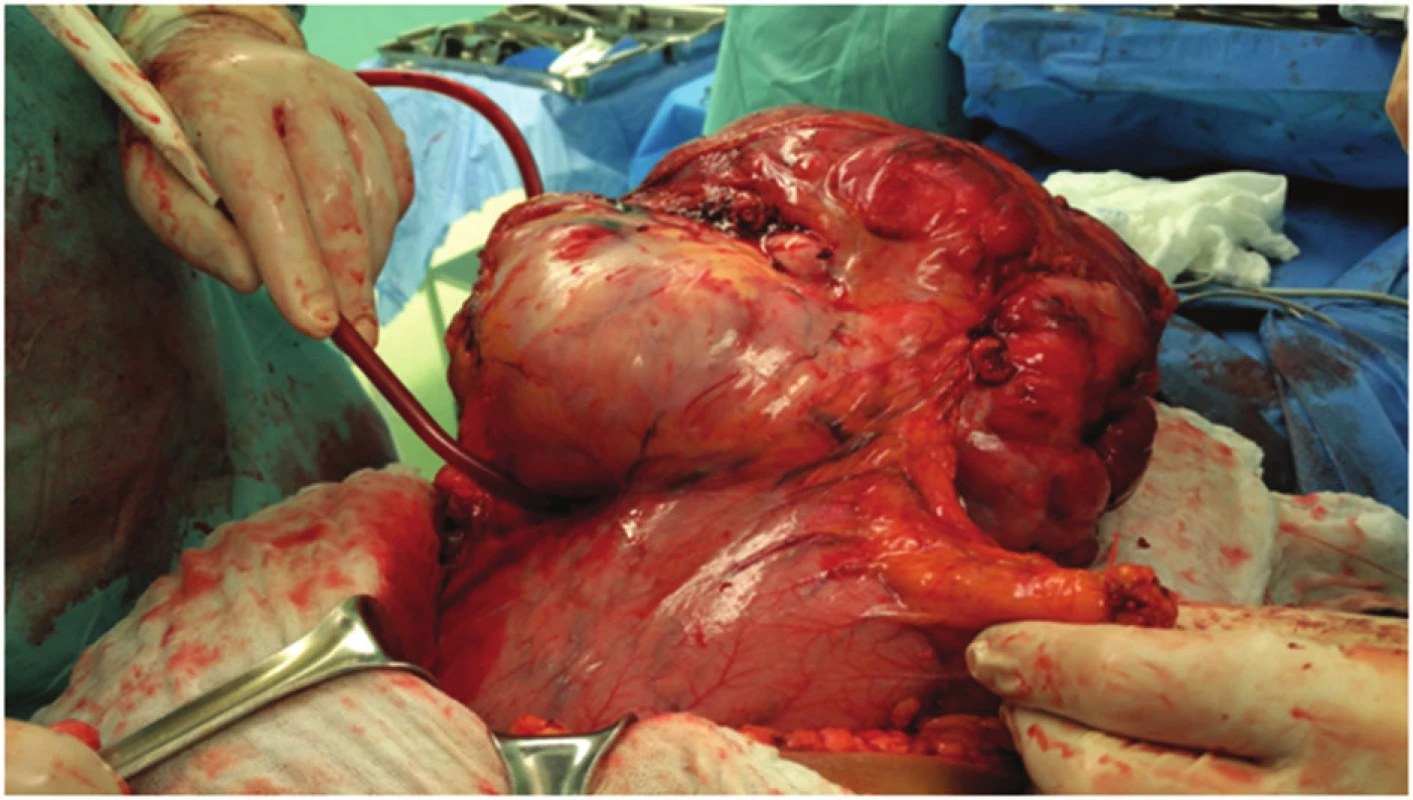
Image 5. Pohled po dokončení exstirpace Fig. 5: Situation after complete extirpation 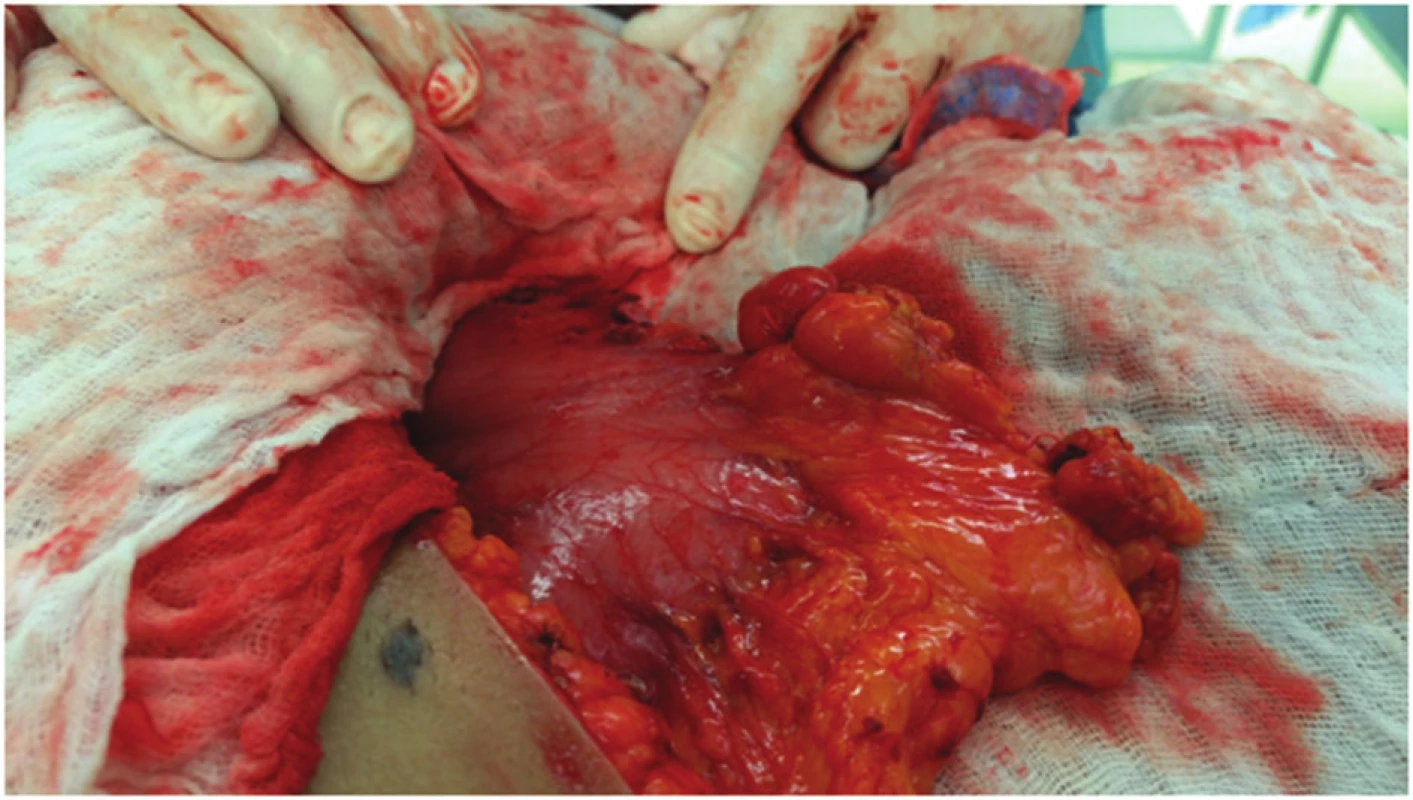
Image 6. Extirpovaný tumor Fig. 6: Resected tumor 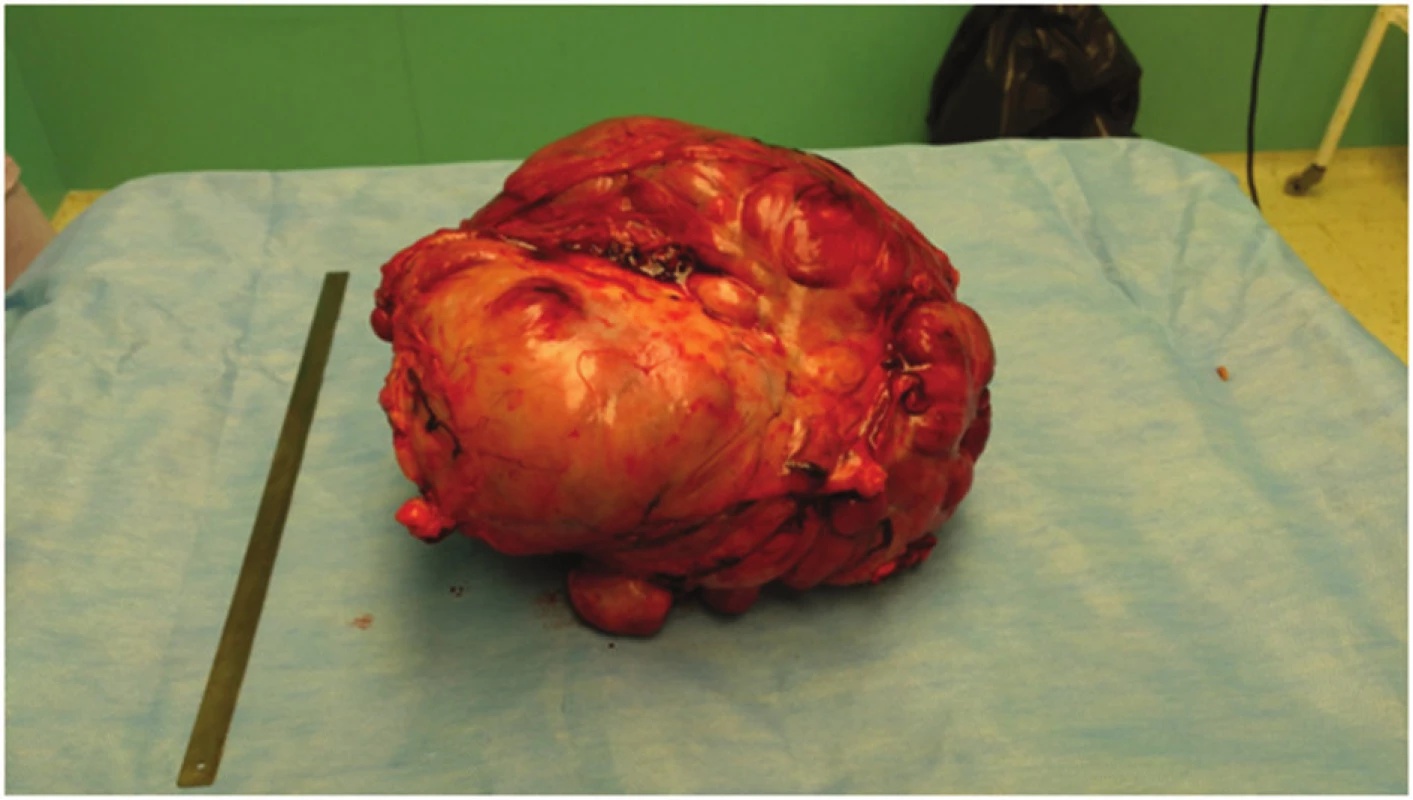
Pooperačně pacient první den monitorován na chir. JIP a poté přeložen na standardní oddělení. Střevní pasáž obnovena 3. pooperační den, další průběh bez komplikací. Dimise 7. pooperační den a pacient předán do dispenzarizace onkochirurgické poradny.
Histologické vyšetření prokázalo vřetenobuněčný tumor MUC4, EMA a cytokeratiny negativní. Dle WHO klasifikován jako myxofibrosarkom grade 1 (Obr. 7).
Image 7. Histologický obraz Fig. 7: Histological picture 
DISKUZE
Sarkomy dutiny břišní a retroperitonea se diagnostikují v populaci ČR jen ve 100 nových případech/rok. Každoročně na tuto diagnózu umírá 60−70 nemocných. Z hlediska věkového rozložení vykazují nárůst ve skupině starších lidí. Asi 30 % se vyskytuje mezi 60.−80. rokem života. Výskyt sarkomů dutiny břišní či retroperitonea je v jakémkoliv věku, počínaje útlým dětstvím. Anatomická lokalizace nevykazuje žádné zvláštnosti predilekce. V etiologii těchto malignit se uvádí jako hlavní rizikový faktor ozáření. Prodělaná léčebná radioterapie zodpovídá za více než 5 % všech sarkomů měkkých tkání. Riziko vzniku sarkomu u ozářených pacientů je tak 8−50násobně zvýšeno proti ostatní populaci. Dalším rizikovým faktorem jsou chemické látky – zejména expozice polyvinylchloridu, dioxinu či fenoxy-herbicidy.
Diagnostika se opírá o USG, CT břicha, MR angiografii či celotělový PET-CT scan.
Punkční tkáňová biopsie je u jednoznačně resekabilního nádoru kontroverzní. Biopsie tenkou jehlou někdy neodhalí přesnou povahu nádoru a může dojít ke kontaminaci okolních tkání nádorovými buňkami.
Histotopatologická klasifikace sarkomů měkkých tkání (WHO 1994) vychází z původu tkáně, jako jsou fibrózní nádory, nádory z cévního endotelu, nádory lipomatózní atd. V roce 2002 Světová zdravotnická organizace uvedla existenci myxoidního sarkomu s fibroblastickou diferenciací a jako jednoznačné diagnostické vodítko pro určení tohoto typu představovaly jaderné atypie. Konečný stupeň morfologického spektra jaderných atypií, tzv. myxofibrosarkom, byl dříve označen jako myxoidní maligní fibrózní histiocytom [3]. Námi operovaný tumor se řadí do skupiny fibrosarkomů a podskupiny myxoidní. Doplňující imunohistochemické vyšetření slouží především k potvrzení diagnostického zařazení a pomáhá rozhodovat v případě nejednotného nálezu. Klinické příznaky bývají zpočátku chudé a u pokročilých tumorů jsou to symptomy v důsledku útlaku okolních struktur, jako jsou močové cesty, tenké a tlusté střevo. Infiltrace okolních orgánů bývá u pokročilých stadií. V našem případě byly celkem tři příznaky, jako jsou bolesti břicha, dyskomfort po jídle a pocit zvětšujícího se objemu břicha.
Léčba těchto tumorů je chirurgická. Ideálním se jeví kompletní exstirpace tumoru –R0resekce, která je rozhodujícím prognostickým faktorem pro přežití pacientů se sarkomem. Při lokálně pokročilém nálezu je nutná en bloc resekce s okolní tkání nebo orgánem při podezření na prorůstání do těchto tkání. Chemoterapie u pacientů s progresí nádorů po operační léčbě je omezená obligátně vysokou chemorezistencí sarkomů [2]. Standardní chemoterapie sarkomů vychází především z kombinace ifosfamidu a doxorubicinu. Dispenzarizace pacientů probíhá na onkologickém či onkochirurgickém pracovišti první 2 roky po 3 měsících a další 3 roky po 6 měsících. Součástí dispenzární prohlídky je odebrání anamnézy, klinické vyšetření a CT hrudníku a dutiny břišní v pravidelných intervalech. Co se týče generalizace těchto nádorů, dochází k ní téměř výhradně do jater. Celkem 90 % metastáz se projeví do dvou let od stanovení diagnózy [4]. Metastazování do lymfatických uzlin je u sarkomů v porovnání se solidními nádory poměrně vzácné. Při podezření na generalizaci je vhodné provést již zmíněné celotělové PET-CT vyšetření.
Závěr
V současné době je chirurgické řešení ohraničených sarkomů dutiny břišní metodou volby. Pacienti s myxofibrosarkomy mají lepší přežití a nižší riziko metastazování než nemocní s ostatními typy sarkomů [3], nicméně je u nich pozorováno vyšší procento lokální recidivy. Po adekvátním chirurgickém výkonu by měla následovat důkladná dispenzarizace. Role optimální pooperační chemoterapie je zatím ve stadiu zkoumání.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. František Janů
Na Ovčíně 3314/9
434 01 Most
e-mail: f.janu@seznam.cz
Sources
1. Žaloudík J. Chirurgické aspekty léčby sarkomů měkkých tkání. Onkologie 2010;4 : 297−301.
2. Lee AY, Narasimhan P, Agaram LX, et al. Optimal percent myxoid component to predict outcome in high-grade myxofibrosarcoma and undifferentiated pleomorphic sarcoma. Ann Surg Oncol 2016;23 : 818−25.
3. Sanfilippo R, MIceli R, Grosso F, et al. Myxofibrosarcoma: Prognostic factors and survival in a series of patients treated at a single institution. Ann Surg Oncol 2011;18 : 720−5.
4. Picardo NE, Mann B, Whittingham-Jones P, et al. Bilateral symmetrical metachronous myxofibrosarcoma: a case report and review of literature. Skeletal Radiol 2011;40 : 1085−8.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2016 Issue 10-
All articles in this issue
- Totální pankreatektomie u maligního onemocnění slinivky břišní − od historie k dnešku
- Jaterní metastázy maligního melanomu – mají resekce nebo radiofrekvenční ablace smysl?
- Fluorescenční angiografie v detekci kvality perfuze anastomózy u resekce sigmoidea a rekta – zhodnocení průběžných výsledků
- Kompletní mezokolická excize u pravostranné hemikolektomie
- Myxofibrosarkom dutiny břišní
- Perforovaná divertikulitída jejuna
- Recidiva sarkomu retroperitonea
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myxofibrosarkom dutiny břišní
- Totální pankreatektomie u maligního onemocnění slinivky břišní − od historie k dnešku
- Kompletní mezokolická excize u pravostranné hemikolektomie
- Jaterní metastázy maligního melanomu – mají resekce nebo radiofrekvenční ablace smysl?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

