-
Medical journals
- Career
Tekutiny, nízká resekce rekta a zase tekutiny…
: P. Kocian; J. Neumann; P. Majtan; J. Hoch
: Chirurgická klinika 2. LF UK a FN Motol, přednosta: prof. MUDr. J. Hoch, CSc.
: Rozhl. Chir., 2014, roč. 93, č. 9, s. 463-467.
: Original articles
Úvod:
Tekutinová terapie je neoddělitelnou součástí léčby nemocných v perioperačním období. Současným trendem je odklon od agresivní perioperační volumoterapie směrem k restriktivním postupům. Cílem práce je ověřit, zda restrikce tekutin v perioperačním období vede ke snížení pooperační morbidity a zkrácení délky hospitalizace v sestavě pacientů po nízké resekci rekta.Materiál a metodika:
Do retrospektivní studie bylo zařazeno 89 pacientů po nízké resekci rekta. Pacienti byli rozděleni v rámci peroperační volumoterapie mediánem 14,9 ml/kg/hod na soubor A (7,4–14,7 ml/kg/hod), soubor B (14,9–36,8 ml/kg/hod) a v rámci volumoterapie v den operace mediánem 3,3 ml/kg/hod na soubor C (2,0–3,3 ml/kg/hod), soubor D (3,3–6,9 ml/kg/hod). U všech pacientů byly retrospektivně sledovány kardiopulmonální komplikace, chirurgické komplikace (ranné komplikace, anastomotický leak), obnova funkce gastrointestinálního traktu (gastroparéza, paralytický ileus), laboratorní zánětlivé markery (leukocyty, CRP) a délka hospitalizace.Výsledky:
Perioperační restrikce tekutin vedla ke statisticky významnému snížení rizika pleurálního výpotku a anastomotického leaku v sestavě pacientů po nízké resekci rekta. Incidence anastomotického leaku v celém souboru byla 9,0 %. Dalším významným rizikovým faktorem pro vznik anastomotického leaku byla neoadjuvantní léčba (15,9 % vs. 2,2 %, p=0,03).Závěr:
Restrikce tekutin v perioperačním období u pacientů po nízké resekci rekta vede ke snížení pooperační morbidity, délka hospitalizace zůstává nezměna.Klíčová slova:
volumoterapie − perioperační péče − restrikce tekutin − nízká resekce rekta − anastomotický leakÚVOD
Tekutinová terapie je v současném pojetí intenzivní medicíny chápána jako nedílná součást léčby chirurgických pacientů v perioperačním období. Tradiční vzorce používané k výpočtu množství tekutin podávaných během operace jsou zřejmě nadhodnocené a obsoletní. Tyto strategie nespočívají jenom na mnohdy velkorysých náhradách akutních krevních ztrát, ale také na úpravě předpokládaného deficitu vyplývajícího například ze zvýšeného pocení anebo úniku tekutin do třetího prostoru [1−3]. Rizikem tohoto přístupu je nadměrný přívod tekutin a z toho vyplývající hyperhydratace se všemi jejími důsledky. Udává se, že hyperhydratace snižuje vitalitu tkání a zhoršuje hojení ran, zvyšuje míru zánětlivé reakce organismu na operaci, stoupá riziko infekčních komplikací, zvýšená je i četnost oběhových a plicních komplikací [4−7]. V kolorektální chirurgii je ohrožena integrita střevních anastomóz a funkce gastrointestinálního ústrojí se obnovuje později. Současné klinické studie prokazují, že perioperační restrikce tekutin v elektivní kolorektální chirurgii vede ke snížení pooperační morbidity a zkrácení délky hospitalizace [8−11]. Perioperační volumorestrikce se stala nedílnou součástí protokolů ERAS – moderního konceptu vedení perioperační péče mající za cíl snížit frekvenci pooperačních komplikací, celkovou délku hospitalizace a zlepšit komfort pacientů. Tyto protokoly se týkají všech fází perioperačního procesu – předoperační přípravy, anestezie, operačního výkonu a následné pooperační péče.
Závěry prací hodnotící efekt perioperační volumorestrikce na výsledky léčby jsou však často obtížně porovnatelné v důsledku odlišných cílů objemové terapie, homogenity pacientů, závažnosti a rozsahu operačních výkonů. K ověření názoru, zda perioperační restrikce tekutin má vliv na pooperační morbiditu a délku hospitalizace, jsme provedli retrospektivní analýzu v relativně homogenní sestavě pacientů elektivně operovaných pro karcinom rekta.
Cílem práce bylo posoudit, zda restrikce tekutin v perioperačním období vede ke snížení pooperační morbidity a zkrácení délky hospitalizace v sestavě pacientů po nízké resekci rekta.
MATERIÁL A METODIKA
Do retrospektivní studie bylo zařazeno 89 pacientů s tumorem rekta, kteří podstoupili elektivní resekční výkon s obnovou střevní kontinuity koloanální/kolorektální anastomózou. Všechny operace byly provedeny na našem pracovišti v období od dubna 2009 do září 2012. Ze zdravotnické dokumentace byl u každého pacienta ze záznamu o perioperační tekutinové terapii zaznamenán příjem tekutin na sále a v den operace (ml, ml/kg/hod). Podle příjmu tekutin na sále a celkového příjmu v den operace byli pacienti rozděleni do dvou skupin: v rámci peroperační volumoterapie mediánem 14,9 ml/kg/hod na soubor A (7,4–14,7 ml/kg/hod) a soubor B (14,9–36,8 ml/kg/hod) a v rámci volumoterapie v den operace mediánem 3,3 ml/kg/hod na soubor C (2,0–3,3 ml/kg/hod) a soubor D (3,3–6,9 ml/kg/hod) (Tab. 1, 2). K posouzení, zda perioperační restrikce tekutin vede ke snížení pooperační morbidity, byly u všech pacientů po nízké resekci rekta retrospektivně sledovány kardiopulmonální komplikace (akutní infarkt myokardu, arytmie, respirační selhání, plicní edém, pleurální výpotek, pneumonie), chirurgické komplikace (SSI, anastomotický leak), obnova funkce gastrointestinálního traktu (gastroparéza, paralytický ileus), laboratorní zánětlivé markery (leukocyty, CRP) a délka hospitalizace. K diagnostice a posouzení rozsahu anastomotického leaku bylo u pacientů s podezřením na netěsnost anastomózy provedeno endoskopické vyšetření nebo „malé“ irrigo. Podnětem k zahájení vyšetřování byl rozvoj septického stavu, protrahované bolesti břicha, porucha pasáže a únik střevního obsahu drénem. Pro statistické zpracování byl pooperační paralytický ileus klasifikován třemi stupni: přirozený (obnova funkce do 4. pooperačního dne), protrahovaný (obnova funkce 4. až 7. pooperační den) a těžký (střevní paralýza trvající déle než týden, nutnost provedení RTG sledované pasáže GIT, terapie prokinetiky). Gastroparéza byla definována přítomností nauzey, opakovaného zvracení s nutností zavedení NGS a aplikací prokinetik. K posouzení systémové zánětlivé odpovědi na chirurgický výkon a perioperační tekutinovou volumoterapii bylo u všech pacientů první a druhý pooperační den provedeno laboratorní vyšetření zánětlivých parametrů (leukocyty a CRP).
1. Peroperační volumoterapie, soubor A (7,4–14,7 ml/kg/hod), soubor B (14,9–36,8 ml/kg/hod) Tab. 1: Intraoperative fluid therapy, group A (7.4–14.7 mL/kg/hr), group B (14.9–36.8 mL/kg/hr) 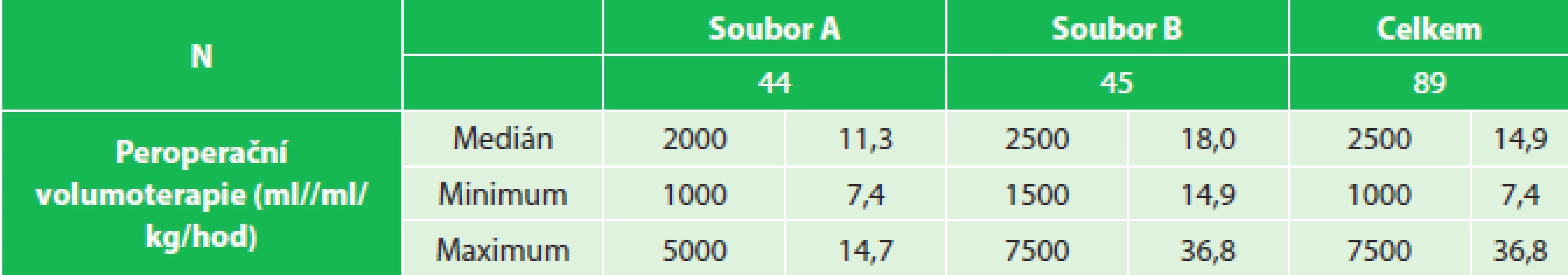
2. Volumoterapie v den operace, soubor C (2,0–3,3 ml/kg/hod), soubor D (3,3–6,9 ml/kg/hod) Tab. 2: Fluid therapy on the day of surgery, group C (2.0–3.3 mL/kg/hr), soubor D (3.3–6.9 mL/kg/hr) 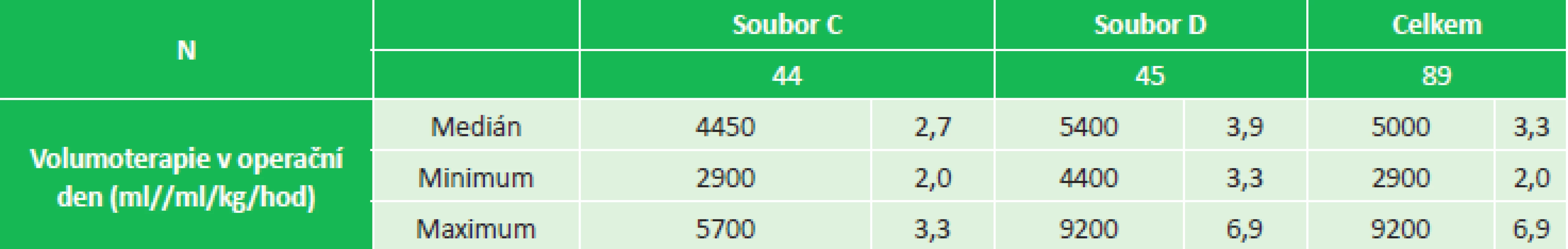
K vyhodnocení dat byl použit program Statistica® 10.0. Vliv vysokého či nízkého příjmu tekutin na sledované parametry byl vyhodnocen kontingenčními tabulkami pomocí Pearsonova Chi-kvadrát testu. Výsledky byly považovány za statisticky významné při hladině p<0,05. Demografické charakteristiky porovnávaných souborů včetně sledovaných dat spojených s perioperační volumoterapií, ASA klasifikací a předoperační onkologickou léčbou jsou uvedeny v Tab. 3 a 4.
3. Charakteristika souboru (peroperační volumoterapie), soubor A (7,4–14,7 ml/kg/hod), soubor B (14,9–36,8 ml/kg/hod) Tab. 3: Patients characteristics (intraoperative fluid therapy), group A (7.4–14.7 mL/kg/hr), group B (14.9–36.8 mL/kg/hr) 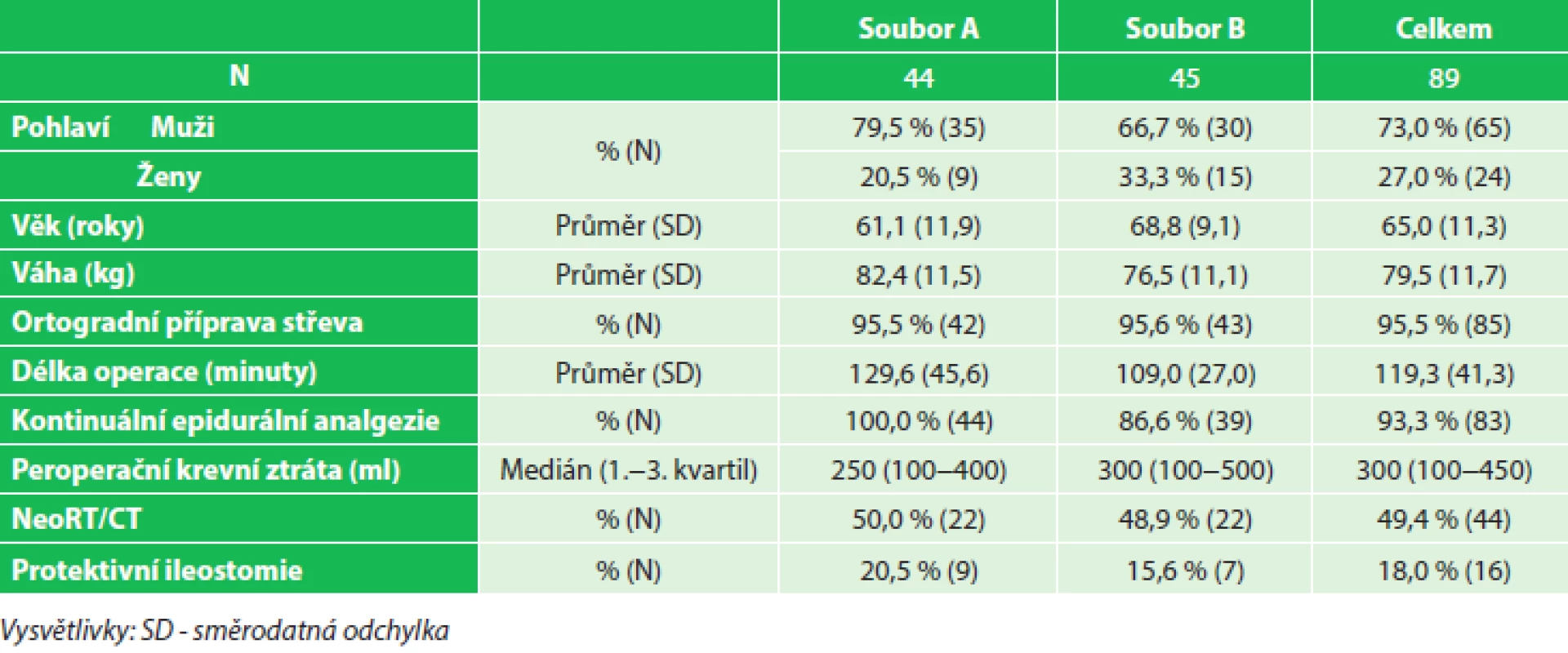
4. Charakteristika souboru (volumoterapie v den operace), soubor C (2,0–3,3 ml/kg/hod), soubor D (3,3–6,9 ml/kg/hod) Tab. 4: Patients characteristics (fluid therapy on the day of surgery), group C (2.0–3.3 mL/kg/hr), group D (3.3–6.9 mL/kg/hr) 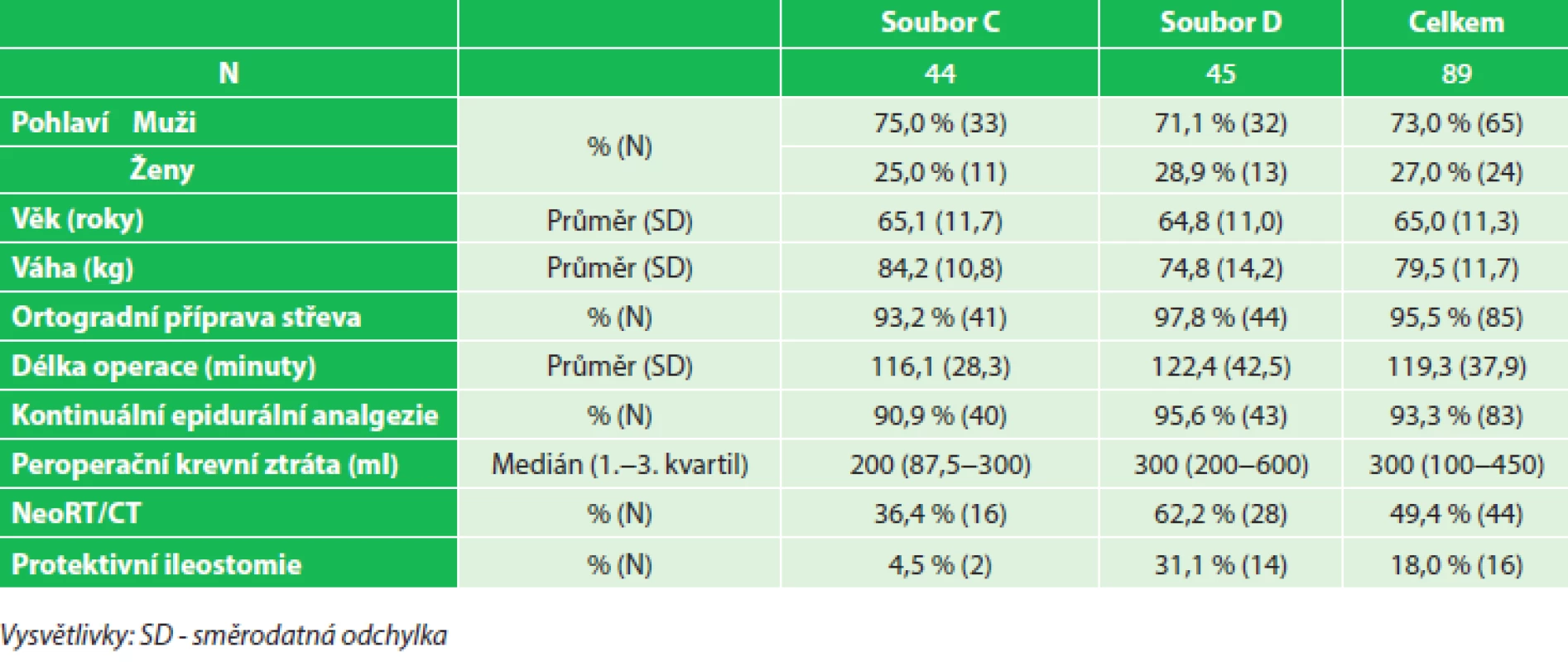
VÝSLEDKY
Celkem bylo provedeno 89 nízkých resekcí rekta s obnovou střevní kontinuity koloanální/kolorektální anastomózou. Téměř polovina pacientů (49,4 %) podstoupila neoadjuvantní konkomitantní radiochemoterapii. Průměrný věk operovaných byl 65 let (±11,3), celkem bylo zařazeno 65 mužů a 24 žen, průměrný operační čas byl 119,3 minuty (±37,9), protektivní ileostomie byla založena v 16 případech (18,0 %), peroperační krevní ztráta byla 300 ml (medián). Důvodem k založení protektivní ileostomie byla peroperačně zjištěná netěsnost anastomózy „air-water“ leak testem. Při negativitě testu byly vždy posouzeny rizikové faktory – neoadjuvantní radiochemoterapie, malnutrice, koloanální anastomóza, komplikovaný průběh operace, špatná zdravotní kondice nemocného – a na základě přítomnosti/nepřítomnosti těchto rizikových faktorů individuálně rozhodnuto. Incidence anastomotického leaku v celém souboru byla 9,0 % (8 pacientů), z toho u 6 pacientů byla provedena ultranízká resekce rekta s koloanální anastomózou, 7 pacientů s anastomotickým leakem podstoupilo neoadjuvantní léčbu. Neoadjuvantní léčba byla jednoznačným rizikovým faktorem pro vznik leaku v anastomóze (15,9 % vs. 2,2 %, p=0,03) (Graf 1). Terapie anastomotického leaku byla v 5 případech operační, ve 3 případech byl zvolen konzervativní postup. Restrikce tekutin během operačního výkonu (7,4–14,7 ml/kg/hod) statisticky významným způsobem snížila riziko pleurálního výpotku (0 % vs. 11,1 %, p=0,04) (Graf 2) a riziko anastomotického leaku u pacientů s neoadjuvantní léčbou (4,5 % vs. 27,3 %) (Graf 3). Stejné výsledky byly dosaženy při použití omezeného množství tekutin v den operace (2,0–3,3 ml/kg/hod) – statisticky významné snížení rizika pleurálního výpotku (0 % vs. 11,1 %, p=0,04) (Graf 4) a snížení rizika anastomotického leaku u pacientů s neoadjuvantní léčbou (6,3 % vs. 21,4 %) (Graf 5). Mezi porovnávanými soubory nebyl statisticky potvrzen významný rozdíl v délce hospitalizace a v ostaních sledovaných parametrech.
1. Výskyt anastomotického leaku po nízké resekci rekta v závislosti na neoadjuvantní radiochemoterapii Graph 1: Incidence of anastomotic leak after low anterior resection in relation to neoadjuvant radiochemotherapy 
2. Výskyt pleurálního výpotku po nízké resekci rekta ve vztahu k peroperační volumoterapii, soubor A (7,4–14,7 ml/kg/hod), soubor B (14,9–36,8 ml/kg/hod) Graph 2: Incidence of pleural effusion after low anterior resection in relation to intraoperative fluid therapy, group A (7.4–14.7 mL/kg/hr), group B (14.9–36.8 mL/kg/hr) 
3. Výskyt anastomotického leaku po nízké resekci rekta ve vztahu k peroperační volumoterapii, soubor A (7,4–14,7 ml/kg/hod), soubor B (14,9–36,8 ml/kg/hod) Graph 3: Incidence of anastomotic leak after low anterior resection in relation to intraoperative fluid therapy, group A (7.4–14.7 mL/kg/hr), group B (14.9–36.8 mL/kg/hr 
4. Výskyt pleurálního výpotku po nízké resekci rekta ve vztahu k volumoterapii v den operace, soubor C (2,0–3,3 ml/kg/hod), soubor D (3,3–6,9 ml/kg/hod) Graph 4: Incidence of pleural effusion after low anterior resection in relation to fluid therapy of the day of surgery, group C (2.0–3.3 mL/kg/hr), group D (3.3–6.9 mL/kg/hr) 
5. Výskyt anastomotického leaku po nízké resekci rekta ve vztahu k volumoterapii v den operace, soubor C (2,0–3,3 ml/kg/hod), soubor D (3,3–6,9 ml/kg/hod) Graph 5: Incidence of anastomotic leak after low anterior resection in relation to fluid therapy on the day of surgery, group C (2.0–3.3 mL/kg/hr), group D (3.3–6.9 mL/kg/hr) 
Dle výsledné p-hodnoty je rozdíl mezi oběma skupinami pacientů statisticky významný.
Dle výsledné p-hodnoty je rozdíl mezi oběma skupinami pacientů statisticky významný.
DISKUZE
Tekutinová terapie je neoddělitelnou součástí léčby nemocných v perioperačním období. Současným trendem je odklon od agresivní perioperační volumoterapie směrem k restriktivním postupům [2,8−12]. Jedním z problémů, které brání zavedení nových poznatků do každodenní klinické praxe, je nedostatek standardizace a komplikované zařazování pacientů do studovaných skupin – restriktivní režim v jedné studii je často označován jako liberální ve studii druhé. Kritický pohled na koncept peroperační volumoterapie přináší až metaanalýza N. Rahbariho z univerzity v Heidelbergu, ve které jsou podle současných doporučení (Miller’s Anaesthesia) jednotlivé tekutinové strategie (restriktivní/standardní/agresivní) přesně definovány. Výsledky této metaanalýzy prokazují, že peroperační restrikce tekutin v elektivní kolorektální chirurgii vede ke snížení pooperační morbidity [13]. Stratifikace našeho souboru (n=89) podle Rahbariho kritérií peroperační volumoterapie – váha, doba předoperačního lačnění, délka operace, typ anestezie, krevní ztráta – potvrzuje restriktivní přístup u 83 pacientů, zatímco standardní přístup pouze v 6 případech. Potvrdili jsme, že náš přístup k vedení perioperační volumoterapie je restriktivní a je v souladu se současným trendem. I přes Rahbariho kritéria peroperační volumoterapie označující náš přístup za restriktivní prokázala retrospektivní analýza v naší sestavě pacientů stratifikovaných mediánem 14,9 ml/kg/hod statisticky významné snížení pooperační morbidity (pleurální výpotek, anastomotický leak u pacientů s neoadjuvantní léčbou) ve skupině s omezeným přijmem tekutin (7,4–14,7 ml/kg/hod). V rozporu s výše uvedeným je práce I. Campbella, ve které autor upozorňuje na riziko hemodynamické nestability a oligurického renálního selhání u pacientů s peroperačním příjmem tekutin 5–10 ml/kg/hod [14]. Takové systémové dopady restriktivní tekutinové terapie nebyly v našem souboru prokázány. Peroperační restrikce tekutin (7,4–14,7 ml/kg/hod) nevedla u žádného pacienta ke kardiovaskulární či renální dysfunkci. Recentní studie prokazují, že nejenom v průběhu operace, ale i v pooperačním období může tekutinová léčba významným způsobem ovlivnit výsledek léčby [8,10,15,16]. Tyto závěry jsou v souladu s výsledky naší práce, které potvrdily statisticky významné snížení rizika pleurálního výpotku a snížení rizika anastomotického leaku u pacientů s neoadjuvantní léčbou ve skupině s omezeným příjmem tekutin v den operace (2,0–3,3 ml/kg/hod). Riziko vzniku leaku v anastomóze je podmíněno řadou faktorů na straně pacienta, vzdáleností anastomózy od anu, způsobem provedení anastomózy, lokálními a celkovými podmínkami pro hojení rány, zkušenostmi pracoviště a v neposlední řadě způsobem onkologické léčby před operací [17,18]. Incidence anastomotického leaku v našem souboru (9,0 %) je srovnatelná s literárně udávanými daty [17,19]. Neoadjuvantní léčba byla významným rizikovým faktorem pro vznik leaku v anastomóze (15,9 % vs. 2,2 %, p=0,03). Porucha hojení anastomózy v důsledku neoadjuvantní léčby byla dále potencována vyšší tekutinovou náloží během operace (27,3 %) a v pooperačním období (21,4 %). Mezi porovnávanými soubory nebyl potvrzen statisticky významný rozdíl v délce hospitalizace a v ostatních sledovaných parametrech.
Restrikce tekutin v periopeačním období je součástí protokolů ERAS. Na našem pracovišti je vedení perioperační péče formou ERAS v kolorektální chirurgii indikováno u vybraných pacientů v závislosti na jejich zdravotní kondici a aktivní spolupráci. Koncept akcelerovaného zotavení po operaci vyžaduje multidisciplinární přístup a klade vyšší nároky na ošetřovatelský personál. Za předpokladu dodržení výše uvedeného může být tento koncept úspěšný a pacient profitovat.
ZÁVĚR
Restrikce tekutin v perioperačním období u pacientů po nízké resekci rekta vede ke snížení pooperační morbidity, zatímco délka hospitalizace není volbou tekutinové strategie statisticky významně ovlivněna. Restriktivní přístup je vhodný zejména u pacientů po neoadjuvantní léčbě, kde vyšší tekutinová nálož potencuje zhoršené podmínky hojení anastomózy v důsledku neoadjuvatní onkologické léčby.
Seznam zkratek:
ERAS – enhanced recovery after surgery
SSI – surgical site infection
GIT – gastrointestinální trakt
NeoRT/CT – neoadjuvantní radiochemoterapie
MUDr. Petr Kocián, Ph.D.
Chirurgická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: petr.kocian@fnmotol.cz
Sources
1. Brandstrup B. Fluid therapy for the surgical patient. Best Pract Res Clin Anaesthesiol 2006;20 : 265−83.
2. Doherty M, Buggy DJ. Intraoperative fluids: how much is too much? Br J Anaesth 2012;109 : 69−79.
3. Jacob M, Chappell D, Rehm M. The ‘third space‘ – fact or fiction? Best Pract Res Clin Anaesthesiol 2009;23 : 145−57.
4. Lowell JA, et al. Postoperative fluid overload: not a benign problem. Crit Care Med 1990;18 : 728−33.
5. Bouchard J, Mehta RL. Fluid balance issues in the critically ill patient. Contrib Nephrol 2010;164 : 69−78.
6. Simmons RS, et al. Fluid balance and the adult respiratory distress syndrome. Am Rev Respir Dis 1987;135 : 924−9.
7. Holte K, Kehlet H. Fluid therapy and surgical outcomes in elective surgery: a need for reassessment in fast-track surgery. J Am Coll Surg 2006;202 : 971−89.
8. Brandstrup B, et al. Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter trial. Ann Surg 2003;238 : 641−8.
9. Nisanevich V, et al. Effect of intraoperative fluid management on outcome after intraabdominal surgery. Anesthesiology 2005;103 : 25−32.
10. Lobo DN, et al. Effect of salt and water balance on recovery of gastrointestinal function after elective colonic resection: a randomised controlled trial. Lancet 2002;359 : 1812−8.
11. Holte K, et al. Liberal or restrictive fluid administration in fast-track colonic surgery: a randomized, double-blind study. Br J Anaesth 2007;99 : 500−8.
12. Bleier JI, Aarons CB. Perioperative Fluid Restriction. Clin Colon Rectal Surg 2013;26 : 197−202.
13. Rahbari NN, et al. Meta-analysis of standard, restrictive and supplemental fluid administration in colorectal surgery. Br J Surg 2009;96 : 331−41.
14. Campbell IT, et al. IV fluids during surgery. Br J Anaesth 1990;65 : 726−9.
15. Cvachovec K. Volumová terapie. ZDN. Příl. Lék. listy 2010;21 : 16−18.
16. Cvachovec K. Problematika tekutinové resuscitace – koloidy a krystaloidy. ZDN. Příl. Lék. listy 2010;12 : 5−8.
17. Matthiessen P, et al. Risk factors for anastomotic leakage after anterior resection of the rectum. Colorectal Dis 2004;6 : 462−9.
18. Schiffmann L, et al. Intensified neoadjuvant radiochemotherapy for rectal cancer enhances surgical complications. BMC Surg 2013;13 : 43.
19. Vermeer TA, et al. Anastomotic leakage and presacral abscess formation after locally advanced rectal cancer surgery: Incidence, risk factors and treatment. Eur J Surg Oncol 2014.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 9-
All articles in this issue
- The role of drains in pancreatic surgery
- Personalised antibiotic therapy in a surgical intensive care unit − overview of current knowledge and the results of an observational kinetic study M. Kaska, J. Martinkova, E. Havel, J. Koci, A. Fouskova, D. Solichova, L. Kujovska, I. Selke-Krulichova, I. Praznovec, V. Salavec
- Fluid therapy and surgical outcomes after low anterior resection
- Chylous mesenteric cyst
- Lymphangioma of the retroperitoneum treated laparoscopically J. Skach, M. Chrenko, P. Hromadka
- Limits of surgery for pancreatic cancer
- Severe hidradenitis suppurativa
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chylous mesenteric cyst
- Lymphangioma of the retroperitoneum treated laparoscopically J. Skach, M. Chrenko, P. Hromadka
- The role of drains in pancreatic surgery
- Fluid therapy and surgical outcomes after low anterior resection
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

